Многие методы исследования в области молекулярной биологии требуют миллионов идентичных копий чистой ДНК. Полимеразная цепная реакция — это молекулярный метод, имитирующий процесс репликации дезоксирибонуклеиновой кислоты для амплификации определенных сегментов ДНК in vitro. Реакция повторяется через серию изменений температуры, во время которых нити ДНК разделяются, праймеры связываются и образуются комплементарные нити.
Эволюция ДНК-полимераз
Прогресс в ПЦР был бы невозможен без эволюции ДНК-полимераз — специализированных ферментов.
История современной ПЦР началась в 1976 году с выделения ДНК-полимеразы Taq из термофильной бактерии Thermus aquaticus. Выявление бактерии означало, что у молекулярных биологов появился термостабильный фермент, способный к повторному циклу ПЦР без необходимости добавления свежей ДНК-полимеразы после каждого цикла.
Однако влияние, которое фермент Taq окажет на молекулярную биологию, не был ясен до 1988 года, пока фермент не коммерциализировали для широкого использования. ДНК-полимераза Taq имела мгновенный успех, и в 1989 г. даже была названа журналом Science «Молекулой года».
Хотя эти разработки представляли собой значительный прогресс, ДНК-полимераза Taq не была идеальной. Анализ с ее использованием был нестабилен при высоких температурах и подвержен ошибкам. Эти факторы сыграли роль в задержке развития возможностей ПЦР на раннем этапе, особенно в приложениях, требующих высокой специфичности и надежности. Вскоре стало очевидно, что разработка ДНК-полимераз неразрывно связана с эффективным использованием ПЦР, и что для увеличения мощности ПЦР и открытия более широкого спектра возможностей анализа необходимо разработать более совершенные ДНК-полимеразы.
В конце 1980-х годов появился ряд методов с использованием «горячего старта», помогающих преодолеть неэффективность и низкую специфичность ДНК-полимеразы Taq при высоких температурах. Эти методы заключались в нагревании образцов до 95°C и последующем охлаждении до 60–70°C перед добавлением полимеразы. Несмотря на эффективность, методы горячего старта отнимали много времени и часто вызывали перекрестное загрязнение проб. ПЦР требовалось долгосрочное решение.
В 1991 г. были выделены и разработаны полимеразы Pfu, полученные из гипертермофильных архей Pyrococcus furiosus. ДНК-полимераза Pfu, в отличие от ДНК-полимеразы Taq, имеет встроенную корректирующую активность экзонуклеазы от 3 ‘до 5’, что означает, что она может исправлять ошибки включения нуклеотидов, значительно снижать частоту ошибок и обеспечивать повышенную специфичность. Разработка и использование как полимераз Pfu, так и Taq продолжались в течение некоторого времени, при этом ПЦР сыграла важную роль в ряде новаторских исследований, таких как секвенирование.
Внедрение слитых ДНК-полимераз в 2003 году, стало первым шагом в разработке полимераз нового поколения и ПЦР высокой точности. Эти специально сконструированные ДНК-полимеразы могли преодолеть или уменьшить многие проблемы, все еще ограничивающие развитие ПЦР. Созданные путем слияния основных компонентов архебактериальной полимеразы с термостабильным ДНК-связывающим доменом, первые ДНК-полимеразы Phusion High Fidelity обладали сильной корректирующей способностью и были невероятно стабильны при высоких температурах реакции. Кроме того, при использовании специализированного ДНК-связывающего домена сродство полимеразы к двухцепочечной ДНК увеличивалось в геометрической прогрессии.
Разработка полимераз следующего поколения наряду с развитием технологий ПЦР в реальном времени и цифровой ПЦР гарантировала, что ПЦР будет играть важную роль в будущих исследованиях в области наук о жизни и здравоохранении.
Что такое полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР) — важнейший лабораторный метод исследования тонкой молекулярной структуры генетического материала. Он состоит из дезоксирибонуклеиновой кислоты (ДНК), составляющей генетический код человека, а также животных и растений.
В медицине анализ используется для уточнения наследственных заболеваний и генетических проблем (риск заболевания, тест на отцовство и т. д.), а также для диагностики многих инфекционных заболеваний. В отличие от серологической диагностики (определение антител к возбудителям в крови) способы полимеразной цепной реакции представляют собой прямой лабораторно-медицинский метод выявления в рамках уточнения инфекционных заболеваний.
Преимущество этого способа диагностики — быстрая доступность результатов. Кроме того, методы полимеразной цепной реакции обладают очень высокой чувствительностью. Это означает, что даже минимальное количество генетического материала от возбудителя (бактерии, вирусы и т. д.) приводит к достоверно положительному результату при наличии соответствующего патогена в нужном исследуемом материале.
Кровь — основной исследуемый материал для этого метода, однако используются и другие биологические жидкости (мокрота, моча, ликвор и т. д.). В основе генетического материала лежит особая длинноцепочечная молекула дезоксирибонуклеиновой кислоты.
У людей генетический материал, состоящий из двухцепочечной ДНК (две комплементарные нити), находится в ядре всех клеток организма, при этом они имеют идентичный генетический материал. Кроме того, индивидуальный геном каждого человека уникален по своему точному составу и сравним с отпечатком пальца, также уникального для каждого человека.
По этой причине генетический материал также называют «генетический код». В этой форме закодирована схема всех структур человеческого организма, таким образом она сохраняется и в дальнейшем может передаваться по наследству.
В ядрах клеток тела дезоксирибонуклеиновая кислота присутствует в особом порядке, известном как хромосомы (наследственные клетки). У людей они всегда встречаются парами, причём, одна наследуется от матери, а другая — от отца. Все клетки человеческого тела содержат в общей сложности 46 хромосом — 22 пары, называемые аутосомами, и одну пару, называемую половыми хромосомами.
Лабораторная процедура может быть использована для исследования тонкой структуры генетического кода человека, что важно при диагностике заболеваний или уточнении конкретных вопросов:
- выявление наследственных заболеваний;
- оценка риска заболевания;
- исследование врожденных особенностей обмена веществ;
- судебно-медицинская (так называемая «криминалистическая») экспертиза.
Не только люди, но и фактически все формы жизни на Земле имеют определенный генетический материал:
- грибы;
- бактерии;
- вирусы;
- паразиты и др.
Геном этих форм жизни также состоит в основном из ДНК или, в варианте некоторых вирусов, также из РНК (рибонуклеиновая кислота), которая, в отличие от ДНК — одноцепочечная. Поэтому в медицинской диагностике этот метод также проводится для уточнения многих инфекционных заболеваний:
- бактериальные инфекции, например, туберкулез, бактериальные венерические заболевания;
- вирусные инфекции, например, вирусный гепатит, ВИЧ-инфекция;
- паразитарные инфекции, например, малярия, и многое другое.
Компоненты полимеразной цепной реакции
ПЦР включает следующие компоненты:
- ДНК-матрица (образец дезоксирибонуклеиновой кислоты, с целевой последовательностью для амплификации);
- дезоксирибонуклеозидтрифосфаты;
- буфер;
- праймеры (прямые и обратные) – короткий сегмент нуклеотидов, комплементарный участку ДНК или РНК, необходимый для амплификации. В этой методике используются две короткие последовательности дезоксирибонуклеиновой кислоты, предназначенные для связывания с началом (прямой праймер) и концом (обратный праймер) последовательности – мишени.
- Taq-полимераза — термостабильная ДНК-полимераза, первоначально выделенная из термофильной бактерии Thermus aquaticus, сопротивляющаяся инактивации при температурах денатурации и позволяющая удлинять праймеры при высокой температуре.
Этапы полимеразной цепной реакции
Для проведения лабораторного исследования, извлеченный образец (содержащий шаблон ДНК-мишени) добавляют в пробирку, содержащую праймеры, свободные нуклеотиды (dNTP) и полимеразу Taq. Смесь помещают в лабораторное оборудование (термоциклер, ДНК-амплификатор) для проведения анализа. Термоциклер увеличивает и уменьшает температуру смеси для соответствующего анализа автоматическими запрограммированными шагами, экспоненциально генерирующими копии целевой последовательности.
Полимеразная цепная реакция включает три основных этапа:
- Денатурация (разделение цепей). Разделение двух комплементарных цепей ДНК, связанных водородными связями, на пару одноцепочечных полинуклеотидных молекул в процессе нагревания (от 94C до 96C);
- Отжиг (связывающий праймеры). Понижение температуры (45-60 C), для прикрепления праймеров к одноцепочечным цепям ДНК;
- Удлинение (синтез новой ДНК). Начинается с отожженного праймера и проходит вдоль цепи ДНК (72C).
После завершения первого цикла процесс повторяется, возвращаясь к первичной температуре, и начинается следующий цикл денатурации, отжига и удлинения (автоматического процесса в термоциклере). Этому трехступенчатому температурному циклу предстоит повторяться около тридцати раз, что приведет к экспоненциальной амплификации последовательности целевого гена.
Поскольку этапы с первого по третий повторяются в несколько циклов, с каждым из них образуются вновь выстроенные цепи ДНК, отсюда и название этой лабораторной процедуры.
Анализ новообразованных цепочек ДНК
В конце, по завершении циклов цепной реакции, так называемые продукты ПЦР-анализа, то есть новообразованные молекулы ДНК, исследуют и оценивают качественно и количественно. Есть много вариантов этой оценки, в основном основанные на окрашивании (как правило, флуоресцентным красителем) ДНК и визуализации (с помощью гель-электрофореза или фотометрического флуоресцентного обнаружения).
Какие результаты анализов дает ПЦР
Результаты современных методов лабораторного исследования можно объединить в две группы:
- качественные результаты;
- количественные результаты.
Качественная методика выявляет, присутствует ли определенный участок генетического материала в исследуемом материале («положительный» результат) или нет («отрицательный» результат).
Таким образом, качественная ПЦР в основном используется для уточнения следующих диагностических вопросов (результаты «да/нет»):
- диагностика наследственных заболеваний;
- уточнение мутаций;
- распознавание генетических характеристик (например, предрасположенность к определенным заболеваниям) и т.д.
Количественная ПЦР — дальнейшее развитие лабораторной процедуры. С помощью нее выявляется не только наличие определенного участка генетического материала, но и количество генетического материала. Соответственно, количественная ПЦР используется для определения количества возбудителей в организме больного. При вирусных инфекциях эта процедура используется для выявления вирусной нагрузки.
Кроме того, количественная лабораторная оценка также имеет большое значение в фундаментальных исследованиях, благодаря чему эта диагностика приносит пользу не только медицине человека, но и ряду других научных областей: ветеринарии, биохимии, биологии и многим другим.
Преимущество этого анализа в диагностике инфекционных заболеваний состоит в том, что результаты лабораторной процедуры становятся доступны достаточно быстро (как правило, в течение одного рабочего дня). Кроме того, это тестирование считается высокочувствительным лабораторным методом. Это означает, что даже минимальное количество бактерий или вирусов в исследуемом материале приводит к достоверно положительному результату.
Наиболее важные области применения ПЦР
Что касается областей применения в области медицины человека, то этот лабораторный тест используется для решения следующих диагностических вопросов:
- Выявление наследственных заболеваний. Процедуры проводятся для диагностики большого количества наследственных заболеваний;
- Фармакогенетика. Исследуя генетические особенности метаболизма печени, можно сделать выводы об эффективности и дозировке препаратов.
- Онкологические заболевания. Метод используется, с одной стороны, для уточнения факторов риска некоторых опухолевых заболеваний (например, рака молочной железы). Однако, с другой стороны, клетки и ткани в уже возникших опухолях также можно исследовать на предмет различных мутаций, что играет все более важную роль в лечении этих заболеваний.
- Судебная медицина («судебная экспертиза»). В этом случае применение ПЦР тестирования имеет большое значение, например, в процедурах установления отцовства.
- Инфекционная медицина. ПЦР имеет огромное значение в диагностике и мониторинге течения и терапии бактериальных, вирусных и паразитарных инфекционных заболеваний.
- Секвенирование ДНК. Это процесс определения последовательности нуклеотидов (пар оснований) определенной последовательности ДНК. Клинически секвенирование используется для выявления патогенных мутаций у лиц с генетическими нарушениями, вызванными редкими вариантами в определенном локусе. Примером может служить повторное секвенирование локуса BRCA1 у лиц с риском семейного рака молочной железы. Текущее клиническое секвенирование основано на ПЦР, при этом каждый анализ фокусируется на определенном экзоне или области гена.
- Обнаружение редких последовательностей. Технология также позволяет обнаруживать редкие последовательности в популяции молекул ДНК или РНК. Это особенно полезно при поиске перестроек ДНК в условиях неоплазии. Примером может служить открытие того, что вирус, родственный Herpes simplex, участвует в патогенезе саркомы Капоши.
Продолжение статьи
- Полимеразная цепная реакция (ПЦР) — все секреты популярного анализа — часть 1.
- Полимеразная цепная реакция (ПЦР) — все секреты популярного анализа — часть 2.
|
ДНК-полимераза |
Частота мутаций
(на 1 нуклеотид/1 |
|
Pfu |
1,3 |
|
Deep |
2,7 |
|
Vent |
2,8 |
|
Taq |
8,0 |
|
exo(-)Pfu |
5,0 |
|
Смесь |
5 |
ошибочно
спаренных нуклеотидов праймера и
ДНК-матрицы одинаково эффективно
предотвращают синтез ДНК Taq-полимеразой.
По способности направлять синтез ДНК
все такие пары 3’-концевого нуклеотида
праймера и соответствующего нуклеотида
матричной ДНК располагаются в следующий
ряд: C–C, A–G, G–A, G–G < A–A < T–C, C–T, T–T
<< A–C, C–A << G–T, T–G (данные фирмы
«Cetus»).
При этом наименее благоприятными для
продолжения синтеза ДНК являются пары
нуклеотидов пурин–пурин и
пиримидин–пиримидин.
РНК-зависимые
ДНК-полимеразы
(обратные транскриптазы, ревертазы).
Обратные транскриптазы способны
осуществлять синтез ДНК на матрице РНК,
полимеризуя четыре дезоксирибонуклеозидтрифосфата,
как это имеет место в случае ДНК-зависимых
ДНК-полимераз. Обратные транскриптазы,
так же как и ДНК-полимеразы функционируют
только при наличии затравки. Широко
используемая в генной инженерии обратная
транскриптаза вируса миелобластоза
птиц помимо полимеризующей активности
обладает 5’3’-
и 3’5’-экзорибонуклеазными
активностями и расщепляет РНК в
ДНК-РНК-гибридах по процессивному
механизму. Обратные транскриптазы
находят применение в синтезе двухцепочечных
ДНК, комплементарных РНК (особенно
мРНК), для последующего ее клонирования
в плазмидных векторах при получении
библиотек (клонотек) кДНК (см. раздел
7.3). Обратные транскриптазы, подобно
ДНК-полимеразам, могут быть использованы
для введения радиоактивной или
флуоресцентной метки в ДНК-зонды в
составе соответствующим образом меченных
дезоксирибонуклеозидтрифосфатов.
Недавно способность
синтезировать ДНК на матрице РНК в
определенных условиях была продемонстрирована
для термостабильной ДНК-полимеразы
Thermus thermophilus. Это позволяет использовать
ее для прямого обнаружения специфических
РНК в биологических образцах методом
ПЦР. Современные модификации такого
подхода дают возможность в одной
реакционной смеси (и пробирке) синтезировать
в реакции обратной транскрипции небольшое
число копий амплифицируемого фрагмента
ДНК на матрице РНК, которые сразу же
используются тем же ферментом в качестве
матрицы в обычной ПЦР (one tube PCR).
-
Другие ферменты
Среди
других многочисленных ферментов,
используемых в генной инженерии, прежде
всего следует упомянуть полинуклеотидкиназы,
которые осуществляют перенос -фосфатных
групп ATP на 5’-OH группы ДНК или РНК.
Полинуклеотидкиназа
бактериофага Т4
широко используется для введения
радиоактивной метки в ДНК или РНК с
целью получения радиоактивно меченных
зондов или секвенирования нуклеиновых
кислот.
Терминальная
трансфераза
из тимуса теленка (терминальная
дезоксирибонуклеотидилтрансфераза),
осуществляющая последовательное
присоединение дезоксирибонуклеозидмонофосфатов
из пула дезоксирибонуклеозидтрифосфатов
к 3’-OH-группам молекул ДНК, используется
для введения радиоактивной метки в
составе меченых нуклеотидов в 3’-концы
ДНК, а также присоединения к 3’-концам
фрагментов ДНК (особенно кДНК) протяженных
гомополимерных последовательностей
нуклеотидов (коннекторов)
для последующего их клонирования.
Щелочные
фосфатазы бактерий
(BAP) и кишечника теленка (CIAP) катализируют
удаление 5’-фосфатных групп ДНК или
РНК, а также расщепление макроэргических
связей рибо- и дезоксирибонуклеозидтрифосфатов.
Их используют при подготовке фрагментов
нуклеиновых кислот к введению 5’-концевой
радиоактивной метки 32Р,
а также для предотвращения лигирования
векторных молекул ДНК самих на себя.
Как уже упоминалось выше, ДНК-лигаза
способна образовывать фосфодиэфирные
связи в одноцепочечных разрывах лишь
при наличии в них 5′-концевого фосфата.
Удаление 5′-концевых фосфатных групп
молекул вектора, лианеризованных с
помощью одной рестриктазы во время его
подготовки для клонирования соответствующего
фрагмента ДНК, предотвращает образование
кольцевых молекул вектора (без вставки),
а также его олигомеров во время лигирования
с клонируемой последовательностью.
Необходимые для лигирования со вставкой
фосфатные группы содержатся в самих
клонируемых фрагментах ДНК, а остающиеся
в результате неполного лигирования два
одноцепочечных разрыва репарируются
in vivo
после введения вектора со вставкой в
бактериальные клетки.
В
заключение следует рассмотреть некоторые
нуклеазы,
часто используемые в генной инженерии.
Нуклеазы – это гидролитические ферменты,
расщепляющие нуклеиновые кислоты. По
механизму расщепления субстратов
нуклеазы разделяют на экзо- и эндонуклеазы.
Экзонуклеазы
осуществляют последовательное отщепление
моно- или небольших олигонуклеотидов
с концов молекул ДНК или РНК, тогда как
эндонуклеазы
вносят в
молекулы нуклеиновых кислот внутренние
разрывы. В частности, к эндонуклеазам
относятся многочисленные рестриктазы,
рассмотренные выше. Некоторые нуклеазы
обладают более широкой специфичностью
и могут гидролизовать как РНК, так и
ДНК, а также одновременно проявлять
эндо- и экзонуклеазную активности.
Нуклеаза Bal31 из Alteramonias aspejiana последовательно
отщепляет отдельные моно- и олигонуклеотиды
с 5’- и 3’-концов двухцепочечных ДНК,
укорачивая обе цепи ДНК приблизительно
с равной скоростью. При этом нуклеаза
Bal31 гидролизует и одноцепочечные ДНК.
Экзонуклеаза III
E. coli
катализирует последовательное отщепление
5’-нуклеотидов из двухцепочечных ДНК
в направлении 3’5’.
Фермент обладает эндонуклеазной
активностью по отношению к апуринизированной
ДНК, активностью РНКазы H (гидролиз РНК
в РНК-ДНК-гибридах) и 3’-фосфатазной
активностью.
Экзонуклеаза
фага
катализирует последовательное отщепление
5’-мононуклеотидов в двухцепочечных
ДНК при наличии в них 5’-концевых
фосфатных групп. Ее используют для
получения одноцепочечных молекул ДНК
с целью их последующего секвенирования.
Нуклеаза
S1 из Aspergillus
orizae специфически расщепляет одноцепочечные
молекулы ДНК с образованием
5’-фосфорилированных моно- и
олигонуклеотидов. Те же свойства присущи
и нуклеазе золотистой фасоли (mung
bean).
Панкреатическая
рибонуклеаза A
(РНКаза A) обладает активностью
эндорибонуклеазы, специфически
расщепляющей фосфодиэфирные связи,
образованные пиримидиновыми нуклеотидами.
Продуктами гидролиза являются
3’-фосфорилированные пиримидиновые
мононуклеотиды и олигонуклеотиды,
содержащие концевые пиримидин-3’-монофосфаты.
Панкреатическая
дезоксирибонуклеаза
I
(ДНКаза I) представляет собой эндонуклеазу,
гидролизующую как одно-, так и двухцепочечную
ДНК с образованием сложной смеси моно-
и олигонуклеотидов, содержащих
5’-фосфатные группы. В присутствии ионов
Mg2+
ДНКаза I независимо атакует каждую цепь
ДНК, при этом места разрывов располагаются
статистически вдоль молекулы, а в
присутствии ионов Mn2+
расщепляет обе цепи ДНК приблизительно
напротив друг друга.
Рассмотренные
ферменты не исчерпывают всего списка
белков, используемых в генной инженерии.
Особенности применения многих из этих
ферментов для решения конкретных
генно-инженерных задач будут не раз
обсуждаться при дальнейшем изложении
принципов генной инженерии.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
: 21 Сен 2009 , Виват, Универ! , том 28,
№4
Часовые генома
Каждую секунду в клетках нашего тела возникает множество повреждений ДНК — число их измеряется квадриллионами. К счастью, лишь очень немногие из них приводят к последствиям в виде мутаций или возникновения раковых опухолей. Каким образом исправляется подавляющее большинство повреждений? Что происходит, когда системы их коррекции дают сбой? Об этом и о многом другом рассказывает эта статья
Эта история началась как в персидской поэме-сказке «Восемь райских садов» Амира Хосрова Дехлеви, написанной еще в XIV в. Жили некогда три брата-принца на острове Цейлон, именуемом тогда Серендипом. И была у них особенность – когда они что-то искали, то находили совершенно другое, но при этом еще более нужное. Почти пять столетий спустя это сказание прочел английский писатель Г. Уолпол и придумал слово serendipity. Считается, что оно входит в список десяти английских слов, самых трудных для перевода, но суть его понятна из легенды – это способность делать неожиданные удачные открытия «по случаю». Неудивительно, что именно в научном мире слово это употребляется особенно часто.
Вот так «по-серендипски» все и произошло… В 1946 г. А. Кельнер из знаменитой лаборатории молекулярной биологии в Колд-Спринг-Харборе занимался важным делом – искал новые антибиотики. Дело было сразу после войны, и успех пенициллина был у всех на слуху. Работая с бактериями стрептомицетами, Кельнер решил проверить, можно ли каким-то стрессовым воздействием заставить их вырабатывать больше нужного продукта. В качестве стрессового фактора он использовал облучение ультрафиолетом. Но вот беда – ему никак не удавалось подобрать нужную дозу облучения, при которой бактерии выживали. Данные по выживаемости стрептомицетов, оцененной по росту их колоний, «скакали» в зависимости от условий, в которых они находились после облучения.
К счастью, будучи очень аккуратным, Кельнер скрупулезно записывал мельчайшие детали своих экспериментов. Оказалось, что сразу после облучения выживаемость стрептомицетов была низкой. Ситуация не особенно улучшалась, если их затем держали какое-то время в темноте. А вот на свету выживаемость постепенно увеличивалась, и чем больше света – тем быстрее!
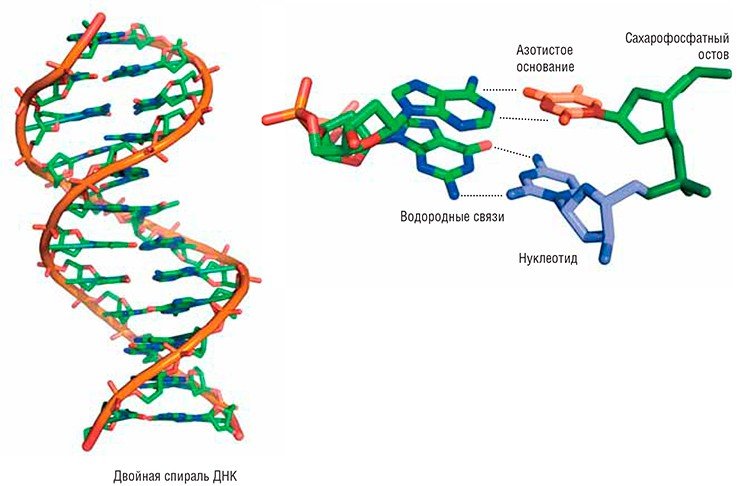
Молекула ДНК преставляет собой спираль, скрученную из двух цепочек. Цепочки состоят из последовательно соединенных нуклеотидов – азотистых оснований, присоединенных к остатку сахара-дезоксирибозы. В результате получается единый сахарофосфатный остов, на который навешаны основания четырех разных типов (аденин (А), гуанин (Г), тимин (Т) и цитозин (Ц)). Основания двух цепочек соединяются друг с другом водородными связями по принципу комплементарности (против А – Т, Ц – Г), что обеспечивает конструкции прочность. Вследствие действия негативных факторов различной природы могут повреждаться как отдельные основания, так и целые нуклеотиды и сахарофосфатный остов
Перепроверка всех результатов заняла у Кельнера три года. А тем временем инактивацию ультрафиолетом бактериофагов (вирусов бактерий) изучал Р. Дульбекко, будущий нобелевский лауреат (в то время он был молодым научным сотрудником в группе С. Лурии, тоже будущего нобелевского лауреата). Ученый пришел точно к таким же выводам, как и Кельнер.
Удивительное совпадение: когда Кельнер написал статью о своих результатах, он послал ее именно Лурии для прочтения и критики. К чести Дульбекко и Лурии, они не стали зажимать работу конкурента, а, напротив, поделились с ним своими достижениями. Статьи обоих ученых вышли в одно и то же время. В общем-то, уже тогда было известно, что ультрафиолет повреждает генетический материал клетки. Результаты исследований свидетельствовали, что видимый свет помогает ему восстанавливаться. Этот процесс назвали фотореактивацией.
Вот так, совершенно случайно и «попутно» было сделано открытие процесса репарации ДНК, не менее важного, чем широко известные другие молекулярно-генетические процессы репликации, транскрипции и трансляции генетического материала. История принцев Серендипа в очередной раз повторилась…
Зачем это нужно?
Как известно, ДНК состоит из азотистых оснований четырех разных типов и сахарофосфатного остова, образующего непрерывную цепочку, на которую эти основания навешены. Повреждаться могут как основания, так и остов. Всего насчитывают около сотни возможных различных повреждений, механизмы возникновения которых также различаются.
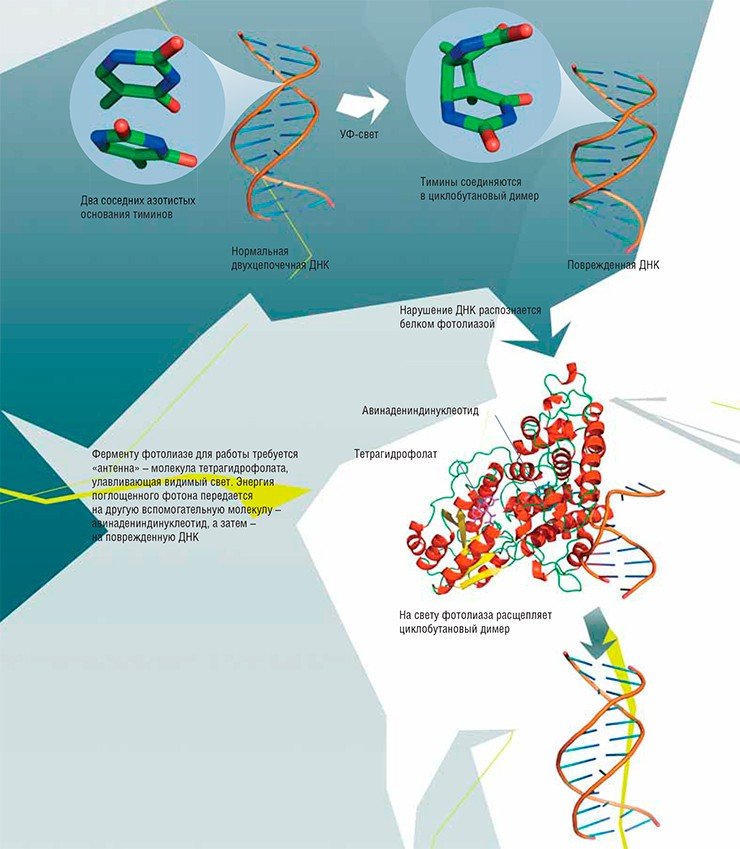
Например, при дезаминировании (отщеплении аминогруппы NH2) из обычного для ДНК основания цитозина возникает урацил, в норме встречающийся только в РНК. Основания ДНК могут подвергаться окислению. К некоторым позициям в основаниях охотно присоединяются другие углеродсодержащие группы – происходит алкилирование. Под влиянием ультрафиолетового света соседние тимины могут сшиваться друг с другом, образуя димеры. Очень часто основания отрываются от остова ДНК: так возникают АП-сайты. А ионизирующая радиация приводит к появлению в цепи ДНК одно- или двухцепочечных разрывов.
Повреждения ДНК, особенно если их много, могут вызывать не только мутации, но и гибель клетки. Тут необходимо отметить, что повреждение ДНК и мутация – не одно и то же. Чтобы повреждение превратилось в мутацию, нужно, чтобы произошла репликация – синтез новой цепочки ДНК на матрице «старой». Обычно при репликации соблюдается принцип комплементарности. Однако если в матрице есть поврежденное звено, то напротив него в дочернюю цепь включится совсем не то, что нужно.
Например, напротив АП-сайта может включиться в принципе все, что угодно – ведь на матрице нет основания-подсказки. Вот так и возникнет мутация, т. е. отклонение последовательности ДНК от исходной. Мутации в половых клетках передаются следующему поколению, а в остальных клетках организма могут приводить к раку. Как полагают сейчас многие ученые, и самая неизлечимая «болезнь» – старение – тоже тесно связана с накоплением мутаций в клетках нашего тела.
Кстати сказать, еще одним источником появления ошибок в ДНК служит неправильное включение нуклеотидов при самой репликации. Ферменты ДНК-полимеразы делают такие ошибки с частотой примерно 0,001—0,00001. Частично полимеразы могут сами исправлять свои ошибки, сразу вырезая неправильно включенное звено, что повышает их надежность еще в 100—1000 раз. Однако даже такая точность соответствует десяткам или даже сотням ошибок, которые возникают в каждой нашей клетке при ее делении.
Все ошибки, возникшие в нуклеотидной последовательности ДНК, необходимо исправлять. Поэтому в процессе эволюции возникли несколько систем, известных под общим названием «системы репарации ДНК», защищающие нас от мутаций, вызванных повреждениями наследственного материала. Дать их даже очень схематичное описание в небольшой статье – задача практически невыполнимая. А полное их описание в главном талмуде ученых-репарационщиков – книге Э. Фридберга «Мутагенез и репарация ДНК» (2006 г.) – занимает полторы тысячи страниц убористого текста. Тем не менее получить общее представление о работе этих систем вполне возможно.
Врачу, исцелися сам!
При штатной работе систем репарации наш геном вполне стабилен. Однако, как и в любой достаточно сложной схеме, у них есть свои слабые точки, неполадки в которых приводят к сбою всего механизма.
Гены, кодирующие белки репарации, ничем не отличаются от других генов – в них тоже могут происходить мутации. Если такая мутация не позволяет белку нормально функционировать, соответствующий путь репарации отключается. Тогда в организме проявляется так называемый мутаторный фенотип, в котором новые мутации появляются гораздо легче, со всеми вытекающими отсюда неприятными последствиями. Дефекты определенных генов репарации проявляются как наследственные болезни, для которых обычно повышен риск возникновения рака, но вообще их проявления могут быть достаточно разнообразны.
РЕМОНТНАЯ МАСТЕРСКАЯ ДНК: УЧИМ МАТЧАСТЬ
На сегодняшний день известно шесть разных механизмов репарации (ремонта) ДНК, которые работают независимо, но иногда могут и взаимодействовать. Еще одна ремонтная система не восстанавливает поврежденную ДНК, но помогает клетке выжить
РЕАКТИВАЦИЯ
Этот процесс идет с помощью одного специфичного белка-фермента, предназначенного для исправления только определенного повреждения. Среди них есть ферменты-самоубийцы, способные катализировать только одну реакцию, т. е. исправить одну «ошибку». При этом их структура меняется, и работать дальше они не могут
ЭКСЦИЗИОННАЯ РЕПАРАЦИЯ ОСНОВАНИЙ
По этому пути происходит репарация небольших поврежденных оснований, не вносящих значительных искажений в структуру ДНК. Сначала такое основание узнается ДНК-гликозилазами, которые вырезают его из ДНК. Таких ферментов более десятка, и каждый из них удаляет только определенные поврежденные основания. После этого в ДНК остается «пустое место» (АП-сайт), в которую в конечном счете встраивается «правильное» основание
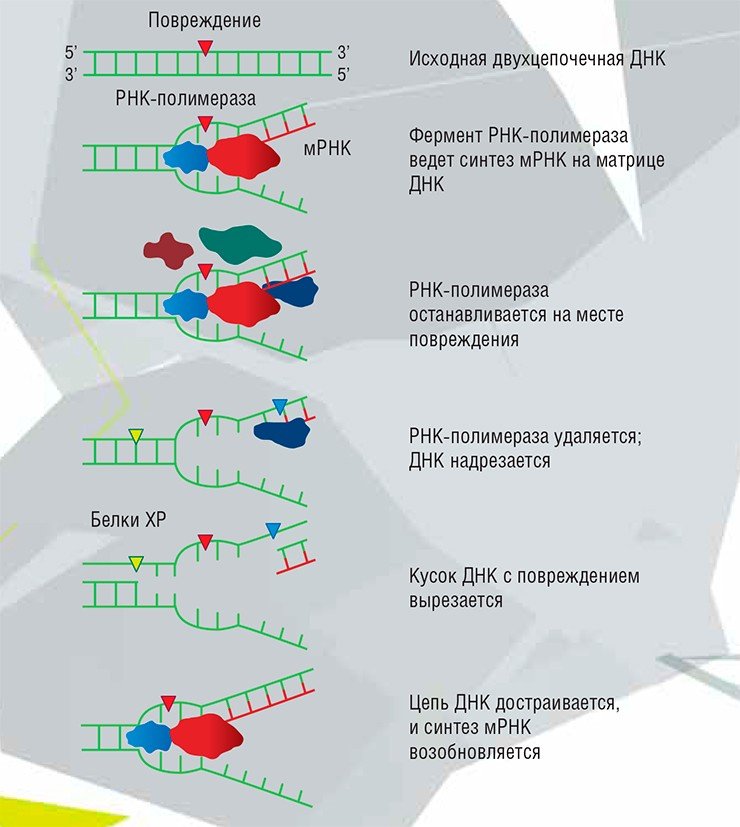
ЭКСЦИЗИОННАЯ РЕПАРАЦИЯ НУКЛЕОТИДОВ
Этот один из самых сложных механизмов репарации задействован в случае повреждений, сильно искажающих структуру ДНК. В нем различают две ветви. В первом случае поврежденное основание может располагаться в любом месте генома; во втором – только в тех сравнительно немногочисленных участках ДНК, которые служат матрицей для синтеза РНК, необходимой для белкового синтеза (как известно, большая часть нашей ДНК ничего не кодирует). В процессе задействованы более двух десятков разных белков.
В глобальной геномной репарации основную роль играют белки, названия которых начинаются с букв XP (по латинскому названию болезни пигментной ксеродермы, которая вызывается нарушениями в их работе). Повреждение распознается, двойная спираль ДНК разделяется на отдельные цепи. Потом из такого «глазка» в ДНК вырезается кусок размером 27—29 нуклеотидов, а на его месте достраивается «правильный» недостающий участок.
Транскрипционнозависимая репарация чуть-чуть попроще, происходит во время синтеза мРНК, в дальнейшем служащей матрицей для синтеза белка. Повреждение при этом находится РНК-полимеразой, которая попросту застревает на аварийном участке в ходе синтеза РНК
РЕПАРАЦИЯ ГЕТЕРОДУПЛЕКСОВ
Гетеродуплекс – пара некомплементарных нуклеотидов – обычно образуется при ошибках копирования ДНК ферментом ДНК-полимеразой. Поскольку оба нуклеотида пары сами по себе вполне «правильны», для репарации нужно различить, какой из них находился в матричной цепи и, следовательно, не должен удаляться.
Эту работу выполняет комплекс белков, который ищет ближайший разрыв в цепочках ДНК – с большой вероятностью это будет как раз то место, где находится ДНК-полимераза, виноватая в ошибке. Значит, именно эта цепь и была неправильно синтезирована. Вся дочерняя цепь ДНК до гетеродуплекса включительно разрушается, и синтез идет заново
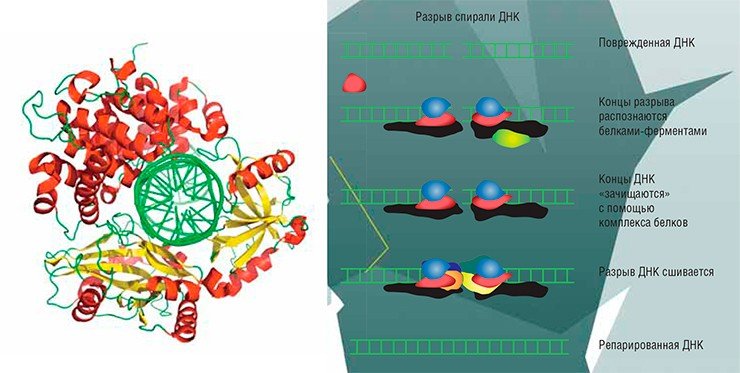
ВОССОЕДИНЕНИЕ НЕГОМОЛОГИЧНЫХ КОНЦОВ
В спирали ДНК могут встречаться повреждения в виде двуцепочечных разрывов. В ходе репарации несколько звеньев по концам разрыва отщепляются и цепи сшиваются.
Однако при этом теряется часть ДНК, где находился разрыв. Поэтому такой процесс характерен в основном для клеток высших организмов, у которых основную часть генома составляет нефункциональная ДНК, и риск потери смысловой ДНК невелик. Такая репарация необходима также при переформировании генов, кодирующих иммуноглобулины, целью которого является создание новых последовательностей ДНК
ГОМОЛОГИЧНАЯ РЕКОМБИНАЦИЯ
Этот довольно сложный процесс позволяет «заштопать» двуцепочечные разрывы безошибочно. Для этого используется неповрежденная копия той же самой последовательности, например, во второй хромосоме из диплоидного набора. Подробно описать процесс затруднительно: в нем принимают участие много ферментов, а нити ДНК тасуются туда-сюда, как карты в руках искусного фокусника
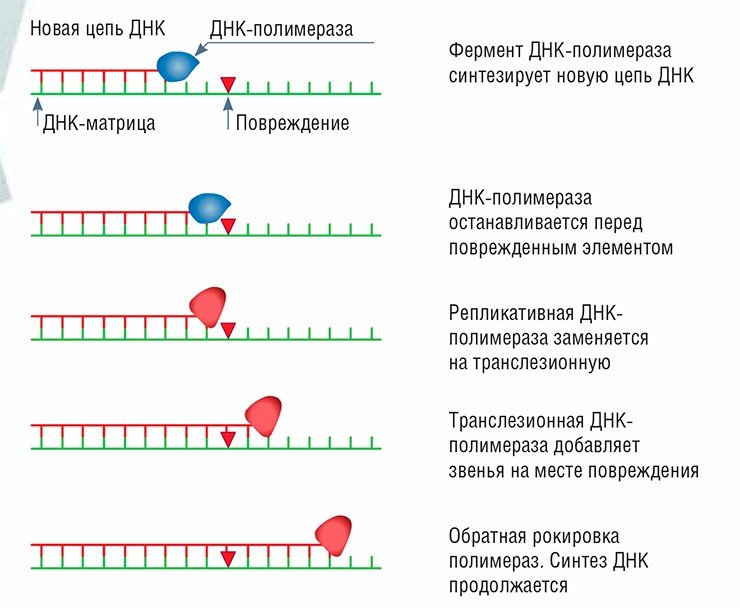
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ
Используется не для репарации, а для «купирования» повреждений ДНК при ее копировании, когда ведущая синтез дочерней цепи ДНК-полимераза на него уже наткнулась и застопорилась. Тогда обычная ДНК-полимераза заменяется на одну из большого семейства транслезионных полимераз. По традиции эти ферменты обозначаются буквами греческого алфавита, и их так много, что пока неизвестно, что кончится раньше – полимеразы или греческий алфавит.
Специальная полимераза вставляет один-два случайных нуклеотида на месте повреждения, а потом за работу вновь принимается обычная. При этом повреждение не удаляется, и на его месте в будущем может возникнуть мутация. Но клетка, тем не менее, выживает
Пожалуй, самая известная и хорошо изученная из таких болезней – пигментная ксеродерма. Она даже оставила следы в художественной литературе: любители триллеров Д. Кунца могут вспомнить, что именно ей страдает детектив-любитель Кристофер Сноу, главный герой цикла «Лунная бухта». На самом деле это даже не одно заболевание, а целых восемь, но с довольно схожими проявлениями. Большая часть случаев связана с неисправностями системы эксцизионной репарации нуклеотидов (недостатком любого из семи белков XPA–XPG, в ней участвующих) либо белка XPV, который представляет собой ДНК-полимеразу, участвующую в транслезионном синтезе.
Фотографиями людей, больных пигментной ксеродермой, специалисты по репарации любят пугать аудиторию на лекциях или научных конференциях. Главный признак болезни – тяжелые ожоги, остающиеся на коже после самого непродолжительного пребывания на солнце. После ожогов быстро появляются пигментные пятна, кожа сохнет и растрескивается, а кончается все раком кожи, который развивается примерно к 7—8 годам. Поражаются и глаза, которые очень болезненно реагируют на солнечный свет. Менее половины больных пигментной ксеродермой доживают до 20 лет. Хорошо, что болезнь эта встречается довольно редко: среди европейцев – примерно у 4 человек из миллиона. А вот у японцев частота встречаемости пигментной ксеродермы в шесть раз выше.
Внимание ученых эта болезнь привлекает в том числе и своей многоликостью. Нечасто бывает, что повреждение одного и того же гена вызывает разные заболевания, но в данном случае дела обстоят именно так. Причина в том, что один и тот же белок может входить в состав разных белковых комплексов, выполняющих в клетке разные функции. И одна мутация может нарушать только способность белка работать в одних комплексах, в других же он будет вполне работоспособен.
Например, некоторые мутации в гене, кодирующем репарационный белок XPD, вызывают типичную ксеродерму, а другие мутации в том же гене – совершенно другую болезнь, синдром Кокейн, при которой в первые два года жизни начинаются проблемы с ростом и развитием. В результате у таких детей развивается карликовость и истощение, а лицо приобретает характерную «птичью» форму – ввалившиеся глаза и выдающийся нос. Разрушаются оболочки нервных волокон, многие нейроны отмирают, в сосудах головного мозга откладываются соли кальция – создается впечатление, что нервная система при этом синдроме стареет намного быстрее остального организма. Средняя продолжительность жизни таких больных еще меньше – около 12 лет.
А еще мутация в том же самом гене может вызывать и третью болезнь – трихотиодистрофию, при которой репарация ДНК происходит практически нормально, но при этом в организме нарушается синтез некоторых белков-кератинов. Результат – ломкие волосы, чешуйчатая кожа и почти полное отсутствие жировой ткани на лице.
Всего насчитывают несколько десятков наследственных заболеваний, связанных с неисправностями систем репарации. По большей части такие болезни, как и следовало ожидать для мутаторного фенотипа, отличаются повышенным риском развития рака и зачастую – ускоренным старением.
В частности, синдром Вернера, при котором не работает одна из ферментов-геликаз репарации, практически точно воспроизводит картину нормального старения. Вот только обычный срок человеческой жизни при этом сжат до 30—50 лет… А еще дефекты репарации часто проявляются в нейродегенеративных заболеваниях. Все знают, что «нервные клетки не восстанавливаются», и хотя это на самом деле не совсем так, но все же типичный нейрон действительно должен служить человеку всю жизнь. А за это время в его ДНК возникает множество повреждений.
Крем с ферментами
Разумеется, такие мощные и специфичные защитные средства, как ферменты репарации, не могли пройти мимо внимания медиков. Хорошо было бы научиться использовать их для предохранения нашего генома от повреждений! Теоретически это возможно, но есть огромная проблема: пока что никто не придумал способа, с помощью которого молекулы белка, используемые в качестве лекарства, могли бы проникать во все клетки тела. Более того, белки вообще плохо проникают в клетки – для этого приходится использовать всяческие ухищрения. Например, их можно запаковать в специальные мембранные пузырьки – липосомы, которые будут сливаться с клеточными мембранами и высвобождать свое содержимое внутрь клетки.
Однако этим способом пока можно доставить терапевтические ферменты не во все ткани, а лишь в такие легкодоступные места, как кожа. Тут ферменты репарации действительно уже нашли применение в медицине – ведь кожа, частенько находящаяся под действием солнечного света, принадлежит к числу органов, больше всего страдающих от генотоксического стресса.
Американская компания AGI Dermatics выпускает кремы с липосомами, содержащими фотолиазу и эндонуклеазу V – два фермента, участвующие в репарации циклобутановых димеров, образующихся в ДНК под действием ультрафиолета. Небольшая баночка крема стоит около сотни долларов, и, по уверениям фирмы, ее продукт работает гораздо лучше обычных защитных кремов. Возможно, это действительно так: в отличие от большинства косметических продуктов, которые никогда не проходили жесткого тестирования, обязательного для лекарств, липосомы AGI Dermatics сейчас находятся на последней стадии клинических испытаний по профилактике рака кожи, в том числе и у больных пигментной ксеродермой.
По-видимому, использование ферментов репарации для предохранения барьерных тканей (кожи и слизистых оболочек) от генотоксического стресса имеет большое будущее. Уже сейчас ДНК-гликозилазы, исправляющие окислительные повреждения ДНК, испытываются (пока на животных) в качестве средств для предупреждения рака легких – органа, подвергающегося самой массированной атаке кислородными радикалами.
Репарацию у врага – подавить!
Итак, если у нас работают системы репарации – это хорошо. Плохо, когда они работают у наших врагов – болезнетворнх бактерий, вирусов и опухолевых клеток. Можно ли каким-то образом на них воздействовать, подавив в них репарацию? Такие примеры уже имеются.
Проще всего, как ни странно, оказалось использовать системы репарации в качестве мишени для лекарств при онкологических заболеваниях. Как известно, очень многие химиопрепараты действуют, повреждая ДНК раковой клетки. При этом эти повреждения, разумеется, подвергаются репарации, что снижает эффективность действия лекарств. Поэтому ингибирование репарации рассматривается сейчас как перспективный метод усиления действенности химиотерапии. Например, на последней стадии клинических испытаний находится бензилгуанин – ингибитор фермента-самоубийцы MGMT, который «ремонтирует» алкилированные основания ДНК и тем самым мешает работе таких широко применяемых противоопухолевых агентов, как кармустин и темозоломид.
Ингибиторы репарации для борьбы с бактериями и вирусами существуют пока только в проекте. Однако известно, что некоторые вирусы, например поксвирусы (в том числе вирус натуральной оспы), герпесвирусы (вирусы простого герпеса и ветряной оспы) и лентивирусы (ВИЧ), нуждаются для своего размножения в репарационном ферменте урацил-ДНК-гликозилазе, либо собственной, либо заимствованной у хозяина. Ингибиторы этого фермента также уже испытываются как противовирусные лекарства.
Что касается болезнетворных бактерий, то наши иммунные клетки-макрофаги при встрече с ними пытаются убить интервентов «окислительным взрывом», выбрасывая огромное количество кислородных и азотных радикалов, повреждающих бактериальную ДНК. Только мощная система репарации помогает бактериям выжить в таком столкновении; если ее удастся подавить, собственным защитникам человеческого организма будет легче справиться с инфекцией.
ДНК, как здоровье?
То, что повреждение ДНК может доставить массу неприятностей – понятно. А есть ли способ как-то оценить «здоровье» ДНК, померить, сколько в ней «ошибок»? Это очень важно, например, для оценки потенциальной степени мутагенности окружающей среды, влияния нового лекарства на человеческий организм, да мало ли еще для чего…
Один такой способ изобрел в 1988 г. Нарендра Сингх из американского Национального института старения. Речь идет о кометографии, или методе кометного хвоста. В самом простом варианте при этом измеряется число двухцепочечных разрывов в ДНК. Отдельные клетки (например, лейкоциты крови) заплавляют в агарозную плашку, разрушают их оболочку особыми реагентами и помещают в электрическое поле – ведут знакомый всем биохимикам электрофорез. Молекула ДНК, заряженная отрицательно, движется к аноду. Но так как она очень длинная, то с места почти не сдвигается. Но если в ДНК есть разрывы, то более короткие фрагменты быстро «убегают», за ними тянутся более длинные и т. д. Так что если окрасить ДНК специальными красителями, то будет видна характерная фигура – «кометный хвост». Чем хвост длиннее, тем больше в ДНК коротких фрагментов, тем больше разрывов и тем сильнее она повреждена.
С момента изобретения кометографии придумали множество ее разновидностей для обнаружения разных видов повреждений. Например, если вести электрофорез в щелочных условиях, то двойная спираль ДНК разделяется на отдельные цепочки. В результате можно увидеть не только двухцепочечные, но и одноцепочечные разрывы и даже АП-сайты. А если всю плашку предварительно хорошенько замочить в растворе, содержащем какую-нибудь ДНК-гликозилазу, то можно будет установить, сколько в ДНК было поврежденных оснований, которые этот фермент вырезает.
Помимо совершенствования методов кометографии постоянно ищутся и новые объекты. Например, несколько лет назад немецкие исследователи предложили для оценки состояния природных водоемов проводить кометографию на пресноводных губках, которые легко «разобрать» на отдельные клетки. Немцы даже приезжали на Байкал, собрали там губки и удостоверились, что байкальская вода генам на пользу.
Легко и быстро оценивать генотоксичность внешней среды помогает система, основанная на SOS-ответе бактерий. Известно, что некоторые бактериальные гены, в том числе гены репарации, включаются только при повреждении ДНК. В начале всех таких генов есть специальный регуляторный элемент – SOS-бокс. Если под него вместо штатного гена подставить какой-нибудь репортерный элемент (например, ген, кодирующий излюбленный биохимиками зеленый флуоресцентный белок), то в условиях, повреждающих ДНК, бактерия будет давать соответствующий цветной сигнал. Таким образом, светящиеся бактерии будут свидетельствовать об опасности для человеческих генов.
Сегодня насчитывается несколько десятков конструкций подобных биосенсоров – некоторые посылали даже в космос для исследования повреждающего действия космических лучей.
Практически закончив писать эту статью, автор зашел в базу данных PubMed, где собраны аннотации почти всех статей по биомедицинской тематике, когда-либо выходивших в мире.
Беглый поиск выдал 33 646 публикаций по тематике «репарация ДНК». Почти все новые «горячие» направления в биологии так или иначе пересекаются с репарацией – есть работы и по репарации в стволовых клетках, и по генотоксичности наночастиц… Как видно, интерес к этой теме огромен, и он будет только расти, ведь безопасность личного генома волнует нас всех.
И, будем надеяться, чудесная особенность принцев Серендипа, с которой началась история открытия репарации ДНК, еще не раз послужит ученым, работающим в этой области.
Литература
Жарков Д. О. Загадки «ржавой» ДНК // Наука из первых рук. – 2006. –№ 6. – С. 24—35.
Ходырева С. Н., Лаврик О. И. Как клетка ремонтирует ДНК // Наука из первых рук. – 2007. –№ 3. – С. 82—89.
Автор и редакция благодарят К. Баумштарк-Хан (Институт аэрокосмической биологии, Германия) за помощь в подготовке иллюстраций
: 21 Сен 2009 , Виват, Универ! , том 28,
№4
Многие методы исследования в области молекулярной биологии требуют миллионов идентичных копий чистой ДНК. Полимеразная цепная реакция — это молекулярный метод, имитирующий процесс репликации дезоксирибонуклеиновой кислоты для амплификации определенных сегментов ДНК in vitro. Реакция повторяется через серию изменений температуры, во время которых нити ДНК разделяются, праймеры связываются и образуются комплементарные нити.
Эволюция ДНК-полимераз
Прогресс в ПЦР был бы невозможен без эволюции ДНК-полимераз — специализированных ферментов.
История современной ПЦР началась в 1976 году с выделения ДНК-полимеразы Taq из термофильной бактерии Thermus aquaticus. Выявление бактерии означало, что у молекулярных биологов появился термостабильный фермент, способный к повторному циклу ПЦР без необходимости добавления свежей ДНК-полимеразы после каждого цикла.
Однако влияние, которое фермент Taq окажет на молекулярную биологию, не был ясен до 1988 года, пока фермент не коммерциализировали для широкого использования. ДНК-полимераза Taq имела мгновенный успех, и в 1989 г. даже была названа журналом Science «Молекулой года».
Хотя эти разработки представляли собой значительный прогресс, ДНК-полимераза Taq не была идеальной. Анализ с ее использованием был нестабилен при высоких температурах и подвержен ошибкам. Эти факторы сыграли роль в задержке развития возможностей ПЦР на раннем этапе, особенно в приложениях, требующих высокой специфичности и надежности. Вскоре стало очевидно, что разработка ДНК-полимераз неразрывно связана с эффективным использованием ПЦР, и что для увеличения мощности ПЦР и открытия более широкого спектра возможностей анализа необходимо разработать более совершенные ДНК-полимеразы.
В конце 1980-х годов появился ряд методов с использованием «горячего старта», помогающих преодолеть неэффективность и низкую специфичность ДНК-полимеразы Taq при высоких температурах. Эти методы заключались в нагревании образцов до 95°C и последующем охлаждении до 60–70°C перед добавлением полимеразы. Несмотря на эффективность, методы горячего старта отнимали много времени и часто вызывали перекрестное загрязнение проб. ПЦР требовалось долгосрочное решение.
В 1991 г. были выделены и разработаны полимеразы Pfu, полученные из гипертермофильных архей Pyrococcus furiosus. ДНК-полимераза Pfu, в отличие от ДНК-полимеразы Taq, имеет встроенную корректирующую активность экзонуклеазы от 3 ‘до 5’, что означает, что она может исправлять ошибки включения нуклеотидов, значительно снижать частоту ошибок и обеспечивать повышенную специфичность. Разработка и использование как полимераз Pfu, так и Taq продолжались в течение некоторого времени, при этом ПЦР сыграла важную роль в ряде новаторских исследований, таких как секвенирование.
Внедрение слитых ДНК-полимераз в 2003 году, стало первым шагом в разработке полимераз нового поколения и ПЦР высокой точности. Эти специально сконструированные ДНК-полимеразы могли преодолеть или уменьшить многие проблемы, все еще ограничивающие развитие ПЦР. Созданные путем слияния основных компонентов архебактериальной полимеразы с термостабильным ДНК-связывающим доменом, первые ДНК-полимеразы Phusion High Fidelity обладали сильной корректирующей способностью и были невероятно стабильны при высоких температурах реакции. Кроме того, при использовании специализированного ДНК-связывающего домена сродство полимеразы к двухцепочечной ДНК увеличивалось в геометрической прогрессии.
Разработка полимераз следующего поколения наряду с развитием технологий ПЦР в реальном времени и цифровой ПЦР гарантировала, что ПЦР будет играть важную роль в будущих исследованиях в области наук о жизни и здравоохранении.
Что такое полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР) — важнейший лабораторный метод исследования тонкой молекулярной структуры генетического материала. Он состоит из дезоксирибонуклеиновой кислоты (ДНК), составляющей генетический код человека, а также животных и растений.
В медицине анализ используется для уточнения наследственных заболеваний и генетических проблем (риск заболевания, тест на отцовство и т. д.), а также для диагностики многих инфекционных заболеваний. В отличие от серологической диагностики (определение антител к возбудителям в крови) способы полимеразной цепной реакции представляют собой прямой лабораторно-медицинский метод выявления в рамках уточнения инфекционных заболеваний.
Преимущество этого способа диагностики — быстрая доступность результатов. Кроме того, методы полимеразной цепной реакции обладают очень высокой чувствительностью. Это означает, что даже минимальное количество генетического материала от возбудителя (бактерии, вирусы и т. д.) приводит к достоверно положительному результату при наличии соответствующего патогена в нужном исследуемом материале.
Кровь — основной исследуемый материал для этого метода, однако используются и другие биологические жидкости (мокрота, моча, ликвор и т. д.). В основе генетического материала лежит особая длинноцепочечная молекула дезоксирибонуклеиновой кислоты.
У людей генетический материал, состоящий из двухцепочечной ДНК (две комплементарные нити), находится в ядре всех клеток организма, при этом они имеют идентичный генетический материал. Кроме того, индивидуальный геном каждого человека уникален по своему точному составу и сравним с отпечатком пальца, также уникального для каждого человека.
По этой причине генетический материал также называют «генетический код». В этой форме закодирована схема всех структур человеческого организма, таким образом она сохраняется и в дальнейшем может передаваться по наследству.
В ядрах клеток тела дезоксирибонуклеиновая кислота присутствует в особом порядке, известном как хромосомы (наследственные клетки). У людей они всегда встречаются парами, причём, одна наследуется от матери, а другая — от отца. Все клетки человеческого тела содержат в общей сложности 46 хромосом — 22 пары, называемые аутосомами, и одну пару, называемую половыми хромосомами.
Лабораторная процедура может быть использована для исследования тонкой структуры генетического кода человека, что важно при диагностике заболеваний или уточнении конкретных вопросов:
- выявление наследственных заболеваний;
- оценка риска заболевания;
- исследование врожденных особенностей обмена веществ;
- судебно-медицинская (так называемая «криминалистическая») экспертиза.
Не только люди, но и фактически все формы жизни на Земле имеют определенный генетический материал:
- грибы;
- бактерии;
- вирусы;
- паразиты и др.
Геном этих форм жизни также состоит в основном из ДНК или, в варианте некоторых вирусов, также из РНК (рибонуклеиновая кислота), которая, в отличие от ДНК — одноцепочечная. Поэтому в медицинской диагностике этот метод также проводится для уточнения многих инфекционных заболеваний:
- бактериальные инфекции, например, туберкулез, бактериальные венерические заболевания;
- вирусные инфекции, например, вирусный гепатит, ВИЧ-инфекция;
- паразитарные инфекции, например, малярия, и многое другое.
Компоненты полимеразной цепной реакции
ПЦР включает следующие компоненты:
- ДНК-матрица (образец дезоксирибонуклеиновой кислоты, с целевой последовательностью для амплификации);
- дезоксирибонуклеозидтрифосфаты;
- буфер;
- праймеры (прямые и обратные) – короткий сегмент нуклеотидов, комплементарный участку ДНК или РНК, необходимый для амплификации. В этой методике используются две короткие последовательности дезоксирибонуклеиновой кислоты, предназначенные для связывания с началом (прямой праймер) и концом (обратный праймер) последовательности – мишени.
- Taq-полимераза — термостабильная ДНК-полимераза, первоначально выделенная из термофильной бактерии Thermus aquaticus, сопротивляющаяся инактивации при температурах денатурации и позволяющая удлинять праймеры при высокой температуре.
Этапы полимеразной цепной реакции
Для проведения лабораторного исследования, извлеченный образец (содержащий шаблон ДНК-мишени) добавляют в пробирку, содержащую праймеры, свободные нуклеотиды (dNTP) и полимеразу Taq. Смесь помещают в лабораторное оборудование (термоциклер, ДНК-амплификатор) для проведения анализа. Термоциклер увеличивает и уменьшает температуру смеси для соответствующего анализа автоматическими запрограммированными шагами, экспоненциально генерирующими копии целевой последовательности.
Полимеразная цепная реакция включает три основных этапа:
- Денатурация (разделение цепей). Разделение двух комплементарных цепей ДНК, связанных водородными связями, на пару одноцепочечных полинуклеотидных молекул в процессе нагревания (от 94C до 96C);
- Отжиг (связывающий праймеры). Понижение температуры (45-60 C), для прикрепления праймеров к одноцепочечным цепям ДНК;
- Удлинение (синтез новой ДНК). Начинается с отожженного праймера и проходит вдоль цепи ДНК (72C).
После завершения первого цикла процесс повторяется, возвращаясь к первичной температуре, и начинается следующий цикл денатурации, отжига и удлинения (автоматического процесса в термоциклере). Этому трехступенчатому температурному циклу предстоит повторяться около тридцати раз, что приведет к экспоненциальной амплификации последовательности целевого гена.
Поскольку этапы с первого по третий повторяются в несколько циклов, с каждым из них образуются вновь выстроенные цепи ДНК, отсюда и название этой лабораторной процедуры.
Анализ новообразованных цепочек ДНК
В конце, по завершении циклов цепной реакции, так называемые продукты ПЦР-анализа, то есть новообразованные молекулы ДНК, исследуют и оценивают качественно и количественно. Есть много вариантов этой оценки, в основном основанные на окрашивании (как правило, флуоресцентным красителем) ДНК и визуализации (с помощью гель-электрофореза или фотометрического флуоресцентного обнаружения).
Какие результаты анализов дает ПЦР
Результаты современных методов лабораторного исследования можно объединить в две группы:
- качественные результаты;
- количественные результаты.
Качественная методика выявляет, присутствует ли определенный участок генетического материала в исследуемом материале («положительный» результат) или нет («отрицательный» результат).
Таким образом, качественная ПЦР в основном используется для уточнения следующих диагностических вопросов (результаты «да/нет»):
- диагностика наследственных заболеваний;
- уточнение мутаций;
- распознавание генетических характеристик (например, предрасположенность к определенным заболеваниям) и т.д.
Количественная ПЦР — дальнейшее развитие лабораторной процедуры. С помощью нее выявляется не только наличие определенного участка генетического материала, но и количество генетического материала. Соответственно, количественная ПЦР используется для определения количества возбудителей в организме больного. При вирусных инфекциях эта процедура используется для выявления вирусной нагрузки.
Кроме того, количественная лабораторная оценка также имеет большое значение в фундаментальных исследованиях, благодаря чему эта диагностика приносит пользу не только медицине человека, но и ряду других научных областей: ветеринарии, биохимии, биологии и многим другим.
Преимущество этого анализа в диагностике инфекционных заболеваний состоит в том, что результаты лабораторной процедуры становятся доступны достаточно быстро (как правило, в течение одного рабочего дня). Кроме того, это тестирование считается высокочувствительным лабораторным методом. Это означает, что даже минимальное количество бактерий или вирусов в исследуемом материале приводит к достоверно положительному результату.
Наиболее важные области применения ПЦР
Что касается областей применения в области медицины человека, то этот лабораторный тест используется для решения следующих диагностических вопросов:
- Выявление наследственных заболеваний. Процедуры проводятся для диагностики большого количества наследственных заболеваний;
- Фармакогенетика. Исследуя генетические особенности метаболизма печени, можно сделать выводы об эффективности и дозировке препаратов.
- Онкологические заболевания. Метод используется, с одной стороны, для уточнения факторов риска некоторых опухолевых заболеваний (например, рака молочной железы). Однако, с другой стороны, клетки и ткани в уже возникших опухолях также можно исследовать на предмет различных мутаций, что играет все более важную роль в лечении этих заболеваний.
- Судебная медицина («судебная экспертиза»). В этом случае применение ПЦР тестирования имеет большое значение, например, в процедурах установления отцовства.
- Инфекционная медицина. ПЦР имеет огромное значение в диагностике и мониторинге течения и терапии бактериальных, вирусных и паразитарных инфекционных заболеваний.
- Секвенирование ДНК. Это процесс определения последовательности нуклеотидов (пар оснований) определенной последовательности ДНК. Клинически секвенирование используется для выявления патогенных мутаций у лиц с генетическими нарушениями, вызванными редкими вариантами в определенном локусе. Примером может служить повторное секвенирование локуса BRCA1 у лиц с риском семейного рака молочной железы. Текущее клиническое секвенирование основано на ПЦР, при этом каждый анализ фокусируется на определенном экзоне или области гена.
- Обнаружение редких последовательностей. Технология также позволяет обнаруживать редкие последовательности в популяции молекул ДНК или РНК. Это особенно полезно при поиске перестроек ДНК в условиях неоплазии. Примером может служить открытие того, что вирус, родственный Herpes simplex, участвует в патогенезе саркомы Капоши.
Продолжение статьи
- Полимеразная цепная реакция (ПЦР) — все секреты популярного анализа — часть 1.
- Полимеразная цепная реакция (ПЦР) — все секреты популярного анализа — часть 2.
| ДНК-полимераза I, термостабильная | |||||
|---|---|---|---|---|---|
Большой (кленовский) фрагмент Taq polA, содержащий polA и рудиментарные домены |
|||||
| Идентификаторы | |||||
| Организм | Thermus aquaticus | ||||
| Символ | ПОЛЬША | ||||
| UniProt | P19821 | ||||
|
Taq полимераза термостабильный ДНК-полимераза I названный в честь теплолюбивый эубактериальный микроорганизм Thermus aquaticus, из которого он был первоначально выделен Chien et al. в 1976 г.[1] Его название часто сокращается до Taq или же Taq pol. Часто используется в полимеразной цепной реакции (ПЦР), метод значительного увеличения количества коротких сегментов ДНК.
T. aquaticus это бактерия что живет в горячие источники и гидротермальные источники, и Taq полимераза была идентифицирована[1] как фермент способен выдерживать денатурирующие белок условия (высокая температура), необходимые во время ПЦР.[2] Поэтому он заменил ДНК-полимеразу из Кишечная палочка изначально использовался в ПЦР.[3]
Ферментативные свойства
Taq ‘оптимальная температура для Мероприятия 75–80 ° C, при период полураспада более 2 часов при 92,5 ° C, 40 минут при 95 ° C и 9 минут при 97,5 ° C, и может повторить 1000 базовая пара цепь ДНК менее чем за 10 секунд при 72 ° C.[4] При 75-80 ° C, Taq достигает оптимального полимеризация скорость около 150 нуклеотиды в секунду на молекулу фермента, и любые отклонения от оптимального температурного диапазона ингибируют скорость удлинения фермента. Один Taq синтезирует около 60 нуклеотидов в секунду при 70 ° C, 24 нуклеотидов / сек при 55 ° C, 1,5 нуклеотидов / сек при 37 ° C и 0,25 нуклеотидов / сек при 22 ° C. При температуре выше 90 ° C, Taq проявляет очень небольшую активность или вообще не проявляет активности, но сам фермент не денатурирует и остается нетронутым.[5] Наличие определенных ионы в реакционном сосуде также влияет удельная активность фермента. Небольшие количества хлорид калия (KCl) и магний ион (Mg2+) продвигать Taqферментативная активность. Taq полимераза максимально активируется при 50 мМ KCl и правильной концентрации Mg2+ что определяется концентрацией нуклеозидтрифосфаты (дНТФ). Высокие концентрации KCl и Mg2+ подавлять Taqактивность.[6] Интересно, что обычный хелатор ионов металлов, EDTA, напрямую связывается с Taq в отсутствие этих ионов металлов.[7]
Один из Taq ‘недостатком является отсутствие 3′ к 5′ экзонуклеаза корректура Мероприятия[4] что приводит к относительно низкой точности репликации. Первоначально частота ошибок составляла примерно 1 из 9000 нуклеотидов.[8] Некоторые термостабильные ДНК-полимеразы были выделены из других термофильных бактерий и архей, таких как Pfu ДНК-полимераза, занимающихся корректурой, и используются вместо (или в сочетании с) Taq для высококачественного усиления.[9] Верность может сильно различаться между Taq, оказывая огромное влияние на последующие приложения секвенирования.[10]
Taq производит продукты ДНК, содержащие A (аденин ) выступы на концах 3 ‘. Это может быть полезно в Клонирование ТА, посредством чего клонирование вектор (например, плазмида ), имеющий T (тимин ) 3 ‘выступ, который дополняет выступ A продукта ПЦР, что позволяет перевязка продукта ПЦР в плазмидный вектор.
В ПЦР
В начале 1980-х гг. Кэри Маллис работал на Cetus Corporation о применении синтетических ДНК для биотехнология. Он был знаком с использованием ДНК олигонуклеотиды в качестве зондов для связывания с целевыми цепями ДНК, а также их использование в качестве грунтовки за Секвенирование ДНК и кДНК синтез. В 1983 году он начал использовать два праймера, один для гибридизировать к каждой цепи целевой ДНК и добавив ДНК-полимераза на реакцию. Это привело к экспоненциальному Репликация ДНК,[11] значительно усиливают дискретные сегменты ДНК между праймерами.[3]
Однако после каждого цикла репликации смесь необходимо нагреть выше 90 ° C до денатурировать вновь сформированная ДНК, позволяющая цепям разделиться и действовать как матрица в следующем раунде амплификации. Эта стадия нагрева также инактивирует ДНК-полимеразу, которая использовалась до открытия Taq полимераза, Кленовский фрагмент (получено из Кишечная палочка ). Taq Полимераза хорошо подходит для этого применения, потому что она способна выдерживать температуру 95 ° C, которая требуется для разделения цепей ДНК без денатурации.
Использование термостабильного Taq позволяет проводить ПЦР при высокой температуре (~ 60 ° C и выше), что способствует высокой специфичности праймеров и снижает производство неспецифических продуктов, таких как димер праймера. Кроме того, использование термостабильной полимеразы избавляет от необходимости добавлять новый фермент в каждый цикл термоциклирования. Одиночная закрытая труба в относительно простой машина можно использовать для выполнения всего процесса. Таким образом, использование Taq полимераза была ключевой идеей, которая сделала ПЦР применимой к большому разнообразию молекулярная биология проблемы, касающиеся анализа ДНК.[2]
Патентные вопросы
Hoffmann-La Roche в итоге купил ПЦР и Taq патенты от Cetus за 330 миллионов долларов, из которых он мог получить до 2 миллиардов долларов роялти.[12] В 1989 г. Научный журнал названный Taq полимераза его первая «Молекула года «. Кэри Муллис получила Нобелевская премия по химии в 1993 г. — единственная награда за исследования, выполненные в биотехнология Компания. К началу 1990-х годов техника ПЦР с Taq полимераза используется во многих областях, включая фундаментальные исследования молекулярной биологии, клинические испытания, и криминалистика. Он также начал находить неотложное применение в прямом обнаружении ВИЧ в СПИД.[13]
В декабре 1999 г. окружной судья США Вон Уокер постановил, что патент 1990 г. Taq Полимераза была частично выпущена на основании вводящей в заблуждение информации и ложных утверждений ученых с Cetus Corporation. Решение поддержало вызов Корпорация Промега против Хоффман-Ла Рош, который приобрел Taq патентов в 1991 году. Судья Уокер сослался на предыдущие открытия, сделанные другими лабораториями, включая лабораторию профессора Джон Трела в Университет Цинциннати отдел биологических наук, как основание для постановления.[14]
Структура домена
| Полимераза Taq, экзонуклеаза | |||||||
|---|---|---|---|---|---|---|---|
Полный Taq ДНК-полимераза, связанная с октамером ДНК |
|||||||
| Идентификаторы | |||||||
| Символ | Taq-exonuc | ||||||
| Pfam | PF09281 | ||||||
| ИнтерПро | IPR015361 | ||||||
| SCOP2 | 1qtm / Объем / СУПФАМ | ||||||
|
Taq PolA имеет общую структуру, аналогичную структуре Кишечная палочка PolA. Средний 3′-5′-домен экзонуклеазы, отвечающий за корректуру, был радикально изменен и не работает.[15] Он имеет функциональный 5′-3′-экзонуклеазный домен на амино-конце, описанный ниже. Остальные два домена действуют согласованно посредством движения связанных доменов.[16]
Экзонуклеазный домен
Taq полимеразная экзонуклеаза является доменом на амино-конце Taq ДНК полимераза Я (термостабильный). Предполагается рибонуклеаза H-как мотив. Домен дает 5 ‘-3’ экзонуклеаза активность к полимеразе.[17]
В отличие от того же домена в Кишечная палочка, которые разрушают праймеры и должны быть удалены путем расщепления для использования ПЦР,[9] не говорят, что этот домен разрушает праймер.[18] Это действие используется в TaqMan зонд: по мере образования дочерних цепей зонды, комплементарные матрице, входят в контакт с полимеразой и расщепляются на флуоресцентные части.[19]
Связывание с ДНК
Taq полимераза связывается в своей щели в активном центре полимеразы с тупым концом дуплексной ДНК. Поскольку Taq полимераза находится в контакте со связанной ДНК, ее боковые цепи образуют водородные связи с пуринами и пиримидинами ДНК. Тот же регион Taq полимераза, связанная с ДНК, также связывается с экзонуклеазой. Эти структуры связаны с Taq полимеразы имеют разные взаимодействия.
Мутанты
А сайт-направленный мутагенез Сообщалось об эксперименте, который увеличивает активность исследуемой 3′-5 ‘экзонуклеазы в 2 раза, но никогда не сообщалось, снижает ли это количество ошибок.[20] Следуя аналогичной линии мысли, химерные белки были получены путем сбора доменов вишни из Кишечная палочка, Taq, и T. neapolitana полимеразы I. Замена рудиментарного домена на функциональный из Кишечная палочка создали белок с возможностью корректуры, но с более низкой оптимальной температурой и низкой термостабильностью.[21]
Были получены версии полимеразы без 5′-3′-экзонуклеазного домена, среди которых Клентак или Stoffel фрагмент наиболее известен. Полное отсутствие экзонуклеазной активности делает эти варианты подходящими для праймеров, которые проявляют вторичную структуру, а также для копирования кольцевых молекул.[9] Другие варианты включают использование Клентак с высококачественной полимеразой, Термосеквеназа который распознает такие субстраты, как ДНК-полимераза Т7 делает, мутанты с более высокой толерантностью к ингибиторам или версии с «доменными тегами», которые имеют дополнительный спираль-шпилька-спираль вокруг каталитического сайта для более плотного удержания ДНК, несмотря на неблагоприятные условия.[22]
Taq Полимераза
Значение в обнаружении болезней
Из-за улучшений Taq полимераза, обеспечиваемая при репликации ДНК ПЦР: более высокая специфичность, меньшее количество неспецифических продуктов и более простые процессы и оборудование, она сыграла важную роль в усилиях по обнаружению заболеваний. «Использование полимеразной цепной реакции (ПЦР) в диагностике инфекционных заболеваний привело к возможности ранней диагностики и надлежащего лечения заболеваний, вызванных привередливыми патогенами, определения чувствительности к противомикробным препаратам медленно растущих организмов и определения количества инфекции». [23] Реализация Taq полимераза спасла бесчисленное количество жизней. Он сыграл важную роль в выявлении многих самых страшных заболеваний в мире, включая туберкулез, стрептококковый фарингит, атипичную пневмонию, СПИД, корь, гепатит и язвенные урогенитальные инфекции. ПЦР, метод, используемый для воссоздания копий конкретных образцов ДНК, делает возможным обнаружение заболеваний за счет нацеливания на конкретную последовательность ДНК целевого патогена из образца пациента и увеличения следовых количеств индикативных последовательностей путем их копирования до миллиардов раз. Хотя это наиболее точный метод выявления заболеваний, особенно ВИЧ, он не выполняется так часто, как альтернативные, более низкие тесты из-за относительно высокой стоимости, трудозатрат и времени.[24]
Опора на Taq Полимераза как катализатор процесса репликации ПЦР была подчеркнута во время пандемии COVID-19 в 2020 году. Нехватка необходимого фермента ограничила способность стран во всем мире производить тест-наборы для вируса. Без Taq полимеразы, процесс обнаружения болезни намного медленнее и утомителен.[25]
Несмотря на преимущества использования Taq полимераза в обнаружении болезней ПЦР, фермент не лишен своих недостатков. Ретровирусные заболевания: ВИЧ, HTLV-1 и HTLV-II; часто включают в свой геном мутации от гуанина до аденина. Подобные мутации позволяют тестам ПЦР выявлять заболевания, но Taq Относительно низкая верность полимеразы приводит к возникновению такой же мутации G-to-A и, возможно, к ложноположительному результату теста.[26]
Смотрите также
- Биологические машины
- ДНК-полимераза I
- Репликация ДНК
- Ферментный катализ
- Динамика белкового домена
Рекомендации
- ^ а б Чиен А., Эдгар Д. Б., Трела Дж. М. (сентябрь 1976 г.). «Полимераза дезоксирибонуклеиновой кислоты из экстремального термофила Thermus aquaticus». Журнал бактериологии. 127 (3): 1550–7. Дои:10.1128 / jb.127.3.1550-1557.1976. ЧВК 232952. PMID 8432.
- ^ а б Сайки Р.К., Гельфанд Д.Х., Стоффель С., Шарф С.Дж., Хигучи Р., Хорн Г.Т. и др. (Январь 1988 г.). «Праймер-направленная ферментативная амплификация ДНК с помощью термостабильной ДНК-полимеразы». Наука. 239 (4839): 487–91. Bibcode:1988Научный … 239..487С. Дои:10.1126 / science.239.4839.487. PMID 2448875.[постоянная мертвая ссылка ]
- ^ а б Сайки Р.К., Шарф С., Фалуна Ф., Маллис КБ, Хорн Г.Т., Эрлих Х.А., Арнхейм Н. (декабрь 1985 г.). «Ферментативная амплификация геномных последовательностей бета-глобина и анализ сайтов рестрикции для диагностики серповидноклеточной анемии». Наука. 230 (4732): 1350–4. Bibcode:1985Научный … 230.1350S. Дои:10.1126 / science.2999980. PMID 2999980. Архивировано из оригинал 19 декабря 2008 г.
- ^ а б Адвокат ФК, Стоффель С., Сайки Р.К., Чанг С.И., Ландре П.А., Абрамсон Р.Д., Гельфанд Д.Х. (май 1993 г.). «Высокий уровень экспрессии, очистки и ферментативной характеристики полноразмерной ДНК-полимеразы Thermus aquaticus и укороченной формы с недостаточностью экзонуклеазной активности от 5 ‘до 3’». Методы и приложения ПЦР. 2 (4): 275–87. Дои:10.1101 / gr.2.4.275. PMID 8324500.
- ^ Протоколы ПЦР: руководство по методам и применению. Innis, Майкл А. Сан-Диего: Academic Press. 1990 г. ISBN 978-0123721808. OCLC 19723112.CS1 maint: другие (связь)
- ^ Технология ПЦР: принципы и приложения для амплификации ДНК. Эрлих, Генри А., 1943-. Нью-Йорк: Стоктон Пресс. 1989 г. ISBN 978-0333489482. OCLC 19323242.CS1 maint: другие (связь)
- ^ Лопата А., Йохарт Б., Сураньи Э.В., Такач Э., Безур Л., Левелес I и др. (Октябрь 2019 г.). «Помимо хелатирования: EDTA прочно связывает ДНК-полимеразу Taq, MutT и dUTPase и напрямую подавляет активность dNTPase». Биомолекулы. 9 (10): 621. Дои:10.3390 / biom9100621. ЧВК 6843921. PMID 31627475.
- ^ Тиндалл К.Р., Кункель Т.А. (август 1988 г.). «Верность синтеза ДНК ДНК-полимеразой Thermus aquaticus». Биохимия. 27 (16): 6008–13. Дои:10.1021 / bi00416a027. PMID 2847780.
- ^ а б c ван Пелт-Веркуил Э, ван Белкум А, Хейс JP (2008). «Taq и другие термостабильные ДНК-полимеразы». Принципы и технические аспекты амплификации ПЦР. С. 103–18. Дои:10.1007/978-1-4020-6241-4_7. ISBN 978-1-4020-6240-7.
- ^ Брандарис-Фонтес С., Камачо-Санчес М., Вила С., Вега-Пла Ю.Л., Рико С., Леонард Дж. А. (январь 2015 г.). «Влияние фермента и условий ПЦР на качество результатов высокопроизводительного секвенирования ДНК». Научные отчеты. 5: 8056. Bibcode:2015НатСР … 5Э8056Б. Дои:10.1038 / srep08056. ЧВК 4306961. PMID 25623996.
- ^ Mullis KB (апрель 1990 г.). «Необычное происхождение полимеразной цепной реакции». Scientific American. 262 (4): 56–61, 64–5. Bibcode:1990SciAm.262d..56M. Дои:10.1038 / scientificamerican0490-56. PMID 2315679.
- ^ Фор Дж., Вичерс И.Р., Кук-Диган Р. (июль 2006 г.). «Влияние деловой практики, лицензирования и интеллектуальной собственности на развитие и распространение полимеразной цепной реакции: тематическое исследование». Журнал биомедицинских открытий и сотрудничества. 1: 7. Дои:10.1186/1747-5333-1-7. ЧВК 1523369. PMID 16817955.
Подробная история Cetus Corporation и коммерческие аспекты PCR. - ^ Guatelli JC, Gingeras TR, Richman DD (апрель 1989 г.). «Амплификация нуклеиновых кислот in vitro: обнаружение последовательностей с низким числом копий и применение для диагностики инфекции вируса иммунодефицита человека 1 типа». Обзоры клинической микробиологии. 2 (2): 217–26. Дои:10.1128 / CMR.2.2.217. ЧВК 358112. PMID 2650862.
- ^ Карран, Крис, Биомедицина, 7 декабря 1999 г.
- ^ Eom SH, Wang J, Steitz TA (июль 1996 г.). «Структура Taq-полимеразы с ДНК в активном центре полимеразы». Природа. 382 (6588): 278–81. Bibcode:1996Натура.382..278E. Дои:10.1038 / 382278a0. PMID 8717047.
- ^ Bu Z, Biehl R, Monkenbusch M, Richter D, Callaway DJ (декабрь 2005 г.). «Движение связанного белкового домена в полимеразе Taq обнаружено с помощью нейтронной спин-эхо-спектроскопии». Труды Национальной академии наук Соединенных Штатов Америки. 102 (49): 17646–51. Bibcode:2005PNAS..10217646B. Дои:10.1073 / pnas.0503388102. ЧВК 1345721. PMID 16306270.
- ^ Ли Ю., Митаксов В., Ваксман Г. (август 1999 г.). «Дизайн на основе структуры ДНК-полимераз Taq с улучшенными свойствами включения дидезоксинуклеотидов». Труды Национальной академии наук Соединенных Штатов Америки. 96 (17): 9491–6. Bibcode:1999PNAS … 96.9491L. Дои:10.1073 / пнас.96.17.9491. ЧВК 22236. PMID 10449720.
- ^ «Будет ли 5 ’→ 3′ эндонуклеазная активность Taq ДНК-полимеразы разлагать праймеры?». NEB. Получено 28 марта 2019.
- ^ Экспрессия гена TaqMan — проекты NCBI
- ^ Пак И, Чой Х, Ли Д.С., Ким И (июнь 1997 г.). «Улучшение 3′-5′-экзонуклеазной активности ДНК-полимеразы Taq с помощью белковой инженерии в активном центре». Молекулы и клетки. 7 (3): 419–24. PMID 9264032.
- ^ Виллбрандт Б., Собек Х., Фрей Б., Шомбург Д. (сентябрь 2000 г.). «Обмен доменами: химеры ДНК-полимеразы Thermus aquaticus, ДНК-полимеразы I Escherichia coli и ДНК-полимеразы Thermotoga neapolitana». Белковая инженерия. 13 (9): 645–54. Дои:10.1093 / белок / 13.9.645. PMID 11054459.
- ^ Ишино С., Ишино Ю. (2014). «ДНК-полимеразы как полезные реагенты для биотехнологии — история развития исследований в этой области». Границы микробиологии. 5: 465. Дои:10.3389 / fmicb.2014.00465. ЧВК 4148896. PMID 25221550.
- ^ Менон П.К., Капила К., Охри В.К. (июль 1999 г.). «Полимеразная цепная реакция и достижения в диагностике инфекционных заболеваний». Медицинский журнал, Вооруженные силы Индии. 55 (3): 229–231. Дои:10.1016 / S0377-1237 (17) 30450-1. ЧВК 5531883. PMID 28775636.
- ^ «Полимеразная цепная реакция (ПЦР)». stanfordhealthcare.org. Получено 2020-04-23.
- ^ «Глава FDA предупреждает о« давлении »поставок реагентов для тестов на коронавирус». MedTech Dive. Получено 2020-04-23.
- ^ Овербо Дж., Джексон С.М., Папенхаузен, доктор медицины, Руденси Л.М. (ноябрь 1996 г.). «Лентивирусные геномы с гипермутацией G-to-A могут быть результатом ошибок полимеразы Taq во время полимеразной цепной реакции». Исследования СПИДа и ретровирусы человека. 12 (17): 1605–13. Дои:10.1089 / помощь.1996.12.1605. PMID 8947295.
Механизмы исправления ошибок во время репликации ДНК и ее репарация вследствие повреждений на протяжении всего жизненного цикла клетки.
Основные моменты:
-
Клетки имеют различные механизмы предотвращения возникновения мутаций – необратимых изменений в ДНК
-
В процессе синтеза ДНК, большинство ДНК-полимераз «проверяют свою работу» и проводят замену бо́льшей части ошибочно вставленных нуклеотидов. Этот процесс можно назвать исправлением ошибок.
-
Сразу после синтеза ДНК любые оставшиеся ошибочные нуклеотиды обнаруживаются и заменяются в так называемом процессе репарации ошибочно спаренных нуклеотидов.
-
Если ДНК повреждена, она может быть восстановлена с помощью различных механизмов, например, путём прямой репарации, эксцизионной репарации или путём восстановления двухцепочечных разрывов
- пострепликативной репарации.
Введение
Как ДНК связана с раком? Рак возникает при неконтролируемом делении клеток, когда игнорируются клеточные «стоп»-сигналы, что приводит к образованию опухоли. Это неправильное поведение клеток вызвано накопившимися мутациями — необратимыми изменениями последовательности ДНК клетки.
На самом деле, ошибки в процессе репликации и повреждения ДНК возникают в клетках нашего тела постоянно. Однако в большинстве случаев они не приводят к раку и даже не вызывают мутаций, такие ошибки обычно обнаруживаются и исправляются в процессе репарации ДНК. Если же повреждение исправить не удаётся, то в клетке включается механизм самоуничтожения — (апоптоз), который предотвращает передачу поврежденной ДНК дочерним клеткам.
Мутации возникают и передаются дочерним клеткам только тогда, когда эти механизмы не справляются. В частности, рак возникает в случае накопившихся в одной клетке мутаций генов, связанных с делением.
В этой статье мы подробно рассмотрим механизмы, используемые клетками для исправления ошибок, которые возникают в процессе репликации. К ним относятся:
-
Исправление ошибок – процесс, который возникает во время репликации ДНК.
-
Репарация ошибочно спаренных нуклеотидов, которая происходит сразу же после репликации ДНК.
-
Механизмы репарации, которые выявляют и исправляют повреждения ДНК на протяжении всего клеточного цикла
Исправление ошибок
ДНК-полимеразы — это ферменты, участвующие в репликации ДНК. Во время копирования ДНК большинство ДНК-полимераз «проверяют», корректный ли нуклеотид они добавляют. Этот процесс называется исправлением ошибок. Если полимераза обнаружит, что был добавлен неправильный нуклеотид, она сразу же удалит и заменит его и только после этого продолжит синтез ДНКstart superscript, 1, end superscript.
Репарация ошибочно спаренных нуклеотидов
Процесс исправления избавляет от основной массы ошибок, но не от всех. После создания новой ДНК запускается механизм репарации ошибочно спаренных нуклеотидов — удаления и замены ошибочно спаренных нуклеотидов, оставшихся в результате репликации. Исправление несоответствий между парами оснований также может включать в себя исправление небольших вставок и делеций, возникающих вследствие «соскальзывания» полимеразы с исходной цепи squared.
Как происходит восстановление неправильно спаренных нуклеотидов? Во-первых, белковый комплекс распознаёт неправильно спаренный нуклеотид и связывается с ним. Другой комплекс разрезает ДНК в области несовпадения, а ещё одна группа ферментов отщепляет некорректный нуклеотид вместе с небольшим участком вокруг него. Затем ДНК-полимераза заполняет этот пробел правильными нуклеотидами, а фермент ДНК-лигаза сшивает разрывы в цепиsquared.
Удивительно: как белки, участвующие в восстановлении ДНК, определяют, «кто прав» во время репарации ошибочно спаренных нуклеотидов? То есть, когда два основания неправильно соединены (как G (гуанин) и T (тимин) на рисунке выше), какое из этих двух оснований должно быть удалено и заменено?
У бактерий можно отличить исходную и дочернюю цепи ДНК по метилированным основаниям. На исходной цепи ДНК есть метильные (minus, start text, C, H, end text, start subscript, 3, end subscript) группы, присоединенные к некоторым из ее оснований, а у дочерней цепи таких групп еще нетcubed.
У эукариот процессы, позволяющие идентифицировать исходную цепь при устранении несоответствий, включают распознавание одноцепочечных разрывов, которые обнаруживаются только у дочерней цепи cubed.
Механизмы репарации ДНК
С ДНК может что-нибудь случиться практически в любой момент жизни клетки, а не только во время репликации. Фактически, ДНК постоянно повреждается из-за воздействия внешних факторов: ультрафиолетового излучения и радиации, химических веществ, не говоря уже о спонтанных процессах, которые протекают даже без вмешательства окружающей среды!start superscript, 4, end superscript
К счастью, наши клетки имеют механизмы восстановления, с помощью которых они находят и исправляют большинство повреждений ДНК. Можно выделить несколько типов репарации:
-
Прямая репарация. Некоторые повреждения ДНК, вызванные химическими реакциями, могут быть «исправлены» находящимися в клетке ферментами.
-
Эксцизионная репарация. Повреждение одного или нескольких нуклеотидов ДНК часто исправляется удалением и заменой поврежденного участка. При эксцизионной репарации оснований удаляется только поврежденное основание. В случае эксцизионной репарации нуклеотидов, как и в случае репарации ошибочно спаренных нуклеотидов, которое мы рассмотрели выше, удаляются целиком нуклеотиды.
-
Репарация двухцепочечных разрывов: Существуют два основных способа: негомологичное соединение концов и гомологичная рекомбинация. Они используются для восстановления двухцепочечных разрывов ДНК (когда вся хромосома разделяется на две части).
Прямая репарация
В некоторых случаях клетка может исправить повреждение ДНК, обратив вызвавшую его реакцию. Дело в том, что «повреждение ДНК» — это, как правило, присоединение к ней лишней группы в результате химической реакции.
Например, гуанин (G) может подвергаться реакции с присоединением метильной (minus, start text, C, H, end text, start subscript, 3, end subscript) группы к атому кислорода в азотистом основании. Если это не исправить, метил-содержащий гуанин будет связываться с тимином (Т), а не с цитозином (С) во время репликации ДНК. К счастью, у людей и многих других организмов есть фермент, который может удалить метильную группу, обратив реакцию, и тем самым вернуть азотистое основание в нормальное состояниеstart superscript, 5, end superscript.
Эксцизионная репарация оснований
Эксцизионная репарация оснований — это механизм, используемый для обнаружения и удаления определенных типов поврежденных азотистых оснований. Ключевую роль в нем играет группа ферментов, называемых гликозилазами. Каждая гликозилаза обнаруживает и удаляет определенный вид поврежденных оснований.
Например, в процессе реакции дезаминирования цитозин может превратиться в урацил — основание, обычно встречающееся только в РНК. Во время репликации ДНК урацил будет соединяться с аденином, а не с гуанином (в отличие от цитозина), поэтому такое превращение может привести к возникновению мутацииstart superscript, 5, end superscript.
Для предотвращения подобных изменений гликозилаза, являющаяся частью сигнального пути эксцизионной репарации, обнаруживает и удаляет дезаминированные цитозины. После того, как основание было удалено, удаляется и оставшаяся часть нуклеотида, а другие ферменты заполняют пробелstart superscript, 6, end superscript.
Эксцизионная репарация нуклеотидов
Эксцизионная репарация нуклеотидов — это еще один способ удаления и замены поврежденных оснований. В результате нее обнаруживаются и корректируются повреждения, которые искажают форму двойной спирали ДНК. Например, азотистые основания могут измениться, присоединив к себе громоздкие группы атомов, в частности, в результате воздействия химических веществ, содержащихся в сигаретном дымеstart superscript, 7, end superscript.
Эксцизионная репарация нуклеотидов также используется для устранения повреждений, вызванных ультрафиолетовым излучением, например, при получении солнечного ожога. Под воздействием УФ-излучения цитозин и тимин могут вступать в реакцию с соседними основаниями, которые также являются цитозином или тимином, образуя при этом связи, изменяющие форму двойной спирали и вызывающие ошибки в процессе репликации ДНК. Наиболее распространенный тип таких связей — тиминовый димер — он состоит из двух тиминовых оснований, вступающих в реакцию друг с другом и образующих химическую связьstart superscript, 8, end superscript.
При эксцизионной репарации нуклеотидов поврежденные нуклеотиды удаляются вместе с соседними нуклеотидами. В этом процессе хеликаза (фермент, раскручивающий ДНК) раскрывает ДНК, образуя пузырь, а ферменты, разрезающие ДНК, отсекают поврежденную часть пузыря. Полимераза заполняет пробел, а лигаза сшивает разрыв в цепиstart superscript, 9, end superscript.
Репарация двухцепочечных разрывов
Некоторые факторы окружающей среды, например, радиация, могут вызывать разрывы обеих цепочек ДНК (разделение хромосомы на две части). Такие повреждения ДНК, если верить комиксам, ведут к появлению супергероев, но могут встречаться и после реальных катастроф, например, Чернобыльской.
Двухцепочечные разрывы опасны, потому что большие сегменты хромосом и сотни содержащихся в них генов могут быть потеряны, если разрыв не будет восстановлен. Существует два способа восстановления двухцепочечных разрывов ДНК: негомологичное соединение концов и гомологичная рекомбинация.
При негомологичном соединении концов два разорванных конца хромосомы просто склеиваются обратно. Этот механизм восстановления является «грубым» и неточным, в результате в месте разрыва, как правило, либо теряются нуклеотиды, либо добавляются лишние, что может привести к мутациям. Но это в любом случае лучше потери целого фрагмента хромосомыstart superscript, 10, end superscript.
При гомологичной рекомбинации для восстановления разрыва используется фрагмент из гомологичной хромосомы, который соответствует поврежденной хромосоме (или из сестринской хроматиды, если ДНК была реплицирована). В этом процессе две хромосомы объединяются, и неповрежденная область гомологичной хромосомы или хроматиды используется в качестве матрицы для замены поврежденной области. Гомологичная рекомбинация работает «чище», точнее, чем негомологичное соединение концов, и обычно не приводит к образованию мутацийstart superscript, 11, end superscript.
Репарация ДНК и заболевания человека
Доказательства важности механизмов репарации получены на основе генетических заболеваний человека. Во многих случаях мутации в генах, которые кодируют белки, участвующие в репарации, связаны с наследственным раком. Например:
-
Наследственный неполипозный колоректальный рак (также называемый синдромом Линча) вызван мутациями в генах, кодирующих белки, которые участвуют в репарации ошибочно спаренных нуклеотидовstart superscript, 12, comma, 13, end superscript. Поскольку такие нуклеотиды не восстанавливаются, у людей, страдающих этим синдромом, мутации накапливаются гораздо быстрее, чем у здоровых. Это может привести к развитию опухолей толстой кишки.
-
Люди с пигментной ксеродермой очень чувствительны к ультрафиолетовому излучению. Это вызвано мутациями в белках, участвующих в эксцизионной репарации нуклеотидов. Когда они не функционируют, димеры тимина и другие виды повреждений, вызванные ультрафиолетовым излучением, перестают восстанавливаться. У людей с пигментной ксеродермой после нескольких минут пребывания на солнце могут возникнуть сильные солнечные ожоги, и около половины из них заболевают раком кожи в возрасте до 10 лет, если только они не избегают солнечных лучейstart superscript, 14, end superscript.