Ушаков Н.Р.
1
1 МОУ «Оболенская СОШ»
эритроциты
кровь
камера горяева
1. Клиническая лабораторная диагностика: учебно-методическое пособие / Д.Ю. Соснин, В.В. Базарный, И.А. Булатова // – Пермь. – 2021. – 191 с. ISBN 978-5-398-02562-0
2. Пасечник, В.В., Биология: 8 класс: учебник для общеобразоват. учреждений под ред. В. В. Пасечника / В.В. Пасечник, А.А. Каменский, Г.Г. Швецов // Просвещение. – 2020. – С. 255. ISBN 978-5-09-018548-6.
3. Стуклов, Н.И.: учебник по гематологии / Н.И. Стуклов, Г.И. Козинец, Н.Г. Тюрина // — М.: Практическая медицина. – 2018. — 336 с. ISBN 978-5-98811-492-5
4. Наука и жизнь. [Электронный ресурс]. – Режим доступа: URL:https://www.nkj.ru/archive/articles/42664/ (дата обращения 16.12.2022).
5. Форменные элементы крови. [Электронный ресурс]. – Режим доступа:
URL:https://www.grandars.ru/college/medicina/formennye-elementy-krovi/ (дата обращения 16.12.2022).
6. Bessis, M. Discovery of the red blood cell with notes on priorities and credits of discoveries, past, present and future. / Bessis M., Delpech G. // Blood Cells. – 1981. – V. 7(3). P. 447-80. PMID: 7039723
7. Ruestow, E.G. The Microscope in the Dutch Republic: The Shaping of Discovery 1st Edition. Cambridge University Press. – 1996. – P. 364. ISBN 978-0521470780
Введение.
В данной работе представлено знакомство с клетками крови – эритроцитами, способами их подсчёта и обозначена их роль в организме человека.
Актуальность работы:
Содержание необходимого количества эритроцитов в крови очень важно для мониторинга состояния здоровья человека. Подсчёт клеток крови можно произвести при помощи дорогостоящего анализирующего оборудования (роботизированных машин), а можно и «вручную» – при помощи камеры Горяева и микроскопа. Этот метод менее затратный, но более трудоёмкий по сравнению с автоматическим методом. Для исследования крови на роботах-анализаторах нужны дорогостоящие приборы и реактивы. При условиях недоступности по каким – либо причинам дорогостоящего оборудования, подсчёт эритроцитов в камерах Горяева производится по сей день и считается резервным методом подсчёта клеток.
Цель работы: изучить эритроциты крови человека.
Задачи исследования:
1. Проанализировать качественные и количественные характеристики эритроцитов.
2. Изучить устройство камеры Горяева и освоить методику её использования.
3. Провести исследование крови.
4. Сделать выводы по результатам исследования.
5. Разработать памятку по подсчёту эритроцитов в камере Горяева и пособие по определению эритроцитов в крови человека с помощью камеры Горяева.
Предмет исследования: эритроциты крови человека.
Объект исследования: капля крови человека.
Гипотеза: эритроциты крови можно увидеть в микроскоп, посчитать их, и сделать это возможно без использования дорогостоящих гематологических роботов-анализаторов.
Методы исследования:
В данном исследовании применялись следующие методы:
— метод наблюдения;
— метод описания, фотографирования, счёта;
-аналитический метод (анализ, сравнение и обобщение полученной информации из различных источников);
-эмпирический метод (опыты).
Продукт проекта: Памятка по подсчёту эритроцитов в камере Горяева; пособие «Подсчёт эритроцитов при помощи камеры Горяева»
Практическая значимость: Данное пособие можно использовать на уроках биологии при изучении темы: «Кровь и остальные компоненты внутренней среды организма» в 8 классе, а также на внеурочной деятельности школьников среднего звена.
Перспективы: изучить химический состав крови человека.
Что такое эритроциты? Для детального изучения данной темы я обратился к различным научным источникам информации. Что представляют собой эритроциты? Данный термин произошел от 2-ух слов «erythos» и «kytos», что в переводе с греческого языка означает «красный» и «вместилище, клетка». Эритроциты представляют собой красные кровяные тельца крови человека, позвоночных, а также некоторых беспозвоночных животных, на которые возложены важные и весьма разнообразные функции. Я выяснил, что эритроциты — это компонент крови. Кровь на 55 % состоит из плазмы (желтовато-белая жидкость, которая в свою очередь состоит в основном из воды, а также различных белков, солей, микроэлементов ивитаминов) и на 45 % из клеток, которые называют кровяными тельцами или кровяными клетками [1,2]. Больше всего в крови человека содержитсяэритроцитов, которые также называют красными кровяными тельцами или красными клетками крови. Они составляют 99 % из всех клеток крови. Каждый вид клеток в крови можно посчитать.
История изучения эритроцитов.
Первооткрывателем эритроцитов обычно считается Антони ван Левенгук. На самом деле он не был первым, кто наблюдал в крови «красные частицы», зато его наблюдения были более длительными и подробными, чем его предшественников – Мальпиги и Сваммердама. В настоящее время кровь анализируют автоматические машины-роботы (анализаторы) [3,4,6,7].
Устройство камеры Горяева.
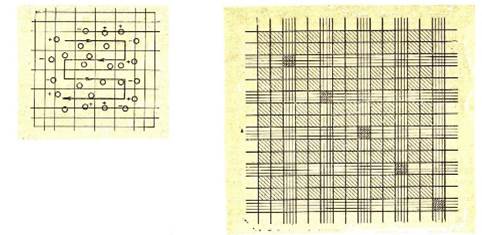
Лабораторнаякамера Горяева (Фото 1), названная в честь русского врача, профессора Казанского университета Горяева Н.К., является специальным монолитным предметным стеклом, предназначенным для подсчета количества клеток в заданном объеме жидкости. Сетка камеры представляет собой квадрат площадью 9 мм2, который разделен на 225 больших квадратов (15 – по вертикали, 15 – по горизонтали), имеющие различный рисунок: часть из них расчерчена только поперечными линиями, часть – только продольными, а 25 больших квадратов разделены на 16 малых квадратов. Кроме того, в 100 больших квадратах исчерченность отсутствует. Они собраны в группы по четыре, всего в сетке 25 групп пустых квадратов. Если условно поделить всю сетку на малые квадраты, то их количество составит 3600. Сторона малого квадрата равна 1/20 мм, его площадь 1/400 мм2 [5].
Фото 1. Камера Горяева.
Строение и образование эритроцитов.
Зрелые эритроциты (нормоциты) представляют собой безъядерные клетки в форме двояковогнутого диска диаметром 7—8мкм. Эритроциты образуются в красном костном мозге (Рисунок 3), откуда попадают в кровь в незрелом виде и достигают окончательнойдифференцировкичерез 1—2 дня после выхода в кровоток. Отслужившие и повреждённые эритроцитыфагоцитируютсямакрофагамиселезёнки,печениикостного мозга. [2].
Функции и роль эритроцитов в организме человека.
Газообменная («дыхательная») – перенос кислорода и углекислого газа, обеспечивается наличием в эритроцитах гемоглобина – железосодержащего кислород-связывающего пигмента. Транспортная – участвуют в транспорте аминокислот, гормонов, антител, лекарств и других веществ. Защитная – связывают токсины за счет присутствия на их поверхности специальных веществ белкового происхождения. Регуляция кроветворения — обеспечение железом процессов образования гемоглобина в красном костном мозге, участвуют в свёртывании крови. Железо выделяется при разрушении старых эритроцитов. Ферментативная: являются носителями различных специфических белковых катализаторов. Принимают участие в водном, солевом обмене, регулируют кислотность крови. На поверхности эритроцитов находятсяантигены—групповые признаки крови. [6,7]. Границы нормы эритроцитов различаются в зависимости от пола, возраста и других особенностей и варьирует в пределах (2,7-5,6) х 10*12 г/л.
Вывод по литературному обзору:
Изучив строение, функции и роль эритроцитов, я понял, что строение эритроцитов идеально соответствует выполняемой ими функции переноса газов, благодаря мелким размерам, а значит, огромному количеству в крови, двояковогнутой форме, отсутствию в зрелых клетках ядер.
Степень изученности темы:
Данная тема изучена довольно подробно, однако количественный метод изучения эритроцитов при помощи камеры Горяева на сегодняшний день используется крайне редко в силу его трудоёмкости и наличия более современных методов исследования. Тем не менее данный метод остаётся востребованным, так как далеко не в каждом медицинском учреждении имеются современные методы анализа клеток крови.
Личный вклад автора: мною проведено исследование и анализ качественных и количественных характеристик эритроцитов; изучено устройство камеры Горяева и освоена методика её использования; произведен подсчёт эритроцитов крови при помощи камеры Горяева и микроскопа; сделаны выводы по результатам исследования; разработана доступная школьникам памятка по подсчёту эритроцитов в камере Горяева и пособие по исследованию эритроцитов при помощи камеры Горяева для внутришкольного пользования, которое может использоваться обучающимися на уроках биологии и внеурочной деятельности.
Основная часть.
Проверка гипотезы количественным методом определения эритроцитов в крови при помощи камеры Горяева.
На базе «Государственного научного центра прикладной микробиологии и биотехнологии» мы осуществили микроскопию капли крови в камере Горяева. Произвёли подсчёт эритроцитов при помощи формул. Сделали фотографии увиденного в микроскоп.
Опыт №1. Подсчёт эритроцитов под микроскопом при помощи камеры Горяева.
1. Организационная часть. Оснащение: Реактивы. 4мл 0,9 % раствор хлорида натрия. Специальноеоборудование: 1. Счетная камера Горяева. 2. Микроскоп.
2. Научно-исследовательская часть.
Подготовительные работы и забор крови.Поместили стекло камеры Горяева под объектив микроскопа и рассмотрели сетку камеры под большим и малым увеличением. Подсчет проводили под малым повышением микроскопа (объектив ×8, окуляр ×10 либо ×15), конденсордолжен быть опущен, а диафрагма закрыта.
Подготовка камеры Горяева. Подготовили счетную камеру: обезжирили при помощи 70% спирта и протёрли насухо камеру с сеткой и покровное стекло, затем покровное стекло притёрли к камере до появления радужных колец (кольца Ньютона) — необходимо наложить так, чтобы оно покрыло обе боковые и среднюю пластинки. Так как боковыепластинки выше средней, между нею и покровным стеклом остается щель. Это сама камера, в которую заливают разведенную кровь. Налили 4 мл 0,9 % раствора натрия хлорида в рабочую пробирку для разбавления эритроцитов.
Забор крови. Подготовка к анализу стандартная: забор крови производился утром натощак, последний приём пищи за 10 ч. Забор крови у моего папы (в количестве 200мкл) в пипетку осуществлял медицинский работник. Далее он погрузил кончик пипетки в 0,9 % раствор натрия хлорида и разбавил кровь в 200 раз (4мл физиологического раствора хлорида натрия плюс 20 микролитров крови).
Заполнение камеры. Далее осторожно перемешали раствор крови в пробирке, вращая ее между ладонями в течение 2 мин (как показал медицинский работник), и каплю раствора поместили в камеру. Разведенную кровь нанесли на среднюю пластинку камеры пипеткой, помещая ее около края покровного стекла. Раствор зашёл под покровное стекло в камеру и заполнили её. Мы подождали 2 мин, пока перемещение жидкости в камере не закончится.
Микроскопирование. При малом увеличении микроскопа нашли сетку камеры. Перевели микроскоп на большое увеличение и начали подсчет эритроцитов. Нашли верхний левый край сетки. Счёт осуществляли в 5 больших квадратах, поделённых на 16 малых, т. е. в 80 малых квадратах. Считали эритроциты в квадратах, которые помещаются по диагонали поля зрения.
Подсчёт эритроцитов. Во время подсчета эритроцитов надо помнить правило Егорова: в маленьких квадратах считать те клетки, которые помещаются как внутри квадрата сетки, так и на его верхней и левой гранях. Это нужно для того, чтобы дважды не считать эритроциты, которые находятся на сторонах смежных квадратиков (Фото 2). По нашим подсчётам в 80-ти маленьких квадратах оказалось 470 эритроцитов. Подставляем это число в формулу, указанную в Памятке по использованию камеры Горяева и получаем X = 470*4000*200/80*106 , Х= 4,7*1012 г/л. Таким образом мы определили, что количество эритроцитов в крови моего папы: 4,7*1012 г/л. Существует специальный протокол исследования, в котором врачи-лаборанты отображают результат расчёта.
Памятка по подсчёту эритроцитов в камере Горяева.
Принцип метода: подсчёт клеток под микроскопом в определённом количестве квадратов счётной сетки и перерасчёт на 1 мкл крови (или на 1 л по системе СИ), осуществляем исходя из значений объёма квадратов и разведения крови. В качестве разводящей жидкости для подсчёта эритроцитов используем 0,9%-й (изотонический, или физиологический) раствор хлорида натрия. В пробирку с 4 мл раствора хлористого натрия вносим 0,02 мл (20 мкл) крови, таким образом кровь разводится в 200 раз (4000/20 = 200). Содержимое пробирки аккуратно, но тщательно перемешиваем и заполняем камеру Горяева. Через 2 минуты проводим микроскопирование при малом увеличении (объектив 8х, окуляр 10х), с приподнятым конденсором и закрытой диафрагмой. Эритроциты подсчитываем в 5 расположенных по диагонали сетки больших квадратах, которые разделены на малые, т. е. в 80 малых квадратах и далее производим расчёт по формуле: X = а*4000*200/80*106 ; где Где X — количество эритроцитов в 1 мкл; а — количество эритроцитов в 80 маленьких квадратах; 80 — количество подсчитанных маленьких квадратов (5 (больших квадратов) *16 (маленьких квадратов) = 80 маленьких квадратов); 200 — степень разведения крови (1/200); 4000 — множитель, который приводит результат объема в 1 мкл крови, поскольку объем маленького квадратика составляет 1/4000 мм. Для определения количества эритроцитов в литре, полученную цифру умножают на 106.
Фото 2. Подсчёт эритроцитов.
Завершение работы. После работы с камерой Горяева мы погрузили её в 70%-ый раствор этилового спирта на 30 минут, после чего промыли камеру дистиллированной водой и протёрли мягкой салфеткой. Камера должна храниться в сухом месте.
Результаты и обсуждение.
Результаты: мы рассмотрели эритроциты под микроскопом в камере Горяева и произвели их подсчёт. На основании увиденного в микроскоп мы сделали фотографии при помощи камеры телефона (Фото 3, 4). По результатам, полученным при подсчёте, мы определили, что полученное количество эритроцитов является нормой для мужчин.
Фото 3,4. Эритроциты под микроскопом.
Вывод по основной части: в результате проведённого исследования мы проанализировали качественные и количественные характеристики эритроцитов; изучили устройство камеры Горяева и освоили методику её использования; провели исследование крови; сделали выводы по результатам исследования; разработали доступную школьникам памятку по работе с камерой Горяева и пособие «Подсчёт эритроцитов при помощи камеры Горяева» для внутришкольного пользования.
Заключение: наша гипотеза подтвердилась, эритроциты можно увидеть под микроскопом и посчитать их при помощи камеры Горяева и микроскопа без использования дорогостоящих роботов-анализаторов и реактивов.
Дальнейшие перспективы исследования: мы продолжим изучение химического состава крови, расширим знания в этой области и попытаемся изучить и посчитать другие форменные элементы крови.
Аптинов М.М. – руководитель учебного центра компании West Medica
Скорость оседания эритроцитов (СОЭ) – показатель, определение которого входит в общий анализ крови. Это неспецифический лабораторный скрининговый тест, изменение которого может служить косвенным признаком текущего воспалительного или иных патологических процессов, таких как злокачественные опухоли и диффузные заболевания соединительной ткани.
Скорость оседания эритроцитов определяют в разведенной цитратом крови за определенный промежуток времени (1час) и выражают в мм за 1 час.Значение СОЭ определяют как расстояние от нижней части поверхностного мениска (прозрачная плазма) до верхней части осевших эритроцитов в вертикальном столбце стабилизированной цитратом цельной крови.
Удельная масса эритроцитов выше, чем удельная масса плазмы, поэтому в пробирке при наличии антикоагулянта (цитрата натрия) под действием силы тяжести эритроциты оседают на дно. Процесс оседания (седиментации) эритроцитов можно разделить на 3 фазы, которые происходят с разной скоростью:
- Первая фаза:медленное оседание отдельных эритроцитов.
- Вторая фаза:образование агрегатов эритроцитов (т.н. «монетные столбики»), ускорение оседания.
- Третья фаза:образование множества агрегатов эритроцитов и их «упаковка», оседание замедляется и постепенно прекращается.
Показатель СОЭ меняется в зависимости от множества физиологических и патологических факторов. Значения СОЭ у женщин несколько выше, чем у мужчин. Изменения белкового состава крови при беременности ведут к повышению СОЭ в этот период. Снижение содержания эритроцитов в крови (анемия) приводит к ускорению СОЭ и, напротив, повышение содержания эритроцитов в крови замедляет скорость седиментации. В течение дня возможно колебание значений, максимальный уровень отмечается в дневное время.
Основным фактором, влияющим на образование «монетных столбиков» при оседании эритроцитов является белковый состав плазмы крови. Острофазные белки, адсорбируясь на поверхности эритроцитов, снижают их заряд и отталкивание друг от друга, способствуют образованию монетных столбиков и ускоренному оседанию эритроцитов. Повышение уровнябелков острой фазы, например, С-реактивного белка, гаптоглобина, альфа-1-антитрипсина и др., при остром воспалении приводит к повышению СОЭ.
При острых воспалительных и инфекционных процессах изменение СОЭ отмечается через 24 ч после повышения температуры и увеличения числа лейкоцитов. При хроническом воспалении повышение СОЭ обусловлено увеличением концентрации фибриногена и иммуноглобулинов. Определение СОЭ в динамике, в комплексе с другими тестами, используют в контроле эффективности лечения воспалительных и инфекционных заболеваний.
Методы определения СОЭ
Метод Панченкова
- Капилляр Панченкова.Стандартный стеклянный капилляр для определения СОЭ: длина – 172 мм; наружный диаметр – 5 мм; диаметр отверстия – 1,0 мм; четкая коричневая градуировка от 0 до 10 см, шаг шкалы – 1,0 мм; верхнее деление шкалы отмечено «0» и буквой «К» (кровь), напротив деления 50 имеется буква «Р» (реактив).
- Прибор ПР-3 (СОЭ-метр, аппарат Панченкова) –представляет собой пластиковый штатив с гнездами для установки 20 капилляров.
- Время измерения: один час.
Процедура определения:
- Подготовить 5% раствор цитрата натрия и внести на часовое стекло.
- Промыть капилляр 5% раствором цитрата натрия.
- Произвести забор капиллярной крови в промытый капилляр.
- Перенести кровь из капилляра на часовое стекло.
- Повторить шаги 3 и 4.
- Перемешать кровь с цитратом натрия на часовом стекле и вновь заполнить капилляр.
- Установить капилляр в штатив Панченкова. Запустить таймер для каждого капилляра отдельно.
- Через 1 час определить СОЭ по высоте столба прозрачной плазмы.
Метод Вестергрена
- Стандартные размеры капилляра: длина: 300 мм± 1,5 мм;диаметр: 2,55 мм± 0,15 мм
- Стандартные температура (18-25˚С) и условия (не позже 2 ч после взятия крови).
- Время измерения: один час.
Процедура определения:
- При взятии пробы венозной крови смешать ее с 5% раствором цитрата натрия в соотношении 4+1.
- Произвести забор капиллярной крови в капилляр Вестергрена.
- Установить капилляр вертикально. Запустить таймер для каждого капилляра отдельно.
- Через 1 час определить СОЭ по высоте столба прозрачной плазмы.
Модифицированный метод Вестергрена: Система Ves-matic (Diesse – Италия).
- Объем пробы: 1 мл венозной крови
- Пластиковые пробирки (вакуумные и простые)
- Безопасность оператора (измерение выполняется в закрытых пробирках)
- Автоматическое перемешивание
- Измерение за 20 минут (10 минбыстрый режим)
- Угол наклона пробирки: 18°
- Температурная коррекция результатов по номограмме Менли
- Простота использования.
- Объективность измерения (результат не зависит от оператора).
- Встроенный термопринтер.
Процедура определения:
- Произвести забор венозной крови до метки в пробирку (вакуумную или простую), содержащую раствор цитрата натрия.
- Перемешать кровь с цитратом натрия в пробирке.
- Установить пробирки в анализатор СОЭ Ves-matic.
- Нажать кнопку Test для запуска измерения.
- Через 20 (или 10) минут анализатор автоматически определит СОЭ для 10, 20 или 30 проб.
Использование для определения СОЭ анализаторов серии Ves-matic позволяет не только повысить скорость анализа, но и существенно повышает точность полученных результатов, т.к., полностью исключает влияние субъективного фактора на результат определения.
Анализаторы серии Ves-matic, производитель Diesse – Италия
VES-MATIC 20 – Стационарный настольный автоматический СОЭ-метр на 20 позиций с перемешиванием проб крови и измерением результатов. Оптимальный прибор для средних и больших лабораторий. Кровь, собранная в специальные пробирки, тщательно перемешивается прибором. Ротор прибора вращается с заданной скоростью (1 поворот каждые 1,5 с). Посредством цифрового датчика прибор автоматически определяет уровень осаждения эритроцитов, данные рассчитываются и выводятся на принтер и дисплей. Время измерения 20 минут. Производительность: до 60 тестов в час. Память на 3 последних цикла измерения (до 60 тестов). 4 режима измерения. Клавиатура: 12 функциональных клавиш.
Сравнение значений СОЭ (мм/час), определенных двумя методами
Результаты сравнения результатов определения СОЭ методом Панченкова и Вестергрена представлены в Таблице 1 и на Рис. 1-2. Как видно из представленных данных, методы Панченкова и Вестергрена дают сходные результаты лишь в диапазоне нормальных значений СОЭ (рис.1, табл.1). В области высоких значений метод Вестергрена показывает более высокие уровни СОЭ (Табл.1).
Таблица 1. Пример результатов СОЭ у одних и тех же пациентов, определенных методом Панченкова и методом Вестергрена
|
метод Панченкова |
метод Вестергрена |
|
2 |
2 |
|
4 |
4 |
|
6 |
6 |
|
8 |
8 |
|
10 |
10 |
|
14 |
15 |
|
16 |
17 |
|
18 |
20 |
|
20 |
22 |
|
30 |
35 |
|
40 |
50 |
|
50 |
65 |
|
60 |
80 |
|
70 |
100 |
|
80 |
120 |
|
— |
140 |
|
— |
160 |
Факторы, влияющие на определение СОЭ:
- Гематокрит
- Температура анализа
- Время хранения пробы (не более 4 ч при комнатной температуре)
- Антикоагулянт (рекомендован цитрат Na)
- Вертикальность пробирки / капилляра
- Длина пробирки / капилляра
- Внутренний диаметр пробирки / капилляра
- Вязкость плазмы
- Степень разведения крови (рекомендуемое разведение 1:5)
Таблица 2. Диапазон нормальных значений СОЭ
|
Группы пациентов |
Значение СОЭ, мм/час |
||
|
метод Панченкова |
метод Вестергрена |
||
|
Дети (до 17 лет) |
4 – 11 |
2 – 10 |
|
|
Мужчины |
(17–50 лет) |
2 – 10 |
2 – 15 |
|
(>50 лет) |
2 – 20 |
||
|
Женщины |
(17–50 лет) |
2 – 15 |
2 – 20 |
|
(>50 лет) |
2 – 30 |
Показания к назначению анализа:
- Воспалительные заболевания;
- Инфекции;
- Подозрение на новообразования;
- Скрининговое обследование при профилактических осмотрах.
Измерение СОЭ необходимо рассматривать как скрининговый тест, который не имеет специфичности для какого-то определенного заболевания и может использоваться в качестве вспомогательного диагностического теста.
Причины изменения СОЭ
Повышение (ускорение СОЭ):
Физиологическое
- Пожилой возраст;
- У женщин во время беременности, менструации, в послеродовом периоде.
Патологическое
- Воспалительные процессы;
- Интоксикации;
- Острые и хронические инфекции (пневмония, остеомиелит, туберкулез, сифилис);
- Аутоиммунные заболевания (коллагенозы);
- Инфаркт миокарда;
- Травмы, переломы костей;
- Состояние после шока, операционных вмешательств;
- Анемии, состояние после кровопотери;
- Заболевания почек (хронический нефрит, нефротический синдром);
- Злокачественные опухоли;
- Парапротеинемии (миеломная болезнь, макроглобулинемия Вальденстрема);
- Гиперфибриногенемия;
- Прием лекарственных препаратов (эстрогенов, глюкокортикоидов)
Понижение (замедление СОЭ):
- Голодание, снижение мышечной массы;
- Прием кортикостероидов;
- Беременность (особенно 1 и 2 семестр);
- Вегетарианская диета;
- Гипергидратация;
- Миодистрофии.
В России и СНГ для определения СОЭ широко используется метод Панченкова, который имеет ряд недостатков:
- возможность использовать для анализа только капиллярную кровь,
- необходимость подготовки антикоагулянта и мытья капилляров,
- отсутствие автоматических приборов для измерения.
- субъективность ручного метода
В западных странах в широко используется метод Вестергрена. В 1977 г. Международный комитет по стандартизации в гематологии (ICSH – InternationalCommitteeforStandardizationinHematology) рекомендовал применение метода Вестергрена по всему миру. Обычно определение СОЭ производится с помощью автоматических анализаторов, в частности с помощью системы Ves-matic (Diesse, Италия). В России они появились в 2005 году и сталиочень популярными.
Преимущества метода Вестергрена с помощью системы Ves-matic:
- Сокращение времени анализа в 2 – 6 раз (10 или 20 минут).
- Точность и объективность (на результат анализа не влияет человеческий фактор).
- Безопасность – применение стандартных одноразовых пробирок с цитратом натрия (оптимальное соотношение кровь/цитрат). уменьшение контакта с кровью. Нет необходимости мыть капилляры.
- Удобствои простота выполнения.
- Стандартизованное перемешивание – количество переворачиваний пробирок – 40 раз.
- Стандартизация выполнения анализа (коррекция результатов в зависимости от температуры по номограмме Менли).
- Возможность использования считывателя штрих-кода (ускорение регистрации и устранение ошибок).
- Возможность подключения к информационной сети.
Литература
- Луговская С.А. и др. «Лабораторная гематология», 2006, «Триада», г.Тверь.
- InternationalCouncilforStandardizationinHaematology (Expert Panel on Blood Rheology).ICSH recommendations for measurement of erythrocyte sedimentation rate. J Clin Pathol 1993; 46:198 – 203.
- Tietz N.W. et al. Clinical Guide to Laboratory Tests, 3rd ed. AACC 1995.
- F.C Prischl and J.D. Schwarzmeier. Automated Determination of the Erythrocyte Sedimentation Rate. I. Med. Univ. — Klinik, Lazarettgasse 14, A-1090 Vienna, Austria.
Эритроциты или красные кровяные тельца – основной компонент крови, переносящий кислород. Наиболее часто выполняемый лабораторный тест, оценивающий состояние эритроцитов — анализ морфологии крови. Благодаря ему можно узнать, есть ли отклонения от нормы.
Что такое эритроциты
Эритроциты — это элементы крови — красные кровяные тельца (греч. Erythros – красный, kytos – клетка). Впервые эритроциты были описаны в 17 веке отцом микробиологии, голландским натуралистом Антони ван Левенгуком.
Благодаря содержанию гемоглобина, эритроциты выполняют в организме человека несколько важных функций, например, они переносят кислород. От их состояния зависит самочувствие и здоровье, поэтому нужно регулярно делать анализ эритроцитов, особенно после 50 лет.
Структура эритроцитов
Эритроцит выглядит как небольшая (7,5 на 2) круглая ячейка, имеющая форму двояковогнутого диска.
Такая конструкция обеспечивает некоторые преимущества:
- увеличивает соотношение поверхности к объему, облегчая присоединение и выделение кислорода;
- расстояние центрально расположенного гемоглобина от поверхности клетки короче, за счет чего его использование эффективнее;
- клетка легче преодолевает сужения и изгибы в кровеносных сосудах.
Эритроциты включают минимум органелл. При созревании теряется ядро, зарождаются и исчезают митохондрии, центриоли и аппарат Гольджи, благодаря чему минимизируется метаболизм и не потребляется переносимый кислород. Эритроциту не нужно большое количество энергии, она поступает за счет гликолиза — анаэробного процесса в цитоплазме.
Эритроциты аполнены гемоглобином – красным красителем, который содержит ион железа (Fe2 +) и обратимо связывает кислород. За форму клетки крови отвечает клеточный каркас, состоящий из спектрина и анкирина, а также ферментов, например, глюкозо-6-фосфатдегидрогеназы.
Кроме того, эта клетка крови содержит множество других ферментов, а на ее поверхности находится множество мембранных белков, в том числе антигены группы крови (системы AB0 и Rh), являющиеся гликопротеинами. Именно наличие этих соединений и их системы определяет группу крови человека.
Функции эритроцитов
Эритроциты ответственны за перенос кислорода из легких в периферические ткани благодаря присутствию гемоглобина. Именно гемоглобин обладает способностью нестабильно связывать кислород там, где его много, то есть в легких, и отдавать его там, где его мало, — в других тканях.
Добавление кислорода связано с изменением степени окисления железа, содержащегося в гемоглобине, с Fe2 + на Fe3 +. Окисленный гемоглобин называется оксигемоглобином. Отказ от кислорода вызывает противоположную реакцию и возвращает железо на вторую стадию (Fe2 +) и, таким образом, возникает готовность повторно присоединить кислород. Весь процесс происходит много раз.
Иногда бывает, что к эритроциту присоединяется иное вещество, кроме кислорода. Если это окись углерода, которая имеет гораздо большее сродство к гемоглобину, из него вытесняется кислород, и связь становится необратимой. В результате эритроцит теряет способность выполнять свою функцию, и в результате образуется карбоксигемоглобин.
Если, с другой стороны, гемоглобин подвергается воздействию окислителя, например, поступающего с лекарством, также невозможно добавить кислород, потому что железо из Fe2 + постоянно превращается в Fe3 +, который не может быть более окислен. Эта форма гемоглобина называется метгемоглобином.
Обе аномальные формы гемоглобина можно лечить высокими дозами чистого кислорода, но шанс на выздоровление есть только в том случае, если его количество в кровотоке мало.
Еще одна важная задача эритроцитов – регулирование pH крови – эритроциты являются одним из основных буферов крови.
Менее важная функция красных кровяных телец – переносить углекислый газ. Гемоглобин лишь незначительно переносит углекислый газ из тканей в легкие, эта форма называется карбаминогемоглобином и, как и оксигемоглобин, представляет собой нестабильную ассоциацию. Большая часть углекислого газа растворяется в плазме.
Производство и разложение эритроцитов
Процесс образования эритроцитов называется эритропоэзом, а клетки, из которых они возникают – эритробластами. Эритроциты вырабатываются и созревают в красном костном мозге, то есть в эпифизах длинных и плоских костей. Внутриутробно эритроциты также образуются в селезенке, в печени и в желточном мешке.
В кровь попадают только зрелые формы и небольшой процент незрелых ретикулоцитов, если их слишком много или в крови есть более ранние стадии развития, имеет место производственное нарушение или слишком быстрая потеря клеток крови из кровообращения, такая ситуация требует диагностики.
Каждую минуту образуется около 2,6 миллиона эритроцитов. Для правильного производства клеток крови необходим ряд ингредиентов:
- в основном железо – эритроциты содержат до 80% железа, присутствующего в организме, то есть около 3,5 граммов;
- витамин B12;
- фолиевая кислота;
- витамин C;
- витамин B6;
- витамин Е.
Этот процесс стимулируется эритропоэтином, секретируемым почками. В меньшей степени на него влияют:
- глюкокортикостероиды;
- щитовидная железа;
- адреналин.
Эритроциты живут около 120 дней, после чего они захватываются печенью и селезенкой, последняя действует как фильтр, удаляя старые и аномальные клетки крови. Компоненты, из которых состоят эритроциты, «перерабатываются» – они перерабатываются и используются для производства новых клеток крови.
Гемоглобин метаболизируется в печени с образованием билирубина, придающим желчи цвет. Затем из билирубина образуются уробилиноген, стеркобилин и уробилин, являющиеся красителем стула и мочи. Большая часть железа в гемоглобине используется повторно, лишь небольшое количество выводится из организма.
Эритроциты: норма
Морфология крови – это базовый тест, его часто проводят не только при различных заболеваниях, но и для элементарной оценки общего состояния организма у людей без признаков болезни. Результат этого исследования содержит несколько данных, правильная интерпретация которых многое говорит об эритроцитах – их структуре, процессе производства и производительности.
Важный параметр — количество эритроцитов, в норме значения колеблются:
- от 4,2 млн до 5,4 млн клеток крови / мкл у мужчин;
- от 3,5 млн клеток / мкл до 5,2 млн клеток / мкл у женщин.
Но самое главное – это количество гемоглобина (HGB или HB), его нормы различаются:
- от 14 до 18 г / дл у мужчин;
- от 12 до 16 г / дл у женщин.
Этот параметр оценивает количество гемоглобина в заданном объеме крови и учитывается, например, при принятии решения о переливании крови.
Следующая величина – это гематокрит (HT или HCT), это отношение объема эритроцитов к объему всей пробы крови, его нормальные значения:
- от 40% до 54% у мужчин;
- от 37% до 47% у женщин.
Эритроциты выше нормы
Увеличение количества эритроцитов называется эритроцитозом (т.е.эритроциты выше нормы). Чаще всего это вызвано обезвоживанием, увеличение просто связано с конденсацией крови.
Причиной эритроцитоза также может быть длительная легкая гипоксия организма, имеющая место в различных ситуациях:
- нахождение в горах, где в воздухе намного меньше кислорода;
- курение, приводящее к появлению небольшого количества окиси углерода, из-за чего некоторые эритроциты не выполняют свои функции, и организм уравновешивает это состояние, производя дополнительные клетки крови;
- синдром обструктивного апноэ во сне, заключающееся в перебоях в дыхании и отсутствии поступления кислорода в легкие;
- заболевания легких (например, ХОБЛ), снижающие эффективность переноса кислорода из легких в кровь.
К случайным причинам относятся:
- врожденные пороки сердца, при которых дезоксигенированная кровь смешивается с оксигенированной кровью;
- прием лекарств, например, глюкокортикостероидов;
- истинная полицитемия, то есть неконтролируемое увеличение количества эритроцитов превышающее верхнюю границу нормы в несколько раз.
Увеличение количества эритроцитарных клеток (мегалоцитоз) может быть связан с рядом заболеваний:
- алкоголизм;
- апластическая анемия;
- химиотерапия;
- гемолитическая анемия;
- повышение уровня глюкозы (гиперосмолярная кома);
- гемолитическая болезнь новорожденных;
- гипотиреоз;
- лейкемия;
- лимфома;
- метапластическая карцинома;
- миелофиброз;
- миелома
- рефракторная анемия;
- дефицит B12, связаный с аномальным синтезом клеточной ДНК и нарушением деления.
Эритроциты ниже нормы
Пониженные результаты показателей эритроцитов называются эритроцитопенией (т.е. эритроциты ниже нормы) и указывают на анемию.
У этого состояния есть много причин, наиболее распространенные из которых:
- дефицит железа;
- недостаток витамина B12;
- дефицит фолиевой кислоты.
Это состояние также возникает при хронических заболеваниях и после кровотечения. Самыми редкие — гемолитические анемии, связанные с разрушением клеток крови. Анемия также может указывать на гипергидратацию и иногда возникает во время беременности.
Уменьшение количества эритроцитарных клеток (микроцитоз) может указывать на:
- гемоглобинопатию (болезнь HbC);
- гемолитическую анемию;
- унаследованный сфероцитоз;
- воспаление;
- ферродефицитную анемию;
- талассемию.
Следует помнить, что небольшие отклонения в морфологии могут встречаться и у полностью здоровых людей. Однако каждый результат этого теста стоит обсудить с врачом.
Эритроциты и другие параметры морфологии
Если анемия обнаруживается на основании количества эритроцитов, гемоглобина и гематокрита, другие морфологические данные могут значительно помочь в диагностике причины состояния. Вот эти значения:
- Среднее содержание гемоглобина в клетке крови (МСН), т.е. масса этого соединения, которое содержится в одном эритроците. Здесь норма находится в пределах 27-31 пг.
- Средняя концентрация гемоглобина в клетке крови (MCHC), т.е. масса гемоглобина в данном объеме эритроцитов. Норма 32-36 г / дл.
Если эти значения снижаются, главным подозревается железодефицитная анемия. Но она также может быть вызвана хроническими заболеваниями или талассемией.
Увеличение MCH и MCHC наблюдается при сфероцитозе — заболевании, при котором эритроциты имеют аномальную форму.
Средний объем кровяных клеток (MCV) или просто их размер должен находиться в диапазоне 82-92 мкл. Снижение MCV подтверждает диагноз железодефицитной анемии, но оно также встречается, хотя и гораздо реже, при талассемии и хронических заболеваниях.
Увеличение этого параметра наблюдается при анемии, вызванной дефицитом витамина B12 и фолиевой кислоты. Недостаток этих микроэлементов может быть вызван недостатком в питании, заболеваниями желудка и кишечника, а также циррозом печени и алкоголизмом. MCV также увеличивается при гипотиреозе и в результате химиотерапии, а иногда и во время беременности.
Два параметра менее важны для общей оценки: содержание ретикулоцитов и коэффициент вариабельности объемного распределения эритроцитов
Содержание ретикулоцитов (Ret.). Их норма составляет 0,5-1,5% от количества эритроцитов, а в абсолютных количествах 20-100 тыс./мкл. Это ювенильные незрелые формы красных кровяных телец, только что вышедших из костного мозга. Их присутствие связано с восполнением недостающего пула эритроцитов, которые физиологически разрушаются.
- Повышение указывает на компенсацию избытка кровяных телец. Оно возникает в случае: гемолитической анемии, кровотечения, а также после правильного лечения анемии.
- Уменьшение наблюдается при нарушении процесса выработки эритроцитов, то есть при апластической анемии и витаминно-дефицитной анемии. Это очень точный индикатор правильности процесса производства клеток крови.
Коэффициент вариабельности объемного распределения эритроцитов (RDW-CV). Норма составляет 11,5-14,5%. Этот показатель определяет, насколько разные эритроциты отличаются друг от друга по размеру. Результат выше 14,5% может быть результатом дефицита железа, витамина B12 или фолиевой кислоты, а также после переливания крови.
Если лабораторные исследования не определяют причину нарушений количества или структуры эритроцитов, проводится биопсия костного мозга и оценивается процесс образования этих клеток крови.
Эритрограмма — оптическая оценка клеток крови
В настоящее время все анализы крови проводятся с помощью автоматических анализаторов, но термины, описывающие появление эритроцитов, все еще существуют, их используют, например, для точного описания характера анемии.
Размер эритроцитов
По размерам есть:
- микроциты – маленькие эритроциты;
- макроциты – большие красные кровяные тельца;
- мегалоциты – гигантские эритроциты.
Если, однако, соотнести эти понятия с параметрами, описанными выше, можно сделать вывод, что они соответствуют MCV, то есть объему эритроцитов.
Анизоцитоз – это наличие в кровотоке эритроцитов разного размера. По неправильной форме можно выделить:
- сфероциты – круглые эритроциты;
- лептоциты – тонкие эритроциты;
- овалоциты – эритроциты овальной формы;
- акантоциты и эхиноциты – эритроциты с выступами;
- шизоциты – фрагменты эритроцитов;
- эритроциты щитовидной железы.
Форма эритроцитов
Явление возникновения различных форм эритроцитов называется пойкилоцитозом. Каждое из вышеупомянутых проявлений клеток крови характерно для заболевания, при котором возникают такие эритроциты, например, шизоцитов при микроангиопатической анемии и лептоцитов при талассемии.
Изменения формы эритроцитов наблюдаются при наличии этих состояний:
- Наследственное заболевание крови:
- элиптоцитоз;
- стаффиновая анемия;
- сфероцитоз;
- талемия;
- гемоглобинопатия.
2. Механического повреждения эритроцитов:
- в случае физической травмы;
- при контакте с химическими веществами;
- из-за медикаментозного лечения.
Сфероцитоз проявляется при наличии:
- гемолитической анемии и о-клеток Хайнца;
- микроангиопатической гемолитической анемии;
- вторичной изоимунической анемии;
- переливании некачественной крови.
Акантоциты могут быть обнаружены при диагнозах:
- алкогольный цирроз печени;
- Абеталипопротеинемия;
- гемолитическая анемия;
- нарушения липидного обмена при неонатальном гепатите;
- малабсорбционная болезнь;
- метастатическое поражение печени;
- после операции по удалению селезенки;
- при наличии дефицита пируваткиназы.
Эхиноциты обнаруживаются, если присутствуют:
- почечная недостаточность;
- дефекты сердечного клапана;
- синдром ДВС;
- накопление фибрина в венах;
- метастатическое заболевание;
- уремия.
Кодоциты могут быть обнаружены, если диагностируется:.
- гемоглобинопатия;
- ферродефицитиновая анемия;
- обструкционные заболевания печени;
- осложнение после операции по удалению селезенки;
- таласемия;
- гемоглобинопатия.
Дакриоциты (каплевидные эритроциты) могут быть обнаружены при наличии.
- метастаз в костном мозге;
- миелоидной метаплазии;
- анемии;
- аплазии, гипоплазии, истощении костного мозга;
- талассемии;
- туберкулеза.
При наличии эхиноцитов можно обнаружить:
- уремию;
- дефицит пируваткиназы;
- язвы желудка и поражения слизистой оболочки;
- последствия переливания старой крови;
- гипокалиемию.
Шистоциты (шлемовидные эритроциты) могут быть обнаружены при наличии:
- ожогов;
- заболевания сердечного клапана;
- ДВС;
- гломерулонефрита;
- гемолитической анемии;
- микроангиопатической гемолитической анемии;
- отторжения трансплантата почки;
- тромбоцитопенической пурпуры;
- васкулита;
- маршевой гемоглобинурии.
Стоматоциты (эритроциты полости рта) присутствуют при:
- заболеваниях печени;
- рожденном стоматоцитозе.
Аннулоциты (кольцевидные эритроциты) могут быть обнаружены при наличии:
- железодефицитной анемии;
- при других гипохромных микроцитарных анемиях.
Дрепаноциты (серповидные эритроциты) могут быть обнаружены при наличии:
- гемоглобинопатии;
- SS, C, SC гемоглобина.
Цвет эритроцитов
Цвет эритроцитов также имеет соответствующие термины для его описания:
- гипохромия – более слабое окрашивание с увеличением центральной светимости;
- гиперхромия – сильная окраска и отсутствие яркости внутри;
- полихроматофилия – неоднородная окраска одной клетки крови;
- анизохромия – это одновременное появление правильно и неправильно окрашенных кровяных телец.
Цвет эритроцита связан с содержанием гемоглобина, то есть MCH и MCHC, и эти значения косвенно определяют их внешний вид.
Гипохромия может наблюдаться при:
- железодефицитной анемии;
- талассемии;
- сидеробластной анемии;
- микроцитарной анемии.
Гиперхромия связана с:
- микрихромией часто увеличивающейй MCV и MCH вместе;
- мегалобластной анемией;
- гемолитической анемией.
Включения в эритроцитах
Также стоит знать о некоторых других аномалиях, которые могут возникать в эритроцитах:
- Эритробласты. Незрелые эритроциты, содержащие клеточное ядро. Они появляются в кровообращении в случае повышенной продукции эритроцитов или при раке крови.
- Кольца Кебота. Появляются при: мегалобластной анемии, отравлении свинцом, когда эритроциты расщепляются до того, как они высвободятся из костного мозга.
- Рулонизация клеток крови. Происходит, когда они переполняются антителами.
- Пункция базофильных эритроцитов. Возникает при нарушениях синтеза гемоглобина, талассемии, мегалобластной анемии, хроническом алкоголизме, сидеробластной или любой другой тяжелой формы анемии, при отравлении свинцом, мышьяком или другими тяжелыми металлами. Часто наблюдается при полихроматофилии.
- Паразиты в эритроцитах. Паразиты обнаруживаются в эритроцитарных клетках при малярии (Plasmodium falciparuim) и бабезиозе.
- Тельца Хауэлла-Джолли. Остатки клеточного ядра и иногда могут быть замечены при серповидной, гемолитической, мегалобластной анемии, гемолизе, после спленэктомии или при отсутствии селезенки после рождения.
- Тела Хайнца. Поврежденный гемоглобин, присутствующий при талассемии и метгемоглобинемии.
- Клетки Папенгеймера. Обнаруживаются, если есть: сидеробластная анемия, талассемия, рефрактерная анемия, дисеритропоэтическая анемия, гемосидероз, гемохроматоз.
Тельца Хауэл-Джолли и Хайнца вместе называются внутриэритроцитарными включениями.
Особенности оценки морфологии эритроцитов
Морфология крови – это простой, широко доступный тест, оценивающий не только эритроциты, но также лейкоциты и тромбоциты. Интерпретацию результатов следует оставить на усмотрение врача, поскольку для правильной оценки требуются знания и опыт.
Единичные небольшие отклонения обычно не вызывают беспокойства. Но любые отклонения в анализе крови необходимо проверять, повторяя анализ.
Чрезвычайно важна методика подготовки к обследованию. Нельзя заниматься спортом или долго стоять перед обследованием. Также требуется голодать в течение 8 часов перед тестом.
10. Гемограмма — понятие, показатели, интерпретация, проблема норм и нормальные значения у человека
Клеточный состав периферической крови у человека в норме достаточно стабилен, поэтому различные изменения его при заболеваниях имеют важное диагностическое значение. Из методов лабораторного исследования форменных элементов крови наибольшее распространение получил общеклинический анализ крови (общий анализ крови, гемограмма). Это исследование проводят в большинстве случаев амбулаторного обследования и практически всем стационарным больным.
Изменения клеточного состава периферической крови наблюдаются не только при патологии, но и при различных физиологических состояниях организма. На показатели крови могут оказать влияние физическая и эмоциональная нагрузка, сезонные, климатические, метеорологические условия, время суток, прием пищи и пр. Чтобы устранить влияние этих факторов, кровь для повторных анализов необходимо брать в одних и тех же условиях.
Под действием физических и химических факторов, с которыми сталкивается человек в современных экологических условиях, а также в своей трудовой деятельности, большинство изменений функции системы кроветворения имеет адаптационный характер. Лишь в крайних случаях эти изменения являются следствием выраженных повреждений. Выявить и правильно оценить адаптационные гематологические реакции на действие токсических факторов малой интенсивности трудно. Не всегда имеется четкая картина различных нарушений. Небольшие изменения количества клеток крови легко «теряются» среди физиологических колебаний, свойственных этим показателям, а сами изменения ограничены в своей направленности.
Патологические изменения крови крайне разнообразны и зависят не только от тяжести процесса, но и от общей реактивности организма и сопутствующих осложнений. Существенное влияние могут оказывать различные лечебные и диагностические воздействия: медикаментозное лечение, оперативные вмешательства, физиотерапия, лучевая терапия, диагностические процедуры.
При многих заболеваниях изменения крови имеют неспецифический характер. В этом случае их используют для динамического наблюдения за больным и в прогностических целях. Получаемым при клинико-лабораторном обследовании гематологическим показателям соответствуют хорошо осознанные, устойчивые представления, которые сложились в системе клинического мышления. Использование этих понятий в ходе обследования и лечения больного составляет неотъемлемый элемент лечебно-диагностического процесса.
В случае гематологических заболеваний исследование клеток крови приобретает первостепенное диагностическое значение. При этом лабораторное обследование необходимо проводить с учетом клинических данных и состояния больного. С помощью показателей клеток крови проводится дифференциальная диагностика, выбирается схема лечения, наблюдаются результаты терапии и т.д.
На распечатках результатов, выдаваемых современными гематологическими анализаторами, могут помещаться комментарии, описывающие возможную патологию, как например: ANISO — анизоцитоз, MICRO — микроцитоз, L SHIFT — смещение влево и т.д. Несмотря на то что морфология крови требует комплексной оценки, необходима интерпретация каждого параметра счета клеток крови в отдельности, а также совокупность клинико-диагностической значимости параметров гемограммы.
Гемограммой называют комплекс показателей, чаще всего получаемых в лаборатории при анализе цельной жидкой крови с помощью автоматизированных методов и дополнительного микроскопического исследования. Гемограмма обычно включает определение концентрации гемоглобина, количества эритроцитов, тромбоцитов, гематокрита, расчет эритроцитарных индексов, количества лейкоцитов, лейкоцитограмму и СОЭ.
Автоматические методы измерения сделали возможным ввести ряд дополнительных параметров: средний объем эритроцита (МСV — mean corpuscular volume), среднее содержание гемоглобина (МСН — mean corpuscular hemoglobin) и средняя концентрация гемоглобина (МСНС — mean corpuscular hemoglobin concentration). Особого внимания заслуживает показатель анизоцитоза эритроцитов — RDW (red cell distribution width), который является важным дополнительным критерием для диагностики и динамического наблюдения за результатами лечения пациентов с анемиями. Эритроцитарные индексы — средний объем эритроцитов (MCV), среднее содержание гемоглобина в эритроците (MCH) и средняя концентрация гемоглобина в эритроците были предложены в 1929 г. Максвеллом Уинтробом (Maxwell Myer Wintrobe) для оценки состояния красных клеток.
Для правильного клинического толкования параметров эритроцитов необходима комплексная оценка всех показателей в сочетании с другими лабораторными данными. С появлением анализаторов крови, регистрирующих множество параметров, интерпретация результатов анализа претерпела некоторые изменения. Некоторые из новых параметров, хотя и были приняты и используются в практике, до сих пор не имеют надежной шкалы показателей нормы. Это вносит существенные затруднения в трактовку результатов. Поскольку в настоящее время автоматизированный анализ крови становится все чаще первым этапом гематологического исследования и для врача важно уметь извлечь максимальную информацию из полученных данных.
Ряд показателей, входящих в общий анализ крови, нельзя признать совершенным. Число эритроцитов (·1012/л или Тэра/л) не вызывает возражений. Общее содержание гемоглобина в крови (г/л) при всей диагностической важности, не является точным показателем. Повышение концентрации гемоглобина может быть результатом истинной полицитемии или следствием потери плазмы. Снижение гемоглобина последует за уменьшением его синтеза, снижением количества эритроцитов или может произойти при гемодилюции. Раньше для уточнения причин этих состояний использовали цветной показатель (ЦП). Но если ЦП снижался и становился меньше единицы, это в равной степени указывало на:
— нарушение синтеза гемоглобина;
— снижение содержания гемоглобина в нормальных по объему эритроцитах;
— уменьшение среднего объема эритроцитов (микроцитоз).
Если ЦП вдруг оказывается более единицы, это не имеет отношения к синтезу гемоглобина, а зависит от преимущественного образования макроцитов. Таким образом, величина ЦП не может однозначно характеризовать синтез гемоглобина и его среднее содержание в одном эритроците. ЦП во многом зависит от объема клетки.
На величине ЦП основано деление анемий на гипо-, нормо- и гиперхромные. В гипохромных эритроцитах содержание гемоглобина снижено. Однако гипохромными, на основании вычисления ЦП, становятся эритроциты с нормальным содержанием гемоглобина (нормохромные), но с увеличенными размерами (макроциты). А к нормохромным относят эритроциты и с нормальным, и с пониженным содержанием гемоглобина (гипохромные), если пониженная концентрация в них гемоглобина компенсирует ЦП уменьшенным размером эритроцитов. Чтобы избежать подобной путаницы, было предложено заменить ЦП на MCH. Он отражает относительное содержание гемоглобина на единицу объема эритроцита и характеризует только синтез гемоглобина.
В зависимости от насыщения эритроцитов гемоглобином они могут быть нормо- и гипохромными.
Проблема нормальных величин в гематологии
Нормальные величины — результаты лабораторных исследований у заведомо здоровых людей. Нормальные величины служат ценными ориентирами для клиницистов, однако не могут служить абсолютными показателями здоровья и болезни, поскольку их значения для здоровых и больных людей нередко совпадают. Кроме того, результаты лабораторных исследований могут отличаться от истинных значений из-за ошибок измерений.
Опыт внедрения гематологических анализаторов в клинико-диагностические лаборатории показывает, что результаты, получаемые с их помощью, нередко входят в противоречие с устоявшимися в практике ЛПУ нормальными величинами.
Процедура установления нормальных величин какого-либо гематологического параметра Х включает в себя несколько этапов:
— выбор метода, с помощью которого будет производиться определение нормальных величин параметра Х;
— калибровка прибора, на котором будет производиться определение нормальных величин параметра Х;
— подбор здоровых доноров, в крови которых будет производиться определение нормальных величин параметра Х;
— измерение параметра Х у доноров;
— статистическая обработка полученных результатов.
Видно, что точное определение норм — весьма сложная и трудоемкая процедура, чреватая неоднозначностью и ошибками:
1. Выбор метода уже несет в себе ту точность, с которой могут быть установлены нормальные величины параметра Х. Если, например, устанавливать нормы концентрации эритроцитов с помощью камеры Горяева, то границы этих норм будут установлены с более чем 15% погрешностью, соответствующей таковой камерного метода.
2. Калибровка прибора — отдельная проблема (обсуждалась в разделе 6).
3. Зависимость значения многих параметров от пола и возраста требует обследования больших однородных половозрастных групп. Трудноразрешимой проблемой является установление нормальных значений у пожилых людей, когда различные заболевания затрудняют формирование однородных групп.
4. При измерении значений параметра Х необходимо тщательно контролировать правильность работы прибора, на котором производится измерение во время всего периода получения результатов. Также надо учитывать возможные ошибки преаналитического этапа взятия этих проб.
5. В результате статистической обработки, как правило, за границы нормальных величин принимаются следующие значения:
— нижняя граница нормальной величины = Хсреднее – 2·CV,
— верхняя граница нормальной величины = Хсреднее + 2·CV,
т.е. такие границы, в пределы которых попадает 95% всех измеренных значений. Это означает, что из 100 измеренных здоровых доноров у 5 человек значение исследуемого параметра может выходить за пределы нормальных величин!
Гемограмма, получаемая при исследовании на гематологическом анализаторе
Нормальные значения гемограммы взрослых, получаемые на гематологических анализаторах
Здесь и далее данные взяты из следующих источников:
1. Клиническая оценка лабораторных тестов: Пер. с англ. Под ред. Н.У. Тица. М: Медицина 1986, 480 с.
2. Энциклопедия клинических лабораторных тестов. Пер. с англ. Под ред. В.В. Меньшикова. М: Издательство «Лабинформ» 1997. 960 с.
Гемоглобин
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
Гемоглобин — основной дыхательный пигмент эритроцитов, способный нестойко связываться с кислородом и углекислым газом, что обеспечивает эритроцитам выполнение их основной функции — газообмена. Гемоглобин является хромопротеидом, состоящим из белка глобина и гема — соединения протопорфирина IX с железом. Гем придает гемоглобину характерную окраску. Присоединение к гему различных химических групп приводит к изменению окраски, на этом основано определение концентрации гемоглобина в крови. Значение гемоглобина можно вычислить по гематокриту, однако диагностическая ценность в этом случае весьма ограниченна.
Метод Сали для определения гемоглобина в третьем тысячелетии применять не рекомендуется.
Концентрация гемоглобина в гематологических анализаторах определяется фотометрически гемиглобинцианидным или гемихромным методом.
Ошибки измерения концентрации гемоглобина. Завышение в результате:
— повышенной мутности сыворотки при гиперлипидемии;
— гипербилирубинемии;
— криоглобулинемии;
— высокого лейкоцитоза;
— избытка нестабильных гемоглобинов (HbS, HbC).
Клинико-диагностическое значение
Повышение концентрации
Первичные и вторичные эритремии
Обезвоживание
Снижение концентрации
Анемии
Гипергидратация
Анемии определяются как снижение общего количества гемоглобина. При диагностике анемий всегда следует соотносить значение показателя с возрастом и полом пациента. Диагностика типа анемии требует проведения дополнительных биохимических и гематологических анализов.
У больных, у которых гемоглобин выше 75 Г/л, препараты железа могут вызвать в течение 10 дней рост гемоглобина на 20-30 г/л (это не означает компенсацию дефицита железа).
Переливание 500 мл крови (или 1 единицы эритроцитной массы — около 300 мл) больному массой тела 70 кг вызывает увеличение гемоглобина на 12 Г/л.
Эритроциты
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
Эритроциты — являются наиболее многочисленной группой форменных элементов крови.
У взрослых их содержание составляет около 5 млн/мкл. Зрелые эритроциты не содержат ядра и органелл, они приблизительно на 35% заполнены гемоглобином. Для эритроцитов характерен относительно низкий уровень обмена, что обеспечивает им довольно длительный период жизни — 100-120 сут.
Ежедневно у человека подвергаются деструкции и погибают около 200 млрд эритроцитов.
Определение количества эритроцитов проводят в счетной камере и с помощью счетчиков или анализаторов клеток крови. Используя так называемое «правило трех», можно по количеству эритроцитов (RBC) оценить концентрацию гемоглобина и показатель гематокрита. 3·RBC=Hb, 3·Hb=Ht. Эту зависимость можно использовать для оценки параметров крови, но только в тех пробах, где эритроциты имеют правильное строение.
В результате ряда последовательных клеточных превращений из эритробласта образуется эритроцит. Процесс сопровождается накоплением гемоглобина и изменениями ядра (конденсация хроматина, исчезновение ядрышек), а заканчивается выталкиванием ядра из клетки. Когда ядро покидает клетку, оставшегося содержимого клетки объемом 90 фл недостаточно, чтобы заполнить клеточную мембрану, площадь которой составляет 150 мкм2, а вместимость около 180 фл. В результате эритроцит приобретает форму двояковогнутого диска (дискоцит) диаметром 7-8 мкм и толщиной 1,8-2,0 мкм (рис. 1).
Площадь поверхности эритроцита двояковогнутой формы больше, чем если бы они имели форму шара, это позволяет эффективнее выполнять функцию газообмена, так как при такой форме диффузная поверхность увеличивается, а диффузное расстояние уменьшается. Кроме того, благодаря своей форме эритроциты обладают большей способностью к обратимой деформации при прохождении через узкие изогнутые капилляры диаметром 2-3 мкм. По мере старения клеток пластичность эритроцитов уменьшается. Пластичность понижена также у эритроцитов с патологически измененной формой (например, у сфероцитов и серповидных эритроцитов), что является одной из причин задержки и разрушения таких клеток в ретикулярной ткани селезенки.
Избыточная вместимость клеточной мембраны обеспечивает возможность значительного изменения объема эритроцита за счет осмотических явлений. Так, при помещении эритроцитов в гипотонический раствор вода проходит внутрь клетки и ее объем возрастает. В гипертоническом растворе наблюдается обратное явление.
В окрашенных препаратах эритроциты имеют форму дисков приблизительно одинакового размера с небольшим просветлением в центре (нормоцит).
Поскольку при автоматическом анализе эритроцитов в канал счета попадают еще и лейкоциты и тромбоциты, ошибка счета (увеличение) эритроцитов возрастает пропорционально лейкоцитозу, превышение количества лейкоцитов более 50 Г/л может искажать показатель среднего объема эритроцитов MCV.
Ложный «эритроцитоз» наблюдается при наличии в крови:
— гигантских тромбоцитов (с объемом >30 фл);
— криоглобулинов.
Ложное занижение количества эритроцитов сопровождает:
— агглютинацию эритроцитов;
— выраженный микроцитоз эритроцитов.
Клинико-диагностическое значение
Увеличение
Реактивные эритроцитозы, вызванные недостатком О2 в тканях:
Врожденные и приобретенные пороки сердца
Легочное сердце
Эмфизема легких
Пребывание на значительных высотах
Реактивные эритроцитозы, вызванные повышенным образованием эритропоэтинов
Поликистоз почек
Водянка почечных лоханок
Новообразования (гемангиобластома, гепатома, феохроцитома)
Влияние кортикостероидов
Болезнь и синдром Кушинга
Лечение стероидами
Эритремия
Дегидратация
Уменьшение
Анемии
Острая кровопотеря
Поздние сроки беременности
Гипергидратация
МСV (средний объем эритроцита)
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
МСV — средний объем эритроцита, определяемый практически всеми современными гематологическими анализаторами. MCV измеряется в фемтолитрах (фл). Значения, находящиеся в пределах 80-100 фл, характеризуют эритроцит как нормоцит, ниже 80 фл — как микроцит, а выше 100 фл — как макроцит.
На рис. 2 показаны типичные виды кривых распределения эритроцитов по объемам.
Имеется прямая зависимость между количеством эритроцитов в крови и средним объемом эритроцита (MCV) (рис. 3).
Количество эритроцитов и концентрация гемоглобина в крови регулируются организмом так, чтобы обеспечивалось их относительное постоянство, поэтому с увеличением содержания эритроцитов в определенных пределах пропорционально уменьшается их объем.
Большинство гематологических анализаторов позволяют охарактеризовать эритроциты объемом от 30 до 250-300 фл. Измерение MCV проводится одновременно с подсчетом эритроцитов по амплитуде импульсов, возникающих при прохождении клетки через апертуру, результаты могут быть выражены графически в виде гистограммы распределения эритроцитов по их объему.
MCV можно вычислить по величине гематокрита и количеству эритроцитов: МСV (фл) = Нt (%)·10/RВС (·1012/л).
Следует обратить внимание, что гематологические анализаторы вычисляют значение гематокрита, исходя из количества эритроцитов и их среднего объема.
MCV меняется в течение жизни: у новорожденных достигает 128 фл, в первую неделю снижается до 100 фл, к году составляет 77-79 фл, затем значения стабилизируются.
МСV является чрезвычайно стабильным показателем, не зависящим для взрослых людей от возраста, пола, расы. Коэффициент вариации этого параметра у пациентов в клинике составляет 6-7%.
MCV количественно выражает микроцитоз или макроцитоз эритроцитов, представляя собой более чувствительный параметр, чем визуальная оценка диаметра эритроцита в мазке, так как изменение диаметра эритроцитов на 5% приводит к увеличению их объема на 15%. Поэтому значение MCV может быть эффективно использовано для дифференциальной диагностики анемий.
Можно сказать, что MCV, а не диаметр является независимой характеристикой популяции эритроцитов. Оценка кривых Прайс-Джонса показывает, что диаметр эритроцитов подвержен заметным изменениям под влиянием различных физиологических факторов. Например, к концу дня средний диаметр эритроцитов значительно увеличивается, во время сна уменьшается, достигая наименьшего значения к 8 часам утра. Колебания размеров эритроцитов в течение дня достигают 8%. На размер эритроцитов влияют также физические нагрузки. Указанные изменения имеют гуморальную природу и связаны с изменениями физико-химических свойств крови. Усредненное значение осмолярности плазмы эквивалентно 0,93% раствору хлорида натрия со значением рН от 7,4 до 7,5. Кровь при автоматическом анализе разводится в изотоническом разбавителе, имеющем стабильные физико-химические параметры, поэтому измерение прибором MCV и анизоцитоза эритроцитов позволяет избежать артефактов визуальных методов оценки.
Однако существует ряд состояний, при которых оценка MCV затруднена. Так, при микросфероцитарной гемолитической анемии микросфероциты имеют диаметр меньше нормы, в то время как средний объем может быть в пределах нормы. В этом случае остается актуальным изучение мазка периферической крови с измерением диаметра эритроцитов и описанием их морфологии. При выраженном анизоцитозе, когда в крови присутствуют микро- и макроциты, MCV, являясь средним показателем объема всей популяции клеток, имеет значение в пределах нормы. Поэтому его надо учитывать в комплексе с показателем анизоцитоза (RDW) и эритроцитарной гистограммой. При холодовой аутоагглютинации MCV может быть ложно завышен, что устраняется хранением и анализом пробы при температуре +37 °С. Еще MCV может быть ложно завышен при диабетическом кетоацидозе вследствие гиперосмолярности плазмы. При разведении пробы крови изотоническим дилюентом анализатора происходит быстрое набухание эритроцитов, отсюда — макроэритроцитоз. Относительное снижение MCV может быть следствием повышенного содержания фрагментов эритроцитов в крови (коагулопатии потребления, механический гемолиз и пр.)
Клинико-диагностическое значение
Значение МСV <80 фл
Микроцитарные анемии
Железодефицитные анемии
Талассемии
Сидеробластические анемии
Анемии, которые могут сопровождаться микроцитозом
Гемолитические анемии
Гемоглобинопатии
Значение МСV >80 фл и <100 фл
Нормоцитарные анемии
Апластические анемии
Гемолитические анемии
Гемоглобинопатии
Анемии после кровотечений
Анемии, которые могут сопровождаться нормоцитозом
Регенераторная фаза железодефицитной анемии
Миелодиспластические синдромы
Значение МСV >100 фл
Макроцитарные и мегалобластные анемии
Дефицит витамина В12, фолиевой кислоты
Анемии, которые могут сопровождаться макроцитозом
Миелодиспластические синдромы
Гемолитические анемии
Болезни печени
Изменения МСV могут служить для определения нарушений водно-электролитного обмена. Повышение значений МСV будет свидетельствовать о гипотоническом нарушении, тогда как понижение значений МСV — о гипертоническом нарушении.
При оценке нарушений водно-электролитной системы можно пользоваться вычисленным МСV (формула дана выше). В этом случае не следует пользоваться значениями МСV, полученными с помощью гематологических анализаторов, так как они измеряют эритроциты в искусственной изоосмотической среде. Гематокрит для этого расчета должен быть определен унифицированным методом с помощью центрифугирования.
МСН (среднее содержание гемоглобина в эритроците)
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
МСН характеризует среднее содержание гемоглобина в отдельном эритроците и отражает массу гемоглобина в «среднем» эритроците. Этот параметр можно вычислить из показателя гемоглобина и количества эритроцитов: МСН (пг) = Нb (Г/л)/RBC(·1012/л).
МСН в эритроците и используемый ранее ЦП выражают одну и ту же характеристику клеток — среднее количество гемоглобина в эритроцитах, но первый показатель дает абсолютное значение в пикограммах, а второй дает содержание гемоглобина в эритроцитах в условных единицах: ЦП = Hb (Г/л)/RBC (·1012/л).
Значение ЦП можно вычислить по следующей формуле: ЦП = МСН (пг)/33,4.
Эти два показателя полностью заменяют друг друга, поэтому нет необходимости вычислять ЦП, если в лаборатории есть гематологический анализатор, рассчитывающий МСН автоматически. Кроме того, МСН в эритроците более объективный параметр, чем ЦП, который не отражает синтез гемоглобина и его содержание в эритроците.
Следует отметить, что повышение MCH свыше 34 пг (гиперхромия) зависит исключительно от увеличения объема эритроцитов, а не от повышенного насыщения их гемоглобином. Это объясняется тем, что концентрация гемоглобина в эритроците имеет предельную величину, не превышающую 0,37 пг на 1 фл объема эритроцита (при больших концентрациях гемоглобин может переходить в кристаллическую форму, что приводит к лизису эритроцита). При условии предельной насыщенности гемоглобином нормальные эритроциты, имеющие объем 90 фл, содержат 34 пг гемоглобина. Таким образом, гиперхромия всегда сочетается с макроцитозом. Снижение MCH до величин менее 27 пг называется гипохромией и может быть следствием как снижения MCV, так и ненасыщенности эритроцитов гемоглобином. Таким образом, гипохромия может быть и при нормоцитозе и даже при макроцитозе.
МСН в эритроците является чрезвычайно стабильным показателем, не зависящим для взрослых людей от возраста, пола, расы. Коэффициент вариации этого параметра у пациентов в клинике составляет 5-6%. Как диагностический параметр МСН является вторичным, зависящим от MCV и самостоятельной диагностической ценности не имеет. МСН коррелирует со значениями МСV и МСНС. Все состояния, приводящие к уменьшению объема и завышению количества эритроцитов, а также к занижению гемоглобина, приводят также и к уменьшению содержания гемоглобина в эритроците. Ложное завышение МСН получается при ошибках, вызывающих увеличение уровня гемоглобина и занижение количества эритроцитов.
По уровню MCH анемии делят на нормохромные, гипохромные и гиперхромные.
Клинико-диагностическое значение
Повышение
Гиперхромные анемии
Мегалобластные анемии
Анемии, сопровождающие цирроз печени
Снижение
Гипохромные анемии
Анемии при злокачественных опухолях
МСНС (средняя концентрация гемоглобина в эритроците)
Коэффициенты пересчета: 1/дл·0,62=ммоль/л; ммоль/л·1,61=г/дл.
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
МСНС отражает концентрацию гемоглобина в «среднем» эритроците, т.е. отношение содержания гемоглобина к объему клетки и характеризует степень насыщения эритроцита гемоглобином в процентах. Этот параметр можно высчитать из показателей гемоглобина и гематокрита: МСНС = Нb (г/дл)·100/Нt (%).
Среднее содержание гемоглобина в эритроците является самым стабильным, генетически детерминированным показателем, не зависящим для взрослых людей от возраста, пола, расы. Коэффициент вариации этого параметра у пациентов в клинике составляет 4-5%. Из всех эритроцитарных индексов МСНС меньше всего подвержен колебаниям при патологических состояниях, поэтому снижение этого показателя имеет большую ценность в диагностике железодефицитной анемии, талассемии, свинцовой интоксикации, некоторых гемоглобинопатий.
МСНС имеет хорошо определенный верхний предел, поэтому любая неточность, связанная с определением количества эритроцитов, гемоглобина и MCV, приводит часто к увеличению МСНС выше предельных значений. Этот параметр может быть использован как индикатор ошибки прибора или ошибки, допущенной при подготовке пробы к исследованию.
Как характеристика клетки средняя концентрация гемоглобина в клетке весьма стабильный параметр. Клетка может быть большой, а может быть маленькой, их может быть много, а может быть мало, но концентрация гемоглобина в клетке связана со структурой клетки и практически не меняется.
И поэтому границы нормы по МСНС являются очень узкими. Этот параметр эффективен для контроля качества. Стабильность калибровок, правильное функционирование прибора, полезно контролировать по текущему среднему значению МСНС. Оно должно колебаться в пределах 34±2 ед.
Любая неточность, связанная с определением гемоглобина, гематокрита, среднего объема эритроцита, приводит к завышению MCHC, поэтому этот параметр больше используется как индикатор ошибки прибора или ошибки, допущенной при подготовке пробы к исследованию, при выполнении разведения.
Клинико-диагностическое значение
Повышение
Гиперхромные анемии — сфероцитоз, овалоцитоз
Гипертонические нарушения водно-электролитной системы
Снижение до уровня <31 г/дл
Гипохромные анемии
Гипотонические нарушения водно-электролитной системы
Верхняя граница растворимости гемоглобина в воде составляет 37 г/дл, поэтому повышение, выходящее за рамки нормальных значений МСНС, отмечается чрезвычайно редко. Результаты выше
37 г/дл являются четким указанием на необходимость повторить анализ. Одной из возможных причин повышения MCHC является гемолиз в пробе.
Для определений нарушений в водно-электролитной системе следует анализировать изменения значений МСНС, а не их абсолютные величины.
При оценке нарушений водно-электролитной системы можно пользоваться вычисленным МСНС (формула дана выше). В этом случае не следует пользоваться значениями МСНС, полученными с помощью гематологических счетчиков, так как они измеряют эритроциты в искусственной изоосмотической среде.
RDW (анизоцитоз эритроцитов)
Нормальные значения: 11,5-14,5%.
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
RDW является мерой различия эритроцитов по объему (анизоцитоза) и характеризует колебания объема эритроцитов. Объемы эритроцитов здорового человека подчиняются нормальному распределению с коэффициентом вариации около 12%. Аналогичную функцию выполняет кривая Прайс-Джонса, подсчет которой вручную чрезвычайно утомителен. Этот показатель подсчитывается большинством гематологических анализаторов как коэффициент вариации среднего объема эритроцитов: RDW (%) = SD/MCV (фл)·100%, где SD — стандартное отклонение объема эритроцитов от среднего значения.
Следует отметить, что нет состояний организма, которые сопровождались бы уменьшением этого коэффициента вариации.
Гематологические анализаторы улавливают анизоцитоз значительно эффективнее, чем это делается с использованием визуальных методов. Оценка степени анизоцитоза под микроскопом сопровождается целым рядом ошибок. При высыхании эритроцитов в мазке их диаметр уменьшается на 10-20%, в толстых мазках он меньше, чем в тонких. Полностью избавиться от артефактов позволяет только автоматизированный подсчет с использованием кондуктометрического метода, где сохраняется стабильность клеток и воспроизводимость результатов.
Высокое значение RDW означает гетерогенность популяции эритроцитов при наличии в пробе крови нескольких популяций эритроцитов (например, после переливания крови). При наличии в крови измененной, но достаточно однородной популяции эритроцитов (микроцитов) значения RDW могут быть в пределах нормы. RDW вместе с МСV служит для дифференциации микроцитарных анемий. RDW следует анализировать вместе с гистограммой эритроцитов, которую представляют большинство современных гематологических анализаторов. Гистограмма графически отражает частоту встречаемости эритроцитов разного объема.
Значения показателя RDW для одной и той же пробы крови, определяемые на приборах, производимых разными фирмами, существенно варьируют. Это происходит из-за того, что имеются существенные различия как в алгоритмах обработки самой кривой, так и в конструкции датчиков аппаратуры. Каждая лаборатория на практике должна установить, какие величины RDW являются нормальными и какова чувствительность данного прибора в отношении регистрации изменений этого параметра. Качество аппаратуры необходимо контролировать путем сопоставления получаемых результатов с
данными, которые дают на тех же образцах приборы заведомо более высокого класса точности.
Клинико-диагностическое значение
Значение МСV >80 фл, RDW в норме:
Анемии при хронических заболеваниях
Талассемия
Значение МСV >80 фл, RDW высокое:
Железодефицитные анемии
Сидеробластические анемии
Повышенное RDW отмечается при:
Макроцитарных анемиях
Миелодиспластических синдромах
Костно-мозговой метаплазии
Метастазах новообразований в костный мозг
Эритроцитарные гистограммы
Регистрируемые с помощью анализаторов эритроцитометрические кривые не соответствуют кривым Прайс-Джонса, которые можно получить при многочисленных и долгих измерениях диаметра эритроцитов под микроскопом (с помощью окулярного микрометра в мазке крови измеряют диаметр не более 300 эритроцитов за 4-6 ч рабочего времени). Дело в том, что диаметр эритроцитов при высыхании мазка уменьшается на 10-15%, в толстых мазках диаметр эритроцитов меньше, чем в тонких и, наконец, в направлении мазка диаметр эритроцитов больше, чем поперек. Кондуктометрический метод отражает объем клеток, поэтому нельзя сопоставлять кривые распределения эритроцитов по объему и по диаметру. Гистограмма распределения эритроцитов по объему имеет ряд особенностей при сравнении с таковой по диаметру:
1. Кривая распределения объемов значительно шире, коэффициент вариации при определении объема в 3 раза выше, чем при определении диаметра.
2. Кривая распределения диаметров эритроцитов является симметричной (Гауссова кривая), а распределение клеток по объему имеет сдвиг вправо, пропорционально коэффициенту вариации диаметров.
3. Если кривая распределения диаметров является полимодальной (имеет несколько пиков), то гистограмма распределения эр
В данной работе проводится анализ подбора режима работы сканирующего (растрового) электронного микроскопа в исследованиях биологических образцов: эритроцитов крови в норме и патологии для формирования новых подходов в методах изучения и диагностики заболеваний. Рассматриваются изображения эритроцитов крови пациентов с заболеваниями почек с гематурией, которые в настоящее время диагностируются методом биопсии. Приводится описание подготовки образцов, сравнение режимов работы в исследованиях морфологии эритроцитов. Получены условия проведения эксперимента для повышения качества изображений, позволяющие получить достоверную информацию о морфологии эритроцитов. Результаты исследования могут лечь в основу рекомендаций проведения экспериментов с биологическими образцами человека для формирования новых подходов в методах клинической лабораторной диагностики.
Ключевые слова: электронная микроскопия, лабораторная диагностика, гематурия, гломерулонефрит, морфология эритроцитов, сканирующий электронный микроскоп, качество изображения.
Введение
В настоящее время является актуальной проблема дифференциальной диагностики гломерулонефритов, в том числе сопровождающихся гематурией, для установления клинико-морфологической формы которых применяется почечная биопсия, сопровождающаяся высокими рисками для пациента. Ранее авторы представляли к публикации работы, связанные с исследованием образцов крови детей с заболеваниями почек с синдромом гематурии, например, такими как IgA-нефропатия, хронический гломерулонефрит, гемморагический васкулит [1, 2]. Исследования сухих мазков крови методом сканирующей электронной микроскопии (СЭМ) позволили сделать выводы о том, что, несмотря на то, что на морфологию эритроцитов крови влияет очень большое количество факторов, существует некоторая связь их форм и размеров с диагнозом заболевания. Связь с диагнозом обнаружена также у количественных и качественных характеристик нанообъектов (НО) на их поверхности эндогенного происхождения, но неясного биогенеза, которые имеют линейные размеры, сопоставимые с размерами вирусов и экзосом.
В ходе изучения образцов крови пациентов проводилась экспериментальная работа по выявлению условий проведения исследования, связанной с подготовкой биообразцов и режима работы электронного микроскопа. Очевидно, что при правильном выборе условий проведения экспериментов получались наиболее качественные изображения, которые позволяли делать анализ морфологии эритроцитов крови на нанометровом уровне. Возможно, исследование особенностей морфологии эритроцитов методом СЭМ у пациентов с различными видами гломерулонефритов позволит сформировать новые подходы в их дифференциальной диагностике. Учитывая необходимость обработки при этом большого количества данных и связанные с этим проблемы их оптимального использования существует необходимость разработки метода машинного обучения в исследованиях форм и размеров эритроцитов, НО СЭМ-изображений. Автоматизация распознавания образов эритроцитов и НО существенно облегчит анализ морфологических данных образцов крови и будет способствовать формированию подходов в разработке методов дифференциальной диагностики заболеваний почек. Для машинного анализа морфологических данных образцов крови необходимо проводить подготовительные работы по оконтуриванию эритроцитов (рис. 1). Качество таких работ, в свою очередь, зависит от качества СЭМ-изображений.
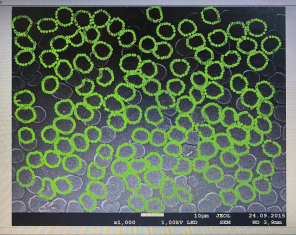
Рис. 1. Оконтуривание эритроцитов, увеличенных в 1000 раз с помощью программы Anaconda prompt (Anaconda 3)
Таким образом, целью данной работы является анализ полученных СЭМ-изображений для установления оптимального режима проведения экспериментов на СЭМ образцов крови человека для выработки практических рекомендаций.
Материалы иметоды исследования
В данной работе рассматривается исследование крови тонких сухих мазков крови с толщиной, примерно сопоставимой толщиной одного эритроцита (1–2 микрон), на предметном стекле пациентов с хроническим мезангиопролиферативным гломерулонефритом (ХМПГН) и пациента без признаков иммунного поражения почек методом СЭМ. Забор крови этих пациентов и эксперименты с применением СЭМ были проведены пять раз в течение года. Эксперимент был начат с мая 2019 года и был завершен в декабре 2019 года. Забор крови был реализован пять раз: в мае, июне, сентябре, ноябре и в декабре 2019 г., т. е. более-менее равномерно в течение одного года. Кровь брали одновременно у обоих пациентов. Исследования проводились на растровом электронном микроскопе JSM-7800F JEOL с разрешающей способностью 1,2 нм (при 1 кВ) с системой Gentle Beem в режиме низких ускоряющих напряжений (1–2 кВ) без проводящих покрытий образцов. При данном исследовании рассматриваются CЭМ-изображения, полученные путем детектирования вторичных электронов с образцов с помощью нижнего детектора микроскопа. Такие ускоряющие напряжения и работа в режиме торможения пучка «Gentle Beam» позволяют не покрывать поверхность образцов проводящим слоем, что увеличивает возможности улучшения качества изображения при таких низких ускоряющих напряжениях и с одновременным применением системы торможения электронов пучка непосредственно перед их падением на исследуемый образец [3].
Результаты и анализ исследования
На рис. 2 представлены изображения эритроцитов и их поверхности с большим количеством нанообъектов пациента с диагнозом ХМПГН в июне 2019 г. при различных увеличениях. Данные этого эксперимента показали, что края выбранного эритроцита неровные и его поверхность при увеличении более чем 10 000 раз не гладкая и имеет включения в виде ямок, впадин и светлых нанометровых объектов (НО). Размер НО на поверхности эритроцитов варьируется от 30 нм до 100 нм. На основе рис.2 было выявлено, что наибольшее количество НО имеет размер 50–70 нм. Данные снимки были сделаны при следующем режиме работы СЭМ: 1) ускоряющее напряжение равнялось 1,00 кВ; 2) рабочее расстояние — WD равнялось 4,0 мм.

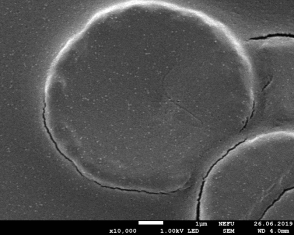
а) б)


в) г)
Рис. 2. СЭМ-изображения капиллярной крови пациента с ХМПГН: 1) эритроцитов — а) и б) при увеличениях 1000х и 10 000х соответственно; 2) НЧ — в) и г) при увеличениях 20 000х и 40 000х соответственно.
На рис. 3 представлены эритроциты и НО на их поверхности образца крови пациентки с ХМПГН, забор которого был сделан в декабре 2019 г. Данные снимки были сделаны при следующем режиме работы СЭМ: 1) ускоряющее напряжение равнялось 1,00 кВ; 2) рабочее расстояние (фокусное расстояние) — WD равнялось 3,9 мм. Изменение WD позволило получить снимок при увеличении 80 000 раз, что было невозможно при WD равном 4,00 мм.


а) б)

в) г)
Рис.3. СЭМ-изображения капиллярной крови пациента с ХМПГН: 1) эритроцитов — а) и б) при увеличениях 1000х и 10 000х соответственно; 2) НЧ — в) и г) при увеличениях 22 000х и 80 000х соответственно.
Из рис., 4 видно, что есть отличия в морфологии эритроцитов крови контрольного образца от морфологии эритроцитов образца крови пациента с ХМПГН. Снимки были сделаны при условиях: 1) ускоряющее напряжение равнялось 1,00 кВ; 2) рабочее расстояние (фокусное расстояние) — WD равнялось 3,7 мм. В отличие от имеющих круглые формы НЧ пациента с ХМПГН НО имеют размытые формы, хлопьеобразны. Такие хлопьеобразные НО наблюдались на поверхности эритроцитов крови больных раком шейки матки после того, как образцы крови c эритроцитами с НО подвергали шоковой заморозке путем охлаждения их до температуры жидкого азота [4].


а) б)
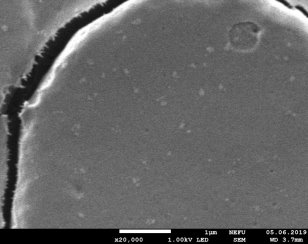

в) г)
Рис. 4. СЭМ-изображения контрольного образца капиллярной крови: 1) эритроцитов — а) и б) при увеличениях 1000х и 10 000х соответственно; 2) НО — в) и г) при увеличениях 20 000х и 40 000х соответственно.
На рис. 5 показаны изображения эритроцитов при одинаковом увеличении и ускоряющем напряжении, но при различных значениях фокусного расстояния.

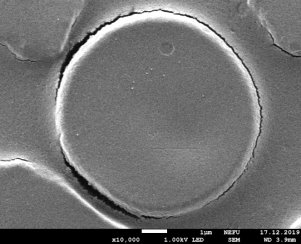
а) б)
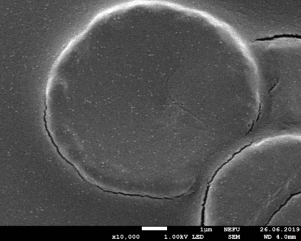

в) г)
Рис.5. СЭМ-изображения капиллярной крови пациента с ХМПГН: 1) эритроцитов — а), б), в), г) при увеличениях 10 000х и ,
,
соответственно
Необходимо отметить, что сравнение СЭМ-изображений при равных режимах работы кроме изменения рабочего расстояния WD показывает, что изображения поверхности эритроцитов заметно отличаются. Видно, что небольшое отклонение в 0,1 мм для WD приводит к получению разной информации от изображений. Например, из рис. 4 в) и с) видно, что, когда , видимо, изображение НО размывается из-за отклонения от оптимальной фокусировки в данных исследованиях. И вместо НО с достаточно выраженными формами в виде круглых фигур получаются изображения НО с размытыми контурами. А наиболее оптимальным условием для рабочего расстояния при низком ускоряющем напряжении 1 кВ является, когда
(рис.5 б), хотя при увеличении в 10 000 раз при
и
нет существенной разницы в качестве изображения, но 80 000 увеличение возможно только для
без потери качества изображения для НО на поверхности эритроцитов. Еще раз необходимо отметить, что при условии
есть возможность получить изображения НО при увеличении в 80 000 раз. И в то же время из рис. 3 г) видно, что при
поверхность эритроцитов уже при 1 000 увеличении кажутся идеально гладкими, ровными и на них не видно никаких НО.
Полученные с помощью сканирующего электронного микроскопа изображения возможно обработать с помощью методов машинного зрения. Например, такие методы имеются в программном обеспечении LabView2013 фирмы National Instruments [5]. При обработке изображений из-за не оптимально подобранных параметров СЭМ возникает проблема с оконтуриванием или по другому выделением нанообъектов и эритроцитов. Выделение эритроцитов проводится при увеличении примерно равном 1000 раз. Благодаря использованию программы возможно точно и быстро посчитать количество дисморфных эритроцитов и НО.
На рис. 6 представлена обработка изображения рис. 3 в). Видно, что после обработки четко выделены НО, черным цветом, относительно всего фона. Как видно из рисунка, после обработки ямки на исходном изображении выделяются черными точками с очень малым размером. В дальнейшем возможно произвести фильтрацию для удаления мелких шумовых объектов. Благодаря выделению в дальнейшем можно произвести подсчет количества НО и их сортировку по размерам.


а) б)
Рис. 6. Снимки до обработки a) и после обработки б) СЭМ изображения при WD=3,9 мм
На рис. 7 представлена обработка изображения рис. 4 в). Изначально видно, что на снимке имеются хлопьевидные объекты на поверхности эритроцита. Но при обработке из-за плохого качества снимка некоторые объекты не выделятся программой. Особенно это видно по краям эритроцита. Конечно, процент потерь не велик. Но также появляются объекты, которые невозможно считать НО, проколы и ямки. При обработке эти объекты закрашиваются черным с размером сопоставимым с НО, что недопустимо.
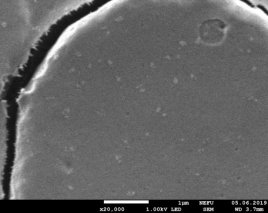
а) б)
Рис. 7. Снимки до обработки а) и после обработки б) СЭМ изображения при WD=3,7 мм
Эти два изображения получены при увеличениях примерно в 20 000 раз. На рис. 8 представлена обработка изображения при увеличении в 80 000 раз. Видно, что при таком изображении намного четче выделяются НО и шумы изображений почти исчезают из-за больших отличий в размерах.


а) б)
Рис. 8. Снимки до обработки а) и после обработки б) СЭМ изображения при WD=3,9 мм и увеличении 80 000х
На основании произведенных обработок СЭМ изображений наглядно показано, что подбор оптимальных параметров при измерении мазков крови позволяют получить более обширную и достоверную информацию.
Заключение
Для данной модификации сканирующего электронного микроскопа при проведении экспериментов с образцами крови в виде сухих мазков на предметном стекле необходимо работать при низком ускоряющем напряжении 1 кВ без напыления проводящего слоя на образец с использованием нижнего детектора вторичных электронов, с активацией системы «Gentle Beam» и с выбором рабочего расстояния .
Таким образом, для определения подходов в выборе параметров в разработке метода дифференциальной диагностики различных видов гломерулонефритов с применением СЭМ на основе исследования морфологии эритроцитов крови на примере эксперимента с образцом крови пациента с ХМПГН необходимо обратить внимание на то, что существует зависимость качества изображения от четкого определения режима работы СЭМ с учетом большого влияния WD на него. Качество изображений влияет на проведение анализа морфологии эритроцитов, что в свою очередь будет определять подход в разработке метода дифференциальной диагностики видов гломерулонефритов с учетом того, что качество изображения влияет на определение вида и степени дисморфии эритроцитов, что является важной информацией в изучении заболевания, выявления особенностей его проявления на клеточном уровне.
Литература:
- Maksimov, G.V., Mamaeva, S.N., Antonov, S.R., Munkhalova Ya.A., Kononova, I.V., Sheikin, I.Yu. Measuring Erythrocyte Morphology by Electron Microscopy to Diagnose Hematuria //Measurement Techniques. June 2016. Volume 59 (3). pp 327–330.
- Мамаева С. Н., Максимов Г. В., Мунхалова Я. А., Антонов С. Р., Дъяконов А. А., Винокуров П. В. Исследование эритроцитов крови с заболеваниями почек с синдромом гематурии с использованием растровой электронной и атомно-силовой микроскопии //Медицинская физика. 2017. № 1 (73), С.58–62.
- Растровая электронная микроскопия для нанотехнологий. Методы и применение [Электронный ресурс] / под ред. У. Жу, Ж. Л. Уанга; пер. с англ. — Эл. изд. — М.: БИНОМ. Лабаратория знаний, 2013. — 582 с. (здесь тоже добавьте, пожалуйста литературу)
- С. Н. Мамаева, Г. В. Максимов, С. Р. Антонов, В. А. Платонова, А. С. Гольдерова, И. В. Кононова, Я. А. Мунхалова, Н. А. Николаева, Т. М. Лебедева «Изучение действия низких температур на морфологию эритроцитов крови детей с гематурией методами оптической и электронной микроскопии» // Ж. Медицинская физика, № 3 (83), 2019 г. С.75–82.
- Визильтер Ю. В., Желтов С. Ю., Князь В. А., Ходарев А. Н., Моржин А. В. Обработка и анализ цифровых изображений с примерами на LabVIEW IMAQ Vision. — М.: ДМК Пресс, 2007. — 464 с.
Основные термины (генерируются автоматически): рабочее расстояние, увеличение, ускоряющее напряжение, изображение, раз, режим работы, капиллярная кровь пациента, качество изображения, сканирующий электронный микроскоп, фокусное расстояние.