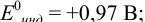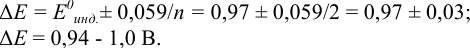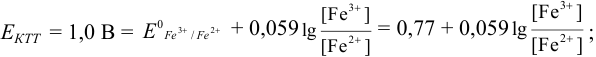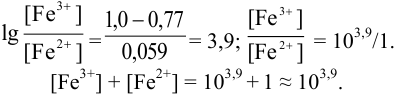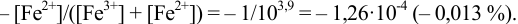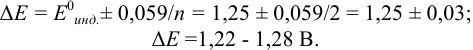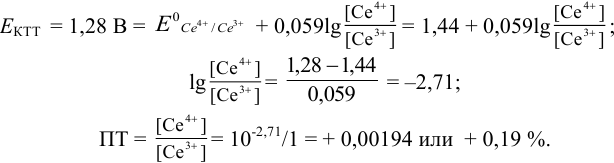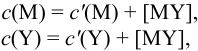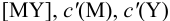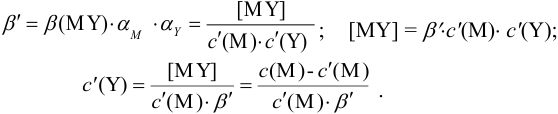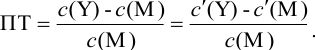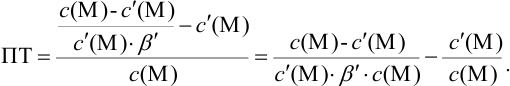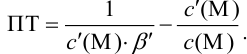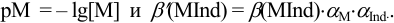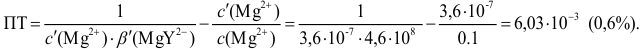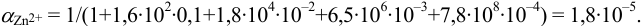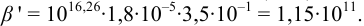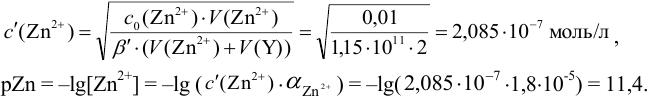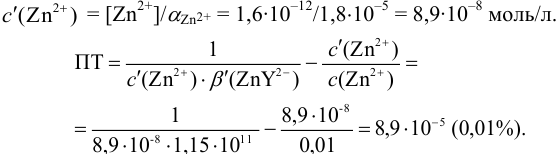Погрешности титрования.
При
каждом титровании возникают погрешности.
Индикаторные погрешности – систематические
погрешности, связаны с несовпадением
ТЭ и конца титрования. Случайные
погрешности связаны с изменением объёма
и массы навески. Систематические
погрешности могут быть положительными
(перетитровывание) и отрицательными
(недотитровывание). Для оценки
систематической погрешности можно
воспользоваться графическим и расчётным
способами. Графический способ является
лишь ориентировочным. Опускают
перпендикуляр из точки с ординатой pT
на ось абсцисс. Отрезок между полученным
значением f
и f
в ТЭ и есть погрешность титрования.
Индикаторные погрешности возникают
тогда, когда pH
в ТЭ не совпадает с pH
индикатора. По методу расчёта погрешности
различают водородную и гидроксильную
погрешности; кислотную и щелочную
погрешности. ПТН
– водородная погрешность, ПТОН
– гидроксильная погрешность, возникающие
за счёт того, что в титруемом растворе
в момент окончания титрования находится
избыток к-ты (избыток H+
— ПТН),
избыток основания (избыток OH—
— ПТОН).
или 0,1%
pT
тимолового синего 8,8.
Величина
0,1% говорит о том, что погрешность
титрования выходит за допустимые пределы
погрешности (0,02%).
Значит этим индикатором пользоваться
нельзя при титровании H2CO3.
или 0,01%
pT
фенолового красного 7,4.
+
0,01 не превышает 0,02%,
поэтому феноловый красный можно
использовать.
Кислотная
или HA
– ошибка обусловлена наличием в растворе
неоттитрованной слабой кислоты. Эта
ошибка определяется отношением
Рассчитаем
ПТНЭ
для тимолового синего и фенолового
красного.
1.Тимоловый
синий.
pT=8,8
pKa=10,32
ПТНЭ=
108,8-10,32
= 0,0302
1,0302
– 100%
0,0302
– ПТ ПТ = 2,93%
ПТ
при титровании тимоловым синим превосходит
допустимую норму (0,2%),
этим индикатором титровать нельзя.
2.Феноловый
красный.
pT=7,3
pKa=10,32
ПТНЭ=
107,3-10,32100%
=0,096%.
Погрешность
мала, феноловый красный можно использовать
в качестве индикатора.
Вывод
1)
При титровании угольной кислотой
наблюдается две точки эквивалентности.
Титрование
до второй точки эквивалентности
невозможно (Ka,1/Ka,2
< 104).
2)
Точка эквивалентности не совпадает с
точкой нейтральности, лежит в щелочной
области (pHТЭ
= 8,33).
3)
Скачок на кривой титрования зависит от
силы протолитов. Чем слабее титруемая
кислота, тем меньше скачёк титрования.
4)
Скачок на кривой титрования зависит от
концентрации титруемых растворов. Чем
больше концентрация, тем больше скачок
на кривой титрования.
5)
Скачок на кривой титрования зависит от
температуры. С повышением температуры
скачок уменьшается.
6)
Вблизи точки эквивалентности необходимо
учитывать автопротолиз H2O
и протолиз, образовавшейся соли.
7)
Скачок pH
при титровании 0,2М H2CO3
0,2М раствором NaOH
равен 2,1 единицы.
II Окислительно-восстановительное титрование (редоксометрия)
Всегда при выводе
кривых титрования необходимо, прежде
всего, рассматривать качественный
состав титруемого раствора. Ведь кривая
титрования показывает изменение
показателя концентрации в процессе
титрования, который определяется
качественным и количественным составом
раствора. В данном случае показателем
концентрации определяемого иона является
окислительно-восстановительный потенциал
системы, включающей две редокс пары. В
редоксометрии используются реакции
окисления – восстановления, связанные
с переходом электронов от одного иона
(молекулы) к другому. Вещество, теряющее
электроны, в этих реакциях является
восстановителем, а приобретающее –
окислителем; первое вещество окисляется,
а второе – восстановливается.
Вос1
— е
Ок1
Ок2
+ е
Вос2
———————————————————
Вос1
+ Ок2
Ок1
+ Вос2
При редоксометрическом
титровании концентрации участвующих
в реакции веществ или ионов все время
изменяются. Должен, следовательно,
изменяться и окислительно –
восстановительный потенциал раствора
(Е).
6Fe2+
+ Cr2O72-
+ 14H+
6Fe3+
+ Cr
3+
+ 7H2O
no(Fe2+) nт(1/6
Cr2O72-)
Fe2+
— e → Fe3+
Cr2O72-
+14H+
+ 6 e → 2Cr
3+
+ 7H2O
Fe3+/
Fe2+
Редокс пары
Cr2O72-/2Cr
3+
Применительно к
нашему случаю обозначим Со(Fe2+)
– исходная молярная концентрация
титруемых ионов железа (0,1М), Ст(1/6
Cr2O72-)
– молярная концентрация эквивалента
титранта (0,1М).
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 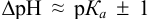
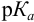
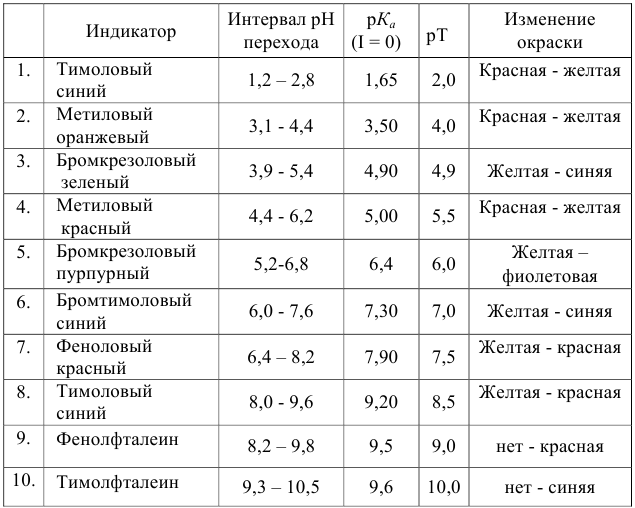
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 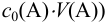
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
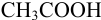
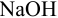
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
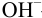
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 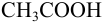



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 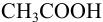
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 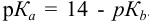
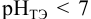
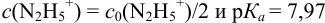
Сравнивая рТ индикаторов и 
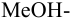
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
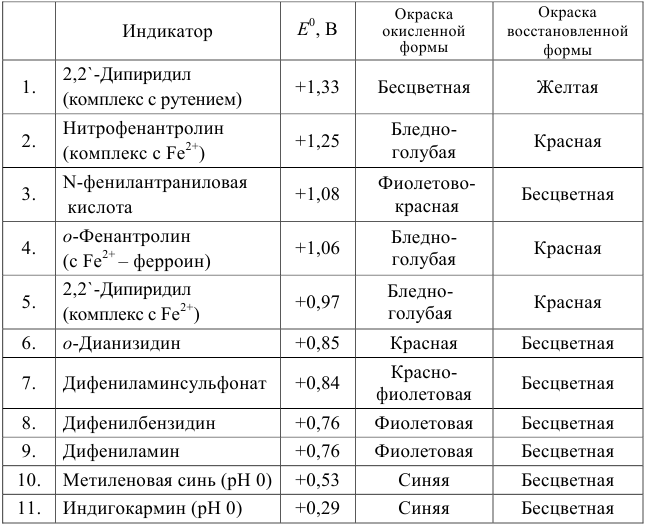
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 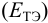

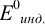
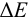
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 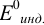
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 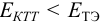
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 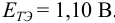
Выберем для рассмотрения порядка расчета два индикатора:
а) с 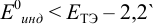
б) с 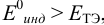
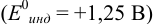
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
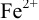



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

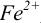
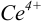
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 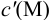
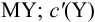
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 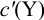
Вблизи ТЭ 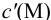
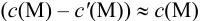
следовательно:
Выражение (8.21) тождественно выражению: 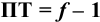
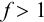
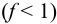
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
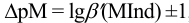
Интервал перехода окраски 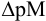
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 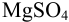

Решение:
В данных условиях 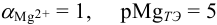
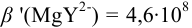
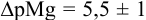
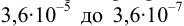

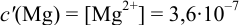
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 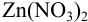

Решение:
1. Рассчитаем условную константу 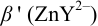
Общие константы устойчивости для аммиачных комплексов 
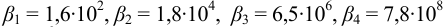

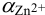
По табл. 7 и табл. 4 приложения находим 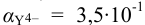
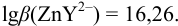

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 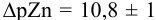
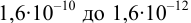

2. Конечная точка титрования наступает при [
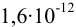

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 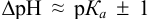
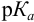
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 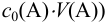
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
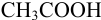
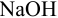
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
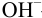
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 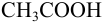



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 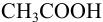
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 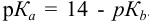
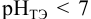
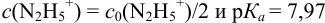
Сравнивая рТ индикаторов и 
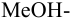
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 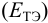

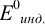
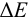
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 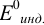
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 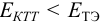
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 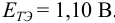
Выберем для рассмотрения порядка расчета два индикатора:
а) с 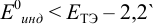
б) с 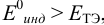
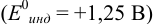
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
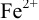



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

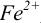
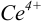
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 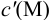
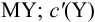
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 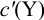
Вблизи ТЭ 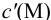
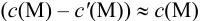
следовательно:
Выражение (8.21) тождественно выражению: 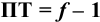
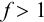
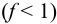
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
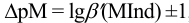
Интервал перехода окраски 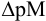
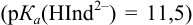
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 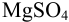

Решение:
В данных условиях 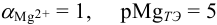
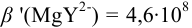
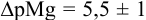
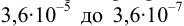

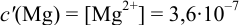
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 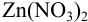

Решение:
1. Рассчитаем условную константу 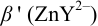
Общие константы устойчивости для аммиачных комплексов 
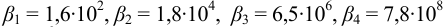

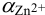
По табл. 7 и табл. 4 приложения находим 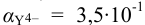
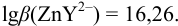

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 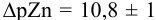
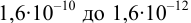

2. Конечная точка титрования наступает при [
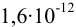

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:



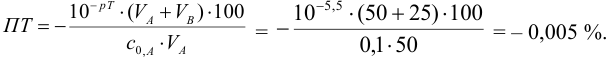
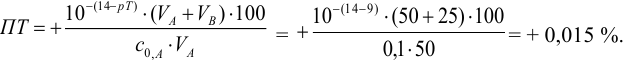
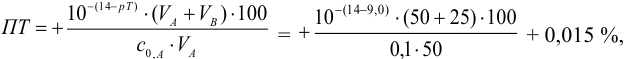
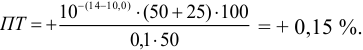
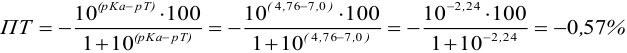
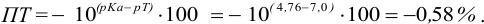
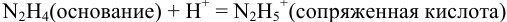
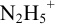
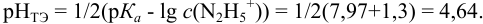
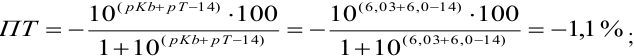
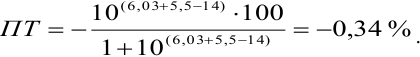

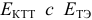 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.