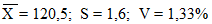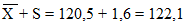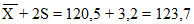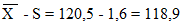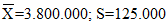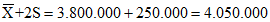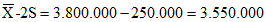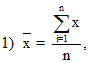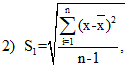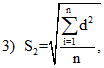Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
Гемоглобин: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показание к назначению исследования
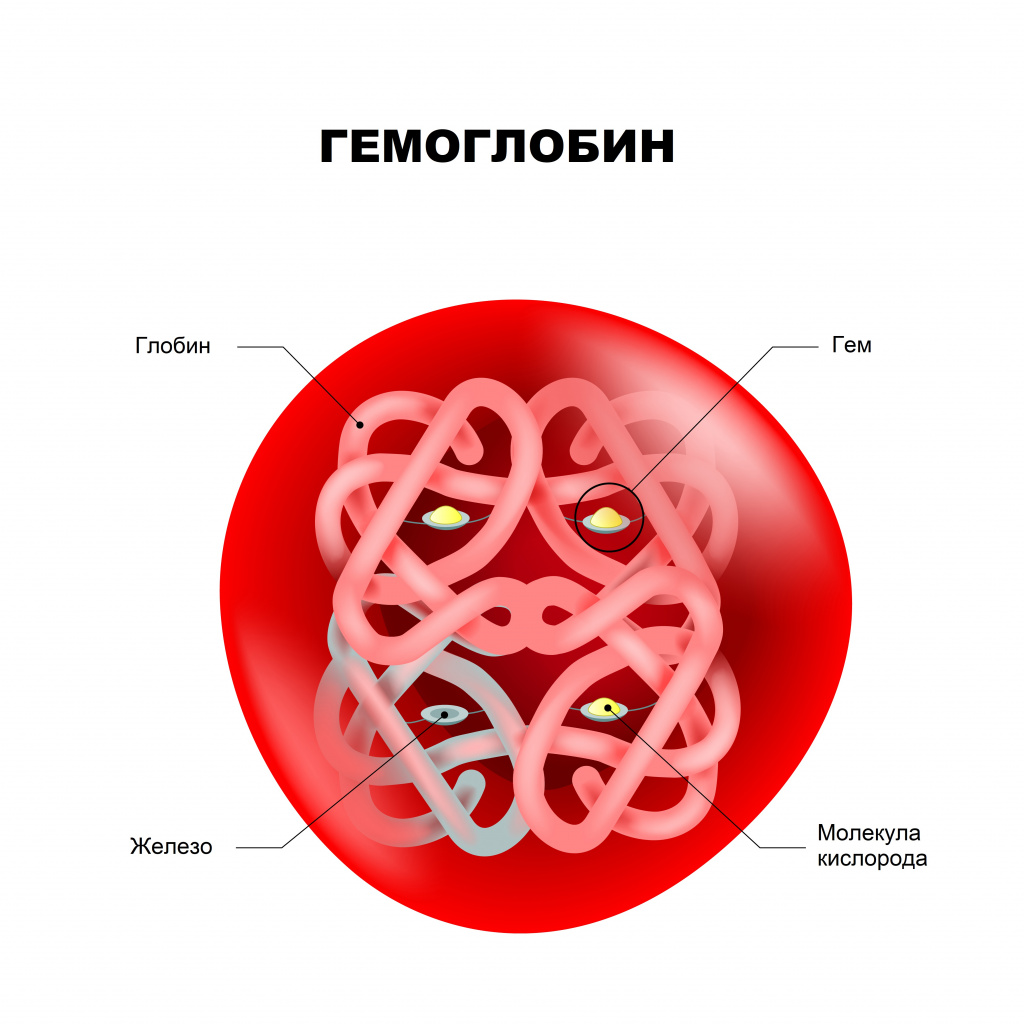
Гемоглобин – сложный белок, основной компонент эритроцитов, переносящий кислород от легких ко всем тканям организма и участвующий в выведении углекислого газа из клеток организма.
Молекула гемоглобина состоит из гема (небелковой части) и глобина (белковой части, которая содержит в своей молекуле четыре полипептидные цепи: две альфа-цепи и две бета-цепи). К каждой из четырех глобиновых субъединиц прикреплена группа гема с атомом железа.
В норме в крови можно обнаружить несколько форм гемоглобина, отличающихся друг от друга белковой частью (количественным или качественным составом аминокислот, входящих в состав глобина):
- эмбриональный (встречается у плода до 2 месяцев внутриутробного развития);
- фетальный (образуется со 2 месяца внутриутробного развития, циркулирует до рождения, разрушается в первую неделю жизни);
- зрелый гемоглобин.
При взаимодействии гемоглобина с различными веществами, способными связываться с его активным центром, возникают производные гемоглобина. В зависимости от того, что присоединил гемоглобин, выделяют формы:
- HbО2 – соединение с кислородом (оксигемоглобин);
- HbСО2 – гемоглобин с углекислым газом (карбогемоглобин);
- HbMet – гемоглобин с окисленным железом (метгемоглобин);
- HbCO – карбоксигемоглобин, образующийся при отравлении угарным газом;
- HbA1С – гликозилированный гемоглобин при сахарном диабете.
Наряду с нормальными формами гемоглобина могут существовать мутантные или патологические. Известно более 300 форм патологических гемоглобинов.
Наиболее часто находят:
- HbS – гемоглобин при серповидно-клеточной анемии;
- гемоглобин Kempsey при полицитемии;
- гемоглобин Hammersmith и др.
Производные и патологические формы гемоглобина определяют с целью диагностики различных заболеваний и в ходе динамического наблюдения за их течением (например, показатель гликозилированного гемоглобина отражает усредненное содержание глюкозы крови за три предшествующих месяца).
Срок жизни эритроцитов, сухое вещество которых на 90-95% состоит из гемоглобина, составляет 110-120 дней. Разрушение эритроцитов происходит в селезенке, небольшая часть гемоглобина распадается в красном костном мозге и звездчатых клетках печени.
Определение концентрации гемоглобина в рамках исследования клинического анализа крови — один из важнейших диагностических методов. Расчетный показатель, отражающий среднее содержание гемоглобина в 1 клетке (эритроците) используется для дифференциальной диагностики анемий.
Концентрацию гемоглобина определяют в рамках профилактического, диспансерного наблюдения при первичном обследовании с целью выявления заболеваний, при госпитализации в стационары терапевтического и хирургического профилей.
Определение количественного содержания гемоглобина используется в комплексе с другими гематологическими показателями (величиной гематокрита, количеством эритроцитов, эритроцитарными индексами) для диагностики ряда патологических состояний: анемии, эритремии и вторичных эритроцитозов, для оценки степени дегидратации организма, определения тяжести кровопотери при геморрагических состояниях, оценки эффективности гемотрансфузий в процессе терапии, определения тяжести состояния пациента при воспалительных, инфекционных заболеваниях, а также для мониторинга проводимой терапии и течения различных заболеваний.
Подготовка к процедуре
- Кровь рекомендуется сдавать утром с 8 до 11 часов, натощак (не менее 8 часов голода, пить воду можно в обычном режиме).
- Сообщите врачу о принимаемых вами лекарственных препаратах.
- Исключите прием алкоголя накануне исследования, не курите в течение 1 часа до исследования.
- Исключите физические и эмоциональные перегрузки накануне исследования.
- После прихода в лабораторию отдохните 10-20 минут перед взятием крови.
- Нежелательно сдавать кровь для лабораторного исследования вскоре после физиотерапевтических процедур, инструментальных обследований и других медицинских вмешательств.
- При контроле лабораторных показателей в динамике рекомендуется проводить повторные исследования в одинаковых условиях: в одной лаборатории (тем же методом), примерно в одинаковое время суток и т. п.
Срок исполнения
1 рабочий день, исключая день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может быть некорректным.
Уровень гемоглобина может быть повышенным после длительного пребывания в высокогорье. Пониженный уровень гемоглобина регистрируется у беременных, вегетарианцев, после нескольких подряд эпизодов сдачи крови.
Сдать анализ крови на гемоглобин можно в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
Исследуемый материал: цельная кровь (с ЭДТА).
Единицы измерения: г/дл.
Альтернативные единицы измерения: г/л.
Коэффициент пересчета: г/л х 0,1 ==> г/дл.
Определение концентрации гемоглобина в крови проводят в ходе исследования клинического анализа крови.
- Анализ крови. Общий анализ крови (без лейкоцитарной формулы и СОЭ) (Complete Blood Count, CBC);
Нормальные показатели
Дети
| Возраст | Показатель гемоглобина, г/дл |
| 1 день — 14 дней | 13,4 — 19,8 |
| 14 дней — 4,3 недели | 10,7 — 17,1 |
| 4,3 недели — 8,6 недель | 9,4 — 13,0 |
| 8,6 недель — 4 месяца | 10,3 — 14,1 |
| 4 месяца — 6 месяцев | 11,1 — 14,1 |
| 6 месяцев — 9 месяцев | 11,4 — 14,0 |
| 9 месяцев-12 месяцев | 11,3 — 14,1 |
| 12 месяцев – 5 лет | 11,0 — 14,0 |
| 5 лет — 10 лет | 11,5 — 14,5 |
| 10 лет — 12 лет | 12,0 — 15,0 |
| Возраст | Показатель гемоглобина, г/дл | |
| Девушки | Юноши | |
| 12 лет — 15 лет | 11,5 — 15,0 | 12,0 — 16,0 |
| 15 лет — 18 лет | 11,7 — 15,3 | 11,7 — 16,6 |
Взрослые
| Возраст | Женщины | Мужчины |
| 18 лет — 45 лет | 11,7 — 15,5 | 13,2 — 17,3 |
| 45 лет — 65 лет | 11,7 — 16,0 | 13,1 — 17,2 |
| > 65 лет | 11,7-16,1 | 12,6-17,4 |
Расшифровка показателей
Гемоглобин у новорожденных выше, чем у взрослых. В течение первого года жизни происходит его постепенное снижение, а затем уровень гемоглобина опять возрастает. В норме показатель гемоглобина у женщин ниже, чем у мужчин.
Что значат пониженные результаты
- Снижение гемоглобина может свидетельствовать об анемии, развивающейся в результате различных причин (острых и хронических кровопотерь; недостатка фолиевой кислоты, витамина В12, железа; неполноценного питания; поражения костного мозга с угнетением его функции; нарушения регуляции образования эритроцитов при уменьшении продукции гормона, стимулирующего рост и размножение эритроцитов; повышенного разрушения эритроцитов под воздействием различных причин или генетических дефектов; хронических воспалительных, инфекционных заболеваний).
- Еще одна причина падения уровня гемоглобина — гипергидратация (избыточное содержание воды в организме).
Что значат повышенные результаты
- Повышение уровня гемоглобина регистрируется при обезвоживании, вызванном острой диареей, многократной рвотой, повышенным потоотделением, диабетом, обширными ожогами.
- Физиологические эритроцитозы отмечаются у жителей высокогорья, летчиков, спортсменов.
- Симптоматические эритроцитозы диагностируются при дыхательной и/или сердечно-сосудистой недостаточности, поликистозе почек, а также у курильщиков.
- Для эритремии (разновидность хронического лейкоза), онкологических заболеваний также характерно снижение уровня гемоглобина.
- К снижению гемоглобина приводит передозировка или неправильное применение препаратов рекомбинантного эритропоэтина.
Дополнительное обследование при отклонении от нормы
При отклонении от нормы концентрации гемоглобина в крови может быть назначено дополнительное обследование.
С целью диагностики анемии:
- ретикулоциты;
Ретикулоциты (Reticulocytes)
Синонимы: Анализ крови на ретикулоциты; Количество ретикулоцитов; Подсчет количества ретикулоцитов; Ретикулоцитарный индекс.
Retic count; Reticulocyte index; Corrected reticulocyte; R…
Эритропоэтин (Erythropoetin)
Синонимы: Анализ крови на эритропоэтин; ЭПО; Гемопоэтин.
Erythropoietin; EPO.
Краткая характеристика исследуемого аналита Эритропоэтин
Эритропоэтин – гликоп�…
Трансферрин (Сидерофилин, Transferrin)
Синонимы: Переносчик железа; Сидерофилин. Siderophilin, Transferrin; Tf.
Краткая характеристика определяемого вещества Транферрин
Транферрин – плазменный бел�…
Железо сыворотки (Iron, serum; Fe)
Определение концентрации железа в сыворотке крови в комплексе с другими тестами (см. белки, участвующие в обмене железа) используют в диагностике железодефицитных…
Фолиевая кислота (Folic Acid)
Фолиевая кислота − витамин, необходимый для нормального синтеза ДНК (особенно в онтогенезе) и процессов кроветворения.
Синонимы: Витамин В9; Фолацин; Пте�…
С целью диагностика заболеваний желудочно-кишечного тракта:
- анализ кала на простейшие;
Анализ кала на простейшие (PRO stool)
Есть ограничения по дням взятия проб в медицинских офисах и приема проб самостоятельно собранных для данного исследования (кал, моча и др.).
Рекомендуем уточнить ин…
Обследования, направленные на выявление поражений внутренних органов:
- оценка показателей работы почек (мочевина, креатинин, клубочковая фильтрация);
Креатинин (в крови) (Creatinine)
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat.
Краткая характеристика определяе…
Мочевина (в крови) (Urea)
Синонимы: Диамид угольной кислоты; Карбамид; Мочевина в крови; Азот мочевины.
Urea nitrogen; Urea; Blood Urea Nitrogen (BUN); Urea; Plasma Urea.
Краткая характеристика аналита Мочевина
Моче�…
Источники:
- Хиггинс К. Расшифровка клинических лабораторных анализов. М.: БИНОМ. Лаборатория знаний, 2010. – 456 с.
- Клинические рекомендации «Железодефицитная анемия». Разраб.: Национальное гематологическое общество, Национальное общество детских гематологов, онкологов. – 2021.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
11396
13 Мая
-
4142
04 Мая
-
16486
16 Апреля
Похожие статьи
Биохимический анализ крови
Биохимический анализ крови: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Микроэлементы промо
В организме человека 86 микроэлементов. Часть из них называют структурными, так как они составляют 99% элементного состава человеческого организма. К ним относятся: углерод, кислород, водород, азот, кальций, магний, натрий, калий, хлор, фосфор, сера, железо.
Клинический анализ крови
Клинический анализ крови: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Гемоглобин
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
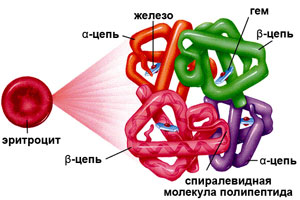
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Как же это происходит? Почему в легких гемоглобин забирает, а в тканях отдает кислород?
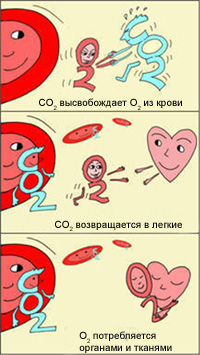
Эффект был описан датским физиологом Христианом Бором http://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Заболевания, связанные с изменением количества или структуры гемоглобина
- Повышение уровня гемоглобина наблюдается при эритроцитозах, обезвоживании.
- Снижение уровня гемоглобина наблюдается при различных анемиях.
- При отравлении угарным газом образуется карбгемоглобин (не путайте с карбоксигемоглобином!), который не может присоединять кислород.
- Под действием некоторых веществ образуется метгемоглобин.
- Изменение структуры гемоглобина называется гемоглобинопатией. Самые известные и частые заболевания этой группы – серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. См.гемоглобинопатии на сайте Всемирной организации здравоохранения http://www.who.int/mediacentre/factsheets/fs308/ru/index.html
Знаете ли Вы?
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.

Другие статьи раздела
-
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии). Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
-
Mycoplasma pneumoniae — возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
-
Азооспермия (azoospermia) — отсутствие сперматозоидов в эякуляте
-
Бактерии – одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
-
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
-
Гипофиз – непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане – гипофизарной ямке турецкого седла. Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
-
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
-
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
-
Делеция (ген.) – вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
-
Механизм обратной связи – система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
10. Гемограмма — понятие, показатели, интерпретация, проблема норм и нормальные значения у человека
Клеточный состав периферической крови у человека в норме достаточно стабилен, поэтому различные изменения его при заболеваниях имеют важное диагностическое значение. Из методов лабораторного исследования форменных элементов крови наибольшее распространение получил общеклинический анализ крови (общий анализ крови, гемограмма). Это исследование проводят в большинстве случаев амбулаторного обследования и практически всем стационарным больным.
Изменения клеточного состава периферической крови наблюдаются не только при патологии, но и при различных физиологических состояниях организма. На показатели крови могут оказать влияние физическая и эмоциональная нагрузка, сезонные, климатические, метеорологические условия, время суток, прием пищи и пр. Чтобы устранить влияние этих факторов, кровь для повторных анализов необходимо брать в одних и тех же условиях.
Под действием физических и химических факторов, с которыми сталкивается человек в современных экологических условиях, а также в своей трудовой деятельности, большинство изменений функции системы кроветворения имеет адаптационный характер. Лишь в крайних случаях эти изменения являются следствием выраженных повреждений. Выявить и правильно оценить адаптационные гематологические реакции на действие токсических факторов малой интенсивности трудно. Не всегда имеется четкая картина различных нарушений. Небольшие изменения количества клеток крови легко «теряются» среди физиологических колебаний, свойственных этим показателям, а сами изменения ограничены в своей направленности.
Патологические изменения крови крайне разнообразны и зависят не только от тяжести процесса, но и от общей реактивности организма и сопутствующих осложнений. Существенное влияние могут оказывать различные лечебные и диагностические воздействия: медикаментозное лечение, оперативные вмешательства, физиотерапия, лучевая терапия, диагностические процедуры.
При многих заболеваниях изменения крови имеют неспецифический характер. В этом случае их используют для динамического наблюдения за больным и в прогностических целях. Получаемым при клинико-лабораторном обследовании гематологическим показателям соответствуют хорошо осознанные, устойчивые представления, которые сложились в системе клинического мышления. Использование этих понятий в ходе обследования и лечения больного составляет неотъемлемый элемент лечебно-диагностического процесса.
В случае гематологических заболеваний исследование клеток крови приобретает первостепенное диагностическое значение. При этом лабораторное обследование необходимо проводить с учетом клинических данных и состояния больного. С помощью показателей клеток крови проводится дифференциальная диагностика, выбирается схема лечения, наблюдаются результаты терапии и т.д.
На распечатках результатов, выдаваемых современными гематологическими анализаторами, могут помещаться комментарии, описывающие возможную патологию, как например: ANISO — анизоцитоз, MICRO — микроцитоз, L SHIFT — смещение влево и т.д. Несмотря на то что морфология крови требует комплексной оценки, необходима интерпретация каждого параметра счета клеток крови в отдельности, а также совокупность клинико-диагностической значимости параметров гемограммы.
Гемограммой называют комплекс показателей, чаще всего получаемых в лаборатории при анализе цельной жидкой крови с помощью автоматизированных методов и дополнительного микроскопического исследования. Гемограмма обычно включает определение концентрации гемоглобина, количества эритроцитов, тромбоцитов, гематокрита, расчет эритроцитарных индексов, количества лейкоцитов, лейкоцитограмму и СОЭ.
Автоматические методы измерения сделали возможным ввести ряд дополнительных параметров: средний объем эритроцита (МСV — mean corpuscular volume), среднее содержание гемоглобина (МСН — mean corpuscular hemoglobin) и средняя концентрация гемоглобина (МСНС — mean corpuscular hemoglobin concentration). Особого внимания заслуживает показатель анизоцитоза эритроцитов — RDW (red cell distribution width), который является важным дополнительным критерием для диагностики и динамического наблюдения за результатами лечения пациентов с анемиями. Эритроцитарные индексы — средний объем эритроцитов (MCV), среднее содержание гемоглобина в эритроците (MCH) и средняя концентрация гемоглобина в эритроците были предложены в 1929 г. Максвеллом Уинтробом (Maxwell Myer Wintrobe) для оценки состояния красных клеток.
Для правильного клинического толкования параметров эритроцитов необходима комплексная оценка всех показателей в сочетании с другими лабораторными данными. С появлением анализаторов крови, регистрирующих множество параметров, интерпретация результатов анализа претерпела некоторые изменения. Некоторые из новых параметров, хотя и были приняты и используются в практике, до сих пор не имеют надежной шкалы показателей нормы. Это вносит существенные затруднения в трактовку результатов. Поскольку в настоящее время автоматизированный анализ крови становится все чаще первым этапом гематологического исследования и для врача важно уметь извлечь максимальную информацию из полученных данных.
Ряд показателей, входящих в общий анализ крови, нельзя признать совершенным. Число эритроцитов (·1012/л или Тэра/л) не вызывает возражений. Общее содержание гемоглобина в крови (г/л) при всей диагностической важности, не является точным показателем. Повышение концентрации гемоглобина может быть результатом истинной полицитемии или следствием потери плазмы. Снижение гемоглобина последует за уменьшением его синтеза, снижением количества эритроцитов или может произойти при гемодилюции. Раньше для уточнения причин этих состояний использовали цветной показатель (ЦП). Но если ЦП снижался и становился меньше единицы, это в равной степени указывало на:
— нарушение синтеза гемоглобина;
— снижение содержания гемоглобина в нормальных по объему эритроцитах;
— уменьшение среднего объема эритроцитов (микроцитоз).
Если ЦП вдруг оказывается более единицы, это не имеет отношения к синтезу гемоглобина, а зависит от преимущественного образования макроцитов. Таким образом, величина ЦП не может однозначно характеризовать синтез гемоглобина и его среднее содержание в одном эритроците. ЦП во многом зависит от объема клетки.
На величине ЦП основано деление анемий на гипо-, нормо- и гиперхромные. В гипохромных эритроцитах содержание гемоглобина снижено. Однако гипохромными, на основании вычисления ЦП, становятся эритроциты с нормальным содержанием гемоглобина (нормохромные), но с увеличенными размерами (макроциты). А к нормохромным относят эритроциты и с нормальным, и с пониженным содержанием гемоглобина (гипохромные), если пониженная концентрация в них гемоглобина компенсирует ЦП уменьшенным размером эритроцитов. Чтобы избежать подобной путаницы, было предложено заменить ЦП на MCH. Он отражает относительное содержание гемоглобина на единицу объема эритроцита и характеризует только синтез гемоглобина.
В зависимости от насыщения эритроцитов гемоглобином они могут быть нормо- и гипохромными.
Проблема нормальных величин в гематологии
Нормальные величины — результаты лабораторных исследований у заведомо здоровых людей. Нормальные величины служат ценными ориентирами для клиницистов, однако не могут служить абсолютными показателями здоровья и болезни, поскольку их значения для здоровых и больных людей нередко совпадают. Кроме того, результаты лабораторных исследований могут отличаться от истинных значений из-за ошибок измерений.
Опыт внедрения гематологических анализаторов в клинико-диагностические лаборатории показывает, что результаты, получаемые с их помощью, нередко входят в противоречие с устоявшимися в практике ЛПУ нормальными величинами.
Процедура установления нормальных величин какого-либо гематологического параметра Х включает в себя несколько этапов:
— выбор метода, с помощью которого будет производиться определение нормальных величин параметра Х;
— калибровка прибора, на котором будет производиться определение нормальных величин параметра Х;
— подбор здоровых доноров, в крови которых будет производиться определение нормальных величин параметра Х;
— измерение параметра Х у доноров;
— статистическая обработка полученных результатов.
Видно, что точное определение норм — весьма сложная и трудоемкая процедура, чреватая неоднозначностью и ошибками:
1. Выбор метода уже несет в себе ту точность, с которой могут быть установлены нормальные величины параметра Х. Если, например, устанавливать нормы концентрации эритроцитов с помощью камеры Горяева, то границы этих норм будут установлены с более чем 15% погрешностью, соответствующей таковой камерного метода.
2. Калибровка прибора — отдельная проблема (обсуждалась в разделе 6).
3. Зависимость значения многих параметров от пола и возраста требует обследования больших однородных половозрастных групп. Трудноразрешимой проблемой является установление нормальных значений у пожилых людей, когда различные заболевания затрудняют формирование однородных групп.
4. При измерении значений параметра Х необходимо тщательно контролировать правильность работы прибора, на котором производится измерение во время всего периода получения результатов. Также надо учитывать возможные ошибки преаналитического этапа взятия этих проб.
5. В результате статистической обработки, как правило, за границы нормальных величин принимаются следующие значения:
— нижняя граница нормальной величины = Хсреднее – 2·CV,
— верхняя граница нормальной величины = Хсреднее + 2·CV,
т.е. такие границы, в пределы которых попадает 95% всех измеренных значений. Это означает, что из 100 измеренных здоровых доноров у 5 человек значение исследуемого параметра может выходить за пределы нормальных величин!
Гемограмма, получаемая при исследовании на гематологическом анализаторе
Нормальные значения гемограммы взрослых, получаемые на гематологических анализаторах
Здесь и далее данные взяты из следующих источников:
1. Клиническая оценка лабораторных тестов: Пер. с англ. Под ред. Н.У. Тица. М: Медицина 1986, 480 с.
2. Энциклопедия клинических лабораторных тестов. Пер. с англ. Под ред. В.В. Меньшикова. М: Издательство «Лабинформ» 1997. 960 с.
Гемоглобин
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
Гемоглобин — основной дыхательный пигмент эритроцитов, способный нестойко связываться с кислородом и углекислым газом, что обеспечивает эритроцитам выполнение их основной функции — газообмена. Гемоглобин является хромопротеидом, состоящим из белка глобина и гема — соединения протопорфирина IX с железом. Гем придает гемоглобину характерную окраску. Присоединение к гему различных химических групп приводит к изменению окраски, на этом основано определение концентрации гемоглобина в крови. Значение гемоглобина можно вычислить по гематокриту, однако диагностическая ценность в этом случае весьма ограниченна.
Метод Сали для определения гемоглобина в третьем тысячелетии применять не рекомендуется.
Концентрация гемоглобина в гематологических анализаторах определяется фотометрически гемиглобинцианидным или гемихромным методом.
Ошибки измерения концентрации гемоглобина. Завышение в результате:
— повышенной мутности сыворотки при гиперлипидемии;
— гипербилирубинемии;
— криоглобулинемии;
— высокого лейкоцитоза;
— избытка нестабильных гемоглобинов (HbS, HbC).
Клинико-диагностическое значение
Повышение концентрации
Первичные и вторичные эритремии
Обезвоживание
Снижение концентрации
Анемии
Гипергидратация
Анемии определяются как снижение общего количества гемоглобина. При диагностике анемий всегда следует соотносить значение показателя с возрастом и полом пациента. Диагностика типа анемии требует проведения дополнительных биохимических и гематологических анализов.
У больных, у которых гемоглобин выше 75 Г/л, препараты железа могут вызвать в течение 10 дней рост гемоглобина на 20-30 г/л (это не означает компенсацию дефицита железа).
Переливание 500 мл крови (или 1 единицы эритроцитной массы — около 300 мл) больному массой тела 70 кг вызывает увеличение гемоглобина на 12 Г/л.
Эритроциты
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
Эритроциты — являются наиболее многочисленной группой форменных элементов крови.
У взрослых их содержание составляет около 5 млн/мкл. Зрелые эритроциты не содержат ядра и органелл, они приблизительно на 35% заполнены гемоглобином. Для эритроцитов характерен относительно низкий уровень обмена, что обеспечивает им довольно длительный период жизни — 100-120 сут.
Ежедневно у человека подвергаются деструкции и погибают около 200 млрд эритроцитов.
Определение количества эритроцитов проводят в счетной камере и с помощью счетчиков или анализаторов клеток крови. Используя так называемое «правило трех», можно по количеству эритроцитов (RBC) оценить концентрацию гемоглобина и показатель гематокрита. 3·RBC=Hb, 3·Hb=Ht. Эту зависимость можно использовать для оценки параметров крови, но только в тех пробах, где эритроциты имеют правильное строение.
В результате ряда последовательных клеточных превращений из эритробласта образуется эритроцит. Процесс сопровождается накоплением гемоглобина и изменениями ядра (конденсация хроматина, исчезновение ядрышек), а заканчивается выталкиванием ядра из клетки. Когда ядро покидает клетку, оставшегося содержимого клетки объемом 90 фл недостаточно, чтобы заполнить клеточную мембрану, площадь которой составляет 150 мкм2, а вместимость около 180 фл. В результате эритроцит приобретает форму двояковогнутого диска (дискоцит) диаметром 7-8 мкм и толщиной 1,8-2,0 мкм (рис. 1).
Площадь поверхности эритроцита двояковогнутой формы больше, чем если бы они имели форму шара, это позволяет эффективнее выполнять функцию газообмена, так как при такой форме диффузная поверхность увеличивается, а диффузное расстояние уменьшается. Кроме того, благодаря своей форме эритроциты обладают большей способностью к обратимой деформации при прохождении через узкие изогнутые капилляры диаметром 2-3 мкм. По мере старения клеток пластичность эритроцитов уменьшается. Пластичность понижена также у эритроцитов с патологически измененной формой (например, у сфероцитов и серповидных эритроцитов), что является одной из причин задержки и разрушения таких клеток в ретикулярной ткани селезенки.
Избыточная вместимость клеточной мембраны обеспечивает возможность значительного изменения объема эритроцита за счет осмотических явлений. Так, при помещении эритроцитов в гипотонический раствор вода проходит внутрь клетки и ее объем возрастает. В гипертоническом растворе наблюдается обратное явление.
В окрашенных препаратах эритроциты имеют форму дисков приблизительно одинакового размера с небольшим просветлением в центре (нормоцит).
Поскольку при автоматическом анализе эритроцитов в канал счета попадают еще и лейкоциты и тромбоциты, ошибка счета (увеличение) эритроцитов возрастает пропорционально лейкоцитозу, превышение количества лейкоцитов более 50 Г/л может искажать показатель среднего объема эритроцитов MCV.
Ложный «эритроцитоз» наблюдается при наличии в крови:
— гигантских тромбоцитов (с объемом >30 фл);
— криоглобулинов.
Ложное занижение количества эритроцитов сопровождает:
— агглютинацию эритроцитов;
— выраженный микроцитоз эритроцитов.
Клинико-диагностическое значение
Увеличение
Реактивные эритроцитозы, вызванные недостатком О2 в тканях:
Врожденные и приобретенные пороки сердца
Легочное сердце
Эмфизема легких
Пребывание на значительных высотах
Реактивные эритроцитозы, вызванные повышенным образованием эритропоэтинов
Поликистоз почек
Водянка почечных лоханок
Новообразования (гемангиобластома, гепатома, феохроцитома)
Влияние кортикостероидов
Болезнь и синдром Кушинга
Лечение стероидами
Эритремия
Дегидратация
Уменьшение
Анемии
Острая кровопотеря
Поздние сроки беременности
Гипергидратация
МСV (средний объем эритроцита)
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
МСV — средний объем эритроцита, определяемый практически всеми современными гематологическими анализаторами. MCV измеряется в фемтолитрах (фл). Значения, находящиеся в пределах 80-100 фл, характеризуют эритроцит как нормоцит, ниже 80 фл — как микроцит, а выше 100 фл — как макроцит.
На рис. 2 показаны типичные виды кривых распределения эритроцитов по объемам.
Имеется прямая зависимость между количеством эритроцитов в крови и средним объемом эритроцита (MCV) (рис. 3).
Количество эритроцитов и концентрация гемоглобина в крови регулируются организмом так, чтобы обеспечивалось их относительное постоянство, поэтому с увеличением содержания эритроцитов в определенных пределах пропорционально уменьшается их объем.
Большинство гематологических анализаторов позволяют охарактеризовать эритроциты объемом от 30 до 250-300 фл. Измерение MCV проводится одновременно с подсчетом эритроцитов по амплитуде импульсов, возникающих при прохождении клетки через апертуру, результаты могут быть выражены графически в виде гистограммы распределения эритроцитов по их объему.
MCV можно вычислить по величине гематокрита и количеству эритроцитов: МСV (фл) = Нt (%)·10/RВС (·1012/л).
Следует обратить внимание, что гематологические анализаторы вычисляют значение гематокрита, исходя из количества эритроцитов и их среднего объема.
MCV меняется в течение жизни: у новорожденных достигает 128 фл, в первую неделю снижается до 100 фл, к году составляет 77-79 фл, затем значения стабилизируются.
МСV является чрезвычайно стабильным показателем, не зависящим для взрослых людей от возраста, пола, расы. Коэффициент вариации этого параметра у пациентов в клинике составляет 6-7%.
MCV количественно выражает микроцитоз или макроцитоз эритроцитов, представляя собой более чувствительный параметр, чем визуальная оценка диаметра эритроцита в мазке, так как изменение диаметра эритроцитов на 5% приводит к увеличению их объема на 15%. Поэтому значение MCV может быть эффективно использовано для дифференциальной диагностики анемий.
Можно сказать, что MCV, а не диаметр является независимой характеристикой популяции эритроцитов. Оценка кривых Прайс-Джонса показывает, что диаметр эритроцитов подвержен заметным изменениям под влиянием различных физиологических факторов. Например, к концу дня средний диаметр эритроцитов значительно увеличивается, во время сна уменьшается, достигая наименьшего значения к 8 часам утра. Колебания размеров эритроцитов в течение дня достигают 8%. На размер эритроцитов влияют также физические нагрузки. Указанные изменения имеют гуморальную природу и связаны с изменениями физико-химических свойств крови. Усредненное значение осмолярности плазмы эквивалентно 0,93% раствору хлорида натрия со значением рН от 7,4 до 7,5. Кровь при автоматическом анализе разводится в изотоническом разбавителе, имеющем стабильные физико-химические параметры, поэтому измерение прибором MCV и анизоцитоза эритроцитов позволяет избежать артефактов визуальных методов оценки.
Однако существует ряд состояний, при которых оценка MCV затруднена. Так, при микросфероцитарной гемолитической анемии микросфероциты имеют диаметр меньше нормы, в то время как средний объем может быть в пределах нормы. В этом случае остается актуальным изучение мазка периферической крови с измерением диаметра эритроцитов и описанием их морфологии. При выраженном анизоцитозе, когда в крови присутствуют микро- и макроциты, MCV, являясь средним показателем объема всей популяции клеток, имеет значение в пределах нормы. Поэтому его надо учитывать в комплексе с показателем анизоцитоза (RDW) и эритроцитарной гистограммой. При холодовой аутоагглютинации MCV может быть ложно завышен, что устраняется хранением и анализом пробы при температуре +37 °С. Еще MCV может быть ложно завышен при диабетическом кетоацидозе вследствие гиперосмолярности плазмы. При разведении пробы крови изотоническим дилюентом анализатора происходит быстрое набухание эритроцитов, отсюда — макроэритроцитоз. Относительное снижение MCV может быть следствием повышенного содержания фрагментов эритроцитов в крови (коагулопатии потребления, механический гемолиз и пр.)
Клинико-диагностическое значение
Значение МСV <80 фл
Микроцитарные анемии
Железодефицитные анемии
Талассемии
Сидеробластические анемии
Анемии, которые могут сопровождаться микроцитозом
Гемолитические анемии
Гемоглобинопатии
Значение МСV >80 фл и <100 фл
Нормоцитарные анемии
Апластические анемии
Гемолитические анемии
Гемоглобинопатии
Анемии после кровотечений
Анемии, которые могут сопровождаться нормоцитозом
Регенераторная фаза железодефицитной анемии
Миелодиспластические синдромы
Значение МСV >100 фл
Макроцитарные и мегалобластные анемии
Дефицит витамина В12, фолиевой кислоты
Анемии, которые могут сопровождаться макроцитозом
Миелодиспластические синдромы
Гемолитические анемии
Болезни печени
Изменения МСV могут служить для определения нарушений водно-электролитного обмена. Повышение значений МСV будет свидетельствовать о гипотоническом нарушении, тогда как понижение значений МСV — о гипертоническом нарушении.
При оценке нарушений водно-электролитной системы можно пользоваться вычисленным МСV (формула дана выше). В этом случае не следует пользоваться значениями МСV, полученными с помощью гематологических анализаторов, так как они измеряют эритроциты в искусственной изоосмотической среде. Гематокрит для этого расчета должен быть определен унифицированным методом с помощью центрифугирования.
МСН (среднее содержание гемоглобина в эритроците)
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
МСН характеризует среднее содержание гемоглобина в отдельном эритроците и отражает массу гемоглобина в «среднем» эритроците. Этот параметр можно вычислить из показателя гемоглобина и количества эритроцитов: МСН (пг) = Нb (Г/л)/RBC(·1012/л).
МСН в эритроците и используемый ранее ЦП выражают одну и ту же характеристику клеток — среднее количество гемоглобина в эритроцитах, но первый показатель дает абсолютное значение в пикограммах, а второй дает содержание гемоглобина в эритроцитах в условных единицах: ЦП = Hb (Г/л)/RBC (·1012/л).
Значение ЦП можно вычислить по следующей формуле: ЦП = МСН (пг)/33,4.
Эти два показателя полностью заменяют друг друга, поэтому нет необходимости вычислять ЦП, если в лаборатории есть гематологический анализатор, рассчитывающий МСН автоматически. Кроме того, МСН в эритроците более объективный параметр, чем ЦП, который не отражает синтез гемоглобина и его содержание в эритроците.
Следует отметить, что повышение MCH свыше 34 пг (гиперхромия) зависит исключительно от увеличения объема эритроцитов, а не от повышенного насыщения их гемоглобином. Это объясняется тем, что концентрация гемоглобина в эритроците имеет предельную величину, не превышающую 0,37 пг на 1 фл объема эритроцита (при больших концентрациях гемоглобин может переходить в кристаллическую форму, что приводит к лизису эритроцита). При условии предельной насыщенности гемоглобином нормальные эритроциты, имеющие объем 90 фл, содержат 34 пг гемоглобина. Таким образом, гиперхромия всегда сочетается с макроцитозом. Снижение MCH до величин менее 27 пг называется гипохромией и может быть следствием как снижения MCV, так и ненасыщенности эритроцитов гемоглобином. Таким образом, гипохромия может быть и при нормоцитозе и даже при макроцитозе.
МСН в эритроците является чрезвычайно стабильным показателем, не зависящим для взрослых людей от возраста, пола, расы. Коэффициент вариации этого параметра у пациентов в клинике составляет 5-6%. Как диагностический параметр МСН является вторичным, зависящим от MCV и самостоятельной диагностической ценности не имеет. МСН коррелирует со значениями МСV и МСНС. Все состояния, приводящие к уменьшению объема и завышению количества эритроцитов, а также к занижению гемоглобина, приводят также и к уменьшению содержания гемоглобина в эритроците. Ложное завышение МСН получается при ошибках, вызывающих увеличение уровня гемоглобина и занижение количества эритроцитов.
По уровню MCH анемии делят на нормохромные, гипохромные и гиперхромные.
Клинико-диагностическое значение
Повышение
Гиперхромные анемии
Мегалобластные анемии
Анемии, сопровождающие цирроз печени
Снижение
Гипохромные анемии
Анемии при злокачественных опухолях
МСНС (средняя концентрация гемоглобина в эритроците)
Коэффициенты пересчета: 1/дл·0,62=ммоль/л; ммоль/л·1,61=г/дл.
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
МСНС отражает концентрацию гемоглобина в «среднем» эритроците, т.е. отношение содержания гемоглобина к объему клетки и характеризует степень насыщения эритроцита гемоглобином в процентах. Этот параметр можно высчитать из показателей гемоглобина и гематокрита: МСНС = Нb (г/дл)·100/Нt (%).
Среднее содержание гемоглобина в эритроците является самым стабильным, генетически детерминированным показателем, не зависящим для взрослых людей от возраста, пола, расы. Коэффициент вариации этого параметра у пациентов в клинике составляет 4-5%. Из всех эритроцитарных индексов МСНС меньше всего подвержен колебаниям при патологических состояниях, поэтому снижение этого показателя имеет большую ценность в диагностике железодефицитной анемии, талассемии, свинцовой интоксикации, некоторых гемоглобинопатий.
МСНС имеет хорошо определенный верхний предел, поэтому любая неточность, связанная с определением количества эритроцитов, гемоглобина и MCV, приводит часто к увеличению МСНС выше предельных значений. Этот параметр может быть использован как индикатор ошибки прибора или ошибки, допущенной при подготовке пробы к исследованию.
Как характеристика клетки средняя концентрация гемоглобина в клетке весьма стабильный параметр. Клетка может быть большой, а может быть маленькой, их может быть много, а может быть мало, но концентрация гемоглобина в клетке связана со структурой клетки и практически не меняется.
И поэтому границы нормы по МСНС являются очень узкими. Этот параметр эффективен для контроля качества. Стабильность калибровок, правильное функционирование прибора, полезно контролировать по текущему среднему значению МСНС. Оно должно колебаться в пределах 34±2 ед.
Любая неточность, связанная с определением гемоглобина, гематокрита, среднего объема эритроцита, приводит к завышению MCHC, поэтому этот параметр больше используется как индикатор ошибки прибора или ошибки, допущенной при подготовке пробы к исследованию, при выполнении разведения.
Клинико-диагностическое значение
Повышение
Гиперхромные анемии — сфероцитоз, овалоцитоз
Гипертонические нарушения водно-электролитной системы
Снижение до уровня <31 г/дл
Гипохромные анемии
Гипотонические нарушения водно-электролитной системы
Верхняя граница растворимости гемоглобина в воде составляет 37 г/дл, поэтому повышение, выходящее за рамки нормальных значений МСНС, отмечается чрезвычайно редко. Результаты выше
37 г/дл являются четким указанием на необходимость повторить анализ. Одной из возможных причин повышения MCHC является гемолиз в пробе.
Для определений нарушений в водно-электролитной системе следует анализировать изменения значений МСНС, а не их абсолютные величины.
При оценке нарушений водно-электролитной системы можно пользоваться вычисленным МСНС (формула дана выше). В этом случае не следует пользоваться значениями МСНС, полученными с помощью гематологических счетчиков, так как они измеряют эритроциты в искусственной изоосмотической среде.
RDW (анизоцитоз эритроцитов)
Нормальные значения: 11,5-14,5%.
Материал для исследования: венозная или капиллярная кровь. Кровь берется с ЭДТА (К3ЭДТА).
RDW является мерой различия эритроцитов по объему (анизоцитоза) и характеризует колебания объема эритроцитов. Объемы эритроцитов здорового человека подчиняются нормальному распределению с коэффициентом вариации около 12%. Аналогичную функцию выполняет кривая Прайс-Джонса, подсчет которой вручную чрезвычайно утомителен. Этот показатель подсчитывается большинством гематологических анализаторов как коэффициент вариации среднего объема эритроцитов: RDW (%) = SD/MCV (фл)·100%, где SD — стандартное отклонение объема эритроцитов от среднего значения.
Следует отметить, что нет состояний организма, которые сопровождались бы уменьшением этого коэффициента вариации.
Гематологические анализаторы улавливают анизоцитоз значительно эффективнее, чем это делается с использованием визуальных методов. Оценка степени анизоцитоза под микроскопом сопровождается целым рядом ошибок. При высыхании эритроцитов в мазке их диаметр уменьшается на 10-20%, в толстых мазках он меньше, чем в тонких. Полностью избавиться от артефактов позволяет только автоматизированный подсчет с использованием кондуктометрического метода, где сохраняется стабильность клеток и воспроизводимость результатов.
Высокое значение RDW означает гетерогенность популяции эритроцитов при наличии в пробе крови нескольких популяций эритроцитов (например, после переливания крови). При наличии в крови измененной, но достаточно однородной популяции эритроцитов (микроцитов) значения RDW могут быть в пределах нормы. RDW вместе с МСV служит для дифференциации микроцитарных анемий. RDW следует анализировать вместе с гистограммой эритроцитов, которую представляют большинство современных гематологических анализаторов. Гистограмма графически отражает частоту встречаемости эритроцитов разного объема.
Значения показателя RDW для одной и той же пробы крови, определяемые на приборах, производимых разными фирмами, существенно варьируют. Это происходит из-за того, что имеются существенные различия как в алгоритмах обработки самой кривой, так и в конструкции датчиков аппаратуры. Каждая лаборатория на практике должна установить, какие величины RDW являются нормальными и какова чувствительность данного прибора в отношении регистрации изменений этого параметра. Качество аппаратуры необходимо контролировать путем сопоставления получаемых результатов с
данными, которые дают на тех же образцах приборы заведомо более высокого класса точности.
Клинико-диагностическое значение
Значение МСV >80 фл, RDW в норме:
Анемии при хронических заболеваниях
Талассемия
Значение МСV >80 фл, RDW высокое:
Железодефицитные анемии
Сидеробластические анемии
Повышенное RDW отмечается при:
Макроцитарных анемиях
Миелодиспластических синдромах
Костно-мозговой метаплазии
Метастазах новообразований в костный мозг
Эритроцитарные гистограммы
Регистрируемые с помощью анализаторов эритроцитометрические кривые не соответствуют кривым Прайс-Джонса, которые можно получить при многочисленных и долгих измерениях диаметра эритроцитов под микроскопом (с помощью окулярного микрометра в мазке крови измеряют диаметр не более 300 эритроцитов за 4-6 ч рабочего времени). Дело в том, что диаметр эритроцитов при высыхании мазка уменьшается на 10-15%, в толстых мазках диаметр эритроцитов меньше, чем в тонких и, наконец, в направлении мазка диаметр эритроцитов больше, чем поперек. Кондуктометрический метод отражает объем клеток, поэтому нельзя сопоставлять кривые распределения эритроцитов по объему и по диаметру. Гистограмма распределения эритроцитов по объему имеет ряд особенностей при сравнении с таковой по диаметру:
1. Кривая распределения объемов значительно шире, коэффициент вариации при определении объема в 3 раза выше, чем при определении диаметра.
2. Кривая распределения диаметров эритроцитов является симметричной (Гауссова кривая), а распределение клеток по объему имеет сдвиг вправо, пропорционально коэффициенту вариации диаметров.
3. Если кривая распределения диаметров является полимодальной (имеет несколько пиков), то гистограмма распределения эр
Методы определения содержания гемоглобина в крови
Клиническое значение определения гемоглобина

- беременность и послеродовой период;
- болезни костного мозга;
- недостаток витамина В12 и фолиевой кислоты;
- снижение количества эритроцитов из-за нехватки железа;
- кровопотери.
Наряду с анемией встречается и завышение показателя:
- избыток эритроцитов или эритроцитоз. Встречается при злокачественных новообразованиях и болезнях костного мозга;
- эритроцитоз вследствие заболеваний сердца и сосудов;
- снижение количества плазмы крови, что делает ее вязкой и увеличивает количество кровяных телец в литре биологической жидкости.
Гемоглобин образуется в красных кровяных клетках после утраты ядра и созревания клетки, период жизни которой длится не более 120 дней. После утилизации клетки в селезенке, в кровь выделяется железо, которое доставляется в костный мозг. Далее этого образуются новые эритроциты.
Методы измерения гемоглобина в крови

- Гемиглобинцианидный.
- Гемихромный.
- Метод Сали.
- Аммиачный.
После любого из методов используют полуавтоматический анализатор, измеряющий спектр длины волны молекулы гемоглобина.
Автоматические методы не смогут распознать нарушения состава крови, но исключат ошибки в подсчёте параметров. Ручной метод используется с применением реактивов и биологической жидкости и способен определить лишь наличие или отсутствие клеток.
Гемиглобинцианидный метод
Гемоглобин имеет много форм, что затрудняет измерение его длины волны. Чтобы сделать процедуру проще, этот показатель переводят в метгемоглобин. Для точности результата используют специальное оборудование: мерные пробирки, фотоэлектроколориметр, трансформирующий раствор. Нормальный показатель длины волны – 540 нм, в этом диапазоне и работает прибор. Расчёты производят по формуле, а итоговый показатель переводят в граммы на литр (г/л).
Интересный факт!
Этот метод применяется для определения уровня гемоглобина все реже, в связи с опасностью для лаборантов, так как реактив может вызвать ожоги кожи и слизистых.
Гемихромный метод

Плюсом такого метода можно назвать быстроту реакции и получение результата за считанные минуты. Лаборатории часто применяют этот метод с использованием реактивов Ольвекс. Они полностью безопасны, долговечны и экономичны.
Метод Сали
Более устаревший способ анализа, который используют редко. Принцип заключается в добавлении в биоматериал хлористоводородной кислоты, что помогает перевести гемоглобин в солянокислый гематин. Далее добавляют дистиллированную воду до коричневой окраски и сравнивают цвета с контрольной пробиркой. Отметка на пробирке указывает на количество вещества в 100 г крови. Для получения результата в литре показатели умножают на десять и вычисляют показатель с помощью пропорции.
Аммиачный метод
Этот метод основан на предыдущих, только в качестве раствора используют аммиак 0,04%. Пробу настаивают для перехода всех форм гемоглобина в одну. Далее рассчитывают результат с помощью фотометра при длине волны 543 нм. Наиболее точным считается гемихромный метод. Таким образом можно исключить риск ошибки, так как все расчеты ведут, основываясь на показателях прибора. Кроме того, этот способ наиболее безопасный и не несет вреда для лаборантов.
Гемоглобин — это важный показатель для врача и пациента. С помощью такого анализа можно судить о наличии заболевания, кровотечения и состояния сердечно-сосудистой системы. Важно проводить анализ с целью профилактики, чтобы не допустить анемию или патологическое превышение показателя. Полученные данные лаборатории должны быть интерпретированы врачом. Только так можно избежать осложнений заболеваний и получить правильное лечение.
Оценка статьи:

Загрузка…
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ОСУЩЕСТВЛЕНИЮ КОНТРОЛЯ КАЧЕСТВА
ГЕМАТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
I. Общие положения
Одним из важных условий получения достоверных результатов гематологических исследований является внедрение в практику работы клинико-диагностических лабораторий контроля качества гематологических исследований, который представляет собой эффективную систему повышения качества определений.
При осуществлении контроля качества гематологических исследований следует руководствоваться методическими указаниями по осуществлению контроля качества работы клинико-диагностических лабораторий, которые даны в приложении к приказу МЗ СССР N 380 от 16 апреля 1975 года «О состоянии и перспективах развития лабораторной клинико-диагностической службы в стране».
В связи со спецификой гематологических исследований контроль качества их предполагает наличие определенных контрольных средств и материалов, которые не используются в других видах лабораторных исследований.
Внутри- и межлабораторный контроль качества гематологических исследований осуществляется под методическим руководством Всесоюзного научно-методического и контрольного центра по лабораторному делу, а также республиканских, краевых и областных организационно-методических и контрольных центров по лабораторному делу.
Врачи-лаборанты, выделенные для работы по контролю качества лабораторных исследований, внедряют внутри- и межлабораторный контроль качества в практику работы всех клинико-диагностических лабораторий на установленной территории.
II. Внутрилабораторный контроль качества
Внутрилабораторный контроль качества гематологических исследований может осуществляться с помощью методов, использующих специальные контрольные материалы или средства, и ряда методов, не требующих контрольных материалов:
1. Исследование параллельных проб.
2. Исследование случайных проб.
3. Исследование повторных проб.
4. Исследование смешанной пробы.
5. Метод средней нормальных величин (по данным больных).
6. Межлабораторный контроль качества.
Методы, основанные на использовании специальных контрольных материалов. Методы, использующие специальные контрольные материалы, дают возможность проводить контроль правильности и воспроизводимости результатов гематологических исследований. Основным требованием к контрольным материалам является их стабильность во времени. Приготовление контрольных материалов для гематологических исследований связано с трудностями, обусловленными кратким сроком жизнедеятельности клеток крови вне организма и быстрым нарушением их функциональных и физико-химических свойств в течение времени. По этой объективной причине срок годности контрольного материала ограничен.
В настоящее время рекомендуются следующие контрольные материалы:
1. Стандартный раствор гемиглобинцианида (производство ВНР).
2. Донорская кровь.
3. Раствор гемолизированной крови.
4. Консервированная кровь.
5. Фиксированные клетки крови (суспензия).
6. Клетки синтетических и других материалов, имитирующие клетки крови.
7. Контрольные мазки (окрашенные и неокрашенные, нормальные и патологические).
Контроль воспроизводимости
Контроль воспроизводимости (или сходимости) результатов гематологических исследований осуществляют с помощью контрольных материалов и расчета статистических параметров для оценки качества работы: средней арифметической величины , среднеквадратического отклонения (S) и коэффициента вариации (V). Для этого в течение 20 рабочих дней в контрольном материале исследуют выбранный компонент методом, применяемым в данной лаборатории. Если какой-либо из результатов резко отличается от остальных, то его оценивают с помощью критерия Т.
После установления статистических критериев строится карта контроля качества, представляющая собой систему координат, на оси абсцисс которой откладывают дни исследований, а на оси ординат — концентрацию компонента в соответствующих единицах. Через середину оси ординат параллельно абсциссе проводят прямую (обозначает среднюю арифметическую) и вверх и вниз от средней и параллельно ей проводят в соответствии с выбранным масштабом прямые, которые обозначают контрольные пределы и
.
Контрольная карта строится на каждый компонент и на одну серию контрольного материала. При перемене серии контрольного материала нужно провести 20-дневные исследования и построить новую контрольную карту.
Каждый результат, полученный в дальнейшем при исследовании контрольного материала той же серии в последующие дни, отмечается на карте в виде точки и служит для оценки воспроизводимости результатов данного компонента.
Пример 1. Построение контрольной карты для гемоглобина. В течение 20 дней определения содержания гемоглобина в контрольном растворе получены следующие результаты:
|
120 |
122 |
121 |
123 |
120 |
|
121 |
122 |
123 |
121 |
121 |
|
123 |
119 |
120 |
118 |
119 |
|
120 |
119 |
122 |
118 |
119 |
n = 20
Х — 2S = 120,5 — 3,2 = 117,3
При использовании контрольных карт целесообразно пользоваться предупредительными и контрольными критериями, ориентируясь на которые можно обнаружить недостатки в работе лаборатории.
Контроль правильности
Контроль правильности результатов гематологических исследований осуществляют с помощью контрольных материалов с исследованным содержанием компонентов, расчета статистических параметров и определения достоверности различий между полученным и паспортным значением.
При этом следует сделать 10 параллельных исследований компонента в контрольном материале, рассчитать из полученных результатов среднюю арифметическую величину и сравнить с паспортными данными этого компонента. Если полученный результат укладывается в пределы допустимых отклонений, имеющихся в паспорте контрольного материала, то правильность исследований — удовлетворительная. В противном случае следует оценить достоверность различий результатов с помощью статистических критериев (например, по тесту Стьюдента).
Методы, не требующие контрольных материалов
Исследование параллельных проб позволяет оценить воспроизводимость результатов исследований с помощью образцов крови больных. Для этого отбирают 10 случайных проб и каждую пробу исследуют дважды. Результаты таких дублированных анализов используются для характеристики качества исследований.
Пример 2. Для оценки воспроизводимости результатов подсчета лейкоцитов исследовали параллельно 10 образцов цельной крови с антикоагулянтом. Результаты представлены в табл. 5.
Таблица 5
ОПРЕДЕЛЕНИЕ ВОСПРОИЗВОДИМОСТИ С ПОМОЩЬЮ
ДУБЛИРОВАННОГО ПОДСЧЕТА КОЛИЧЕСТВА ЛЕЙКОЦИТОВ (10 ПРОБ)
|
N образца |
А |
В |
А — В |
(А — В)2 |
|
1 |
2 |
3 |
4 |
5 |
|
1 |
7.970 |
7.400 |
570 |
324.900 |
|
2 |
9.470 |
9.230 |
240 |
57.600 |
|
3 |
7.410 |
7.230 |
180 |
32.400 |
|
4 |
14.820 |
15.410 |
590 |
345.100 |
|
5 |
3.610 |
4.690 |
1.080 |
1.166.400 |
|
6 |
4.590 |
6.280 |
1.690 |
2.856.100 |
|
7 |
4.490 |
3.700 |
790 |
624.100 |
|
8 |
9.980 |
10.870 |
890 |
792.100 |
|
9 |
14.890 |
14.260 |
630 |
396.900 |
|
10 |
5.240 |
5.540 |
300 |
90.000 |
|
Сумма (А — В)2 = 6.688.600 |
S = 578,3.
Сначала находят разницу между значениями каждой пары, опуская знаки; затем разницу возводят в квадрат, все складывают и делят на 2n (где n — число пар), так как каждая пара представляет собой индивидуальную переменную и каждый член пары имеет свою собственную вариабельность.
Затем рассчитывают среднеквадратическое отклонение различий и строят контрольную карту для оценки воспроизводимости, аналогичную описанной выше для контрольных проб. Разницу между двумя анализами, сделанными для одной и той же пробы, отмечают каждый день на карте. Контрольные пределы карты — 0 +/- 2S (в примере для подсчета лейкоцитов — от -1,157 до +1,157). Результаты, попадающие вне контрольных пределов, с 95% вероятностью покажут существование каких-то нарушений в аналитической системе. В этом случае выявляют возможную причину большого разброса результатов и исследование повторяют более тщательно.
Исследование случайной пробы. Метод этот аналогичен предыдущему методу параллельных проб. Разница заключается в том, что вместо анализа всех проб лаборант выборочно исследует повторно пробы (одну или две пробы). Эти пробы могут также случайно выбираться заведующим лабораторией без ведома лаборанта. Таким путем зав. лабораторией оценивает воспроизводимость результатов, получаемых лаборантами.
Исследование повторных проб. Принцип метода состоит в повторном исследовании нескольких случайно выбранных проб, число которых пропорционально количеству проводимых исследований.
Сравнивая соответствующие пары результатов, получают объективные данные о качестве проведенных исследований. Повторные исследования проб должны проводиться после выполнения анализов текущего дня.
При применении этого метода 5% образцов должны исследоваться повторно.
Метод повторных определений дает возможность оценить качество работы аппаратуры и лаборанта во время исследований. Метод может использоваться в любой лаборатории вне зависимости от количества производимых анализов. Недостатком его является невозможность контроля правильности полученных результатов.
Пробы, выбранные для повторных исследований, могут исследоваться и на следующий день с целью калибровки аппаратуры. Для консервации клеток крови добавляют ЭДТА из расчета 1 — 2 мг на 1 мл крови. Хранить пробы необходимо при 4 °C.
Исследование смешанной пробы. При оценке воспроизводимости методом дублированных проб получают более близкие значения, чем обычно получают при наличии случайных ошибок. В методе смешанной пробы это исключено. Метод состоит в следующем: из группы образцов случайно выбирают два (А и В); из каждого образца А и В берут равные объемы и смешивают (образец С); исследуют все три образца.
Таблица 6
ОПРЕДЕЛЕНИЕ ВОСПРОИЗВОДИМОСТИ ПО СМЕШАННЫМ ПРОБАМ
|
Компонент |
А |
В |
С |
А + В ——- 2 |
Различие <*> |
|
Гемоглобин |
125 |
142 |
130 |
133,5 |
3,5 |
|
Гематокрит |
47 |
52 |
50 |
49,5 |
0,5 |
———————————
<*> Различие между величиной, полученной в смешанной пробе (С), и теоретической величиной .
Для построения контрольной карты по этому методу рекомендуют проводить исследования смешанных проб в течение 40 дней.
Метод средней нормальных величин
(по данным больных)
Метод основан на статистическом анализе результатов проб больных. Предполагается, что средняя величина, полученная по данной методике за один день или за определенное время, при большом объеме работы лаборатории (не менее 30 определений) приблизительно постоянна изо дня в день. Если в выполнении анализа вкрадывается систематическая ошибка, то это выразится в сдвиге средней величины результатов.
Для построения контрольной карты необходимо в течение 20 дней ежедневно рассчитывать среднюю нормальных величин данного компонента, где нормальную область рассматривают в пределах . Величины, выходящие за эти пределы, отбрасывают. Затем следует рассчитать среднюю и среднеквадратическое отклонение средних за 20 дней и ошибку средних для группы нормальных величин.
Затем рассчитывают контрольные пределы . Выбор пределов 2m, а не 3m, делает метод более чувствительным и увеличивает частоту выявления внеконтрольных величин.
После построения контрольной карты ежедневно находят среднюю нормальных результатов данного компонента и откладывают на карте. Чем больше результат входит в расчет средней, тем более эффективной становится средняя в определении действительной области.
Метод средней нормальных величин дает возможность обнаруживать ошибки, не выявленные другими методами контроля, и является действительным контролем на всех этапах исследования проб больных.
Межлабораторный контроль качества
Лаборатории, систематически участвующие в межлабораторном контроле качества гематологических исследований, могут использовать результаты контроля для оценки качества своей работы. Особенно ценными являются долгосрочные контрольные опыты.
Рассчитанное статически среднеквадратическое отклонение результатов данной лаборатории можно рассматривать как оценку точности в выполнении отдельного теста, а индекс среднеквадратического отклонения (IS) — как отражение способности лаборанта правильно выполнять анализы.
Осуществление контроля качества
отдельных гематологических параметров
Контроль качества исследований содержания гемоглобина. Для контроля качества определения гемоглобина используют стандартные растворы гемиглобинцианида с известным содержанием гемоглобина и специальные контрольные растворы (донорская кровь, гемолизированная кровь и консервированная кровь).
Стандартный раствор гемиглобинцианида (производство фирмы «Reanal», ВНР) используют для контроля правильности работы фотометров и построения калибровочной кривой при использовании гемиглобинцианидного метода определения гемоглобина в крови. Определение гемоглобина проводится фотометрическим методом путем определения содержания Hb по калибровочной кривой, выведенной для каждого прибора по серии стандартных растворов гемиглобинцианида с известной концентрацией гемоглобина.
Раствор гемолизированной крови. Для контроля воспроизводимости определения гемоглобина применяют растворы гемолизированной крови. Гемолизаты готовят из донорской крови (цитратной), можно с истекшим сроком годности, человеческой или лошадиной. Гемолизаты являются контролем на весь процесс исследования и используются при определении гемоглобина гемиглобинцианидным методом.
Основными требованиями к гемолизирующим веществам и растворителям являются следующие:
1) они должны быть бесцветными и прозрачными и не вступать в реакцию с красящими веществами крови;
2) величина разведения должна быть под контролем (рекомендуют 1% раствор крови).
Оптически прозрачные растворы готовят при помощи центрифугирования или используя некоторые растворы веществ: 0,1%, 0,25%, 0,4% растворы щелочи, 50% растворы мочевины, раствор сапонина и др. (ГОСТ 4212-76).
Раствор гемолизированной крови стабилен не менее года при условии хранения в холодильнике в темной посуде.
Для оценки воспроизводимости определений гемоглобина гемолизат исследуют в течение 20 дней, из полученных данных рассчитывают , S, V, контрольные пределы
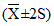
Для использования гемолизата в целях контроля правильности следует установить точную концентрацию гемоглобина в данном гемолизате.
Ограничения применения гемолизата:
1) дефицитность крови,
2) трудоемкость приготовления стерильного и гомогенного раствора в условиях лаборатории.
Для определения количества гемоглобина пользуются также колориметром простейшего устройства — гемометром Сали.
Доводку и коррекцию гемометров Сали производят, определяя одновременно содержание гемоглобина в данной пробе крови спектрофотометрически циангемиглобиновым методом. При этом производят 6 определений: в неразведенной крови и в разведениях 1:2, 1:3, 1:4, 1:5 и 1:6. Это необходимо потому, что результаты, полученные по методу Сали, не подчиняются закону Ламберта-Бера. Полученные данные наносят на систему координат (на листе миллиметровой бумаги), обозначая на ней также результаты, полученные циангемиглобиновым методом. Построенную кривую используют для вычисления результатов при последующих определениях до новой проверки гемометра. Если нет спектрофотометра, то измерение можно провести и на обычном фотометре, но с меньшей точностью.
Гемометр Сали является аналитически недостаточно надежным, и из-за своего несовершенства является источником многих ошибок.
Контроль качества подсчета клеток крови
К контрольным материалам, применяемым для контроля качества подсчета клеток крови, предъявляется ряд дополнительных требований:
1. Материал должен легко приводиться в гомогенное состояние, не агглютинироваться.
2. Физиологические константы и реологические свойства материала, находящегося в растворе жидкости (вязкость, плотность, индекс рефракции, электропроводность), должны соответствовать этим параметрам в крови, а форма и размер частиц — аналогичным клеткам крови.
3. Контрольный материал должен быть химически инертным.
Методики приготовления контрольных материалов изложены ниже.
Контроль качества подсчета количества эритроцитов
Контроль качества определения эритроцитов с помощью контрольных материалов осуществляется по принципу опосредованного контроля методом контрольных карт (табл. 7).
Таблица 7
ПРИМЕР РАСЧЕТА
И ПОСТРОЕНИЯ КОНТРОЛЬНОЙ КАРТЫ
ДЛЯ КОНТРОЛЯ КАЧЕСТВА ПОДСЧЕТА ЭРИТРОЦИТОВ В КРОВИ
2S │4.050.000
├─────────────────────────────────────────────────────────────
│3.925.000
_ ├─────────────────────────────────────────────────────────────
Х │3.800.000
├─────────────────────────────────────────────────────────────
│3.675.000
├─────────────────────────────────────────────────────────────
-2S │3.550.000
├─────────────────────────────────────────────────────────────
│
├────┴────┴────┴────┴────┴────┴────┴────┴────┴────┴───────────
│ 1 2 3 4 5 6 7 8 дни исследований
В течение 2 дней проводят 20 определений количества эритроцитов в консервированной крови, рассчитывают контрольные пределы и строят контрольную карту. Неудовлетворительная воспроизводимость результатов может быть обусловлена тем, что существуют объективные причины неточностей при определении количества эритроцитов в крови:
а) статистическая ошибка, обусловленная подсчетом малого количества клеток в крови;
б) распределительная ошибка, обусловленная неравномерным распределением клеток в камере;
в) механическая ошибка, обусловленная техническим несовершенством в устройстве счетной камеры.
Контроль качества подсчета лейкоцитарной формулы
в мазках крови
Необходимой предпосылкой для правильного учета морфологических особенностей клеток крови является удачно сделанный и хорошо окрашенный мазок крови. Невыполнение одного из этих условий ведет к неправильному распределению клеток крови или плохому выявлению их морфологических особенностей, а вместе с тем и к ошибкам в определении. Хорошо сделанный мазок крови должен отвечать следующим условиям:
1. Мазок должен начинаться на 1 — 1,5 см от узкого края предметного стекла и кончаться в 2 — 3 см от его другого края. Общая длина мазка должна охватывать 0,5 — 0,75 площади стекла.
2. Мазок должен быть равномерной толщины, а не волнообразным. Хороший мазок крови толще всего в начале, постепенно утончается и заканчивается в виде следа, как бы оставленного тонкой щеткой.
3. Мазок должен быть «свободным с края». Другими словами, слой крови не должен достигать длинного края стекла, а между ним и краем должно оставаться расстояние в несколько миллиметров.
Мазки, превышающие 3/4 общей длины предметного стекла, очень толсты. Эритроциты в большей части такого препарата прижаты один к другому или ложатся монетными столбиками. Это мешает правильно исследовать их морфологию. Мазки, короче 1/2 предметного стекла, очень тонки. Лейкоциты отделены друг от друга, сильно деформированы и неправильно распределяются. Отсутствие свободных от крови краев означает, что использованное при приготовлении мазка шлифовальное стекло касалось края предметного стекла. В таких случаях большие клетки перемещаются к краю мазка, и это вызывает неправильное распределение клеток. В неравномерном (волнообразном) мазке распределение клеток крайне неудовлетворительно. Толстые участки содержат больше лимфоцитов, тонкие — больше моноцитов и сегментоядерных клеток.
Для доброкачественного исследования морфологии клеток большое значение имеет правильная его фиксация и окраска.
Источники ошибок
Правильная фиксация мазка придает стойкость форменным элементам крови по отношению к содержащейся в красках воде, которая без фиксации мазка гемолизует эритроциты и изменяет строение лейкоцитов. Фиксация мазка, вызывая коагуляцию белка, прикрепляет препарат к стеклу.
В качестве фиксаторов предложены: метиловый спирт, этиловый спирт, смесь Никифорова, состоящая из равных частей этилового спирта и серного эфира. Лучшим фиксатором является метиловый спирт.
Недостаточная фиксация мазка дает слабую окраску нейтрофильной зернистости лейкоцитов и ведет к некачественной окраске клеток.
Качественная окраска мазка позволяет правильно дифференцировать клетки крови и их структуру при микроскопическом исследовании.
При применении любой методики окрашивания мазка крови важно точно соблюдать методические правила приготовления растворов и временные промежутки в течение процесса окрашивания. При приготовлении растворов необходимо учитывать рН воды; она должна быть нейтральной.
Партии красителя, существующие в продаже, имеют различную интенсивность окраски. Это обязывает опытным путем установить оптимальные концентрацию (разведение) и время окрашивания для каждого флакона красителя, которые устанавливаются путем окрашивания серии препаратов растворами с различной концентрацией красителя, меняя длительность его воздействия.
Для контроля качества подсчета лейкоцитарной формулы в мазках крови используют контрольные мазки. Контрольные мазки готовятся из капиллярной крови доноров и больных обычным способом на предметных стеклах, выполняя требования к правильному приготовлению мазков, фиксируются и окрашиваются. Затем контрольные мазки многократно просчитываются (не менее 20 раз) по 200 клеток квалифицированными специалистами (не менее 5 человек). Из полученных данных статистически рассчитываются критерии определения правильности подсчета мазка путем расчета и S. Для удлинения срока хранения мазка используют свойства клея БФ-6 образовывать тонкую прозрачную пленку, герметически приклеивающуюся к поверхности мазка и стекла и предохраняющую мазок от воздействия окружающей среды.
Кроме специально приготовленных мазков в качестве контрольных образцов используют мазки, исследованные в данной лаборатории и оказавшиеся наиболее трудными для диагностики. Контрольные образцы, нормальные и патологические, регулярно вводятся в поток клинических образцов, и с их помощью проверяют качество работы каждого сотрудника лаборатории. Подсчет лейкоцитарной формулы считается правильным, если результаты подсчета клеток входят в рассчитанные контрольные границы для каждого вида клеток крови.
III. Межлабораторный контроль качества
гематологических исследований
Межлабораторный контроль качества гематологических исследований осуществляется в соответствии с методическими указаниями (см. приложение 1 к настоящему приказу МЗ СССР).
Межлабораторный контроль качества гематологических исследований осуществляется периодически, не реже одного раза в квартал, под методическим руководством контрольного центра по лабораторному делу республики, края, области.
При межлабораторных экспериментах по контролю качества гематологических исследований можно рекомендовать для контроля следующие параметры:
1) содержание гемоглобина (в нормальной и патологической области концентрации);
2) число эритроцитов;
3) число лейкоцитов;
4) скорость оседания эритроцитов;
5) гематокритная величина;
6) цветовой показатель;
7) подсчет лейкоцитарной формулы.
В качестве контрольного материала при осуществлении межлабораторного контроля качества используют консервированную кровь, фиксированные клетки крови, контрольные образцы мазков крови. Методы их получения и приготовления изложены ниже.
Контрольные пробы рассылают в пузырьках или в запаянных ампулах. Количество материала рассчитывают, исходя из числа участвующих лабораторий и количества контролируемых показателей. Для удобства пересылки мазков по почте мазки готовят на рентгеновской пленке и пересылают в конвертах.
Контрольные мазки, фиксированные, но неокрашенные, рассылают с целью выяснения правильности окраски мазков крови. Окраска мазков производится в лаборатории — участнице межлабораторного эксперимента, а результаты подсчета лейкоцитарной формулы возвращаются в контрольный центр, где оцениваются правильность окраски и подсчета лейкоцитарной формулы.
Оценка результатов участников контроля. После получения результатов контрольных исследований контрольный центр определяет критерии оценки качества исследований и проводит статистическую обработку результатов. Критериями для оценки результатов участников могут служить: статистически обработанные усредненные данные всех участников контрольного эксперимента (при достаточно большом количестве лабораторий — не менее 20).
Количественные параметры (концентрация гемоглобина, величина гематокрита, клетки крови) оценивают статистически. Если результат укладывается в 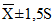
— удовлетворительным и
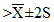
Для оценки результатов исследования мазков крови пользуются двумя критериями — удовлетворительно и неудовлетворительно. Удовлетворительно следует оценивать правильно подсчитанную лейкоцитарную формулу с описанием измененной морфологии эритроцитов и лейкоцитов.
При исследовании контрольных мазков патологической крови лаборатория должна дать краткое заключение о предполагаемой патологии.
Неудовлетворительным считают исследование при отсутствии описания измененной морфологии эритроцитов, а также если не обнаружен какой-либо вид патологии (палочкоядерный сдвиг, эозинофилия, лимфоцитарная и моноцитарная реакция, сдвиг формулы до миелобластов, наличие бластных форм, плазматических клеток и т.д.).
Формулы расчета аналитической надежности метода
xi — результат отдельного определения;
— средняя арифметическая;
xi max — наибольшее значение ряда результатов;
xi min — наименьшее значение ряда результатов;
— знак суммирования;
d — разница между параллельными определениями;
n — число определений;
S — среднее квадратическое отклонение;
V — коэффициент вариации;
T — тест на грубые ошибки;
F — тест оценки вариации методов.
и
— средние арифметические результатов сравниваемых методов;
m — ошибка средней арифметической.
x и y — результаты отдельных определений;
и
— средние арифметические каждого ряда определений;
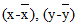
rх и ry — ранги ряда «х», «y»;
n — число пар сравниваемых величин;
— знак суммирования.
11) y = a + bx,
x — результаты сравнительного метода;
y — результаты метода-кандидата;
a — значение y при x, равном 0;
b — коэффициент пропорциональности или регрессии.
Методика приготовления контрольных материалов
Контрольный материал, приготовленный по одной из описанных ниже методик, обрабатывают и исследуют так же, как и пробы больных. Ошибки самого исследования нужно отличать от ошибок, присущих материалу. Для этого нужно быть в полной уверенности, что в результате хранения не произошло таких изменений материала, которые превысили бы воспроизводимость самого метода исследования.
Внутрилабораторный контроль воспроизводимости результатов гематологических параметров осуществляется по общепринятому методу контрольных проб с построением контрольных карт и последующим ежедневным откладыванием значений контрольных проб.
Для определения истинных значений числа клеток в контрольных материалах используют прямой подсчет разведенного материала в камере для подсчета клеток. Этот метод является достаточно точным при применении проверенных (откалиброванных) камер и проведении довольно большого числа подсчетов для снижения случайных ошибок исследования. Средняя арифметическая из числа подсчетов является критерием для оценки правильности исследований.
I. Контрольные материалы для исследований
гемоглобина
Приготовление раствора гемолизата. Для приготовления гемолизата используют:
1) консервированную человеческую кровь (цитратную), можно с истекшим сроком годности;
2) консервированную лошадиную кровь;
3) донорскую человеческую кровь, свежую, собранную в сосуд с 0,6 моль/л раствором лимоннокислого натрия из расчета 1:5.
200 мл полученной цитратной крови центрифугируют при 3.000 об./мин. в течение 30 мин. Плазму сливают. К эритроцитам добавляют 100 мл стерильной дистиллированной воды и тщательно перемешивают на магнитной мешалке в течение 30 мин. Раствор помещают в холодильник при -20 °C на 24 часа. На следующий день раствор размораживают и вновь тщательно перемешивают в течение 30 мин.
Затем раствор фильтруют в асептических условиях через стеклянный фильтр millipore (соответствует N 4 — с величиной пор 4 — 10 мкм — отечественного производства) и разливают в стерильные бутылочки по 1 мл. Хранят раствор в холодильнике, оптимальная температура -20 °C. Стабилен в течение года.
Гемолизат используется для контроля воспроизводимости результатов определения гемоглобина с помощью контрольных карт. При наличии в лаборатории контрольного материала с известным содержанием гемоглобина в растворе гемолизата можно определить точную величину гемоглобина и использовать для контроля правильности.
При определении концентрации гемоглобина в крови необходимо избегать следующих ошибок.
1. При взятии крови:
а) использование неточно откалиброванных пипеток (0,02 мл),
б) неточное заполнение капилляра кровью,
в) неточное пипетирование физиологического раствора и крови.
2. При разведении:
а) использование неточно откалиброванной пипетки (5,0 мл),
б) недостаточно чистая посуда (следы крови),
в) недостаточное прополаскивание реактивом,
г) неточное пипетирование реактивов,
д) использование старых, неправильно приготовленных реактивов.
3. При измерении:
а) использование неоткалиброванного прибора,
б) использование грязных или непарных кювет,
в) мутность растворенной пробы.
II. Контрольные материалы для подсчета
числа эритроцитов
1. Консервированная кровь. Консервированную кровь сохраняют вне организма в течение длительного срока с поддержанием всех биологических и функциональных свойств. Консервированная кровь должна сохраняться без явлений деструкции эритроцитов.
Для приготовления консервированной крови в качестве стабилизаторов используются антикоагулянты, и на основе этих веществ предложены следующие консервирующие растворы (pH растворов доводят до требуемого значения 0,1 моль/л NaOH):
I. 1) Натрий лимоннокислый (цитрат натрия) — 2 г ч, чда.
2) D (+) — Глюкоза — 3,0 г, безводная, ч, чда.
3) Левомицетин — 0,075 г фарм.
4) Бидистиллированная вода — до 100 мл.
pH раствора доводится до 4,5 — 5,1. Консервированная кровь готовится путем добавления к крови консервирующего раствора в отношении 4:1.
II. 1) Лимонная кислота — 1,0 г, чда, хч.
2) D (+) — Глюкоза — 3,0 г, безводная, ч, чда.
3) Натрий фосфорнокислый трехзамещенный — 0,75 г, ч, чда.
4) Бидистиллированная вода — до 100 мл.
pH раствора доводят до 5,7 (5,5 — 6,0). Консервированную кровь готовят путем добавления к крови консервирующего раствора в отношении 4:1.
III. 1) Глюкоза — 25 г, безводная, ч, чда.
2) Натрий лимоннокислый — 22 г, чда.
3) Лимонная кислота — 8 г, ч, чда, хч.
4) Бидистиллированная вода — до 1000 мл.
pH раствора доводится до 6,4. Консервированная кровь готовится путем добавления к крови консервирующего раствора в отношении 3:1.
IV. 1) D (+) — Глюкоза — 2,0 г, безводная, ч, чда.
2) Натрий лимоннокислый — 300,0 г, ч, чда.
3) Натрий фосфорнокислый безводный однозамещенный — 0,15 г, ч, чда.
4) Бидистиллированная вода — до 1000 мл.
pH раствора доводится до 6,9. Консервированная кровь готовится путем добавления к крови консервирующего раствора в отношении 2:1.
V. 1) D (+) — Глюкоза — 20,5 г, безводная, ч, чда.
2) Натрий лимоннокислый — 8,0 г, ч, чда.
3) Лимонная кислота — 0,55 г, ч, чда, хч.
4) Натрий хлористый — 4,2 г, ч, чда, хч.
5. Бидистиллированная вода — до 1000 мл.
pH раствора доводится до 6,1. Консервированная кровь готовится путем добавления к крови консервирующего раствора в отношении 4:1.
В консервированных растворах эритроциты сохраняют свои функциональные и биологические свойства в течение нескольких дней при 20 °C, а в условиях холодильника — до 20 — 30 дней.
Суспензия фиксированных эритроцитов. При фиксации эритроцитов происходят физико-химические изменения в мембране эритроцитов, что предохраняет клетки от лизиса. В качестве фиксирующего материала предложены формальдегид, танин, глутаральдегид, ледяная уксусная кислота.
Наибольшее распространение получила методика фиксации эритроцитов глутаральдегидом. После фиксации размер клеток изменяется в течение первых 3 — 4 дней, затем остается стабильным от нескольких месяцев до нескольких лет.
Методика приготовления. Кровь собирают в сосуд с антикоагулянтом ЭДТА (5 мг сухого ЭДТА на 1 мл крови). Затем трижды промывают изоосмотическим фосфатным буфером. Для этого к собранной крови добавляют раствор буфера в 2 раза больше объема крови и полученную суспензию центрифугируют в течение 10 мин. при 3000 об./мин. Промытые эритроциты фиксируют 0,25% раствором глутаральдегида в фосфатном буфере, который постепенно добавляют к эритроцитам в отношении 1:10 (кровь:фиксирующий раствор). Фиксация производится при комнатной температуре в течение часа. Фиксированные эритроциты трижды промывают дистиллированной водой и доводят до окончательного объема водой или 12,5% раствором глицина. Затем добавляют 3 мл 1% раствора азида натрия. Тщательно перемешивают на магнитной мешалке в течение 30 минут и разливают в стерильные стеклянные пузырьки по 2 — 5 мл. Хранение проводят при 4 °C. Перед использованием материал перемешивают на магнитной мешалке в течение 10 мин.
Приготовленную суспензию хранят в темных склянках в холодильнике при 4 °C. Срок хранения — от 6 месяцев до 1 года. Суспензию используют для контроля качества подсчета эритроцитов автоматическим и камерным методами.
Приготовление изоосмотического фосфатного буфера 154 ммоль/л, pH 7,4:
0,246 г однозамещенного фосфорнокислого калия и 3,187 г двузамещенного фосфорнокислого калия трехводного растворяют дистиллированной водой в мерной колбе на 100 мл.
Ограничения применения консервированной крови
и фиксированных клеток крови
1. Дефицитность крови.
2. Фиксированные эритроциты обладают большей вязкостью по сравнению с кровью (прилипают к стенкам и не переходят в состояние суспензии).
3. При фиксировании клеток изменяется их электрический заряд, что влияет на правильность результатов при автоматическом подсчете клеток.
4. Фиксированные клетки более регидны, что затрудняет их прохождение через отверстия анализатора и меняет амплитуды пульсовой волны (при автоматическом подсчете).
5. В первые 3 — 5 дней происходит уменьшение объема фиксированных эритроцитов, затем их размеры остаются стабильными в течение 6-ти месяцев.
6. Дефицитность реактивов (глутаральдегида и азида натрия).
При подсчете количества клеток крови следует избегать следующих ошибок.
1. При взятии крови:
а) использование неточно откалиброванных пипеток;
б) неточное пипетирование и разведение крови,
в) недостаточно быстрый забор крови и размешивание ее с реактивом для разведения.
2. При разведении:
а) неточное пипетирование реактива для разведения,
б) использование грязной посуды и пипеток,
в) использование неточно откалиброванных пипеток,
г) использование некачественного реактива для разведения, вызывающего гемолиз эритроцитов.
3. При измерении:
а) несоблюдение правил подготовки счетной камеры,
б) несоблюдение временных промежутков при подсчете количества эритроцитов в камере, необходимых для оседания клеток на сетку,
в) нетщательное перемешивание крови перед заполнением камеры,
г) подсчет клеток в недостаточном количестве квадратов и несоблюдение правил подсчета,
д) использование неоткалиброванного прибора при автоматическом подсчете клеток.
Метод сохранения мазков
для многократного микроскопирования
К 0,5 мл клея БФ-6 прибавляют 3 мл абсолютного спирта, 3 мл бутилового спирта и тщательно перемешивают до получения прозрачной жидкости с желтоватым оттенком. Хранят в склянке с хорошо притертой пробкой.
На предметное стекло с мазком наносят пипеткой большую каплю пленкообразующей смеси и, покачивая стекло, дают ей равномерно растечься по его поверхности. Избыток смеси с края стекла удаляют и препарат кладут на горизонтальную поверхность для высушивания. При комнатной температуре пленка высыхает за 15 — 20 мин. Для ускорения сушки мазок можно поместить в термостат при 60 °C.
Начальник Главного управления
лечебно-профилактической помощи
А.М.МОСКВИЧЕВ
Приложение N 3
к приказу Министерства
здравоохранения СССР
от 23 апреля 1985 г. N 545
Скачать документ целиком в формате PDF