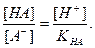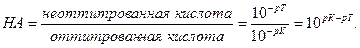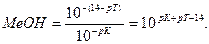В университете на практическом курсе аналитической химии мне приходилось много титровать. Я помню осторожное дозирование титранта стеклянной бюреткой, неудобный процесс повторного наполнения бюретки и постоянное опасение, что я неправильно выбрала конечную точку.
Все студенты в группе получали разные результаты, но мы так и не поняли почему. В те годы у меня было мало знаний. Сейчас, после 10 лет опыта титрования, я поняла, что результаты ручного титрования очень сильно зависят от человека, который проводит анализ. Ниже я перечислю основные источники ошибок, и как вы можете их избежать.

Правильный выбор индикатора
Значение pH конечной точки титрования зависит от константы кислотной диссоциации (Ka) используемых кислоты и основания. Если сильное основание титруют сильной кислотой, значение pH в конечной точке составляет около 7. Титрование сильного основания слабой кислотой смещает конечную точку в сторону диапазона щелочи. Титрование сильной кислоты слабым основанием – в зону кислот. Это объясняет, почему при кислотно-щелочном титровании используются несколько разных индикаторов. Какой мы выберем?
На приведенной выше диаграмме показаны самые популярные pH индикаторы. Из графика видно, что не получите правильных результатов при pH конечной точки = 7, если в качестве индикатора вы используете кристаллический фиолетовый или метиловый оранжевый. К счастью, в большинстве стандартов и в стандартных методиках работы индикатор уже указан. Если будете следовать инструкциям, все будет хорошо!

Субъективность распознавания конечной точки
Проблемы начинаются в процессе определения конечной точки. Вы когда-нибудь задумывались о тонкостях изменения цвета?
На рисунке вы видите пять стадий кислотно-щелочного титрования c(HCl) = 1 моль/л с c(NaOH) = 1 моль/л. Единственная разница между соседними фотографиями заключается в одной капле титранта. На каком из них истинная конечная точка?
Может это конечная точка на рисунке 1 с бледно-розовым оттенком? Или на картинке под номером 3 с более интенсивным цветом? Или даже на картинке 5, где розовый цвет наиболее яркий? Между 1 и 5 было добавлено всего четыре капли титранта. Одна капля – это 50 мкл, а добавленный в сумме объем составляет 200 мкл титранта или примерно 7,3 мг соляной кислоты. Для фармацевтического анализа – это колоссальная ошибка.

Считываем объем на бюретке
Вы помните, как правильно считывать значения на бюретке? Нужно убедиться, что фиксируете значение мениска четко по горизонтали. Знаете почему?
Значение объема зависит от угла, под которым вы смотрите на бюретку. На данном рисунке данные отличаются от фактического значения до 0,2 мл (200 мкл) в зависимости от угла обзора. Чем больше ваш ракурс отклоняется от горизонтали, тем более неточными будут значения и сам результат. Вы можете допустить среднюю ошибку 200 мкл. Но для титрования это недопустимо много, на предыдущем примере я рассказала почему.
Повышаем объективность и точность оценки
Как можно исключить эти ошибки? Легче всего просто обойти возможную неточность. Решением станет использование электронной бюретки. Все, что вам нужно сделать, это заполнить ее титрантом, а затем нажать кнопку. Устройство автоматически измерит объем и выдаст оцифрованный результат. Использование электронной бюретки уже обеспечит высокий уровень объективности ваших результатов.
Электронная бюретка также повысит и точность данных. Мне не нужно рассказывать вам, насколько важна точность в аналитической химии, но я приведу пример. Представьте, что вы определили чистоту золота в 90%, а на самом деле оно чистое на 99%. Вы бы потеряли много денег, продавая свое золото с этой иллюзией!
Ранее я показала, что визуальное распознавание конечной точки с цветовым индикаторам может привести к ошибкам до 200 мкл. Неточность ручной бюретки может вызвать погрешность в дополнительных 200 мкл. Хотя электронная бюретка не помогает добиться лучшей объективизации при распознавании конечной точки, она добавляет куда меньший объем титранта: вместо прежних 50 мкл на каплю, всего 0,25 мкл в зависимости от объема используемой бюретки. Это существенно снизит ошибку при распознавании конечной точки. Самые распространенные бюретки описаны ниже:
| Объем цилиндра бюретки (мл) | Мин. добавляемый объем (µл) |
| 5 | 0.25 |
| 10 | 0.50 |
| 20 | 1.00 |
| 50 | 2.50 |
Следующий шаг: автоматическое титрование
Если вы хотите закрыть все источники ошибок, про которые мы говорили, вам придется перейти на автоматическое титрование или автотитрование. В этом случае вы будете использовать электрод для анализа изменения pH в образце и математический алгоритм для детектирования конечной точки — индикатор вам больше не потребуется. Кроме того, вы получите ту же точность, что и с электронной бюреткой.
Ознакомьтесь с соответствующей записью в блоге для получения дополнительной информации.
How to Transfer Manual Titration to Autotitration
Author

Iris Kalkman
Product Specialist TitrationMetrohm International Headquarters, Herisau, Switzerland
I вариант.
1. Что изучает аналитическая химия?
а) Изучает соединения с углеродом различных элементов, а также их свойства и методы определения
б) Это наука о методах идентификации и обнаружения элементов и их соединений+
в) Наука о законах строения, структуры и превращения химических веществ
2. Что из перечисленного не является химическим методом анализа?
а) Гравиметрия
б) Титриметрия
в) Рентгенография+
3. В чем состоит особенность сильных электролитов?
а) Степень диссоциации более 30 % +
б) Степень диссоциации стремиться к нулю
в) Степень диссоциации находится в пределах 5-30 %
4. Чему равно ионное произведение воды?
а) 10-14 +
б) 14
в) < 1
5. Что такое буферная емкость раствора?
а) Это предельное количество воды, которые можно прибавить к данному буферу, с изменения его рН не более, чем на 1
б) Это предельное количество кислоты или основания, которые можно прибавить к данному буферу с изменением рН не более 10 %
в) Это предельное количество кислоты или основания, которые можно прибавить к данному буферу без изменения его рН +
6. Какая из приведенных формул соответствует расчету рН?
а) pH = 14 -[OH–]
б) pH= -lg[H+] +
в) рН= -lg[OH–]
7. Гидролиз – это процесс:
а) растворения в воде
б) взаимодействия ионов растворенных в воде соли с ионами воды +
в) растворения в воде под действием тока
8. Как снизить ошибку титрования?
а) Максимально растянуть величину скачка и правильно подобрать индикатор +
б) Сделать несколько раз титрование
в) При титровании применять более концентрированные растворы
9. Что такое конечная точка титрования?
а) Момент или точка титрования, в которой некоторое свойство раствора (например, окраска) претерпевает заметное изменение +
б) Это точка титрования, при которой добавлен избыток титранта
в) Это точка титрования, при которой достигнут рН=7
10. Условие, при котором выпадает осадок:
а) Если ионное произведение меньше величины произведения растворимости
б) Если ионное произведение превышает величину произведения растворимости +
в) Если ионное произведение равно величине произведения растворимости
11. Что такое декантация?
а) Укрепление дисперсных частиц, с последующим перенесением на фильтр
б) Промывание осадка, перенесенного на фильтр
в) Промывание осадка в стакане с отстаиванием и сливанием жидкости с раствора +
12. В каком из ниже перечисленных методов рабочим раствором является раствор соли ртути?
а) Аргентометрия
б) Роданометрия
в) Меркуриметрия +
13. Какое из ниже приведенных названий не соответствует трилону Б?
а) Хелатон III
б) Комплексон II +
в) ЭДТА
14. Что из перечисленного не является металлоиндикатором?
а) Мурексид
б) Метиленовый голубой +
в) Эрихром чёрный Т
15. Какой из реагентов не используют при щелочном сплавлении?
а) Пиросульфат калия +
б) Едкий натр
в) Кальцинированную соду
16. Что такое маскирование?
а) Осаждение мешающих веществ с последующим отделением осадка
б) Перевод определяемого вещества в более удобную для анализа форму
в) Устранение влияния присутствующих в растворе веществ на определение какого-либо элемента+
17. Какой может быть ошибка определения?
а) Постоянной
б) Временной
в) Систематической+
18. Что такое точность анализа?
а) Близость результатов друг к другу из выборки n
б) Это значение, до которого необходимо округлить полученный результат
в) Это качественная характеристика близости к нулю всех видов ошибок+
19. Что такое воспроизводимость?
а) Эта мера того, как повторяются результаты при многократном проведении анализа+
б) Параметр, характеризующий близость экспериментальных и истинных значений измеряемой величины
в) Это минимальное расхождение между результатами, полученными при испытании одной пробы
20. В каком из случаев используют метод добавок?
а) При больших концентрациях элементов
б) При малых концентрациях элементов+
в) При невозможности использования метода сравнения
II вариант.
1. Как выбрать длину волны при проведении фотометрических определений?
а) Измерения проводят при длине волны, соответствующей максимуму поглощения+
б) Измерения проводят при длине волны, соответствующей минимуму поглощения
в) Измерения проводят при любой длине волны при условии, что прибор измерит данную оптическую плотность
2. В каких координатах строят калибровочный график?
а) Оптическая плотность – длина волны
б) Аналитический сигнал – концентрация+
в) Объем раствора – концентрация
3. Какая из горючих смесей, используемых в атомно-абсорбционной спектроскопии, дает наибольшую температуру?
а) Ацетилен – воздух
б) Закись азота – ацетилен+
в) Пропан – воздух
4. Что определяют методом пламенно-эмиссионной спектрометрии?
а) Содержание тугоплавких элементов
б) Содержание тяжелых металлов
в) Содержание щелочных металлов+
5. На чем основан потенциометрический метод?
а) На измерении разности потенциалов между электродами+
б) На измерении ЭДС
в) На измерении концентрации определяемого иона в растворе
6. Что такое хроматография?
а) Метод определения массы вещества, полученного на погруженном в раствор электроде
б) Метод анализа, основанный на исследовании взаимодействия излучения с атомами и молекулами вещества
в) Метод разделения веществ, основанный на распределении компонентов между двумя фазами подвижной и неподвижной+
7. Фактор пересчета в гравиметрическом анализе – это:
а) пересчет определяемого вещества на сухое состояние
б) сколько граммов определяемого вещества содержится в 1 г осадка+
в) отличие количества полученного осадка от теоретического выхода
8. Какой крепости получится кислота при смешении 2 кг 50% H2SO4 и 1 кг 20%?
а) 40 %+
б) 35 %
в) 45 %
9. Что такое стандартизация раствора?
а) Это установление его точной концентрации+
б) Приготовление раствора из стандарта
в) Установление срока годности раствора
10. Пробу массой m высушили и масса высушенной пробы m1, какой формулой воспользоваться для расчета влаги в %:
а) m1*100/ m
б) m*100/ m1
в) (m – m1)*100/ m+
11. У.Бергман:
а) основатель качественного анализа
б) основатель химической науки
в) основатель количественного анализа
г) предложил колориметрический метод анализа
д) разработал основы систематического анализа катионов металлов+
12. Что такое инструментальные индикаторы?
а) средства качественного определения степени мешающего влияния сопутствующих веществ на определение данного вещества
б) предельная селективность
в) количественная характеристика селективности
г)приборы, фиксирующие рН, окислительно-восстановительный потенциал, электрическую проводимость раствора или другие свойства среды.+
13. Пробоотборным устройством является:
а) биосенсор
б) барометр
в) батометр+
г) фотометр
14. Что из представленного является методом проведения качественного анализа?
а) дробный анализ+
б) гравиметрический метод
в) титрования
г) биохимический
15. Что такое относительная масса структурного элемента вещества, эквивалентная в химической реакций одному атому водорода или одному электрону?
а) молярная атомная масса
б) моль
в) относительная эквивалентная масса (эквивалент)+
г) молярная эквивалентная масса (грамм/эквивалент)
16. Отметьте метод количественного анализа, не используемый в хромотографии:
а) абсолютная калибровка
б) внутренняя нормализация
в) внутренного стандарта
г) метод осаждения+
17. Что служит индикатором в йодометрии?
а) свежеприготовленный 3% раствор гидроксида меди (II)
б) свежеприготовленный 1% раствор уксусной кислоты
в) свежеприготовленный 2% раствор гидроксида кальция (II)
г) свежеприготовленный 1% раствор крахмала+
18. Какое соединение образуется в результате двух процессов комплексообразования и адсорбции в йодометрии?
а) красного цвета
б) синего цвета+
в) зеленого цвета
г) фиолетового цвета
19. Выберите типы стандартных рабочих растворов используют в титриметрическом анализе:
а) вторичный/третичный
б) первичный/третичный
в) первичный/четвертичный
г) первичный/вторичный+
20.Условная или реальная частица, которая может присоединять, высвобождать, замещать один ион водорода в кислотно-основных реакциях или быть эквивалентна одному электрону в окислительно-восстановительных реакциях это:
а) эквивалент+
б) моль
в) титрант
г) аликвот
В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
=
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
(4.2)
где
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
– объем аликвоты титруемого раствора,
мл;
–
концентрация и
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
=
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Погрешности титрования
Методика титриметрического анализа многостадийна, погрешности могут возникать на любой стадии её проведения: при измерении массы навески, объёма приготовленного раствора или аликвоты, при проведении титрования, обнаружении конечной точки титрования. В зависимости от причины возникновения погрешности в титриметрических методах анализа, как и погрешности вообще, могут быть:
К появлению систематических погрешностей в титриметрических методах анализа может приводить:
· использование неверно градуированной посуды;
· неправильная техника титрования (слишком быстрое добавление титранта);
· неточное считывание объёма титранта, израсходованного для титрования;

Погрешности, обусловленные несовпадением точки эквивалентности и рТ индикатора, называются индикаторными.
Индикаторные погрешности в кислотно-основном титровании удобно разделить на 4 вида:
Водородная индикаторная погрешность может возникнуть при недотитровании сильной кислоты (в таком случае погрешность отрицательная) либо когда сильная кислота используется в качестве титранта и добавлена в избытке (положительная погрешность).
Если концентрации титруемого вещества и титранта одинаковы, то Vконечн = 2V0, тогда
Гидроксидная погрешность может возникнуть при недотитровании сильного основания (отрицательная погрешность) либо в том случае, когда сильное основание используется в качестве титранта и добавлено в избытке (положительная погрешность).
Кислотная и основная индикаторные погрешности могут быть только отрицательными (если, конечно, исключить гипотетический случай использования слабой кислоты или основания в качестве титранта).
Величина кислотной погрешности представляет собой молярную долю неоттитрованной кислоты.
Если 
Формула для расчёта основной погрешности выводится аналогичным образом и выглядит следующим образом
или в упрощённом виде
Пример 13.1.Рассчитать систематическую индикаторную погрешность титрования 0,1 М HCl и 0,1 М HCOOH при использовании в качестве титранта 0,1 М NaOH и индикатора метилового оранжевого (рТ = 4).
В случае HCl титрование заканчивается при рН меньшем (4), чем рН в точке эквивалентности (7), поэтому имеет место водородная индикаторная погрешность. Поскольку в конечной точке титрования определяемое вещество будет недотитровано, величина систематической индикаторной погрешности будет отрицательной
При титровании HCOOH в конечной точке титрования будет оставаться неоттитрованная слабая кислота, поэтому в данном случае будет кислотная индикаторная погрешность.
Совершенно очевидно, что метиловый оранжевый не может быть использован для обнаружения конечной точки титрования раствора HCOOH раствором NaOH.
Даже в том случае, если систематическая индикаторная погрешность равна 0 (pHэкв = рТ), всё равно будет иметься случайная погрешность визуального обнаружения конечной точки титрования с помощью индикатора. Вследствие физиологических особенностей нашего зрения рТ индикатора можно определить лишь с неопределённостью примерно ± 0,4 ед. рН. Величина случайной индикаторной погрешности зависит от крутизны скачка титрования — чем она больше, тем случайная погрешность меньше. Индекс крутизны скачка титрования рассчитывается следующим образом:
При титровании слабых кислот (оснований) крутизна скачка титрования меньше, следовательно, случайная индикаторная погрешность больше, чем при титровании сильных кислот (оснований) (рис 13.5). Для 0,1 М сильных кислот и оснований величина случайной индикаторной погрешности составляет ±2×10 -7 . По мере уменьшения силы кислоты (основания) и концентрации случайная погрешность увеличивается.
Рис. 13.5. Влияние крутизны скачка титрования на случайную индикаторную погрешность: 1 – 0,1 М HCOOH; 2 – 0,1 М HCl
В виде полосы показана область неопределённости обнаружения конечной точки титрования для индикатора, имеющего рТ 8
13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
Анализ смеси карбоната и гидроксида, карбоната и гидрокарбоната щелочного металла с применением двух индикаторов
При титровании смеси гидроксида и карбоната щелочного металла, например, NaOH и Na2CO3 и обнаружении конечной точки титрования с помощью фенолфталеина протекают реакции:
NaOH + HCl ® NaCl + H2O
При обнаружении конечной точки титрования с помощью метилового оранжевого реакция взаимодействия гидроксида натрия с кислотой протекает точно также, а карбонат натрия титруется до угольной кислоты. Разность между объёмами раствора титранта, израсходованного для титрования смеси в присутствии метилового оранжевого и фенолфталеина, будет соответствовать протеканию реакции:
Фактор эквивалентности NaHCO3 в данной реакции равен 1. Если принять, что NaHCO3 в исходной смеси не было, то n(NaHCO3) = n0(Na2CO3) и массу карбоната натрия можно рассчитать следующим образом

Для взаимодействия с NaOH, находящимся в анализируемой пробе, будет расходоваться объём стандартного раствора титранта равный VФ – (VМО – VФ) = 2VФ — VМО, поэтому массу NaOH рассчитывают по следующей формуле
Если на титрование смеси щелочи и карбоната с фенолфталеином и метиловым оранжевым затрачивается практически одинаковый объём стандартного раствора титранта, то содержание карбоната в смеси очень мало. Напротив, если объёмы раствора титранта, затраченные для титрования, значительно отличаются, то в анализируемой смеси содержится много карбоната
Анализ смеси гидрокарбоната и карбоната щелочного металла титрованием её раствором сильной кислоты в присутствии двух индикаторов основан на том же принципе, что и анализ смеси гидроксида и карбоната. При титровании смеси с фенолфталеином с титрантом взаимодействует лишь карбонат
С метиловым оранжевым титруются и карбонат и гидрокарбонат. По объёму раствора HCl, затраченному для титрования с фенолфталеином, можно рассчитать содержание Na2CO3 (fэкв = 1), а по разности между объёмом раствора HCl, затраченным для титрования с метиловым оранжевым и удвоенным объёмом, затраченным для титрования с фенолфталеином — содержание NaHCO3:
Чем больше титранта требуется для титрования с фенолфталеином, тем больше карбоната содержится в анализируемой пробе. Если при добавлении к титруемому раствору фенолфталеина последний окрашивается в слабо розовый цвет и для его обесцвечивания требуется лишь несколько капель раствора титранта, то содержание карбоната в пробе очень мало.
Определение азота в органических соединениях по Кьельдалю и ионов аммония
- II. Погрешности измерений, обработка результатов, выбор средств измерений.
- Абсолютные и относительные погрешности
- Аддитивные погрешности
- Анализ составляющих погрешности измерительного канала
- Вопрос № 3. Оценка погрешности измерений
- Вычисление элементов эллипса погрешности при ОМС по 2-м навигационным параметрам.
- Измерения и их погрешности
- Индикаторные погрешности
- Истинное и действительное значение физической величины. Погрешность результата измерения. Причины возникновения погрешности.
- Какие погрешности и почему возникают при нарушении принципа постоянства баз.

Определение азота в органических соединениях методом Кьельдаля проводят следующим образом (устройство прибора показано на рис. 13.6). Точную навеску анализируемого образца помещают в колбу Кьедьдаля и подвергают минерализации с помощью концентрированной серной кислоты, к которой добавлены K2SO4 и СuSO4, а в некоторых случаях ещё и селен или HgO. В процессе окисления органической части молекулы азот восстанавливается до иона аммония. После окончания минерализации к раствору добавляют NaOH. При этом образуется NH3, который отгоняют и поглощают раствором H3BO3 или стандартным раствором сильной кислоты (H2SO4 или HCl). В первом случае при взаимодействии борной кислоты с аммиаком образуется эквивалентное NH3 количество иона BO2 — , который затем титруют стандартным раствором HCl (титрование заместителя). Во втором случае определяют избыток сильной кислоты, не вступивший в реакцию с NH3, титруя раствор стандартным раствором NaOH (обратное титрование).
Обычный метод Кьельдаля используют для органических соединений, содержащих аминный азот (амины, аминокислоты и т.д.). Для определения азота в нитратах, нитритах, нитросоединениях и т.п. необходимо ещё предварительное восстановление данных азотсодержащих групп до иона аммония или аминогруппы.
Методику, похожую на описанную выше, можно использовать также и для веществ, которые легко гидролизуются с образованием аммиака или аминов. Такие вещества не подвергают минерализации, а сразу проводят их щелочной гидролиз. Например, определение азота в соединении (1) требует обязательной минерализации, а для соединения (2) достаточно щелочного гидролиза.
Ион аммония является достаточно слабой кислотой (pKa = 9,24), поэтому его прямое титриметрическое определение при концентрации в водном растворе, например, 0,1 моль/л, невозможно.
Определение борной кислоты
Борная кислота является слабой одноосновной кислотой (pKa » 9,3). Её кислотные свойства обусловлены реакцией:
Борная кислота является слишком слабой для того, чтобы её можно было с удовлетворительной погрешностью оттитровать щелочью в водном растворе. Однако, она может взаимодействовать с органическими веществами, в состав которых входит a-диольная группа (глицерин, глюкоза, фруктоза, маннит, сорбит и др.), с образованием более сильных комплексных кислот (например, у маннитборной кислоты pKa = 5,3). Последние могут быть оттитрованы раствором щёлочи в присутствии фенолфталеина.
Наиболее часто используемым на практике комплексообразователем при определении борной кислоты является глицерин, хотя по сравнению, например, с маннитом или моносахаридами данное вещество является менее активным комплексообразующим реагентом. Кроме того, глицерин очень вязкий и работать с ним неудобно. Глицерин, используемый в лаборатории, может содержать примеси кислот. Перед применением его необходимо нейтрализовать раствором щёлочи до появления слабо-розового окрашивания фенолфталеина.
Дата добавления: 2015-08-05 ; просмотров: 13 ; Нарушение авторских прав
Источник
Лекция 15. Кислотная и основная индикаторные погрешности титрования
Ключевые слова:показатель титрования индикатора, рН в точке эквивалентности,
кислотная индикаторная погрешность титрования, основная индикаторная
Кислотная погрешность (δHA)вызвана присутствием в растворе недотитрованной слабой кислоты и имеет отрицательное значение. Для вычисления кислотной погрешности составим выражение для константы диссоциации слабой кислоты и преобразуем это выражение:
НА 
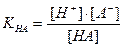
Поскольку НА кислота слабая, концентрация недиссоциированных молекул кислоты — [НА] — практически равна общей концентрации свободной кислоты в растворе. Величина [А − ] равна концентрации полученной соли. В результате нейтрализации 1 моля кислоты образуется 1 моль соли. Следовательно, отношение [НА]/[А − ] можно рассматривать как отношение концентрации неоттитрованной части кислоты к оттитрованной ее части, и оно позволяет оценить величину кислотной ошибки титрования (δНА). Поскольку [Н + ]=10 −р T , а KНА=10 −рК , из приведенного выше уравнения находим
δ
Если титрование необходимо провести так, чтобы индикаторная ошибка титрования не превышала 0,1%, то есть чтобы оставшаяся неоттитрованная кислота составляла не более 0,001 от количества оттитрованной кислоты, нужно, чтобы 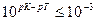
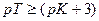
Значит, в тех случаях, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только при условии, если величина показателя титрования индикатора рТ не менее, чем на 3 единицы, превышает величину показателя диссоциации кислоты рК.
Например, достаточно точно оттитровать уксусную кислоту (рКкисл=4,73) можно только при применении таких индикаторов, показатель титрования которых рТ≥7,73. Значит, ни метиловый оранжевый (рТ≈4), ни метиловый красный (рТ≈5,5), ни лакмус (рТ≈7) не подходят. Наоборот, фенолфталеин (рТ≈9) можно использовать для титрования уксусной кислоты щелочью.
Величина кислотной погрешности в процентах (%) представляет собой молярную долю неоттитрованной кислоты и может быть рассчитана через соотношение
δНА(%) = 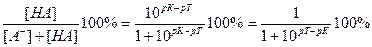
Основная погрешность титрования(δМеОН) вызвана присутствием в растворе недотитрованного слабого основания, как правило, имеет отрицательное значение. Учитывая диссоциацию слабого основания, составим выражение для константы диссоциации и преобразуем его.
МеОН 
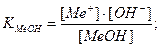
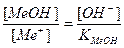
δМеОН = 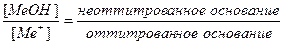
В конце титрования рН = рТ, а рОН =(14−рТ), и [OH — ] = 10 -(14- pT ) . Следовательно: δ
Достаточно точным титрование может быть при условии, если δМеОН-ошибка равна или меньше величины 10 −3 , то есть если 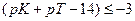
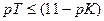
Величина основной погрешности в процентах (δМеОН(%)) представляет собой молярную долю неоттитрованного основания и может быть рассчитана через соотношение
δМеОН(%) = 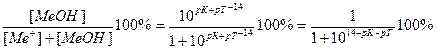
Пример 1. Вычислить ошибку титрования 0,1 н. раствора уксусной кислоты 0,1 н. раствором гидроксида натрия с индикаторами: а) метиловым оранжевым; б) фенолфталеином.
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 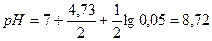
А. Титрование с метиловым оранжевым заканчивается при рН≈4. По окончании титрования в растворе будет присутствовать избыточная уксусная кислота СН3СООН. А так как это кислота слабая, она вызовет δНА-ошибку:
δ 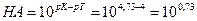
Это значит, что неоттитрованная часть уксусной кислоты относится к оттитрованной ее части, как 5,4 к 1. Другими словами, из 6,4 части первоначально взятой СН3СООН остаются неоттитрованными 5,4 части. Отсюда легко вычислить δНА-ошибку в процентах, составив пропорцию:
5,4 − х% . Следовательно: δНА(%) = 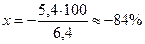
Вывод — титровать уксусную кислоту с метилоранжем нельзя. Тот же вывод можно получить без вычислений, применяя соотношение рТ≥(рК+3). Можно использовать индикаторы, для которых рТ≥ (4,76 + 3) = 7,76. Для метилоранжа это условие не выполняется: рТ≈4 − -ошибка:
δ 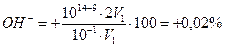
Фенолфталеин можно использовать для титрования уксусной кислоты щелочью.
Пример 2. Чему равна индикаторная ошибка титрования 0,1 н раствора NН4ОН 0,1 н раствором НСl с индикаторами: а) фенолфталеином, б) метиловым оранжевым?
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 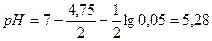
А. Титрование с фенолфталеином заканчивается при рН≈9; в растворе по окончании титрования будет некоторый избыток NН4ОН. Поэтому в данном случае возникает δМеОН-ошибка: δ 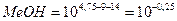
Следовательно, из 1,56 весовых частей первоначально взятого NН4ОН не оттитрованными остаются 0,56 весовой части. Составим и решим пропорцию:
0,56 — х% Следовательно: δМеОН(%) = 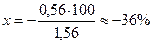
Индикатор фенолфталеин непригоден для титрования гидроксида аммония сильной кислотой. Тот же вывод получаем при применении соотношения для индикаторов: рТ≤(11−pK) = 11 – 4,76 = 6,24.
Тогда как для фенолфталеина рТ≈9 > 6,24.
Б. В случае титрования NН4ОН с метиловым оранжевым титрование заканчивается при рН≈4,0 вместо рН=5,28. В этом случае возникает δН + -ошибка: δ 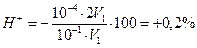
Контрольные вопросы
1.В каком титровании возникает кислотная индикаторная погрешность?
2.В каком титровании возникает основная индикаторная погрешность?
3.Как рассчитывается кислотная индикаторная погрешность?
4.Как рассчитывается основная индикаторная погрешность?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. — М.: Дрофа, 2005. — С. 139 – 140, 149 – 151.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.123 — 125.
Источник
Ошибки титриметрического анализа также подразделяют на систематические и случайные. Обычно систематические ошибки очень невелики. Причины их будут рассмотрены далее при описании отдельных методов здесь же ограничимся только одним примером. [c.165]
Опшбки в титриметрическом анализе в зависимости от их происхождения могут быть подразделены на методические ошибки, которые связаны с особенностями метода титрования, и специфические ошибки, связанные с особенностями данного метода. [c.349]
Присутствие в растворе белковых веществ и коллоидов, а также нейтральных солей обычно тоже влияет на интервал перехода индикаторов и хотя для титрования применяют лишь те индикаторы, у которых так называемые белковая и солевая ошибки невелики, все же при высоких концентрациях белковых веществ или солей в растворах эти ошибки могут стать значительными. Чтобы исключить влияние всех указанных выше факторов на окончательный результат анализа, каждый раз, когда приходится вести титрование при нагревании или в присутствии неэлектролитов, большого количества солей и т. д., следует устанавливать титр рабочего раствора в тех же самых условиях. Это правило является вообще одним из основных в титриметрическом анализе. [c.253]
Различают прямое титрование, основанное на непосредственном взаимодействии анализируемого вещества и титранта, и обратное титрование, в котором процессу титрования предшествует вспомогательная реакция. Последний метод характеризуется несколько более высокой ошибкой, так как количество измерений при его выполнении возрастает. Для уменьшения суммарной ошибки анализа необходимо, чтобы объем раствора титранта (при выбранной навеске анализируемого вещества) был возможно большим, а ошибка в определении концентрации этого раствора— возможно меньшей. Обычно относительная средняя квадратичная ошибка результатов анализа титриметрическим методом составляет 0,1—0,5%. [c.342]
Ошибки титриметрического анализа подразделяют на систематические и случайные. Обычно систематические ошибки очень невелики. [c.317]
Типичной и наиболее широко распространенной методической погрешностью титриметрических методов анализа является индикаторная ошибка. Она возникает при фиксировании конечной точки титрования. [c.64]
Однонормальные растворы мало пригодны для целей титриметрического анализа как слишком концентрированные. В прибавляемой при титровании ими последней капле раствора содержалось бы, очевидно, довольно много соответствующего вещества, и поэтому так называемая капельная ошибка титрования была бы вел и ка. [c.214]
В титриметрическом анализе часто встречается методическая ошибка, связанная с добавлением избытка реагента по отношению к теоретическому количеству, необходимому для изменения окраски индикатора, по которой судят о конце реакции. В конечном итоге правильность всего анализа определяется спецификой того самого явления, которое лежит в основе определения. [c.60]
Ошибки титриметрического анализа могут быть вызваны следующими причинами. [c.322]
Как будет показано позже, при рассмотрении титрования с внешними индикаторами ошибку, связанную с отбором проб, можно сделать исчезающе малой. Метод равного помутнения, предложенный в 1832 г. Гей-Люссаком, явился одним из первых методов титриметрического анализа. Впоследствии он был нспользован для весьма точного определения атомных весов галогенов и серебра. [c.320]
Каждому методу анализа присущи свои ошибки, которые могут отсутствовать в других методах. Например, ошибки, связанные с потерей вещества при прокаливании, наблюдаются в гравиметрическом анализе, но их нет в титриметрическом анализе. Ошибки, связанные с применением индикаторов, характерны для титриметрического анализа, но отсутствуют в гравиметрическом анализе. Указание на эти ошибки дано при каждом отдельном методе. Есть ошибки, которые характерны для всех методов количественного анализа. Наиример, взвешивая на аналитических весах, можно всегда сделать ошибку, равную 0,0002 г. В тщательно проводимом анализе неорганических веществ относительная ошибка не должна превышать 0,1%. Поэтому навеска вещества для анализа не должна быть меньше 0,2 г. [c.283]
В титриметрическом анализе получаются ошибки при отсчетах на градуированной посуде (бюретках). Например, пользуясь бюреткой на 50 мл, при каждом отсчете мы делаем ошибку 0,02 мл. При отсчете объема в 10 мл ошибка не должна превышать 0,2%. Поэтому надо в случае бюреток на 50 мл работать с объемами растворов не менее 20 мл. [c.283]
Ошибки методические. Эти ошибки зависят от особенностей применяемого метода анализа, например от не вполне количественного протекания реакции, на которой основано определение, от частичной растворимости осадка, от соосаждения вместе с ним различных посторонних примесей, от частичного разложения или улетучивания осадка при прокаливании, от гигроскопичности прокаленного осадка, от течения наряду с основной реакцией каких-либо побочных реакций, искажающих результаты титриметрических определений, от свойств примененного при титровании индикатора и т. д. Методические ошибки составляют наиболее серьезную причину искажения результатов количественных определений, устранить их трудно. [c.48]
Каждому методу анализа свойственны свои специфические ошибки. Например, в гравиметрическом анализе имеют место ошибки, связанные с потерей вещества при промывании и прокаливании осадков. В титриметрическом анализе — ошибки, связанные с применением индикаторов. Наряду с этим имеются ошибки, свойственные всем или многим методам количественного анализа, [c.303]
Операции титриметрического анализа также выполняются с некоторыми, хотя и сравнительно небольшими, ошибками. Считают, что всякое титриметрическое определение включает в себя 1) ошибку определения титра раствора 2) ошибку титрования анализируемого вещества. Первая зависит от точности взвешивания стандартного вещества и правильности измерения объема раствора. Вторгся определяется точностью титрования, т.е. правильностью установления точки эквивалентности с помощью индикатора. Например, если капля раствора, прибавляемая к исследуемой жидкости, имеет слишком большой объем, то этим создается вероятность добавить не строго эквивалентное, а большее количество вещества. [c.165]
Кондуктометрическое титрование расширяет область применения титриметрического анализа, так как благодаря ему становится возможным титрование окрашенных и мутных растворов, когда переход окраски индикатора трудно наблюдать визуально более -точно устанавливается конечная точка при титровании слабых кислот и оснований при кондуктометрическом титровании можно использовать многие реакции осаждения и комплексообразования при анализе смеси веществ повышается точность определений. Относительная ошибка определения находится в пределах 0,1—2% в зависимости от определяемых концентраций. [c.93]
Ошибки в отсчетах по бюретке являются главным источником ошибок в титриметрическом анализе. Особенно часто подобные ошибки допускают начинающие химики, занимая неправильное положение, при отсчете (рис. 92). Относительная ошибка отсчета, вместо допустимого значения 0,1%, может достигнуть 0,3% ли даже 0,6%. [c.109]
Индикаторная ошибка. Своеобразным видом методической ошибки титриметрических методов анализа является индикаторная ошибка. Эта ошибка возникает в связи с тем, что индикатор вступает в реакцию взаимодействия с титрантом либо несколько раньше, либо несколько позже точки эквивалентности. Поскольку взаимодействие определяемого компонента и индикаторного вещества -с титрантом подчиняется законам химического равновесия, момент вступления индикатора в реакцию определяется как прочностью обоих образующихся соединений (константой образования), так и соотношением концентраций искомого компонента и индикатора. Из всех этих величин только концентрация индикатора не является закрепленной и может варьироваться в тех или иных пределах. [c.33]
Другим примером постоянной ошибки служит избыточный объем реагента, необходимый для изменения окраски в титриметрическом анализе. Объем этот обычно мал и не зависит от общего объема реагента, затраченного на титрование. И снова относительная ошибка будет тем выше, чем больше общий объем. Очевидно, одним из путей снижения постоянной ошибки будет выбор разумного количества пробы в соответствии, конечно, с методом анализа. [c.61]
Достоинства потенциометрического метода анализа. Метод потенциометрического титрования имеет при прочих равных условиях ряд достоинств по сравнению с методами визуального титриметрического анализа он более чувствителен, при его использовании исключается субъективная ошибка определения точки эквивалентности. Метод дает возможность проводить определения в мутных и окрашенных растворах и даже в вязких пастах, где невозможно использование индикаторов, и дифференцированно титровать не анализируемые другими методами многокомпонентные смеси веществ без предварительного разделения. [c.43]
Преимущества потенциометрического метода титрования. Потенциометрическое титрование при прочих равных условиях имеет ряд преимуществ по сравнению с визуальными титриметрическими методами анализа. Метод потенциометрического титрования более чувствителен, при использовании его исключается субъективная ошибка, возникающая при визуальном нахождении момента завершения химической реакции, т. е. конечной точки титрования. Этот метод дает возможность определять вещества в мутных и сильно окрашенных растворах, дифференцированно (раздельно) титровать компоненты смесн веществ в одной и той же порции раствора и, наконец, автоматизировать процесс титрования, так как измеряемой величиной является электрический параметр. [c.37]
При определении содержания добавочных компонентов допустима большая ошибка определения [а = 2. .. 5. ..10% (отн.)], особенно при определении небольших содержаний (<10″ %). Вследствие таких требований к точности определения основных и добавочных компонентов для определения первых применяют преимущественно химические методы анализа, для вторых — физико-химические методы. Из химических методов большое применение, благодаря их быстроте, находят титриметрические методы с различными способами определения точки эквивалентности. При особо высоких требованиях к точности прибегают к гравиметрическим методам анализа. Среди физико-химических методов определения добавочных компонентов особенно широкое применение нашли электрохимические методы анализа (полярография, кулонометрия) и оптические (фотометрия). При определении не очень малых количеств элементов (>1%) применяют также различные варианты объемных методов анализа. [c.399]
Систематические ошибки. Систематические ошибки обусловливаются многими причинами. К ним относятся, например, ошибки, зависящие от особенностей метода анализа. Используемые конкретные реакции данного метода могут протекать не вполне количественно, что связано с обратимостью химических процессов. Вместе с осадком могут соосаждаться и посторонние римеси, увеличивая массу осадка. Осадки даже наименее растворимые имеют какую-то частичную растворимость, что уменьшает массу осадка. Осадки могут частично разлагаться при прокаливании, впитывать водяные пары или поглощать газы из атмосферы. В растворе могут происходить побочные реакции. В титриметрических методах некоторые ошибки связаны с используемым индикатором и т. п. К этому типу ошибок относятся ошибки, связанные с личными качествами самого аналитика. Например, не все способны точно уловить момент перемены окраски раствора в процессе титрования, не всегда точно улавливаются мелкие деления на шкале приборов. Иногда [c.215]
В вычислении результатов титриметрических определений наименее точная цифра — число миллилитров титрующего раствора, израсходованного на титрование. Поскольку сотые доли миллилитра отмечаются лишь приблизительно, можно принять, что максимальная ошибка отмеривания не менее 0,02 мл. Ошибка от натекания также равна 0,02 мл. Таким образом, общая ошибка может доходить до 0,04 мл . При общем расходе титрующего раствора 20 мл это составит 0,2% отн. Отсюда следует, что, беря для анализа 1 г, вполне можно проводить отвешивание с точностью до 1 мг это дает относительную ошибку в 0,5 мг, или 0,05%. Если на титрование расходуется меньше 20 мл [c.11]
Ошибки эталонов и стандартов. Определение содержания отдельных компонентов во многих методах химического анализа опосредовано через применение разного рода стандартов и эталонов. Таковы методы фотометрического, эмиссионного спектрального, атомно-абсорбционного, газохроматографического анализов, полярографические, амперометрические, кон-дуктометрические, радиохимические и многие другие методы. В последнее время в титриметрических методах получили [c.35]
Преимущества метода кулонометрического титрования также ощутимы в тех случаях, когда для проведения анализа требуется малое количество реагента. Регулируя силу тока, можно легко и с высокой точностью вводить в раствор небольшие порции реагента, тогда как в классических титриметрических методах дозирование малых объемов даже сильно разбавленных растворов приводит к значительным ошибкам. [c.43]
Систематические ошибки. Систематические ошибки обусловливаются многими причинами. К ним относятся, например, ошибки, зависящие от особенностей метода анализа. Используемые конкретные реакции данного метода могут протекать не вполне количественно, что связано с обратимостью химических процессов. Вместе с осадком могут соосаждаться и посторонние примеси, увеличивая массу осадка. Осадки даже наименее растворимые имеют какую-то частичную растворимость, что уменьшает массу осадка. Осадки могут частично разлагаться при прокаливании, могут впитывать водяные пары или поглощать газы из атмосферы. В растворе могут происходить побочные реакции. В титриметрических методах ошибки могут быть связаны с используемым индикатором и т. п. К этому типу ошибок относятся ошибки, связанные с личными качествами самого аналитика. Например, не все могут точно уловить момент перемены окраски раствора в процессе титрования, не всегда точно улавливаются мелкие деления на шкале приборов. Иногда учащиеся ориентируются на определенные данные или на цифры, которые получают работающие рядом, а не на свои собственные. Это так называемые психологические ошибки, зависящие от настроения самого исполнителя. [c.227]
Малые количества углекислоты (несколько ч. на млн.) определить очень трудно, так как в воздухе содержится значительное количество СО2. Поэтому химический анализ связан с трудностью определения поправки холостого опыта. Вследствие того, что аммиак и С02 образуют химическое соединение, обычные методы газового анализа «здесь оказываются неприемлемыми. В работе [443] предложен титриметрический метод определения СО2 в безводном аммиаке, основанный па связывании углекислоты в виде карбамата аммония, отделении аммиака отгонкой при комнатной температуре, обработке остатка разбавленной серной кислотой, поглощении выделяющейся СО2 гидроокисью бария и титровании избытка последнего щавелевой кислотой. Этим методом при содержании углекислоты 0—50 ч. на млн. абсолютная ошибка равна 1,5 ч. на млн. [c.257]
На результат анализа могут оказывать влияние и случайные ошибки. Чтобы устранить их, титриметрическое определение повторяют несколько раз и берут среднее из них. Однако, вычисляя средний результат, допускают отклонения не более 0,3%. Результаты определений, отличающиеся на большую величину, отбрасывают при вычислении среднего арифметического. Например, если в четырех определениях нормальности раствора едкого натра были получены величины 0,1134, 0,1135, 0,1142 и 0,1136, то число 0,1142 отбрасывают, оно отличается от наименьшего числа 0,1134 на 0,8%. Из остальных величин берут среднее арифметическое. [c.318]
Весьма важное значение имеет правильное вычисление результатов титриметрического анализа. Все вычисления рекомендуется выполнять со всей тщательностью и внимательно, так как правильные результаты титрования из-за ошибок в расчетах дают неверный результат. Всякое определение включает два рода ошибок ошибку в концентрации титрующего раствора и ошибки титрования определяемого вещества. Эти ошибки компенсируются в том случае, если концентрация титруюшего раствора установлена в тех же условиях, что и титрование анализируемого образца. Влияние случайных ошибок можно устранить, повторяя титрование несколько раз. Отклонение от среднего результата не должно превышать 0,3% относительных. Поэтому отсчеты объемов по бюретке необходимо вести с точностью до 0,02— 0,03 мл. Например, три последовательных титрования дают 25,06 25,03 25,03 мл. Средний результат титрования должен быть записан в виде 25,04 мл. Если отклонения превышают допустимую величину, то такие результаты титрования не должны приниматься во внимание при вычислении среднего результата. Для повышения точности измерения объема применяют бюретки малого диаметра или весовые бюретки. [c.351]
Проведенный выше раэбор систематических ошибок хими-t e Koro аяализа не претендует на исчерпывающую полноту. Из рассмотрения исключены некоторые виды ошибок, например, ошибка натекания и капельная ошибка в титриметрических методах анализа. Некоторые виды систематических ошибок только упомянуты. Основное внимание и наибольшее количество примеров посвящено ошибкам традиционных методов гравиметрического, титриметрического и фотометрического анализов. Такой стиль изложения оправдан целью данного раздела—дать общее представление о систематических ошибках химического анализа, способах их обнаружения и оценки и методах их уменьшения. Детальный разбор всех известных источников ошибок должен входить как составная часть в теорию и практику каждого отдельного метода химического анализа, ибо каждому методу присущи свои специфические ошибки». Удачным примером в этом плане может служить руководство по (фотоколориметрическим и спектрофотометрическим методам анализа М. И. Булатова и И. П. Калин-кина (Л, Химия , 1976, 376 с.), где этому вопросу уделено большое внимание. Однако сказанное в равной мере относится и к любым другим химическим и физическим методам, [c.48]
В качестве титруюш его раствора при аналогичном определении может быть использован метапериодат [1176]. В работе [59] проведено титриметрическое определение ртути нри осаждении ее перйодатом калия в виде Hg5(100)2, растворении осадка в кислоте и иодометрическим титровании. При определении от 0,2 до 0,02 г Hg(II) ошибка равна +0,2%. Для анализа соединений Hg(II) можно также использовать данный метод, предварительно восстановив Hg(II) до Hg(I). [c.90]
Элементный бром в водах определяют титрованием раствором соли Мора по N,N-диэтил- г-фeнилeндиaминy [739, 741] согласно описанию на с. 76. Для его определения в водных растворах рекомендованы экстракционные методы с фотометрическим и титриметрическим окончанием [157]. Они требуют небольшого расхода времени, но ошибки анализа достигают 20—50%. Для качественного определения брома можно применять реакции, рассмотренные в главе III. [c.179]
Для анализа производственных вод применяется титриметрический метод определения сульфидов и цианидов потенциометрическим титрованием, разработанный в ВУХИНе [ 1 ]. Данный метод значительно сокращает время анализа, количество реактивов. Время определения составляет 10—15 мин, ошибка — 1 — 2 % (отн.) (химические методы требуют [c.59]
К ошибкам этого же типа в значительной мере можно отнести также индикаторные ошибки в титриметрических методах, поскольку во многих случаях их можно предрассчитать. В какой-то мере возможна приближенная оценка отдельных видов методической ошибки и в других методах химического анализа. Однако обычно методические ошибки включают в себя отдельные слагаемые, обусловленные не только неполнотой протекания равновесных процессов или параллельным протеканием сопроцессов , но и неравновесностью отдельных стадий химико-аналитических процессов, т. е. связанные с кинетическими факторами. [c.25]
При титровании следовых количеств хлорид-ионов возможна ошибка за счет реакции НС1 с СО,. Такую ошибку можно корректировать введением поправки [720]. Ошибку титрования увеличивает скоагулировавшийся осадок. Поэтому для предотвращения коагуляции к концентрированным растворам хлоридов лития,, натрия, калия, магния, кальция добавляют 5—10 мл 0,1%-ного раствора агар-агара. В качестве титранта используют 0,01— 0,1 N AgNOg (чаще всего 0,05А ). Метод Мора применяют в основном для анализа вод [633, 771]. В настоящее время он все больше вытесняется другими титриметрическими методами, исключающими использование серебра. Ограничивает также применимость этого метода необходимость проведения анализа в нейтральной срвде, что исключает присутствие в ана.иизируемых объектах тяжелых металлов. Поэтому гораздо чаще применяют метод Фоль-гарда, позволяющий проводить титрование в кислой среде. [c.36]
Большинство методов количественного ультрамикрохимического анализа основано на измерении какого-либо параметра, функционально связанного с массой. Это, прежде, всего, титриметрические и фотометрические методы. Важным преимуществом физико-химических методов является то, что при их использовании нет необходимости брать навески на высоко точных и чувствительных ультрамикровесах, так как микронавеска может быть взята и отбором аликвотной части раствора. При анализе жидкостей измеряют объем, взятый для анализа. В физических методах, как, например, эмиссионном спектральном, рентгеноспектральном, масс-спектральном анализе навески нЗ микровесах вообще не берут. Конечно, и в этих методах точность анализа зависит во многом от погрешности приборов. Во всяком случае в ультрамикроанализе, так же как и в микроанализе, случайные ошибки приборов составляют, по крайней мере, треть погрешности, вызываемой химическими факторами [c.183]
Анализ сплавов никеля. Предложено несколько методов, в зависимости от определяемых количеств вольфрама. Титриметрический метод [746] применяют для определения 0,5—5% W из навески 0,1 г сначала восстанавливают W(VI) до W(III) свинцом, затем вводят избыток Fe(III), восстановленное железо оттитровывают К2СГ2О7. Для определения 0,04—5% W разработан [153] экстракционно-фотометрический метод с помощью роданида и хлорида N,N N»-тpифeнилгyaнидиния. При определении 0,05 — 1,0% W и 1—5% W ошибка определения составляет соответственно + 10% и + 2—5%. Флуориметрический метод [561] позволяет определять 0,5—3% W из навески 0,05—0,1 г. [c.178]
Для определения сантимиллиграммовых количеств азота в органических соединениях предложен титриметрический метод, состоящий в разложении вещества серной кислотой в запаянной кварцевой трубке при нагревании, пропускании реакционной смеси через ионообменную смолу основного характера и титровании образовавшегося NH4OH раствором HGIO4 с потенциометрической регистрацией КТТ [782]. Продолжительность анализа 12 мин. Определяемый минимум 30 мкг N. Абсолютная ошибка +0,25%. Металлы мешают определению. [c.182]
Курс аналитической химии Издание 5 (1982) — [
c.98
,
c.295
]
Курс аналитической химии Кн 2 Издание 4 (1975) — [
c.98
,
c.301
]