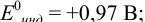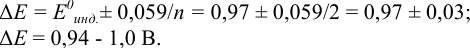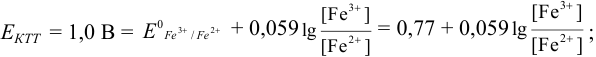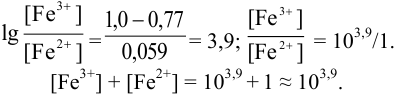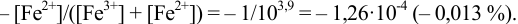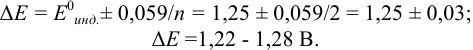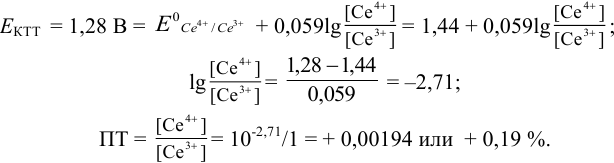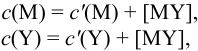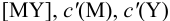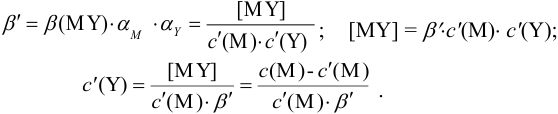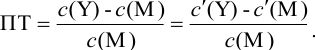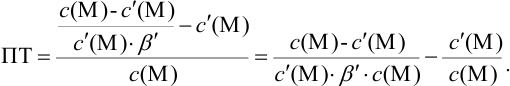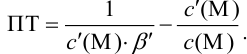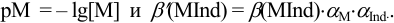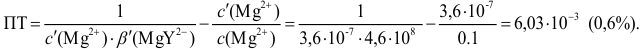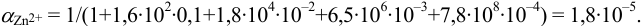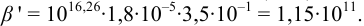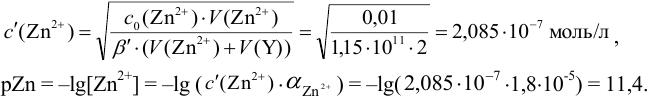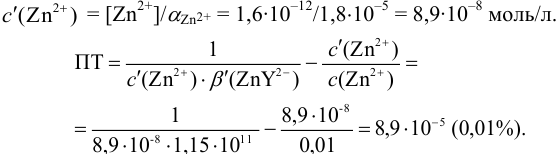Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 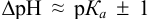
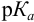
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 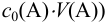
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
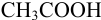
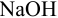
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
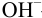
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 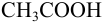



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 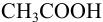
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 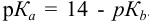
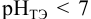
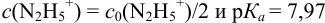
Сравнивая рТ индикаторов и 
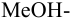
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 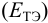

Таблица 8.14
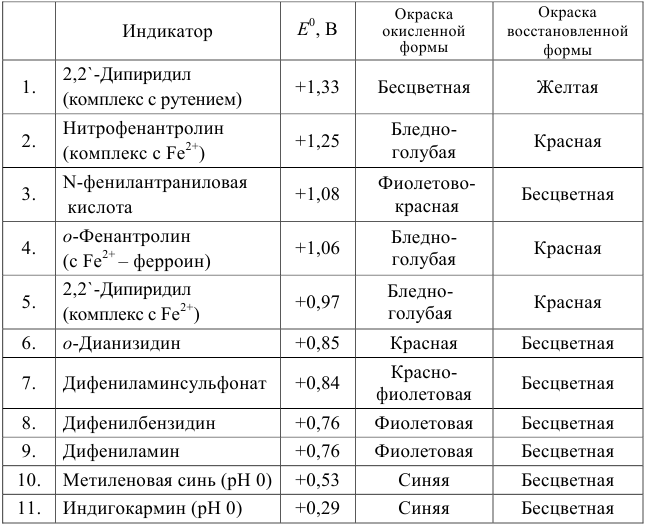
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 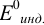
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 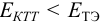
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 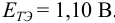
Выберем для рассмотрения порядка расчета два индикатора:
а) с 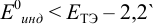
б) с 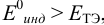
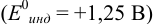
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
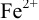



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

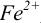
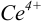
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 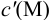
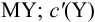
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 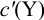
Вблизи ТЭ 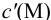
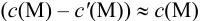
следовательно:
Выражение (8.21) тождественно выражению: 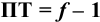
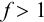
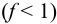
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
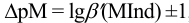
Интервал перехода окраски 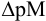
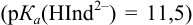
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 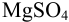

Решение:
В данных условиях 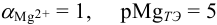
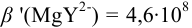
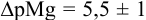
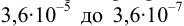

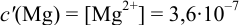
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 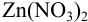

Решение:
1. Рассчитаем условную константу 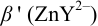
Общие константы устойчивости для аммиачных комплексов 
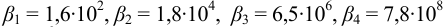

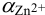
По табл. 7 и табл. 4 приложения находим 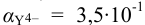
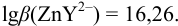

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 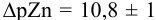
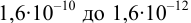

2. Конечная точка титрования наступает при [
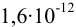

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 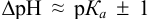
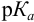
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 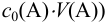
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
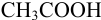
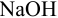
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
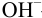
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 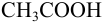



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 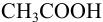
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 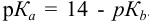
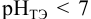
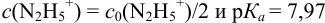
Сравнивая рТ индикаторов и 
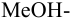
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 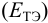

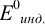
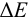
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 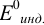
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 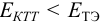
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 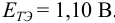
Выберем для рассмотрения порядка расчета два индикатора:
а) с 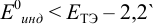
б) с 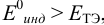
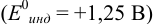
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
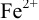



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

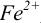
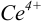
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 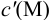
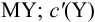
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 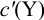
Вблизи ТЭ 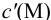
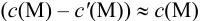
следовательно:
Выражение (8.21) тождественно выражению: 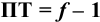
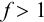
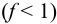
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
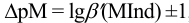
Интервал перехода окраски 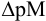
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 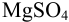

Решение:
В данных условиях 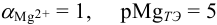
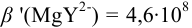
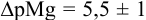
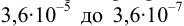

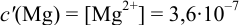
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 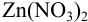

Решение:
1. Рассчитаем условную константу 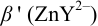
Общие константы устойчивости для аммиачных комплексов 
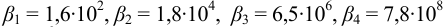

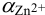
По табл. 7 и табл. 4 приложения находим 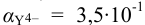
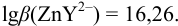

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 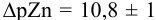
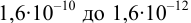

2. Конечная точка титрования наступает при [
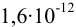

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
5.
ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ
Титриметрический
метод анализа состоит в измерена объема
раствора точно известной концентрации,
стехиометрически соответствующего
содержанию определяемого компонента.
В
титриметрическом методе используются
все типы химических реакций:
кислотно-основное взаимодействие,
реакции окисления и восстановления,
реакции осаждения и комплексообразования.
Константа
равновесия этих реакций должна быть
достаточно велика, чтобы при добавлении
эквивалентного количества титранта
содержание исходных веществ в растворе
не превышало 0,1% от их начальной
концентрации. В этом случае концентрация-
определяемых ионов вблизи точки
эквивалентности
изменяется резко. Это наглядно показывают
кривые титрования, которые графически
выражают зависимость логарифма (или
показателя) концентрации титруемого
веществу от концентрации титранта.
Кривые титрования позволяют обосновать
выбор индикатора, используемого для
определения точки эквивалентности,
которая представляет собой точку
стехиометричности.
Каждый метод
титриметрического анализа имеет свои
особенности, связанные с данным типом
реакции.
Предлагаемые
ниже задачи на вычисление концентрации
реагирующих веществ в процессе титрования,
расчеты констант равновесия реакций,
вычисление индикаторных ошибок
расположены по методам анализа.
5.1.
Метод
кислотно-основного титрования
5.1.1.
Кривые
титрования; вычисление рН.
В
процессе кислотно-основного взаимодействия
в водных растворах изменяется концентрация
ионов гидроксония и, следовательно, рН.
Кривая титрования выражает в данном
случае зависимость рН от концентрации
титранта (кислоты или основания). Возможны
следующие случаи титрования: сильных
кислот и оснований, слабых кислот и
оснований и титрование солей слабых
кислот и оснований.
С учетом реакции
|
|
(5.1) |
в упрощенном виде
|
|
(5.2) |
константа
равновесия реакции между сильной
кислотой и сильным основанием будет
равна
|
|
(5.3) |
Высокое
значение константы равновесия показывает,
что в данном случае основное требование,
предъявляемое к реакциям в титриметрическом
анализе, выполняется в широком интервале
концентраций титруемых веществ.
При
титровании сильной кислоты сильным
основанием концентрация ионов гидроксония
до точки эквивалентности равна
концентрации кислоты ()
а рН= -lg.
После точки эквивалентности в соответствии
с уравнением (1.7)
.-
концентрация основания, добавленного
в избытке;
рН= 14
+ lg.
В точке
эквивалентности [Н+]
= [ОН—];
следовательно, рН будет равен 7.
Пример
1. Вычислить
рН раствора, если к 50.00 мл 0.100 М раствора
НСl
добавлено: 1) 25.00 мл, 2) 49.95 мл, 3) 50.00 мл и 4)
50.05 мл 0.100 М раствора NaOH.
Решение.
Найдем концентрацию кислоты ()
или основания ()
в
каждом случае с учетом реакции
нейтрализации и разбавления раствора.
1)
,
рН=
-lg
= — lg
0.066 = 1.48.
2)
,
рН=
-lg(5×10-5)
= 4.30.
-
В данном случае
добавлено эквивалентное количество
щелочи; следовательно, рН = 7. -
В этом случае
введен некоторый избыток щелочи
рН =
14 +lg(5×10-5)
= 9.70.
Расчеты
можно провести и другим способом,
вычислив сначала концентрацию кислоты
(СА)
и основания (СВ)
после разбавления, а затем учесть реакцию
между ними и в зависимости от того, какой
из реагентов будет в избытке, вычислить
или
.
Пример
2. К
15.00 мл 0.100 М КОН добавлены следующие
количества 0.084 М НС1: 1) 17.50 мл, 2) 17.85 мл и
3) 18.15 мл. Вычислить рН растворов.
Решение.
1)
2)
3)
В первом случае
после реакции нейтрализации в избытке
остается КОН.
рН =
14- lg(3.08×10-3)
=
11.49.
Во
втором случае добавлено эквивалентное
количество НС1, реакция будет нейтральной
и рН = 7.
В третьем случае
кислота присутствует в избытке.
pH
= -lg(7.5×10-4)
= 3.12.
Реакцию
между слабой кислотой НА и сильным
основанием можно представить в следующем
виде:
|
|
(5.4) |
Константа равновесия
ее будет равна
|
|
(5.5) |
Из
уравнения (5.5) следует, что при титровании
слабых кислот возможность количественного
определения ограничивается не только
концентрацией раствора, но и значением
константы диссоциации кислоты (КНА)
Обозначим
начальную концентрацию кислоты С0.
Концентрация ионов водорода в растворе
слабой кислоты в некотором приближении
может быть вычислена по уравнениям
(1.24) и (1.25)
При добавлении
щелочи в растворе образуется буферная
смесь, состоящая из неоттитрованной
кислоты и ее соли.
Концентрация
водородных ионов до точки эквивалентности,
согласно уравнению (1.88), будет равна
рН рассчитывается
по уравнению (1.107)
В точке
эквивалентности рН раствора будет
определяться гидролизом соли (1.44) и
вычисляется по уравнению (1.50)
После
точки эквивалентности концентрация
ОН—
в растворе определяется избытком
введенного сильного основания и рН
может быть вычислен по уравнениям
(1.15), (1.11).
Аналогичным
образом проводятся расчеты рН в процессе
титрования слабого основания (ВОН)
сильной кислотой (1.53). рН в растворе ВОН
в начальный момент в соответствии с
уравнением (1.32) равен
При
добавлении кислоты до достижения точки
эквивалентности образуется буферная
смесь (ВОН + В+),
рН определяется по уравнению (1.108).
—
концентрация
образующейся соли, равная концентрации
введенной сильной кислоты.
В точке
эквивалентности рН вычисляется по
уравнению (1.57)
После точки
эквивалентности концентрация водородных
ионов будет равна концентрации кислоты,
присутствующей в избытке, с учетом
разбавления раствора.
При
титровании соли слабой одноосновной
кислоты сильной кислотой следует принять
во внимание, что до точки эквивалентности
образуется буферная смесь (НА + А—),
в точке эквивалентности — кислота НА, а
после нее в избытке присутствует сильная
кислота.
В
случае многоосновных кислот (НnА)
буферные смеси содержат НmА(n—m)-
+
Нm-1А(n—m+1)-
в
точках эквивалентности присутствуют
кислые соли НmА(n—m)-
.
Если
константы ионизации по отдельным
ступеням заметно отличаются друг от
друга, то рН в точках эквивалентности
может быть вычислен по уравнению (5.6)
|
|
(5.6) |
Пример
3.
К 100.00 мл 0.100 М раствора уксусной кислоты
(рК = 4.75) добавлены различные объемы
0.100 М раствора гидроксида натрия: 1) 99.50
мл, 2) 100.00 мл и 3) 100.50 мл. Вычислить рН
растворов.
Решение.
Найдем концентрации кислоты (Сна)
и
образовавшейся
соли (СА),
выраженные в миллимолях (мМ), для первого
случая с учетом реакции
СНА
= 100×0.1 — 99.5×0.1 = 0.05 мМ;
СА
= 99.5×0.1 = 9.95 мМ.
Вычислим
рН по уравнению (1.107)
Во
втором случае добавлено эквивалентное
количество NaOH.
Концентрация соли будет равна
рН можно рассчитать
по уравнению (1.50)
В
последнем случае введен избыток сильного
основания. Концентрация его будет равна
рН =
14 + lg(2.5×10-4)
= 10.40.
Пример
4. К
100.00 мл 0.100 М раствора фосфорной кислоты
(pK1
= 2.12; рК2
= 7.20; рК3
=
12.3) добавлены различные объемы 0.100 М
раствора КОН: 1) 99.50 мл, 2) 100.50 мл, 3) 199.50 мл,
4) 200.00 мл. Вычислить рН растворов.
Решение.
Запишем уравнения реакций
Найдем,
концентрацию Н3РО4
(),
H2РО4—
(),
НРО42-
(),
в мМ на данный объем:
1) =
100×0.1
— 99.5×0.1
= 0.05
мМ,
=
99.5×0.1
= 9.95 мМ;
2)
=
100.5×0.1
-100×0.1
= 0.05 мМ;
=
100×0.1
— 0.05 = 9.95 мМ;
3)
= 199.5×0.1
— 100×
0.1 = 9.95 мМ,
=
100×0.1
— 9.95 = 0.05 мМ;
4)
= 100×0.1
= 10 мМ,
В
первом случае в растворе образовалась
буферная смесь Н3РО4
+ Н2РО4—.
1)

Во
втором и третьем случаях буферная смесь
содержит Н2РО4—
и НРО42-
2)
.
3)
В
последнем случае добавлено 2 эквивалента
КОН, в растворе присутствует только
К2НРО4,
рН можно вычислить по уравнению (5.6)
З а
д а ч и
Вычислить рН
растворов
589. К
20 мл 0.12 М раствора гидроксида натрия
добавлено 5.2 мл 0.24 М раствора хлороводородной
кислоты.
-
К 25
мл азотной кислоты с титром 0.006128
добавлено 20.25 мл 0.1105 М раствора едкого
натра. -
К 20
мл 0.175 н раствора серной кислоты добавлено
35 мл гидроксида натрия, титр которого
0,.004000. -
.0.1 М
раствор хлороводородной кислоты
нейтрализован 0.1 М раствором едкого
натра на 80%. -
К 100
мл 0.01 н раствора хлороводородной кислоты
добавлено 99.9 мл, 100.0 мл, 100.1 мл 0.01 н
раствора гидроксида натрия.
-
К 20
мл 0,15 н раствора муравьиной кислоты
добавлено 40 мл 0.075 М раствора КОН. -
К 100
мл 0.1 н раствора одноосновной кислоты
(К = 1×10-6)
добавлено 99.9 мл 0.1 М раствора NaOH. -
К 30
мл 0.15 н раствора уксусной кислоты
добавлено 60 мл 0.075 М раствора гидроксида
натрия. -
К
20.55 мл 0.1 М раствора аммиака добавлено:
1) 20.50 мл, 2) 20.86 мл, 3) 21.00 мл 0.0985 М раствора
НС1. -
К 50
мл 0,1 н раствора бутиламина (C4H9NH2,
К = 4×10-4)
добавлено 20 мл 0.25 М раствора HCl.
С каким индикатором следует проводить
титрование бутиламина? -
0.1 н
раствор буры оттитрован на 100% 0.1 н
раствором хлороводородной кислоты. -
К 20
мл 0.1036 М раствора фосфорной кислоты
добавлено 15.82 мл 0.1307 М раствора гидроксида
натрия. -
К 17.5
мл 0.12 М раствора фосфорной кислоты
добавлено 35 мл 0.12 М раствора КОН. -
К 25
мл 0.12 М раствора фосфорной кислоты
добавлено 30.00 мл 0.25 М раствора КОН. -
К
15.05 мл 0.1 М раствора фосфорной кислоты
добавлено 45.15 мл 0.1 М раствора NaOH. -
К
24.30 мл 0.12 М раствора Na3PO4
добавлено 40.52 мл 0.12 М раствора НС1. -
К 20
мл 0.125 М раствора карбоната натрия
добавлено 24.00 мл, 25.00 мл, 50.00 мл 0.1 М
раствора НС1. -
К
20.50 мл 0.1 М раствора мышьяковой кислоты
добавлено 45 мл 0.1 М раствора КОН.
-
К
18.75 мл 0.112 М раствора щавелевой кислоты
добавлено
38.00 мл, 40.00 мл 0.109 М раствора NaOH. -
К
18.75 мл 0.1 М раствора гидразина добавлено
14.5 мл и 15.00 мл 0.125 М раствора NaOH. -
К
19.,25 мл 0.105 н раствора гидроксиламина
добавлено 10.10 мл, 19.50 мл, 20.20 мл 0.1 н
раствора НС1.I -
К 25
мл 0.02723 М раствора НС1 добавлено 20 мл
0.1 М раствора Na2HPO4. -
К
20.50 мл раствора НС1 добавлено 20.55 мл
0.100 М раствора аммиака; рН = 7.52. Найти
концентрацию раствора НС1. -
К
25.00 мл раствора НС1 добавлено 22.20 мл
0.125 М раствора аммиака; рН = 7.24. Вычислить
концентрацию раствора НС1. -
К
14.78 мл раствора фосфорной кислоты
добавлено 30.00 мл 0.0980 М раствора NaOH;
рН = 2.50. Найти концентрацию раствора
Н3РО4 -
К
20.15 мл 0,100 М раствора Na3PO4
добавлено 19.84 мл раствора НС1О4;
рН = 5.72. Вычислить концентрацию раствора
НСlO4. -
К
24.30 мл 0.120 М раствора Na3PO4
добавлено 40.52 мл раствора HNO3;
рН = 7.80. Рассчитать концентрацию раствора
HNO3. -
К
25.00 мл 0.100 М раствора карбоната натрия
добавлено 14.71 мл раствора НС1; рН = 7.00.
Найти концентрацию раствора НС1. -
К
22.00 мл 0.2500 М раствора НС1 добавлено 22.20
мл раствора карбоната натрия; рН = 4.65.
Рассчитать концентрацию раствора
Na2CO3. -
К
20.00 мл 0.125 М раствора фосфорной кислоты
добавлено 50.00 мл раствора NaOH;
рН = 11.50. Найти концентрацию раствора
NaOH. -
К
25.00 мл 0.100 М раствора дигидрофосфата
натрия добавлено 24.50 мл раствора КОН;
рН = 8.40. Рассчитать концентрацию раствора
КОН.
5.1.2.
Индикаторные
ошибки кислотно-основного титрования.
При кислотно-основном
титровании индикаторные ошибки
обусловлены несовпадением показателя
титрования индикатора рТ (величины рН,
при котором наблюдается наиболее резкое
изменение окраски) и рН в точке
эквивалентности.
Различают следующие
типы индикаторных ошибок:
1)
Водородная (Н-ошибка) или гидроксидная
ошибка (ОН-ошибка), возникающие в том
случае, когда индикатор меняет свою
окраску при некотором избытке сильной
кислоты или соответственно сильного
основания;
2)
кислотная или основная ошибки. В этом
случае в момент изменения окраски
индикатора остается неоттитрованной
некоторая часть слабой кислоты или
слабого основания.
Н-ошибка
(xH)
связана с индикаторами, рТ которых <
7, и может быть вычислена по уравнению
|
|
(5.7) |
где
СH
-концентрация титруемой сильной кислоты
(моль/л), V1
— первоначальный объем раствора, V2
—объем
раствора в конце титрования.
Для
индикаторов с рТ > 7 характерна ОН-ошибка
(xOH),
которая вычисляется по уравнению
|
|
(5.8) |
где
СOH
—
концентрация сильного основания
(моль/л).
Для
вычисления кислотной ошибки (xHА)
можно
использовать
формулу степени нейтрализации (W)
А.
М. Васильева
|
|
(5.9) |
или,
поскольку титрование с данным индикатором
заканчивается при [Н+]
= 10—pT,
|
|
(5.10) |
Очевидно,
что
|
xHА |
(5.11) |
или
|
|
(5.12) |
Аналогичным
образом могут быть найдены солевая (хА)
или
щелочная (хB)
ошибки.
Пример
5.
Вычислить ошибку титрования 0.2 н раствора
НС1 0.2 н NaOH
с индикатором метиловым оранжевым (рТ
= 4).
Решение.
Поскольку концентрации растворов
кислоты и щелочи одинаковы, то по
окончании титрования V2
= 2Vl.
Титрование
закончится при рН = 4, следовательно, в
растворе останется избыток Н+-ионов,
обусловливающих «водородную»
ошибку
Пример
6. Вычислить
индикаторную ошибку титрования 0.2 н НС1
0.2 н NaOH
с фенолфталеином (рТ = 9).
Решение.
Титрование закончится при рН = 9,
следовательно,
в растворе будет избыток щелочи, что
вызовет ОН-ошибку
Пример
7. Вычислить
ошибку титрования муравьиной кислоты
раствором сильного основания с индикатором
метиловым красным (рТ = 5;
= 1.77×10-4).
Решение.
Титрование заканчивается при рН=5. В
растворе останется неоттитрованная
кислота НСООН. Вычислим кислотную ошибку
титрования
Пример
8.
Вычислить ошибку титрования ацетата
натрия соляной кислотой с индикатором
метиловым оранжевым (рТ = 4; КНА=
1.8×10-5).
Решение.
В данном случае будем определять солевую
ошибку (xA),
обусловленную
неоттитрованной солью (CH3COONa)
при указанном рН.
Степень
оттитрования CH3COONa
(WA)при
рН = 4 будет составлять
Ошибка
титрования: 100 —
85 = 15%.
Пример
9. Вычислить
ошибку титрования гидроксиламина (KB
= 9.33×10-9)
соляной кислотой с индикатором метиловым
красным (рТ = 5).
Решение.
Здесь ошибка будет в основном обусловлена
неоттитрованным слабым основанием при
указанном рН (хB)
З
а
д
а
ч
и
Вычислить ошибку
титрования
-
0.5 н
раствора HC1
0.15 н раствором NaOH
с индикатором тимолфталеином (рТ = 10). -
0,2 н
раствора HG1
0.2 н раствором NaOH
с индикатором нейтральным красным (рТ
= 7). -
0.1 н
раствора НС1 0.2 н раствором NaOH
с индикатором фенолфталеином (рТ = 9). -
0.21 н
раствора HС1
0.3 н раствором NaOH
с индикатором метиловый красным (рТ =
5). -
0.1 н
раствора HСI
0.1 н раствором NaOH
с индикатором метиловым оранжевым (рТ
= 4). -
0.1 М
раствора H2SO4
0.2 н раствором NaOH
с индикатором метиловым оранжевым (рТ
= 4).
625.
0.05 М
раствора H2SO4
0.1 н раствором NaOH
с индикатором фенолфталеином (рТ = 9).
-
0.1 н
раствора НСООН 0.1 н раствором NaOH
с индикатором фенолфталеином (рТ = 9). -
0.2 н
раствора НСООН 0.3 н раствором NaOH
с метиловым оранжевым (рТ = 4). -
0.1 н
раствора НСООН 0.1 н раствором NaOH
с индикатором метиловым оранжевым (рТ
= 4).
30. 0.1
н
раствора уксусной кислоты 0.1 н раствором
NaOH
с индикатором нейтральным красным (рТ
= 7).
631. 0.2
н
раствора СН3СООН
0.2 н раствором щелочи с индикатором
фенолфталеином (рТ = 9).
632. Определить
степень оттитрования 0.2 н раствора
СН3СООН
0.2 н раствором щелочи с индикатором
метиловым оранжевым (рТ = 4).
633. Можно
ли титровать 0.005 М раствор H2SO4
0.01
н NaOH
с метиловым оранжевым (рТ = 4)?
-
Можно
ли титровать 0.001 н раствор НС1 0.001 н
раствором NaOH
с метиловым красным (рТ =5)? -
Чему
равняется ошибка титрования 0.1 н раствора
NH3
0.1 н раствором НС1 с индикатором крезоловым
пурпурным (рН = 8)? -
Чему
равняется ошибка титрования 0.2 н раствора
NH3
0.2 н раствором НС1 с нейтральным красным
(рТ = 7)? -
Вычислить
солевую индикаторную ошибку при
титровании натриевой соли н-масляной
кислоты хлороводородной кислотой с
индикатором метиловым красным (рТ = 5). -
Вычислить
ошибку титрования ацетата натрия
хлороводороднсй кислотой с индикатором
метиловым красным (рТ = 5).
5.2.
Окислительно-восстановительные
реакции
Количественной
характеристикой окислительно-восстановительных,
свойств системы
является
величина окислительно-восстановительного
потенциала (Е)
|
|
(5.13) |
где
E0—
стандартный окислительно-восстановительный
потенциал данной системы; аox
— активность
окисленной формы (Аox);
аred
—
активность восстановленной формы
(Аred).
Принимая
в первом приближении активности равными
концентрациям веществ и подставляя в
уравнение (5.13) значения постоянных
величин, получим следующее выражение
для Е
(при
температура 25°), которое и будем
использовать в дальнейшем,
|
|
(5.14) |
Для
системы
|
|
(5.15) |
С
изменением концентрации Н+-потенциал
изменяется.
Окислительно-восстановительный
потенциал изменяется также в присутствии
веществ, образующих либо с окисленной,
либо с восстановленной формами
малорастворимые или комплексные
соединения.
Константа
равновесия окислительно-восстановительной
реакции
|
|
(5.16) |
определяется из
следующего уравнения:
|
|
(5.17) |
где z
— общее
число электронов, участвующих в данной
реакции; ЕC,
E0»
окислительно-восстановительные
потенциалы систем Аox/Аred
и Вox/Вred.
При
титровании восстановителя окислителем
(или наоборот) изменяется величина
окислительно-восстановительного
потенциала. Для вычисления потенциала
в процессе титрования можно использовать
уравнение (5.14). При этом до точки
эквивалентности удобнее вычислять
изменение потенциала титруемой системы,
а после точки эквивалентности рассчитывать
потенциал пары титрант / продукт
его восстановления или окисления.
Потенциал в точке эквивалентности
(Eэкв)
дается уравнением (5.18) для реакции типа
(5.16)
|
|
(5.18) |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Индикаторная ошибка — титрование
Cтраница 1
Индикаторная ошибка титрования вычисляется аналогично ошибке в осадительном титровании. Для этого нужно знать концентрацию взятого для титрования [ Me ], [ Me ] в точке эквивалентности, которая вычисляется на основании константы устойчивости комплекса с ЭДТА при данном рН и [ Me ] в момент, когда индикатор меняет окраску. Эта величина вычисляется с использованием константы устойчивости комплекса металла с индикатором.
[1]
Индикаторной ошибкой титрования называют погрешность, которая вызывается несовпадением показателя титрования, используемого индикатора с41 величиной рН в точке эквивалентности.
[3]
Индикаторной ошибкой титрования называют погрешность, которая вызывается несовпадением показателя титрования используемого индикатора с величиной рН в точке эквивалентности.
[4]
При вычислении индикаторной ошибки титрования используют эти же формулы, но неизвестной величиной будет являться концентрация соответствующей кислоты ( основания) или соли.
[5]
Эту погрешность называют индикаторной ошибкой титрования.
[6]
Таким образом, возможны четыре индикаторные ошибки титрования в методе нейтрализации: водородная, гидроксильная, кислотная и щелочная.
[7]
Имеется полная аналогия в вычислении индикаторных ошибок титрования в кислотно-основном и осацительном титровании.
[8]
Как уже было указано, индикаторной ошибкой титрования является погрешность, которая обусловлена несовпадением показателя титрования применяемого индикатора с величиной рН в точке эквивалентности. При этом различают четыре основных типа индикаторных ошибок.
[9]
Выше было показано, как путем вычисления индикаторной ошибки титрования решать вопрос о пригодности какого-либо заранее заданного индикатора. Если же индикатор не указан, то выбирают такой, показатель титрования которого возможно ближе подходит к величине рН в точке эквивалентности ( находимой по известным формулам), и вычисляют для него индикаторную ошибку титрования.
[10]
Выше было показано, как путем вычисления индикаторной ошибки титрования решается вопрос о пригодности какого-либо заранее заданного индикатора.
[11]
Выше было показано, как путем вычисления индикаторной ошибки титрования решается вопрос о пригодности какого-либо заранее заданного индикатора.
[12]
Таким образом, по Бьерруму, возможны четыре индикаторные ошибки титрования в методе нейтрализации: водородная, гидро-ксильная, кислотная и щелочная.
[13]
Чтобы окраска окислительно-восстановительного индикатора изменялась при титровании резко и индикаторная ошибка титрования была незначительной, необходимо, чтобы область перехода индикатора находилась в пределах скачка потенциалов на кривой титрования.
[14]
Страницы:
1
2
3



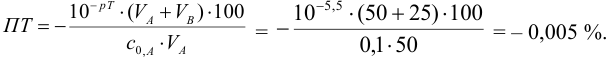
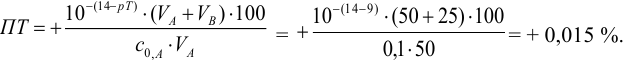
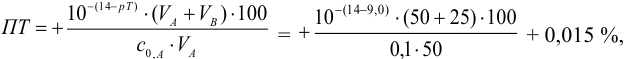
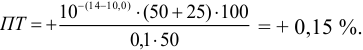
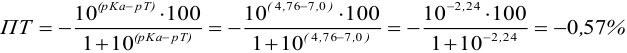
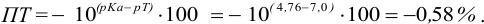
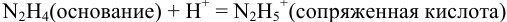
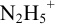
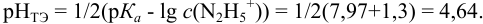
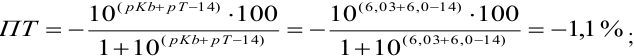
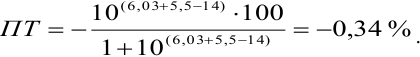

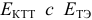 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.