Диагностика заболеваний редко обходится без инструментальных и лабораторных исследований. Оценки симптомов недостаточно — нужно узнать, что происходит внутри органов и тканей. Одним из наиболее точных методов обследования является биопсия. Врач производит забор тканевого материала в области предполагаемого патологического процесса с целью его дальнейшего изучения. Микроскопический анализ полученного образца помогает выявить характерные для определенного заболевания изменения. В онкологической практике биопсия считается информативным методом уточнения типа опухоли, ее стадирования.
- Что это за анализ?
- Показания к проведению
- Виды и способы проведения биопсии
- Подготовка
- Может ли биопсия быть ошибочной?
Что это за анализ?
Биопсия — высокоинформативный способ обследования, применяемый в случае необходимости анализа клеток в определенной анатомической области. Забор тканей с их последующим обследованием с помощью микроскопии дает возможность точно оценить клеточный состав. Без такой процедуры сложно обойтись, если врач подозревает наличие доброкачественного или злокачественного новообразования в определенном органе. Это уточняющее исследование, дополняющее результаты других диагностических процедур. Онколог анализирует результаты биопсии, рентгенографии, эндоскопии и иммунологических тестов совместно.
Онкологические заболевания развиваются быстро и угрожают жизни пациента. Нужно как можно раньше выбрать наиболее эффективную схему лечения. Именно с этой целью проводится биопсия. По результатам процедуры врач приходит к выводу, какие травматичные или даже опасные с точки зрения осложнений способы лечения уместны в данном случае. Подбирается тактика оперативного вмешательства, радиотерапии, химиотерапевтического лечения. Все это было бы невозможно без точного определения типа опухоли, ее стадии и распространенности в организме. Нужны цитологические и гистологические тесты.
В качестве примера можно привести злокачественное новообразование прямой кишки, растущее в нижней части органа. В качестве основного метода лечения выполняется иссечение этой анатомической структуры с последующим формированием колостомы для выделения каловых масс. Если диагноз не был полностью подтвержден, подобное вмешательство не проводят. Оно может по ошибке сделать пациента инвалидом.
Показания к проведению
Подобная диагностическая процедура требуется, если врач предполагает о наличии патологического процесса, подтверждение которого невозможно с помощью других способов исследования. В большинстве случаев это онкологические болезни, однако область применения биопсии ими не ограничивается. Например, такое исследование часто назначают гастроэнтерологи для оценки состояния слизистой оболочки органов пищеварительного тракта. Определяется вид воспалительного процесса, подбирается способ его лечения. В гинекологии и эндокринологии этот метод дает возможность определить причину нарушения фертильности, обнаружить ранние признаки воспаления и дисплазии.
Также биопсия необходима для определения особенностей течения и степени тяжести патологического процесса при болезнях печеночной ткани, почек, головного мозга, мышц и других анатомических структур. Это важно для подбора и изменения схемы медикаментозной терапии. По результатам анализа врач определяет прогностические данные.
Виды и способы проведения биопсии
В современной клинической практике чаще всего используют следующие методики выполнения биопсии:
- Мазки, соскобы и бритвенный метод. Зачастую специалисту требуется небольшое количество материала для постановки диагноза. Можно выполнить мазок и получить все необходимые данные при его последующей микроскопии. Например, такой способ часто применяют в гинекологии. Бритвенная биопсия предполагает иссечение тонкого участка кожного покрова с помощью скальпеля или другого инструмента.
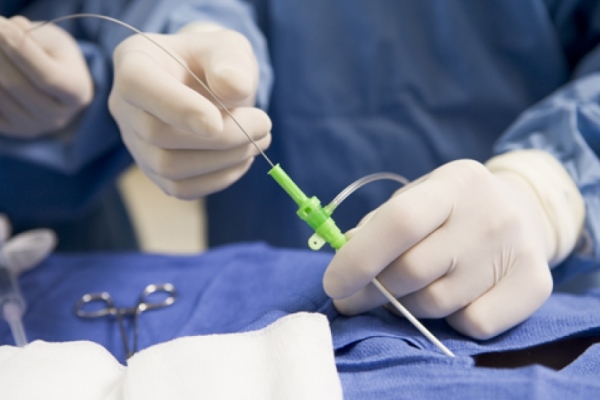
- Тонкоигольная пункция. Такая процедура тоже подходит для случаев, когда достаточно получить немного клеток. В область предполагаемого патологического процесса вводится тонкая игла, захватывающая тканевой образец.
- Толстоигольная пункция. Позволяет произвести забор большого образца тканей без иссечения. Ее назначают при злокачественном новообразовании молочной железы, печеночной ткани, предстательной железы. Трепан-биопсия подходит для исследования кожного покрова, костномозговых структур. Используется специальный инструмент в форме цилиндра.
- Аспирационный метод. Это современная техника забора материала, при котором используется вакуумный прибор в форме цилиндра. В качестве механизма применяется отрицательное давление. Прибор присоединяют к игле. Аспирация дает возможность взять несколько образцов в разных участках анатомической структуры.
- Операционная биопсия. Проводится непосредственно во время операции, когда врач иссекает опухолевую ткань. Это высокоинформативное исследование, позволяющее оценить состояние большого количества тканей. Минус такого вида процедуры — определить тип болезни можно только после операции. Плюсом можно считать совмещение лечебной практики с достоверной диагностикой.
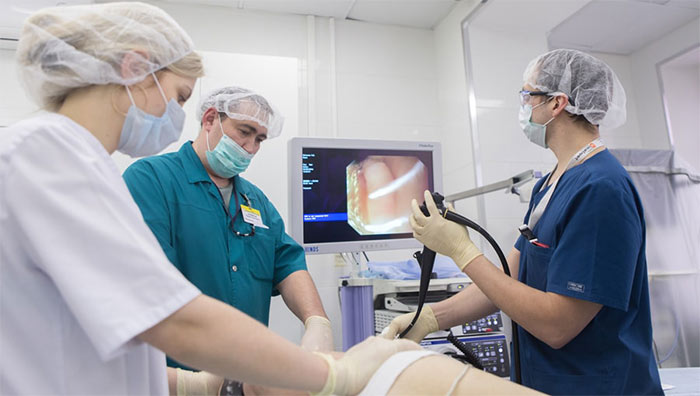
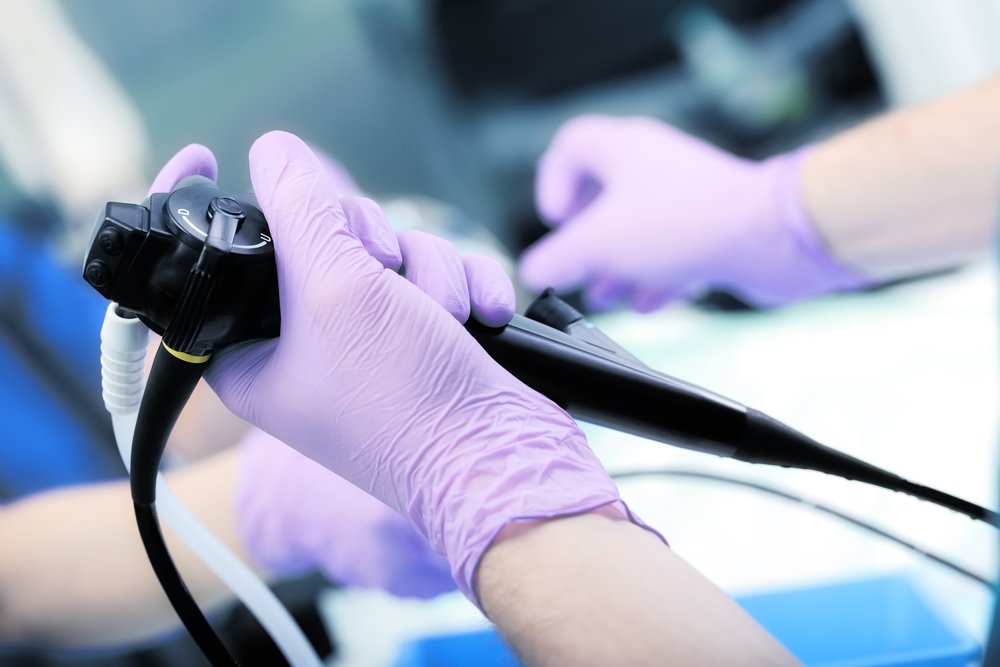
- Эндоскопическая биопсия. Проводится во время диагностики внутренних полостных структур, вроде пищеварительного или респираторного тракта. С помощью эндоскопа врач осматривает подозрительные участки тканей и выбирает место забора материала. Плюсом такой техники можно считать повышенную точность результатов исследования.
Способ проведения диагностики выбирают в зависимости от анамнеза пациента.
Подготовка
В большинстве случаев специально готовиться не следует. Достаточно прийти к врачу в день проведения процедуры и подписать необходимые документы. Специалист объяснит, как будет проходить обследование. Расскажет о рисках и возможных неприятных ощущениях. Определенные виды биопсии выполняют под местным обезболиванием. Реже требуется наркоз. Пациент может сам выбирать комфортный для него способ выполнения диагностики. В случае наркоза нужны специальные подготовительные процедуры.
Для биопсии характерны стандартные осложнения, возникающие при других видах вмешательств. Возможно кровоизлияние, инфицирование тканей. Реже возникает травматизация внутренних органов. Такие негативные последствия редки, но врач обязательно уведомляет пациента о рисках.
Может ли биопсия быть ошибочной?
Достоверность исследования зависит от способа его проведения, анамнеза пациента, опыта врача и других факторов. Например, при пункции специалист может получить образец тканей без злокачественных клеток, если игла попала в соседнюю с опухолью область. В этом случае возможен ложноположительный результат. Онкологи учитывают такую вероятность, и всегда назначают уточняющие исследования. Диагноз не ставится только на основе результатов одной процедуры. Всегда проводится комплексная оценка состояния организма.
Быстрая и надежная диагностика злокачественных новообразований — одна из основных задач современной онкологии. На поздней стадии многие опухоли выявляются достаточно просто, но прогноз в этом случае чаще всего оказывается неблагоприятным. Основные трудности для диагностики представляют именно ранние или редкие формы онкологических заболеваний, при которых симптомы еще отсутствуют, а опухоль при этом активно растет и метастазирует.
Вне зависимости от того, на какой стадии заболевания врачам удалось установить диагноз, известие о наличии онкологического заболевания, как правило, оказывается шоком для самого пациента и его близких.
Чтобы сократить время, необходимое для назначения оптимального лечения (а значит, в конечном счете, улучшить прогноз), следует убедиться в том, что лечащий врач достаточно компетентен и способен в сжатые сроки определить необходимый объем диагностических исследований.
Насторожиться следует в случаях, когда врач не может однозначно и просто описать имеющуюся проблему и предлагает, например, провести хирургическую операцию для диагностики или, напротив, предлагает лечение без обследования, не объясняя, какими средствами и с какой целью будет проводиться терапия.
В этих случаях рекомендуется обратиться к другому онкологу для уточнения диагноза и получения так называемого «второго мнения». В распоряжении врачей, работающих в современных клиниках, сегодня имеется широкий арсенал средств для диагностики и лечения онкологических заболеваний, важно лишь правильно выбрать место лечения и доктора, который обладает достаточной квалификацией для того, чтобы разобраться в проблемах конкретного пациента.
Также следует отметить, что лечение в специализированных медицинских центрах, работающих по самым современным протоколам, может оказаться более эффективным, нежели терапия по месту жительства, поскольку выбор препаратов для химиотерапии (равно как и других методов лечения) в таких клиниках, как правило, существенно шире.
Подозрение на рак — обследование
Для обследования пациента с подозрением на онкологическое заболевание или больного, диагноз которого уже установлен, но вызывает сомнения, могут применяться различные методы лабораторной и инструментальной диагностики.
Лабораторные общеклинические анализы показывают в основном неспецифические изменения. Особенно важны в онкологической практике показатели периферической крови и костного мозга, а именно — эритропоэз и изменения лейкоцитарной формулы. До 70–80% случаев рака сопровождаются гипохромной анемией с изменением формы и размеров эритроцитов. Количество лейкоцитов и степень их зрелости при разных заболеваниях значительно варьируют — от лейкопении до лейкоцитоза.
Рентгенодиагностика занимает одно из ведущих мест в онкологии, ее методы постоянно совершенствуются. Компьютерная, магнитно-резонансная томография и исследования с контрастом позволяют обнаружить опухоль и метастазы даже при небольших размерах.
Благодаря эндоскопическим методам можно провести детальный осмотр новообразования в полостях и полых органах, а также взять кусочек ткани на биопсию.
УЗИ чаще всего применяют в диагностике опухолей щитовидной и молочной желез, малого таза, брюшной полости и забрюшинного пространства, мягких тканей, лимфатических узлов. Это доступный и простой метод, чувствительность которого может достигать 90%. Под контролем УЗИ проводят аспирационную биопсию опухолей.
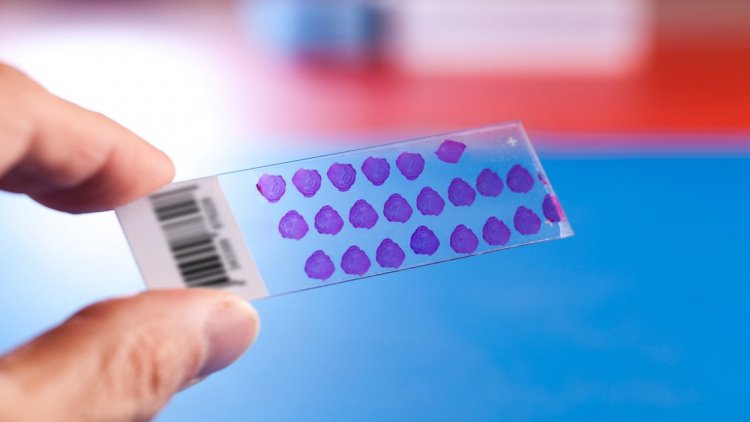
Гистологическое и цитологическое исследования позволяют установить морфологический диагноз, степень злокачественности процесса и выбрать подходящую тактику ведения пациентов. Без них в онкологии невозможно установить окончательный диагноз. Для обнаружения атипичных клеток на гистологический анализ берут кусочек ткани, полученный при биопсии или в ходе операции. Для цитологического исследования используется клеточный материал. На цитологии под микроскопом с высокой разрешающей способностью исследуют материал, полученный путем аспирации или отслаивания (эксфолиации) клеток. Его специально концентрируют, чтобы увеличить количество клеток в объеме материала. Его фиксируют, окрашивают и изучают под микроскопом на предмет атипичных клеток. Это позволяет провести дифференциальную диагностику между злокачественными и доброкачественными опухолями.
Уточняющие методы обследования
Существует ряд обследований, которые помогают уточнить онкологический диагноз в сомнительных случаях.
Иммунодиагностика позволяет обнаружить антигены опухолевых клеток, которые отличаются от нормальных клеточных антигенов. Кровь и моча пациента содержат опухолевые маркеры, их выявляют при помощи реагентов, содержащих специальные антитела, при реакции ИФА. Наибольшую практическую ценность имеют такие антигены, как α-фетопротеин, PSA, СА-125, раково-эмбриональный антиген, хорионический гонадотропин, трофобластический В-глобулин.
Уточняющие онкологический диагноз обследования чаще всего сложные и дорогостоящие, поэтому не применяются массово в качестве скрининга. Но они обладают высокой точностью и в спорных ситуациях помогают врачу поставить верный диагноз. Уточняющая диагностика необходима не для удовлетворения академического интереса лечебного учреждения или врача, она призвана разрешить серьёзные сомнения в диагнозе, которые не отмели традиционные и не столь дорогие исследования. Возможно, с её помощью удастся разрешить вопрос «рак или не рак» или подобрать лучшее – оптимальное лечение опухоли. В любом случае эти исследования – крайняя необходимость, без которой невозможно решить важнейший для жизни вопрос, и тогда цена процедуры – вопрос совсем не главный.
Важен комплексный подход к диагностике, когда на начальном этапе выполняется стандартное и утверждённое клиническими рекомендациями обследование, а далее, по мере необходимости – крайней диагностической необходимости, поэтапно проводятся дополнительные исследования. Не все сразу, а только после тщательного анализа информативности предыдущего этапа. Перед каждым обследованием врач должен рассказать, на какие важные для пациента вопросы он надеется получить ответ, какие варианты ответов возможны, какие трактовки результатов удовлетворят его и помогут пациенту скорее начать лечение.
Можно назначать всё известное науке, используя всю установленную в медицинском центре аппаратуру, но также можно делать только необходимое, в оптимальном объёме и в разумные сроки. Стоимость процедур очень важна, но не важнее жизни. Наша клиника может предложить оптимальный подход во всём – и в диагностике, и в лечении, тем более что у нас есть всё, что позволит сделать это быстро и очень качественно.
Биопсия — самый «близкий к телу» метод диагностики. От пациента отщипывают кусочек и изучают под микроскопом. В воображении некоторых пациентов биопсия приравнивается чуть ли не к хирургической операции. Это не так, хотя и то, и другое может проводиться одновременно. Что же такое биопсия, какая она бывает и для чего проводится, рассказывает MedAboutMe.
Что такое биопсия в медицине?
Биопсия — это метод анализа тканей человеческого организма. Суть его очень проста: взять образец органа (биоптат), извлечь его из организма и внимательно рассмотреть. Собственно, сам термин это и означает в переводе с греческого: bios — живой и opsis — наблюдение при помощи глаз, то есть, визуальное исследование живой ткани.
История биопсии начинается с имени арабского врача Альбукасиса, которого называют мусульманским отцом хирургии — он же Абу аль-Касим Аль-Захрави. Именно он впервые использовал полую иглу, чтобы получить образец тканей зоба щитовидной железы и впоследствии исследовать его. Долгое время врачи делали биопсию, скорее, случайно, чем намеренно. Но в конце XIX века все изменилось. Технологии исследования тканей при помощи микроскопа и возможности взятия образцов развились достаточно — и медицина получила новый метод.
В России первую диагностику при помощи биопсии провел в 1875 году доктор М.М. Руднев. В 1878 году немецкие ученые описали исследование образца шейки матки. А в 1879 году парижский дерматолог Эрнест Анри Бенье, который проводил научные изыскания в области болезней кожи, ввел термин «биопсия», обозначив им процедуру взятия образцов тканей.
Следует понимать, что биопсия — это инвазивный метод, то есть, при этом совершается проникновение в тело человека. И это травматичный метод, приводящий хоть и к минимальным, но повреждениям тканей. Поэтому врачи назначают биопсию тогда, когда без нее не обойтись. Просто так данный метод никогда не используется.
Итак, биопсия позволяет получить образец клеток или тканей. Его можно изучать на клеточном уровне, то есть, исследуется состояние отдельных клеток и их компонентов — цитологическое исследование, для которого может использоваться световой или более мощный, электронный микроскоп. А можно при помощи светового микроскопа анализировать срез ткани — при многих заболеваниях изменения происходят в структуре ткани органа. Иногда при проведении гистологического анализа требуется предварительная обработка образцов специальными растворами — их окрашивание или иная подготовка для диагностики.
В зависимости от того, какой метод предполагается использовать, биопсия проводится разными путями.
Как получить образец для исследования при биопсии?
Для цитологического исследования образцы материала получают одним из следующих методов:
- Соскоб (мазок) — с пораженных тканей специальным шпателем или скальпелем на предметное стекло соскребается некоторое количество материала.
- Тонкоигольная биопсия — клетки органа или жидкость забираются путем отсасывания через полую длинную тонкую иглу. Так получают образцы костного мозга или кист.
При заборе кусочка тканей, в зависимости от того, какие ткани и каким образом надо исследовать, выделяют два вида биопсии:
- Эксцизионная — при этом удаляется и направляется на исследование все образование, а не отдельная его часть. Например, это может быть подозрительная родинка. В этом случае биопсия является одновременно и лечебной, и диагностической процедурой: сначала подозрительные ткани полностью удаляют, а потом проверяют: насколько они были опасны и не стоит ли поискать другие проявления болезни.
- Инцизионная — на исследование забирается только часть пораженной болезнью ткани.
Забор тканей может проводиться разными путями:
- Пункционная биопсия — образец тканей забирается при помощи полой иглы. Обычно используется для получения образца тканей, расположенных недалеко от поверхности кожи.
- Трепан-биопсия позволяет получать образец ткани в виде столбика при помощи трепана — специальной полой трубки. Используется при необходимости получения образца из плотных опухолей и костей.
- Кор-биопсия (режущая, сердцевинная биопсия) — разновидность трепан-биопсии, отличающаяся от нее механическими особенностями трепана. Проводится при помощи биопсийного пистолета — устройства для получения образцов молочной и щитовидной желез, почек, простаты, печени и других мягких тканей.
- Петлевая биопсия — при этом образец забирается при использовании петли и устройства, позволяющего резать ткань (коагулятор или радиочастотный аппарат). Проводят при эндоскопических исследованиях, а также при гинекологическом обследовании и др.
- Щипковая биопсия (панч-биопсия) — образец ткани удается получить при помощи специальных щипцов. Чаще всего используется при заболеваниях пищевод, желудка и кишечника.
- Скарификационная биопсия проводится устройством, позволяющим срезать тонкий слой ткани. Обычно используется при необходимости проведения биопсии кожи.
Самый частый побочный эффект биопсии — боль при проведении процедуры. Поэтому в большинстве случаев предварительно проводится местная анестезия — обезболивание конкретного участка, на котором будет проводиться забор тканей. Но, если речь идет только о соскобе, то, конечно, анестезия не нужна.
Биопсия не проводится при нарушениях свертываемости крови, а также при возможности получить требуемые данные другими, неинвазивными методами диагностики.
Биопсия и диагностика заболеваний
Устоялось мнение, что биопсия проводится, прежде всего, для опровержения или подтверждения предварительного диагноза «рак». И действительно, этот метод обязателен для окончательной постановки диагноза онкологами. Но он также успешно применяется и в других направлениях медицины, а не только в онкологии.
- Урологи исследуют ткани мочеполовой и мочевыделительных систем для поиска воспалительных процессов почек и мочевого пузыря, а также кистозных образований в них;
- Гинекологи при помощи биопсии диагностируют бесплодие, воспаление, предраковые состояния, а также некоторые эндокринные болезни;
- Гастроэнтерологи анализируют состояние желудочно-кишечного тракта: выявляют участки воспаления и ткани в предраковом состоянии и др.;
- Пункция лимфатических узлов проводится для их оценки при аутоиммунных, инфекционных и онкологических заболеваниях.
- Биопсия пересаженных органов необходима, чтобы проверить, не идет ли реакция отторжения.
- Пункция спермы может проводиться для оценки фертильности в ходе лечения бесплодия.
А в феврале этого года американские ученые сообщили, что разработали метод ранней диагностики болезни Паркинсона путем биопсии тканей подчелюстной слюнной железы. Метод позволяет выявить белок, указывающий на наличие болезни, на стадии, когда нет даже первых признаков заболевания. Это значит, что можно будет раньше начать лечение.
Обычно биопсия назначается, когда нет других возможностей получить информацию о клетках и тканях пораженного органа. Причем нередко забор тканей проводится «заодно» — раз уж все равно добрались до больного органа, почему бы не отщипнуть кусочек для анализа. То есть, взять образец тканей можно в процессе хирургической операции или других диагностических процедур, таких как:
- эндоскопия,
- колоноскопия,
- бронхоскопия и др.
Для проведения биопсии врач может воспользоваться дополнительным оборудованием, позволяющим наблюдать за процедурой, чтобы «не промахнуться» — томографом, аппаратом УЗИ или иной аппаратурой.
Ошибки при проведении биопсии
Идеальных методов диагностики медицина не знает. При проведении биопсии тоже возможны ошибки и получение ложноотрицательного результата, то есть, болезнь есть, но ее не нашли. Так, считается, что гистологическое исследование тканей — довольно точный метод и достоверен на 90%. Что может быть причиной ошибок при биопсии:
- при заборе было получено слишком мало материала и его оказалось недостаточно для полноценной диагностики;
- забор материала для анализа произведен не из опухоли, а из здоровых тканей рядом с ней;
- материал взят из зоны фиброза или некроза опухоли и не дает достаточно информации, чтобы определить наличие злокачественного образования;
- при подготовке материала к исследованию срез был проведен под неудачным углом;
- врач-морфолог не обладал достаточным опытом для выявления характерных признаков на сложном образце.
Выводы
- Биопсия — инвазивный, но малотравматичный метод диагностики, который никогда не назначается врачом просто так, без достаточных на то оснований. Если врач считает, что нужна биопсия — лучше не спорить, часто вовремя проведенный анализ является залогом жизни пациента.
- Современные технологии позволяют провести биопсию качественно и практически безболезненно.
- Результаты биопсии считаются окончательными. По ним врач может назначать лечение. Если результаты вызывают сомнения у врача (например, по всем признакам есть опухоль, а биопсия ее не показала) — возможна ошибка при заборе пробы. В этом случае врач может направить пациента на повторный анализ.
- Если результаты биопсии вызывают сомнения у пациента, он может забрать свои «стекла» с гистологическими срезами и отправить их на повторный анализ в другую клинику.
Клиническая лабораторная диагностика: национальное руководство / Под ред. В. В. Долгова, В. В. Меньшикова. – 2012
Руководство по лабораторным методам диагностики / Кишкун А.А. – 2013
Получение в раках проводимой биопсии биологического образца для его последующего изучения, как и сами результаты диагностического исследования, могут быть ошибочными. Помимо человеческого фактора и неточности в самой аппаратуре, медики выделяют и иные предрасполагающие факторы, влияющие на точность итогового результата.
Ошибка в биопсии
Образец забранной ткани для последующего гистологического анализа может быть получен самыми разными методами, которые существуют в рамках малоинвазивной хирургии. Так в ходе проведения пункционного вида биопсии – материал забирают посредством трубки и иглы с режущим краем. При этом стоит помнить – необходимый объем биопата не всегда может в шприц, и соответственно полученный результат может быть отрицательным. Потому возникает потребность в повторении забора биопата.
При отсутствии возможности полностью удаления опухоли – врачи проводят иссечение ее части. Но и в этом случае может быть ошибка в результатах диагностики, поскольку забранный образец может отличаться от основной массы и объема новообразования. Так тотальное удаление новообразования – точный метод диагностики в данном случае.
Ошибки в биопсии и основные причины
В случае проведения гистологии забранного биопата – возможны ошибки и основными причинами, которые приводят к ним, врачи называют следующие:
- Неправильно выбрано место для проведения прокола иглой. В этом случае биопсийный инструмент не проникает достаточно глубоко внутрь, проводится только поверхностный забор биопата с пораженного участка. Этот образец не может в полной мере покажет клиническую картину течения патологического процесса.
- Из очага новообразования невозможно взять достаточное количество биологического материала для анализа – чаще всего это происходит по причине особенностей роста новообразования.
- При нарушении правил забора и последующего хранения биологического материала.
- Также ошибка может быть следствием неправильной технологии, несоблюдение правил и этапов приготовления для последующего исследования забранного биопата.
- Причина ошибки может крыться и в низком уровне квалификации врача, проводящего само исследование биопата и недостаточная квалификация медика, проводящего интерпретацию полученных лабораторных анализов.
На итоги результатов биопсии могут влиять и медикаменты, которые пациент принимал накануне проведенного забора биологического материала. Но в большинстве своем ошибок при исследовании биопата и трактовке результатов диагностики не возникает, либо его процент минимален и не может влиять на итог всего процесса диагностики.
21.09.2018
С. Х. Аль-Шукри, С. Ю. Боровец, М. А. Рыбалов
Кафедра урологии Санкт-Петербургского государственного медицинского университета
имени акад. И. П. Павлова
В данном обзоре оцениваются преимущества и недостатки основных методов диагностики и
стадирования рака предстательной железы, приводятся сведения о современных высокотехнологичных методах стадирования и номограммах. Рассматриваются причины ошибок, возникающих
при диагностике и стадировании рака предстательной железы.
Ключевые слова: рак предстательной железы; диагностика; стадирование.
Введение
Повышение эффективности лечения рака предстательной железы (РПЖ) является одной из наиболее актуальных проблем современной урологии.
В мире РПЖ занимает 3–4 место в структуре заболеваемости злокачественными новообразованиями.
В России заболеваемость РПЖ в 2004 году составляла 6,9 %, а в 2009 году — уже 10,7 % [1]. При этом
за последние три десятилетия возросло число мужчин, умерших от этого заболевания [2].
I. МЕТОДЫ ДИАГНОСТИКИ РПЖ
Методы диагностики рпж — включают оценку
результатов пальцевого ректального исследования
(ПРИ), определении уровня ПСА в плазме крови.
Окончательный диагноз РПЖ может быть установлен только по результатам биопсии предстательной
железы, которую целесообразно выполнять под
ТРУЗ-контролем. При клиническом стадировании
для уточнения границ местного распространения
новообразования предстательной железы и для выявления местных и отдаленных метастазов в дополнение используют различные методы, позволяющие
получить изображение: компьютерную томографию
(КТ), магнитно-резонансную томографию (МРТ),
сцинтиграфию костей скелета и др. Однако результаты этих методов могут быть интерпретированы ошибочно как в пользу гипо, так и гипердиагностики.
Работы многих исследователей посвящены оптимизации скрининга и ранней диагностики РПЖ [3–5].
1.1. ПРИ. До внедрения в широкую клиническую практику ПСА, ПРИ было единственным
методом диагностики РПЖ. Большинство злокачественных новообразований РПЖ располагаются
в периферической зоне простаты и могут быть выявлены с помощью ПРИ, если их объем превышает
0,2 см 3. Положительная прогностическая ценность ПРИ варьирует от 4 % до 11 % у мужчин с уровнем ПСА от 0 до 2,9 нг/мл, и от 33 % до 83 % —
от 3 до 9,9 нг/мл и выше [6]. В связи с тем, что оба
этих метода имеют независимую друг от друга диагностическую ценность, рекомендовано применять
их комбинацию.
1.2. ПСА и его производные. Несмотря на то, что
уровень ПСА в плазме крови повышается при различных заболеваниях предстательной железы —
РПЖ, доброкачественной гиперплазии предстательной железы (ДГПЖ) и простатите, ПСА остается
практически единственным маркером, применяемым в целях ранней диагностики РПЖ. Однако
единых общепринятых международных стандартов
в отношении пороговых значений ПСА, которые
могли бы использоваться для диагностики РПЖ,
не существует [7]. Результаты недавнего исследования по профилактике РПЖ, проведенного в США,
подтвердили, что у многих мужчин РПЖ может
присутствовать, несмотря на низкий уровень ПСА
крови [8] (см. табл. 1).
При использовании более высоких условных
границ уровня ПСА (>4 нг/мл) для принятия решения о целесообразности проведении биопсии простаты повышается и риск пропустить клинически
значимый РПЖ; в тоже время при снижении этого
показателя (< 4 нг/мл) возрастает доля неоправданно выполненных биопсий простаты, когда новообразование отсутствует. До настоящего времени нет
данных литературы, которые позволили бы определить оптимальное пороговое значение ПСА, при
котором необходима биопсия простаты для выявления непальпируемого, но клинически значимого
РПЖ [9].
Таблица 1. Риск РПЖ при низком уровне ПСА в плазме крови
| Уровень ПСА, нг/мл | Риск РПЖ, % |
| 0-0,5 | 6,6 |
| 0,6–1 | 10,1 |
| 1,1–2 | 17,0 |
| 2,1–3 | 23,9 |
| 3,1–4 | 26,9 |
Производные ПСА — скорость нарастания и время удвоения ПСА — были предложены различными
исследователями [10, 11], однако при углубленном
изучении оказалось, что они не представляют большей ценности по сравнению с ПСА, и в настоящее
время не включены в клинические рекомендации
по диагностике РПЖ [9].
В отличие от них, расчет % свободного ПСА
оказался более значимым показателем, используемым преимущественно для выявления РПЖ у больных при значениях ПСА от 4 до 10 нг/мл и отрицательном результате ПРИ. РПЖ выявляют более
чем у половины мужчин с % свободного ПСА < 10,
в то время как при % свободного ПСА > 10 частота
выявляемости РПЖ на превышает 8 % [12].
1.3. PCA3. Относительно новый и интенсивно
исследуемый в настоящее время маркер — PCA3
(простатоспецифический некодирующий мРНК),
который определяют в осадке мочи после массажа простаты. Этот маркер имеет более высокую
чувствительность и специфичность по сравнению с ПСА, не зависит от объема простаты и наличия простатита у больного [13]. Сравнительно
небольшое число опубликованных работ по анализу диагностической ценности этого маркера
не позволяет рекомендовать его для широкого
использования в клинической практике. В связи
с этим в настоящее время этот маркер можно рассматривать как экспериментальный метод диагностики РПЖ.
1.4. ТРУЗИ. Классическая картина гипоэхогенного образования, расположенного в периферической зоне простаты, встречается не всегда, поэтому
ТРУЗИне относят к методам, позволяющим достоверно определять наличие РПЖ. ТРУЗ-контроль
получил широкое распространение при выполнении биопсии простаты.
1.5. Биопсия простаты. Биопсия предстательной железы является достоверным методом верификации диагноза РПЖ. Многими авторами были
предложены различные методики выполнения
этого исследования, отличающиеся по количеству
и участкам расположения биопсийных вколов.
При объёме ПЖ 30–40 см3 необходимо проводить
биопсию не менее чем из 8 точек. С увеличением
количества точек более 12, точность анализа существенно не изменяется [14]. На основании результатов Британского исследования по диагностике и лечению РПЖ была рекомендована биопсия
из 10 точек [15].
II. МЕТОДЫ СТАДИРОВАНИЯ РПЖ
2.1. ПРИ. Принято выделять клиническое стадирование, основанное на данных ПРИ, определении
уровня ПСА, рентгенологических, радиоизотопных
и других клинических методах исследования, а также патологоанатомическое стадирование, которое
становится возможным после морфологического
анализа удаленной предстательной железы, семенных пузырьков и лимфатических узлов. Патологоанатомическое стадирование более точно позволяет
оценить распространение болезни и судить о ее прогнозе. Наиболее важными патологоанатомическими прогностическим факторами после радикальной
простатэктомии являются степень дифференцировки новообразования, позитивный хирургический
край, экстракапсулярное распространение опухоли, ее инвазия в семенные пузырьки и метастазирование в тазовые лимфатические узлы. Сведения
об ошибках патологоанатомического стадирования
не включены в настоящий обзор литературы.
ПРИ позволяет определить не только наличие
РПЖ, но и степень его местного распространения.
Пальпируемая опухоль в простате — это признак,
характерный для низкодифференцированного РПЖ
(степень злокачественности по Gleason — 8–10 баллов). Чувствительность и воспроизводимость
ПРИ весьма низкие, что приводит как к недооценке, так и к переоценке степени распространения
РПЖ. Чувствительность метода при определении
клинической стадии РПЖ не превышает 30 % [16].
Стадия рака простаты правильно диагностируется
с помощью данного исследования менее чем в 50 %
случаев [17].
2.2. ПСА. Более высокий уровень ПСА в плазме крови косвенно указывает на большую степень
распространения РПЖ, но не позволяет достоверно
предсказать ни клиническую, ни патоморфологическую его стадию [18, 19].
2.3. ТРУЗИ позволяет выявить только 60 % опухолей простаты, остальные не распознаются из-за
эхогенности, сходной с таковой у окружающих
здоровых тканях. При этом остаются недиагностированными более 60 % РПЖ на стадии рТ3 [20].
ТРУЗИ в комбинации с цветной допплерографией
позволяет визуализировать проходящие через капсулу кровеносные сосуды, что типично при экстракапсулярном распространении новообразования
[21, 22]. Однако эта методика имеет низкую воспроизводимость, в связи с чем ее относят к категории
вспомогательных.
2.4. Биопсия простаты. По результатам биопсии простаты можно оценить степень местного распространения РПЖ, а также степень злокачественности новообразования в баллах по шкале Gleason.
Процент пораженной ткани — наиболее надежный
прогностический фактор риска инвазии опухоли
в семенные пузырьки и экстракапсулярного распространения новообразования.
2.5. КТ и МРТ недостаточно надежно позволяют
судить о степени распространения РПЖ, чтобы рекомендовать их как обязательные методы обследования. МРТ с эндоректальной катушкой позволяет
более точно определить стадию РПЖ и прорастание
опухоли в семенные пузырьки. Однако на фоне геморроидальных и воспалительных изменений ПЖ
или после ее биопсии интерпретация данных может
быть затруднена [9]. Сочетание контрастной МРТ
и МРТ в Т2‑режиме усиления и применение МРТспектроскопии позволяет лучше верифицировать
опухолевую ткань и диагностировать экстракапсулярное распространение опухоли [23].
Недостатки методов визуализации при РПЖ:
- Ложноотрицательные результаты из-за постбиопсийной крови.
- Артефакты от газа в прямой кишке, перистальтики.
- Ложноположительные очаги.
- Ложноотрицательные результаты ЭМРТ при
РПЖ с инвазией в прямую кишку. - Выявление РПЖ в центральной зоне.
- Невыявляемые очаги рака.
- Высокая зависимость от опыта рентгенолога.
Пути решения: - МРТ до биопсии или через 4 недели после нее.
- Подготовка пациента (микроклизма).
- Динамическое контрастирование.
- МРТ с поверхностной катушкой.
- МР-спектроскопия.
- Субспециализация.
2.6. Высокотехнологичные методы стадирования РПЖ. К новым перспективным методам, позволяющим получить изображение, можно отнести
ПЭТ, при помощи которого диагностируют около
70 % РПЖ на стадии рТ2 и pT3a‑4 [9]. При этом
очаг рака и микрометастазы < 5 мм остаются нераспознанными.
Наиболее перспективным методом визуализации является совмещённая позитронноэмиссионная/компьютерная томография. Этот
метод дает возможность за одно обследование получить информацию об анатомическом строении
и метаболических процессах. Метаболические
процессы (по результатам ПЭТ) здесь могут соотноситься с определенной анатомической локализацией (по данным КТ). Совмещённая позитронноэмиссионная/компьютерная томография имеет
более высокую точность разрешения — до 2 мм, однако также как и ПЭТ подразумевает использование специфичных для опухолевой ткани радиофармпрепаратов.
К современным ультразвуковым высокотехнологичным методам диагностики и стадирования РПЖ
относят эластографию и гистосканнинг.
Эластография — это неинвазивная методика,
используемая при диагностике опухолей, при которой оценивается степень жесткости (эластичность) мягких тканей. В основу методики положена
классическая методика пальпации объемных образований. Опухолевая ткань имеет коэффициент
жесткости до 28 раз превосходящий аналогичный
показатель здоровой ткани. В момент механической компрессии опухоль деформируется меньше,
чем окружающие ткани. При эластографии пальпация осуществляется посредством ультразвуковой
волны и механической компрессии. Программное
обеспечение ультразвукового аппарата обрабатывает принятый отраженный сигнал и воспроизводит
изображение на экране в формате цветного картирования, что позволяет дифференцировать ткани
в зависимости от эластичности. В результате более
плотные структуры тканей отображается оттенками
синего цвета, а легко сжимаемые эластичные участки маркируются красной цветовой шкалой. Результаты эластографии могут помочь в принятии решения о биопсии и выборе участка — «мишени» при
неоднозначных данных ПСА; использование данного метода возможно даже после повторных биопсий
предстательной железы. К недостаткам эластографии относят: высокую зависимость от опыта врача,
производящего исследование, сложность овладения
данным методом диагностики, а также низкая повторяемость результатов.
Гистосканнинг является еще одним новым высокотехнологичным методом ультразвуковой диагностики и стадирования рака предстательной железы.
Осуществляется дифференцировка между опухолевой и здоровой тканью, определение локализации
опухоли при малых ее размерах, невыявляемых с помощью стандартного ТРУЗИ. Чувствительность метода составляет 90 %, специфичность — 72 % [24].
В результате исследования получают информацию
о локализации зон, подозрительных на опухолевые,
что позволяет выполнить прицельную биопсию.
2.7. Номограммы. Большим числом групп исследователей были предложены разнообразные алгоритмы и номограммы для определения местного
распространения РПЖ, вероятности лимфогенного
метастазирования, а также принадлежности пациентов к прогностически неблагоприятной группе.
В основе метода — комплексная оценка результатов
ПРИ, уровня ПСА в плазме крови и степени дифференцировки новообразования. Одним из примеров
может быть индекс CAPRA, позволяющий оценить
вероятность безрецидивной выживаемости больных РПЖ на основании совокупности клинических
и морфологических критериев [25]. Использование
комбинации показателя уровня ПСА, индекса Глисона при биопсии простаты и клинической стадии Т
(номограмма Партина) дает лучшие результаты при
прогнозировании патоморфологической стадии,
чем каждый из параметров по отдельности [26].
2.8. N, M-стадирование. Тазовая лимфаденэктомия — золотой стандарт
определения метастазирования в лимфатические
узлы, N (открытым или лапароскопическим доступом).
М‑стадирование. У 85 % больных, умерших
от РПЖ, отмечают метастатическое поражение скелета [27]. Наличие и распространенность метастазов в кости позволяет определить прогноз в каждом
конкретном случае. Повышенный уровень щелочной фосфатазы, специфичной для костной ткани,
у 70 % может указывать на наличие метастазов в кости [28], однако наиболее чувствительным методом
исследования является остеосцинтиграфия. Помимо костей раковыми клетками могут быть поражены
отдаленные лимфоузлы, легкие, печень, головной
мозг, кожа. В зависимости от локализации отдаленных метастазов для их выявления при мягкотканой
локализации могут быть применены клинический
осмотр, рентгенография грудной клетки, УЗИ, КТ,
МРТ. При уровне ПСА в плазме крови >100 нг/мл
практически у всех больных имеют место отдаленные метастазы РПЖ [29].
III. Причины ошибок при
диагностике и стадировании РПЖ
Среди причин, приводящих к ошибкам при диагностике и стадировании РПЖ можно выделить
субъективные и объективные.
Субъективные:
- Недостаточная квалификация специалистов.
- Неправильная интерпретация данных обследования.
Объективные:
- Отсутствие высоко специфичных методов
диагностики. - Недостаточное использование современных
методов диагностики. - Неиспользование стандартных рекомендаций, предложенных Европейской ассоциацией урологов.
В заключении следует отметить, что в последние
годы предпринимаются попытки совершенствования
методов ранней диагностики и стадирования РПЖ.
Однако существует потребность в создании новых,
более точных методов, позволяющих выявлять клинически значимый РПЖ. К перспективным методам, позволяющим оптимизировать процессы диагностики и стадирования, можно отнести ПЭТ/КТ,
диффузионную МРТ, МР-спектроскопию, динамическую МРТ с повышением контраста. Необходима дальнейшая разработка специфичных для РПЖ
радиофармпрепаратов. Кроме того, важна унификация при интерпретации полученных данных — использование рекомендаций Европейской ассоциации урологов.
Список литературы
- Чиссов В. И., Русаков И. Г. Заболеваемость раком предстательной железы в Российской Федерации // Экспериментальная и клиническая урология. — 2011. — № 2–3. — С. 6–7.
- Quinn M., Babb P. Patterns and trends in prostate cancer incidence,
survival, prevalence and mortality. Part I: international comparisons
// B. J. U. Int. — 2002. — Vol. 90, N 2. — P. 162–173. - Ilic D., O’Connor D., Green S., Wilt T. J. Screening for prostate
cancer: a Cochrane systematic review // Cancer Causes Control.
— 2007. — Vol. 18, N 3. — P. 279–285. - Andriole G. L., Crawford E. D., Grubb R. L. 3rd. et al. Mortality results
from a randomized prostate-cancer screening trial // N. Engl.
J. Med. — 2009. — Vol. 360, N 13. — P. 1310–1319. - Schröder F. H., Hugosson J., Roobol M. J. et al. Screening
and prostate-cancer mortality in a randomized European
study // N. Engl. J. Med. — 2009. — Vol. 360, N 13. —
P. 1320–1328. - Schröder F. H., van der Maas P., Beemsterboer P. et al. Evaluation
of the digital rectal examination as a screening test for prostate
cancer. Rotterdam section of the European Randomized Study of
Screening for Prostate Cancer // J. Natl. Cancer Inst. — 1998. —
Vol. 90, N 23. — P. 1817–1823. - Semjonow A., Brandt B., Oberpenning F. et al. Discordance of
assay methods creates pitfalls for the interpretation of prostatespecific
antigen values // Prostate. — 1996. — Suppl. 7. —
P. 3–16. - Thompson I. M., Pauler D. K., Goodman P. J. et al. Prevalence
of prostate cancer among men with a prostate-specific antigen
level < or = 4.0 ng per milliliter // N. Engl. J. Med. — 2004. —
Vol. 350, N 22. — P. 2239–2246. - Heidenreich A., Bellmunt J., Bolla M. et al. EAU guidelines on
prostate cancer. Part 1: screening, diagnosis, and treatment of
clinically localised disease // Eur. Urol. — 2011. — Vol. 59,
N 1. — P. 61–71. - Carter H. B., Pearson J. D., Metter E. J. et al. Longitudinal evaluation
of prostate-specific antigen levels in men with and without
prostate disease // JAMA. — 1992. — Vol. 267, N 16. —
P. 2215–2220. - Schmid H.-P., McNeal J. E., Stamey T. A. Observations on the
doubling time of prostate cancer. The use of serial prostate-specific
antigen in patients with untreated disease as a measure of increasing cancer volume // Cancer. . 1993. . Vol. 71, N 6. .
P. 2031.2040. - Catalona W. J., Partin A. W., Slawin K. M. et al. Use of the percentage
of free prostate-specific antigen to enhance differentiation of
prostate cancer from benign prostatic disease: a prospective multicentre
clinical trial // JAMA. . 1998. . Vol. 279, N 19. .
P. 1542.1547. - Deras I. L., Aubin S. M., Blase A. et al. PCA3: a molecular urine assay
for predicting prostate biopsy outcome // J. Urol. . 2008. .
Vol. 179, N 4. . P. 1587.1592. - Eichler K., Hempel S., Wilby J. et al. Diagnostic value of systematic
biopsy methods in the investigation of prostate cancer:
a systematic review // J. Urol. . 2006. . Vol. 175, N 5. .
P. 1605.1612. - Donovan J., Hamdy F., Neal D. et al. Prostate Testing for Cancer
and Treatment (ProtecT) feasibility study // Health Technol. Assess.
. 2003. . Vol. 7, N 14. . P. 1.32. - Матвеев Б. П. Клиническая онкоурология. — М.: Вердана,
2003. — 717 с. - Spigelman S. S., McNeal J. E., Freiha F. S., Stamey T. A. Rectal
examination in volume determination of carcinoma of the prostate:
clinical and anatomical correlations // J. Urol. . 1986. .
Vol. 136, N 6. . P. 1228.1230. - Partin A. W., Carter H. B., Chan D. W. et al. Prostate specific antigen
in the staging of localized prostate cancer: influence of tumour
differentiation, tumour volume and benign hyperplasia //
J. Urol. . 1990. . Vol. 143, N 4. . P. 747.752. - Hudson M. A., Bahnson R. R., Catalona W. J. Clinical use of prostate
specific antigen in patients with prostate cancer // J. Urol. .
1989. . Vol. 142, N 4. . P. 1011.1017. - Enlund A., Pedersen K., Boeryd B., Varenhorst E. Transrectal
ultrasonography compared to histopathological assessment for
local staging of prostatic carcinoma // Acta Radiol. . 1990. .
Vol. 31, N 6. . P. 597.600. - Sauvain J. L., Palascak P., Bourscheid D. et al. Value of power
and 3D vascular sonography as a method for diagnosis and staging
of prostate cancer // Eur. Urol. . 2003. . Vol. 44, N 1. .
P. 21.30; discussion 30.31. - 22. Zalesky M., Urban M., Smerhovsky Z. et al. Value of power Doppler
sonography with 3D reconstruction in preoperative diagnostics
of extraprostatic tumor extension in clinically localized prostate
cancer // Int. J. Urol. . 2008. . Vol. 15, N 1. . P. 68.75;
discussion 75. - Fuchsjager M., Shukla-Dave A., Akin O. et al. Prostate cancer imaging
// Acta Radiol. . 2008. . Vol. 49, N 1. . P. 107.120. - Simmons L. A., Autier P., Zat’ura F. et al. Detection, localisation
and characterisation of prostate cancer by prostate HistoScanning
(.) // B. J. U. Int. . 2012. . Vol. 110, N 1. . P. 28.35. - Cooperberg M. R., Freedland S. J., Pasta D. J. et al. Multiinstitutional
validation of the UCSF cancer of the prostate risk assessment
for prediction of recurrence after radical prostatectomy //
Cancer. . 2006. . Vol. 107, N 10. . P. 2384.2391. - Partin A. W., Mangold L. A., Lamm D. M. et al. Contemporary update
of the prostate cancer staging nomograms (Partin Tables)
for the new millennium // Urology. . 2001. . Vol. 58, N 6. .
P. 843.848. - Whitmore W. F. Jr. Natural history and staging of prostate cancer //
Urol. Clin. North Am. . 1984. . Vol. 11, N 2. . P. 205.220. - Wolff J. M., Ittel T. H., Borchers H. et al. Metastatic workup of patients
with prostate cancer employing alkaline phosphatase and
skeletal alkaline phosphatase // Anticancer Res. . 1999. .
Vol. 19, N 4A. . P. 2653.2655. - Rana A., Karamanis K., Lucas M. G., Chisholm G. D. Identification
of metastatic disease by T category, Gleason score and serum PSA
level in patients with carcinoma of the prostate // Br. J. Urol. .
1992. . Vol. 69, N 3. . P. 277.281.