Статья поступила в редакцию 04.05.2021 г.
DOI: 10.24411/2687-0053-2021-10022
Информация для цитирования:
Анищенко В.В., Архипова А.А., Титов С.Е., Полоз Т.Л., Краснов О.А. АНАЛИЗ ОШИБОК ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ДИСПЛАЗИЯ И РАК ЖЕЛУДКА //Медицина в Кузбассе. 2021. №2. С. 50-54.
Анищенко В.В., Архипова А.А., Титов С.Е., Полоз Т.Л., Краснов О.А.
Новосибирский государственный медицинский университет, Клинический госпиталь «АВИЦЕННА» Группы компаний «Мать и дитя», Городская клиническая поликлиника № 1, АО «Вектор-Бест»,
ФГБУН «Институт молекулярной и клеточной биологии» СО РАН, Новосибирский государственный университет, ЧУЗ «Клиническая больница «РЖД-Медицина», г. Новосибирск, Россия,
Кемеровский государственный медицинский университет, г. Кемерово, Россия
Рак желудка на IV стадии выявляется в 38,9 %, для повышения точности эзофагогастродуоденоскопии с биопсией перспективным видится дополнительно использовать молекулярные маркеры на основе РНК.
Цель исследования — анализ ошибок дифференциальной диагностики язвы с дисплазией и рака желудка при использовании эндоскопического, гистологического метода и классификатора основного на профилировании миРНК.
Материалы и методы. Был проведен ретроспективный анализ результатов эндоскопического и морфологического исследований 89 наблюдений пациентов с язвами желудка с дисплазией, и молекулярно-генетическое исследование образцов архивного гистологического материала в виде парафиновых блоков этих пациентов. Проспективное исследование заключалось в повторных эндоскопических исследованиях через 3, 6, 9, 12, 24 месяцев, а также мы наблюдали больных при помощи электронной базы БАРС Медицинской информационной системой.
Результаты. Средний промежуток времени до выявления злокачественного характера язвенного поражения составил 11 месяцев, при этом выявлено 8 случаев (8,9 %) рака желудка, из восьми 4 случая (4,5 %) — это несвоевременно выявленный рак, инфильтративно-язвенная форма. В двух случаях из четырех раков классификатор, основанный на профилировании миРНК, отнес поражения в группу рака. 7 из 8 язвенных поражений в описании эндоскопического осмотра охарактеризованы как гигантские, то есть больше 3,0 см.
Выводы. При выявлении профиля миРНК, соответствующего раку желудка, необходимо вести пациента более агрессивно, после снятия угрозы рецидива кровотечения провести повторную эзофагогастродуоденоскопию с мультифокальной биопсией. Ключевые слова: язва; дисплазия; рак; миРНК; диагностика
Anischenko V.V., Arkhipova A.A., Titov S.E., Poloz T.L., Krasnov O.A.
Novosibirsk State Medical University, Clinical Hospital «AVICENNA» of the Group of Companies «Mother and Child», City Clinical Polyclinic N 1, JSC «Vector-Best», FSBSI Institute of Molecular and Cellular Biology SB RAS, Novosibirsk State University, Clinical Hospital Russian Railways-Medicine, Novosibirsk, Russia, Kemerovo State Medical University, Kemerovo, Russia
ANALYSIS OF ERRORS IN DIFFERENTIAL DIAGNOSTICS OF DYSPLASIA AND STOMACH CANCER
IV stage stomach cancer is detected in 38.9 % of cases; additional use of RNA-based markers seems to be a promising way to improve the accuracy of esophagogastroduodenoscopy with biopsy.
Objective of the study — analysis of errors in differential diagnostics of ulcers with dysplasia and stomach cancer using the endoscop-ic and histological methods, and a classification based on miRNA profiling.
Materials and methods. We carried out a retrospective analysis of the results of endoscopic and morphological studies of 89 observations of patients with stomach ulcers with dysplasia and performed a molecular genetic study of samples of archival histological material of these patients in the form of paraffin blocks. The prospective study consisted in repeated endoscopic examinations after 3, 6, 9, 12, 24 months, and we also observed patients using the electronic database BARS Medical Information System. Results. The average time before the detection of the malignant nature of the ulcerative lesion was 11 months. There were detected 8 cases (8.9 %) of stomach cancer, 4 cases out of which (4.5 %) were untimely detected infiltrative ulcerative cancer. In two cases out of four the lesions were attributed to the cancer group according to the classification based on siRNA profiling. 7 out of 8 ulcerative lesions in the description of the endoscopic examination are described as giant, that is, more than 3.0 cm.
Conclusions. When a miRNA profile corresponding to stomach cancer is identified, it is necessary to lead the patient more aggressively, after removing the threat of recurrent bleeding, repeat esophagogastroduodenoscopy with multifocal biopsy. Key words: ulcer; dysplasia; cancer; miRNA; diagnostics.
АНАЛИЗ ОШИБОК ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ДИСПЛАЗИЯ И РАК ЖЕЛУДКА
50
T. 20 № 2 2021
(Медицина
Medicine in Kuzbass
в Кузбассе
По данным GLOBOCAN, в 2018 году рак желудка занял второе место как причина смерти среди 36 видов рака в 185 странах мира [1]. Однако организованные программы скрининга существуют только в Японии и Южной Корее, для Азиатско-Тихоокеанского региона это необходимая мера, так как около 60 % выявленных случаев рака желудка приходятся на страны Восточной Азии [2].
Гастроканцероген 1 класса Helicobacter pylori участвует в том числе в патогенезе гастродуоденаль-ных язв, и появление язвы в желудке сопряжено с риском злокачественной трансформации. Но в источниках литературы частота малигнизации язвы, выявленная при эзофагогастродуоденоскопии, значительно варьирует, от 6 до 21 % [3, 4]. Вследствие этого возник вопрос: нуждаются ли пациенты с язвой желудка в контрольных эндоскопических осмотрах? В Великобритании, согласно рекомендациям NICE (National Institute for Health and Clinical Excellence), необходимо выполнять повторную гастроскопию через 8 недель всем пациентам с язвой желудка, а вот Американское общество гастроинте-стинальной эндоскопии, напротив, советует проводить эзофагогастродуоденоскопию только в отдельных клинических ситуациях. Selinger CP et al. считают, что контрольные эндоскопические исследования уменьшают количество диагностических ошибок и, вероятно, являются главной причиной разброса данных о частоте злокачественной трансформации [3].
В «Золотой стандарт» диагностики рака и предраковых поражений желудка входит гистологическое исследование биоптатов, полученных при эзофагогастродуоденоскопии, но сама эндоскопическая диагностика является инвазивным, дорогим методом, к тому же от врача, выполняющего исследования, требуются специализированные знания, навыки и опыт работы, особенно при выявлении ранних форм. Из-за вышеуказанных причин и бессимптомного течения рак желудка часто выявляется на поздней стадии (IV стадия 38,9 %) и, как следствие, в первый год с момента установления диагноза летальность составляет 45,8 % [5].
В то же время, ранняя диагностика рака и его своевременное лечение обеспечивает выживаемость в более чем 90 % наблюдений. Онкомаркеры (аль-фа-фетопротеин, СА-19-9, СА-125, карциноэмбрио-нальный антиген) не работают для выявления раннего рака. Поэтому поиск новых инструментов по-прежнему актуален. В качестве перспективных биомаркеров ранней диагностики злокачественной трансформации рассматривают миРНК, они регулируют все процессы жизнедеятельности клетки, к тому же стабильны и легко извлекаются из различных биологических материалов и даже из парафиновых блоков. Немаловажно, что профили экспрессии миРНК неопластической ткани отличаются при сравнении с профилем экспрессии миРНК нормальной ткани [6].
Цель настоящего исследования — анализ ошибок дифференциальной диагностики язвы с диспла-
зией и рака желудка при использовании эндоскопического, гистологического исследования и классификатора, основанного на профилировании миРНК.
МАТЕРИАЛЫ И МЕТОДЫ
Был проведен ретроспективный анализ результатов эндоскопического и морфологического исследований 89 пациентов с язвами желудка с диспла-зией, и молекулярно-генетическое исследование образцов архивного гистологического материала в виде парафиновых блоков этих пациентов. До выполнения молекулярно-генетического исследования проведена независимая экспертная оценка гистологических образцов. Уровень экспрессии микроРНК определялся с помощью полимеразной цепной реакции с обратной транскрипцией в реальном времени (ОТ-ПЦР РВ). Стратификацию образцов на разные группы проводили с помощью алгоритма построения дерева принятия решений С-ИТ. Выделение РНК, выявление микроРНК и стратификация образцов на разные группы описано ранее [7, 8]. Проспективное исследование заключалось в повторных эндоскопических исследованиях через 3, 6, 9, 12, 24 месяцев, а также мы наблюдали больных при помощи электронной базы БАРС Медицинской информационной системы. От всех пациентов получены информированные согласия. В результате выявлено 8 (8,9 %) случаев рака желудка, средний возраст больных раком 59 + 5,4 лет, гендерное распределение: мужчин — 5 (62,5 %), женщин — 3 (37,5 %).
РЕЗУЛЬТАТЫ
Учитывая малое количество наблюдений, каждому распознанному случаю злокачественного новообразования (ЗНО) присвоен порядковый номер, далее проведен подробный анализ. Главные результаты представлены в таблице 1.
Четыре случая (2, 4, 6, 

Случай № 1. В январе 2017 года госпитализация по неотложным показаниям с клиникой желудочно-кишечного кровотечения в хирургическое отделение, по данным первого эндоскопического осмо-
__я у» гч Medicine
<^УАвШЩШ in Kuzbass Т. 20 № 2 2021
в Кузбассе ‘
Таблица
Характеристика выявленных случаев злокачественных новообразований желудка
Table
Characteristics of the identified cases of malignant neoplasm in stomach
Архивный Размер
№ гистологический Диагностирован язвенного Гистологический диагноз Стадирование Оперативное
материал, рак желудка поражения по TNM лечение
заключение: Язва желудка
1 Январь 2017 Май 2020 4,0 см в диаметре Низкодифференцированная аденокарцинома T3NxMo
2 Август 2017 Октябрь 2017 4,0-5,0 см Умеренно дифференцированная аденокарцинома TxNxMI
3 Ноябрь 2017 Декабрь 2019 3,5-4,0 см Низкодифференцированная аденокарцинома TxNxMI
4 Декабрь 2017 Март 2018 4,0 см в диаметре Умеренно дифференцированная аденокарцинома TxNxMo
2,5 см в Высокодифференцированная Субтотальная
5 Январь 2018 Март 2018 диаметре аденокарцинома TlaNoMo дистальная резекция + D 2
6 Март 2018 Апрель 2018 6,0-9,0 см Низкодифференцированная аденокарцинома TxNxMI
5,0 см в Умеренно дифференцированная T4aN1Mo Субтотальная
7 Август 2018 Ноябрь 2019 диаметре аденокарцинома (после операции) дистальная резекция + D 2
8 Сентябрь 2018 Октябрь 2018 5,0-3,5 см Низкодифференцированная аденокарцинома T2-3N1MO (после операции) Гастрэктомия + D2
тра в антральном отделе найдена язва размером 1,2 см Forrest 2С, через 5 дней выполнена повторная гастроскопия с биопсией. В описании эзофаго-гастродуоденоскопии указано, что язвенный дефект уменьшился до 0,9 см, а в дне язвы появился регенерирующий эпителий. При морфологическом исследовании получено заключение — хронический пе-риульцерозный гастрит с фокусами low-grade дис-плазии. В мае 2020 года (через 41 месяц) больная поступила по скорой помощи с диагнозом желудочно-кишечное кровотечение. В периоде госпитализации было выявлено злокачественное образование желудка, гистологическое заключение — Низкодифференцированная аденокарцинома. Ввиду тяжелой коморбидности специализированное лечение пациентке было противопоказано.
Случай № 3. В ноябре 2017 года амбулаторное обращение с астеническим синдромом, был направлен на эзофагогастродуоденоскопию, на которой выявили язву препилорического отдела с субкомпен-сированным стенозом привратника, выполнили щипцовую биопсию, получены 3 фрагмента ткани из язвенного дефекта. Пациент был проконсультирован хирургом, ему рекомендовали хирургическое лечение, на которое он согласился. Однако в ходе подготовки к плановой госпитализации на фоне консервативной терапии стеноз привратника был купирован, и пациент отказался от операции несмотря на то, что при морфологическом исследовании обнаружили фокусы high-grade дисплазии. Вновь обратился к участковому терапевту в декабре 2019 года (через 26 месяцев) с жалобами на снижение массы и увеличение размера живота. При ультразвуковом
исследовании органов брюшной полости найдены метастазы в печени и асцит.
Случай № 5. В январе 2018 года госпитализация по экстренным показаниям с желудочно-кишечным кровотечением, выполнен эндоскопический гемостаз. Перед выпиской из стационара больной прошел в плановом порядке гастроскопию с биопсией для проведения гистологического исследования. В результате получено заключение: Хроническая язва с high-grade дисплазией и началом регенерации. Пациент выписан из стационара и направлен к онкологу.
Случай № 7. На фоне приема кардиомагнила в стандартной дозе больной начал испытывать боли в эпигастрии, был направлен участковым терапевтом на эзофагогастродуоденоскопию, при которой найден язвенный дефект овальной формы, размером до 1,0 см, большую часть дна язвы покрывал регенерирующий эпителий, а фибрин составлял примерно одну треть. Выполнена биопсия, гистологическое заключение — Хроническая язва, регенерация. Через 15 месяцев больной поступил по экстренным показаниям с желудочно-кишечным кровотечением, при эндоскопическом исследовании найдена язва 4,0 х 5,0 см, после стабилизации гемостаза выполнена повторная гастроскопия с биопсией, морфологическое исследование показало периульцерозный гастрит с очагами кишечной метаплазии и фокусами high-grade дисплазии. Пациент выписан из стационара и направлен к онкологу.
Наблюдения № 1, № 3, № 5, № 7 объединяет длительный язвенный анамнез, в каждом случае более 5 лет. В первые 12 месяцев после установле-
__п у» гч Medicine
Т. 20 № 2 2021 ^МбСЩиЖ in Kuzbass
в Кузбассе
ния диагноза рака желудка умерли все пациенты, кроме случаев заболевания № 5 и № 7. Все образцы архивного гистологического материала вошли в исследование, имея заключение: Язва с диспла-зией, при использовании разработанного нами метода по профилю экспрессии миРНК [7, 8] в 2-х случаях (№ 4, № 6), классификатор отнес поражения желудка в группу рак. Библиотека случаев метода построения математической модели, основанного на профилировании миРНК, уже превышает 340 случаев, при этом при выявлении рака чувствительность 97,14 % и специфичность 97,55 %, а для дисплазии чувствительность 95,35 %, специфичность 95,65 %, что подтверждает необходимость применения миРНК при каждом выявленном случае дисплазии. При этом в качестве альтернативы щипцовой биопсии можно использовать браш-биопсию. Она менее травматична [9], при исследовании материала с браш-препарата профиль миРНК оказался идентичным профилю миРНК, полученному с гистологического материала одного и того же больного.
ОБСУЖДЕНИЕ
Средний промежуток времени до выявления злокачественного характера язвенного поражения желудка в исследуемых случаях составил 11 месяцев. 7 из 8 язвенных поражений в описании эндоскопического осмотра охарактеризованы как гигантские, то есть больше 3,0 см, а размер язвы считается одним из главных параметров, который позволяет врачу-эндоскописту заподозрить злокачественное поражение [10]. Однако, несмотря на размер язвенного дефекта и наличие дисплазии в гистологическом заключении, больные не взяты под пристальное наблюдение хирурга и эндоскописта.
Также у 5 пациентов (62,5 %) биопсия ограничивалась 1-2 фрагментами, так как увеличение количества биоптатов могло привести к рецидиву кровотечения, а из-за инвазивного характера гастроскопии больные неохотно идут в плановом порядке на повторные эндоскопические исследования. Все это затрудняет интерпретацию данных исследования и не позволяет поставить диагноз рак. Очевидно, что не существует метода диагностики, которым можно на 100 % подтвердить диагноз рак. В последние 10 лет все чаще появляются публикации, в которых рекомендуется для повышения точности и дифференциальной диагностики использовать молекулярные маркеры на основе ДНК и РНК [6, 10]. В нашем исследовании, несмотря на то, что не была проведена мультифокальная биопсия, два пациента с инфильтративно-язвенным раком по образцам, полученным при первой эзофагогастродо-деноскопии, все-таки были классифицированы с помощью предложенного набора миРНК как рак. Это обнадеживает, но требуются дальнейшие исследования.
ВЫВОДЫ:
1. При выявлении на эзофагогастродуоденоско-пии гигантской язвы с признаками неустойчивого гемостаза целесообразно заменить мультифокаль-ную щипцовую биопсию на браш-биопсию, профиль экспрессии миРНК, полученный с браш-препарата и гистологического материала у одного и того же больного, идентичен.
2. При выявлении профиля миРНК, соответствующего раку желудка, необходимо вести пациента более агрессивно, после снятия угрозы рецидива кровотечения провести повторную эзофагогастроду-оденоскопию с мультифокальной биопсией.
ЛИТЕРАТУРА / REFERENCES:
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68(6): 394-424. doi: 10.3322/ caac.21492.
2. Asaka M, Kato M, Sakamoto N. Roadmap to eliminate gastric cancer with Helicobacter pylori eradication and consecutive surveillance in Japan. J Gastroenterol. 2014; 49(1): 1-8. doi: 10.1007/s00535-013-0897-8.
3. Selinger CP, Cochrane R, Thanaraj S, Sainsbury A, Subramanian V, Everett S. Gastric ulcers: malignancy yield and risk stratification for follow-up endoscopy. Endosc Int Open. 2016; 4(6): E709-14. doi: 10.1055/s-0042-106959.
4. Muro EA, Celaya FB, Virseda JMMP, Aguilar EB, Legaz SO, Pérez FJJ. Analysis of the clinical benefits and cost-effectiveness of performing a systematic second-look gastroscopy in benign gastric ulcer. Gastroenterol Hepatol. 2009; 32(1): 2-8. doi: 10.1016/j.gastrohep.2008.07.002.
5. Statua of cancer the population of Russia in 2019 /ed. Caprina AD, Starinsky VV, Shahzadova АО. M.: P.A. Hertsen Moscow Oncology Research Center. 2020. 239 p. Russian (Состояние онкологической помощи населению России в 2019 году / под ред. Каприна А.Д, Старинского В.В., Шахзадова А.О. М.: МНИОИ им. П.А. Герцена, 2020. 239 с.)
6. Link A, Schirrmeister W, Langner C, Varbanova M, Bornschein J, Wex T, Malfertheiner P. Differential expression of microR-NAs in preneoplastic gastric mucosa. Scientific Reports. 2015; 5: 8270. doi: 10.1038/srep08270.
7. Titov SE, Anishchenko VV, Poloz TL, Veryaskina YuA, Arkhipova AA, Ustinov SN. Differential Diagnostics of Gastric Cancer and Precancerous Changes of the Gastric Mucosa Using Analysis of Expression of Six Micrornas. Russian Clinical Laboratory Diagnostics. 2020; 65(2): 131-136. Russian (Титов С.Е., Анищенко В.В., Полоз Т.Л., Веряскина Ю.А., Архипова А.А., Устинов С.Н. Возможности дифференциальной диагностики рака желудка и предраковых изменений слизистой желудка с помощью анализа экспрессии шести микроРНК //Клиническая лабораторная диагностика. 2020. Т. 65, № 2. С. 131-136.) doi: 10.18821/0869-2084-2020-65-2-131-136.
__я у» гч Medicine
<^УАвШЩШ in Kuzbass Т. 20 № 2 2021 в Кузбассе
8. Anishchenko VV, Titov SE, Poloz TL, Veryaskina YuA, Arkhipova AA, Bubnov IV. Dinamic screening of precancerous esophagus using molecular genetic analysis. Siberian Journal of Oncology. 2020; 19(6): 38-45. Russian (Анищенко В.В., Титов С.Е., Полоз Т.Л., Веряскина Ю.А., Архипова А.А., Бубнов И.В. Динамический скрининг предраковых состояний пищевода с помощью молекулярно-генетического анализа //Сибирский онкологический журнал. 2020. Т. 19, № 6. С. 38-45.) doi: 10.21294/1814-4861-2020-19-6-38-45.
9. Arkhipova AA, Anischenko VV. Characteristic of Stomach Ulcers, Complicated by Bleeding. Acta BiomedicaScientifica. 2020; 5(1): 42-46. Russian (Архипова А.А., Анищенко В.В. Характеристика язв желудка, осложнённых кровотечением //Acta Biomedica Scientifica. 2020. Т. 5, № 1. С. 42-46.) https://doi.org/10.29413/ABS.2020-5.1.5.
10. Lord R, El-Feki M, Tomos L, Mohammed N, Subramanian V, Rembacken BJ. Giant gastric ulcers: Malignancy yield and predictors from a 10-year retrospective single centre cohort. United European Gastroenterol J. 2018; 6(7): 1000-1006. doi: 10.1177/2050640618770013.
11. Hu B, Hajj NE, Sittler S, Lammert N, Barnes R, Meloni-Ehrig A. Gastric cancer: Classification, histology and application of molecular pathology. J Gastrointest Oncol. 2012; 3(3): 251-261. doi: 10.3978/j.issn.2078-6891.2012.021.
Информация о финансировании и конфликте интересов
Исследование не имело спонсорской поддержки. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией
настоящей статьи.
Сведения об авторах:
АНИЩЕНКО Владимир Владимирович, доктор мед. наук, профессор, зав. кафедрой хирургии факультета усовершенствования врачей, ФГБОУ ВО НГМУ Минздрава России; главный специалист по хирургии, Клинический госпиталь «АВИЦЕННА» Группы компаний «Мать и дитя», г. Новосибирск, Россия. E-mail: AVV1110@yandex.ru ORCID: 0000-0003-1178-5205
АРХИПОВА Анна Александровна, канд. мед. наук, врач-эндоскопист, отделение хирургического дневного стационара, ГАУЗ НСО «ГКП № 1», г. Новосибирск, Россия. E-mail: ierusalimova@gmail.com ORCID: 0000-0001-5653-2960
ТИТОВ Сергей Евгеньевич, канд. биол. наук, ст. науч. сотрудник лаборатории ПЦР, АО «Вектор-Бест»; ст. науч. сотрудник лаборатории молекулярной генетики, ФГБУН ИМКБ СО РАН; инженер лаборатории структурной, функциональной и сравнительной геномики, НГУ, г. Новосибирск, Россия. ORCID: 0 0 0 0-0 0 01-94 01-5737
ПОЛОЗ Татьяна Львовна, доктор мед. наук, зав. цитологической лабораторией, ЧУЗ «КБ» РЖД-Медицина, г. Новосибирск, Россия. ORCID: 0000-0003-4006-7560
КРАСНОВ Олег Аркадьевич, доктор мед. наук, профессор, кафедра факультетской хирургии и урологии, ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия. ORCID: 0000-0002-5214-7771
Information about authors:
ANISHCHENKO Vladimir Vladimirovich, doctor of medical sciences, professor, head of the department of surgery, faculty of advanced training for physicians, Novosibirsk State Medical University; chief specialist in surgery, Clinical Hospital «AVICENNA» of the Group of Companies «Mother and Child», Novosibirsk, Russia. E-mail: AVV1110@yandex.ru ORCID: 0000-0003-1178-5205
ARKHIPOVA Anna Aleksandrovna, candidate of medical sciences, endos-copist, department of surgical day hospital, City Clinical Polyclinic N 1, Novosibirsk, Russia. E-mail: ierusalimova@gmail.com ORCID: 0000-0001-5653-2960
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
TITOV Sergey Evgenievich, candidate of biological sciences, senior researcher, PCR laboratory, Vector-Best JSC; senior researcher, laboratory of molecular genetics, Institute of Molecular and Cellular Biology SB RAS; engineer, structural, functional and comparative genomics laboratory, Novosibirsk State University, Novosibirsk, Russia. ORCID: 0000-0001-9401-5737
POLOZ Tatyana Lvovna, doctor of medical sciences, head of the cytology laboratory, ChUZ «Clinical Hospital» Russian Railways Medicine, Novosibirsk, Russia. ORCID: 0000-0003-4006-7560 KRASNOV Oleg Arkadevich, doctor of medical sciences, professor, department of faculty surgery and urology, Kemerovo State Medical University, Kemerovo, Russia. ORCID: 0000-0002-5214-7771
Корреспонденцию адресовать: АРХИПОВА Анна Александровна, 630005, г. Новосибирск, ул. Лермонтова, д. 40. Тел: 8 (383) 201-48-88. E-mail: ierusalimova@gmail.com
__п у» гч Medicine
Т. 20 № 2 2021 КУШШЦиШ in Kuzbass
1 — в Кузбассе
Быстрая и надежная диагностика злокачественных новообразований — одна из основных задач современной онкологии. На поздней стадии многие опухоли выявляются достаточно просто, но прогноз в этом случае чаще всего оказывается неблагоприятным. Основные трудности для диагностики представляют именно ранние или редкие формы онкологических заболеваний, при которых симптомы еще отсутствуют, а опухоль при этом активно растет и метастазирует.
Вне зависимости от того, на какой стадии заболевания врачам удалось установить диагноз, известие о наличии онкологического заболевания, как правило, оказывается шоком для самого пациента и его близких.
Чтобы сократить время, необходимое для назначения оптимального лечения (а значит, в конечном счете, улучшить прогноз), следует убедиться в том, что лечащий врач достаточно компетентен и способен в сжатые сроки определить необходимый объем диагностических исследований.
Насторожиться следует в случаях, когда врач не может однозначно и просто описать имеющуюся проблему и предлагает, например, провести хирургическую операцию для диагностики или, напротив, предлагает лечение без обследования, не объясняя, какими средствами и с какой целью будет проводиться терапия.
В этих случаях рекомендуется обратиться к другому онкологу для уточнения диагноза и получения так называемого «второго мнения». В распоряжении врачей, работающих в современных клиниках, сегодня имеется широкий арсенал средств для диагностики и лечения онкологических заболеваний, важно лишь правильно выбрать место лечения и доктора, который обладает достаточной квалификацией для того, чтобы разобраться в проблемах конкретного пациента.
Также следует отметить, что лечение в специализированных медицинских центрах, работающих по самым современным протоколам, может оказаться более эффективным, нежели терапия по месту жительства, поскольку выбор препаратов для химиотерапии (равно как и других методов лечения) в таких клиниках, как правило, существенно шире.
Подозрение на рак — обследование
Для обследования пациента с подозрением на онкологическое заболевание или больного, диагноз которого уже установлен, но вызывает сомнения, могут применяться различные методы лабораторной и инструментальной диагностики.
Лабораторные общеклинические анализы показывают в основном неспецифические изменения. Особенно важны в онкологической практике показатели периферической крови и костного мозга, а именно — эритропоэз и изменения лейкоцитарной формулы. До 70–80% случаев рака сопровождаются гипохромной анемией с изменением формы и размеров эритроцитов. Количество лейкоцитов и степень их зрелости при разных заболеваниях значительно варьируют — от лейкопении до лейкоцитоза.
Рентгенодиагностика занимает одно из ведущих мест в онкологии, ее методы постоянно совершенствуются. Компьютерная, магнитно-резонансная томография и исследования с контрастом позволяют обнаружить опухоль и метастазы даже при небольших размерах.
Благодаря эндоскопическим методам можно провести детальный осмотр новообразования в полостях и полых органах, а также взять кусочек ткани на биопсию.
УЗИ чаще всего применяют в диагностике опухолей щитовидной и молочной желез, малого таза, брюшной полости и забрюшинного пространства, мягких тканей, лимфатических узлов. Это доступный и простой метод, чувствительность которого может достигать 90%. Под контролем УЗИ проводят аспирационную биопсию опухолей.
Гистологическое и цитологическое исследования позволяют установить морфологический диагноз, степень злокачественности процесса и выбрать подходящую тактику ведения пациентов. Без них в онкологии невозможно установить окончательный диагноз. Для обнаружения атипичных клеток на гистологический анализ берут кусочек ткани, полученный при биопсии или в ходе операции. Для цитологического исследования используется клеточный материал. На цитологии под микроскопом с высокой разрешающей способностью исследуют материал, полученный путем аспирации или отслаивания (эксфолиации) клеток. Его специально концентрируют, чтобы увеличить количество клеток в объеме материала. Его фиксируют, окрашивают и изучают под микроскопом на предмет атипичных клеток. Это позволяет провести дифференциальную диагностику между злокачественными и доброкачественными опухолями.
Уточняющие методы обследования
Существует ряд обследований, которые помогают уточнить онкологический диагноз в сомнительных случаях.
Иммунодиагностика позволяет обнаружить антигены опухолевых клеток, которые отличаются от нормальных клеточных антигенов. Кровь и моча пациента содержат опухолевые маркеры, их выявляют при помощи реагентов, содержащих специальные антитела, при реакции ИФА. Наибольшую практическую ценность имеют такие антигены, как α-фетопротеин, PSA, СА-125, раково-эмбриональный антиген, хорионический гонадотропин, трофобластический В-глобулин.
Уточняющие онкологический диагноз обследования чаще всего сложные и дорогостоящие, поэтому не применяются массово в качестве скрининга. Но они обладают высокой точностью и в спорных ситуациях помогают врачу поставить верный диагноз. Уточняющая диагностика необходима не для удовлетворения академического интереса лечебного учреждения или врача, она призвана разрешить серьёзные сомнения в диагнозе, которые не отмели традиционные и не столь дорогие исследования. Возможно, с её помощью удастся разрешить вопрос «рак или не рак» или подобрать лучшее – оптимальное лечение опухоли. В любом случае эти исследования – крайняя необходимость, без которой невозможно решить важнейший для жизни вопрос, и тогда цена процедуры – вопрос совсем не главный.
Важен комплексный подход к диагностике, когда на начальном этапе выполняется стандартное и утверждённое клиническими рекомендациями обследование, а далее, по мере необходимости – крайней диагностической необходимости, поэтапно проводятся дополнительные исследования. Не все сразу, а только после тщательного анализа информативности предыдущего этапа. Перед каждым обследованием врач должен рассказать, на какие важные для пациента вопросы он надеется получить ответ, какие варианты ответов возможны, какие трактовки результатов удовлетворят его и помогут пациенту скорее начать лечение.
Можно назначать всё известное науке, используя всю установленную в медицинском центре аппаратуру, но также можно делать только необходимое, в оптимальном объёме и в разумные сроки. Стоимость процедур очень важна, но не важнее жизни. Наша клиника может предложить оптимальный подход во всём – и в диагностике, и в лечении, тем более что у нас есть всё, что позволит сделать это быстро и очень качественно.
Содержание
- Точность метода МРТ
- Причины ошибок диагностики
- Достоверность ПЭТ КТ
- Как избежать постановки неправильного диагноза?
В случае с обследованием человеческого организма на наличие раковых заболеваний ни один из методов не может гарантировать 100% безошибочный результат. Для диагностики применяются ПЭТ КТ, МРТ, классическая КТ, УЗД — все они имеют свои плюсы и минусы. Рассмотрим более подробно МРТ и ПЭТ КТ. Могут ли они ошибаться? Если да, то каковы причины неверных результатов при диагностировании рака?
Точность метода МРТ

- характер контура патологии;
- однородность содержимого;
- степень накопления контрастного вещества.
Это позволяет косвенно определить характер опухоли: доброкачественная или злокачественная. Окончательно подтвердить диагноз может только биопсия, но чем выше квалификация врача, выполняющего расшифровку, тем меньше возможность ошибки. Если соблюдать все правила проведения процедуры, то результат будет корректным.
Причины ошибок диагностики
Ошибки при заключении могут быть следствием неправильного размещения пациента на столе томографа, его движений при сканировании или появления артефактов на снимках. На всех изображениях, полученных при МРТ, есть разного рода артефакты, но они в большинстве случаев легко распознаются специалистом. Однако в некоторых ситуациях они могут имитировать патологические состояния, что требует от врача внимательности при расшифровке изображений.
Причины ошибок можно условно разделить на три группы:
- неправильная подготовка пациента к обследованию;
- недостаточная квалификация врача, проводящего процедуру;
- подбор неверной методики диагностики.
Нарушения процесса исследования из-за пациента
Одной из основных причин неправильных результатов МРТ является нарушение процесса диагностики пациентом. Чтобы подобного не случилось, человек должен:
до начала обследования снять с себя предметы, в состав которых входит металл;
- проинформировать лечащего врача о присутствии в теле имплантов из металла;
- в процессе обследования не совершать никаких телодвижений (соблюдать полную неподвижность).
Последний пункт имеет особое значение для точности результата. Малейшие шевеления пациента приводят к смазанности изображения. Именно поэтому лежать нужно не двигаясь, а это непросто при условии, что процесс длится достаточно долго.
Неверно подобранная методика
МРТ часто не может отличить раковые клетки от отечной жидкости и поэтому выдает неверный результат. Не всегда данный метод обследования может распознать опухоль головного мозга, а также легких из-за высокой воздушности и небольшого количества воды в тканях органов дыхания. Изучить состояние костных структур, используя МРТ, также не получится.
Для выявления новообразований лучше применить КТ. Компьютерная томография отлично справляется с поиском опухолей молочной железы и желудка, а МСКТ способна обнаружить образования величиной 2-3 мм.
Диагностические возможности аппарата напрямую зависят от его мощности. Снимки, полученные с помощью низкопольных установок, не обладают необходимой точностью. Для получения достоверных данных лучше применять оборудование с магнитным полем от 1,5 Тесла.
Недостаточная квалификация специалиста
Оборудование для МРТ очень точно воспроизводит изображение. Далее все снимки передаются рентгенологу, который должен их расшифровать. От его компетентности и уровня квалификации зависит постановка верного диагноза. Жировая клетчатка, мышцы, эпителий дают разный сигнал, поэтому иногда можно даже предположить из какой ткани состоит опухоль. К сожалению, многие врачи допускают ошибки в заключении из-за неверной расшифровки результатов.
Достоверность ПЭТ КТ
ПЭТ КТ (позитронно-эмиссионная томография, совмещенная с компьютерной томографией) — это исключительный способ радионуклидного обследования, при помощи которого осуществляется диагностика онкологических заболеваний, патологий ЦНС и эндокринной системы. Надежность исследования, в зависимости от исследуемого органа, колеблется в границах от 85 до 99%.
Несмотря на высокий процент точности, иногда ПЭТ КТ все же ошибается. Причиной этого являются разного рода объективные и субъективные факторы.
Основы работы метода

Датчики ПЭТ фиксируют повышенный обмен РФП, как «горячую зону». КТ в это время делает множественные снимки, тем самым указывая точное место локализации патологии. Изображения, выполненные с применением радиофармпрепарата, накладываются поверх срезов, которые были получены при КТ.
Используя метод ПЭТ КТ, можно получить точную оценку строения органов и патологических процессов, узнать их характеристики. При КТ, УЗД и МРТ подобный анализ провести невозможно.
Главные причины ошибок
В основе ошибок ПЭТ КТ лежат следующие причины:
параллельное существование еще одной патологии с аналогичными проявлениями;
- низкое разрешение аппарата ПЭТ КТ;
- заболевание находится на ранней стадии развития;
- телодвижения пациента во время процедуры;
- неправильная подготовка к диагностике;
- присутствие на теле или одежде обследуемого предметов из металла;
- повышенный сахар в крови;
- передвижения пациента в момент распределения РПФ в организме;
- неправильное толкование срезов специалистами.
Как избежать постановки неправильного диагноза?
Для того, чтобы в результате обследования получить правильный диагноз, необходимо:
- правильно подготовиться к предстоящему процессу;
- заранее снять все предметы, в состав которых входит металл;
- не совершать никакой активности во время распределения контраста по организму и в период исследования;
- проинформировать врача о наличии серьезных заболеваний (например, сахарный диабет);
- проходить процедуру в специализированных центрах с высококвалифицированным персоналом и качественным оборудованием.
Поделитесь с друьями!
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Третьякова Ю.И.
1
Патрикеева М.С.
1
Меньшикова Н.С.
1
1 ФГБОУ ВО Пермский государственный медицинский университет им. ак. Е.А. Вагнера Минздрава России
В статье представлен клинический случай с описанием пациента 28 лет с агрессивным течением перстневидно-клеточного рака желудка, диагностированного на последней стадии. Из анамнеза известно, что в течение 2,5 месяцев больной наблюдался с диагнозом «гастропатия, индуцированная нестероидными противовоспалительными препаратами (НПВП), с назначением ингибиторов протонной помпы». В связи с ухудшением состояния и неэффективностью терапии пациент был госпитализирован в гастроэнтерологическое отделение клиники. На рентгенографии желудка были выявлены признаки инфильтративных изменений стенок желудка и канцероматоз брюшины. По данным фиброгастроскопии — слизистая желудка ярко гиперемирована, плотная при инструментальной пальпации. По результатам патогистологического исследования выявлен недифференцированный аденогенный рак с образованием перстневидных клеток. Больному проведен один курс полихимиотерапии в краевом онкодиспансере без положительного эффекта. Пациент скончался в связи с прогрессированием основного заболевания и развитием полиорганной недостаточности. Был поставлен заключительный патологоанатомический диагноз: Злокачественное новообразование желудка: низкодифференцированная аденогенная карцинорма G3-4 (перстневидно-клеточный вариант – гистологически) с метастазами в парааортальные, периэзофагальные лимфоузлы, легкие, надпочечники; канцероматоз плевральных полостей и брюшины рТ4N3M1b. В заключение статьи даны рекомендации по мерам профилактики онкологических заболеваний.
клинический случай
рак желудка
поздняя диагностика
перстневидно-клеточный рак
онкология.
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
2. Абдуллаев А.Г., Аллахвердиев А.К., Бесова Н.С., Бяхов М.Ю., Горбунова В.А., Давыдов М.И., Давыдов М.М., Ибраев М.А., Карселадзе А.И., Кувшинов Ю.П., Малихова О.А., Неред С.Н., Стилиди И.С., Трякин А.А. Клинические рекомендации по диагностике и лечению больных раком желудка. Ассоциация онкологов России, 2017. 40 с.
3. Денисов И.Н., Артемьева Е.Г., Маленкова В.Ю., Бусалаева Е.И. Рак желудка. Руководство для врачей общей практики (семейных врачей). Ассоциации врачей общей практики РФ, 2015. 14 с.
4. Белковец А.В., Курилович С.А., Решетников О.В. Наследственный рак желудка (научный обзор) // Международный журнал прикладных и фундаментальных исследований. 2016. № 1-4. С. 516-522.
5. Джемал А., Паоло В., Брей Ф., Торре Л., Форман Д. Атлас современной онкологии. Издание второе. Американское онкологическое общество, 250 Williams Street, Atlanta, Georgia 30303 USA (США), 2014. 136 с.
6. Бойкова С.П., Зайратьянц О.В., Зотова Л.А. Патологическая анатомия: атлас: учеб. пособие для студентов медицинских вузов и последипломного образования. М.: «ГЭОТАР-Медиа», 2014. 961 с.
7. Рыбакова Д.В., Давыдов М.М., Казанцев А.П., Керимов П.А., Матинян Н.В. Рак желудка у пациента 16 лет: описание клинического случая // Онкопедиатрия. 2017. Т. 2. №4. С.147–151.
8. Вашакмадзе Л.А., Филоненко Е.В., Бутенко А.В., Кириллов Н.В., Хомяков В.М. Отдаленные результаты хирургического лечения больных местнораспространенным и диссеминированным раком желудка в сочетании с интраоперационной фотодинамической терапией. // Фотодинамическая терапия и фотодиагностика. 2013. Т. 1. №2. С.3-10.
9. Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2017 году. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 236 с.
10. Бойцов С.А., Чучалин А.Г., Арутюнов В.Г. Биличенко Т.Н., Бубнова М.Г., Ипатов П.В., Калинина А.М., Карпин А.Д., Марцевич С.Ю., Оганов Р.Г., Погосова Н.В., Старинский В.В., Стаховская Л.В., Ткачева О.Н., Чиссов В.И., Шальнова С.А., Шестакова М.В. Профилактика хронических неинфекционных заболеваний. Клинические рекомендации. Москва. 2013. 136 с.
Смертность от онкологических заболеваний занимает второе место после болезней сердечно-сосудистой системы. В 2017 г. в России выявлено почти 541 тыс. онкобольных, а умерло 290,7 тыс., что составило 15,9% в общей структуре смертности [1, с. 3].
В последние годы отмечается тенденция к снижению заболеваемости раком желудка (РЖ), тем не менее в структуре заболеваемости злокачественными новообразованиями населения России РЖ занимает 4-е место у мужчин (7,6%) и 5-е место у женщин (4,7%) [1, с. 9, 10]. Пик заболеваемости приходится на возраст старше 50 лет. Злокачественные новообразования желудка занимают вторую позицию в структуре смертности у мужчин и женщин. Ежегодно в РФ регистрируют около 36 тыс. новых случаев РЖ, и более 34 тыс. больных умирает от этого заболевания. Этиология заболевания до конца не выяснена [2, с. 6].
Имеется связь возникновения патологии с определенными факторами риска. Их можно разделить на немодифицируемые: пол (мужчины страдают чаще), возраст (по мере увеличения возраста увеличивается частота возникновения РЖ), генетическая предрасположенность (5–10% пациентов, страдающих РЖ, имеют отягощенный семейный анамнез); и модифицируемые: инфекция Helicobacter Pylori (HP), характер рациона, ожирение, курение, алкоголь, профессиональная деятельности [3, с. 4-6].
В настоящее время установлено, что почти 90% случаев РЖ в мире обусловлено инфицированием бактерией HP. При этом средства лечения HP-инфекции существуют, но широко не применяются из-за недостатка подтвержденных данных эффективности в профилактике рака желудка и высокой стоимости [5, с. 22]. К возникновению РЖ могут привести фоновые заболевания: хронический атрофический гиперпластический гастрит, аденоматозные полипы, пернициозная анемия, состояния после резекции желудка, болезнь Менетрие [2, с. 6]. Различают три гистологических типа РЖ (по Lauren, 1965 г.): кишечный, диффузный, смешанный. При диффузном раке опухоль представлена слабоорганизованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки). Для данного типа характерен диффузный инфильтративный рост [2, с. 7].
Перстневидно-клеточный рак желудка содержит не менее половины клеток с признаками внутриклеточного образования слизи. Скапливающаяся в цитоплазме слизь сдвигает ядро к периферии, и клетка приобретает сходство с перстнем [6, с. 589]. Согласно результатам клинических наблюдений неблагоприятный прогноз при диффузном раке желудка связывают с низкой выявляемостью на ранних стадиях, быстрым течением, более злокачественным потенциалом опухолевых клеток и ранним метастазированием [7].
Приводим случай летального исхода пациента с перстневидно-клеточным раком желудка, диагностированным на последней стадии.
Клиническое наблюдение. Пациент В., 28 лет, поступил в гастроэнтерологическое отделение клинической медико-санитарной части г. Перми 14.11.2017 г. с жалобами на постоянные боли в области правого фланка живота, преимущественно в нижней части; интенсивные боли в правом подреберье и правом боку при глубоком дыхании; тошноту, рвоту желчью, вздутие живота, Также пациента беспокоили отсутствие аппетита, отвращение к пище, жидкий стул 2–3 раза в сутки без примесей. Отмечались выраженная общая слабость, повышение температуры тела до 37,4°С. За 1 месяц больной похудел на 13 кг.
Анамнез. В начале сентября 2017 г. больной получал терапию антибактериальными и нестероидными противовоспалительными препаратами (НПВП) по назначению стоматолога (после экстракции зуба) в течение 7 дней. В начале октября 2017 г. были вновь назначены антибактериальная терапия и НПВП по поводу гайморита. На фоне приема препаратов появились боли в эпигастрии, изжога, неустойчивый стул. Больной обратился в поликлинику по месту жительства, где обследовался у участкового терапевта. 7 октября 2017 г. выполнена фиброгастродуоденоскопия (ФГДС), на которой выявлены множественные язвы желудка (6 дефектов), язва двенадцатиперстной кишки (ДПК) в стадии эпителизации, застойная гастропатия, дуоденогастральный рефлюкс. Уровень антител к HP составил 1,44. Получал терапию ингибиторами протонной помпы (ИПП), антацидами без эффекта – сохранялись тошнота и абдоминальный болевой синдром с локализацией в эпигастрии.
Участковым терапевтом дано направление на экстренную госпитализацию в терапевтическое отделение городской больницы с диагнозом: Множественные язвы желудка и язва луковицы ДПК, ассоциированные с HP. Гастринома? Синдром Золлингера–Эллиссона?, где больной находился с 12.10.2017 г. по 24.10.17 г. При обследовании в общем анализе крови (ОАК) от 13.10.2017 г.: гемоглобин – 157 г/л; умеренное повышение лейкоцитов до 11х109/л; ускоренная скорость оседания эритроцитов (СОЭ) – 40 мм/час. В биохимическом анализе крови от 13.10.2017 г. общий белок, амилаза, холестерин, печеночные тесты, электролиты крови в пределах нормальных значений. На ультразвуковом исследовании органов брюшной полости (УЗИ) от 13.10.2017 г. выявлены признаки диффузных изменений видимых участков поджелудочной железы. Кал на скрытую кровь – слабоположительный.
23.10.2017 г. выполнена повторная ФГДС: слизистая желудка диффузно гиперемирована с выраженным отеком, утолщена, сосудистый рисунок смазан. Слизистая оболочка в области привратника отечна, гиперемирована. По всем стенкам множественные точечные лимфоидные высыпания. Заключение: Диффузный катаральный гастрит выраженной степени активности. Дуоденогастральный рефлюкс. Диффузный катаральный бульбит выраженной степени активности. Косвенные признаки панкреатита. Гистологическое исследование не проводилось.
В стационаре по результатам обследований был поставлен диагноз: Язвенная болезнь желудка, луковицы ДПК. Множественные острые язвы желудка в активной стадии. НПВП-ассоциированная гастропатия. Язва луковицы ДПК в стадии эпителизации. Больной получал терапию спазмолитиками, ИПП 40 мг в сутки, антацидами.
На фоне лечения отмечалась положительная клиническая и эндоскопическая динамика в виде уменьшения болевого синдрома и эпителизации язвенных дефектов. Пациент был выписан из стационара с рекомендациями продолжить прием ИПП в дозе 40 мг в сутки и явиться на прием к участковому терапевту.
После выписки боли в эпигастрии усилились, появилась острая боль справа в боку в области ребер. Участковый терапевт назначил прием прокинетика, антацидных препаратов, НПВП внутримышечно (в/м) № 3. 4.11.2017 г. у пациента внезапно возникла острая боль в области верхнего левого фланка живота и межреберьях, связанная с дыханием. Больной обратился в приемное отделение клинической больницы, где был поставлен диагноз: Межреберная невралгия. Проведена терапия НПВП в/м, и больной был отпущен домой под наблюдение невролога и терапевта с рекомендациями приема НПВП. Далее по назначению гастроэнтеролога поликлиники принимал висмута трикалия дицитрат, спазмолитики, даларгин без эффекта – сохранялись абдоминальный болевой синдром, неустойчивый стул; также появились выраженное вздутие живота, рвота, отвращение к пище, прогрессирующее похудание. 13.11.2017 г. выполнена ректороманоскопия: стенка прямой кишки с трудом расправлялась воздухом, с эрозиями, утолщенными складками, сосудистый рисунок смазан. Заключение: эрозивно-катаральный проктосигмоидит.
14.11.2017 г. пациент был экстренно госпитализирован в гастроэнтерологическое отделение клиники для дальнейшего обследования и лечения.
Из анамнеза жизни известно, что пациент рос и развивался соответственно возрасту. Курил в течение 8 лет по 10 сигарет в день. Профессиональных вредностей не было. Со слов больного, ранее лечился по поводу мочекаменной болезни. Наследственность по заболеваниям органов пищеварения не отягощена.
При физическом исследовании обращала на себя внимание бледность кожных покровов с сероватым оттенком. Кожа чистая, отеков не отмечалось. Пульс – 92 удара в минуту, ритмичный. Тоны сердца ясные, ритм правильный. Дополнительные шумы не выслушивались. Дыхание везикулярное, ослаблено в нижних отделах, хрипы не выслушивались. Перкуторный звук несколько притуплен в нижних отделах легких. ЧДД – 16 в минуту.
Язык обложен бело-желтым налетом у корня, влажный. Живот плотный, увеличен за счет вздутия и асцита; пальпация резко болезненная в эпигастрии, в области правого фланка живота, по ходу толстой кишки. Ординаты Курлова 10х8х7 см. Стул оформленный, чередующийся с кашицеобразным, без патологических примесей, 1–2 раза в сутки. Со стороны почек и мочевого пузыря без видимой патологии.
Результаты лабораторно-инструментальных исследований представлены ниже.
ОАК: эритроциты 4,7х109/л, гемоглобин 140 г/л, среднее содержание гемоглобина (ССГ) 29%, тромбоциты 307х109/л, лейкоциты 8,4х/л, палочкоядерные нейтрофилы 7%, сегментоядерные нейтрофилы 75%, лимфоциты 15%, моноциты 3%, повышение СОЭ до 43 мм/час.
ОАМ: цвет – желтый, мутная, pH 6,0, умеренная протеинурия 0,39 г/л, лейкоциты 4–6 в поле зрения (п/з), эритроциты 0–1 в п/з, эпителий 2–3 в п/з, слизь +.
Биохимический анализ крови от 15.11.2017 г.: глюкоза 4,8 ммоль/л, Ca 2,29 ммоль/л, AСТ/АЛТ 16/18 Ед/л, ГГТП 84 Ед/л, ЩФ 285 Ед/л, общий белок 54 г/л, альбумины 27 г/л, билирубин общий 12 мкмоль/л, прямой 4,1 мкмоль/л, холестерин общий 3,7 мкмоль/л, калий 4,5 ммоль/л, натрий 134 ммоль/л, креатинин 51 ммоль/л, резкое повышение С-реактивного белка (СРБ) 105 мг/л, снижение железа сыворотки до 4,5 мкмоль/л, повышение общей железосвязывающей способности сыворотки до 75, незначительное повышение прокальцитонина до 0,2 нг/мл. При форезе белков выявлены снижение альбумина до 37,95% и повышение α1-глобулинов до 8,77%, α2-глобулинов до 13,28%, β-глобулинов до 18,5 3%, γ-глобулин 21,47%.
Коагулограмма от 15.11.2017 г.: протромбиновое время 14,9 секунд (11–15 секунд), тромбиновое время – 17,2 секунд, активированное частичное протромбиновое время – 28 секунд (24–35 секунд), резкое повышение фибриногена до 9,56 г/л.
Копрограмма от 16.11.2017 г.: консистенция жидкая, цвет темно-коричневый, переваренные мышечные волокна 0–1–2 в п/з, неизмененные мышечные волокна 0–1 в п/з, форменные элементы крови 0–1 в п/з, лейкоциты 10–20 в п/з, эпителий плоский – единичный в п/з, нейтральных жиров нет, жирных кислот нет, крахмал внеклеточно скудно, йодная флора +, детрит +++.
ФГДС от 14.11.2017 г.: складки желудка гипертрофированные, отечные. Слизистая желудка ярко гиперемирована, плотная при инструментальной пальпации, ранимая при контакте с линейными рубцами неправильной формы. Луковица ДПК деформирована, рыхлая с увеличенными эрозированными фолликулами, на верхушках – фибрин. Заключение: Болезнь Крона? Дуоденогастральный рефлюкс. Косвенные признаки панкреатита. Выполнена биопсия.
Результаты патогистологического исследования слизистой желудка (20.11.2017 г.): в слизистой оболочке пилородуоденальной области очаговое скопление крупных клеток округлой и овальной формы, со светлой слизьсодержащей цитоплазмой, периферически расположенными уплощенными ядрами, единичные клетки с гиперхромными ядрами, скудной цитоплазмой. Диагноз: недифференцированный аденогенный рак с образованием перстневидных клеток.
16.11.2017 г. выполнена КТ органов брюшной полости. Выявлен выпот в реберно-диафрагмальные синусы с обеих сторон. Желудок в области тела и антрального отдела с неравномерно утолщенными стенками до 0,8 см. Большой сальник в области эпигастрия уплотнен, с узловыми образованиями. В брюшной полости большое количество свободного выпота. Заключение: Признаки двустороннего гидроторакса, инфильтративных изменений стенок желудка. Большой сальник в эпигастральной области уплотнен с узловыми образованиями (канцероматоз брюшины). Асцит. Аденопатия гепатодуоденальных лимфатических узлов.
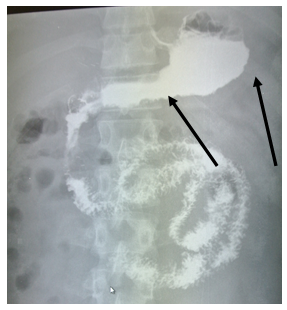
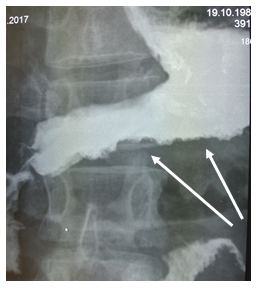
На рентгеноскопии пищевода, желудка, ДПК с бариевой взвесью диагностировано стойкое сужение просвета тела, синуса, выходного отдела желудка (рис. 1) с неровными фестончатыми контурами, атипичным рельефом слизистой (рис. 2). Заключение: Рентгенологические признаки инфильтративного поражения желудка.
Рис. 1. Рентгенологическое исследование желудка пациента В., 28 лет: сужение просвета тела, синуса, выходного отдела желудка
Рис. 2. Рентгенологическое исследование желудка пациента В., 28 лет: неровность и фестончатость контуров, атипичный рельеф слизистой
В условиях стационара проводилась инфузионная, антибактериальная, спазмолитическая, обезболивающая терапия. Амитриптилин 6,25–12,5 мг на ночь. Больной выписан из отделения 22.11.2017 г. с диагнозом:
Основной: Недифференцированный аденогенный рак выходного отдела желудка IV ст. Сопутствующий: Эрозивно-катаральный проктосигмоидит.
Осложнения: Канцероматоз брюшины. Аденопатия гепатодуоденальных лимфоузлов. Асцит. Двусторонний гидроторакс. Дефицит железа.
Пациенту выдано направление в онкологический диспансер. Даны рекомендации приема Амитриптилина 25 мг на ночь; Прегабалина 75 мг 1 раз в день; Нейробиона по 1 табл. 3 раза в день.
С 23.11.2017 г. по 30.11.2017 г. пациент находился в краевом онкологическом диспансере, где был подтвержден диагноз: Злокачественное новообразование желудка (ЗНО) IV ст. Т4NxMx».
Проведен 1 курс полихимиотерапии (ПХТ). После выписки, несмотря на проводимое лечение, состояние пациента прогрессивно ухудшалось. 18.12.2017 г. проведена эвакуация 10 литров асцитической жидкости в условиях стационара. 20.12.2017 г. – консультативный прием в онкологическом диспансере. Диагноз: Злокачественное новообразование желудка IV ст. Т4NxMx. Тотальное поражение. Канцероматоз брюшины. Прогрессирование. Кахексия. Асцит. Было рекомендовано продолжить симптоматическую терапию по месту жительства, а также попытка проведения гастростомии. Учитывая тяжесть состояния, ПХТ не показана.
22.12.2017 г. больной отметил появление одышки. На следующий день самостоятельно обратился в приемное отделение краевой больницы и был госпитализирован в отделение торакальной хирургии. На КТ органов грудной клетки (23.12.2017 г.) выявлен двусторонний гидроторакс. По легочным полям определялись очаги уплотнения по типу «матового стекла».
23.12.2017 г. и 25.12.2017 г. – плевральная пункция – эвакуирован 1 л серозно-геморрагического отделяемого. 26.12.2017 г. состояние больного тяжелое, с отрицательной динамикой. Появились рвота темной кровью, боли в эпигастрии, слабость, сухость во рту. На ФГДС – кровотечение интрагеморрагическое. Эрозивный эзофагит. Гемостаз системой EndoClot.
27.12.2017 г. состояние было крайне тяжелым. Сохранялась рвота темной кровью. Пациент переведен в ОРИТ, где проводилась инфузионная терапия, получал Метоклопрамид, Трамадол, Кетопрофен, Верошпирон, Транексам, Нексиум. При обследовании нарастала тромбоцитопения – 11569-41-19х109л, показатели очищения: мочевина 20,01 ммоль/л; креатинин 140,9 ммоль/л; гипопротеинемия 46,4 г/л.
27.12.2017 г. в 22:15 – асистолия. Реанимационные мероприятия в полном объеме – без эффекта.
27.12.2017 г. в 22:45 констатирована биологическая смерть. Труп В., 28 лет, был направлен на патологоанатомическое исследование с диагнозом: Перстневидноклеточный рак желудка с переходом на нижнюю треть пищевода T4NхM1. Канцероматоз плевры. Метастатическое поражение легких. Двусторонний экссудативный плеврит. Асцит. Осложнения: Кахексия. Желудочно-кишечное кровотечение. Геморрагический шок. Синдром полиорганной недостаточности.
Патологоанатомический диагноз:
Основное заболевание: Злокачественное новообразование желудка: низкодифференцированная аденогенная карцинорма G3-4 (перстневидно-клеточный вариант – гистологически) с метастазами в парааортальные, периэзофагальные лимфоузлы, легкие, надпочечники; канцероматоз плевральных полостей и брюшины рТ4N3M1b.
Осложнение основного заболевания: Отек головного мозга. Двусторонний гидроторакс (1200/1200 мл). Асцит 3500 мл. Кахексия. Венозное полнокровие и паренхиматозная дистрофия миокарда, печени, почек.
Сопутствующие заболевания: Хронический пиелонефрит, ремиссия.
Обсуждение. В структуре заболеваемости РЖ возрастает доля молодого контингента больных (до 45 лет) с преобладанием низкодифференцированных и сложных форм, характеризующихся крайне плохим прогнозом [7, 8]. В настоящее время показатели несвоевременной диагностики рака желудка (IV стадия) являются одними из лидирующих, составляя в России 39,9% [9, с. 10].
Врач первичного звена является первой линией защиты в борьбе с онкопатологией. Первичная профилактика направлена на выявление и устранение влияния неблагоприятных факторов окружающей среды (канцерогенов) на процесс возникновения злокачественной опухоли, а также на устранение модифицируемых факторов риска [10]. У описанного нами пациента к факторам риска можно отнести длительный стаж курения и инфекцию НР.
Вторичная профилактика направлена на выявление и устранение предраковых заболеваний и диагностирование злокачественного новообразования на ранней стадии процесса при помощи ряда лабораторных и инструментальных методов обследования, включая полное гистологическое и молекулярно-генетическое исследование. При этом важно помнить о «симптомах тревоги» [10]. У пациента имели место снижение массы тела и повышение СОЭ, что должно было насторожить врачей. В течение 1,5 месяцев пациента вели с диагнозом «НПВП-гастропатия» с назначением ИПП, которые могли маскировать клинику рака желудка. Кроме того, отсутствие анамнестических данных о наличии фоновых заболеваний желудка и наследственной предрасположенности, молодой возраст пациента, неспецифическая симптоматика в начале заболевания, а также несвоевременное гистологическое исследование слизистой желудка послужили причиной поздней диагностики.
Заключение. Важно помнить, что рак желудка может быть диагностирован и в молодом возрасте, имея при этом крайне агрессивное течение. Необходимо выделять группы риска и своевременно проводить скрининг онкологических заболеваний. Регулярное диспансерное наблюдение является важнейшей массовой и высокоэффективной медицинской технологией сбережения здоровья и снижения преждевременной смертности населения.
Библиографическая ссылка
Третьякова Ю.И., Патрикеева М.С., Меньшикова Н.С. ПОЗДНЯЯ ДИАГНОСТИКА РАКА ЖЕЛУДКА У ПАЦИЕНТА 28 ЛЕТ (СЛУЧАЙ ИЗ ПРАКТИКИ) // Современные проблемы науки и образования. – 2018. – № 6.
;
URL: https://science-education.ru/ru/article/view?id=28401 (дата обращения: 06.06.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Суть проблемы
Больная Д. – 59лет. В 2021 году перенесла операцию субтотальной дистальной панкреатоспленэктомии по поводу опухоли хвоста поджелудочной железы. При КТ в марте 2022г. – данных за рецидив опухоли не выявлено, ранее видимые (при КТ от 2021г.) единичные слабоувеличенные верхние мезентериальные и забрюшинные лимфоузлы — без динамики количества и размеров. В сентябре 2022года у больной появилась тошнота, боли в животе и уплотнение в эпигастральной области при пальпации. При КТ в сентябре 2022года отмечалось появление небольшого количества жидкости в брюшной полости и слабое увеличение перигастральных лимфоузлов по малой кривизне желудка, изменений в желудке выявлено не было. Со временем боли в животе стали нарастать, усилилась слабость и похудание. При ЭГДС в конце декабря 2022г.по передней стенке антрального отдела желудка было выявлено бугристое экзофитное неоднородное образование размерами около 3х2,5см с некрозом в центре. Взята биопсия.
Описание КТ от 27.01.2023г. — в верхнем этаже брюшной полости определяемое ранее (при КТ от 30.09.2022г.) небольшое количество жидкости увеличилось, преимущественно, по передней поверхности печени (толщина слоя до 10мм), а также по большой кривизне желудка и по его передней стенке. Также усилилась ранее видимая неравномерная инфильтрация малого и большого сальника, преимущественно, в левом эпи-мезогастрии с подпаиванием петель кишечника к передней брюшной стенке, увеличилась гиперемия брыжейки тонкой кишки. По передней стенке антрального отдела желудка определяется мягкотканное неоднородное, интенсивно контрастирующееся узлообразование размерами-30х22х20мм с неровными контурами, выбухающее в просвет желудка, с его сужением и инфильтрирующее все подлежащие слои вплоть до серозы с инфильтрацией передней перигастральной жировой клетчатки. В толще образования появился гиподенсивный очаг распада-9х7мм.
Данное образование определялось и при предыдущем КТ от 30.09.2022г. размерами-21х18х16мм, структура его была однородной. Множественные лимфоузлы малого сальника и по малой кривизне желудка по прежнему умеренно увеличены количественно и в размерах, максимально до 10х9мм — без динамики при сравнении с КТ от 30.09.2022г. и КТ от 17.03.2022г. При КТ от 17.03.2022г. новообразований в желудке не определялось, перигастральные лимфоузлы были не увеличены. В левой плевральной полости появилось небольшое количество жидкости, толщина слоя до 16-17мм. Очаговых изменений в печени не обнаружено.
Анализ диагностических ошибок при КТ от 30.09.2022г.:
- Не обнаружена экзофитная солидная опухоль в антральном отделе желудка
- Не зафиксирована инфильтрация большого сальника, что вместе с асцитом говорило о начавшемся канцероматозе брюшины.
- Не были учтены жалобы пациентки и клинические проявления болезни.
Выводы
Процесс постановки правильного диагноза затянулся во времени, что ухудшило состояние пациентки, привело к увеличению размеров опухоли и ее распаду, а также к распространению опухолевого процесса по брюшине. Прогноз ухудшился.
К сожалению, пациентка в сентябре 2022года сделала КТ исследование в другом медучреждении с описанием КТ другим врачом-рентгенологом, который вовремя не увидел развития новой онкопатологии в желудке, что привело к затягиванию процесса и ухудшению состояния пациентки. Поэтому, очень важно, по возможности, проводить КТ контроль в динамике в одном медучреждении и, что еще важнее, описывать КТ исследование конкретного пациента тем врачом, который описывал его и ранее. Это позволит избежать ошибок в описании, ускорит процесс диагностики и улучшит его качество, особенно, при динамическом КТ наблюдении.



 до начала обследования снять с себя предметы, в состав которых входит металл;
до начала обследования снять с себя предметы, в состав которых входит металл; параллельное существование еще одной патологии с аналогичными проявлениями;
параллельное существование еще одной патологии с аналогичными проявлениями;