Кроме ошибок,
связанных с измерением интенсивностей
падающего и проходящего пучков света
следует учитывать и другие источники
погрешностей.
Выходящий из
монохроматора пучок света не является
строго параллельным. Поэтому длина пути
отдельных лучей пучка, а следовательно
их поглощение,будет неодинаковым.
Эффективная длина пути, пройденного
непараллельным пучком внутри образца,
больше толщины образца. Это учитывается
при конструировании серийных
спектрофотометров, в которых
погрешности вследствие непараллельности
пучка света обычно не превышают
ошибок регистрирующей схемы. При
сравнении поглощения в образцах
одинаковой толщины эти ошибки
компенсируются.
К
ошибкам определения показателей
поглощения приводят также попадание
рассеянного света на приемник
излучения, неточная установка образцов
и нелинейность регистрирующих
устройств. Для уменьшения интенсивности
рассеянного света приборы снабжаются
сменными светофильтрами, выделяющими
отдельные участки спектра. Лучшие
результаты дают схемы с двойной
монохроматизацией излучения.
Весьма
существенным при спектрофотометрических
измерениях является учет зависимости
ошибки определения оптической
плотности (или пропускания) от величины
пропускания. Если точность определения
оптической плотности связана только
с погрешностями измерений интенсивностей
падающего I0 и
проходящего I световых
потоков и эти погрешности одинаковы
для обоих потоков, то, используя (1),
нетрудно получить формулу для
относительной ошибки:
(9)
Из ур.(9) следует,
что наибольшая точность измерений может
быть достигнута при значениях пропускания
образцов, заключенных в пределах —
10- 45% (что соответствует интервалу
оптической плотности от единицы до 0,2)
. Для образцов с оптической плотностью
меньше 0,2 или большей единицы ошибка
измерений резко возрастает. При проведении
количественного анализа используется
формула (1) , которая выведена для
строго монохроматического излучения.
В то же время излучение, проходящее
через выходную щель монохроматора
спектрофотометра, не строго
монохроматическое. Характеристикой
степени монохроматичности пучка
является спектральная ширина щели
,
которая для автоколлимационных систем
в видимой и УФ-области спектра для не
очень узких щелей может быть вычислена
по формуле
(10)
где s
— линейная ширина щели (в мм), Дi
— линейная дисперсия прибора (в мм/нм).
Величина
ошибки, связанная с конечной шириной
щели, зависит от степени изменения
коэффициента поглощения в интервале
.
При исследовании веществ с широкими
полосами поглощения спектральную
ширину щели можно сделать намного
меньше ширины полосы поглощения.
В этом случае измеренная величина
поглощения будет слабо зависеть от
ширины щели при измерении в максимумах
или минимумах полос поглощения. Эта
зависимость резко усиливается при
измерениях на крутых склонах полос
поглощения. Для уменьшения ошибок,
связанных с немонохроматичностью
потока излучения, при проведении
количественного анализа рекомендуется
измерять оптическую плотность в
максимумах или минимумах полос
поглощения. Если это не удается, то
необходима строгая фиксация
спектральной ширины щели и длин
волн, на которых проводятся измерения.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Ошибки спектрофотометрических измерений определяются флуктуациями показаний на выходном приборе. Их величина зависит, в свою очередь, от стабильности источника света, флуктуаций светового пучка на пути от источника света к приемнику, шумов приемно-усилительной аппаратуры и регистрирующего прибора. Рассмотрим влияние этих источников ошибок на результаты измерений, учитывая, что при абсорбционных измерениях, в конечном итоге, существенна точность определения оптической плотности О, а не интенсивностей поглощенного и непоглощенного сигналов. Напомним, что [c.137]
Пусть чувствительность определения примесей в пробе объемом 25 мл при помощи кюветы толщиной 5 см равна 0,005 у/см . Тогда минимальное обнаруживаемое количество вещества равно 0,005 X (25/5) == 0,025 мкг, или 2,5 10 %, для пробы весом 1 г. Эта величина примерно соответствует ошибке спектрофотометрических измерений малых поглощений. [c.133]
Рассмотренные ошибки спектрофотометрического метода в основном относятся к работе прибора. Естественно, что не меньшее значение могут иметь ошибки, связанные с работой самого исследователя (точность приготовления исходных растворов, способ заполнения кювет), и с условиями протекания конкретной химиче- ской реакции (разложение реагентов, межмолекулярные взаимодействия и т. п.). Все это должно учитываться при проведении фотометрических измерений. [c.22]
Изучение факторов, влияющих на точность спектрофотометрических измерений [19] — [27], показывает, что причины ошибок в спектрофотометрии могут быть весьма разнообразны и многочисленны. Ошибки возникают, например, за счет действий оператора, условий проведения реакций, недостаточной чистоты кювет, непостоянства их установки в кюветные отделения, невоспроизводимости настройки шкалы прибора на О и 100% пропускания, непостоянства излучения источника освещения, нестабильности работы фотоэлектрической системы [24] — [27]. [c.30]
При определении Do (ВаО) на основании данных по реакций образования ВаО получаемые значения существенно зависят от принятого в расчете типа основного состояния этой молекулы. Значение, приведенное по данным работ [72, 74, 75, 396], получено для основного состояния Х 2 оно подтверждено результатами измерений методом электронного удара [73]. Расчет по результатам измерения давления пара ВаО менее надежен из-за неточности данных по АЯ (ВаО, тв.) и АЯд (Ва, тв.). В обзоре [76] принимается основное состояние и рекомендуется Do = 131 6. См. также [4, стр. 236]. Спектрофотометрические измерения [118, 119], приведшие к значению —120, содержали ошибки, см. [396]. [c.49]
На абсолютную и относительную точность (воспроизводимость) спектрофотометрических измерений влияет ряд разнообразных и часто трудно поддающихся учету факторов [23, 40]. Для количественного анализа и различных сравнительных исследований наиболее важной является воспроизводимость измерений и несущественны некоторые ошибки систематического характера, так что при разработке многих методик исследования, а также аппаратуры, исключению последних уделяется мало внимания. В связи с этим существует такое положение, что при высокой в большинстве случаев относительной точности современных спектрофотометрических измерений данные, полученные на различных приборах или в различных условиях эксперимента, часто значительно различаются. В большей части опубликованных исследований ультрафиолетовых спектров поглощения авторами не оценивается абсолютная точность измерений, а также не приводятся данные, относящиеся к аппаратуре и методике эксперимента, позволяющие провести хотя бы грубую оценку подобного рода. [c.383]
Расчет общей (максимальной) ошибки и отдельных составляющих ошибок дифференциальных спектрофотометрических измерений кобальта (14—26 г/л) в виде перхлората, измеренных по отношению к оптимальному раствору сравнения, содержащему 12 г/л Со +, приведены в табл. 7, [c.54]
Из уравнения (28) можно также сделать следующие общие заключения по точности дифференциальных спектрофотометрических измерений. Ошибка будет меньше, если [c.44]
Погрешность в определении истинной константы диссоциации слагается в основном из трех величин погрешности, вносимой спектрофотометрическими измерениями, погрешности потенциометрических измерений (если они производились) и ошибки, которая вносится принятой методикой нахождения истинной константы диссоциации по найденному значению кажущейся или концентрационной константы диссоциации. [c.93]
Ошибки при спектрофотометрических измерениях [c.137]
Первоначально рассмотрим точность анализов. Ошибка воспроизводимости, которой характеризуется точность определений атомно-абсорбционного анализа, складывается за счет двух основных операций получения поглощающего слоя и измерения поглощения спектрофотометром. Источники возникновения и величина ошибок при спектрофотометрических измерениях обсуждались ранее ( 19), причем было показано, что эти ошибки могут быть в принципе уменьшены до дробовых шумов приемника, имеющих статистическое происхождение. Случайные ошибки, связанные с получением поглощающего слоя, обусловлены следующими звеньями анализа неоднородностью образцов, дозированием проб на электрод, случайными обстоятельствами, определяющими скорость испарения элемента в кювету, колебаниями температуры кюветы и давления постороннего газа. [c.329]
Непосредственная погрешность спектрофотометрического измерения, включающая ошибки настройки прибора на О и 100% пропускания [76, 83, 88—91], погрешность отсчета по измерительному потенциометру и ошибки, связанные с нестабильностью электронной схемы [82, 92] в процессе измерения. [c.17]
Выбор условий регистрации спектров оказывает существенное влияние на результаты спектрофотометрических измерений. При выборе оптимальных условий удается свести к минимуму как систематические, так и случайные ошибки, возникающие [c.19]
Зависимость ошибки определения концентрации от величины пропускаемости света измеряемым раствором. Одна из существенных ошибок спектрофотометрических измерений возникает при отсчетах величины пропускания на крайних участках соответствующей шкалы прибора. Вследствие логарифмической формы закона поглощения наибольшая точность может быть получена при измерениях в области средних значений величины пропускания. Если предельное значение неопределенности при отсчете О величины отклонения гальванометра обозначить через (10 и предположить, что источник излучения является стабильным и что соотношение между интенсивностью падающего светового пучка и отклонением гальванометра является линейным, то [c.85]
Одновременное присутствие в растворе последовательно образующихся комплексов может привести к серьезным ошибкам при сочетании спектрофотометрических измерений с экстракцией растворителем. Только один из последовательных комплексов — электронейтральный — может экстрагироваться органическим растворителем. Различные последовательно образующиеся комплексы, которые содержат большее или меньшее количество лигандов, чем необходимо для нейтрализации положительного заряда центрального иона металла, и сами несут положительный или отрицательный заряд, останутся в водной фазе. Возможность ошибки будет наименьшей в случае комплексов, в которых для нейтрализации электрического заряда центрального иона металла и насыщения его координационной сферы требуется такое же число лигандов, как и для координации. [c.88]
Дифференциальный спектрофотометрический метод может быть применен и в тех случаях, когда имеется наложение в спектрах поглощения соединения и реагента. Тогда при измерении по отношению к одному из использованных как эталон растворов в значительной степени исключается ошибка за счет поглощения реагента. [c.480]
XI1-3-1. При каком значении Т (парциальное поглощение) в спектрофотометрических анализах будет минимальной относительная ошибка в определении концентрации (Дс/с) для данной ошибки измерения Г [c.143]
Дифференциальный метод анализа используют для повышения точности спектрофотометрических и фотоколориметрических измерений при определении высоких концентраций веществ (от 10 до 100%). Сущность метода заключается в измерении светопоглощения анализируемого раствора относительно раствора сравнения, содержащего определенное количество испытуемого вещества это приводит к изменению рабочей области шкалы прибора и снижению относительной ошибки анализа до 0,5—1%. [c.40]
Кроме того, в настоящее время разработаны спектрофотометрические методы определения большого содержания отдельных компонентов. Эти методы называют дифференциальной фотометрией. Для точного измерения в параллельном световом потоке устанавливают стандартный раствор, близкий по составу к испытуемому раствору. Таким образом, измеряется разница интенсивности двух световых потоков ошибка измерений меньше сказывается на конечном результате. Главные трудности и недостатки, по сравнению с эмиссионным спектральным анализом, связаны с затратой времени на подготовку вещества к анализу, отделение мешающих компонентов, и др. Результат зависит от выбора условий, реактивов и концентрации посторонних ионов. Групповые методы почти не разработаны, поэтому для каждого элемента необходим отдельный ход анализа. [c.9]
Другим методом определения констант является измерение возрастания растворимости в воде исследуемого вещества при различных значениях pH раствора (глава 6), Этот метод не так точен, как потенциометрический, спектрофотометрический и кондуктометрический, но бывает полезен в тех случаях (к счастью, редких), когда вещество слишком мало растворимо в воде для того, чтобы использовать потенциометрический или кондуктометрический метод, и спектр его непригоден для определения. Катализ гидролиза эфиров, дисахаридов и глюкозидов как метод измерения констант ионизации представляет лишь исторический интерес. В ряде случаев этот метод приводил к очень грубым ошибкам. [c.18]
Обычно спектрофотометрические измерения проводят в таких условиях, когда оптическая плотность исследуемого раствора лежит в 1феде-лах А = 0,2—0,8, так как именно при таких значениях оптической плотности достигается минимальная ошибка спектрофотометрических измерений. [c.528]
Общепринято, что такое ограничение не распространяется па спектрофотометрические данные, и отклонения обычно определяют как разность между необходимым и рассчитанным све-топоглощением [4, И, 12, 53, 72—74]. Обычно при определенных условиях нет необходимости использовать веса, так как в этом случае ошибки спектрофотометрического измерения преобладают над ошибками измерения концентрации [11, 12, 75]. Кроме того, показания современных спектрофотометров имеют постоянную дисперсию в некотором диапазоне значений светопоглощения (см. разд. 8.3, п. 6). Однако если измерять светопоглощение одного и того же раствора при нескольких длинах волн, то будет наблюдаться корреляция ошибок. Для математической корректности следовало бы учесть такую корреляцию, введя весовую матрицу, содержащую ковариации переменных. Тем не менее корреляцией можно пренебречь, так как спектрофотометрические ошибки начинают проявляться, когда ошибки в концентрациях составляют несколько десятых долей процента, а ошибки в измерении светопоглощения— несколько тысячных [12]. Показано [12], что даже в случае преобладания концентрационных ошибок пренебрежение корреляцией незначительно влияет на результат. [c.96]
В настоящее время метод остановленной струи широко приме-ляется для решения многих задач химической кинетики установление механизмов химической реакции, определение стадий, лимитирующих протекание реакции обнаружение промежуточных комплексов, определение кинетики ферментативных реакций, установление числа и концентрации активных центров фермента, изучение быстрых конформационны5( переходов в белках и нуклеиновых кислотах. Метод требует быстрой регистрации это единственное существенное ограничение его применимости. Особое внимание при применении метода остановленной струи необходимо уделять тер-мостатированию, так как разница в температурах в кювете наблюдения и растворе смеси реагентов может привести к большим оптическим ошибкам, затрудняющим установление механизма наблюдаемой реакции. Точность определения констант скоростей данным методом примерно такая, как и при обычных спектрофотометрических измерениях кинетики химических реакций. [c.28]
Рассмотрим в первую очередь ошибки, вытекающие из самой сущности законов поглощения излучений, и основные закономерности, установленные еще в 1937 г. Туайменом и Лотианом [19]. Найденная ими зависимость ошибки измерения А от ее абсолютного значения является определяющей в оценке ошибок спектрофотометрических измерений. [c.30]
Иногда в случае неблагоприятных условий спектрофотометрические измерения подвержены более высоким ошибкам. Например, реакцию гафния (IV) с хлораниловой кислотой в 3 М хлорной кислоте изучали спектрофотометрически в области 260—360 нм. Было измерено светопоглощение двенадцати растворов при двадцати одной длине волны [6]. На рис. 2.4 показана зависимость определяемого числа частиц от заданной ошибки матричного элемента. Результаты, полученные при исследовании хлораниловой кислоты в 3 М хлорной кислоте, также показаны на рис. 2.4. [c.41]
Определение по собственному светопоглощению. Метод основан на спектрофотометрическом измерении светопоглощения водного, раствора хлора [164, 524] или его раствора в I4 [117, 946] в УФ-области спектра (330—350 нм). Нижний предел определяемой концентрации хлора 2-10 М (1 мкг мл). Относительная ошибка при определении 10 М хлора составляет 4%, для более низких концентраций (< 10 М) ошибка увеличивается до 30— 50% [117]. [c.68]
Для индикации и регистрации показаний анализаторов все шире применяют цифровые преобразователи и цифровые регистраторы, обладающие целым рядом преимуществ перед аналоговыми, к которым в первую очередь относятся почти полное устранение ошибки считывания показаний и возможность непосредственной обработки данных на вычислительной машине. В состав цифрового регистрирующего устройства входят аналого-цифровой преобразователь, индикатор и перфоратор с логической схемой управления. Голландской фирмой Витатрон для регистрации и обработки результатов спектрофотометрических измерений выпускаются цифровой преобразователь ОНР 100 и цифровой регистратор ОКР 200. [c.135]
Спектрофотометрические измерения. На рис. 1 показаны ультрафиолетовые спектры перксеноната при различных значениях pH. Поскольку ионную силу растворов не контролировали, о результатах спектрометрических измерений можно сделать только качественные заключения. Однако очевидно, что при pH ниже И в перксенонатном растворе появляются новые формы соединений ксенона. В пределах ошибки опыта имеются две изобестических точки, что указывает на то, что во всем интервале pH имеются только две основные поглощающие формы. [c.237]
Свегла, Палл и Ердеи показали , что для вычисления ошибок спектрофотометрических измерений недостаточно учитывать только ошибки показания прибора ошибки возникают также из-за неопределенности отрезков, отсекаемых на осях координат калибровочными графиками и из-за различных наклонов последних. [c.30]
Сопоставление активационных параметров кислотного гидролиза алкилсульфатов с длинной цепью и немицеллярного этилсуль-фата показывает, что ускорение реакции при образовании мицелл связано главным образом с уменьшением энтальпии активации, а не с увеличением энтропии [212]. Этот вывод был получен с использованием потенциометрических данных. Однако энергия активации кислотного гидролиза додецилсульфата натрия, полученная из спектрофотометрических измерений, оказалась одинаковой в мицеллярных и истинных растворах (табл. 8), тогда как энтропия активации была на 6,9 энтр. ед. больше в случае мицеллярного раствора [215]. Это противоречие, вероятно, объясняется неодинаковым выбором стандарта для сравнения (раствор этилсульфата и неми-целлярный раствор додецилсульфата). Возможно также, что расхождения связаны с отклонениями температурной зависимости от уравнения Аррениуса и зависящими от температуры ошибками потенциометрического метода. [c.282]
Такой спектральный анализ требует трудно достижимой точности спектрофотометрических измерений. Он осложнен взаимным наложением аналитических полос свободных молекул и Н-комплексов, температурной зависимостью коэффициентов поглощения этих полос, неудобством и неточностью термостатирования (из-за нагрева образца излучением) и другими факторами. Ошибки спектральных определений АН составляют от 0,2 ккал1моль для прецизионных измерений до 0,5—1 ккалЫоль для обычных, но эти величины скорее характеризуют лишь невоспроизводимость измерений, а действительные неточности больше Расхождения результатов разных авторов часто намного превышает предполагаемые ошибки, достигая целых единиц ккалЫоль, или приблизительно 100% от измеряемой величины Поэтому, несмотря на большое число опубликованных данных, надежные сходящиеся значения энтальпий водородных связей известны все еще для сравнительно немногих систем . [c.139]
В работе [1049] изучены условия, при которых возможно быстрое спектрофотометрическое определение ртути в неорганических соединениях. Показано, что закон Вера выполняется для концентраций (0,5—4)-10 М Hg(II). Относительное стандартное отклонение составляет 1,8%. Изучено влияние концентрации иодида калия на определение ртути и найдено, что для 2,2-10 М Hg(II) поглощение остается неизменным, если концентрация иодида калия изменяется от 1,2 до 0,8 М. Установлено, что при pH 4 окисление Т до Тз становится заметным, однако ошибка не превышает 1%. Измерение поглощения ртутного комплекса при pH 10 дает ошибку 1%. Низкие величины оптической плотности могут быть получены при высоких pH из-за образования частиц Hg(OH) . На определение ртути данным методом оказывают влияние анионы СгО , СгзО , поглощающие в области 323 млг. Влияние СН связано с образованием частиц типа Hg( N) J4 . Ионы Ag , Сг + не влияют, если их концентрация равна 2-10 М. Но медь, платина, золото окисляют Т до и поэтому должны быть восстановлены кислым раствором НааЗгОз до анализа. Влияют на определение ртути ионы Ре(П), РЬ(П), В1(1П), Т1(1), которые дают видимые осадки в 1 М КТ при концентрации их. <1.10 М. Этот метод может быть применен в присутствии галогенидов и псевдогалогенидов. [c.105]
Одна из групп исследователей [16] вычисляла константы устойчивости, используя уравнения материального баланса. Минимизировалась сумма квадратов отклонений аналитической концентрации иона водорода. В этом случае взвешивание особенно важно, поскольку ошибка измерения pH соответствует большим отклонениям при низких значениях pH, чем при высоких [13]. Обычно взвешивание более необходимо при потенциометрических вычислениях, чем в спектрофотометрических методах 1 жно оно и тогда, когда используются отклонения функции п. Оказалось, что вычисленные веса изменяются в слишком широких пределах [26, 68, 69]. Возможно, частичной причиной этого является то, что авторы аппроксимируют данные функцией, зависимые переменные которой сами являются функциями экспериментальных наблюдений. Так, очевидно, что полная аналитическая концентрация иона водорода является экспоненциальной функцией от pH. Таким образом, условия применимости метода наименьших квадратов (разд. 4.6) выполнены не полностью, поскольку неточные зависимые переменные сопоставляются с функциями от точных значений независимых переменных. Особенно следует избегать использования отклонений функции образования п. Правильным будет применять для расчета всех потенциометрических данных функцию суммы квадратов разностей между вычисленными и наблюдаемыми э. д. с. Дополнительное преимущество такого подхода — возможность использовать единичные веса до тех пор, пока нет веских оснований полагать противное. Примером использования единичных весов служит минимизация суммы квадратов разностей меладу вычисленным и наблюдаемым объемом титрантов в процессе кислотно-основного титрования [29]. Другие исследователи также для простоты вводили допущение о единичности весовой матрицы [11, 15, 31, 51], и было сообщение, что и с весовыми коэффициентами и без них получались одни и те же значения рассчитанных констант устойчивости. [c.95]
Ошибки спектрофотометрических измерений определяются флуктуациями показаний на выходном приборе. Их величина зависит, в свою очередь, от стабильности источника света, флуктуаций светового пучка на пути от источника света к приемнику, шумов приемно-усилительной аппаратуры и регистрирующего прибора. Рассмотрим влияние этих источников ошибок на результаты измерений, учитывая, что при абсорбционных измерениях, в конечном итоге, существенна точность определения оптической плотности О, а не интенсивностей поглощенного и непоглощенного сигналов. Напомним, что [c.137]
Пусть чувствительность определения примесей в пробе объемом 25 мл при помощи кюветы толщиной 5 см равна 0,005 у/см . Тогда минимальное обнаруживаемое количество вещества равно 0,005 X (25/5) == 0,025 мкг, или 2,5 10 %, для пробы весом 1 г. Эта величина примерно соответствует ошибке спектрофотометрических измерений малых поглощений. [c.133]
Рассмотренные ошибки спектрофотометрического метода в основном относятся к работе прибора. Естественно, что не меньшее значение могут иметь ошибки, связанные с работой самого исследователя (точность приготовления исходных растворов, способ заполнения кювет), и с условиями протекания конкретной химиче- ской реакции (разложение реагентов, межмолекулярные взаимодействия и т. п.). Все это должно учитываться при проведении фотометрических измерений. [c.22]
Изучение факторов, влияющих на точность спектрофотометрических измерений [19] — [27], показывает, что причины ошибок в спектрофотометрии могут быть весьма разнообразны и многочисленны. Ошибки возникают, например, за счет действий оператора, условий проведения реакций, недостаточной чистоты кювет, непостоянства их установки в кюветные отделения, невоспроизводимости настройки шкалы прибора на О и 100% пропускания, непостоянства излучения источника освещения, нестабильности работы фотоэлектрической системы [24] — [27]. [c.30]
При определении Do (ВаО) на основании данных по реакций образования ВаО получаемые значения существенно зависят от принятого в расчете типа основного состояния этой молекулы. Значение, приведенное по данным работ [72, 74, 75, 396], получено для основного состояния Х 2 оно подтверждено результатами измерений методом электронного удара [73]. Расчет по результатам измерения давления пара ВаО менее надежен из-за неточности данных по АЯ (ВаО, тв.) и АЯд (Ва, тв.). В обзоре [76] принимается основное состояние и рекомендуется Do = 131 6. См. также [4, стр. 236]. Спектрофотометрические измерения [118, 119], приведшие к значению —120, содержали ошибки, см. [396]. [c.49]
На абсолютную и относительную точность (воспроизводимость) спектрофотометрических измерений влияет ряд разнообразных и часто трудно поддающихся учету факторов [23, 40]. Для количественного анализа и различных сравнительных исследований наиболее важной является воспроизводимость измерений и несущественны некоторые ошибки систематического характера, так что при разработке многих методик исследования, а также аппаратуры, исключению последних уделяется мало внимания. В связи с этим существует такое положение, что при высокой в большинстве случаев относительной точности современных спектрофотометрических измерений данные, полученные на различных приборах или в различных условиях эксперимента, часто значительно различаются. В большей части опубликованных исследований ультрафиолетовых спектров поглощения авторами не оценивается абсолютная точность измерений, а также не приводятся данные, относящиеся к аппаратуре и методике эксперимента, позволяющие провести хотя бы грубую оценку подобного рода. [c.383]
Расчет общей (максимальной) ошибки и отдельных составляющих ошибок дифференциальных спектрофотометрических измерений кобальта (14—26 г/л) в виде перхлората, измеренных по отношению к оптимальному раствору сравнения, содержащему 12 г/л Со +, приведены в табл. 7, [c.54]
Из уравнения (28) можно также сделать следующие общие заключения по точности дифференциальных спектрофотометрических измерений. Ошибка будет меньше, если [c.44]
Погрешность в определении истинной константы диссоциации слагается в основном из трех величин погрешности, вносимой спектрофотометрическими измерениями, погрешности потенциометрических измерений (если они производились) и ошибки, которая вносится принятой методикой нахождения истинной константы диссоциации по найденному значению кажущейся или концентрационной константы диссоциации. [c.93]
Ошибки при спектрофотометрических измерениях [c.137]
Первоначально рассмотрим точность анализов. Ошибка воспроизводимости, которой характеризуется точность определений атомно-абсорбционного анализа, складывается за счет двух основных операций получения поглощающего слоя и измерения поглощения спектрофотометром. Источники возникновения и величина ошибок при спектрофотометрических измерениях обсуждались ранее ( 19), причем было показано, что эти ошибки могут быть в принципе уменьшены до дробовых шумов приемника, имеющих статистическое происхождение. Случайные ошибки, связанные с получением поглощающего слоя, обусловлены следующими звеньями анализа неоднородностью образцов, дозированием проб на электрод, случайными обстоятельствами, определяющими скорость испарения элемента в кювету, колебаниями температуры кюветы и давления постороннего газа. [c.329]
Непосредственная погрешность спектрофотометрического измерения, включающая ошибки настройки прибора на О и 100% пропускания [76, 83, 88—91], погрешность отсчета по измерительному потенциометру и ошибки, связанные с нестабильностью электронной схемы [82, 92] в процессе измерения. [c.17]
Выбор условий регистрации спектров оказывает существенное влияние на результаты спектрофотометрических измерений. При выборе оптимальных условий удается свести к минимуму как систематические, так и случайные ошибки, возникающие [c.19]
Зависимость ошибки определения концентрации от величины пропускаемости света измеряемым раствором. Одна из существенных ошибок спектрофотометрических измерений возникает при отсчетах величины пропускания на крайних участках соответствующей шкалы прибора. Вследствие логарифмической формы закона поглощения наибольшая точность может быть получена при измерениях в области средних значений величины пропускания. Если предельное значение неопределенности при отсчете О величины отклонения гальванометра обозначить через (10 и предположить, что источник излучения является стабильным и что соотношение между интенсивностью падающего светового пучка и отклонением гальванометра является линейным, то [c.85]
Одновременное присутствие в растворе последовательно образующихся комплексов может привести к серьезным ошибкам при сочетании спектрофотометрических измерений с экстракцией растворителем. Только один из последовательных комплексов — электронейтральный — может экстрагироваться органическим растворителем. Различные последовательно образующиеся комплексы, которые содержат большее или меньшее количество лигандов, чем необходимо для нейтрализации положительного заряда центрального иона металла, и сами несут положительный или отрицательный заряд, останутся в водной фазе. Возможность ошибки будет наименьшей в случае комплексов, в которых для нейтрализации электрического заряда центрального иона металла и насыщения его координационной сферы требуется такое же число лигандов, как и для координации. [c.88]
Дифференциальный спектрофотометрический метод может быть применен и в тех случаях, когда имеется наложение в спектрах поглощения соединения и реагента. Тогда при измерении по отношению к одному из использованных как эталон растворов в значительной степени исключается ошибка за счет поглощения реагента. [c.480]
XI1-3-1. При каком значении Т (парциальное поглощение) в спектрофотометрических анализах будет минимальной относительная ошибка в определении концентрации (Дс/с) для данной ошибки измерения Г [c.143]
Дифференциальный метод анализа используют для повышения точности спектрофотометрических и фотоколориметрических измерений при определении высоких концентраций веществ (от 10 до 100%). Сущность метода заключается в измерении светопоглощения анализируемого раствора относительно раствора сравнения, содержащего определенное количество испытуемого вещества это приводит к изменению рабочей области шкалы прибора и снижению относительной ошибки анализа до 0,5—1%. [c.40]
Кроме того, в настоящее время разработаны спектрофотометрические методы определения большого содержания отдельных компонентов. Эти методы называют дифференциальной фотометрией. Для точного измерения в параллельном световом потоке устанавливают стандартный раствор, близкий по составу к испытуемому раствору. Таким образом, измеряется разница интенсивности двух световых потоков ошибка измерений меньше сказывается на конечном результате. Главные трудности и недостатки, по сравнению с эмиссионным спектральным анализом, связаны с затратой времени на подготовку вещества к анализу, отделение мешающих компонентов, и др. Результат зависит от выбора условий, реактивов и концентрации посторонних ионов. Групповые методы почти не разработаны, поэтому для каждого элемента необходим отдельный ход анализа. [c.9]
Другим методом определения констант является измерение возрастания растворимости в воде исследуемого вещества при различных значениях pH раствора (глава 6), Этот метод не так точен, как потенциометрический, спектрофотометрический и кондуктометрический, но бывает полезен в тех случаях (к счастью, редких), когда вещество слишком мало растворимо в воде для того, чтобы использовать потенциометрический или кондуктометрический метод, и спектр его непригоден для определения. Катализ гидролиза эфиров, дисахаридов и глюкозидов как метод измерения констант ионизации представляет лишь исторический интерес. В ряде случаев этот метод приводил к очень грубым ошибкам. [c.18]
Обычно спектрофотометрические измерения проводят в таких условиях, когда оптическая плотность исследуемого раствора лежит в 1феде-лах А = 0,2—0,8, так как именно при таких значениях оптической плотности достигается минимальная ошибка спектрофотометрических измерений. [c.528]
Общепринято, что такое ограничение не распространяется па спектрофотометрические данные, и отклонения обычно определяют как разность между необходимым и рассчитанным све-топоглощением [4, И, 12, 53, 72—74]. Обычно при определенных условиях нет необходимости использовать веса, так как в этом случае ошибки спектрофотометрического измерения преобладают над ошибками измерения концентрации [11, 12, 75]. Кроме того, показания современных спектрофотометров имеют постоянную дисперсию в некотором диапазоне значений светопоглощения (см. разд. 8.3, п. 6). Однако если измерять светопоглощение одного и того же раствора при нескольких длинах волн, то будет наблюдаться корреляция ошибок. Для математической корректности следовало бы учесть такую корреляцию, введя весовую матрицу, содержащую ковариации переменных. Тем не менее корреляцией можно пренебречь, так как спектрофотометрические ошибки начинают проявляться, когда ошибки в концентрациях составляют несколько десятых долей процента, а ошибки в измерении светопоглощения— несколько тысячных [12]. Показано [12], что даже в случае преобладания концентрационных ошибок пренебрежение корреляцией незначительно влияет на результат. [c.96]
В настоящее время метод остановленной струи широко приме-ляется для решения многих задач химической кинетики установление механизмов химической реакции, определение стадий, лимитирующих протекание реакции обнаружение промежуточных комплексов, определение кинетики ферментативных реакций, установление числа и концентрации активных центров фермента, изучение быстрых конформационны5( переходов в белках и нуклеиновых кислотах. Метод требует быстрой регистрации это единственное существенное ограничение его применимости. Особое внимание при применении метода остановленной струи необходимо уделять тер-мостатированию, так как разница в температурах в кювете наблюдения и растворе смеси реагентов может привести к большим оптическим ошибкам, затрудняющим установление механизма наблюдаемой реакции. Точность определения констант скоростей данным методом примерно такая, как и при обычных спектрофотометрических измерениях кинетики химических реакций. [c.28]
Рассмотрим в первую очередь ошибки, вытекающие из самой сущности законов поглощения излучений, и основные закономерности, установленные еще в 1937 г. Туайменом и Лотианом [19]. Найденная ими зависимость ошибки измерения А от ее абсолютного значения является определяющей в оценке ошибок спектрофотометрических измерений. [c.30]
Иногда в случае неблагоприятных условий спектрофотометрические измерения подвержены более высоким ошибкам. Например, реакцию гафния (IV) с хлораниловой кислотой в 3 М хлорной кислоте изучали спектрофотометрически в области 260—360 нм. Было измерено светопоглощение двенадцати растворов при двадцати одной длине волны [6]. На рис. 2.4 показана зависимость определяемого числа частиц от заданной ошибки матричного элемента. Результаты, полученные при исследовании хлораниловой кислоты в 3 М хлорной кислоте, также показаны на рис. 2.4. [c.41]
Определение по собственному светопоглощению. Метод основан на спектрофотометрическом измерении светопоглощения водного, раствора хлора [164, 524] или его раствора в I4 [117, 946] в УФ-области спектра (330—350 нм). Нижний предел определяемой концентрации хлора 2-10 М (1 мкг мл). Относительная ошибка при определении 10 М хлора составляет 4%, для более низких концентраций (< 10 М) ошибка увеличивается до 30— 50% [117]. [c.68]
Для индикации и регистрации показаний анализаторов все шире применяют цифровые преобразователи и цифровые регистраторы, обладающие целым рядом преимуществ перед аналоговыми, к которым в первую очередь относятся почти полное устранение ошибки считывания показаний и возможность непосредственной обработки данных на вычислительной машине. В состав цифрового регистрирующего устройства входят аналого-цифровой преобразователь, индикатор и перфоратор с логической схемой управления. Голландской фирмой Витатрон для регистрации и обработки результатов спектрофотометрических измерений выпускаются цифровой преобразователь ОНР 100 и цифровой регистратор ОКР 200. [c.135]
Спектрофотометрические измерения. На рис. 1 показаны ультрафиолетовые спектры перксеноната при различных значениях pH. Поскольку ионную силу растворов не контролировали, о результатах спектрометрических измерений можно сделать только качественные заключения. Однако очевидно, что при pH ниже И в перксенонатном растворе появляются новые формы соединений ксенона. В пределах ошибки опыта имеются две изобестических точки, что указывает на то, что во всем интервале pH имеются только две основные поглощающие формы. [c.237]
Свегла, Палл и Ердеи показали , что для вычисления ошибок спектрофотометрических измерений недостаточно учитывать только ошибки показания прибора ошибки возникают также из-за неопределенности отрезков, отсекаемых на осях координат калибровочными графиками и из-за различных наклонов последних. [c.30]
Сопоставление активационных параметров кислотного гидролиза алкилсульфатов с длинной цепью и немицеллярного этилсуль-фата показывает, что ускорение реакции при образовании мицелл связано главным образом с уменьшением энтальпии активации, а не с увеличением энтропии [212]. Этот вывод был получен с использованием потенциометрических данных. Однако энергия активации кислотного гидролиза додецилсульфата натрия, полученная из спектрофотометрических измерений, оказалась одинаковой в мицеллярных и истинных растворах (табл. 8), тогда как энтропия активации была на 6,9 энтр. ед. больше в случае мицеллярного раствора [215]. Это противоречие, вероятно, объясняется неодинаковым выбором стандарта для сравнения (раствор этилсульфата и неми-целлярный раствор додецилсульфата). Возможно также, что расхождения связаны с отклонениями температурной зависимости от уравнения Аррениуса и зависящими от температуры ошибками потенциометрического метода. [c.282]
Такой спектральный анализ требует трудно достижимой точности спектрофотометрических измерений. Он осложнен взаимным наложением аналитических полос свободных молекул и Н-комплексов, температурной зависимостью коэффициентов поглощения этих полос, неудобством и неточностью термостатирования (из-за нагрева образца излучением) и другими факторами. Ошибки спектральных определений АН составляют от 0,2 ккал1моль для прецизионных измерений до 0,5—1 ккалЫоль для обычных, но эти величины скорее характеризуют лишь невоспроизводимость измерений, а действительные неточности больше Расхождения результатов разных авторов часто намного превышает предполагаемые ошибки, достигая целых единиц ккалЫоль, или приблизительно 100% от измеряемой величины Поэтому, несмотря на большое число опубликованных данных, надежные сходящиеся значения энтальпий водородных связей известны все еще для сравнительно немногих систем . [c.139]
В работе [1049] изучены условия, при которых возможно быстрое спектрофотометрическое определение ртути в неорганических соединениях. Показано, что закон Вера выполняется для концентраций (0,5—4)-10 М Hg(II). Относительное стандартное отклонение составляет 1,8%. Изучено влияние концентрации иодида калия на определение ртути и найдено, что для 2,2-10 М Hg(II) поглощение остается неизменным, если концентрация иодида калия изменяется от 1,2 до 0,8 М. Установлено, что при pH 4 окисление Т до Тз становится заметным, однако ошибка не превышает 1%. Измерение поглощения ртутного комплекса при pH 10 дает ошибку 1%. Низкие величины оптической плотности могут быть получены при высоких pH из-за образования частиц Hg(OH) . На определение ртути данным методом оказывают влияние анионы СгО , СгзО , поглощающие в области 323 млг. Влияние СН связано с образованием частиц типа Hg( N) J4 . Ионы Ag , Сг + не влияют, если их концентрация равна 2-10 М. Но медь, платина, золото окисляют Т до и поэтому должны быть восстановлены кислым раствором НааЗгОз до анализа. Влияют на определение ртути ионы Ре(П), РЬ(П), В1(1П), Т1(1), которые дают видимые осадки в 1 М КТ при концентрации их. <1.10 М. Этот метод может быть применен в присутствии галогенидов и псевдогалогенидов. [c.105]
Одна из групп исследователей [16] вычисляла константы устойчивости, используя уравнения материального баланса. Минимизировалась сумма квадратов отклонений аналитической концентрации иона водорода. В этом случае взвешивание особенно важно, поскольку ошибка измерения pH соответствует большим отклонениям при низких значениях pH, чем при высоких [13]. Обычно взвешивание более необходимо при потенциометрических вычислениях, чем в спектрофотометрических методах 1 жно оно и тогда, когда используются отклонения функции п. Оказалось, что вычисленные веса изменяются в слишком широких пределах [26, 68, 69]. Возможно, частичной причиной этого является то, что авторы аппроксимируют данные функцией, зависимые переменные которой сами являются функциями экспериментальных наблюдений. Так, очевидно, что полная аналитическая концентрация иона водорода является экспоненциальной функцией от pH. Таким образом, условия применимости метода наименьших квадратов (разд. 4.6) выполнены не полностью, поскольку неточные зависимые переменные сопоставляются с функциями от точных значений независимых переменных. Особенно следует избегать использования отклонений функции образования п. Правильным будет применять для расчета всех потенциометрических данных функцию суммы квадратов разностей между вычисленными и наблюдаемыми э. д. с. Дополнительное преимущество такого подхода — возможность использовать единичные веса до тех пор, пока нет веских оснований полагать противное. Примером использования единичных весов служит минимизация суммы квадратов разностей меладу вычисленным и наблюдаемым объемом титрантов в процессе кислотно-основного титрования [29]. Другие исследователи также для простоты вводили допущение о единичности весовой матрицы [11, 15, 31, 51], и было сообщение, что и с весовыми коэффициентами и без них получались одни и те же значения рассчитанных констант устойчивости. [c.95]
Содержание статьи
- Описание метода
- Математическое описание
- Закон БЛБ
- Ограничения
- Преимущества
- Техническая часть
- Производная
На способности поглощения молекулами и атомами излучения, имеющего электромагнитную природу, базируется спектрофотометрический метод.
Спектрофотометрический метод анализа

Делят спектрофотометрию: на молекулярную, когда искомое вещество молекулярная структура, и атомную. В зависимости от длин волн, которые способен различить прибор, и веществ, которые надо будет определять, выбираются спектрофотометры.
Для внесения поправок на законы преломления и рассеяния в некоторых устройствах, проводят измерение взвеси (раствор с исследуемым веществом) и раствора. Когда луч света проходит через взвесь, то в зависимости от поглощающих свойств вещества, происходит его ослабление. Интенсивность ослабления луча имеет зависимость от содержания вещества во взвеси. Более точная зависимость определяется у Бугера-Ламберта-Бера (БЛБ), закон «вещество его толщина – от ослабления линии энергии».
Спектрофотометрическое определение фигурирует во многих областях для разных задач:
- подтверждает подлинность заявленного элемента/продукта,
- определяет доброкачественность изготовленного препарата,
- с его помощью находят радиоактивные элементы в водоемах,
- количественно оценивает, сколько разных веществ находится во взвеси,
- различать химические элементы во взвеси.
Применяется в биологических и геологических лабораториях, в целях радиационной безопасности (на АЭС, институтах и т.д.), промышленностях, где требуется знать химический состав продуктов и материалов.
Математическое описание спектрофотометрического метода
Введем понятие коэффициента пропускания Т.
I – интенсивность световой энергии, прошедшей через взвесь,
I0 – через раствор.
Для определения концентрации искомых веществ, спектрофотометры используют оптическую плотность, которая находится как D=-lоg10(T).
Количественно отыскивается концентрация посредством закона БЛБ:
I=I0*10-εlc
С помощью элементарных преобразований легко можно получить, что lоg10(T)=ε*l*c или D= ε*l*c.
Обозначения переменных представлены ниже в ограничениях данного закона.
Если в раствор вводят несколько исследуемых элементов, то метод применим и в этом случае. Каждый элемент будет давать свой вклад в общую оптическую плотность по закону сложения:
D=D1+D2+…+Dk.
Закон Бугера Ламберта Бера определяет, что оптическая плотность, линейно связана с концентрацией, а ее график выходит из начала координат. В реальности линейность не всегда наблюдается.
Закон Бугера Ламберта Бера
Чтобы закон полностью выполнялся, должны соблюдаться следующие условия:
- Излучение должно быть монохроматическим, т.е. длина волны должна быть одинаковой, ей будут просвечивать раствор и взвесь.
- Молярный коэффициент поглощения (ε) зависит от преломляющих свойств сред – как взвеси, так и раствора. Если преломление во взвеси сильнее, то линейный закон не применим. Чем больше коэффициент ε, тем более чувствительным будет метод в данном определении.
- Во время измерений должна быть постоянная температура окружающей среды. Допустимо изменение только в пределах пары градусов.
- Применяться должен только параллельный пучок света.
- В процессе измерения спектрофотометром концентрация (с) анализируемого вещества не должна меняться вследствие изменения природы исследуемого вещества. Например, во взвеси не должны молекулы переходить в ионы, в результате диссоциации или кислотно-основной реакции.
- Стараться избегать возбуждения электронов в атоме (иногда такой способ тоже применяют для анализа, но в классическом применении его избегают), то есть не облучать атомы энергией свыше шестидесяти килоджоулей.
- Свет должен проходить одинаковый путь (l) при измерении раствора и взвеси.
- В качестве раствора часто применяют дистиллированную воду.
Ограничения спектрофотометрического метода
Интенсивнее поглощаются те энергии (длина волны), которые соответствуют энергетическим уровням возбуждения внутренних переходов атомов и молекул: тогда молярный коэффициент поглощения максимален.
- Метод плохо работает для смеси газов.
- Ограничения закона БЛБ.
Преимущества спектрофотометрического метода
- Хорошо подходит для определения состава инертных газов.
- Работает с низкими концентрациями – различает элементы, если их немного во взвеси.
- Можно добиться расширенной неопределенности на уровне 0,5-1,%.
- Применим как для высокого, так и для низкого содержания вещества в растворе.
- Применим для примесей, ввиду закона сложения.
- Быстрота определения (если не считать подготовку растворов).
- Простота.
Техническая часть спектрофотометрического метода
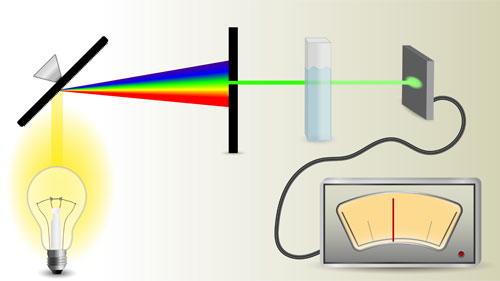
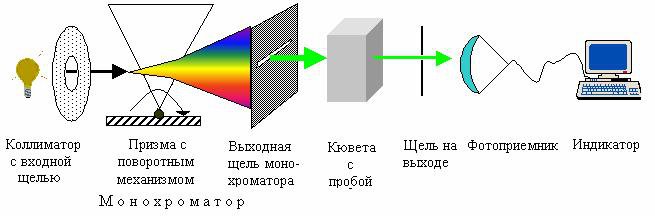
Основные части спектрофотометра:
- источник излучения,
- монохроматор (если источник света не может дать монохроматический луч),
- кювета, в которую размещаются растворы и взвеси,
- измерительный прибор.
Основные части расширяются: 1 призмами, зеркалами и линзами, чтобы добиваться параллельности света, 2 клиньями и диафрагмами, которые выравнивают интенсивность световых лучей.
Получить монохроматический свет можно следующими источниками света:
- непрямым солнечным светом,
- галогенными лампами,
- лазером,
- штифтом Нернста,
- лампой накаливания,
- глобар штифт,
- флуоресцентным излучением.
Спектрофотометрическое измерение, как описано выше, требует подбора нужной оптической линии. Для изготовления штифта Нернста (шН) применяют оксиды редкоземельных Me, которые плотно спрессовывают между собой в столбец. Глобар (Г) получают спрессовыванием в столб, карбида кремния. Когда через них пропускают ток, то они выдают световое излучения с соответствующими длинами волн: шН – от 1,6 до 2,0 мкм или от 5,6 до 6,0 мкм; Г – от 2 до 16 мкм.
Монохромизаторы – это те устройства, которые создают стабильную волну. В качестве начинки монохромизаторов используют светофильтры и призмы.
Разделяют светофильтры на:
- Абсорбционные
- Интерференционные
- Интерференционно-поляризационные
Для изготовления светофильтров и кюветов чаще всего используют кварц и стекло.
В качестве приемников интенсивности световых лучей или рецепторов используют фото-умножители и фотоэлементы. Характеризуют рецепторы по двум свойствам: спектральная и интегральная чувствительность. Первая характеристика – умение различать разные оптические линии, интегральная чувствительность – умение реагировать на сплошной поток света.
Для измерений в области ИК, излучения используют термоэлементы, которые делают из термо-ЭДС или термопары, и болометр. Последний изменяет сопротивление материала при воздействии на него температурой: термоэлемент встроен в мостовую схему, инфракрасное излучение вызывает нагревание этого элемента и разбаланс моста.
Спектрофотометрический анализ включает в себя построение градуировочной характеристики по известным образцам, чтобы вывести зависимость C=f(D), соотнесение полученных результатов в последующем. Когда градуировочная характеристика определена, то порядок измерения такой: 1 раствор (является основой при измерениях) — его измерение, 2 добавление в раствор исследуемого вещества,3 добавление красителя. В этом случае, степень окраски взвеси должна прямо зависеть, от концентрации исследуемого вещества, 4 измерение в спектрофотометре окрашенного раствора. Иногда в спектрофотометр вбиты соответствующие базы, и тогда метод не требует градуировочных образцов.
Производная спектрофотометрия
При этой разновидности метода, используют две разные линии света, для измерения взвеси. Лучи близко расположены друг к другу по спектру, формируются светофильтрами, которые встроены в прибор. Данное устройство может определить концентрацию разных веществ в одном растворе. По сравнению со спектрофотометрами цена на фотоколориметры не высока (спектрофотометр СФ-2000-02 стоит 192 000 руб., а фотоколориметр КФК-5М 55 000 руб.), а точность достаточна, для проведения большинства анализов.
Современные спектрофотометры позволяют менять величину кювета, что увеличивает возможности анализа, некоторые производят анализ всего за несколько секунд.
Таблица. УФ-видимая производная спектрометрия ионов металлов.
| Вещества (катионы) | Автор | Год | d n | Примечания |
|---|---|---|---|---|
| Be, Mg | Salinas | 1987 | 1 | Органический комплекс |
| Be | Zhu | 1989 | 3 | В бериле |
| Bi | Morelli | 1982 | 1, 2 | Комплекс с тиобарбитуровой кислотой; Cu наличие |
| Bi, Pb | Li | 1986 | 4 | Следы в Sn |
| Ca | Chen | 1986 | 4 | Органический комплекс |
| Ca | Jimenez | 1990 | — | В крови и моче |
| Ge | Wang | 1987 | — | Следы в минералах |
| Mg | Salinas | 1986 | 1 | Органический комплекс |
| Pb (Zn, Cd) | Li | 1989 | 3 | В поверхностно-активных веществах |
| S | Niu | 1985 | < | Косвенное определение в кластерных соединениях |
| Au, Pd, Pt | Kuroda | 1990 | 1 | Хлорокомплексы |
| Cd, Zn | Talsky | 1981 | 5 | Смеси |
| Cd, Zn, (Pb) | Li | 1989 | 3 | В поверхностно-активных веществах |
| Co | Singh | 1984 | 2 | В осажденных концентрациях |
| Co | Spitsin | 1985 | — | В сплавах |
| Co, Cu | Bermejo-Barrera | 1985 | < td=»»> | Комплекс ЭДТА |
| Co | Odashima | 1986 | < td=»»> | Органический комплекс; следы |
| Co | Jyothi | 1987 | > 2 | Комплексы с красителями |
| Co, Fe | Jiang | 1988 | < td=»»> | В Ni |
| Co, Ni | Murillo | 1988 | 1 | Совместное определение |
| Co, V | Jimenez | 1989 | 2 | В сталях |
| Cr(III) | Shijo | 1986 | 2 | Органический комплекс |
| Cr, Mn | Zhen | 1986 | — | В Cr сталях |
| Cr, Mn | Iyer | 1986 | — | Совместное определение; в сталях |
| Cu | Ishii | 1980 | 2, 4 | Органический комплекс |
| Cu, Fе(III) | Morelli | 1983 | 1, 2 | Органический комплекс |
| Cu, Co | Bermejo-Bantra | 1985 | — | Комплекс ЭДТА |
| Cu, Zn | Li | 1987 | — | Органический комплекс |
| Cu, Zn | Wei | 1989 | 4 | Органический комплекс в воде; редко-земельные элементы |
| Fe(II), Fe(III) | Talsky | 1982 | 4 | Прямое определение |
| Fe(III), Co, Ni | Talsky | 1982 | 4 | Прямое и совместное определение |
| Fe | Singh | 1983 | 2 | Hg концентраты |
| Fe(III), Cu | Morelli | 1983 | 1, 2 | Органический комплекс |
| Fe(III) | Bermejo-Barrera | 1984 | — | Комплекс ЭДТА |
| Fe(II), Fe(III) | Haubensak | 1985 | 4 | Прямое определение |
| Fe(III), Co, Ni | Haubensak | 1985 | 4 | Прямое совместное определение |
| Fe(III) | Bermejo-Barrera | 1986 | — | Комплекс ЭДТА |
| Fe | Odashima | 1986 | — | Органический комплекс; следы |
| Fe | Ishii | 1986 | 2 | Органический комплекс |
| Fe(III), Bi | Bermejo-Barrera | 1987 | < td=»»> | Комплекс ЭДТА |
| Fe, Nd, Pr | Ren | 1987 | 3 | В Nd-Fe-сплавах |
| Fe,Co | Jiang | 1988 | < td=»»> | В Ni |
| Fe(III) | Mori | 1989 | 3 | Органический комплекс |
| Hg(II) | Griffiths | 1979 | 2, 4 | < td=»»> |
| Hg | Medilina | 1986 | — | Органический комплекс |
| Hg | Sharma | 1989 | — | В пестицидах |
| In | Shanna | 1986 | >2 | Органический комплекс |
| Mn, Cr | Zhen | 1986 | — | В Cr- сталях |
| Mn, Cr | Jyes | 1986 | — | Совместное определение в сталях |
| Mn | Lin | 1987 | — | Следы |
| Mn | Kus | 1989 | 4 | В Ni |
| Mo | Qu | 1985 | 1 | Органический комплекс в рудах и минералах |
| Mo | Hernandez-Mendez | 1987 | 3 | Комплексы красителей |
| Mo, Ti, V | Suzuki | 1987 | 1 | Пероксо комплексы в смесях |
| Nb | Wang | 1988 | < td=»»> | В минералах |
| Ni | Ishii | 1982 | 2 | Концентрация в нг× мл–1 |
| Ni, Co, Fe(III) | Talsky | 1982 | 4 | Прямое совместное определение |
| Ni, Co, Fe(III) | Haubensak | 1985 | 4 | Прямое совместное определение |
| Ni | Malinowska | 1986 | — | Органический коплекс |
| Ni | Wang | 1986 | — | В Co-минералах |
| Ni, Co | Murillo | 1988 | 1 | Совместное определение |
| Os(VIII), Pd(II) | Morelli | 1985 | 2 | Смеси |
| Pd(II), Ru(III) | Morelli | 1983 | 2 | В смесях |
| Pd, Pt | Qu | 1984 | 1 | Совместное определение в рудах |
| Pd(II), Os(VIII) | Morelli | 1985 | 2 | Смеси |
| Pd, Pt | Kus | 1987 | 5 | Дитизонаты |
| Pd, Pt | Mai | 1987 | — | Cовместное определение |
| Pd, Pt, Au | Kuroda | 1990 | 1 | Хлорокомплексы |
| Rh(III) | Shijo | 1988 | 2 | Органический комплекс |
| Ru(III), Pd(II) | Morelli | 1983 | 2 | Смеси |
| Ru(III) | Shijo | 1987 | 2 | Органический комплекс |
| Sc | Li | 1986 | — | Сложные красители |
| Sc | Li | 1988 | 3 | В сплавах |
| Ta | Kvaratskheli | 1990 | 1 | В присутствии Nb |
| Ti, V, Mo | Suzuki | 1987 | 1 | Пероксокомплексы смеси |
| V, Co | Jimenez | 1989 | 2 | В сталях |
| Zn, Cd | Talsky | 1981 | 5 | Дитизонаты; смеси |
| Zn, Cd | Talsky | 1982 | 5 | Дитизонаты; в смесях |
| Zn, Cu | Li | 1987 | — | Органический комплекс |
| Zn, Cd, Pb | Li | 1989 | 3 | В поверхностно-активных веществах |
| Zn, Cu | Wei | 1989 | 4 | Органический комплекс |
| Zr | Wang | 1986 | 1 | В Ag-Pd сплавах |
| Ионы металлов | Edwards | 1985 | — | В гумусовых веществах |
| Редкоземельные элементы | Shibata | 1973 | 1 | < td=»»> |
| Редкоземельные элементы | Zhang | 1986 | > 2 | Органический комплекс |
| Ce, Er | Poro | 1972 | 1 | Органический комплекс |
| Ce,Tb | Mishchenko | 1987 | — | < td=»»> |
| Eu, Sm | Kucher | 1983 | — | В смесях |
| Eu, La | Rao | 1986 | >2 | Совместное определение |
| Gd | Lepine | 1986 | 2 | В нитратах |
| Gd | Alexandrova | 1988 | — | < td=»»> |
| Gd | Yan | 1989 | 4 | В солях редкоземельных элементов |
| Ho | Cottrell | 1980 | 2 | < td=»»> |
| La, Eu | Rao | 1986 | > 2 | Совместное определение |
| Nd | Hernandez-Mendez | 1987 | > 2 | Органический комплекс |
| Nd, Tm | Garcia Sanchez | 1987 | — | Смеси |
| Nd | Hernandez-Mendez | 1988 | > 2 | В стеклах |
| Ho, Nd, Sm, Er, | Li | 1989 | 3 | < td=»»> |
| Eu, Pr, Nd, Sm, Eu, | Alexandrova | 1982 | — | EDTA-комплекс |
| Dy, Ho, Er, Тm | Ren | 1985 | >2 | Смеси редко земельных элементов |
| Pr, Nd, Dy, Тm Pr, Nd, Sm, Eu, | Alexandrova | 1987 | — | В смесях |
| Ho, Er | Bai | 1987 | — | EDTA-комплекс |
| Pr, Nd, Eu, Ho, Er, Tm | Chen | 1987 | 2 | Органические комплексы |
| Pr | Sukumar | 1988 | 3 | Следы в Al |
| Sm | Bhagarathy | 1988 | 3 | Сложные красители |
| Tm, Nd | Garcia Sanchez | 1987 | — | Смеси |
| U(IV) | Perfil’ev | 1984 | — | Органический комплекс |
| (UO2)2+ | Perfil’ev | 1986 | — | Органический комплекс |
| (UO2)2+ | Skujins | 1986 | 2 | < td=»»> |
| U | Kvaratskheli | 1988 | 1 | Th присутствует |
| Th, U | Kuroda | 1990 | 2 | Мышьяк азокомплекс |
Авторы:
сотрудники компанииКак уже отмечалось, в зависимости от условий задачи одни и те же ошибки могут рассматриваться и как случайные и как систематические. Классификация ошибок спектрального анализа, приведенная ниже, составлена применительно к наиболее часто встречающимся условиям его осуществления.
Случайные ошибки.
Источники случайных ошибок спектрального анализа многообразны. К их числу должны быть отнесены следующие:
- Один из видов неоднородности химического состава материала эталонов проб: различие состава отдельных порций вещества в объемах, расходуемых для получения спектров (ошибки, обусловленные отклонением среднего состава отобранной пробы от среднего состава анализируемого материала, строго говоря, являются не ошибками анализа, ошибками при пробоотборе). В металлических сплавах такая неоднородность чаще всего возникает вследствие межкристаллитной или внутрикристаллитной ликвации.
- Неоднородность материала эталонов проб, заключающаяся в различных физических или физико-химических свойств вещества в указанных элементарных объемах. Такие различия иногда приводят к изменению условий питания излучающего облака разряда или условий возбуждения. Этот вид неоднородности связан с нарушением сплошности вещества металлических образцов (например, с осевой рыхлостью, пористостью литых проб), с местными изменениями их структуры (например, с неравномерным отбелом образцов чугуна, с различной глубиной закаленного или обезуглероженного слоя образцов стали, колебаниями величины зерна при нестандартной проковке проб и т.п.), а также с изменениями общего состава проб (влияния третьих элементов).
- Изменения интенсивности спектральных линий вследствие неучитываемых колебаний при поступлении определяемого элемента из других источников, помимо образца (возможный неконтролируемый перенос элемента при подготовке поверхности образца, колебания загрязненности реактивов, особенно существенные при определении малых содержаний элементов, неконтролируемый перенос элементов с неочищенного подставного электрода).
- Нестабильность условий возбуждения спектров. Этот источник ошибок связан с колебаниями напряжения в сети 220 В, питающего источник возбуждения; с изменениями параметров электрических схем в процессе работы генератора; с нестандартностью формы подставных электродов, массы образцов, микрорельефом их поверхности; с непостоянством длины межэлектродного промежутка; с неконтролируемым изменением количества третьих элементов, имеющих низкий потенциал возбуждения или ионизации; с изменениями количества вещества пробы, поступающей в разряд.
- Нестабильность условий регистрации интенсивности спектральных линий. Это обстоятельство связано с неконтролируемыми смещениями источника света с оптической оси спектрографа, с подобными же изменениями времени обжига/экспозиции, а также с нестандартностью свойств и режимов работы приемников излучения. При фотоэлектрической регистрации возможны ошибки, обусловленные взаимным смещением регистрируемого пучка света и входной щели вследствие колебаний температуры прибора, его вибрации, а также с нестабильностью работы электрических измерительных схем.
- Погрешность построения градуировочных графиков. Она обусловлена некоторой субъективностью выбора градуировочной кривой, а также неаккуратным снятием отсчета и построением графика.
Систематические ошибки при измерениях
К источникам их относятся следующие:
- Несоответствие рабочих проб и применяемых эталонов по тем свойствам, которые влияют на интенсивность спектральных линий (влияния структуры сплава, формы и массы образцов, влияния третьих элементов). Этот источник ошибок является наиболее частым и существенным.
- Недостаточно точное установление химического состава эталонов. Ошибка, возникающая вследствие этого, обусловлена тем, что интенсивность спектральных линий при прочих равных условиях пропорциональна истинному содержанию элемента в образце, в то время как градуировочный график строится по паспортным (номинальным) значениям концентрации элементов, не всегда точно совпадающих с истинными.
- Отличие состава эталонных образцов (одного или нескольких), применяемых в данной лаборатории, от паспортных данных, обусловленное особым видом неоднородности — неоднородностью в значительных объемах материала партии эталонов (например, из-за зональной ликвации в слитках металла, использованного для изготовления эталонов). Неоднородность такого вида приводит к постоянному отличию состава данного образца от среднего состава партии, описываемого паспортом (свидетельством) комплекта эталонов.
В конкретных условиях работы в каждой лаборатории значение тех или иных ошибок, естественно, может быть различным.
Нетрудно заметить, что один и тот же источник ошибок может фигурировать в обоих разделах приведенной классификации ошибок спектрального анализа. Это лишний раз иллюстрирует зависимость характера действия источников ошибок от условий задачи.
Так как источники ошибок весьма многообразны, то при недостаточной точности анализа обычно бывает трудно (а иногда и невозможно) непосредственно установить, какие методические усовершенствования нужны для ее повышения. В таких случаях необходимым этапом работы является оценка величины ошибок и выявление наиболее опасных их источников.
Методы оценки точности спектрального анализа
Авторы:
сотрудники компанииСмотрите так же:
- Особенности спектрального анализа чугунов
- Принципы атомно-эмиссионного спектрального анализа
- Сравнение рентгенофлуоресцентного анализатора c оптико-эмиссионным спектрометром при анализе металлов и сплавов
- Список ГОСТов на методы спектрального анализа
Опубликовано: 24.03.2022
Обновлено: 26.05.2023
Кол-во просмотров: 2813
Читать: 5 минут
Спектрофотометр — инструмент, который используют для спектрального анализа твердых поверхностей и жидкостей. Это возможно благодаря видимому, инфракрасному и ультрафиолетовому электромагнитному излучению.
Сферы применения
Измерение спектрофотометром актуально для различных сфер, особенно медицины. Также без прибора не обходится работа физиков, биологов и представителей естественных наук. Он помогает проводить точную количественно-качественную оценку исследуемых материалов.
Инструмент необходим для различных научных исследований. Например, многие открытия в сфере колориметрии (химического анализа) стали возможными благодаря прибору.
Известен даже отдельный метод анализа цвета, который проводится при помощи спектрофотометра. Способ хорош тем, что дает высокую точность при минимальных погрешностях.
Не менее популярна модель и для промышленности. Например, при определении плотности твердых тел или растворов. Благодаря выявлению объема того или иного вещества, получается поддерживать оптимальное соотношение компонентов, которые нужны по технологии изготовления раствора.
Наиболее распространенными областями для использования лабораторного спектрофотометра сейчас являются:
- Фармацевтика. Контроль концентрации различных веществ в составе лекарственных препаратов — один из важных этапов любого фармацевтического производства. При проведении исследований благодаря прибору специалисты оценивают оттенок тканей и веществ.
- Промышленность. На производствах, которые занимаются получением чистых веществ при помощи их выделения из смесей или растворов, необходимы спектрофотометрические исследования. После определения плотности растворов и скорости ее изменения можно судить о присутствии примесей в составе.
- Химическая промышленность. Спектрофотометр определяет химический состав реактивов и различных веществ, которые требуются для производства продукции.
- Полиграфия. В этой отрасли иногда может возникать нужда в определении оттенка и состава применяемых в печати красок.
Спектрофотометры также нужны при производстве лаков и красок, текстиля, косметики и многих других товаров.
Принцип работы
Устройство спектрофотометра очень простое: в нем есть источник света, усилитель сигналов, фотоприемник, монохроматор, зеркало, стекло и емкость для реагента. Монохроматор включает дифракционную решетку или призму, выделяющую излучение с определенной длиной волны. В зависимости от модели может быть от одной до четырех емкостей для проб.
Фотоприемники запечатлевают уровень светового излучения, который проходит через материал. Более современные устройства оборудованы фотодиодной матрицей, внутри которой есть встроенный датчик. Он трансформирует световой сигнал в электрический, что отражается на экране оборудования.
Погрешность спектрофотометра незначительна и во многом зависит от длины волны. В среднем она может составлять 0,1 нм и не превышает 0,5 нм.
Если прибор обладает небольшой мощностью, то обработка волн с различной длиной происходит поэтапно, после данные выводятся на монитор. От числа фотодиодных датчиков зависит производительность и точность работы. При наличии фотодиодной матрицы можно проводить исследования при производственных операциях или в момент возникновения химической реакции. Это дает возможность оперативно анализировать состояние реакционных соединений.
Принцип спектрофотометра основан на измерении уровня отражения или поглощения монохроматических световых потоков. При исследовании внешние условия не могут влиять на результат анализа.
Сами инструменты работают по двум схемам. При первой на пробу попадает монохроматический световой луч с определенной длиной волны спектрофотометра, который при прохождении сквозь материал направляется в фотоприемник. Там измеряется разница между потоками. При второй световой поток попадает на реагент непосредственно от лампы, после монохроматор выделяет небольшой пучок на фотоприемник.
Виды спектрофотометров
Современные модели бывают одно- и двухлучевым.
- Однолучевые имеют единственный источник света. При этом для вычисления коэффициента отражения нужно менять алгоритмы применяемых подсчетов.
- Двухлучевые оснащены двумя лучами, что позволяет не заботиться о корректировке вычислений. Такие модели отличаются большей точностью в работе и намного удобнее благодаря чувствительности к любым изменениям окружающей среды.
Также производители предлагают различные виды спектрофотометров по следующим характеристикам:
- По числу монохроматоров — с одним или двумя.
- По типу источника света и рабочему диапазону — видимый, ультрафиолетовый, инфракрасный.
- По количеству приемников вторичного излучения — одному или нескольким.
- По разновидности конструкции — стационарные или мобильные.
Современные характеристики спектрофотометров позволяют получить непрерывное излучение благодаря качественным источникам света, а также иметь огромный диапазон за счет добавления фотоприемников. Самые технологичные приборы оборудованы матрицами на базе фотоприемников, что гарантирует поступление спектра как на образец, так и на дифракционную решетку. Таким образом результаты быстро обрабатываются и выводятся на монитор.
Также новые модели отличаются небольшими размерами и компактностью. Благодаря большому выбору устройств, можно подобрать подходящую конструкцию в зависимости от вида исследуемого материала.
Кюветы для спектрофотометров
Кювета — некрупная прямоугольная емкость для водных образцов. Сосуды используют в спектрофотометрических исследованиях для определения коэффициента поглощения на определенной длине волны.
Кюветы изготавливают из качественного прозрачного стекла, которое отличается хорошими оптическими свойствами. Такой материал устойчив к агрессивному воздействию окружающей среды и подходит для работы даже в расширенном диапазоне оптической плотности рабочих сред. Их выбор позволяет получать точную информацию о плотности жидкостей химического или биологического происхождения.
Кюветы применяются при любом назначении спектрофотометра — как для качественных, так и для количественных исследований и контроля:
- В лабораториях.
- В учреждениях экологии, санитарного и эпидемиологического контроля.
- На производственных и химических компаниях.
Использование кювета также позволяет максимально точно определять концентрацию препаратов в крови человека. Это включает вычисление химических веществ в различных биологических жидкостях и тканях.
Предлагаем кюветы для фотометрии по низким ценам в нашем интернет-магазине.

 Интенсивнее поглощаются те энергии (длина волны), которые соответствуют энергетическим уровням возбуждения внутренних переходов атомов и молекул: тогда молярный коэффициент поглощения максимален.
Интенсивнее поглощаются те энергии (длина волны), которые соответствуют энергетическим уровням возбуждения внутренних переходов атомов и молекул: тогда молярный коэффициент поглощения максимален.