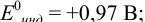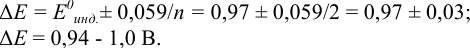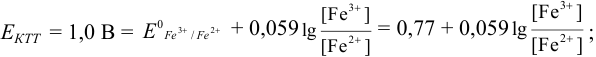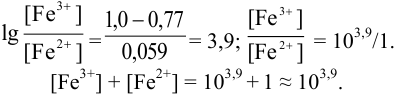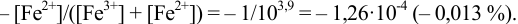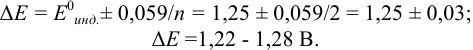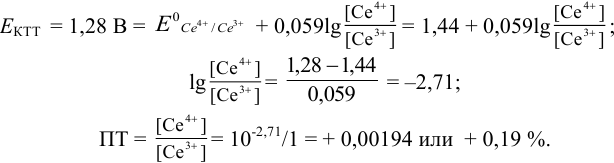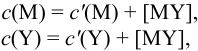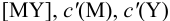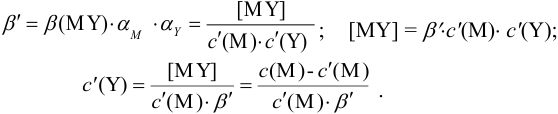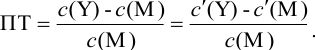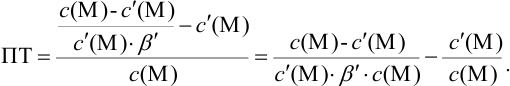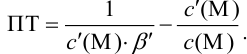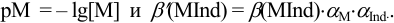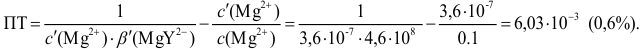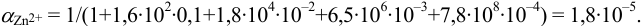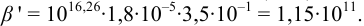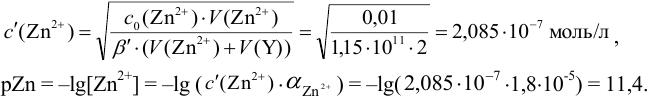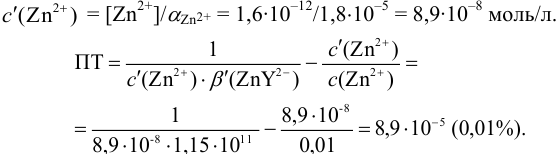1.5.1 Протонную
ошибку можно рассчитать ОТ [Н+]
,%
,
(25)
где V-
исходный объем определяемого вещества,
мл;
VD—
объем добавленного титранта, мл;
рТ- показатель
титрования индикатора.
1.5.2 Гидроксидную
ошибку можно рассчитать ОТ [ОН—],
%
(26)
1.5.3 Кислотная
ошибка возникает,если при недотитровании
слабых кислот в растворе остается
небольшое количество кислоты в
молекулярной форме (ОТА)
,%
(27)
1.5.4 Основная ошибка
появляется
при недотитровании слабого основания
(ОТВ),
%
(28)
Примеры решения
задач.
Пример 1
На титрование
смеси, состоящей из карбонатов натрия
и калия массой 0,4 г израсходовали 22,00 мл
0,3М HCl.
Вычислить массовую долю (%) Na2CO3
и К2СО3
в смеси.
Решение:
Обозначим: w –
количество Na2CO3
в % — (доля Na2CO3),
(100-w) – количество
К2СО3
в % — (доля К2СО3)
%сод
=
qA=
qA
= nA
· ЭA
где %сод
— процентное
содержание.
nA
· ЭA
=
,
т.е. nA
· ЭA
·
100 = % сод
·
а
n=
n=
В точке эквивалентности
количество эквивалентов в смеси равно
n+
n=
n
Подставляем
числовые значения
+
=
Тогда
ω
= 46,12% Na2CO3
а массовая доля
К2СО3
находится из разности
100 – 46,12 = 53,88% К2СО3
Пример 2
Навеску хлорида
аммония обработали избытком щелочи.
Выделившийся аммиак поглотил 50 мл
0,5120М HCl
и раствор разбавили до 250 мл. На титрование
50 мл полученного раствора израсходовали
23,73 мл 0,05М КОН (К = 0,9740). Вычислить массу
NH3,
которая содержалась в хлориде аммония.
Решение
Итак, количество
HCl
в исходном растворе кислоты составляе
n=
С учетом разбавления
до 250 мл
n=
Количество КОН,
пошедшего на титрование HCl,
взятого в избытке
n=
Количество аммиака
считаем: n=
n
– n
Пример 3
Чему должен быть
равен титр раствора К2Сr2О7,
чтобы 1 мл его, израсходованный на
титрование FeCl2,
полученного из навески руды 0,2 г
соответствовал точно 0,5% железа.
Решение
6Fe2++
Сr2О72-
+14H+
→ 6Fe3++
2Сr3+
+7H2O
% =
q
=
1 мл К2Сr2О7
титрует 0,001 г Fe,
т.е. это
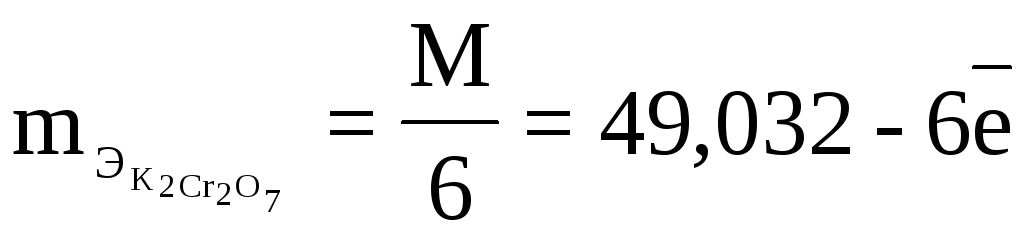
по 3
ТВ/А=
ТВ=
Подставляем
числовые значения
ТВ=
Пример 4
Для определения
свободного Р2О5
в суперфосфате,
содержащуюся в водном растворе его
Н3РО4
титруют NaOH,
причем образуется NaH2PO4.
Чему равен Т,
если на 0,1035г Н2С2О4
расходуется 25,15 мл данного раствора
NaOH?
Решение
Н3РО4
+ NaOH
= NaH2РO4+НОН
2Н3РО4
=Р2О5
+ 3Н2О
fэкв
(Р2О5)=1/2
Р2О5
+ 3Н2О
= 2Н3РО4
25,15 мл NaOH
титруют 0,1035г Н2С2О4
1 мл NaOH
титрует x
г Н2С2О4
х =
Это Т(ТВ/А)
ТВ/А=
ТВ=— это Т
Т=
Пример 5
На титрование с
фф навески массой 0,4478 г, состоящей из
Na2CO3,
NaHCO3
и NaCl
потребовалось
18,80 мл 0,1998М раствора НCl.
При титровании с мо на ту же навеску
израсходовали 40,00 мл раствора кислоты.
Вычислить массовую долю (%) Na2CO3
и NaHCO3
в смеси.(фф- фенолфталеин, мо- метилоранж)
Решение
При титровании
смеси с фф протекает реакция
Na2CO3
+ НCl
= NaCl
+ NaHCO3
в присутствии мо
Na2CO3
+ 2НCl
= 2NaCl + H2О
+ CO2
NaHCO3
+
НCl
= NaCl + H2О
+ CO2
Следовательно,
при титровании смеси в присутствии фф
с раствором хлороводородной кислоты
взаимодействует только один компонент
смеси Na2CO3
и количество
его легко определить по формуле (18)
Тогда
Как следует из
приведенных реакций, объем раствора
НCl,
затраченный на титрование гидрокарбоната
натрия, в присутствии мо можно представить
так
VHCl
MO
= 2VHCl
фф
Отсюда
Пример 6
Для определения
содержания формальдегида в пестициде
навеску препарата массой 3,017 г обработали
50,00 мл 1 М раствора NaOH
(K=0,9022)
в присутствии пероксида водорода. При
нагревании произошла реакция
НСОН + ОН—
+ Н2О2
= НСОО—
+ 2Н2О
При охлаждении
избыток щелочи оттитровали 20,12 мл
раствора НCl
с ТНCl
= 0,03798. Вычислить массовую долю (%)
формальдегида в препарате пестицида.
Решение
Сущность обратного
титрования отражает формула
С учетом условий
задачи выражаем число молей реагирующих
веществ
n(HCl)=
Составляем расчетное
уравнение
—
Подставив числовые
выражения, получаем
ωx
= 20,86 %
Иногда в ходе
анализа целесообразно осуществить
двойное и даже тройное замещение.
Например, в случае тройного замещения
можно схематично написать реакции в
следующем виде
Даны вещества А,В,
С, D.
S
– заместитель
ZAA
+ ZBB
+ ….→ Z1S1
+….
Z1S1
+ ZCC
+ ….→ Z2S2
+….
Z2S2
+ ZDD
+ ….→ Z3S3
+….
Третий заместитель
S3
титруют титрантом Т
Z3S3
+ ZTT
+ … → ZPP+…
Массу и массовую
долю (%) определяемого вещества в таком
случае вычисляют по формулам
%сод
=
Пример 7
Навеску сплава,
содержащего свинец, массой 0,3526г растворили
в азотной кислоте. Свинец осаждают в
виде хромата, осадок отфильтровывают,
отмывают от избытка хромата и растворяют
в соляной кислоте. В растворе хромат-ионы
определяют иодометрически. На титрованиие
выделившегося иода израсходовано 25,85
мл 0,0500 М раствора Na2S2O3.
Рассчитать массовую долю свинца в сплаве
(Мол. масса (Pb)
207,19)
Решение
Уравнение реакций
можно представить в следующем виде
Pb2+
+ CrOPbCrO4
(ZA=Z1=1)
2 PbCrO4
+ 2H3O+↔
2 Pb2++
Cr2O+3H2O
(Z1=2;
Z2=1)
Cr2O+6J—+14
H3O+↔3J2+2Cr3+
+21H2O
(Z2=1;
Z3=3)
J2
+2S2O↔2J—+S4
O(Z3=1;
ZT=2)
Массовую долю
свинца вычисляют по формуле
ωPb,%
=
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 
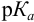
Таблица 8.12
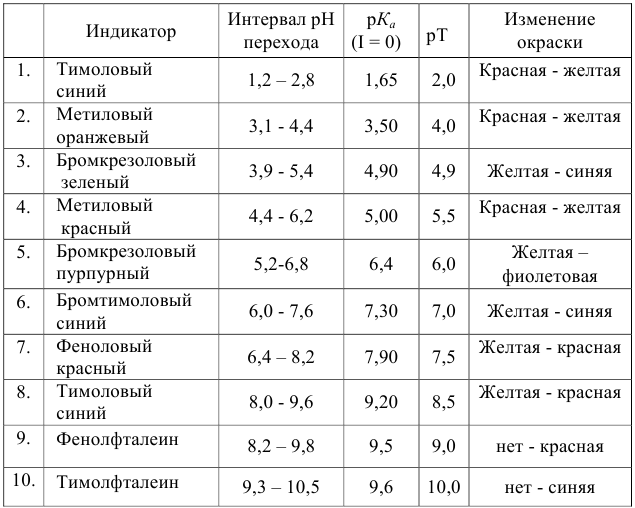
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 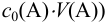
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
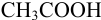
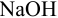
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
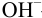
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 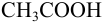



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 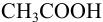
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 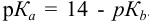
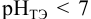
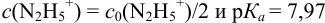
Сравнивая рТ индикаторов и 
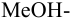
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 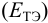

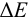
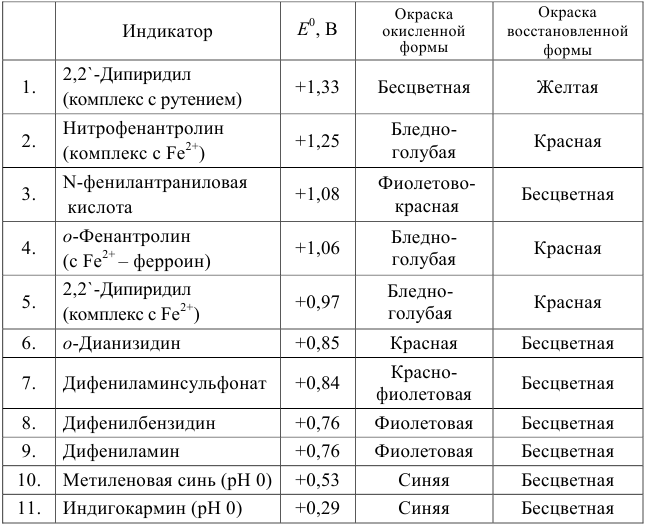
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 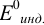
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 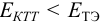
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 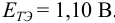
Выберем для рассмотрения порядка расчета два индикатора:
а) с 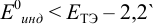
б) с 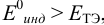
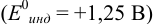
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
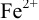



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

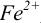
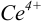
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 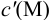
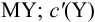
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 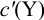
Вблизи ТЭ 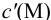
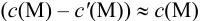
следовательно:
Выражение (8.21) тождественно выражению: 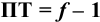
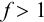
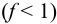
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
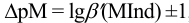
Интервал перехода окраски 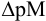
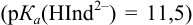
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 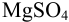

Решение:
В данных условиях 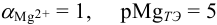
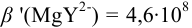
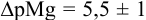
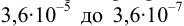

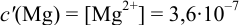
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 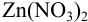

Решение:
1. Рассчитаем условную константу 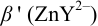
Общие константы устойчивости для аммиачных комплексов 
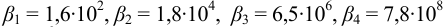

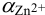
По табл. 7 и табл. 4 приложения находим 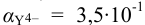
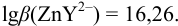

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 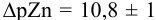
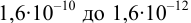

2. Конечная точка титрования наступает при [
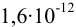

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Аналогичная зависимость имеет место и при других видах реакций. Так, например, 0,1 и. раствор уксусной кислоты (Кк 1сл. = 2-10 . можно точно оттитровать 0,1 н. раствором едкой щелочи. Однако борную кислоту (Ккисл. = б-10 ) в тех же условиях уже нельзя титровать с удовлетворительной точностью. Наоборот, метаборнокислый натрий можно титровать соляной кислотой, а уксуснокислый натрий — нельзя. Некоторые из этих нри.меров расс.матриваются подробнее при изучении отдельных методов. Для вычисления ошибки титрования, обусловленной малым скачком (или, точнее, нерезким перегибом кривой титрования), вблизи точки эквивалентности имеется несколько методов, более или меиее сложных. Один из наиболее простых методов, предложенный К. Б. Яцимирским, кратко рассматривается ниже. [c.278]
В вычислении результатов титриметрических определений наименее точная цифра — число миллилитров титрующего раствора, израсходованного на титрование. Поскольку сотые доли миллилитра отмечаются лишь приблизительно, можно принять, что максимальная ошибка отмеривания не менее 0,02 мл. Ошибка от натекания также равна 0,02 мл. Таким образом, общая ошибка может доходить до 0,04 мл . При общем расходе титрующего раствора 20 мл это составит 0,2% отн. Отсюда следует, что, беря для анализа 1 г, вполне можно проводить отвешивание с точностью до 1 мг это дает относительную ошибку в 0,5 мг, или 0,05%. Если на титрование расходуется меньше 20 мл [c.11]
Этим уравнением можно пользоваться для вычисления относительной ошибки титрования и для определения допустимой степени разбавления раствора [261 ]. Предположим, что светопропускание измеряется с точностью 0,2%, т. е. что АТ = 0,002 и светопропускание в точке эквивалентности равно приблизительно 0,85. Уравнение (7,18) дает соответственно величину АС [c.189]
Весьма важное значение имеет правильное вычисление результатов объемного анализа. Все вычисления в объемном анализе рекомендуется производить со всей тщательностью и внимательностью, так как правильные результаты титрования, вследствие неправильно проведенных расчетов, дают неверный результат анализа. Всякое объемное определение включает две ошибки ошибку в концентрации титрующего раствора и ошибки титрования определяемого вещества. Эти ошибки могут компенсироваться в том случае, если концентрация титрующего раствора была установлена в тех же условиях, что и титрование анализируемого образца. Влияние случайных ошибок можно устранить, повторяя титрование несколько раз. Отклонение от среднего результата не должно превышать 0,3% относительных. Поэтому отсчеты объемов по бюретке необходимо вести с точностью до 0,02—0,03 мл. Например, три последовательных титрования дают следующие отсчеты 25,06 25,03 25,03 мл. Средний результат титрования должен быть записан в виде 25,04 мл. Если отклонения превышают допустимую величину, то такие результаты титрования не должны приниматься во внимание при вычислении среднего результата. Для повышения точности измерения объема применяют бюретки малого диаметра или весовые бюретки. [c.445]
Определение борной кислоты. Эту очень слабую кислоту можно непосредственно титровать щелочью, применяя тропеолин О или нитрамин в качестве индикаторов, в том случае, когда концентрация борной кислоты равна примерно 1 н. Рас-твором- свидетелем тогда может служить 0,05 М раствор карбоната натрия точность титрования 1—2%. При вычислении показателя титрования рТ следует иметь в виду, что борная кис-, лота ведет себя несколько ненормально ее константа диссоциации значительно возрастает с увеличением концентрации вследствие образования более сильной полиборной кислоты. Так, величина Ка при 18° оказалась равной 4,6-Ю в 0,1 М растворе, 2,6-10 в 0,25 М растворе и 1,19 10 в 0,5 Л1 растворе. Негели применил свои индикаторы помутнения для титрования борной кислоты. Он прибавлял в избытке щелочь, а затем оттитровывал обратно избыток последней 0,1 н. кислотой по индикатору изонитрозоацетил-/г-аминоазобензолу (стр. 63) до появления мути ошибки в его опытах доходили до 2—3%. [c.142]
Вычисление количества определяемого вещества основано на законе Фарадея. Чувствительность метода определяется чувствительностью способа индикации конца титрования и может быть доведена до микрограммовых количеств. Таким образом, метод пригоден для определения растворов как моляр-цай, так ц микромолярной концентрации. Точность метода определяется точностыо замера времени и силы тока. Ошибка определения составляет 0,1 %. Сксч)ость определения ка к правило, [c.257]
Анализируемый раствор подкисляют до pH 2—3 и на кончике шпателя добавляют твердую аскорбиновую кислоту (до полного исчезновения окраски железа) При тщательном перемешивании добавляют разбавленный раствор аммиака или буферный раствор до появления неисчезающей мути. На кончике шпателя вводят избыток КСК, разбавляют водой до 200—250 мл, добавляют 20 мл аммиачного буферного раствора с pH 10 и нагревают. Раствор светлеет и по достижении температуры 70—80 С становится светло-желтым. В теплый раствор добавляют из бюретки 0,1 М раствор комплексона III при тщателыюм перемешивании, пока раствор не станет прозрачным. Добавляют эриохром черный Т (смесь с НаС1 в соотношении 1 200) до сильной сине-зеленой окраски, и избыток комплексона III титруют 0,1 М раствором МдС12 до красной окраски и в заключение титруют раствором комплексона III до сине-зеленой окраски. Так много раз можно получить эквивалентную точку и при вычислении использовать среднее значение всех эквивалентных точек. Такой прием позволяет свести к минимуму капельную ошибку титрования и повысить точность определения. [c.79]
Хорошо известно, что количества кадия и натрия в смеси пх хлоридов могут быть вьлислены, если содержание хлорида точно известно (нанример, из результатов нотенциометрического титрования). Подобно этому, из результатов ионообменного определения сульфата можно вычислить состав смеси, состоящей из сульфатов калия и натрия. Оба определения дают достаточную точность только в том случае, если катионы присутствуют в смеси в приблизительно одинаковых количествах. Отсюда следует, что ценность этих определений для большинства практических целей весьма ограничена. Ионообменный метод, предложенный Габриэльсоном [35 J, дает значительно лучшие результаты, особенно в тех случаях, когда относительные количества солей различны (нанример, 10 и 90%). Изз чались только смеси хлоридов натрия и калия, и принцип метода легко может быть пояснен на этом примере. Пробу раствора выпаривают и остаток точно взвешивают. Другую пробу такого же объема пропускают через катионит, насыщенный одним из ионов раствора. Колонку промывают дистиллированной водой, вытекающий раствор и промывные воды выпаривают и остаток точно взвешивают. Из результатов этих взвешиваний состав раствора можно определить простым вычислением, причем максимальная относительная ошибка не превышает 2%. Метод можно использовать и для оиределения анионов в этом случае вместо катионита применяют анионит. [c.240]
Анализ составов равновесных фаз осуществляли рефрактометрически на приборе ИРФ-22 [5] и методом объемного титрования [6]. Точность измерения показателя преломления составила 0,0005. Среднеквадратичная ошибка при определении содержания уксусной кислоты в исследованных системах методом объемного титрования, вычисленная но формуле [7] [c.25]
Ошибка титрования вследствие разложения образующегося альдегидбисульфитного соединения. Для аналитических целей большое значение имеет вычисление по константе разложения альдегид-бисульфитного или кетон-бисульфитного соединения той части альдегида (или кетона), которая остается в свободном состоянии в растворе наряду с избытком бисульфита. Зная эту величину, можно вычислить точность аналитического определе- [c.245]
Эти данные можно использовать как для внесения соответствующих поправок, так и для вычисления минимального количества титруемого вещества при заданной точности определения. Если, например, на некоторое титрование теоретически необходимо затратить а миллиграмм-эквивалентов КМПО4, то в действительности затрачивается а -т миллиграмм-эквивалентов. Отсюда индикаторная ошибка О в процентах равна [c.149]
Расчет кривых титрования вблизи точки эквивалентности часто не отличается высокой точностью, поскольку он основан на использовании разности двух больших чисел, близких по абсолютному значению. Например, при вычислении концентрации AgNOз после добавления 25,10 мл 0,0100 М раствора AgNOз числитель в расчетной формуле (0,2510—0,2500) содержит лишь две значащих цифры следовательно, и AgNOз в лучшем случае можно вычислить с точностью до двух значащих цифр. Тем пе менее, чтобы уменьшить ошибку при округлении, мы провели этот расчет с точностью до трех цифр, а округлили после вычисления pAg. [c.195]

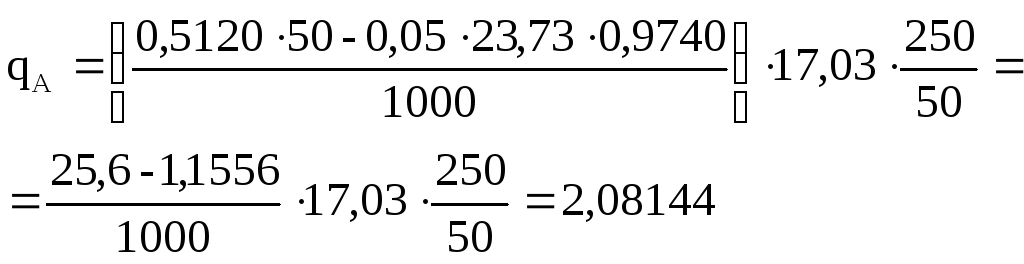
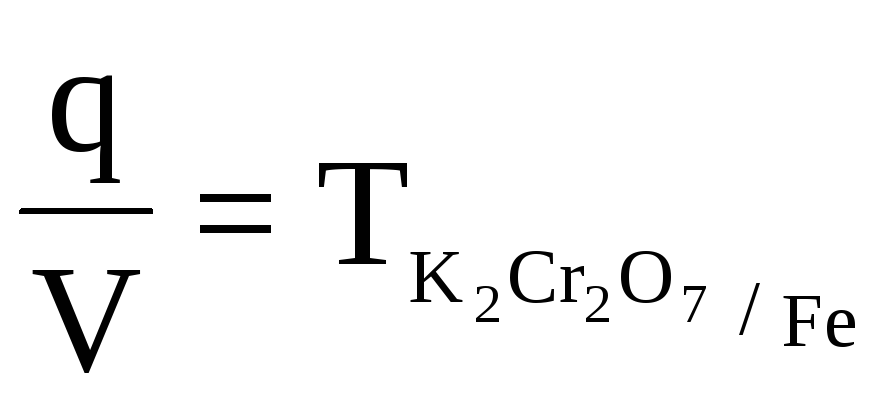


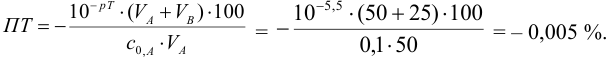
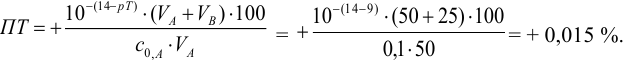
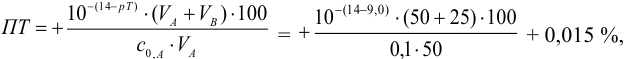
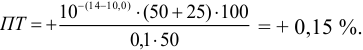
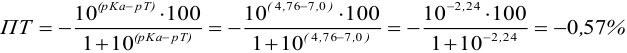
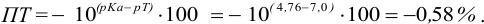
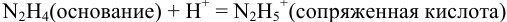
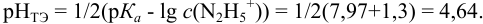
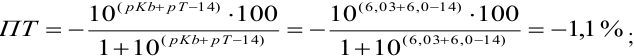
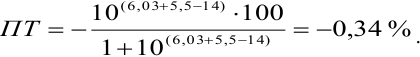

 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.