Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Статьи
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой — требует от врача-клинициста осведомленности о многочисленных антибиотиках и их свойствах (спектр действия, фармакокинетика, побочные эффекты и т. д.), умения ориентироваться в вопросах микробиологии, клинической фармакологии и других смежных дисциплинах.
Согласно И. В. Давыдовскому, «врачебные ошибки — род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Ошибки в антибактериальной терапии инфекций дыхательных путей имеют наибольший удельный вес в структуре всех лечебно-тактических ошибок, совершаемых в пульмонологической практике, и оказывают существенное влияние на исход заболевания. Кроме того, неправильное назначение антибактериальной терапии может иметь не только медицинские, но и различные социальные, деонтологические, экономические и другие последствия.
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
| Тактические ошибки | Стратегические ошибки |
|
|
|
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
Наиболее распространенная ошибка в амбулаторной практике — назначение антибактериальных препаратов при острых респираторных вирусных инфекциях (ОРВИ), имеющее место как в терапевтической, так и в педиатрической практике. При этом ошибки могут быть обусловлены как неправильной трактовкой симптоматики (врач принимает ОРВИ за бактериальную бронхолегочную инфекцию в виде пневмонии или бронхита), так и стремлением предотвратить бактериальные осложнения ОРВИ.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
|
Инфекции верхних дыхательных путей |
Инфекции нижних дыхательных путей |
|
|
|
Одной из распространенных ошибок при проведении антибактериальной терапии является назначение одновременно с антибиотиком противогрибковых средств с целью профилактики грибковых осложнений и дисбактериоза. Следует подчеркнуть, что при применении современных антибактериальных средств у иммунокомпетентных пациентов риск развития грибковой суперинфекции минимален, поэтому одновременное назначение антимикотиков в этом случае не оправдано. Комбинация антибиотика с противогрибковым средством целесообразна только у больных, получающих цитостатическую или противоопухолевую терапию или у ВИЧ-инфицированных пациентов. В этих случаях оправдано профилактическое назначение антимикотиков системного действия (кетоконазол, миконазол, флуконазол), но не нистатина. Последний практически не всасывается в желудочно-кишечном тракте и не способен предотвратить грибковую суперинфекцию иной локализации — полости рта, дыхательных или мочевыводящих путей, половых органов. Часто практикующееся назначение нистатина с целью профилактики дисбактериоза кишечника вообще не находит логического объяснения.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
| Тонзиллофарингит | Острый средний отит | Синусит | Обострение хронического бронхита | Пневмония |
| Streptococcus pyogenes | Streptococcus pneumoniae Haemophilus influenzae |
Streptococcus pneumoniae Haemophilus influenzae Moraxella catarrhalis в ассоциации с анаэробами |
Haemophilus influenzae Streptococcus pneumoniae Moraxella catarrhalis; У пожилых: + Staphylococcus aureus |
Streptococcus pneumoniae Haemophilus influenzae Mycoplasma pneumoniae Chlamydia pneumoniae, реже — Enterobacteriaceae Staphylococcus aureus Klebsiella pneumoniae Legionella pneumophila |
Кроме того, при выборе препарата следует учитывать уровень приобретенной резистентности возбудителей в популяции. Основные тенденции, касающиеся резистентности возбудителей, отмеченной в последние годы, отражены в таблице 4. Таблица 4. Современные проблемы резистентности наиболее частых возбудителей внебольничных инфекций дыхательных путей.
| Микроорганизмы | Современные проблемы лечения |
| Streptococcus pneumoniae | Снижение чувствительности к бета-лактамам; устойчивость в пенициллину в России не превышает 2%, но штаммы с умеренной чувствительностью составляют 10 — 20%. b-лактамы (амоксициллин, ампициллин, цефалоспорины III-IV поколения, карбапенемы) сохраняют полную клиническую эффективность в отношении пенициллинрезистентных пневмококков, в то же время эффективность цефалоспоринов I-II поколения может быть снижена. Низкая природная активность пероральных цефалоспоринов III поколения, прежде всего цефтибутена. Рост устойчивости к макролидам: в Европе от 8 до 35%, в России — около 12%; устойчивость ассоциируется с клиническим неуспехом терапии. Высокая частота резистентности в России к ко-тримоксазолу и тетрациклинам (>50%). Низкая природная активность ранних фторхинолонов, в последние годы отмечено увеличение частоты резистентных штаммов; высокая активность новых фторхинолонов — резистентность минимальная. |
| Streptococcus pyogenes | Возрастание устойчивости к макролидам: в Европе до 50%, в России 10-20%. Рост устойчивости прямо связан с увеличением частоты потребления макролидов, главным образом пролонгированных препаратов (азитромицин, кларитромицин). Высокая устойчивость к тетрациклинам (>50%). Низкая природная активность ранних фторхинолоно в. Устойчивость к пенициллину и другим b-лактамам не описана. |
| Haemophilus influenzae | Продукция b-лактамаз в 1 — 40%, в России не превышает 10%; клинически амоксициллин не уступает защищенным пенициллинам. Практически не наблюдается устойчивости к амоксициллину/клавуланату, цефалоспоринам II-IV поколений, фторхинолонам. Цефалоспорины I поколения не активны. Природная активность макролидов низкая, риск бактериологического неуспеха лечения высокий. Устойчивость к ко-тримоксазолу в России около 20%. |
Наиболее значимые проблемы, связанные с применением основных антибактериальных средств при инфекциях дыхательных путей, могут быть сформулированы следующим образом. b-лактамы:
| Рекомендуются | Не рекомендуются |
|
Пенициллины Амоксициллин Амоксициллин/клавуланат Пероральные цефалослорины II поколения Цефуроксим аксетил Новые фторхинолоны Левофлоксацин Моксифлоксацин Макролиды (только при атипичной пневмонии) Доксициклин (только при атипичной пневмонии) |
Ко-тримоксазол Ампиокс Аминогликозиды Гентамицин Ранние фторхинолоны Ципрофлоксацин Офлоксацин Пефлоксацин Ломефлоксацин Цефалоспорины I поколения Цефазолин Цефалексин Цефрадин Цефаклор Пероральные цефалоспорины III поколения Цефтибутен |
Следует подчеркнуть, что назначение некоторых антибактериальных препаратов, применяемое в амбулаторной практике при респираторных инфекциях, нельзя признать рациональным. К таким препаратам прежде всего относятся:
| Тонзиллофарингит | Острый средний отит | Синусит | Хронический бронхит | Пневмония |
| Амоксициллин Амоксициллин/клавуланат1 Феноксиметилпенициллин Бензатин пенициллин Цефадроксил Цефуроксим аксетил1 Линкомицин1 Клиндамицин1 |
Амоксициллин Амоксициллин/клавуланат Цефуроксим аксетил Цефтриаксон |
Амоксициллин/клавуланат Цефуроксим аксетил Левофлоксацин Моксифлоксацин Клиндамицин |
Амоксициллин/клавуланат Амоксициллин Цефуроксим аксетил Левофлоксацин Моксифлоксацин |
Амоксициллин Амоксициллин/клавуланат Макролиды2 Доксициклин2 Левофлоксацин Моксифлоксацин |
1 Преимущественно при рецидивирующем течении
2При атипичной этиологии (Mycoplasma pneumoniae, Chlamydia pneumoniae, Legionella pneumopriila) Представленные рекомендации имеют наиболее общий характер. В то же время с практических позиций выбор оптимального антибактериального препарата также должен осуществляться с учетом особенностей пациента и заболевания. Так, например, у больных пневмонией молодого и среднего возраста без отягощающих факторов терапевтический эффект оказывают амоксициллин, макролиды, защищенные пенициллины и новые фторхинолоны. Однако у больных пожилого возраста в этиологии заболевания большее значение приобретают S. aureus и грамотрицательные бактерии, что объясняет снижение эффективности амоксициллина и макролидов у этой категории больных. Также распространенной во врачебной практике ошибкой является отказ от назначения антибактериальной терапии при пневмонии беременным женщинам из-за опасения негативного влияния препаратов на плод. Следует отметить, что перечень антибактериальных препаратов, прием которых нежелателен во время беременности из-за риска эмбриотоксического действия, ограничен — тетрациклины, хлорамфеникол, сульфаниламиды, ко-тримоксазол, фторхинолоны, аминогликозиды. Другие антибиотики, в частности b-лактамы, макролиды, могут применяться у беременных женщин. Другие возможные факторы, влияющие на выбор антибактериального препарата, представлены в таблице 7. Таблица 7. Особые клинические ситуации при внебольничных инфекциях нижних дыхательных путей.
| Ситуация | Возбудители | Наиболее надежные препараты |
| Алкоголизм, сахарный диабет | Enterobacteriaceae S. aureus S. pneumoniae |
Амоксициллин/клавуланат Левофлоксацин Моксифлоксацин |
| Деструкция, абсцедирование | S. aureus Анаэробы К. pneumoniae |
Амоксициллин/клавуланат Клиндамицин + цефалоспорин I II поколения Фторхинолон + метронидазол Имипенем Меропенем |
| Бронхоэктазы, муковисцидоз | P. aeruginosa S. aureus |
Ципрофлоксацин Цефтазидим Меропенем |
| ВИЧ | P. carinii Enterobacteriaceae |
Ко-тримоксазол + фторхинолон |
Нередки ошибки при выборе антибактериального препарата в случае неэффективности первоначального. Здесь необходимо также остановиться на ошибках антибактериальной терапии, которые касаются несвоевременной оценки неэффективности первоначального антибиотика. Общепринятым критическим сроком оценки эффективности (или неэффективности) антибактериальной терапии считаются 48-72 ч с момента его назначения. К сожалению, приходится нередко сталкиваться с такими случаями, когда больной продолжает получать назначенный антибиотик в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Обычно критерием эффективности антибактериальной терапии является снижение или нормализация температуры тела больного, уменьшение признаков интоксикации. В тех случаях (не столь частых), когда лихорадка с самого начала заболевания отсутствует, приходится ориентироваться на другие признаки интоксикации (головная боль, анорексия, общемозговая симптоматика и т. д.), а также на отсутствие прогрессирования заболевания за период проводимого лечения. Продолжение антибактериальной терапии, невзирая на ее неэффективность, имеет немало негативных последствий. При этом затягивается назначение другого, более адекватного антибиотика, что ведет к прогрессированию воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией) и развитию осложнений, а также удлиняет сроки лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов препаратов, а также развития и усиления антибиотикорезистентности. Продолжение лечения, несмотря на неэффективность проводимой терапии, подрывает доверие больного и его родственников к лечащему врачу. Очевидна и неэкономичность такой ошибочной тактики антибактериальной терапии (напрасный расход неэффективного АП, дополнительные затраты на лечение токсических эффектов и др.). Кроме того, ошибки встречаются при замене неэффективного антибиотика на другой, т. е. при смене препарата. При этом врач забывает, что принцип выбора антибактериального препарата остается прежним, т. е. ориентироваться следует на клиническую ситуацию с учетом, однако, неэффективности первоначального препарата и ряда других дополнительных признаков. Отсутствие эффекта от первоначально назначенного антибиотика в известной степени должно служить дополнительным ориентиром, позволяющим обосновать выбор второго препарата. Так, например, отсутствие эффекта от применения b-лактамных антибиотиков (пенициллины, цефалоспорины) у больного с внебольничной пневмонией позволяет предполагать атипичную этиологию пневмонии (микоплазменной, хламидийной или легионеллезной) с учетом, разумеется, других клинических признаков. Клинические признаки атипичной пневмонии, вызванной Mycoplasma pneumoniae или Chlamydia pneumonias:
| Примеры | Целесообразно |
| Амоксициллин внутрь 0,75-1 г в сутки | 0,5-1 г три раза в сутки |
| Ампициллин в/в 2 г в сутки | 1 г четыре раза в сутки |
| Амоксициллин/клавуланат внутрь 0,375 г три раза в сутки |
0,625 г три раза в сутки или 1 г два раза в сутки |
| Цефуроксим аксетил внутрь 0,5 г в сутки | 0,5 г два раза в сутки |
| Эритромицин внутрь 1 г в сутки | 0,5 г четыре раза в сутки |
| Кларитромицин внутрь 0,5 г в сутки | 0,5 г два раза в сутки |
| Ципрофлоксацин внутрь 0,5 г в сутки | 0,5-0,75 г два раза в сутки |
| Оксациллин внутрь 1-1,5 г в сутки | Не рекомендуется |
| Ампиокс внутрь 0,25-0,5 г три раза в сутки | Не рекомендуется |
Неправильный выбор интервалов между введениями антибактериальных препаратов обычно обусловлен не столько сложностями парентерального введения препаратов в амбулаторных условиях или негативным настроем больных, сколько неосведомленностью практикующих врачей о некоторых фармакодинамических и фармакокинетических особенностях препаратов, которые должны определять режим их дозирования. Типичной ошибкой является назначение в амбулаторной педиатрической практике при пневмонии бензилпенициллина с кратностью введения два раза в сутки, так как более частое его введение неудобно для пациента. Следует отметить, что при нетяжелом течении пневмонии вряд ли оправдано стремление некоторых врачей к обязательному назначению парентеральных антибиотиков. Современные антибактериальные препараты характеризуются хорошей биодоступностью при приеме внутрь, а также одинаковой клинической эффективностью с парентеральными препаратами, поэтому в подавляющем большинстве случаев оправдано лечение пероральными препаратами. Если назначение парентеральных антибиотиков действительно необходимо, следует выбрать препарат с длительным периодом полувыведения (например, цефтриаксон), что позволяет назначать его один раз в сутки. IV. Ошибки при комбинированном назначении антибиотиков Одной из ошибок антибактериальной терапии внебольничных респираторных инфекций является необоснованное назначение комбинации антибиотиков. Врачи старших поколений помнят то время (50-70-е гг. прошлого столетия), когда при лечении пневмонии обязательным считалось назначение пенициллина и стрептомицина, о чем свидетельствовали многие учебные пособия и руководства. Это был своеобразный стандарт лечения пневмоний для того времени. Несколько позднее одновременно с антибиотиками рекомендовалось назначение сульфаниламидов, с учетом полученных в свое время 3.В.Ермольевой данных о химиотерапевтическом синергизме сульфаниламидов и пенициллина. В современной ситуации, при наличии большого арсенала высокоэффективных антибактериальных препаратов широкого спектра, показания к комбинированной антибактериальной терапии значительно сужены, и приоритет в лечении респираторных инфекций остается за монотерапией. В многочисленных контролируемых исследованиях показана высокая клиническая и бактериологическая эффективность адекватных антибактериальных средств при лечении респираторных инфекций в режиме монотерапии (амоксициллин, амоксициллин/клавуланат, цефалоспорины II — III поколений, новые фторхинолоны). Комбинированная антибактериальная терапия не имеет реальных преимуществ ни в выраженности эффекта, ни в предотвращении развития резистентных штаммов. Основными показаниями к комбинированной антибактериальной терапии являются тяжелое течение пневмонии — в этом случае общепринятым стандартом лечения становится комбинированное назначение парентерального цефалоспорина III поколения (цефотаксим или цефтриаксон) и парентерального макролидного антибиотика (эритромицин, или кларитромицин, или спирамицин); последние включаются в комбинацию для воздействия на вероятных атипичных микроорганизмов (легионелла или микоплазма). Следует отметить, что в настоящее время в клинической практике появились новые антибактериальные препараты (левофлоксацин, моксифлоксацин) с высокой активностью в отношении как типичных, так и атипичных возбудителей, что позволяет назначать их в режиме монотерапии даже при тяжелой пневмонии. Другой клинической ситуацией, оправдывающей комбинированное назначение антибиотиков, является пневмония у иммунокомпрометированных пациентов (лечение цитостатиками, СПИД), при которой имеется высокая вероятность ассоциации возбудителей (см. таблицу 7). К сожалению, часто в амбулаторной практике приходится сталкиваться с ситуациями, при которых больным с нетяжелым течением пневмонии, при отсутствии осложнений, тяжелой фоновой патологии назначается два антибиотика. Логичного обоснования этой тактики лечения нет, при этом следует учитывать возможный антагонизм препаратов, более высокий риск нежелательных реакций и увеличение стоимости лечения. Следует отметить, что нерациональные комбинации антибактериальных препаратов имеют и официальные лекарственные формы, которые выпускаются отечественной фармацевтической промышленностью, например ампиокс, олететрин. Разумеется, применение таких препаратов недопустимо. V. Ошибки, связанные с длительностью антибактериальной терапии и критериями клинической эффективности В некоторых случаях проводится необоснованно длительная антибактериальная терапия. Такая ошибочная тактика обусловлена, прежде всего, недостаточным пониманием цели самой антибактериальной терапии, которая сводится прежде всего к эрадикации возбудителя или подавлению его дальнейшего роста, т. е. направлена на подавление микробной агрессии. Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками (аускультативная картина, сохраняющаяся рентгенологическая инфильтрация, ускорение СОЭ) регрессирует медленнее и не требует продолжения антибактериальной терапии (см. таблицу 9). В связи с этим следует считать ошибочной тактику, согласно которой у больного с сохраняющимися рентгенологическими признаками легочной инфильтрации, крепитирующими хрипами (crepitacio redux), увеличением СОЭ при нормализации температуры тела и исчезновении (или уменьшении) признаков интоксикации продолжают проводить антибактериальную терапию. Таблица 9. Сроки исчезновения симптомов при эффективной антибактериальной терапии внебольничной пневмонии.
| Симптомы и признаки | Сроки исчезновения |
| Интоксикация | 24-48 ч |
| Отрицательная гемокультура | 24-72 ч |
| Лихорадка | 2 — 5 дней |
| Лейкоцитоз | 5- 10 дней |
| Хрипы в легких | 1 — 3 недели |
| Сухой кашель | 2 — 8 недель |
| Инфильтрация на рентгенограмме | 2 — 8 недель |
Еще более ошибочна тактика замены одного антибиотика на другой в подобных ситуациях, расцениваемых врачом как неэффективность назначенной антибактериальной терапии. У некоторых больных после исчезновения признаков интоксикации и даже регрессии воспалительных изменений в легких в течение длительного времени может сохраняться слабость, потливость, субфебрильная температура. Последняя расценивается врачом как проявление не полностью купированной бронхолегочной инфекции, что «подтверждается» рентгенологическими данными в виде изменения легочного рисунка или «остаточными явлениями пневмонии» и обычно влечет за собой назначение антибактериального препарата, несмотря на отсутствие изменений со стороны крови. Между тем подобная клиническая ситуация часто обусловлена вегетативной дисфункцией после легочной инфекции (постинфекционная астения) и не требует антибактериальной терапии, хотя, разумеется, в каждом конкретном случае необходимы тщательное обследование больного и расшифровка всей имеющейся симптоматики. Рекомендованная длительность применения антибактериальных препаратов при бронхолегочных инфекциях приведена в таблице 10. Таблица 10. Длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике.
| Заболевания | Рекомендованная длительность терапии (дни) |
| Стрептококковый тонзиллофарингит | 10* |
| Острый средний отит | 5-7** |
| Острый синусит | 10-14 |
| Обострение хронического бронхита | 7-10*** |
| Пневмония | 5-7**** |
| * | Показана эффективность цефуроксим аксетила, телитромицина и азитромицина при пятидневных курсах; бензатинпенициллин вводится однократно внутримышечно |
| ** | Показана эффективность цефтриаксона (50 мг/кг в сутки) в течение трех дней |
| *** | Показана эффективность новых фторхинолонов (левофлоксацин, моксифлоксацин) при пятидневных курсах |
| **** | Обычно рекомендуемые сроки леченая составляют три-четыре дня после нормализации температуры; средние сроки лечения — пять-десять дней. При стафилококковой этиологии пневмонии рекомендуется более длительный курс антибактериальной терапии — две-три недели; при атипичной пневмонии (микоплазменная, хламидийная, легионеллезная) предполагаемая длительность антибактериальной терапии составляет 10-14 дней. |
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
© ХРИСТОЛЮБОВА Е.И., Л И. ВОЛКОВА
ОШИБКИ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ ВНЕБОЛЬНИЧНЫХ ПНЕВМОНИЙ
Е.И. Христолюбова, Л.И. Волкова
Сибирский государственный медицинский институт, г. Томск, ректор — д.м.н., проф.
В.В. Новицкий
Резюме. Проведён ретроспективный анализ медицинской документации: амбулаторные карты 438 больных, обратившихся в поликлиническое отделение, и 104 истории болезни, госпитализированных в пульмонологическое отделение с диагнозом «Внебольничная пневмония» (ВП). Проанализированы ошибки антибактериальной терапии (АБТ): выбор стартовой, определение её длительности, сроков коррекции, назначение режима дозирования антибактериального препарата (АБП). Внедрение в практику врачей стандартов лечения ВП приводит к улучшению качества лечения и уменьшению количества ошибок (АБТ).
Ключевые слова: внебольничная пневмония, ошибка антибактериальной терапия.
Внебольничная пневмония (ВП) является распространённым заболеванием, встречающимся в практике врачей-терапевтов и требующим лечения на разных этапах оказания медицинской помощи — как в поликлинике, так и в стационаре [8]. По данным литературы, внедрение в практику врачей стандартов лечения внебольничных пневмоний приводит к улучшению качества лечения и уменьшению количества ошибок антибактериальной терапии (АБТ) [3, 4, 9].
Однако, несмотря на имеющиеся рекомендации по лечению больных ВП, представленные в «Стандартах (протоколах) диагностики и лечения больных с неспецифическими заболеваниями лёгких» [5], в Федеральной программе по диагностике и лечению внебольничной пневмонии у взрослых в России [7], врачи допускают существенные и многочисленные ошибки в лечении этого заболевания [4, 10]. Это относится как к выбору стартовой антибактериальной терапии (АБТ), так и к определению её длительности, сроков коррекции, назначению режима дозирования антибактериального препарата (АБП). В литературе представлены единичные работы, посвящённые анализу
ошибок АБТ пневмоний после введения в действие «Стандартов (протоколов) диагностики и лечения больных с неспецифическими заболеваниями лёгких» [5].
Материалы и методы С целью оценки качества АБТ и ее ошибок, совершаемых врачами при лечении больных ВП, нами проведён ретроспективный анализ медицинской документации, которая ведётся врачами в поликлиническом и пульмонологическом отделениях МКЛПМУ «Городская больница №3» г. Томска. Были изучены амбулаторные карты 438 больных, обратившихся в поликлиническое отделение, и 104 истории болезни госпитализированных в пульмонологическое отделение с ВП. Для того, чтобы определить результативность внедрения рекомендаций по лечению ВП, представленных в Стандартах [5], мы проанализировали ошибки АБТ за периоды 1999-2000 гг. (333 больных) и 2005 г. (105 больных).
Возраст больных, получивших лечение в условиях поликлиники, составил от 16 до 84 лет (средний возраст 43,03±17,75 лет), из них мужчин было 60%. По возрасту больные распределились следующим образом: 16-19 лет — 9%; 20-29 — 21,7%; 30-39 — 16%; 40-49 -17,4%; 50-59 — 15,4%; 60-69 — 13%; 70 и старше — 7,5%. Итак большинство больных было трудоспособного возраста. Работающие больные составили 58,3%; учащиеся и студенты — 12,7%; пенсионеры — 13,4%; инвалиды — 2,6%; неработающие
трудоспособного возраста — 13%. Сопутствующая патология (ИБС, гипертоническая болезнь, хронический пиелонефрит, сахарный диабет, хронический бронхит, бронхиальная астма и др.) имела место в 39,4% у больных в возрасте 29 лет и старше. Наиболее частой была патология сердечно-сосудистой системы.
Возраст больных, госпитализированных в стационар, составил от 16 до 87 (средний возраст 54,95±19,12) лет, из них мужчин было 51,6%. По возрасту больные распределились следующим образом: 16-19 лет — 8%; 20-29 — 9,7%; 30-39 — 9,7%; 40-59 -17,7%; 60-69 — 15,3%; 70 и старше — 29,1%, из них больные трудоспособного возраста составили 55,6%. Работающие больные составили 26,6%, пенсионеры — 46%, инвалиды -4%, неработающие трудоспособного возраста — 14,5%, учащиеся и студенты — 6,5%, лица без определённого места жительства — 2,4%. Таким образом, большую часть госпитализированных больных составили неработающие лица (73,4%).
Результаты и обсуждение Ошибки антибактериальной терапии внебольничной пневмонии в условиях поликлиники. Выбор стартовой антибактериальной терапии является одним из важных вопросов, определяющих исход пневмонии [1, 6]. В качестве ошибок АБТ мы расценивали факты несоблюдения протоколов АБТ, изложенных в Стандартах [5].
Как в 1999-2000 гг., так и в 2005 г. назначение АБП выполнялось в большинстве случаев согласно протоколу, изложенному в Стандартах диагностики и лечения больных с неспецифическими заболеваниями лёгких. Процентное соотношение препаратов выбора стартовой АБТ в обоих периодах времени было одинаковым: «по Стандартам» — 77,2% и 78% и «не по Стандартам» — 22,8% и 22% соответственно (р>0,05). Среди препаратов стартовой АБТ «по Стандартам» в обоих анализируемых периодах преобладали препараты группы пенициллинов (75,9% и 60,9%). Однако в 2005 году достоверно чаще стали назначаться препараты группы макролидов: 37,8 % в 2005 году против 24,1% в предыдущих анализируемых годах (р=0,03). Имелись и качественные различия в выборе АБП. Так в 1999-2000 гг. из препаратов группы пенициллинов чаще назначался ампициллин внутрь и парентерально. Ни в одном случае не был назначен амоксициллин. Из препаратов группы макролидов чаще назначался эритромицин в таблетках. В 2005 г. применялись более эффективные АБП: основным назначаемым препаратом группы пенициллинов стал амоксициллин, из группы макролидов — мидекамицин, спирамицин. Эритромицин не был назначен ни в одном случае. В тех случаях, когда АБ назначались не по протоколу, в обоих анализируемых периодах чаще назначался ципрофлоксацин (ципролет) в таблетированном виде, что было ошибочным, так как он обладает низкой активностью в отношении пневмококковой инфекции [6]. Обращает на себя внимание то, что в 2005 г. уменьшилось назначение гентамицина по сравнению с таковым в 1999-2000 годах: (0,9% против 3,3%), применение которого в амбулаторных условиях считается распространённой грубой ошибкой [7] (рис. 1).
При выборе стартовой АБТ при ВП в амбулаторных условиях рекомендуется пероральное назначение одного АБП [7]. Анализ показал, что в 2005 г. стала формироваться тенденция к более редкому парентеральному назначению антибактериальных препаратов: 11,4% в 2005 против 21,2% в предыдущих
рассматриваемых в аналитическом аспекте годах (р=0,05). Одновременное назначение двух антибиотиков в 1999-2000 гг. наблюдалось крайне редко, а в 2005г. этого не наблюдалось.
Одним из основных критериев оценки адекватного выбора стартового АБП является положительная динамика клинических симптомов и, в первую очередь, нормализация температуры тела. Показателем неадекватного выбора стартовой АБТ является факт изменения ее из-за отсутствия положительной клинической симптоматики. Оценка эффективности стартовой АБТ была проведена по факту смены АБТ. В период 1999-2000 гг. анализировались 224 наблюдения, в 2005г. — 84 (исключены госпитализированные больные).
В 1999 — 2000 гг. смена стартовой АБТ из-за её неэффективности проведена у 67 (29,9%) больных. Большинству — 170 (75,9%) больных первоначальная АБТ была назначена согласно Протоколу, у остальных — 54 (24,1%) она не соответствовала Стандартам. В тех случаях, когда АБ был назначен согласно Стандартам, необходимость в смене первоначального антибиотика из-за его неэффективности возникла у 44 (25,8%) больных. Практически у всех этих больных АБ первого выбора были ампициллин в таблетках, низкая эффективность которого в настоящее время доказана, и эритромицин в таблетках, причём последний — в недостаточной суточной дозе. У тех больных, которым была назначена АБТ, не соответствующая Стандартам, необходимость смены АБ возникла достоверно чаще — в 23 (42,6%) наблюдениях, (р=0,01). У больных этой группы препаратом выбора в большинстве случаев был ципролет. У больных ВП, получавших лечение в 2005 году, смена первоначальной АБТ производилась достоверно реже, чем в предшествующие годы — только у 8 (9,5%, р<0,001) больных, причём в большинстве случаев стартовым АБП был также ципролет.
При смене АБП, так же как и при назначении стартовой терапии, допускались ошибки в выборе: у 20 (29,8%) больных выбирался антибиотик, не соответствующий Стандартам: ципролет, доксициклин, гентамицин, цефазолин. Смена АБ проводилась дважды к 5 (7,5 % больных), при этом во всех случаях выбирался АБП, не соответствующий рекомендациям.
Ошибки дозирования АБП — это назначение неправильных доз и неправильный режим назначения (кратность приёма) препаратов. Недостаточная доза АБ не только является одной из причин неэффективности терапии, но и создаёт предпосылки для формирования резистентности микроорганизмов [10]. Дозирование АБП анализировалось у 400 больных ВП (в 333 — первоначальное назначение и в 67 — повторное) в 1999-2000 гг. и у 113 (в 105 -первоначальное назначение и в 8 — повторное) в 2005 г. При определении адекватной дозы АБ, назначаемых при ВП, мы руководствовались рекомендациями Л.И. Дворецкого и С.В. Яковлева [2]. В 1999-2000 гг. ошибки в выборе адекватной дозы АБП имели место у 64 (16%) больных, а в 2005г. — только у 4-х (3,6%), что было достоверно реже (р <0,001) (табл.1). Ошибочный выбор дозы АБП заключался в следующем: назначение в таблетках ципролета в дозе 500 мг в сутки; эритромицина — 1,0 г в сутки; ампициллина в таблетках в дозе 1 — 1,5 г в сутки; мидекамицина в дозе 0,8 г в сутки. В 2005 г. наблюдались аналогичные ошибки дозирования при назначении ципролета и мидекамицина.
Неправильный режим назначения (кратность приёма) антибактериального препарата в 1999-2000 гг имел место в 15 (3,7%) наблюдениях. В основном это было двух- и
трёхкратное назначение ампициллина и пенициллина. В 2005 г. таких ошибок не наблюдалось.
Таблица 1
Ошибки в выборе адекватной дозы антибиотика
Антибиотик Рекомендуемая доза, в сут. Ошибочная доза, в сут. Количество случаев
1999-2000 2005
1 2
п % п %
Ципролет 1,0 0,5 35 8,8 1 0,95
Эритромицин 2,0 1,0 24 6,0 0
Ампициллин 2,0 — 3,0 1,0 — 1,5 4 1 0
Мидекамицин ,4 2, — ,2 0,8 1 0,25 3 2,8
Всего ошибок дозирования 64 16,0 4 3,6*
Примечание: *р<0,001
Назначение нистатина, являющееся, согласно данным литературы, одной из распространённых ошибок при проведении АБТ [7], наблюдалось всего в 6 (1,5%) наблюдениях, а в 2005 г. таких назначений не было.
Одной из ошибок АБТ является её необоснованно длительные сроки из-за сохранения аускультативных данных, изменённых лабораторных показателей, рентгенологических признаков лёгочной инфильтрации при отсутствии температурной реакции [6]. Этот показатель был проанализирован у 224 больных ВП, которые получали курс АБТ в условиях поликлиники в 1999-2000 гг. В анализируемой группе необоснованно длительное назначение АБП имело место у 17 (7,6%) больных. У 13 из них основанием для продолжения АБТ послужила сохраняющаяся после контрольного рентгенологического исследования инфильтрация в лёгочной ткани, у 2 — отсутствие динамики аускультативной картины (наличие влажных хрипов), у 2 — сохранение изменённых лабораторных показателей (ускорение СОЭ).
Ошибки антибактериальной терапии внебольничных пневмоний на госпитальном этапе. У больных, получавших лечение в стационаре, выбор стартового АБП согласно Стандартам имел место у 101 (97,1%) больного и не соответствовал им — лишь у 3 (2,9%). В большинстве случаев (96%) препаратами выбора были АБП группы пенициллинов (инъекционные формы ампициллина). То есть у госпитализированных больных выбор
стартовой антибактериальной терапии в основном соответствовал Стандартам. Тем не менее, у 44 (42,3%) больных стартовая АБТ была неэффективной, в связи с чем проводилась смена АБП. Из-за отсутствия клинического эффекта у 26 больных была проведена однократная смена АБ, при этом сохранялась монотерапия, либо назначались два АБП. У 18 больных выполнялась двухкратная смена АБ, и назначалось последовательно 3-4 АБП. Одновременно назначались не более двух АБП. При смене стартовой АБТ у 67 больных имело место назначение второго и третьего АБП, из них у 51 (76%) назначались неадекватные АБП (в 46,2% — ципролет в таблетках).
Для выяснения причин неэффективности была проанализирована вся группа больных (44) ВП, которым осуществлялась смена стартового АБП. Анализ показал, что во всех случаях имела место недооценка тяжести ВП при первичном осмотре лечащим врачом. Установлено, что у 35 (79,5%) больных отмечались факторы, отягощавшие течение пневмонии, которые не были учтены врачом при выборе стартового антибиотика. У 23 (52,3%) из них имелась сопутствующая патология: хронический бронхит, бронхиальная астма; у 16 (36,4%) уже имелись осложнения: у 7 (15,9%) — двустороннее поражение, у 9 (20,4%) — абсцедирование, у 7 (15,9%) — экссудативный плеврит. Лейкоцитоз у этих больных составил в среднем (10,3±1,2 -109/л, причём у 14 из них он равнялся 11,0-109/л и более). У двух больных отмечалась выраженная лейкопения с количеством клеток белой крови менее 2,0-109/л.
Важным критерием адекватности стартовой АБТ является нормализация температуры тела. Оценка эффективности первоначальной АБТ по этому показателю проведена у 64 больных. У большей части из них (56,2%) наблюдалась нормализация температуры в течение первых четырёх суток АБТ. Позднее 4-го дня снижение температуры
наблюдалось в 43,8% случаев. Сохранение повышенной температуры тела более 4-х дней после назначения АБП у значительной части больных свидетельствовало о формальном подходе к выбору стартовой АБТ, без должной оценки сопутствующей патологии, развития осложнений и оценки тяжести заболевания. Несмотря на тот факт, что в большинстве случаев выбор АБ соответствовал Стандартам, чаще всего препаратом выбора был ампициллин, который не действует на атипичные микробы.
Средняя продолжительность АБТ в стационаре составила 12,7 ± 4,4 дня.
Необоснованно избыточная АБТ, которая продолжалась от 3 до 8 (в среднем 4,7 ±1,5) дней, обнаружена у 8 (7,7%) больных. В 2 наблюдениях в качестве причины этого указаны сохраняющиеся изменённые лабораторные показатели (ускорение СОЭ), в одном -наличие остаточных явлений, выявленных при контрольном рентгенологическом
исследовании, в остальных — аргументации не было. В условиях стационара преобладал парентеральный способ введения АБП, ошибок дозирования их выявлено не было.
Таким образом наиболее частой ошибкой АБТ при лечении больных ВП на этапе поликлиники был неадекватный выбор АБП при назначении стартовой АБТ и при смене АБ. Ошибки дозирования, профилактическое назначение противогрибковой терапии (нистатина) в поликлинике отмечены редко. В условиях стационара таких ошибок не было. В ряде случаев врачи поликлиники и стационара допускали необоснованно длительное назначение АБТ. Основной ошибкой АБТ при лечении больных ВП в стационаре является недооценка тяжести течения ВП и влияния сопутствующей патологии, и в связи с этим был сделан неадекватный выбор стартового АБП.
Все эти ошибки относятся к субъективным, их причиной является недостаточное знание врачей. После введения Стандартов наблюдается уменьшение количества ошибок, допускаемых врачами в лечении ВП в условиях поликлиники. Использование врачами поликлиник и стационаров современных стандартов по ведению больных с ВП позволяет уменьшить количество ошибок в лечении этого заболевания, а также оптимизировать выбор АБП.
Таким образом при проведении экспертизы качества лечения больных с внебольничными пневмониями экспертами страховых компаний следует учитывать соблюдение врачами современных стандартов по диагностике и лечению этого заболевания.
ERRORS OF ANTIBACTERIAL THERAPY OF OUT-PATIENT PNEUMONIA
E.I. Hristolyubova, L.I. Volkova Siberian state medical university
Retrospective analysis of medical documentation was made: 438 case histories of out-patients and 104 case histories of patients were admitted to the pulmonology department with diagnosis community-acquired pneumonia. The errors of antibacterial therapy were analyzed: the choice of initial therapy, its duration, correction term, the dose of antibacterial drug. Inculcation in practice of treatment standards leads to improvement of treatment quality and decrease of quantity of errors.
Литература
1. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: пособие для врачей / А.Г. Чучалин, А.И. Синопальномков,
Яковлев С.В. и др. // Клинич. микробиол. и антимикроб. Химиотерапия. — 2003. — №5. —
С. 198-224.
2. Дворецкий Л.И., Яковлев С.В. Ошибки антибактериальной терапии инфекций дыхательных путей в амбулаторной практике //Леч. врач. — 2003. — №8. — С.48-54.
3. Назаренко Г.И., Антипин А.Н., Новиков Ю.К. Антибактериальная терапия внебольничных пневмоний (анализ литературы и собственных данных, клиническая эффективность рекомендаций) // Пульмонология. — 2004. — №4. — С. 60-66.
4. Представления врачей поликлиник об этиологии и тактике лечения внебольничной пневмонии в амбулаторных условиях / С.А. Рачина, С.Н. Козлов, Е.А. Иделевич и др. // Пульмонология. — 2004. — №2. — С. 6-12.
5. Стандарты (протоколы) диагностики и лечения больных с неспецифическими заболеваниями лёгких (взрослое население). — М., 1998. — С. 33-47.
6. Страчунский Л. С. Антибактериальная терапия внебольничной пневмонии в амбулаторных условиях // Consil. Medicum. — 2002. — Т.4, №4. — С.180-185.
7. Федеральная программа по диагностике и лечению внебольничной пневмонии у взрослых в России / Consil. medicum. — Экстра-выпуск. — 21c. — // www. consilium medicum.com
8. Чучалин А.Г., Синопальников А.И., Страчунский Л.С. Пневмония. — М.: ООО «Мед. информац. агентство», 2006. — С. 17-49.
9. Barlow G., Nathwani D., Davey P. The effect of implementing the British Thoracic Society community-acquired pneumonia guidelines on antibiotic prescribing and costs in a UK teaching hospital // Clin. Microbiol. Infect. — 2006. — Vol. 12, N 5. — P. 498-500.
10. Management of patients with community-acquired pneumonia in a primary care hospital: a critical evaluation / S. Ewig, K. Seifert, T. Kleinfeld et al. // Respir. Med. — 2000. — Vol. 94, N6. — P. 556-563.
%
20
18
16
14
12
10
8
6
4
2
0
18,3
4
16,2
Т2 34
6,8
3,8
0,9
0 0
у— 2,3
0 0 0,6 1 т 1,1 г. и
0
0,6 а
0
1999 2000 2005 1999 2000 2005.1999 2000 2005 1999 2000 2005 1999 2000 2005 1999 2000 2005
^——————‘ 4———у———‘ <——-^’ «Ч________________________■> V—————-‘ V——————V
Ципрофлоксацин/
ципролет
Гентамицин
Цефазолин
V
Ампиокс
V
Канамицин
«V»
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Доксициклин
Рис. 1. Препараты стартовой антибактериальной терапии, назначенные терапевтами поликлиники для лечения внебольничной пневмонии, но не соответствующие стандартам.
Согласно И.В. Давыдовскому, «врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Сегодня врачебная ошибка трактуется как неправильные действия или бездействие врача при исполнении им своих профессиональных обязанностей, не являющиеся следствием его недобросовестности и не содержащие состава преступления или признаков проступка.
Согласно И.В. Давыдовскому, «врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Сегодня врачебная ошибка трактуется как неправильные действия или бездействие врача при исполнении им своих профессиональных обязанностей, не являющиеся следствием его недобросовестности и не содержащие состава преступления или признаков проступка.
Врачебные ошибки могут быть нескольких видов. 1. Диагностические, т.е. связанные с постановкой диагноза. 2. Лечебно–тактические: сюда входят ошибки в выборе методов исследования и в оценке их результатов. 3. Лечебно–технические: это неполное обследование больного и ошибки диагностических или лечебных манипуляций. 4. Организационные: сюда включаются неправильная организация рабочего места и лечебного процесса. 5. Ошибки ведения медицинской документации. 6. Ошибки поведения медицинского персонала.
Практически все виды вышеперечисленных ошибок совершаются врачом на различных этапах курации больных внебольничной пневмонией (ВП) – заболеванием потенциально курабельным, но тем не менее являющимся причиной летального исхода у 5–30% заболевших. По данным ВОЗ, пневмония занимает 4–е место в структуре причин смертности. В США ежегодно регистрируют от 5 до 6 млн случаев этого заболевания у взрослых. По данным официальной статистики по РФ, формирующейся на основании анализа отчетов лечебных учреждений, заболеваемость ВП среди взрослых несколько превышает 400 тыс. случаев, что скорее всего значительно ниже реальной заболеваемости. Согласно расчетным данным, ежегодно в РФ возникает не менее 1,5 млн случаев ВП, хотя вполне вероятно, что это тоже далеко от истинной ситуации.
Основные ошибки ведения пациентов с пневмонией могут быть сведены к следующим:
– диагностика и верификация пневмонии;
– оценка тяжести заболевания;
– выбор антибактериального препарата;
– оценка эффективности назначенного антибактериального препарата;
– коррекция антибактериальной терапии;
– длительность антибактериальной терапии;
– полипрагмазия при лечении больных пневмонией.
Диагностика и верификация пневмонии
Уже при первом контакте с больным врача подстерегают опасности совершения ошибок, связанных с диагностикой пневмонии в качестве основной нозологической формы. По мнению академика РАМН проф. А.Г. Чучалина, «процент врачебных ошибок в России очень высок, более 30%. Так, например, из 1,5 млн заболеваний пневмонией диагностируется не более 500 тыс. Причин тому несколько, в том числе и полное отсутствие в стране системы контроля качества оказания врачебной помощи».
Диагностика ВП основывается на умении врача своевременно выявлять и правильно трактовать ряд признаков, являющихся критериями и составляющих так называемый золотой стандарт диагностики ВП – кашель, лихорадка (свыше 3 суток), клинические признаки легочного инфильтрата, лейкоцитоз, рентгенологические признаки легочного инфильтрата. Поскольку последние два признака не могут быть оценены при первичном осмотре, то, по мнению экспертов Британского торакального общества, для своевременной диагностики ВП может быть достаточно трех других признаков. Несмотря на, казалось бы, однозначность и доступность вышеуказанных диагностических критериев диагностика ВП, прежде всего в системе первичного звена (врач–терапевт), остается в настоящее время несовершенной. Около 30% случаев пневмонии диагностируются поздно или вообще не диагностируются. Причины поздней или ошибочной диагностики ВП можно условно разделить на объективные и субъективные. Так, несвоевременное обращение больного к врачу в силу различных причин может быть одной из причин поздней диагностики. С другой стороны, возможно атипичное течение пневмонии, при котором на первый план выступает внелегочная симптоматика, признаки декомпенсации сопутствующей патологии (сердечная недостаточность, сахарный диабет и др.). Такие ситуации нередко встречаются у лиц пожилого и старческого возраста, а также у больных, страдающих различными хроническими заболеваниями. Однако основным источником ошибок в диагностике ВП является недостаточная компетентность врача, которая сказывается в несовершенстве умения и навыков выявления клинических признаков (перкуторных, аускультативных) легочного инфильтрата, неправильной трактовке выявленных симптомов, затянувшемся обследовании больного. Основными дифференциально–диагностическими проблемами остаются заболевания с синдромно сходной симптоматикой (туберкулез, опухолевые заболевания, пневмониты неинфекционной природы, интерстициальные заболевания легких, ТЭЛА и некоторые другие). Невыполнение рекомендаций, возведенных в ранг стандартов диагностики пневмонии, само по себе считается ошибкой (лечебно–технические ошибки в виде неполного обследования больного по И.В. Давыдовскому). К таким диагностическим стандартам относится рентгенологическое исследование грудной клетки у больных с подозрением на пневмонию до начала лечения. Между тем анализ качества диагностики пневмонии в различных регионах России свидетельствует о том, что данное исследование проводилось лишь у незначительного количества больных до начала антибактериальной терапии (АТ) [1]. К этой же категории ошибок на этапе диагностики заболевания относится отсутствие бактериологического исследования мокроты и крови у госпитализированных больных пневмонией.
Таким образом, врачи не всегда следуют имеющимся клиническим рекомендациям по диагностике пневмонии, что может быть обусловлено недостаточным знакомством или вообще незнанием и игнорированием таковых.
Оценка тяжести ВП и принятие решения о месте лечения больного
Ошибки в определении тяжести ВП не позволяют адекватно оценить прогноз заболевания у больного и обосновать тактику лечения. Прежде всего, тяжесть пневмонии определяет место пребывания пациента с ВП (амбулаторное или стационарное лечение). Более того, в случае необходимости госпитализации степень тяжести заболевания позволяет врачу принять решение о переводе больного в ОРИТ. Общепринятыми показаниями для госпитализации больных ВП являются наличие дыхательной недостаточности, декомпенсация сопутствующей патологии (сердечная недостаточность, сахарный диабет и др.), невозможность обеспечить адекватное лечение и уход в домашних условиях
Тяжесть пневмонии является одним из клинических ориентиров для выбора антибактериального препарата (АП), адекватного данной ситуации. Практически все рекомендации по антибактериальной терапии ВП приводятся с учетом тяжести течения заболевания.
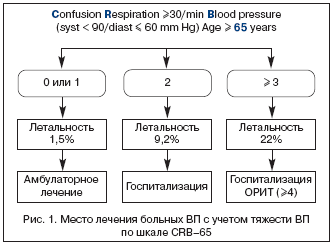
Предложены различные системы–шкалы, позволяющие оценить тяжесть пневмонии (РОRT, PSI, CURB, CURB–65). Некоторые шкалы громоздки, трудны для быстрой оценки и принятия решения. Наиболее практически приемлемой для оценки тяжести ВП можно считать шкалу СURB–65 (Confusion – спутанность, Urea – уровень мочевины в крови, Respiration – число дыханий/мин. – >30/мин., Blood pressure – артериальное давление: систолическое ≤90 мм рт. ст., диастолическое ≤60 мм рт. ст. Age >65 лет), однако она требует определения показателя мочевины в крови, что практически малореально в условиях первичного врачебного звена. С учетом этого можно использовать шкалу CRB–65, позволяющую прогнозировать летальность и, следовательно, определять показания к госпитализации либо в общетерапевтические отделения, либо в ОРИТ (рис. 1).
Антибактериальная терапия внебольничной пневмонии
Пожалуй, на этапе принятия решения о назначении АТ больным пневмонией совершается наибольшее число ошибок, касающихся различных аспектов АТ. К таким ошибкам относятся:
– своевременность начала АТ;
– выбор АП (доза, режим дозирования, путь введения и др.);
– оценка первоначальной эффективности АП;
– необходимость коррекции АТ;
– длительность АТ.
Сроки начала АТ пневмонии являются одним из факторов, влияющих на конечные результаты лечения. Особенно важным является как можно более раннее назначение АП больным пожилого и старческого возраста в связи с более тяжелым течением пневмонии и худшим прогнозом. Показано, что смертность в первые 30 дней среди больных тяжелой пневмонией в возрасте старше 65 лет, у которых АТ была начата в первые 8 ч с момента поступления, была значительно ниже по сравнению с больными, которым антибиотик назначался в более поздние сроки [2]. В другом исследовании отмечено значительное снижение смертности среди больных пневмонией, госпитализированных в отделение интенсивной терапии, у которых АТ начиналась в течение 4 ч с момента поступления по сравнении с более поздним началом лечения [3]
Несвоевременное начало АТ у госпитализированных больных ВП было отмечено при анализе качества ведения больных ВП в некоторых регионах России [1].
Выбор АП. Наиболее важным и ответственным решением, от которого во многом зависит эффективность лечения и исход заболевания, является выбор первоначального АП.
Между тем обращает на себя внимание частое несоответствие стартового АП принятым клиническим рекомендациям, составляющее, по некоторым данным, 22,8%, а также недостаточная суточная доза АП (18,6%) или неадекватный режим дозирования (5,6%) [4]. По данным НИИ АХ СГМУ (2007), у 85% больных тяжелой ВП стартовый АП не соответствовал клиническим рекомендациям, внутривенное введение АП назначалось только в 59% случаев, а у большинства пациентов (68%) АТ проводилась в режиме монотерапии. Несмотря на достаточную осведомленность врачей о препаратах выбора при лечении ВП в реальной амбулаторной практике назначение АП не всегда соответствует современным рекомендациям (высокая частота назначения ципрофлоксацина, цефазолина, парентеральных цефалоспоринов III поколения, «увлечение» макролидами в ущерб b–лактамам). Если для врача основными критериями выбора АП является эффективность и удобный режим приема, то для пациентов это эффективность и возможность перорального приема [1].
Ошибочным следует считать назначение больным ВП следующих АП:
• цефалоспорины I поколения;
• аминогликозиды (гентамицин);
• ранние фторхинолоны (ципрофлоксацин);
• тетрациклины (высокий уровень устойчивости);
• ко–тримоксазол (высокий уровень устойчивости, побочные эффекты);
• ампициллин внутрь (низкая биодоступность);
• ампиокс;
• клиндамицин.
Тем не менее, по данным Л.В. Юдиной [4], цефалоспорины I поколения при лечении ВП назначались 12,4% больным, фторхинолоны II поколения (главным образом ципрофлоксацин) – 17,4%, аминогликозиды – 7,4%, ко–тримоксазол – 6,6%, рифампицин и доксициклин – по 4,1%, линкомицин – 1,7%
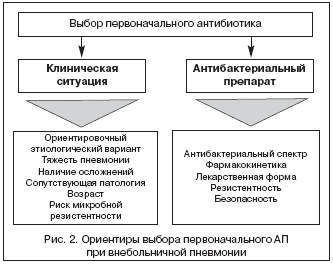
В подавляющем большинстве случаев врач принимает решение о выборе первоначального антибиотика, не имея данных о характере возбудителя пневмонии, а зачастую и перспектив получения таких данных. С учетом этого АТ носит не целенаправленный, а эмпирический характер, в чем должен отдавать себе отчет врач, курирующий больного ВП. В реальной клинической практике выбор первоначального АП для лечения больных ВП должен определяться, с одной стороны, клинической ситуацией, а с другой – свойствами самого АП (рис. 2).
При амбулаторном ведении больных ВП, согласно рекомендациям Российского респираторного общества, следует выделять две группы пациентов:
1–я группа – больные в возрасте до 60 лет без сопутствующей патологии;
2–я группа – больные старше 60 лет с наличием различной сопутствующей патологии (ХОБЛ, сахарный диабет, хроническая алкогольная интоксикация и др.), которая с одной стороны может определять этиологический вариант (риск наличия грамотрицательной флоры) ВП, а с другой – прогноз заболевания. У больных этой группы выше риск антибиотикорезистентности микроорганизмов (пенициллинорезистентность S. pneumoniae, выработка b–лактамаз грамнегативными микроорганизмами).
Больным 1–й группы рекомендовано назначение внутрь амоксициллина или макролидов с оптимальной фармакокинетикой (азитромицин, кларитромицин). Макролиды предпочтительнее при непереносимости β–лактамных антибиотиков или при подозрении на ВП, вызванную атипичными микроорганизмами (микоплазма, хламидия). В качестве альтернативных АП у этой группы больных возможно назначение внутрь респираторных фторхинолонов (Таваник, моксифлоксацин, гемифлоксацин). Несмотря на неактивность аминопенициллинов в отношении атипичных возбудителей, клинические исследования не выявили различия в эффективности между аминопенициллинами, различными макролидами и респираторными фторхинолонами [5].
Больным 2–й группы также рекомендуется АТ внутрь с использованием защищенных пенициллинов (амоксициллин/клавуланат, амоксициллин/сульбактам), комбинация защищенных пенициллинов с макролидами или респираторные фторхинолоны в режиме монотерапии. Преимущество парентерального введения АП в амбулаторном лечении ВП не доказано.
Госпитализированным больным с более тяжелым течением заболевания следует назначать АП парентерально. Общепринято применение β–лактамов (амоксициллин, защищенные пенициллины, цефалоспорины II–III поколений) в сочетании с макролидами (азитромицин, кларитромицин). Летальность при внебольничных пневмониях, особенно среди больных пожилого возраста, ниже при назначении комбинированной терапии цефалоспоринами II–III поколения в сочетании с макролидами по сравнению с монотерапией цефалоспоринами III поколения. Доказано, что комбинированная АТ β–лактамами и макролидами улучшает прогноз больных ВП, сокращает сроки пребывания в стационаре, что делает оправданной подобную комбинацию [6]. Альтернативными АП могут быть респираторные фторхинолоны (левофлоксацин – Таваник, моксифлоксацин). Имеются данные о том, что Таваник в режиме монотерапии оказывает клинический и бактериологический эффект, сравнимый с комбинацией β–лактамов и макролидов [7–9].
В одном из последних метаанализов сравнивалась эффективность комбинированной АТ β–лактамами и макролидами с респираторными фторхинолонами (Таваник) в режиме монотерапии [10]. Анализу были подвергнуты результаты 23 рандомизированных контролируемых исследований, включивших 7885 больных. По результатам проведенного метаанализа было установлена более высокая клиническая эффективность респираторных фторхинолонов по сравнению с комбинированной АТ больных тяжелой ВП. В то же время при лечении пациентов с нетяжелой пневмонией респираторные фторхинолоны не имели преимуществ перед комбинированной АТ. Если у госпитализированных больных (тяжелая ВП) при приеме респираторных фторхинолонов внутрь не отмечено различий между двумя исследуемыми группами, то при внутривенном введении респираторные фторхинолоны оказывали более выраженный клинический и бактериологический эффект по сравнению с комбинацией β–лактамов и макролидов. Кроме того, по результатам метаанализа, побочные эффекты, особенно со стороны желудочно–кишечного тракта, регистрировались достоверно реже. Следует отметить, что в большинстве исследований, включенных в метаанализ, левофлоксацин (Таваник) применялся в суточной дозе 500 мг.
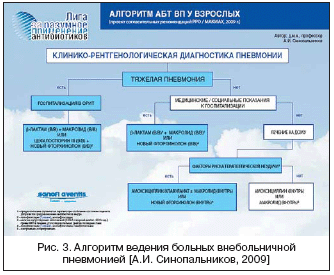
На рисунке 3 представлен алгоритм АТ больных ВП в соответствии с последними рекомендациями Российского респираторного общества и МАКМАХ.
Дозирование АП. Нередко встречаются ошибки в выборе дозы назначенного АП без учета тяжести пневмонии. В недостаточной суточной дозе АП назначался у 18,6% больных ВП [11].
Стандартные дозы β–лактамов и других АП у больных тяжелой ВП могут оказаться недостаточно эффективными. Наличие признаков сепсиса и септического шока при тяжелой ВП требует назначения более высоких доз β–лактамов (амоксициллин/клавуланат 1,2–2,4 г 2–3 раза/сут.; цефотаксим 2–3 г 2–3 раза/сут.) или Таваника (500 мг/сут.). При тяжелой ВП дозирование АП имеет свои особенности в отношении как суточных доз, так и кратности введения. Предпочтительным путем введения АП у данной категории пациентов является внутривенное введение.
Путь введения АП определяется многими факторами, в том числе тяжестью пневмонии, состоянием больного, фармакокинетической характеристикой АП и др. Если в целом ряде ситуаций при инфекциях нижних дыхательных путей парентеральный путь введения не имеет альтернативы (нарушение сознания, стволовые расстройства с нарушением глотания, патология кишечника и др.), то в остальных случаях парентеральная АТ требует определенных показаний и должна быть обоснованной, а не произвольной. При достижении клинического эффекта от парентеральной АТ рекомендуется переход на оральную форму того же или сходного по антимикробному спектру другого антибиотика (ступенчатая терапия). Критериями для перехода с парентерального на оральный путь введения антибиотиков следует считать нормальные показатели температуры на протяжении 2–кратного измерения за последние 16 ч, нормальное количество лейкоцитов или тенденция к нормализации, субъективное улучшение (уменьшение кашля, одышки), стабилизация показателей дыхания и гемодинамики, отсутствие признаков нарушения всасывания [12]. Оптимальными сроками перехода с парентеральной на оральную терапию являются 48–72 ч. Для обеспечения комплайентности следует отдавать предпочтение антибиотикам с высокой биодоступностью и удобным режимом дозирования (1–2 раза/сут.). Таким требованиям отвечают современные респираторные фторхинолоны (Таваник, моксифлоксацин).
В то же время ошибочным является назначение АП внутрь с целью «облегчить и упростить» лечение как для больного, так и для среднего медперсонала без учета конкретной клинической ситуации и фармакокинетики АП. У больных с тяжелой пневмонией это может стать одной из причин недостаточного эффекта или вообще неэффективности лечения. Не следует назначать АП внутрь при тяжелых пневмониях, особенно препараты с низкой биодоступностью (ампициллин, цефуроксим аксетил), что не позволяет достигать оптимальной концентрации АП в крови. В то же время у больных нетяжелой ВП при отсутствии осложнений и фоновой патологии допустима оральная АТ. В подобных ситуациях парентеральный путь введения АП оказывается не только необоснованным, но и более дорогостоящим.
Оценка эффективности первоначального АП. При амбулаторном ведении больного ВП обязательной является оценка эффективности и переносимости назначенного АП (правило второго визита) через 48–72 ч. АТ внебольничной пневмонии следует считать неэффективной, если отсутствуют признаки клинической стабилизации, которыми считаются:
– температура – < 37,8 °С
– ЧСС <100 уд./ мин.
– систолическое АД >90 мм рт. ст.
– ЧД < 24 /мин.
– Sa02 > 90%
При анализе ведения больных ВП приходится нередко сталкиваться с такими ошибками, когда больной продолжает получать назначенный АП в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Необоснованно длительная АТ при отсутствии эффекта и необходимость смены АП наблюдалась у 20,6% [11]. Ошибочность подобной практики имеет немало негативных последствий. Во–первых, затягивается назначение другого, более адекватного АП, что способствует прогрессированию легочного воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией), развитию осложнений, удлинению сроков лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов АТ, развития антибиотикорезистентности. Не следует игнорировать и значение негативного влияния неэффективности проводимой терапии на больного и его родственников, влекущего за собой утрату доверия к врачу и потерю комплайенса. Очевидна и неэкономичность такой ошибочной тактики АТ (напрасный расход неэффективного АП, задержка пребывания больного в стационаре, дополнительные затраты на лечение токсических эффектов и др.).
При отсутствии эффекта в указанные сроки следует пересмотреть тактику АТ (замена амоксициллина на Таваник или добавление последнего к β–лактамному АП) или решить вопрос о госпитализации пациента.
Коррекция АТ. Наряду с серией ошибок при оценке эффективности АП встречаются ошибки при коррекции АТ, т.е. смене одного АП на другой. При отсутствии данных микробиологического исследования принцип выбора АП остается тем же самым, т.е. ориентировка на клиническую ситуацию с учетом, однако, неэффективности первоначального АП и других дополнительных признаков. Отсутствие эффекта от первоначального АП в известной степени должно быть дополнительным ориентиром, позволяющим обосновать выбор второго АП. Так, отсутствие эффекта от β–лактамных АП (пенициллины, цефалоспорины) у больного ВП позволяет предполагать или делает более вероятным предположение о легионелезной или микоплазменной пневмонии (с учетом, разумеется, других признаков). В свою очередь, это делает обоснованным назначение АП из группы макролидов (азитромицин, кларитромицин и др.) или респираторных фторхинолонов (Таваник, моксифлоксацин).
Во избежание ошибок при коррекции АТ следует иметь в виду возможные причины неэффективности АП, к которым относятся:
– неправильный диагноз (туберкулез, опухоль, отек легких и др.);
– наличие осложнений (легочные, внелегочные);
– тяжелая сопутствующая и фоновая патология;
– неадекватный первоначальный АП;
– неадекватный режим дозирования АП;
– антибиотикорезистентность;
– поздно начатая АТ.
Длительность АТ. По различным данным, необоснованно длительная антибиотикотерапия проводится у 11,5% [11]. Согласно рекомендациям IDSA/ATS (2007), больной ВП должен лечиться как минимум в течение 5 дней (уровень доказательности I), лихорадка должна стойко отсутствовать в течение 48–72 ч, при этом не должно быть более 1 признака клинической нестабильности (уровень доказательности II). При высокой вероятности «атипичной» пневмонии рекомендуется более продолжительная АТ, до 14 дней, хотя имеются данные об эффективности и более коротких курсов в подобных клинико–эпидемиологических ситуациях. Наличие таких признаков, как астения, субфебрилитет, неполное рентгенологическое разрешение пневмонии, отсутствие полного рентгенологического разрешения пневмонии и нормализации показателей СОЭ не должны являться показанием для продолжения АТ и тем более для назначения другого АП.
Полипрагмазия. Среди большинства врачей укоренилось ошибочное мнение о необходимости назначения больным ВП наряду с АП различных лекарственных средств (антигистаминные, иммуномодуляторы, витамины, НПВП, противогрибковые препараты и др.). Подобная полипрагмазия не имеет достаточной доказательной основы, а только лишь удорожает лечение и повышает риск побочных эффектов лекарственного лечения.
Так, например, одной из распространенных ошибок при проведении АТ пневмонии является назначение одновременно с АП противогрибковых средств с целью как профилактики грибковых осложнений, так и «лечения» кандидоза в случаях обнаружения в полости рта грибков из рода Сandida. Обычно назначается нистатин внутрь, что трудно объяснимо с позиций его фармакокинетики: этот АП обладает весьма низкой биодоступностью и практически не всасывается из ЖКТ. Действие нистатина в основном местное. Кроме того, врач при назначении нистатина ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза и факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.). В свое время Б.Е. Вотчал писал: «…кандидамикоз – это не грибки, а болезнь, т.е. должны быть не только грибки в мазке, но и симптомы кандидамикоза».
Учет различных клинических ситуаций. В повседневной клинической практике при назначении любого медикаментозного средства, в том числе и АП, приходиться учитывать многочисленные факторы конкретной клинической ситуации (возраст, сопутствующая патология, прием других медикаментов и т.д.), определяющей тактику АТ и ее особенности. Недоучет всех факторов и неадекватная оценка особенностей данной ситуации влечет за собой ошибки в АТ, наиболее часто встречающиеся при следующих ситуациях:
• возраст больных (дети, старики);
• беременность;
• тяжелая сопутствующая патология с функциональными нарушениями различных органов и систем;
• медикаментозная терапия сопутствующих заболеваний;
• аллергические реакции на различные АП.
Ошибочно назначение беременным фторхинолонов, клиндамицина, метронидазола для лечения пневмонии. Кроме того, с осторожностью должны назначаться аминогликозиды, ванкомицин, имипенем.
Наличие сопутствующей патологии в ряде случаев создает сложности в проведении АТ, что может приводить и к ошибкам в выборе АП, его дозировки, путях введения, длительности АТ и т.д. При этом в основе ошибок может лежать либо невыявление сопутствующей патологии, либо ее недооценка в отношении токсического влияния АП, либо, наконец, недостаточное знание фармакокинетических особенностей выбранного АП. При наличии у больного почечной недостаточности следует отдавать предпочтение выбору АП с преимущественно внепочечным выведением (цефоперазон) или с двойным путем элиминации (ципрофлоксацин). Ошибочно назначение потенциально нефротоксичных АП (аминогликозиты, карбапенемы) без корректировки дозы у больных с сопутствующей почечной недостаточностью. Опасно также в подобных ситуациях сочетание АП, обладающих нефротоксическими свойствами (аминогликозиды и цефалоспорины, за исключением цефоперазона).
Особенно следует учитывать наличие сопутствующей, нередко множественной патологии с функциональными нарушениями органов и систем у больных пожилого и старческого возраста. Возрастное снижение показателей клубочковой фильтрации наряду с высокой частотой нефроангиосклероза у пожилых должны быть одним из факторов, влияющих на выбор АП, что, к сожалению, не всегда учитывается в клинической практике.
При наличии достоверно установленной гиперчувствительности к пенициллину ошибочно назначение других b–лактамных АП (цефалоспорины, карбаменемы). Альтернативными АП могут быть фторхинолоны, макролиды. Однако следует иметь в виду, что нередко за «аллергию на антибиотики» принимаются реакции другого происхождения (сосудистые, вегетативные и др.), в связи с чем следует критически оценивать указания больных на такую «непереносимость» и более тщательно анализировать имеющуюся ситуацию. Вместе с тем опасны внутрикожные пробы на АП, поскольку существует такая же опасность тяжелых анафилактических реакций.
По данным исследования С.А. Рачиной и соавт. [1] об индикаторах качества ведения больных ВП, основные ошибки ведения госпитализированных больных ВП сводятся к следующим:
• рентгенологическое исследование позже 24 ч с момента поступления;
• отсутствие бактериологического исследования мокроты и крови (при тяжелых ВП) до назначения АП;
• задержка начала АТ более 8 ч с момента верификации диагноза;
• несоответствие режима АТ национальным рекомендациям;
• недостаточное использование режима ступенчатой терапии;
• отсутствие профилактики у пациентов из группы риска.
Современная ситуация, свидетельствующая об ошибках диагностики и ведения больных ВП, обусловлена многими причинами, и прежде всего недостаточным следованием клиническим рекомендациям (КР). Основными барьерами на пути внедрения КР по ведению больных ВП в практику врача–терапевта являются следующие [13]:
• недостаточная осведомленность врачей о существовании КР;
• недостаточное знакомство и знания КР;
• консервативность клинического менталитета врача;
• отсутствие у врачей мотивации;
• невозможность контроля преимущества следования КР в лечении больных ВП;
• неуверенность в улучшении исходов ВП в случаях следования КР.
В то же время следование КР способствуют повышению эффективности лечения и благоприятному исходу заболевания, а также уменьшают риск принятия ошибочных решений при ведении больных ВП. Имеются доказательные данные о том, что, если врач следует клиническим рекомендациям, доля неэффективной терапии уменьшается на 35–40%, а вероятность летального исхода – на 45% [14]. Таким образом, основными реальными путями, которые позволят избежать или по крайней мере минимизировать ошибки ведения больных ВП является строгое следование КР. С учетом этого первоочередной задачей органов здравоохранения и постдипломного обучения следует считать внедрение КР в практику врачей первичного звена здравоохранения, и прежде всего врачей–терапевтов [15].
В статье приведены существующие данные систематических обзоров и рандомизированных контролируемых исследований (РКИ) по использованию различных режимов антибактериальной терапии пиелонефрита и инфекций мочевыводящих путей. Продемонстрированы основные ошибки применения антибактериальных средств у детей с инфекцией мочевой системы в практике врачей-педиатров г. Казани с позиции доказательной медицины.
Согласно эпидемиологическим и популяционным данным, инфекции мочевой системы занимают ведущее место среди инфекций детского возраста после острых респираторных инфекций [1, 2]. Применение антибактериальных средств является основным компонентом терапии и этиотропным лечением инфекций мочевой системы [3]. До недавнего времени не было доказательных данных по эффективности различных режимов антибактериальной терапии инфекций мочевой системы у детей, и подходы к лечению основывались в основном на мнениях экспертов, сформировавшихся традициях, а выбор антибиотика обосновывали микробиологическими исследованиями по изучению активности in vitro [4]. Благодаря развитию рандомизированных контролируемых исследований (РКИ) стали появляться доказательные данные. Насколько результаты РКИ используются в практике врачей-педиатров — позволяют выявить фармакоэпидемиологические исследования, оценивающие качество антимикробной терапии в условиях реальной клинической практики.
Парентеральная или пероральная терапия
Обоснованность использования парентерального режима терапии в различных клинических ситуациях часто становится предметом дискуссий. В настоящее время среди врачей нет определенного согласия относительно выбора пути введения антибиотика: перорально (внутрь) или парентерально (внутривенно, внутримышечно). Результаты Кокрейновских систематических обзоров и рандомизированных клинических исследований, сравнивающих парентеральные и пероральные режимы антибактериальной терапии у детей с инфекцией мочевой системы, в том числе острым пиелонефритом, не нашли различий в частоте благоприятных исходов, времени разрешения острой симптоматики, эрадикации возбудителя, частоте развития рецидивов и повреждения почечной паренхимы [5-8].
По результатам фармакоэпидемиологического исследования, проведенного в г. Казани [Е.В. Юдина, А.И. Сафина, Л.Е. Зиганшина, 2005-2008 гг.] пероральная (аминопенициллины, включая ингибитор-защищенные; цефалоспорины II-III поколения) и парентеральная (аминогликозиды, цефалоспорины III поколения) антибактериальная терапия также были равноэффективны в активной стадии пиелонефрита у детей в условиях стационара, при этом выбор парентерального режима антибактериальной терапии был клинически необоснован в 29% случаев.
В Кокрейновских систематических обзорах было показано, что короткий курс стартовой парентеральной терапии с переходом на пероральный путь введения через 2-4 дня — равноэффективны по сравнению с длительной парентеральной терапией у детей с пиелонефритом. То есть, если пероральные антибактериальные средства не могут быть использованы (тяжелое состояние, невозможность приема внутрь, диспепсические явления) — оптимальным является внутривенное введение антибиотиков в течение 2-4 дней с дальнейшим переходом на пероральный режим [9]. Переход на пероральный режим антибактериальной терапии не должен откладываться до того момента, когда в дальнейшем продолжении лечения антибиотиками уже нет необходимости [10]. Как показало наше исследование, такой подход к лечению в практике педиатров практически не используется: при назначении парентеральных антибиотиков длительность использования парентерального режима в детских стационарах г. Казани в большинстве случаев (97%) была избыточна (в среднем 7-10 дней).
Хотя стандартное лечение тяжелых инфекций мочевой системы подразумевает проведение внутривенной антибактериальной терапии (по крайней мере, стартовой), появились исследования, которые показали, что и пероральная стартовая антибактериальная терапия также эффективна. Систематический обзор, включающий 15 РКИ, 1743 пациента (взрослые и дети), продемонстрировал отсутствие доказательств, что пероральная антибактериальная терапия при тяжелых инфекциях мочевой системы менее эффективна, чем парентеральная или стартовая парентеральная терапия. Было установлено, что путь введения антибиотика не определяет успех терапии [11].
Большинство современных пероральных антибиотиков характеризуются достаточным спектром активности, высокой биодоступностью, а также малой кратностью приема, что позволяет эффективно их использовать при лечении инфекционно-воспалительных заболеваний. При равной эффективности с парентеральными антибиотиками пероральные антибактериальные средства являются менее затратными. Снижение расходов при использовании пероральных антибактериальных средств обусловлено разницей в стоимости пероральных и парентеральных антибиотиков, значительным снижением стоимости введения антибиотика, уменьшением нагрузки на персонал, возможностью ранней выписки из стационара, снижением риска постинъекционных осложнений и внутрибольничного инфицирования. Кроме того, лечение для пациента становится более комфортным, что особенно важно в педиатрической практике [3, 8, 12].
Выбор антибиотика
В рандомизированных контролируемых исследованиях была исследована и доказана клиническая эффективность аминопенициллинов (ингибитор-защищенных), аминогликозидов, цефалоспоринов III поколения при остром пиелонефрите у детей. В результате проведенных исследований остались невыясненными вопросы эффективности антибактериальной терапии у детей с пузырно-мочеточниковым рефлюксом III-V степени, с рецидивирующими инфекциями мочевой системы, а также сравнительной эффективности различных пероральных антибактериальных средств [5, 7, 8, 11]. При инфекциях нижних отделов мочевой системы у детей исследована эффективность нитрофурантоина, ко-тримоксазола [13]. Не исследована клиническая эффективность нитроксолина, а также макролидов при инфекциях мочевой системы, вызванных типичными уропатогенами. В фармакоэпидемиологических исследованиях, включающих амбулаторных и госпитализированных пациентов от 1 месяца до 18 лет, было показано, что для лечения инфекций мочевой системы врачи-педиатры использовали антибактериальные средства с недоказанной эффективностью: в 2000-2005 гг. — нитроксолин, фуразолидон, фуразидин, хлорамфеникол, метронидазол, макролиды, тетрациклины [Шевелев А.Н., Страчунский Л.С.; Смоленск]; в 2005-2008 гг. — макролиды, линкомицин, нитроксолин, фуразидин [Юдина Е.В., Сафина А.И., Зиганшина Л.Е., 2008].
Длительность антибактериальной терапии
В настоящее время отмечается недостаток доказательств в отношении оптимальных сроков продолжительности антибиотикотерапии для большинства инфекционных болезней. Определение длительности назначения антибиотиков, даже при распространенных инфекциях, часто основывается лишь на сформировавшихся традициях [10, 14]. Многочисленные исследования показали, что длительность антимикробной терапии у детей с инфекцией мочевой системы должна быть не меньше 7 дней [3]. Для детей с пиелонефритом рекомендуемый курс лечения антибиотиками составляет не менее 10-14 дней [2, 3, 6, 15, 16]. Для определения оптимальной общей продолжительности антибактериальной терапии необходимы дальнейшие исследования [5].
Тактика лечения острых инфекций нижних отделов мочевой системы остается спорной. Исследования коротких курсов терапии не обеспечили убедительные доказательства их эффективности. Для лечения цистита у детей прием антибиотика в течение 5-7 дней обычно оказывается достаточным [2, 3, 16]. Увеличение продолжительности курса лечения более 7 дней, как правило, не влияет на эффективность, но повышает риск нежелательных лекарственных реакций [15]. По результатам систематического обзора (10 РКИ, 652 ребенка) при инфекциях нижних отделов мочевой системы (уретрите и цистите) короткий курс антибиотиков (2-4 дня) был так же эффективен, как и в течение 14 дней. Оценивали первичные (персистирование клинических симптомов в конце лечения, диагностически значимая бактериурия в конце терапии, частота рецидивов инфекций мочевой системы после лечения) и вторичные (согласие с лечением — комплаенс, развитие устойчивых микроорганизмов, затраты и побочные эффекты терапии) исходы. В связи с отсутствием возможности проведения исследования с включением достаточного количества участников, чтобы продемонстрировать сокращение эпизодов инфекций мочевой системы после лечения, исследователи рекомендуют клиницистам использовать доступные данные для определения продолжительности терапии у детей с инфекциями нижних отделов мочевой системы [17].
Таким образом, с позиций доказательной медицины, основными ошибками антибактериальной терапии инфекций мочевой системы у детей являются: использование антибактериальных средств с недоказанной эффективностью (нитроксолин, фуразидин, фуразолидон, макролиды, метронидазол, линкомицин, тетрациклины, хлорамфеникол), необоснованное назначение парентеральных антибактериальных средств, избыточная длительность парентеральной антибактериальной терапии.
А.И. Сафина, Е.В. Юдина, Л.Е. Зиганшина
Казанская государственная медицинская академия
Сафина Асия Ильдусовна -доктор медицинских наук, заведующая кафедрой педиатрии и перинатологии
Литература:
1. Паунова С.С. Инфекция мочевой системы у детей (этиология, патогенез, клиника). Медицинский научный и учебно-методический журнал 2002; 9: 56-72.
2. Цыгин А.Н., Комарова О.В., Сергеева Т.В. Инфекция мочевыводящих путей: методическое письмо. М., 2007. 12 с.
3. Баранов А.А., Володин Н.Н., Самсыгина Г.А. Рациональная фармакотерапия детских заболеваний: Руководство для практикующих врачей. Под общ. ред. Баранова А.А., Володина Н.Н., Самсыгиной Г.А. М.: Литера, 2007. В 2 книгах. Книга 1; 1163 с.
4. Alper B.S., Curry S.H. Urinary Tract Infection in Children. American Family Physician 2005; V. 72: 2483-2488.
5. Bloomfield P., Hodson E.M., Craig J.C. Antibiotics for acute pyelonephritis in children. The Cochrane Database of Systematic Reviews 2006, Issue 2 The Cochrane Database of Systematic Reviews 2005, Issue 1. Art. No.: CD003772.pub2. DOI: 10.1002/14651858.CD003772.pub2.
6. Craig J.C., Hodson E.M. Treatment of acute pyelonephritis in children. BMJ 2004; V.328: 179-180.
7. Hodson E.M., Willis N.S., Craig J.C. Antibiotics for acute pyelonephritis in children. Database of Systematic Reviews 2007, Issue 4. Art. No.: CD003772. DOI: 10.1002/14651858.CD003772.pub3.
8. Montini G., Toffolo A., Zucchetta P. Antibiotic treatment for pyelonephritis in children: multicentre randomised controlled non-inferiority trial. BMJ 2007; V.335: 386-393.
9. Baumer J.H., Jones R.W.A. Urinary tract infection in children, National Institute for Health and Clinical Excellence. Archives of Disease in Childhood — Education and Practice 2007; V.92: 189-192.
10. Гиссенс И.К. Оценка качества антимикробной химиотерапии. International J. of Antimicrobial Agents 2001; V.17: 9-19.
11. Pohl A. Modes of administration of antibiotics for symptomatic severe urinary tract infections. Cochrane Database of Systematic Reviews 2007, Issue 4. Art. No.: CD003237. DOI: 10.1002/14651858.CD003237. pub2.
12. Царегородцев А.Д. Рациональный выбор антимикробной терапии инфекции мочевой системы у детей: руководство по фармакотерапии в педиатрии и детской хирургии, т. 3 «Нефрология» (под ред. М.С. Игнатовой). М., 2003. 436 с.
13. Williams G., Wei L., Lee A., Craig J.C. Long-term antibiotics for preventing recurrent urinary tract infection in children. Cochrane Database of Systematic Reviews 2006, Issue 3. Art. No.: CD001534. DOI: 10.1002/14651858.CD001534.pub2.
14. Alp E., Hoeven J.G. Duration of antibiotic treatment: are even numbers odd? J. Antimicrob Chemother 2005; V. 56: 441-442.
15. Клинические рекомендации. Педиатрия. Под ред. А.А. Баранова. М.: ГЭОТАР-Медиа, 2009. 432 с.
16. Hellerstein S. Antibiotic treatment for urinary tract infections in pediatric patient. Minerva Pediatr. 2003; V.55 (5): 395-406.
17. Michael M., Hodson E.M., Craig J.C. Short versus standard duration oral antibiotic therapy for acute urinary tract infection in children. Cochrane Database of Systematic Reviews 2003, Issue 1. Art. No.: CD003966. DOI: 10.1002/14651858.CD003966.
Обсуждение закрыто.