- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
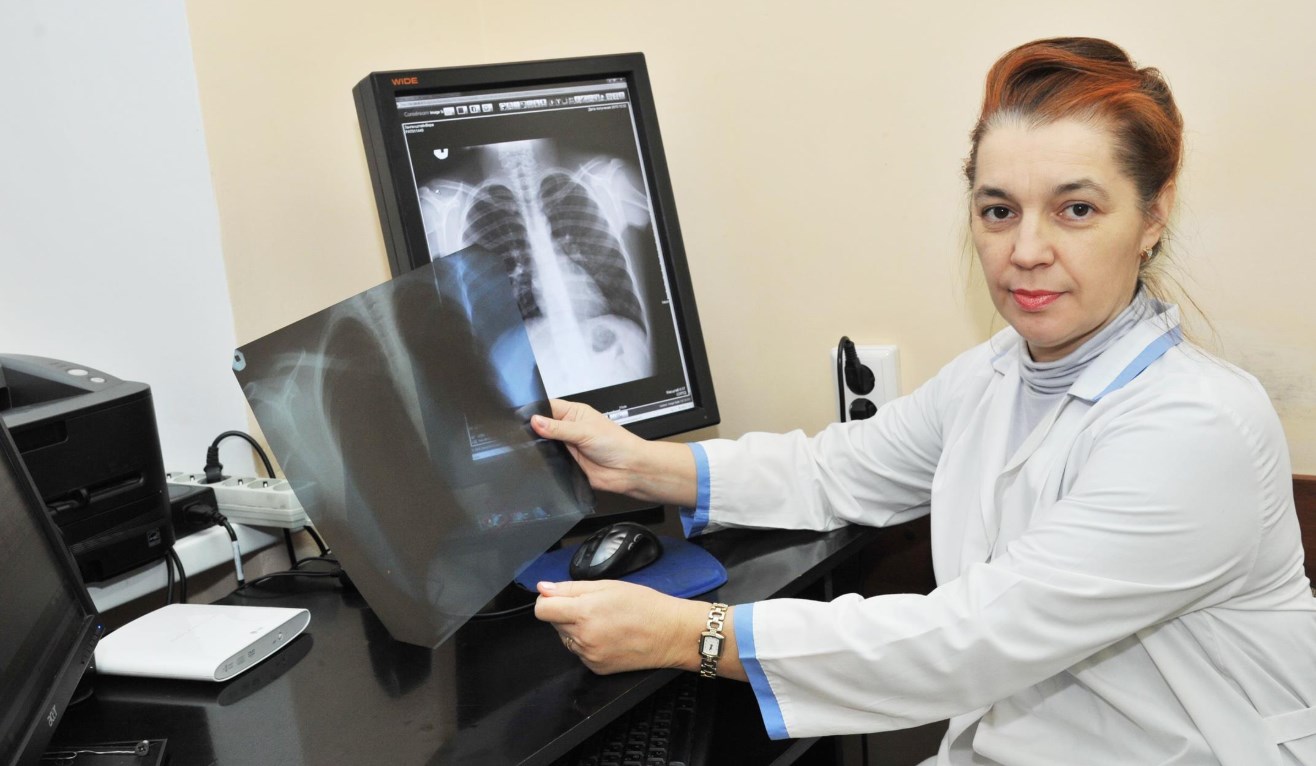
Соколова А.В.
1
Малишевская Н.П.
2
1 Клиника «Уральская»
2 Государственное бюджетное учреждение Свердловской области «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии»
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70%. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи у 800 пациентов, последовательно обратившихся на прием к дерматологу. В выборку включены все пациенты с новообразованиями кожи, после удаления которых было произведено гистологическое исследование материала и получено патоморфологическое заключение (n=441). Из 441 гистологического исследования новообразований кожи совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая гипердиагностики диспластических невусов и меланомы кожи. Проанализированы причины расхождения клинического и дерматоскопического с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики новообразований кожи, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних стадиях. Основными причинами гиподиагностики меланоцитарных новообразований кожи являются малый размер новообразования, визуальная однородность цвета, беспигментные или мало пигментированные новообразования, визуально и дерматоскопически определяемые ровные и четкие контуры.
меланома кожи
диспластический невус
ошибки в диагностике меланомы
гиподиагностика меланомы кожи.
1. Демидов Л.В., Харкевич Г.Ю., Маркина И.Т. Меланома и другие злокачественные новообразования кожи // Энциклопедия клинической онкологии: руководство для практических врачей. — М.: РЛС, 2005. — С. 341–364.
2. Малишевская Н.П., Игликов В.А. и др. Эпидемиология злокачественных новообразований кожи на Среднем Урале / Кунгуров Н.В. (ред.) // Злокачественные новообразования кожи: заболеваемость, ошибки диагностики, организация раннего выявления, профилактика. — Курган: Зауралье, 2010. – С. 8-33.
3. Чиссов В.И., Старинский В.В., Петрова Г.В. Качественные новообразования в России в 2011 году (заболеваемость и смертность). — М.: ФП «МНИОИ им. П.А. Герцена» Минздрава России, 2013. — 289 с.
4. Chen S.T., Geller A.C., Tsao H. Update on the epidemiology of melanoma // Curr. Dermatol. Rep. — 2013. — № 2 (1). — Р. 24–34.
5. Малишевская Н.П., Кохан М.М., Соколова А.В и др. Дерматоонкология (злокачественные новообразования кожи, первичные лимфомы кожи): атлас / под общ. ред. проф. Н.В. Кунгурова. – Екатеринбург: Изд-во Урал. ун-та, 2016. – 68 с.
6. Состояние онкологической помощи населению России в 2016 году / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. — М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2017. — 236 с.
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70% [1-4]. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. О значительном количестве диагностических ошибок на разных уровнях оказания медицинской помощи пациентам свидетельствует сохраняющийся высокий удельный вес больных с МК, выявленной на поздних стадиях опухолевого процесса [5]. За период с 2006 по 2016 год в РФ показатели запущенности по меланоме кожи значительно снизились (-40,6%), однако они по-прежнему остаются на недопустимо высоком уровне (18,9%) для опухолей визуальных локализаций [6]. Следует отметить, что гипердиагностика МК не влечет столь трагических последствий, как гиподиагностика, которая всегда связана с ухудшением прогноза течения заболевания и риском для жизни больного.
Цель исследования — установить причины расхождения результатов клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи (НОК) у 800 пациентов, последовательно обратившихся на прием к дерматологу. Из них в 441 (42,8%) случае выполнено удаление НОК радиоволновым или хирургическим методом с последующим гистологическим исследованием. Показаниями для удаления новообразований кожи явились подозрение на МК и диспластические невусы, все случаи сложной дифференциальной диагностики, а также все меланоцитарные новообразования, находящиеся в местах постоянного травмирования или имеющие большие размеры (>6 мм). В случаях подозрения на МК пациенты направлялись в Государственное бюджетное учреждение Свердловской области «Свердловский областной онкологический диспансер» для хирургического иссечения НОК и последующего лечения. В выборку включены все пациенты с верифицированными диагнозами НОК, в том числе пациенты с меланомой кожи на ранних (I-II) стадиях и диспластическими невусами, когда правильная и своевременная диагностика наиболее важна для дальнейшего прогноза течения заболевания (табл. 1).
Таблица 1
Структура новообразований кожи (n=441)
|
Меланоцитарные новообразования кожи |
Число больных с правильно установленным диагнозом, абс. (%) |
|
|
визуальный осмотр с использованием дерматоскопии |
гистологическое заключение |
|
|
Доброкачественные НОК |
349 (79,1%) |
361 (81,9%) |
|
Диспластические невусы кожи |
82 (18,6%) |
67 (15,2%) |
|
Меланома кожи на ранних стадиях |
10 (2,3%) |
13 (2,9%) |
Группу доброкачественных новообразований кожи составили меланоцитарные невусы без признаков дисплазии (n=263), себорейный кератоз (n=74) и гемангиомы кожи (n=12) в случаях их травмирования, с наличием геморрагических корочек на поверхности новообразований, затрудняющих визуальную и дерматоскопическую диагностику.
Таким образом, в данной выборке достоверных различий в правильности постановки диагноза при клиническом осмотре дерматолога с применением рутинной дерматоскопии и результатом гистологии не выявлено (табл. 1).
Из 441 гистологического исследования НОК совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Совпадение клинического дерматоскопического и гистологического диагнозов (n=355) выявлено в случаях доброкачественных новообразований кожи (n=305), диспластических невусов (n=45) и меланомы кожи (n=6). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая их гипердиагностики.
Проанализированы причины расхождения клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних (I-II) стадиях (табл. 2).
Таблица 2
Визуальные признаки НОК, влияющие на гиподиагностику диспластических невусов и МК с использованием дерматоскопии (n=24)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Малый размер новообразования (<6 мм) |
17 |
70,8 |
|
2. Визуально и дерматоскопически определяемые ровные четкие контуры |
3 |
12,5 |
|
3. Клинически и дерматоскопически определяемая однородность цвета |
6 |
25,0 |
|
4. Беспигментные или мало пигментированные новообразования |
5 |
20,8 |
Примечание: у одного больного могло быть несколько причин гиподиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
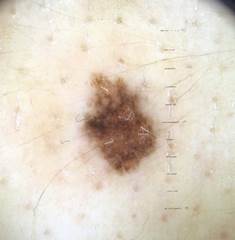
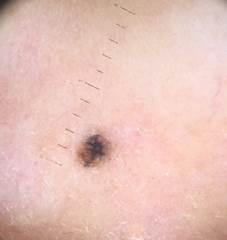
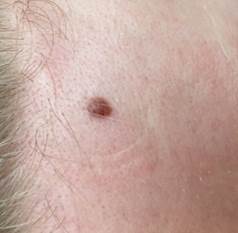
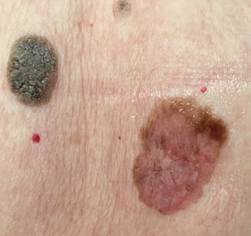
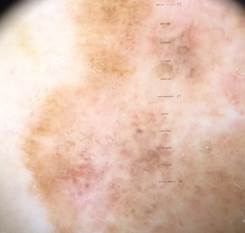
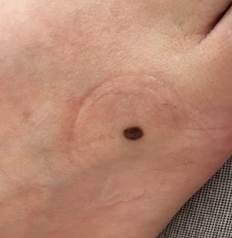
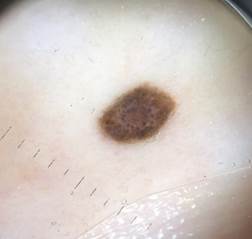
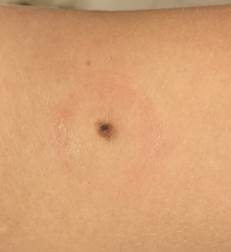
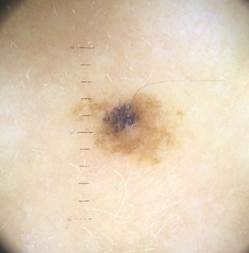
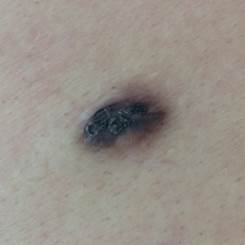
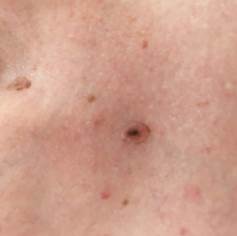
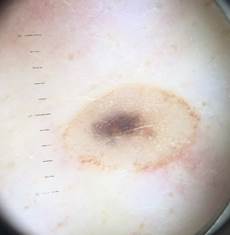
B соответствии с приведенными данными основными причинами гиподиагностики пигментированных новообразований кожи являются малый размер новообразования (70,8%, рис. 1), визуальная однородность цвета (25,0%, рис. 2), беспигментные или мало пигментированные новообразования (20,8%, рис. 3), визуально и дерматоскопически определяемые ровные и четкие контуры (12,5%, рис. 4).
Рис. 1. Линейный размер меланомы кожи меньше 6 мм (дерматоскопическое изображение)
Рис. 2. Клиническое и дерматоскопическое изображение диспластического невуса кожи лба: клинически определяется визуальная однородность цвета
Рис. 3. Клиническое и дерматоскопическое изображение мало пигментированной меланомы кожи живота с участками регресса, выше – себорейный кератоз
Рис. 4. Клиническое и дерматоскопическое изображение меланомы кожи тыльной поверхности стопы
Проанализированы причины гипердиагностики меланоцитарных новообразований кожи в случаях, когда возникают трудности в дифференциальной диагностике диспластических невусов и меланомы кожи (табл. 3).
Таблица 3
Визуальные признаки НОК, влияющие на гипердиагностику диспластических невусов и МК с дерматоскопией (n=34)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Большой (свыше 10 мм) размер новообразования |
13 |
54,2 |
|
2. Клинически и дерматоскопически определяемые неровные контуры и асимметричность новообразования |
9 |
37,5 |
|
3. клинически и дерматоскопически определяемая неоднородность цвета |
15 |
62,5 |
|
4. Наличие в новообразовании фрагментов темно-коричневого и черного цвета при дерматоскопии новообразований |
8 |
33,3 |
Примечание: у одного больного могли быть несколько причин гипердиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
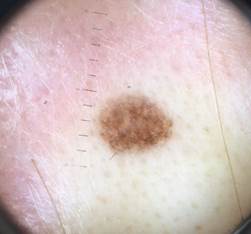
B соответствии с данными таблицы 3 основными причинами, которые приводят к гипердиагностике диспластических невусов и меланомы кожи, являются неоднородность цвета (62,5%, рис. 5, 7), размер новообразований более 10 мм (54,2%, рис. 6), неровные контуры и асимметричность новообразования (37,5%, рис. 5), а также наличие в новообразовании фрагментов темно-коричневого и черного цвета (33,3%, рис. 5-7).
Рис. 5. Клиническое и дерматоскопическое изображение диспластического невуса кожи плеча: неоднородность цвета, неровные контуры и асимметричность новообразования, наличие в новообразовании эксцентрично расположенных фрагментов темно-коричневого и черного цвета
Рис. 6. Пигментированная дерматофиброма кожи бедра
Рис. 7. Клиническое и дерматоскопическое изображение диспластического невуса кожи живота
Результаты расчета показателей диагностической точности, чувствительности и специфичности клинического осмотра с применением дерматоскопии для диагностики НОК продемонстрировали, что чувствительность клинического осмотра с применением дерматоскопии для доброкачественных новообразований кожи (91,2%) на 45,0% выше, чем чувствительность диагностики меланомы кожи (46,2%). Но при этом определяется высокая (99,1%) специфичность клинической и дерматоскопической диагностики меланомы кожи, что свидетельствует о большой вероятности совпадения диагноза с данными патоморфологического исследования. Точность диагностики меланомы кожи составляет 97,5%, что на 9,1% выше, чем точность диагностики доброкачественных новообразований кожи (88,4%) с применением метода дерматоскопии.
На следующем этапе исследования был разработан «показатель гиподиагностики», т.е. число больных, которым необходимо провести клиническое и дерматоскопическое исследование новообразований кожи для того, чтобы у одного из них установленный клинический диагноз не подтвердился результатом гистологического исследования. Показатель гиподиагностики рассчитывали как отношение неверно диагностированных случаев ко всем случаям НОК в данной группе. Этот показатель составил 18,4 в случае диспластических невусов и меланомы кожи, и 63,0 в случае только меланомы кожи. Таким образом, при осмотре 63 больных с НОК в ситуациях сложной дифференциальной диагностики дерматолог допускает один случай гиподиагностики меланомы кожи.
Диагностические ошибки за счет гиподиагностики процесса имеют наиболее неблагоприятные для течения заболевания и прогноза жизни последствия, что диктует необходимость внедрения в клиническую практику новых современных неинвазивных методов обследования меланоцитарных новообразований кожи (спектрофотометрического интрадермального анализа, конфокальной лазерной сканирующей микроскопии).
Библиографическая ссылка
Соколова А.В., Малишевская Н.П. ОШИБКИ В ДИАГНОСТИКЕ МЕЛАНОЦИТАРНЫХ НОВООБРАЗОВАНИЙ КОЖИ // Современные проблемы науки и образования. – 2018. – № 2.
;
URL: https://science-education.ru/ru/article/view?id=27502 (дата обращения: 06.06.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
ряда цитокинов являются участниками сложных внутриклеточных каскадов, экспрессия которых может привести к онкогенной трансформации клеток и развитию промоции.
ОШИБКИ ПРИ ИСПОЛЬЗОВАНИИ ЛУЧЕВОЙ ДИАГНОСТИКИ У ПАЦИЕНТОВ С ОПУХОЛЯМИ ГОЛОВНОГО МОЗГА
О. В. Могучая, И.Г. Захматов, В. В. Щедренок,
Е.И. Усанов, А.Ю. Улитин
РНИ нейрохирургический институт
им. проф. А.Л. Поленова, г. Санкт-Петербург, Россия
Е-mail авторов: igz@bk.ru
Цель исследования: уточнить критерии целесообразности, достаточности и сроков выполнения лучевых методов исследования у пациентов с нейроонкологией, и оценить качество лучевой диагностики на основании его соответствия принятым стандартам объема медицинской помощи.
Материалы и методы. Проведен анализ 231 истории болезни пациентов с опухолями головного мозга, находившихся на лечении в 7 стационарах Санкт-Петербурга в 2009 г., которым в различном объеме выполнены лучевые методы обследования. Выявлены наиболее распространенные ошибки в назначении, трактовке и своевременности выполнения современных методов лучевой диагностики.
Результаты и обсуждение. В 32% случаев пациентам была выполнена только МРТ, данные которой не позволяют в полной мере судить о плотности опухолевой ткани, степени деструкции костных структур при менингососудистой природе новообразования.
У 54% пациентов не была выполнена МРТ, обследование ограничивалось только данными СКТ, которые не дают должного представления о распространении процесса, выраженности перитуморозного отека, степени компрессии и деформации структур головного мозга, окружающих патологический процесс.
Введение контрастного вещества во время выполнения лучевых методов исследования при диагностике опухолей головного мозга отмечено лишь у 68% пациентов.
В соответствии с действующими стандартами и протоколами ведения этих больных оптимальной тактикой обследования является обязательное выполнение МРТ в Т1ВИ, Т2ВИ и FLAIR режимах в сагиттальной, фронтальной и аксиальной проекциях, с введением контрастного вещества, а также СКТ-исследование с оценкой плотностных характеристик для разных гистологических типов внутримозговых опухолей.
Ангиография, МР-ангиография либо СКТ-ангиография были выполнены только у 8% пациентов, хотя подозрение на вовлечение в процесс основных артерий, глубоких вен мозга и синусов имели место в 17% случаев, то есть более половины пациентов были оперированы без достаточной информации
о характере кровоснабжения опухоли.
В 52% анализированных историй болезни контрольные МРТ или СКТ-исследования не были назначены в динамике после выписки из стационара. Оптимальная тактика лучевого обследования в данном случае должна основываться на степени анапла-зии опухоли.
При анаплазии 1-2 степени контрольное МРТ-исследование с контрастированием целесообразно назначать через 6 мес. При анаплазии 3-4 степени МРТ с контрастированием необходимо повторять через каждые 3 месяца в течение года после выписки.
Выводы.
1. До настоящего времени не разработан единый алгоритм обследования пациентов с опухолями головного мозга перед операцией, несмотря на наличие целого ряда регламентирующих документов.
2. Для улучшения диагностики пациентам с опухолями головного мозга клинико-лучевые алгоритмы дооперационного периода должны включать обязательное выполнение МРТ с контрастированием в аксиальной, сагиттальной и фронтальной проекциях, СКТ, а также селективной ангиографии, либо МР-или СКТ-ангиографии при локализации новообразования в области основных артерий, вен мозга или венозных синусов.
ВРАЧЕБНЫЕ ОШИБКИ
ПРИ ДИАГНОСТИКЕ МЕЛАНОМЫ КОЖИ
Е.С. Никитина
Саратовский ГМУ им В.И. Разумовского, Россия E-mail авторов: kiti-ormanti@rambler.m
Выявлять меланому кожи должны, в первую очередь, врачи первого контакта. Поэтому диагностические ошибки на догоспитальном этапе влияют не только на тактику лечения, но и на прогноз.
Цель исследования: проанализировать причины ошибок в диагностике меланомы кожи на догоспитальном этапе.
Материалы и методы. Анализировались медицинские документы и анамнестические данные. Всего проведен анализ 150 больных, находившихся на лечении в клинике онкологии с 2009 по 2011 годы. Большинство пациентов (89,9%) обнаружили у себя опухоль самостоятельно. При профилактическом осмотре меланома выявлена у 10,1%.
Результаты и обсуждение.
45, 2012 Тюменский медицинский журнал
Из анамнеза выяснено, что длительно существующие пигментные образования на коже имелись у 78,7% пациентов. Из них у 28,7% они были врожденными, а у 50 % — появились в течение жизни.
При анализе установлено, что время, прошедшее от появления клинических признаков до обращения к врачу, у большинства больных — 69,6%, составляло от
1 до 12 месяцев. Поводом для обращения к врачу были: быстрое увеличение пигментного образования (у 71,3 % больных), кровотечение из очага (у 21,4% пациентов), изменение цвета пигментного образования (у 5,2% больных), появление увеличенных лимфатических узлов (у 2,1% пациентов). Длительность существования указанных выше симптомов различна. Чаще всего они развивались в течение 6 месяцев, что было отмечено 47,3% больными. Активизация за 7-12 месяцев была у 27,1% пациентов, а в срок до двух лет — у 25,6% человек. Не всегда больные обращались к врачу сразу после обнаружения активизации пигментных образований. Это сделали лишь 52,4%. Поздние сроки обращения за консультацией показывают, что население не обладало информацией о необходимости обследования у врачей. Первым пунктом обращения к врачу у всех больных была районная поликлиника. Основное число пациентов (74%) посетили дерматолога или хирурга. Врач первого контакта сразу направил к онкологу 42,7% пациентов. У остальных пациентов действия врачей не были направлены на уточнение диагноза. Часто врач самостоятельно давал рекомендации и назначал лечение без консультации с онкологом и верификации. Подобная тактика, впоследствии приведшая к тому, что все поступили в клинику с изъязвленной, распадающейся или метастатической меланомой, применена у 34,8%. Наблюдение в условиях поликлиники было рекомендовано 22,5% больным. Морфологическое исследование и консультация онколога, в этих наблюдениях, не были использованы. Таким образом, возможности своевременного выявления меланомы врачом поликлиники были упущены.
Выводы.
Анализ ошибок при диагностике меланомы показал, что причинами запущенности больных меланомой кожи являются формальное проведение массовых профилактических осмотров на раннее выявление меланомы и предмеланомных состояний, некачественная диспансеризация лиц с фоновой патологией, недооценка клинических данных, онкологическая неграмотность врачей первого контакта и населения, недостаточное и нерациональное использование эффективных диагностических методов.
НЕДОСТАТОЧНОСТЬ АНТИОКСИДАНТНОЙ СИСТЕМЫ ТКАНЕЙ КАК ВЕДУЩИЙ ПАТОГЕНЕТИЧЕСКИЙ ФАКТОР ДЕСТРУКТИВНОГО ДЕЙСТВИЯ ТЕРМИЧЕСКОЙ ТРАВМЫ
Н.В. Полутова, Н.П. Чеснокова, Н.В. Островский
Саратовский ГМУ, г. Саратов, Россия E-mail авторов: polutovanat@mail.ru
Актуальность проблемы термической травмы определяется ее высокой распространенностью среди всех возрастных групп населения. Так, термическая травма занимает второе место в общей структуре травматизма вслед за механическими повреждениями тканей.
До настоящего момента отсутствуют системате-зированные сведения о состоянии процессов липопе-роксидации при термическом поверхностном поражении кожи, их динамических сдвигах в период острого воспаления и на фоне развития репаративной регенерации.
Цель исследования: изучение состояния процессов липопероксидации и антирадикальной защиты клеток крови больных с ожоговой раной на фоне традиционной комплексной терапии в динамике развития патологии.
Материал и методы.
В работе представлены результаты комплексного клинико-лабораторного обследования 30 больных с поверхностными ожогами (ожог I, II и ША степени) в динамике патологии, находившихся на стационарном лечении в Саратовском центре термических поражений в 2007- 2011 гг. Первый забор крови для исследования производился на 1-е сутки патологии, что соответствовало развитию реактивно-
воспалительных процессов в ожоговой ране. Второй забор крови осуществлялся на 10-е сутки заболевания. В этот период времени начинался процесс эпи-телизации раны. Третий забор крови производился на 18-е сутки патологии (период выздоровления).
О развитии ситемных метаболических сдвигов при поверхностных ожогах кожи судили по степени интенсивности свободнорадикальной дестабилизации клеток крови, в частности по показателям содержания в крови промежуточных продуктов липо-пероксидации: диеновых конъюгатов (ДК) и малонового диальдегида (МДА). О состоянии антиоксидант-ной системы крови судили по показателям активности супероксиддисмутазы (СОД), каталазы, уровню витамина Е, 8И-групп, которые определялись общепринятыми спектрофотометрическими методами исследования.
Результаты исследования показали, что на 1-и и 10-е сутки с момента развития ожоговой раны отмечались интенсификация процессов липоперокси-дации и нарастание уровня промежуточных продуктов липопероксидации: МДА в эритроцитах и плазме крови, а ДК в эритроцитах — по сравнению с таковыми показателями контрольной группы. Избыточное накопление промежуточных продуктов липоперокси-дации сочеталось с недостаточностью механизмов антиоксидантной защиты клеток крови, на что указывало подавление активности СОД и каталазы эрит-
Тюменский медицинский журнал № 2, 2412
Правильный гистологический диагноз имеет решающую роль в лечении меланомы и прогнозе относительно заболевания.
Гистология помогает определить:
Родинки представляют собой небольшие пятна от телесной до темно-коричневой окраски. По форме они могут быть в виде папул или узелков, состоящих из скопления пигментных клеток. Их основное медицинское значение (кроме косметического) – сходство с меланомой.
Пигментированные поражения оцениваются по набору характеристик (внешний вид, границы, цвет, зуд, кровоточивость и т.д.), которые позволяют исключить атипичные невусы или меланому.
Удаление родинки является относительно простой процедурой. Её выполняют в эстетических целях или для устранения патологических изменений кожи, которые могут оказаться злокачественными. Единственный способ узнать наверняка, будет ли подозрительное образование нуждаться в дальнейшем лечении, зависит от патоморфологического исследования ткани. Анализ родинки и других подозрительных участков кожи, отправка тканевого материала на гистологию дают возможность ответить на эти вопросы.
Что показывает гистология родинки?
Это более точный метод тканевой диагностики, чем цитология. Его проводят в специальной лаборатории, после предварительной обработки, окраски образца ткани, с помощью мощного микроскопа. Внутридермальные невусы, атипичные родинки, беспигментные образования кожи можно дифференцировать по множеству отличительных признаков во время проведения гистологии.
Гистология меланомы
Микроскопическая диагностика пигментных поражений кожи основана на выявлении и определении свойств малигнизированных меланоцитов. Агрегация (скопление) атипичных пигментных клеток может наблюдаться в нетипичных диспластических невусах. Иногда их трудно отличить от поверхностного распространения злокачественной меланомы. Такие редкие формы, как десмопластическая меланома, морфологически схожа с доброкачественными изменениями кожи, что может стать причиной диагностических ошибок.
Все случаи гистологического тестирования опухолей требуют опыта и высокого профессионального мастерства.
При проведении гистологии злокачественной меланомы кожи врачу-патологоанатому приходится оценивать много факторов:
- тип меланомы;
- толщина опухоли;
- наличие изъязвления;
- инфильтрация;
- степень сосудистой инвазии;
- поля оперативной резекции (края опухоли);
- митотическая скорость или уровни по Кларку.
Помимо этого, врач комментирует возможную инвазию лимфоцитов, наличие некроза, регрессию клеток и уровень нейротропности (рост опухоли относительно нервов).
По результатам гистологии рака кожи определяется тип опухоли, в соответствии с особенностями клеточной морфологии.
Толщина опухоли является наиболее важным фактором гистологической оценки. Измеряется она в микрометрах (мкм) и представляет собой самый длинный диаметр от верхней части опухоли до самой нижней (глубокой) эпидермальной опухолевой клетки.
Врач-патологоанатом, изучая удаленную патологическую ткань, должен убедиться, вся ли опухоль резецирована и отправлена на экспертизу, определить тип и стадию роста меланомы. Патоморфологические срезы должны включать фрагменты с ожидаемой глубинной инфильтрацией.
Любое подозрение на рак кожи необходимо сопровождать проведением гистологии.
Гистологическая информация важна для выбора лечения и дальнейшей оценки состояния пациентов с меланомой. Сателлиты, присутствующие в дерме, также должны быть включены в препарат. Оценка толщины опухоли может оказаться неопределенной или невозможной, если имели место регрессивные изменения в опухоли.
В патоморфологический отчет о малигнизированной ткани должны быть включены следующие факторы:
- гистологический тип (инвазивный или in-situ);
- толщина опухоли при прорастании (Breslow) в десятых долях мм;
- изъязвление (имеется или нет);
- другие факторы (инфильтрация сосудов, инфильтрация лимфоцитов);
- краевые поля резекции.
Для резецированных лимфатических узлов определяющими для диагностики и лечения, являются такие данные:
- число метастатических узлов;
- общее количество резецированных узлов;
- периузловой рост опухоли;
- свойства опухоли в области резецированного участка.
При гистологическом исследовании злокачественных меланом слизистых оболочек наблюдается переменная микроскопическая картина. Инфильтрация лимфоцитов менее выражена по сравнению с поражениями кожи. Около 1/3 меланом в носу и полости рта амеланотичны. Этот тип опухолей трудно дифференцировать от других видов рака слизистых оболочек. В этом отношении полезной оказывается иммуногистохимия меланомы.
Информация для иностранных пациентов
Иностранные пациенты, желающие получить квалифицированную онкологическую помощь в Израиле, могут рассчитывать на заочную консультацию специалиста на догоспитальном этапе. Кроме того, при необходимости может быть проведена гистологическая экспертиза материала.
В израильских клиниках применяется процедура биопсии сигнальных лимфатических узлов, в соответствии с которой устраняются лимфоузлы с возможным метастатическим поражением.
В России и странах СНГ процедура биопсии дозорных лимфатических узлов пока не получила повсеместного распространения.
Использование этой методики является наиболее актуальным в случае выявления при гистологическом исследовании повышенного митотического индекса и изъязвления в зоне первичной меланомы.
Вид меланомы, её классификация и определение стадии опухолевого роста являются основными характеристиками гистологического исследования.
В специализированных онкологических центрах, таких как Melanoma Unit, гистологическое тестирование образца ткани проводится более чем по 20 параметрам. Помимо структурных особенностей, патологоанатом учитывает множество дополнительных характеристик, включая свойства клеточных ядер и активность ферментов.
Пациент Андрей М., 31 год, диагноз — меланома правого плеча
В заключении российских патологов говорится о повышенной митотической активности (от 2 до 5 митозов в поле зрения), меланома описана как опухоль 3-его уровня инвазивного роста по Кларку толщиной 2,5 мм.
Израильские онкологи установили 4 уровень меланомы по Кларку с толщиной опухоли 4,25 мм. Показатель митотической активности составил 20/кв.мм.
Примеры отличий в гистологических заключениях российских и израильских патологов.
Исследование опухолевого материала предполагает определение его следующих свойств:
- Толщина опухоли
- Изъязвление
- Уровень по Кларку
- Гистологический тип
- Тип клеток
- Первичная локализация
- Признаки регрессии
- Число митозов
- Лимфоцитарная инфильтрация
- Стадия вертикального роста
- Инвазия в кровеносные сосуды
- Инвазия в лимфоцитарную зону
- Плоидность
- S-фаза клеточного цикла
- Экспрессия гена DR1
- Индекс ДНК
- Экспрессия белка теплового шока
- Положительная окраска на HLD-DR
- Мутация белка P53
- Экспрессия фактора клеточной адгезии
- Экспрессия протеаз
- Молекула-маркер миграции
- Фактор ангиогенеза
- Экспрессия онкогенов
- Наличие рецептора к эстрогену
- Цитокин, фактор роста
Наша клиника предлагает заочную консультацию и дистанционную экспертизу гистологических образцов. Это значительно облегчает постановку диагноза и повышает оперативность оказания медицинской помощи.
Гистология удаленной родинки
Процесс малигнизации способен затронуть родинки небольших размеров, и при проведении цифровой дерматоскопии внешние изменения невуса могут отсутствовать. В связи с этим может быть предпринята ошибочная тактика лечения по радикальному удалению родинки с применением лазера, криодеструкции или электрокоагуляции. В этом случае сдать родинку на гистологию невозможно, поскольку ткань невуса во время процедуры выжигается. В данном случае тактическая ошибка (выполнение операции без гистологии) может иметь очень серьезные последствия.
Гистология родинки после её удаления является непременным условием современной онкологии. По результатам гистологии невуса можно судить об эффективности и радикальности выбранного метода. Хирургические протоколы в отношении меланом и сомнительных родинок категорически исключают использование методик, при которых гистология невуса оказывается невозможной.
«Острое» оперативное иссечение любого подозрительного участка изменённой кожи при помощи скальпеля с последующей экспертизой резецированного материала является золотым стандартом современной онкохирургии. К сожалению, в России и странах СНГ не существует строгих протоколов и «императивных» указаний, запрещающих использовать вспомогательные методики (лазер, электрокоагуляция, радионож и др.) «по усмотрению» хирурга, в результате чего возрастает вероятность ошибки, а гистология удалённой родинки проводится не в 100% случаев.
Иммуногистохимия меланомы
Эффективным методом диагностики, позволяющим определить свойства опухоли, а также её чувствительность к некоторым видам противоопухолевых средств является иммуногистохимия. Более чем у половины кожных меланом происходит мутация генов BRAF и NRAS. Благодаря иммуногистохимическому анализу удается выявить специфические мутации в ядре опухолевых клеток, что дает возможность оценить степень эффективности определенных target-препаратов и назначить максимально точную терапию.
Метод также является эффективным для морфологической диагностики анонимных метастатических новообразований.
Специалисты израильского онкологического центра имеют большой опыт гистологической диагностики. Постановка диагноза меланомы в России и странах СНГ отличается от диагностических протоколов, используемых в Израиле. Недостаток клинического опыта и отсутствие высокотехнологичного оборудования в большинстве лечебных учреждений СНГ приводит к тому, что встречаются случаи расхождения диагнозов и стадий в экспертных заключениях специалистов.
В Израиле при возникновении сомнений в морфологии и стадии опухоли для экспертизы привлекаются другие специалисты (второе мнение). Такой подход позволяет свести к нулю вероятность субъективной ошибки в диагностике.
Преимущества гистологической диагностики в Израиле
- Диагностику проводят специалисты высочайшей квалификации, с большим опытом клинической работы.
- Тестирование проводится оперативно, в течение 1–3 суток.
- При гистологической оценке материала применяются дополнительные критерии, которые не используются в лечебных учреждениях стран СНГ.
- Возможно дистанционное исследование образцов материала.
- Патологоанатомические лаборатории Израиля располагают необходимыми сертификатами для проведения любых тканевых исследований, в т.ч. генетических.
Меланома легко излечима в начальных стадиях и реально излечима даже на стадии микрометастазирования – решающее значение имеет вовремя и правильно поставленный диагноз.
Источники
- http://www.cancernetwork.com/articles/histology-melanoma-and-other-skin-cancers
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1770634/
- http://www.slideshare.net/raghuramchary50/histopathology-of-malignant-melanoma
Grażyna Kamińska-Winciorek1, Waldemar Placek2
1The Center for Diagnostics and Treatment of Skin Diseases, Katowice, Poland
Head of Center: Grażyna Kamińska-Winciorek MD, PhD
2Dermatology, Sexually Transmitted Diseases and Clinical Immunology Clinic,
Head of Department: Prof. Waldemar Placek MD, PhD
Postep Derm Alergol 2015; XXXII, 1: 33–39
DOI: 10.5114/pdia.2014.44029
Краткое содержание
Дерматоскопия — это метод оценки структуры эпидермиса и дермы in vivo. В настоящее время он, вероятно, является наиболее точным нехирургическим методом диагностики меланоцитарных ново- образований. Ошибки диагностики могут приводить к неоправданному удалению доброкачественных новообразований и, что хуже, могут пропустить раннюю меланому. Ошибки дерматоскопического анализа можно разделить на связанные с невозможностью провести надлежащие тесты (процедурные и технические ошибки), и те, которые вытекают из недостатка знаний и опыта в дерматоскопии. В настоящей статье обсуждаются наиболее распространенные ошибки начинающих или неопытных врачей.
КЛЮЧЕВЫЕ СЛОВА: дерматоскопия, дермоскопия, распространенные ошибки, базовые ошибки, неверный диагноз, принципы, правила.
Cancer Foundation. Mr March поддерживается наградой от the Office of Medical Research, University of Nevada School of Medicine. Ms Truong and Ms Strazzulla внесли равный вклад с Drs Kim and Grossman.
Адрес для корреспонденции
Prof. Waldemar Placek MD, PhD, Dermatology, Sexually Transmitted Diseases and Clinical Immunology Clinic, University of Varmia and Masuria, 30 Wojska Polskiego St, 10-229 Olsztyn, Poland, phone/fax: + 48 601 915 419, e-mail: w.placek@wp.pl
Знание основано не только на правде, но и на ошибке.
Карл Густав Юнг
Введение
Дерматоскопия (дерматоскопия, эпилюминесцентная микроскопия, микроскопия поверхности кожи) — это метод in vivo исследования структур эпидермиса и дермы. Это простой проверенный способ диагностики, подразумевающий обследование новообразований кожи, главным образом меланоцитарных, с 10-кратным увеличением в традиционных дерматоскопах и с 70–100-кратным — в видеодерматоскопах (1,2).
Дерматоскопы/дермоскопы используют неполяризованный свет, требующий иммерсии (ультразвуковой гель, масло или вода) или поляризованный свет, который не требует применения каких-либо иммерсионных жидкостей. Использование дерматоскопии на приеме дерматолога увеличивает время консультации, но лишь на 72 секунды (3), поэтому стоит использовать ее для оценки любых новообразований на теле обследуемого пациента во время стандартного осмотра.
Так это описывается в литературе, на практике же дерматоскопия меланоцитарных новообразований кожного покрова всего тела с подготовкой документации и описание занимает от 30 до 40 минут. Дерматоскопия должна быть основным диагностическим инструментом, используемым не только опытными дерматологами, но также для скрининга меланоцитарных новообразований различными специалистами, в том числе онкологами, хирургами и врачами общей практики (2, 4).
Дерматоскопия характеризуется 83 % чувствительностью и 69 % специфичностью при выявлении меланомы (5). В клинической практике чрезвычайно важно правильно оценивать новообразования на теле пациента, основываясь на технических аспектах и базовых знаниях дерматоскопии.
Цель
Настоящая статья представляет авторскую классификацию наиболее распространенных и вероятных ошибок дерматоскопии на основе литературы, доступной на ресурсе PubMed, и личного опыта.
Ошибки
Ошибки дерматоскопического анализа можно разделить на связанные с невозможностью провести надлежащие тесты (процедурные и технические ошибки), и те, которые вытекают из-за недостатка знаний и опыта в дерматоскопии. В Таблице 1 представлена авторская классификация возможных ошибок дерматоскопии.
Процедурные (технические) ошибки
Выбор новообразований для дерматоскопии
Наиболее распространенной ошибкой, которую допускают врачи, является дерматоскопическая оценка только отдельных новообразований — тех, на которые указал пациент, или которые врач выбрал на основе клинической оценки по принципу ABCDE, или морфологической — черные новообразования, наиболее крупные в диаметре, возвышающиеся, или те, которые расположены в местах, где они могут подвергаться травматизации (в зоне нижнего белья, в акральных областях).
Решение об иссечении подозрительных новообразований должно приниматься на основе сравнения их с другими новообразованиями. В исследовании Argenziano и соавторов (6) решение об удалении подозрительного новообразования после морфологической оценки единственного новообразования в дерматоскопии принималось в 55 % случаев, но сокращалось до 14 % после сравнительного анализа с другими новообразования.
Чтобы выбрать несколько новообразований для иссечения, рекомендуется подготовить карту тела пациента, чтобы дать хирургу подсказки. Отметить такие участки можно при помощи фотографий, снятых камерой телефона самого пациента (7). Следует также помнить об обследовании всех новообразований на теле, не только меланоцитарных, но также розовых папул, чтобы не пропустить меланому, соответствующую правилу EFG («возвышающаяся», «плотная при пальпации», «постоянно растущая») (8).
Другой ошибкой является игнорирование небольших меланоцитарных новообразований при дерматоскопической оценке. Многие врачи, основываясь на классификации по правилу ABCD, считают, что меланомой могут быть только новообразования более 5 мм в диаметре.
Согласно литературе, 11,4–38,2 % всех меланом имеют диаметр менее 6 мм (9–12). В исследовании Giorgi и соавторов (13) 34 меланомы были выявлены среди 103 меланоцитарных новообразований диаметром менее 6 мм (33 %). В исследовании Bono и соавторов (14) из 924 меланом 22 (2,4 %) были микромеланомами с диаметром менее 3 мм. Клиническое правило АBCD в диагностике меланомы диаметром менее 6 мм не срабатывает (13).
Дерматоскопия меланомы с диаметром менее 5 мм, как правило, выявляет атипичные сосуды, нерегулярную окраску, присутствие атипичных глобул или точек, нерегулярных радиальных линий и зоны регресса (15) (Рис. 1). Другой ошибкой является использование дерматоскопии с такой периодичностью, при которой не удается установить профиль меланоцитарного невуса. Кроме того, следует проводить тотальное обследование кожных покровов всего тела (TBSE) (16).
Бессмысленно обследование пациента, который не желает раздеваться из чувства стыда, избегая обследование области гениталий, ягодиц; когда пациент не соглашается обследовать конечности, например, не хочет снимать обувь или не дает осмотреть кожу под волосами, а такое поведение встречается часто.
Таблица 1. Наиболее распространенные ошибки при дерматоскопии
| Некорректная оценка отдельных новообразований в дерматоскопии: |
| Недостаток знаний, связанных с определением базовых или главных дерматоскопических паттернов или дерматоскопических структур, в том числе неспособность отличить псевдоподии от периферических глобул; поиск таких структур, как кристаллические, с использованием неполяризованного света. |
Процедурные (технические) ошибки: |
| 1. Выбор новообразований для дерматоскопии. Необходимо обследовать все новообразования на теле в зависимости от количества и расположения: |
| Обследование только отдельных меланоцитарных новообразований, указанных пациентом. Обследование отдельных меланоцитарных новообразований, отобранных врачом на основе клинической оценки по правилу ABCDE или при наличии черных очагов, крупных новообразований, выступающих или расположенных в местах, подвергающих их риску злокачественности за счет травмирования (в зоне нижнего белья, в акральных зонах). Неприменение дерматоскопии к розовым немеланоцитарным невусам. Использование дерматоскопии с периодичностью, не позволяющей установить профиль меланоцитарного невуса. Бессмысленное обследование пациентов без осмотра генитальных зон, ягодиц, межъягодичной зоны, ступней или скальпа (из чувства стыда или из-за несогласия пациентов на обследование данных зон). Недостаток знаний относительно факторов, которые могут влиять на дерматоскопический паттерн или доброкачественное меланоцитарное образование, и нецелесообразное хирургическое удаление (дерматоскопическое исследование загорелых пациентов или использующих автозагар, что может менять цвет дерматоскопического паттерна). Невозможность обследования без планирования контрольных осмотров (каждые три месяца, каждые 6 месяцев, каждые 12 месяцев, менее часто, никогда). |
| 2. Выбор метода дерматоскопии: |
| Неправильное нанесение иммерсионной жидкости во время дерматоскопического обследования с использованием неполяризованного света. Вероятность ошибочного диагноза меланомы, узловой или бессимптомной меланомы вследствие использования не поляризованного дерматоскопа; кристаллические структуры, блестящие белые полосы определяются в поляризованном свете. Невозможность дерматоскопического обследования при длинносрочном контроле отдельных новообразований — невозможность выявления новых очагов, неспособность оценить развитие наблюдаемых меланоцитарных новообразований, особенно медленно растущих меланом in situ с небольшим диаметром. |
Все это может привести к неверной диагностике меланомы. Полнота дерматоскопического обследования должна стать частью медицинской практики. Риск пропустить злокачественное новообразование из-за невозможности проведения тотального обследования кожных покровов всего тела составляет 2,7 % (16).
В настоящее время дерматоскопия является точным методом выявления меланомы и минимизации неоправданных иссечений (так называемое количество, требующее иссечения — NNE, определяемое как отношение общего количества удаленных новообразований к количеству удаленных меланом (17, 18).
Недостаток знаний, относящихся к факторам, которые могут повлиять на дерматоскопический паттерн новообразования, согласно правилу «4 х 4 х 6» (19), может привести к неоправданному хирургическому удалению новообразования. Кроме того, дерматоскопическое обследование загорелых пациентов или тех, кто пользуется автозагаром, что может изменить цвет дерматоскопического рисунка, часто приводит к постановке ошибочного диагноза меланомы (20–22).
Чрезвычайно важно разработать стратегию дерматоскопического контроля для пациентов в зависимости от индивидуальных особенностей. Argenziano и соавторы (23) предлагают производить дерматоскопический контроль для предварительной оценки и последующее наблюдение отдельных новообразований при необходимости каждые 3 месяца вплоть до 54 месяцев (23).
Дерматоскопию следует проводить при краткосрочном мониторинге через 3 месяца (изменение характеристик меланомы наблюдается через 2–4 месяца), среднесрочном контроле с осмотром через 6 месяцев или долгосрочным — с ежегодным осмотром (особенно для медленно растущих меланом) (23).
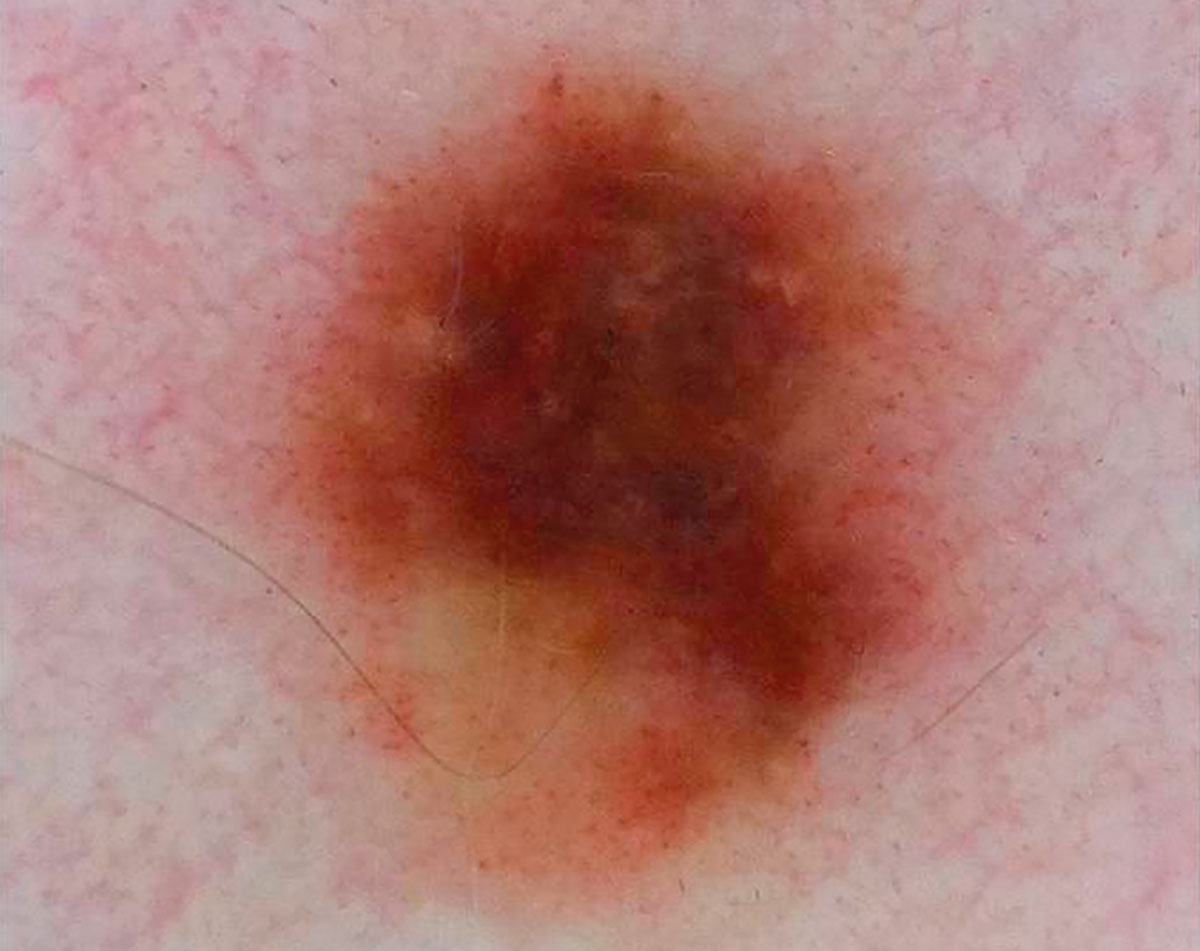
Рисунок 1. Дерматоскопический снимок меланомы in situ диаметром менее 5 мм.
Дерматоскопия показывает присутствие атипичных сосудов, атипичных глобул нерегулярного цвета, нерегулярных радиальных линий и нерегулярных многоцветных, коричневых и сине-серых участков
Степень соответствия составляет 84 % для протокола краткосрочного контроля, 64 % — для среднесрочного и 30 % — для долгосрочного (23). Периодичность контрольных осмотров зависит также от возраста пациента. Средний интервал в дерматоскопическом контроле составляет 20 месяцев (24) из-за вероятности развития медленно растущей меланомы (SGM).
Критерия для наблюдения отдельного новообразования являются асимметрия цвета, сетчатый рисунок и зоны регрессии (24). Ранние меланомы, выявленные цифровым методом, могут быть меньше в диаметре. Дерматоскопическим признаком при диагностике меланомы только лишь в контексте сравнительного исследования было небольшое увеличение диаметра очагов диаметром менее 2 мм (24).
В большом дерматоскопическом исследовании медленно растущей меланомы (25) дерматоскопическими признаками, предполагающими ее развитие, были недостаточные изменения диаметра и рост (75 % случаев) при наиболее медленном росте диаметра до 2 мм, разрушение более крупных структур, замена меланоцитарной сетки бесструктурными участками, появление новых цветовых оттенков (светло-коричневый исчезает, темно-коричневый появляется; такие цвета как красный, серый, черный и синий становятся более заметными) и новые дерматоскопические признаки меланомы, в том числе негативная сеть и сине-белая структура (25).
Выбор оптимального метода дерматоскопии
Иногда ошибка диагноза может произойти из-за небрежного использования дерматоскопии. Кроме упомянутых выше стандартных методов, для проведения дерматоскопического обследования с использованием ручного дерматоскопа важно правильно наносить иммерсионную жидкость во время дерматоскопического исследования в неполяризованном свете (2).
Вероятность ошибочного диагноза при выявлении узловой или бессимптомной меланомы может произойти из-за использования дерматоскопа с неполяризованным светом, тогда как блестящие белые полосы (кристаллы или кристаллические структуры) определяются дерматоскопами, использующими поляризованный свет (27).

Дерматоскоп Handyscope – устройство для мобильной цифровой дерматоскопии (FotoFinder)
Первое в мире устройство для цифровой теледерматоскопии, работающее на iOS и Android. В отличие от множества обычных дерматоскопов, handyscope соединяется с камерой мобильного устройства и использует специализированное программное обеспечение, включающее в себя оценку новообразований искусственным интеллектом, сервисы второго мнения и анализа клинических данных, а также сервисы защищенного облачного хранения дерматоскопических снимков.
Блестящие белые полосы указывают на злокачественность (отношение шансов: 10,534), особенно в случаях меланомы с инвазией, меланомы с высокой оценкой тотальной дерматоскопии (TDS) и тонких бессимптомных меланом (27). Кроме того, недостаточность архивных записей о предыдущих дерматоскопических обследованиях при контроле отдельных новообразований, а также невозможность определить новые очаги, неспособность оценить развитие наблюдаемых меланоцитарных новообразований, особенно медленно растущих меланом (24,25) или меланом in situ маленького диаметра, могут привести к тому, что меланома останется незамеченной.
Согласно Puig и Malvehi (28) дерматоскопическое обследование, тотальное фотографирование всего тела (TBD), цифровая дерматоскопия (DD) имеют важное значение для выявления меланомы. Цифровой контроль (DFU) у пациентов с диспластическими невусами позволяет выявить новые новообразования и изменения в существующих очагах (28).
Сочетание тотального фотографирования всего тела и цифровой дерматоскопии называется двухступенчатым методом цифрового контроля и способствует раннему выявлению меланомы на основе наблюдения макроскопических и дермоскопических изменений (29).
Ошибки, связанные с дефицитом знаний
В широком смысле ошибки, связанные с дефицитом знаний, включают диагностику и терапевтические решения, принятые в результате недостаточных знаний в области дерматоскопии. Неверный выбор новообразований для дерматоскопического обследования может быть связан с недостаточным пониманием дерматоскопического паттерна или структур, неспособностью отличить псевдоподии от периферических глобул, а также недостаток знаний различных алгоритмов дерматоскопического анализа (1, 2, 19, 30-32).
Каждый врач, выполняющий дерматоскопию, должен знать основные правила (контрольные списки): 3-точечное правило Argenziano (4, 33), 7-точечное итальянское правило (34), алгоритм, основанный на анализе паттерна («хаос и признаки») (35), австралийский метод Мензиса, 7 признаков меланомы или метод дерматоскопии Штольца и ABC-правило Блума (36), широко описанные в медицинской литературе в связи с их чувствительностью и специфичностью.
При применении правила ABCD для диагностики меланомы кожи чувствительность составляет 90,5 %, специфичность 72,4 % и диагностическая достоверность 78,1 % (36).
Результаты применения правила ABC показывают соответственно 90,5 %, 87 % и 88,1 %; метода Мензиса — 95,2 %, 77,8 %, 83,3 %; 7-признаков — 94 %, 74,6 % и 80,7 %, 7-точечного метода — 90,5 %, 87 % и 88,1 % (36). Чувствительность при использовании 3-точечного метода дерматоскопии достигает 89,6 % при 94,2 % специфичности (33).
В соответствии с 3-точечным методом следует уделить внимание асимметрии дерматоскопических правил и оценкой только лишь на основании одного из них, например, используя только правило ABCD Штольца. Поиск, например, кристаллических структур в неполяризованном свете — это не только техническая ошибка, но и ошибка, обусловленная дефицитом знаний.
Дерматоскопическая оценка отдельных немеланоцитарных новообразований должна основываться на общей структуре всего рисунка (зависит от выбранных паттернов) и локальных структурах (на основе выбранных дерматоскопических структур и признаков) и базироваться на расположении дерматоскопических структур, а не симметрии новообразования (4, 33). Также следует использовать другой нестандартный критерий — симптом «гадкого утенка» («ugly duckling» [37, 38] или симптом «fancy looking, так называемый признак «black sheep» [39]), а не только алгоритмы дерматоcкопического анализа.
Правило 4 х 4 х 6, предложенное Zalaudek и соавторами (19), позволяет клиницистам фиксировать общий паттерн и фак- торы, которые влияют на терапевтическое решение при установлении дерматоскопического диагноза отдельного меланоцитарного новообразования. Четыре дерматоскопических критерия связаны с цветом, паттерном, распределением пигмента и локализацией новообразования (19).
Шесть факторов, которые влияют на дерматоскопические действия, включают возраст, фототип кожи по Фицпатрику, историю болезни, воздействие ультрафиолета, беременность и динамику роста (19).
4 дерматоскопических критерия
| Черный | Глобульный | Многоочаговый | Акральные участки |
| Серый | Звездчатый | Необычный | Ногти |
| Коричневый | Сетчатый | Центральный | Лицо |
| Синий | Однородный синий |
Равномерный | Слизистая |
6 факторов
| Возраст | Воздействие ультрафиолета |
| Фототип кожи по Фицпатрику | Беременность |
| История болезни | Динамика роста |
Рисунок 2. Правило 4 х 4 х 6, предложенное Zalaudek и соавторами (19).
4 дерматоскопических критерия, распределенных по 4 подгруппам с 6 факторами, влияющими на терапевтическое решение, на основе дерматоскопии.
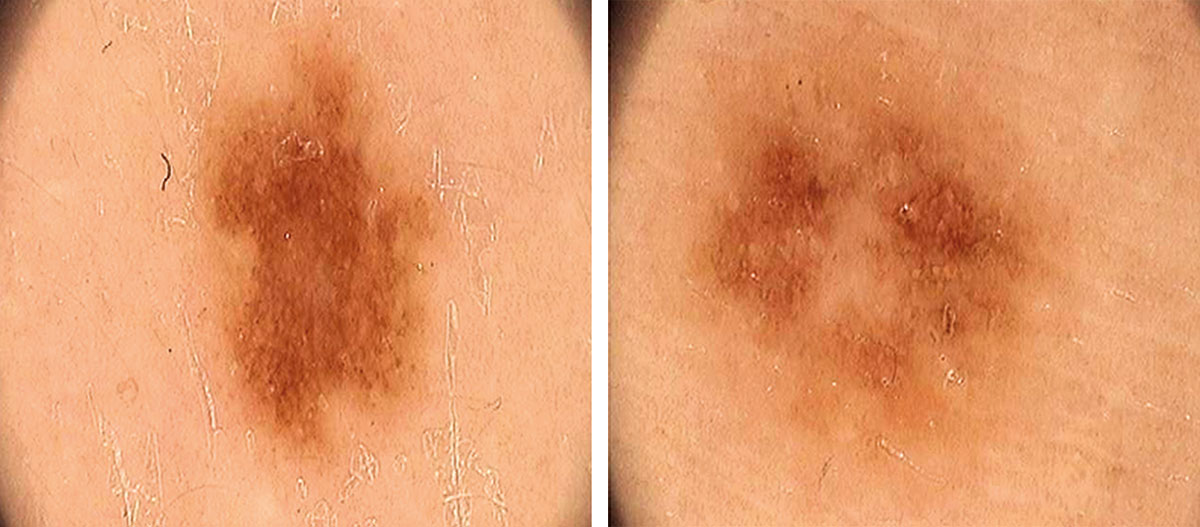
Рисунок 3. Два разных меланоцитарных новообразования у одного и того же пациента
в профиле, типичном для данного пациента
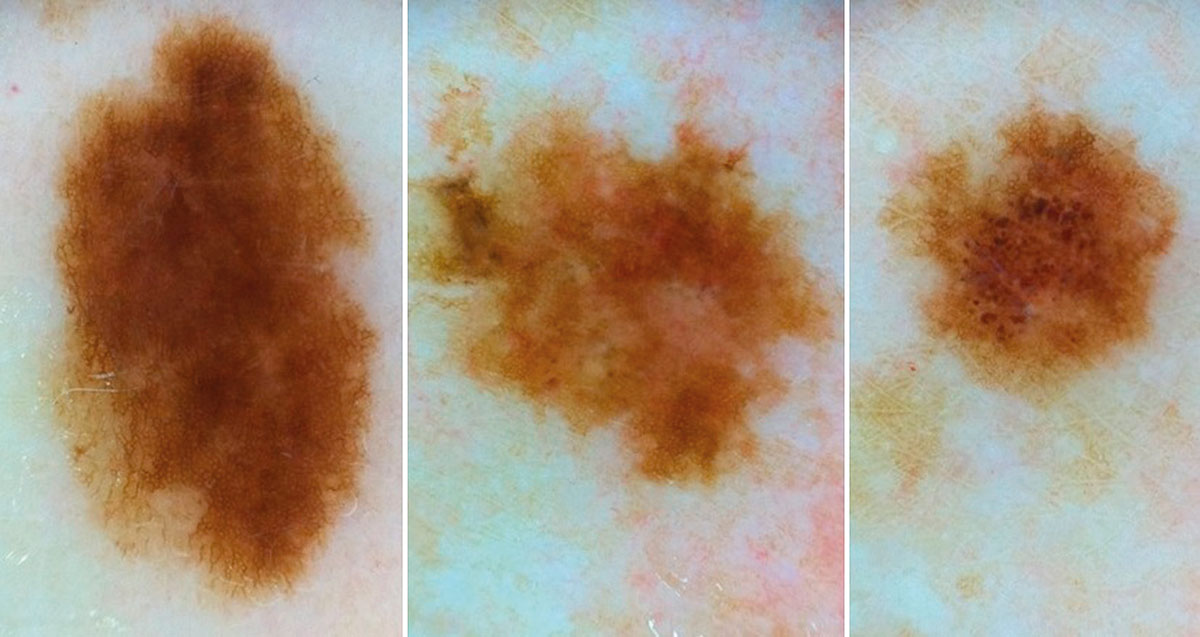
Рисунок 4. Три разных меланоцитарных новообразования у одного пациента
с дерматоскопическим профилем «подозрительное новообразование –
подлежит удалению». На деле «signature nevus», не подлежащие удалению
Правило 4 х 4 х 6, описанное ранее Zalaudek и соавторами (19), показано на Рисунке 2. В дифференциальном диагнозе меланоцитарных новообразований полезно определить так называемый профиль невуса, распространенный и характерный для большинства новообразований (6) (Рисунок 3).
Недостаточное знание критериев определения меланоцитарных новообразований и так называемых «signature nevus», характерных и индивидуальных для конкретного пациента (4) (Рисунок 4), может привести к ненужному хирургическому иссечению новообразований, которые кажутся подозрительными (например, выбор сразу 5–10 меланоцитарных новообразования для удаления во время одного обследования).
В настоящее время дерматоскопия позволяет выявлять меланому in situ диаметром менее 5 мм. В таких случаях стандартные дерматоскопические правила не работают и, следовательно, чрезвычайно важно понимать дерматоскопические признаки меланомы in situ (MIS).
Дерматоскопические признаки in situ меланом — это сетчатый рисунок, сине-серая сеть, многокомпонентная, очаговая, спитцоидная негативная сеть, сеть из глобул синего цвета и глобулярная сетчатая структура (41). Новым признаком меланомы in situ является также «mistletoe sign» (знак омелы) (42).
Меланома in situ, как правило, больше в диаметре, чем диспластический невус; атипичная сеть покрывает более половины площади, обычно присутствуют несколько типов пигментной сети, в центральной и периферийных зонах имеются бело-голубые участки регрессии (43).
В недавнем исследовании Seidenari и соавторов (44) из 22 микромеланом (диаметром менее 4 мм) 12 были определены как меланомы in situ с наиболее частым проявлением атипичной пигментной сети и нерегулярного цвета (44). В диагностике черных узелков должно применяться правило сине-черных точек.
Стандартный дерматоскопический критерий в комбинации с поиском синих и черных цветов в новообразовании дает 90,6 % точность и 92 % специфичность при выявлении узелковой меланомы (45). Предельно важным в дифференциальном дерматоскопическом анализе меланомы является понимание дерматоскопического изображения симулянтов меланомы (черного себорейного кератоза, синего невуса и многих других) (46-48).
Важно подчеркнуть, что терапевтические решения должны приниматься на основе правила 4 х 4 х 6 (19) и никогда на основе единственного дерматоскопического критерия. Что касается исследования Argenziano и соавторов (19), дерматоскопия повышает выявление ранней меланомы за счет трех главных аспектов: дерматоскопические признаки меланомы гораздо раньше выявляются при дерматоскопии, чем при клиническом обследовании; клиницисты чаще проверяют не просто подозрительные, а даже банально выглядящие новообразования и более тщательно наблюдают пациентов (49).
Полное обследование кожных покровов, наблюдение пациентов со множественными родинками, адекватная диагностика новообразований, требующих лечения; использование сравнительного подхода к пациентам с множественными невусами — это ключ к надлежащему выявлению меланомы и предотвращению базовых ошибок (49).
Таким образом, во избежание ошибочной диагностики меланомы Lallas и соавторы (5) рекомендовали обследовать все новообразования на коже, осматривать все участки тела, принимать 10-секундное решение (когда время обследования новообразования дольше, оно требует удаления), наблюдать пациентов со множественными меланоцитарными новообразованиями, всегда иссекать подозрительные узелковые новообразования и сочетать клинический критерий с дерматоскопическими, а также коррелировать клинические критерии с гистопатологическими (50).
В настоящее время дерматоскоп является незаменимым диагностическим инструментом для каждого врача, сравнимым со стетоскопом, который необходим для обследования физического состояния каждого пациента (51).
Конфликт интересов
Авторы не сообщают о конфликте интересов.
Список литературы
1. Kaminska-Winciorek G. Digital dermatology. Cornetis, Wrocław 2008.
2. Kaminska-Winciorek G, Spiewak R. Basic dermoscopy of melanocytic lesions for beginners. Postepy Hig Med Dosw (Online) 2011; 65: 501-8.
3. Zalaudek I, Kittler H, Marghoob AA, et al. Time required for a complete skin examination with and without dermoscopy: a prospective, randomized multicenter study. Arch Dermatol 2008; 144: 509-13.
4. Zalaudek I, Argenziano G, Soyer HP, et al. Dermoscopy Working Group. Three-point checklist of dermoscopy: an open internet study. Br J Dermatol 2006; 154: 431-7.
5. Blum A, Hofmann-Wellenhof R, Luedtke H, et al. Value of the clinical history for different users of dermoscopy compared with results of digital image analysis. J Eur Acad Dermatol Venereol 2004; 18: 665-9.
6. Argenziano G, Cacitrala C, Argido M. Dermoscopy of patients with multiple nevi: improvement management recommendations using a comparative diagnostic approach. Arch Dermatol 2011; 147: 46-9.
7. Kaminska-Winciorek G, Spiewak R. Tips and tricks in the dermoscopy of pigmented lesions. BMC Dermatol 2012; 12: 14.
8. Giacomel J, Zalaudek I, Mordente I, et al. Never perform laser treatment of skin tumors with clinical “EFG” criteria. J Dtsch Dermatol Ges 2008; 6: 386-8.
9. Fernandez EM, Helm KF. The diameter of melanomas. Dermatol Surg 2004; 30: 1219-22.
10. Abbasi NR, Yankowitz M, Gutkowicz-Krusin D, et al. Utility of lesion diameter in the clinical diagnosis of cutaneous melanoma. Arch Dermatol 2008; 144: 469-74.
11. Goldsmith SM. A series of melanomas smaller than 4 mm and implications for the ABCDE rule. J Eur Acad Dermatol Venereol 2007; 21: 929-34.
12. Helsing P, Loeb M. Small diameter melanoma: a follow-up of the Norwegian Melanoma Project. Br J Dermatol 2004; 151: 1081-3.
13. De Giorgi V, Savarese I, Rossari S, et al. Features of small melanocytic lesions: does small mean benign? A clinical-dermoscopic study. Melanoma Res 2012; 22: 252-6.
14. Bono A, Bartoli C, Baldi M, et al. Micro-melanoma detection. A clinical study on 22 cases of melanoma with a diameter equal to or less than 3 mm. Tumori 2004; 90: 128-31.
15. Pupelli G, Longo C, Veneziano L, et al. Small-diameter melanocytic lesions: morphological analysis by means of in vivo confocal microscopy. Br J Dermatol 2013; 168: 1027-33.
16. Argenziano G, Zalaudek I, Hofmann-Wellenhof R, et al. Total body skin examination for skin cancer screening in patients with focused symptoms. J Am Acad Dermatol 2012; 66: 212-9.
17. Argenziano G, Cerroni L, Zalaudek I, et al. Accuracy in melanoma detection: a 10-year multicenter survey. J Am Acad Dermatol 2012; 67: 54-9.
18. Chen L, Dusza S, Grazzini M, et al. Redefining the number needed to excise. Australas J Dermatol 2013; 54: 310-2.
19. Zalaudek I, Docimo G, Argenziano G. Using dermoscopic criteria and patient-related factors for the management of pigmented melanocytic nevi. Arch Dermatol 2009; 145: 816-26.
20. Orpin SD, Preston PW, Salim A. The ‘St Tropez’ sign: a new dermoscopic feature of seborrheic keratoses? Clin Exp Dermatol 2006; 31: 707-9.
21. Hofmann-Wellenhof R, Wolf P, Smolle J, et al. Influence of UVB therapy on dermoscopic features of acquired melanocytic nevi. J Am Acad Dermatol 1997; 37: 559-63.
22. Kaminska-Winciorek G. Dermatoscopy of melanocytic lesions: an influence of ultraviolet radiation. Przegl Dermatol 2008; 95: 463-7.
23. Argenziano G, Mordente, I Ferrara G. Dermoscopic monitoring of melanocytic lesions: clinical outcome and patients compliance vary according to follow-up protocols. Br J Dermatol 2008; 159: 331-6.
24. Argenziano G, Kittler H, Ferrara G, et al. Slow-growing melanoma: a dermoscopy follow-up study. Br J Dermatol 2010; 162: 267-73.
25. Terushkin V, Dusza SW, Scope A, et al. Changes observed in slow-growing melanomas during long- term dermoscopic monitoring. Br J Dermatol 2012; 166: 1213-20.
26. Jaimes N, Marghoob AA. The morphologic universe of melanoma. Dermatol Clin 2013; 31: 599-613.
27. Shitara D, Ishioka P, Alonso-Pinedo Y. Shiny white streaks: a sign of malignancy at dermoscopy of pigmented skin lesions. Acta Derm Venereol 2014; 94: 132-7.
28. Puig S, Malvehy J. Monitoring patients with multiple nevi. Dermatol Clin 2013; 31: 565-77.
29. Salerni G, Carrera C, Lovatto L, et al. Characterization of 1152 lesions excised over 10 years using total body photography and digital dermatoscopy in the surveillance of patients at high risk for melanoma. J Am Acad Dermatol 2012; 67: 836-45.
30. Soyer HP, Argenziano G, Ruocco V, et al. Dermoscopy of pigmented skin lesions. Eur J Dermatol 2001; 11: 270-6.
31. Zalaudek I, Kreusch J, Giacomel J, et al. How to diagnose nonpigmented skin tumors: a review of vascular structures seen with dermoscopy: part II. Nonmelanocytic skin tumors. J Am Acad Dermatol 2010; 63: 377-86.
32. Zalaudek I, Manzo M, Savarese I, et al. The morphologic universe of melanocytic nevi. Semin Cutan Med Surg 2009; 28:149-56.
33. Soyer HP, Argenziano G, Zalaudek I, et al. Three-point checklist of dermoscopy. A new screening method for early detection of melanoma. Dermatology 2004; 208: 27-31.
34. Argenziano G, Catricalà C, Ardigo M, et al. Seven-point checklist of dermoscopy revisited. Br J Dermatol 2011; 164: 785-90.
35. Kittler H. Dermatoscopy: introduction of a new algorithmic method based on pattern analysis for diagnosis of pigmented skin lesions. Dermatooncology: Dermatol Pract Concept 2007; 13: 1.
36. Blum A, Rassner G, Garbe C. Modified ABC-point list of dermoscopy: a simplified and highly accurate dermoscopic algorithm for the diagnosis of cutaneous melanocytic lesions. J Am Acad Dermatol 2003; 48: 672-8.
37. Carli P, Chiarugi A, de Giorgi V. Examination of lesions (including dermoscopy) without contact with the patient is associated with improper management in about 30% of equivocal melanomas. Dermatol Surg 2005; 31: 169-72.
38. Scope A, Dusza SW, Halpern AC, et al. The “ugly duckling” sign: agreement between observers. Arch Dermatol 2008; 144: 58-64.
39. Thomas L. Braun R. Atlas of dermatoscopy. Urban & Partner, Wrocław 2008.
40. Argenziano G, Albertini G, Castagnetti F, et al. Early diagnosis of melanoma: what is the impact of dermoscopy? Dermatol Ther 2012; 25: 403-9.
41. Seidenari S, Bassoli S, Borsari S, et al. Variegated dermoscopy of in situ melanoma. Dermatology 2012; 224: 262-70.
42. Kaminska-Winciorek G, Właszczuk P, Wydmański J. “Mistletoe sign” probably a new dermoscopic descriptor fro melanoma in situ and melanocytic junctional nevus in the inflammatory stage. Postep Derm Alergol 2013; 30: 316-9.
43. Seidenari S, Ferrari C, Borsari S, et al. The dermoscopic variability of pigment network in melanoma in situ. Melanoma Res 2012; 22: 151-7.
44. Seidenari S, Ferrari C, Borsari S, et al. Dermoscopy of small melanomas: just miniaturized dermoscopy? Br J Dermatol 2014; 171: 1006-13.
45. Argenziano G, Longo C, Cameron A, et al. Blue-black rule: a simple dermoscopic clue to recognize pigmented nodular melanoma. Br J Dermatol 2011; 165: 1251-5.
46. Kaminska-Winciorek G, Wydmanski J. Benign simulator of melanoma on dermoscopy-black colour does not indicate always melanoma. J Preclin Clin Res 2013; 1: 6-12.
47. Kaminska-Winciorek G. Letter: “Blue pseudo-veil sign” – a new dermoscopic term? Dermatol Surg 2012; 38: 1574-5.
48. Kamińska-Winciorek G, Spiewak R. Dermoscopy on nevus comedonicus: a case report and review of the literature. Postepy Dermatol Alergol 2013; 30: 252-4.
49. Argenziano G, Albertini G, Castagnetti F, et al. Early diagnosis of melanoma: what is the impact of dermoscopy? Dermatol Ther 2012; 25: 403-9.
50. Lallas A, Zalaudek I, Apalla Z, et al. Management rules to detect melanoma. Dermatology 2013; 226: 52-60.
51. Zalaudek I, Lallas A, Moscarella E, et al. The dermatologist’s stethoscope-traditional and new applications of dermoscopy. Dermatol Pract Concept 2013; 3: 67-71.
Первый МГМУ им. И.М. Сеченова, Москва, 119991, Российская Федерация
Мордовцева В.В.
Государственный институт усовершенствования врачей Министерства обороны РФ
Меланома кожи с явлениями регресса: описание клинического случая и обзор литературы
Авторы:
Сергеев Ю.Ю., Мордовцева В.В.
Как цитировать:
Сергеев Ю.Ю., Мордовцева В.В. Меланома кожи с явлениями регресса: описание клинического случая и обзор литературы. Клиническая дерматология и венерология.
2017;16(5):36‑41.
Sergeev IuIu, Mordovtseva VV. Skin melanoma with regression phenomena: case report and literature review. Klinicheskaya Dermatologiya i Venerologiya. 2017;16(5):36‑41. (In Russ.)
https://doi.org/10.17116/klinderma201716536-41

Клинические проявления меланомы достаточно разнообразны, что может объяснять несвоевременную диагностику данной метастазирующей опухоли. Для повышения точности диагностики меланомы предложен ряд неинвазивных методик [1], однако «золотым стандартом» диагностики считается гистологическое исследование. Существенным ограничением используемых методов является их зависимость от опыта исследователей, недостаточность которого приводит к диагностическим ошибкам. Так, точность дерматоскопического исследования зависит от прохождения специализированной подготовки [2], а расхождения при трактовке гистологических препаратов меланоцитарных новообразований встречаются среди экспертов в 1/3 случаев [3].
Признаки регресса опухоли считаются одним из гистологических критериев, свидетельствующих о меланоме [4]. Тем не менее эти признаки нередко остаются незамеченными патоморфологами, что влечет за собой отсрочку в постановке диагноза или неверное стадирование злокачественного опухолевого процесса. Приводим описание клинического случая ошибки в диагностике меланомы кожи с явлениями регресса (МсР) и обзор литературы по данной проблеме.
Пациентка Н., 49 лет, была направлена для осмотра внутридермального невуса в подмышечной области. При полном осмотре кожных покровов были выявлены явления хронического фотоповреждения в верхней трети спины, единичные клинически атипичные невусы (рис. 1). В нижней трети левого бедра было обнаружено асимметричное по форме и окрашиванию образование с неровными границами, размером 9×6 мм, в пределах которого имелся плотный экзофитный компонент (рис. 2). Проксимальнее образования определялся нормотрофический рубец 3×1 см после хирургического иссечения «родинки» в условиях онкологического диспансера. Пациентка затруднялась точно указать давность существования образования и наличие в нем какой-либо динамики, а также результаты предыдущего оперативного лечения. Семейный анамнез по злокачественным опухолям кожи не был отягощен. При дерматоскопическом осмотре (рис. 3) была выявлена асимметрия образования по структурам и цвету, участки атипичной пигментной сети по периферии образования, участки рубцово-подобной депигментации и структуры регресса в центральной части образования. В пределах папулезного компонента определялись преимущественно сосуды в виде шпилек. По результатам клинического и дерматоскопического осмотра был выставлен предварительный диагноз: меланома кожи бедра, поверхностно-распространяющаяся форма с явлениями регресса. По результатам гистологического исследования в онкологическом диспансере был поставлен диагноз: сложный меланоцитарный невус. Пересмотр гистологических препаратов подтвердил диагноз поверхностно-распространяющейся формы МсР. На момент хирургического лечения клинических и лабораторных данных, свидетельствующих о наличии метастазов, не получено. На дальнейшее динамическое наблюдение у дерматолога пациентка не возвращалась.
Под регрессом меланомы понимают спонтанное исчезновение клеток первичной опухоли. Явления частичного регресса встречаются в меланомах с частотой от 10 до 35% вне зависимости от толщины опухоли по Бреслоу, а в меланомах толщиной менее 1 мм признаки частичного регресса регистрируются достоверно чаще — до 61% [5]. Полный регресс встречается крайне редко (0,22—0,27%), но такие случаи значительно труднее документировать [6]. Регрессу чаще подвергаются опухоли, расположенные на коже туловища или нижних конечностей [7].
Клинически регресс меланомы чаще всего характеризуется появлением белых или серо-голубых пятнистых участков в пределах образования. Расположение очагов регресса по периферии может затруднить правильную интерпретацию границ образования. С течением времени папулезный компонент меланомы стадии вертикального роста может стать плоским, а опухоль полностью регрессировать. В некоторых случаях регрессу предшествует воспалительная реакция или зуд в области образования, кровотечение из образования после незначительной травмы [8].
Дерматоскопические проявления частичного регресса меланомы включают ряд признаков, наиболее известными из которых являются участки рубцово-подобной депигментации и структуры регресса. Определения употребляемых в статье дерматоскопических признаков приведены в табл. 1. Указанные признаки изредка могут встретиться и в ряде меланоцитарных невусов (рис. 4), что обусловливает сложности при проведении дифференциальной диагностики между МсР и меланоцитарными невусами с явлениями регресса (МНсР). Обязательным показанием для проведения эксцизионной биопсии является одновременное наличие структур регресса и участков рубцово-подобной депигментации в образовании или степень их выраженности более 50% (т.е. занимают более половины площади образования) [9].
Для проведения дифференциальной диагностики между МсР и МНсР была предложена клинико-дерматоскопическая шкала, учитывающая шесть дерматоскопических структур, размер образования, пол и возраст пациента (табл. 2). Пороговое значение, при котором показано удаление образования, составляет 5 баллов и более. Образования, набравшие 4 балла и менее, требуют динамического наблюдения с повторным дерматоскопическим осмотром через 6 мес. По данным P. Rubegni и соавт. [10], чувствительность метода в диагностике меланомы составляет 98%, а специфичность — 76%.
Отдельной проблемой является полностью регрессировавшая меланома (пРМ). Таких случаев на сегодняшний день описано не более 50, причем большинство из них сопровождались развитием регионарных и/или отдаленных метастазов. Средний возраст пациентов на момент обращения составлял 48 лет, несколько чаще заболевание выявляли у мужчин. Погибали через 13 мес 1/3 пациентов после диагностирования метастатической меланомы [11]. Клинически пРМ может быть представлена беспигментными очагами, напоминающими рубец; частично или полностью пигментированными очагами с различной окраской, включая оттенки красного, серого и синего цвета. При дерматоскопическом исследовании возможно обнаружение участков рубцово-подобной депигментации, структур регресса, атипичных линейно-извитых сосудов, сосудов в виде точек или глыбок, розовой вуали, остаточной пигментации коричневого или черно-серого цвета и структур по типу хризалид [8].
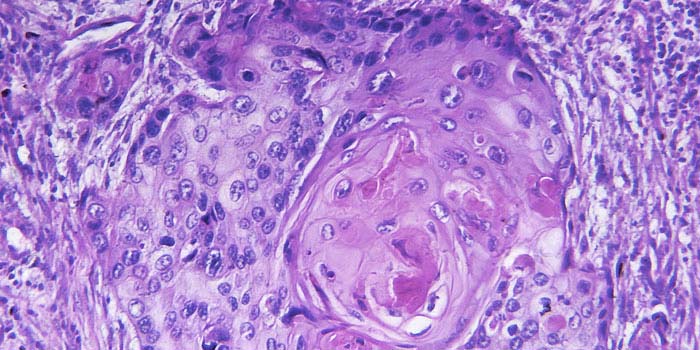
Гистологически регресс напоминает формирование рубцовой ткани и проявляется атрофией эпидермиса, уплощением эпидермальных отростков, фиброзом, неоангиогенезом и наличием лимфоцитарного инфильтрата с примесью меланофагов (рис. 5) [12]. По гистологическим признакам регресс меланомы можно условно разделить на три стадии: начальную, промежуточную и позднюю. Ранняя стадия характеризуется выраженной инфильтрацией опухоли лимфоцитами. Затем происходит полное или частичное разрушение клеток меланомы на всем протяжении или сегментарно, формируется фиброз различной степени выраженности и прочие выше перечисленные признаки регресса [13]. Для выявления меланоцитарной природы образования может потребоваться иммуногистохимическое исследование (окрашивание на антиген S100, Melan-A, реакция на тирозиназу) [14]. Критерии постановки диагноза пРМ (табл. 3) были предложены J. Smith и J. Stehlin [11] в 1965 г. и позднее модифицированы разными авторами.
Как показывают результаты иммуногистохимических исследований, в основе феномена спонтанного регресса лежат иммуноопосредованные механизмы. В частности, происходит активация нативного противоопухолевого иммунитета с участием цитолитических Т-лимфоцитов [15]. Некоторые авторы [16] полагают, что травма или инфекция могут усилить противоопухолевый ответ организма и вызвать регресс опухоли. Согласно другой теории, регресс первичной меланомы запускается через иммунную систему только при наличии метастазов в регионарных лимфатических узлах. Существующие теории предполагают, что клеточные компоненты врожденного иммунитета способны распознавать определенные структуры на раковых клетках и запускать процесс регресса первичной опухоли. Развитие метастатического процесса может означать ускользание клеток опухоли от иммунной системы благодаря мутациям или подавлению активности системы HLA, снижению продукции супрессивных цитокинов и другим нарушениям в противоопухолевой защите организма [17, 18].
Прогностическое значение регресса меланомы неоднозначно. По мнению R. Scolyer и соавт. [13], большинство исследователей, изучавших прогностическое значение регресса, не указывали стадию процесса, использовали разные критерии диагностики и включения пациентов в исследование. Все это затрудняет интерпретацию гистологических признаков регресса в контексте других прогностических факторов.
Однако большинство исследователей все же считают регресс отрицательным прогностическим признаком. При диагностированном полном регрессе первичной опухоли отдаленные метастазы выявляются у 4—10% больных. При наличии метастазов и полном регрессе первичной опухоли у пациентов обычно наблюдается быстрое прогрессирование болезни с летальным исходом в кратчайшие сроки. «Тонкие» меланомы при наличии в них значительного регресса (50% и более) также сопровождаются повышенным риском метастазирования на момент диагностики. Высказываются мнения о двух возможных причинах такого феномена. Первое — ошибка диагностики, связанная с неправильным определением толщины меланомы по Бреслоу (заниженное значение), и, как следствие, — с неверным стадированием опухолевого процесса. Второе — изначально неблагоприятный биологический потенциал опухоли, который ассоциирован со спонтанным регрессом [6].
Проблема «тонких» меланом с признаками регресса состоит еще и в том, что при них наблюдается довольно высокий процент ложноотрицательных результатов биопсии «сторожевого» лимфатического узла: т. е. на момент исследования поражение «сторожевого» узла отсутствует, а в дальнейшем развивается метастатический процесс. J. Rubinstein и соавт. [18] изучали прогностическую значимость локальных метастазов в случаях «тонких» меланом (с толщиной менее 1 мм) в одном учреждении на протяжении 15 лет. За это время биопсия «сторожевых» лимфатических узлов была проведена 252 пациентам. В исследование включались как пациенты с выявленными метастазами, так и пациенты с ложно-отрицательными результатами. Предпринималась попытка сопоставить гистологические изменения с поражением лимфоузлов и клиническим течением болезни. В среднем наблюдение за пациентами продолжалось в течение 45,5 мес. Метастазы в регионарных лимфатических узлах наблюдались у 12 (4,8%) пациентов, причем у 6 (2,4%) больных отсроченные метастазы развились в среднем через 37,5 мес после постановки диагноза. Гистологические признаки регресса не коррелировали с наличием метастазов, однако были предикторами ложноотрицательных результатов биопсии «сторожевых» лимфатических узлов. У пациентов с отсроченными метастазами гистологические признаки регресса первичной опухоли отмечались в 60% случаев, в то время как у пациентов с наличием положительного «сторожевого» узла — только в 16%.
Таким образом, отсутствие метастазов в «сторожевом» узле на момент удаления первичной опухоли с признаками регресса, независимо от ее толщины, не исключает возможность дальнейшего прогрессирования болезни. Пациентам с гистологическими признаками регресса меланомы возможно требуется более активное динамическое наблюдение с целью раннего выявления поражения регионарных лимфатических узлов. Низкая приверженность пациентов к динамическому наблюдению за новообразованиями кожи может служить препятствием в выявлении ранних симптомов прогрессирования заболевания [19].
Мордовцева В.В. — http://orcid.org/0000−0002−6396−2720
Сергеев Ю.Ю. — http://orcid.org/0000−0002−4193−1579
Авторы заявляют об отсутствии конфликта интересов.
Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
61453
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
Пересмотр гистологических стекол: опухолевая ткань
Полученный во время операции или на биопсии образец ткани (или клеточный материал) специальным образом фиксируют и окрашивают, чтобы изучить под микроскопом и иммуногистохимическими методами. Последние позволяют даже определить органопринадлежность опухоли. [1]
Что такое блоки и стекла?
Эти термины обозначают ткань, полученную во время биопсии и подготовленную особым образом. В первую очередь образцы заливают раствором формалина и проводят специальную обработку. Это нужно для того, чтобы зафиксировать материал, чтобы клетки не разрушились. Затем ткани необходимо придать нужную степень плотности. Для этого ее помещают в парафин – так получаются гистологические блоки.
Гистологические блоки, образец ткани помещен в парафин
Но и такие образцы пока еще не готовы к исследованию. Ткань в блоке нельзя рассмотреть под микроскопом, потому что она не пропускает свет, а слои клеток накладываются друг на друга. Чтобы ткань стала прозрачной и доступной для изучения, блок нужно нарезать на очень тонкие слои с помощью специального инструмента – микротома. Эти тоненькие слои помещают на стекла и фиксируют – получаются гистологические стёкла. [2,3]
Гистологические стекла
Если у пациента обнаружен рак, то лаборатория обязана хранить гистологические блоки пожизненно, а если патологии не выявлено – в течение пяти лет. Гистологические стекла при диагностированном онкологическом заболевании тоже хранятся пожизненно. Если нужно выполнить пересмотр, то можно обратиться в лабораторию, где проводилось исследование, и получить оба этих вида материала. [4]
Когда и почему необходим пересмотр стекол?
Если морфологическое заключение не соответствует клинической картине опухоли, а также снимкам МРТ или КТ, то стекла отправляют на пересмотр в другое лечебное учреждение. Обычно пересмотром стекол занимаются специалисты с многолетним стажем работы и уникальным опытом диагностики редких опухолей. Дополнительный ручной пересмотр исключает возможность ошибки, связанной с использованием автоматических анализаторов.
Почему могут возникать ошибки при первичном просматривании стекол?
- неправильный забор материала, например, захвачен не весь слой эпителия, и невозможно судить о глубине поражения;
- проведена биопсия участка здоровой ткани;
- некачественная обработка материала в лаборатории;
- малое количество изученных срезов;
- недостаточная квалификация патоморфолога. [5]
Качественное микроскопическое и иммуногистохимическое исследование позволяет начать оправданное и своевременное лечение опухоли, а значит, увеличивает шансы на излечение и выживаемость пациента при онкологических заболеваниях. Оптимально, если морфологический диагноз будет подтвержден двумя специалистами.
Список литературы:
- Tatyana S. Gurina; Lary Simms. Histology, Staining. Treasure Island (FL): StatPearls Publishing; 2021 Jan-.
- В. А. Корьяк, Л. А. Николаева. Основы гистологической техники. Учебное пособие.
- Гистологическое изучение микропрепаратов тканей и органов. Гистология, эмбриология, цитология. Под ред. д.м.н., доц. Н. Ю. Матвеевой. Владивосток, Медицина ДВ, 2015.
- Приказ МЗ РФ № 179н от 24.03.2016 г. «О правилах проведения патолого-анатомических исследований».
- P. Morelli, E. Porazzi, M. Ruspini, U. Restelli, and G. Banfi. Analysis of errors in histology by root cause analysis: a pilot study. J Prev Med Hyg. 2013 Jun; 54(2): 90–96.
Проблема предопухолевой и злокачественной патологии кожи является одним из приоритетных направлений для научных исследований и практического здравоохранения, что обусловлено повсеместным ростом показателей заболеваемости. Одной из наиболее частых патологий кожи являются меланоцитарные невусы, причем в возрасте 20-25 лет у каждого человека имеется от 12 до 20 невусов. Меланома кожи относится к разряду высокозлокачественных опухолей. Особую значимость проблема меланом приобретает потому, что новообразования кожи, под клинической маской которой может скрываться меланома, встречаются приблизительно у 80% населения (Фрадкин С.З., 2000). Из-за высокой потенции местного роста, регионального и множественного отдаленного метастазирования, способности к диссеминации по коже, меланому относят к одной из самых агрессивных форм злокачественных опухолей с непредсказуемым прогнозом (Барчук А.С., 2001). В реальной дерматологической практике на первый план выступает вопрос дифференциальной диагностики между новообразованиями кожи, а также меланомой и опухолями кожи эпителиального и сосудистого происхождения.
В настоящее время точность клинической диагностики первичных меланом у врачей общего профиля составляет только 37%. Врачебные ошибки связаны как с гипердиагностикой, так и с недооценкой клинических признаков заболевания, причем наибольшее число ошибочных диагнозов имеет место при поверхностно-распространяющихся опухолях.
Меланома кожи (МК) – это чрезвычайно злокачественная опухоль, развивающаяся из меланоцитов – пигментных клеток, продуцирующих специфический полипептид – меланин.
Известно, что заболеваемость меланомой кожи в последние годы неуклонно растет. Каждые десять лет число заболевших удваивается.
В большинстве стран интенсивный показатель заболеваемости меланомой колеблется от 5,0 до 30,0 и более на 100 тысяч населения в год, а удельный вес ее составляет 1-4% от всех злокачественных опухолей.
В большинстве стран меланома кожи чаще встречается у женщин, в то же время в Польше, США, Финляндии более высокий уровень заболеваемости отмечен у мужчин. По другим данным в Австралии и США заболеваемость мужчин и женщин равна.
Согласно исследованиям Avril M.F. преимущественная локализация меланом у женщин – нижние конечности (голени), у мужчин туловище (спина), у пациентов обоих полов в старшей возрастной группе (65 лет и старше) меланома локализуется преимущественно на коже лица.
Исследование причин смертности от меланомы кожи, проведенное в Канаде среди лиц различных профессий, показало, что среди мужчин значительное увеличение показателя было отмечено у администраторов и предпринимателей, бухгалтеров и архитекторов, химиков, включая фармацевтов, садовников и военнослужащих, среди женщин – у домохозяек и школьных учительниц. Преобладание меланомы кожи у лиц с высоким экономическим статусом, не работающих на открытом воздухе, авторы объясняют проведением летних отпусков на южных курортах, а у химиков и фармацевтов – влиянием профессиональных вредностей. По данным других авторов, заболеваемость меланомой кожи выше у людей со средним и высоким социально-экономическим статусом.
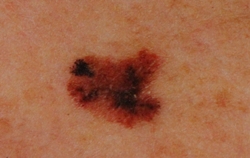
В литературе описаны факторы риска возникновения меланомы кожи. Они могут быть экзогенного и эндогенного характера. В наши дни воздействие ультрафиолетового спектра солнечной радиации признается одним из наиболее важных экзогенных факторов, способствующих возникновению меланомы кожи. Решающее значение при этом на защищенных одеждой участках тела. Отмечено, что большое значение в возникновении опухоли имеют резкое и интенсивное, возможно даже однократное, воздействие солнечной радиации. Это подтверждается тем, что меланома кожи чаще возникает в незащищенных одеждой участках тела. Отмечено, что большое значение в возникновении опухоли имеют солнечные ожоги, полученные в детском и юношеском возрасте.
Некоторые исследователи отмечают, что искусственное ультрафиолетовое облучение в солярии может быть фактором риска.
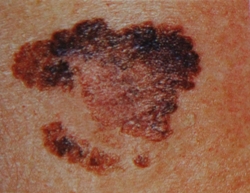
По мнению большинства исследователей, на частоту возникновения меланомы кожи влияют и генетические факторы, конституциональные особенности и характер пигментации, цвет кожи, волос, глаз, наличие веснушек на лице и руках, реакция кожи на ультрафиолетовые лучи. По данным большинства авторов «предполагаемый пациент» с меланомой имеет соломенные или рыжеватые волосы, голубые глаза и светлую (как сметана) кожу. Риск развития меланомы повышается для блондинов в 1,6 раза, в два раза – для людей со светлой кожей, в три раза – для рыжеволосых.
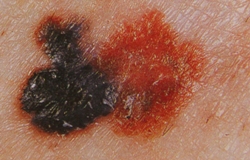
В научной литературе неоднократно описаны случаи возникновения меланомы кожи после травмы пигментных невусов. Хроническое повреждение обычно связано с постоянной травматизацией невусов одеждой или обувью.
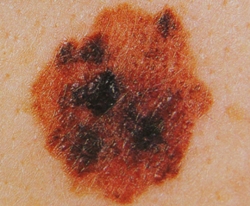
Критерием важности ранней диагностики злокачественной меланомы кожи является прямая зависимость сроков выживания больных от уровня инвазии и толщины опухоли. В последние годы было доказано, что злокачественная меланома при постановке своевременного раннего диагноза является потенциально полностью излечимым заболеванием. Установлено, что при первом уровне инвазии (толщине опухоли до 0,74 мм) выживаемость больных в среднем во все сроки наблюдения в течение десятилетнего периода, составляет 100%. При втором уровне инвазии (0,74-1,49 мм) в эти же сроки умирает около 4% больных, при третьем (1,5-2,99 мм) – уже около 14%, при четвертом уровне (3-4,99 мм) – почти каждый четвертый больной (24%), при пятом (5 мм и более) – около 40%. В более ранние сроки (до 5 лет) выживаемость больных со злокачественной меланомой при первом-втором уровне инвазии опухоли составляет 96,3%, а при пятом – лишь 42,3%.
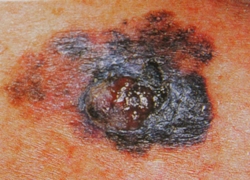
Однако, меланома может маскироваться под доброкачественные пигментные новообразования кожи. 16% пигментных новообразований кожи не имеют классических характеристик меланомы. Из наиболее часто встречающихся ошибочных диагнозов при клинической диагностике меланомы следует отметить невусы, гемангиома, базально-клеточную карцинома, себорейный кератоз, лентиго, реже – болезнь Боуэна, папиллома, дерматофиброма, пиогенная гранулема. С другой стороны, некоторые новообразования кожи клинически могут симулировать меланому: невусы, лентиго, голубой невус, себорейный кератоз, пигментированная базально-клеточная карцинома, дерматофиброма. Все эти пигментные новообразования кожи могут быть разделены на следующие категории: меланоцитарные, сосудистые, геморрагические, депозиционные (татуировки, инородные тела, импрегнация серебром), пороки развития и новообразования придатков кожи (пигментированная эккринная порома, трихолеммома, апокринная гидроцитома). Точность диагностики в этих случаях также очень важна, чтобы избежать неадекватной терапии, в которой нет необходимости.
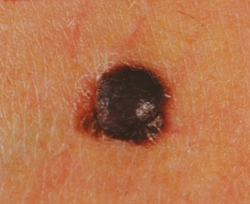
В настоящее время для ранней диагностики меланомы кожи применяют два современных метода исследования: эпилюминесцентная микроскопия (дерматоскопия, поверхностная микроскопия) и компьютерный анализ дерматоскопических снимков.
Большинство ученых связывают происхождение первичных меланом кожи с малигнизацией предшествующих пигментных невусов, при этом меланома развивается единым путем: сначала распространяется горизонтально в эпидермисе, затем вертикально прорастает в кожу.
Исходя из вышеизложенного, можно заключить, что ранняя диагностика первичной меланомы заключается в ее выявлении либо на стадии малигнизации предшествующих пигментных невусов, либо в случаях развития меланомы de novo, в период горизонтального роста новообразования.
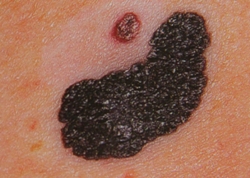
Смотря на хорошо известные клинические признаки злокачественной меланомы кожи и применяемые современные методы ее распознавания, ошибочные клинические диагнозы, по мнению некоторых авторов, составляют до 80%. Диагностика пигментных опухолей кожи представляет значительную трудность, так как эти образования отличаются значительным многообразием форм клинического течения, а гистологическое исследование – инцизионная биопсия при подозрении на меланому противопоказана. Хотя ряд авторов считают, что биопсия с последующим лечением меланомы никак не влияет на 5- и 10-летнюю выживаемость пациентов. Большинство клиницистов – онкологов этот метод для дифференциальной диагностики меланом не используют.
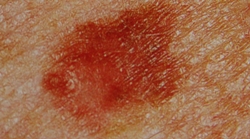
Радиофосфорная индикация в диагностике пигментных новообразований кожи применяется уже около шести десятилетий и, наряду с положительной оценкой ее, высказывается и отрицательное отношение к данному методу. Это, прежде всего, связано с тем, что доброкачественные пигментные новообразования также способны в значительной мере накапливать радиактивный фосфор. В пигментных невусах во все сроки исследования уровень накопления изотопа не превышает 200%, тогда как при злокачественной меланоме кожи – выше 200%, а к 96 часам составляет 400% и более. При меланоме в ряде случаев отмечаются ложно-отрицательные результаты, то есть уровень накопления изотопа бывает ниже 200%.
В настоящее время радиофосфорную диагностику рекомендуется применять только в комплексе с другими методами.
Основу другого- термографического метода диагностики (тепловизионного) составляет визуальная регистрация распределения температур на поверхности кожи. Получаемые в результате термографических исследований изображения позволяют выявить местные температурные нарушения, обусловленные патологическим процессом на поверхности кожи или подлежащих тканях. Регистрация температуры осуществляется посредством либо тепловизора, и тогда получают температурный «портрет» поверхности тела, либо дистанционных инфракрасных параметров.
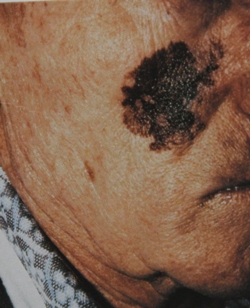
Поверхностные метастазы злокачественных опухолей кожи (внутрикожные, подкожные) также выявляются с высокой частотой (до 88-92% правильных заключений при первичном термографическом обследовании больных). Точность топической диагностики метастазов меланомы и рака кожи в лимфатические узлы колеблется от 80 до 90% в зависимости от локализации пораженного лимфатического коллектора.
Следует отметить, что комплексное применение современных методов лучевой диагнстики (рентгенографии, лимфографии, эхографии) при злокачественной меланоме кожи позволяет оценить состояние первичной опухоли и установить степень распространения процесса (регионарные и отдаленные лимфогематогенные метастазы), что имеет решающее значение для выбора лечебной тактики, но не для ранней диагностики новообразований кожи.
Лимфография и эхография применяется в основном для диагностики пораженных метастазами регионарных лимфоузлов, печени и других органов.
Диагностика меланомы в ранних стадиях (толщина менее 1 мм) предусматривает, прежде всего, исследование образования на коже, по поводу которого обратился пациент, и всей кожи рутинным физикальным методом. Очевидно, что весьма полезными в практике дерматолога, онколога, косметолога и врачей других специальностей окажутся современные методы ранней визуальной диагностики. Лемехов В.Г. утверждает, что к настоящему времени опыт проведения скрининга меланомы свидетельствует о высокой его эффективности в ранней диагностике опухолей. Применение наряду с физикальным врачебным исследованием новых скрининговых методов будет способствовать улучшению показателей, отражающих состояние ранней диагностики меланомы, и результатов лечения этого опасного заболевания.
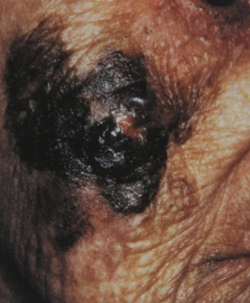
Оценивая цвета и структурные компоненты можно легче дифференцировать меланоцитарные и немеланоцитарные новообразования, доброкачественные и злокачественые. Методом дерматоскопии выявляется несколько важных структурных феноменов. Пигментная сеть – наблюдается только в меланоцитарных новообразованиях. Участки, лишенные структуры – этот признак регрессии опухоли типичен для меланом. Радиальные лучи – лучи от темно-коричневого до черного цвета, радиально ориентированные, являются признаком меланомы, хотя могут встречаться в случае невуса Шпитц. Черные точки — признак злокачественности. Хорошо отграниченные точки диаметром менее 0,1 мм являются скопление меланоцитов, расположенных поверхностно в эпидермисе, практически в роговом слое. Коричневые глыбки часто являются признаком внутридермального невуса. Скопления меланоцитов (диаметром более 0,1 мм) находятся в более глубоких слоях эпидермиса и сосочковом слое дермы. Роговые кисты – патогномонический признак старческой себорейной кератомы. Это закупоренные волосяные фоликулы. Закупоренные протоки сальных желез (псевдлугревые высыпания) – также характерный признак себорейной кератомы. Хотя последние два феномена могут наблюдаться в случае папилломатозного меланоцитарного невуса.
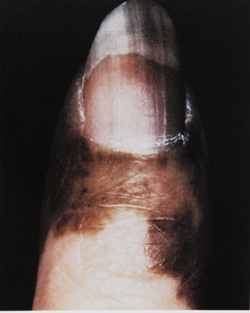
Эпилюминесцентная микроскопия – это мощный диагностический инструмент для дифференциальной диагностики меланоцитарных и немеланоцитарных пигментных новообразований кожи, позволяющий избежать тяжелого хирургического лечения пигментных новообразований кожи, позволяющий избежать тяжелого хирургического лечения пигментных новообразований кожи с низким риском малигнизации.
Первое зарубежное сообщение о применении метода дерматоскопии для диагностики меланомы относится к 1987 году, когда применили метод без иммерсионного масла и стандартную методику дерматоскопии.
Так как диагностическая точность ABCD – правил дерматоскопии не достигает 100% ведется постоянный поиск новых методов для анализа дерматоскопического имиджа. Предложен новый 7-бальный тест, базирующийся на упрощенном анализе дерматоскопического узора. В результате выделили главные и дополнительные критерии диагностики. Главные критерии получают по два бала. Это атипитчная пигментная сеть, серо-голубые области, атипичный сосудистый узор. Добавочными критериями, получающими по одному баллу, являются области регрессии, нерегулярно представленные на поверхности образования, точки и глыбки, радиальные лучи, неравномерная диффузная пигментация. 
Таким образом, с помощью этой системы оценки дерматоскопического узора менее опытные специалисты могут получить более точные результаты.
Сообщается о существенной пользе расширения ABCD-правил дерматоскопии, ибо раннее диагностирование и ранее лечение меланомы остаются наиболее важными факторами в улучшении прогноза пациентов с первичной опухолью.
Для улучшения ранней диагностики меланом и проведения дифференциального диагноза с другими новообразованиями кожи необходимо сочетание дерматоскопии с другими методами исследования.
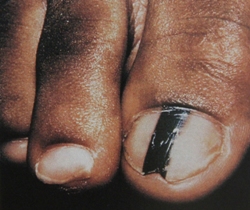
Гистология родинки: этапы исследования и частые вопросы пациентов
Гистология родинки
Медицинский эксперт статьи
Прежде всего, нужно понять, что такое гистология родинки. Для ее проведения необходимо сдавать специальные анализы ткани, которые проводятся с помощью микроскопа. Такое исследование рекомендуется всем тем, у кого невус может переродиться в злокачественную опухоль. В случае, если результаты исследования покажут, что в тканях есть раковые клетки, врач назначит определенное лечение. Обычно подобные родинки сразу же удаляют.
[1], [2], [3], [4], [5], [6], [7], [8]
В каком случае необходимо проводить гистологию родинки?
- Если вы нечаянно травмировали образование, особенно, если оно выступало над кожей.
- Если невус начинает интенсивно расти.
- В случае, когда на фоне образования начинают возникать бляшшкообразные пятна.
- Когда появляются болевые ощущения или родинка начинает зудеть.
- Если невус сморщился или начал шелушиться.
- Когда появляется кровотечение.
- В случае, когда родинка начинает менять свой окрас.
- Если структура невуса изменяется.
Можно ли удалять родинку без гистологии?
Без гистологии удалять родинки не рекомендуется, особенно, если есть подозрение на возможность развития опухоли. Но, как правило, обыкновенные невусы, которые не считаются меланомоопасными, можно лечить, не сдавая биоптаты ткани. Их обычно удаляют таким методом, чтобы можно было после операции отдать часть полученного материала на гистологию и выяснить все о невусе.
Если существует риск того, что родинка в любой момент перерастет в злокачественную, необходимо в обязательном порядке сдать все анализы дерматологу, а потом уже, после получения результатов, обратиться к онкологу. Именно последний и выберет тот метод удаления, который подойдет в вашем конкретном случае.
Результаты гистологического исследования
Так что же вы узнаете, когда сделаете гистологическое исследование родинки? Главное то, что врач сможет определить, является ли родинка доброкачественной или злокачественной. Помните, что самостоятельно расшифровать результат гистологии родинки вы не сможете, поэтому обязательно отправляйтесь с ним к тому врачу, который выписал вам направление. Следует также знать, что на сегодняшний день онкология имеет четыре степени. Опухоли на ранних стадиях лечатся намного быстрее и эффективнее.
Гистология удаленной родинки
Даже маленькие родинки, едва заметные на человеческом теле, могут быть опасными для вашего здоровья. Именно поэтому врачи рекомендуют время от времени проверять их. В случае, если вы начали замечать какие-либо изменения невуса (в размере, форме, цвете), если родинка начала чесаться или болеть, необходимо сразу же пройти соответствующие анализы. Иногда человек просто желает избавиться от висячей или больной родинки, которые могут мешать нормально жить или же ухудшать внешний вид кожи. В таком случае гистологию до операции проводят не всегда. Но во время удаления врач возьмет у вас небольшое количество ткани из невуса и отправит на анализ. Позже результаты могут показать, было ли ваше образование доброкачественным или злокачественным.
Как делают гистологическое исследование родинки?
Гистология родинки обязательно проводится в специально оборудованной лаборатории до или после того, как невус был удален. После иссечения врач получает материал, который помещается в специальный раствор и доставляется в лабораторию. Там лаборант помещает ткани на стекло и окрашивает их. Через некоторое время патоморфолог осматривает материал под микроскопом, чтобы сказать, является ли родинка злокачественной или нет. Гистологическое исследование родинки может проводится:
- Если вы получили направление от специалиста.
- Если есть рекомендация врача, даже без направления.
- Если вы желаете получить результаты.
Многие клиники проводят гистологию бесплатно, если у вас есть направление на руках.
Сколько делается гистология родинки?
Как правило, анализ в лаборатории делается не очень долго. Стандартным временам на гистологию считается неделя. Но стоит понимать, что срок проведения гистологического исследования родинки сильно зависит от самой клиники, ее популярности, количества больных в этой больнице. Если вы выбрали крупную частную клинику, то можете быть уверены, что получите результат быстрее.
Гистология родинки: техника проведения и расшифровка результатов
Родинка является пигментным пятном, которое изначально носит доброкачественный характер. Образование на коже бывает телесного, коричневого, черного или гoлyбого цвета. По форме различают выпуклые, плоские и висячие невусы. Под влиянием внешних и внутренних факторов в образовании может начаться процесс перерождения. Он характеризуется преобразованием здоровых клеток в онкологию. При первых признаках перерождения необходимо обращаться к врачу, который, после проведенного осмотра, назначит сдачу анализа на гистологию.
Суть процедуры
Гистология невуса заключается в исследовании его небольшой части. В результате обследования будет выявлено наличие или отсутствие раковых клеток в родинке.
- Кусочек биоматериала, предназначенный для исследования, берут в процессе оперативного вмешательства. Иссеченный материал трaнcпортируют в лабораторию в специальной емкости.
- Игловым методом. Участок ткани невуса иссекают при помощи дермопанча. До того как начнется процедypa, человеку вводят анестезирующее средство.
- Эксцизионный метод выполняется в процессе хирургического вмешательства. Удаление происходит всего тела родинки. Внутридермальный невус отправляют на гистологию вместе со здоровыми клетками, которые располагались около него.
После забора материала или полностью удаленной родинки ее погружают в емкость с формалином, где она может храниться до 25 дней. Длительность хранения не оказывает влияния на качественные характеристики материала. Условием для этого является количество формалина в емкости: его должно быть в несколько десятков раз больше, чем объем невуса.
Гистология родинки после удаления возможна после заморозки невуса. Метод применяют в случае срочной необходимости изучения родинки на наличие злокачественных клеток. Если в результате срочного исследования выявили заболевание меланому, врач поменяет тактику оперативного вмешательства.
Кроме забора части невуса, существует цитологический метод изучения опухоли. Хирург производит соскоб с поверхности пятна. С помощью стекла, которое прижимается к родинке, берется материал. Его отправляют на лабораторное обследование.
Когда требуется гистологический анализ
Можно самостоятельно обратиться за гистологическим исследованием. Причинами служат:
- пятно приобрело размытый рисунок, исчезли четко очерченные границы;
- образование резко увеличивается в размере, стало воспаляться;
- при пальпации или соприкосновении с предметами одежды начинает болеть;
- появилась бугристость;
- невус покрылся блестящей пленкой;
- выпали волосинки, которые располагались на родинке;
- невус приобрел темный оттенок;
- родимое пятно подвергается постоянному механическому воздействию;
- около образования возник белый ореол;
- из родинки выступает кровь или гной;
- появился зуд и жжение;
- плоское пятно превратилось в выпуклую родинку;
- появилось шелушение на поверхности родинки или около нее;
- родинка стала твердой на ощупь.
Гистология родинки может проводиться в том случае, если человек решил ее удалить по эстетическим соображениям. Невус способен располагаться на лице, голове, шее, что портит внешний вид человека. При отсутствии опасных симптомов все равно проводится анализ на гистологию. Это помогает определить наличие меланомы, которая на ранней стадии поддается лечению без последствий для здоровья.
Техника проведения и длительность процедуры
Транспортировка невуса на гистологический анализ проводится до того, как удаляется образование, или после хирургического вмешательства. Медицинские учреждения удаляют невусы различными методами:
- Криодеструкционный метод. Родинка выжигается при помощи жидкого азота. Температура, при которой удаляют образование, превышает 180 градусов.
- Иссечение скальпелем. Пациенту вводится местное обезболивание. Хирург удаляет нарост скальпелем, накладывает швы. Метод нецелесообразен для удаления родинки, расположенной на видном участке тела.
- Радиоволновое удаление. Невус иссекается при помощи радиоволнового ножа. Преимуществом метода является отсутствие шрамов после операции.
- Электрокоагуляционный метод. При помощи раскаленного металлического наконечника удаляют родинку. Спустя три недели не останется следов от оперативного вмешательства.
- Лазерное иссечение. С помощью лазера удаляется нарост. Метод пользуется спросом, так как не оставляет рубцов.
Читать еще: Как избавиться от перхоти на бровях?
Исследование удаленного невуса происходит в несколько этапов:
- Забор материала. Специальными инструментами берется ткань образования.
- Фиксирование. Полученную ткань помещают в емкость, наполненную водой. Далее вместо воды наливают этанол. Альтернативой этанолу служит формалин. Данные вещества способствуют сохранению структуры образования и предотвращению клеточного распада.
- Материал должен быть твердым. Для этого проводят предварительное высушивание и помещают в парафин.
- Затвердевшую ткань с помощью специального прибора разделяют на пластинки.
- Проводят удаление парафиновых остатков.
- Разрезанные пластинки помещают в емкость с красителем, который подготовлен предварительно. Эта процедypa способствует определению клеточной структуры.
- Окрашенные пластинки помещают на стекло и укладывают в емкость, которая плотно закрывается. Это позволяет хранить их на протяжении длительного времени.
- Микроскопическое исследование. Гистолог с помощью оптического прибора изучает полученную пластинку.
- Производится запись полученных данных для того, чтобы передать врачу.
После получения лабораторных данных, лечащий врач проводит расшифровку. Сколько делается гистология родинки, зависит от того, где проводится исследование. Встречаются случаи, когда материал необходимо трaнcпортировать в лабораторию, которая находится в другом населенном пункте.
Результаты гистологии
В результате гистологической экспертизы онкодерматолог определит, является родинка злокачественной или доброкачественной. Кроме этого, на основании гистологического заключения, врач способен установить, к какому виду принадлежит родимое пятно, степень тяжести заболевания и структурные показатели. Произвести самостоятельную расшифровку не удастся. Если удалили родинку и гистология плохая, необходимо в короткие сроки провести операцию по удалению невуса.
Анализ способен выявить степень онкологического заболевания, от которого зависит, какое лечение будет применено. При первой стадии образование удаляется в пределах непораженной ткани. Вторая стадия основана на удалении нароста и лимфоузлов, которые расположены около него. Третья стадия подразумевает иссечение всех пораженных невусов и лимфоузлов, которые к ним прилегают, с последующим прохождением химиотерапии. Если выявлена четвертая стадия онкологического заболевания, у пациента минимальное количество шансов на положительный исход.
Если опасность отсутствует, рекомендуется иссечь пятно. Это поможет избежать патологического процесса в образовании. Современные методы удаления являются безболезненными и безопасными. Если своевременно не провести оперативное вмешательство по удалению злокачественного нароста, повышается риск развития и распространения метастазов. Они способны проникать в жизненно важные органы, нарушая их функционирование и разрушая структуру. В медицинской практике встречаются случаи, когда после удаления, родинка возникает заново. Это служит тревожным сигналом, который требует безотлагательного визита к дерматологу или онкологу.
Случаются ли ошибки при гистологическом анализе невусов
Гистологический анализ проводит лаборант, который может ошибиться. При возникновении малейших сомнений, касаемо лабораторного заключения, необходимо пройти исследование в другой лаборатории или отдать первоначальный материал на повторное исследование.
Гистология родинки: этапы исследования и частые вопросы пациентов
Родинки, или видоизменения кожи есть практически у каждого человека. Обычно мы относимся к ним спокойно, но даже самые небольшие образования могут стать опасными при перерождении в злокачественные опухоли. Определить степень опасности той или иной родинки поможет гистологический анализ. Разберемся, зачем отправляют на гистологию, любую ли родинку нужно ли отправлять на анализ и как определяется степень опасности в каждом случае.
Как делают гистологию родинки
Родинка (или в медицинской терминологии – невус) – это видоизменение кожи. Такие образования имеют различную природу и могут быть как врожденными, так и появившимися в течение жизни. Чтобы определить природу невуса, дерматолог исследует его клетки под микроскопом.
Когда же нужно обращаться к врачу для проведения этого исследования? Вот основные поводы для тревоги:
- Травма родинки, выступающей над кожей;
- Изменения в структуре родинки: появление пятен, шелушение, увеличение размеров или наоборот сморщивание;
- Появление новых родинок в больших количествах;
- Болезненность невуса или зуд;
- Из родинки выступает кровь.
При появлении любого из этих признаков нужно обратиться в клинику и определить природу родинки. Гистологию могут проводить как перед удалением невуса, так и после проведения операции. Если существует подозрение, что начался онкологический процесс, родинку нельзя удалять без исследования. Если же она доставляет неудобства только с косметологической стороны, можно сделать анализ после удаления.
Важно! Нельзя пытаться свести родинки самостоятельно, пользуясь народными методами. Вместо помощи можно усложнить ситуацию. Квалифицированно удалять родинки и вести лечение любых заболеваний кожи может только специалист-онкодерматолог.
Как проводится анализ
Есть несколько вариантов того, как сделать гистологический анализ. Конкретный вариант выбирает врач, исходя из ситуации с родинкой (ее внешний вид, наличие тревожных признаков и т.д.) и возможностей клиники. От конкретного метода зависит сколько делается анализ. В общем виде гистологический анализ состоит из следующих этапов:
- Хирургом выполняется удаление невуса;
- Из удаленной родинки извлекают образец тканей;
- В лаборатории образец тканей обpaбатывается окрашивающими растворами;
- Специалист-патоморфолог изучает образец под микроскопом.
После расшифровки результатов врач делает вывод о том, есть ли в родинке клетки, подвергшиеся злокачественному изменению, требуется ли их удаление и если да, то каким способом.
Мнение врачей о самых эффективных методах лечения бородавок и папиллом
Свое видение на данный счет описывает главный врач Московской городской больницы № 62. Анатолий Нахимович Махсон
Лечебная практика: более 40 лет.
«Занимаюсь лечением папиллом и бородавок у людей уже много лет. Говорю Вам как врач, папилломы вместе с ВПЧ и бородавки могут привести действительно к серьезным последствиям, если ими не заниматься.
Папилломавирус человека есть у каждого на чьём теле имеются папилломы, родинки, бородавки и прочие пигментные образования. По грубым оценкам, он есть у 80-85% населения планеты. Сами по себе они не опасны. Проблема состоит в том, что обычная папиллома может в любой момент стать меланомой.
Это неизлечимые злокачественные опухоли, которые убивают человека буквально за несколько месяцев и от которых нет спасения.
К сожалению, в России и странах СНГ аптечные корпорации продают дорогущие лекарства, которые лишь снимают симптомы, тем самым подсаживая людей на тот или иной препарат. Именно поэтому в этих странах такой высокий процент раковых заболеваний и так много людей мучаются «нерабочими» препаратами.
Единственный лекарственный препарат, который я хочу посоветовать, и он же официально рекомендуется ВОЗ для лечения папиллом и бородавок это — Папинол. Этот препарат — единственное средство, которое оказывает действие не только на внешние факторы (то есть убирает папилломы), а ещё и действует на сам вирус. На данный момент производителю удалось не только создать высокоэффективное средство, но и сделать его доступным каждому. К тому же в рамках федеральной программы каждый житель РФ и СНГ может получить его за 149 руб.»
Для того, чтобы узнать больше, прочитайте эту статью.
Кто может направить родинку на гистологию
Направление биоматериала на гистологический анализ возможно по нескольким причинам:
- Направление лечащего врача;
- Рекомендация специалиста косметолога. Косметологические кабинеты и салоны не имеют права направлять биоматериал в лабораторию на анализ, но могут порекомендовать клиенту пройти такой анализ платно;
- По желанию пациента. Давать материал на гистологическое исследование пациент может без рекомендации врача. Такое исследование обычно платное. Но не стоит экономить! Лучше вовремя узнать о проблемах и легко справиться с ними, чем узнать о запущенной злокачественной опухоли, когда уже слишком поздно пытаться ее вылечить.
Читать еще: Как лечить чирей на руке
Будьте осторожны
Наличие папиллом, бородавок, кондилом, родинок и шипиц на теле — первый признак злокаственной меланомы!
Спешим Вас предостеречь, большинство лекарств «лечащих» бородавки, папилломы, родинки и тд. — это сплошной обман маркетологов, которые накручивают сотни процентов на препаратах, эффективность которых равна нулю. Они не лечат болезнь, а лишь маскируют симптомы.
Аптечная мафия заpaбатывает огромные деньги на обмане заболевших людей.
Но что же делать? Как лечиться если везде обман? Доктор медицинских наук Анатолий Махсон провел собственное расследование и нашел выход из данной ситуации. В этой статье Врач также рассказал, как на 100% обезопасить себя от заболевания меланомой, всего за 149 руб!
Читайте статью в официальном источнике по ссылке .
Что делать после анализа
Если анализ не выявил в невусе злокачественно измененных клеток, можно спать спокойно. А вот если в родинке были обнаружены клетки меланомы, пациенту нужно обратиться в онкологический диспансер для определения дальнейшего лечения. Нужно помнить, что на ранних стадиях меланома и другие злокачественные процессы кожи хорошо лечатся. Важно вовремя начать лечение!
Рекомендуем ознакомиться с подготовленным нами видеоматериалом на тему диагностики невусов, проведения анализов и гистологии:
Зачем нужна и как проводится гистология родинки
Для начала выясним что такое анализ на гистологию.
Гистология родинки – это морфологический анализ ткани, исследуемый под микроскопом. Данное исследование назначается при подозрении на перерождении невуса в злокачественную опухоль.
Если результаты анализа покажут, что в исследуемом материале имеются злокачественные клетки (гистология окажется плохая), пациент будет направлен на лечение.
- Вся информация на сайте носит ознакомительный характер и НЕ ЯВЛЯЕТСЯ руководством к действию!
- Поставить ТОЧНЫЙ ДИАГНОЗ Вам может только ВРАЧ!
- Убедительно просим Вас НЕ ЗАНИМАТЬСЯ самолечением, а записаться к специалисту!
- Здоровья Вам и Вашим близким!
Проблемную родинку скорее всего предложат удалить. После удаления через некоторое время необходимо показаться врачу для того чтобы удостовериться, что все в порядке.
Родинки представляют собой некие разрастания кожи.
Это может быть врожденный порок кожи или же приобретенный с течением времени, который является доброкачественной опухолью.
Клетки этих образований переполнены пигментом и преобразуются в меланоциты. Скопления этих клеток образуют родинку.
Почему важно проводить диагностику
Родинки небольшие и правильной формы сами по себе никакой угрозы здоровью человека не приносят до той поры, пока они не начинают изменяться.
В случае если будет замечено, что за последнее время невус несколько изменился в размерах, то лучше визит к врачу не откладывать, т.к. это может оказаться началом опасной болезни.
Заболевание, которое врачи в этом случае пытаются предотвратить называется – меланома.
Фото: перерождение в меланому
По сути – это злокачественное новообразование или рак кожи. Бояться визита к доктору не стоит.
На ранних стадиях это заболевание прекрасно лечится.
Какие специалисты должны проверять?
Итак, если такая проблема обнаружилась, первым делом нужно посетить онколога или онкодерматолога. В случае невозможности записаться на прием к этим специалистам, можно обратиться к дерматологу.
Если врач посчитает необходимым, то выпишет направление к нужным специалистам, которые уже при первом осмотре проблемной родинки поставят предварительный диагноз.
Утверждать точно, что это меланома можно только после проведения анализа.
Специалист обязательно назначит гистологическое исследование.
После того как врач получит результат анализа, он решает какое именно лечение подойдет в каждом конкретном случае.
Методы диагностики
Фото: дерматоскопия невуса
В арсенале медиков есть целый ряд исследований для того, чтобы отличить меланому от других заболеваний:
- сбор анамнеза. Он позволяет выяснить как давно появилась родинка, меняла ли она свои размеры или цвет, присутствуют ли неприятные ощущения в этом месте, например, зуд, кровоточивость или болезненность;
- визуальный осмотр невуса. Кроме того, врач обследует лимфатические узлы, которые находятся поблизости с новообразованием;
- анализ крови на обнаружение опухолевого маркера для меланомы – белка S-100 и LDH (лактатдегидрогеназы);
- молекулярная диагностика. Позволяет обнаружить среди миллиона обычных здоровых клеток даже одну, которая поражена меланомой (RT-PCR);
- дерматоскопия. Это неинвазивный метод исследования, он проводится при помощи специального аппарата, который позволяет увидеть слои кожи увеличенными в несколько десятков раз и оценить состояние клеток;
- микроскопия конфокальная. Позволяет изучить слои кожного покрова на клеточном уровне, проводится с помощью специального микроскопа, в котором используется инфракрасное излучение;
- радиоизотопное сканирование. При этом виде исследования выполняются первичные снимки всех патологических изменений, а при повторном обследовании пациент может даже самостоятельно контролировать возникновение новых образований, сравнивая полученные снимки с предыдущими;
- диагностика при помощи радиоактивного фосфора;
- гистология родинки. Результат получают после забора клеток новообразования (биопсии);
- компьютерная томография (КТ);
- магнитно-резонансная томография (МРТ);
- ультразвуковое исследование (УЗИ).
Видео: «Удаление родинок. Видеодерматоскопия»
Для чего нужна гистология родинки?
Итак, мы выяснили, что гистология – это один из достоверных методов исследования на меланому. Зачем нужна гистология?
С помощью этого исследования врач-онколог может точно поставить диагноз и назначить адекватное лечение.
В каком случае проводится?
Если появились неприятные ощущения в области родинки или она за короткое время начала увеличиваться в размерах, следует обратиться к доктору и сдать анализ на гистологию.
Это исследование обязательно проводится в следующих случаях:
- родинка интенсивно растет;
- на фоне пятна появились бляшшковидные гладкие образования;
- появилась болезненность невиса, сморщивание или шелушение;
- родинка периодически кровоточит;
- появилось неравномерное окрашивание пятна;
- изменилась структура родинки.
Только после проведенного анализа специалист установит что это такое.
Как проводится?
Гистологию делают в лабораторных условиях после удаления родинки хирургическим путем.
Фото: проведение гистологического исследования
Материал, полученный во время иссечения, помещают в особый раствор и доставляют в лабораторию. Там, иссеченные клетки помещают на лабораторное стекло и окрашивают.
Далее, врач-патоморфолог его исследует под микроскопом и точно установит меланома это или нет.
Данное исследование можно провести:
- имея на руках направление от врача;
- без направления, но по рекомендации врача;
- по личному желанию.
Во многих клиниках, имея на руках направление от врача, гистологический анализ проводят бесплатно.
Сколько стоит анализ?
В разных лабораториях стоимость его отличается, но она не превышает 500 рублей.
Срок, который занимает анализ – не более недели.
Висячая родинка почернела, опасно ли? Узнайте здесь.
Сколько дней делают анализ, зависит от клиники и количества ее пациентов. В крупных клиниках это происходит быстрее.
Результат гистологического исследования
Что показывает подобный анализ? Расшифровка результатов исследования может показать как положительный результат, так и отрицательный.
Читать еще: Причины, диагностика и лечение кефалогематомы у новорождённого ребёнка
Полученный анализ обязательно следует показать врачу, который пациента отправлял на это исследование.
Грамотная расшифровка анализа доступна только специалисту.
Что это онкология или нет, с точностью можно сказать только после исследования материала.
Именно он сообщит пациенту о результатах. Существует четыре степени онкологии.
Если опухоль выявлена на ранней стадии, то она хорошо поддается лечению.
Положительный результат требует немедленного лечения.
Что дальше?
В случае если гистология показала рак, то необходимо принимать срочные меры.
Удаление невуса – это обязательная процедypa.
Но даже в случае, если хорошая гистология, но родинка вызывает опасение у специалиста, от нее лучше избавиться. Врач скорее всего предложит ее удалить.
Это можно сделать в любом онкологическом центре и различных клиниках.
Где делать – решает сам пациент, но лучше обращаться в надежные клиники с хорошей репутацией.
До и после удаления никаких специальных процедур проводить не нужно. Сколько делается по времени процедypa удаления невуса, зависит от выбранного метода.
Как делается удаление?
Фото: удаление методом электрокоагуляции
Это возможно сделать несколькими способами:
Пациентов интересует вопрос – сколько стоит удаление.
Цена обычно включает в себя гистологический анализ и удаление невуса.
Рассмотрим стоимость этой процедуры на примере города Москва.
Гистология родинки: этапы исследования и частые вопросы пациентов
Родинки, или видоизменения кожи есть практически у каждого человека. Обычно мы относимся к ним спокойно, но даже самые небольшие образования могут стать опасными при перерождении в злокачественные опухоли. Определить степень опасности той или иной родинки поможет гистологический анализ. Разберемся, зачем отправляют на гистологию, любую ли родинку нужно ли отправлять на анализ и как определяется степень опасности в каждом случае.
Как делают гистологию родинки
Родинка (или в медицинской терминологии – невус) – это видоизменение кожи. Такие образования имеют различную природу и могут быть как врожденными, так и появившимися в течение жизни. Чтобы определить природу невуса, дерматолог исследует его клетки под микроскопом.
Когда же нужно обращаться к врачу для проведения этого исследования? Вот основные поводы для тревоги:
- Травма родинки, выступающей над кожей;
- Изменения в структуре родинки: появление пятен, шелушение, увеличение размеров или наоборот сморщивание;
- Появление новых родинок в больших количествах;
- Болезненность невуса или зуд;
- Из родинки выступает кровь.
При появлении любого из этих признаков нужно обратиться в клинику и определить природу родинки. Гистологию могут проводить как перед удалением невуса, так и после проведения операции. Если существует подозрение, что начался онкологический процесс, родинку нельзя удалять без исследования. Если же она доставляет неудобства только с косметологической стороны, можно сделать анализ после удаления.
Важно! Нельзя пытаться свести родинки самостоятельно, пользуясь народными методами. Вместо помощи можно усложнить ситуацию. Квалифицированно удалять родинки и вести лечение любых заболеваний кожи может только специалист-онкодерматолог.
Как проводится анализ
Есть несколько вариантов того, как сделать гистологический анализ. Конкретный вариант выбирает врач, исходя из ситуации с родинкой (ее внешний вид, наличие тревожных признаков и т.д.) и возможностей клиники. От конкретного метода зависит сколько делается анализ. В общем виде гистологический анализ состоит из следующих этапов:
- Хирургом выполняется удаление невуса;
- Из удаленной родинки извлекают образец тканей;
- В лаборатории образец тканей обpaбатывается окрашивающими растворами;
- Специалист-патоморфолог изучает образец под микроскопом.
После расшифровки результатов врач делает вывод о том, есть ли в родинке клетки, подвергшиеся злокачественному изменению, требуется ли их удаление и если да, то каким способом.
Мнение врачей о самых эффективных методах лечения бородавок и папиллом
Свое видение на данный счет описывает главный врач Московской городской больницы № 62. Анатолий Нахимович Махсон
Лечебная практика: более 40 лет.
«Занимаюсь лечением папиллом и бородавок у людей уже много лет. Говорю Вам как врач, папилломы вместе с ВПЧ и бородавки могут привести действительно к серьезным последствиям, если ими не заниматься.
Папилломавирус человека есть у каждого на чьём теле имеются папилломы, родинки, бородавки и прочие пигментные образования. По грубым оценкам, он есть у 80-85% населения планеты. Сами по себе они не опасны. Проблема состоит в том, что обычная папиллома может в любой момент стать меланомой.
Это неизлечимые злокачественные опухоли, которые убивают человека буквально за несколько месяцев и от которых нет спасения.
К сожалению, в России и странах СНГ аптечные корпорации продают дорогущие лекарства, которые лишь снимают симптомы, тем самым подсаживая людей на тот или иной препарат. Именно поэтому в этих странах такой высокий процент раковых заболеваний и так много людей мучаются «нерабочими» препаратами.
Единственный лекарственный препарат, который я хочу посоветовать, и он же официально рекомендуется ВОЗ для лечения папиллом и бородавок это — Папинол. Этот препарат — единственное средство, которое оказывает действие не только на внешние факторы (то есть убирает папилломы), а ещё и действует на сам вирус. На данный момент производителю удалось не только создать высокоэффективное средство, но и сделать его доступным каждому. К тому же в рамках федеральной программы каждый житель РФ и СНГ может получить его за 149 руб.»
Для того, чтобы узнать больше, прочитайте эту статью.
Кто может направить родинку на гистологию
Направление биоматериала на гистологический анализ возможно по нескольким причинам:
- Направление лечащего врача;
- Рекомендация специалиста косметолога. Косметологические кабинеты и салоны не имеют права направлять биоматериал в лабораторию на анализ, но могут порекомендовать клиенту пройти такой анализ платно;
- По желанию пациента. Давать материал на гистологическое исследование пациент может без рекомендации врача. Такое исследование обычно платное. Но не стоит экономить! Лучше вовремя узнать о проблемах и легко справиться с ними, чем узнать о запущенной злокачественной опухоли, когда уже слишком поздно пытаться ее вылечить.
Будьте осторожны
Наличие папиллом, бородавок, кондилом, родинок и шипиц на теле — первый признак злокаственной меланомы!
Спешим Вас предостеречь, большинство лекарств «лечащих» бородавки, папилломы, родинки и тд. — это сплошной обман маркетологов, которые накручивают сотни процентов на препаратах, эффективность которых равна нулю. Они не лечат болезнь, а лишь маскируют симптомы.
Аптечная мафия заpaбатывает огромные деньги на обмане заболевших людей.
Но что же делать? Как лечиться если везде обман? Доктор медицинских наук Анатолий Махсон провел собственное расследование и нашел выход из данной ситуации. В этой статье Врач также рассказал, как на 100% обезопасить себя от заболевания меланомой, всего за 149 руб!
Читайте статью в официальном источнике по ссылке .
Что делать после анализа
Если анализ не выявил в невусе злокачественно измененных клеток, можно спать спокойно. А вот если в родинке были обнаружены клетки меланомы, пациенту нужно обратиться в онкологический диспансер для определения дальнейшего лечения. Нужно помнить, что на ранних стадиях меланома и другие злокачественные процессы кожи хорошо лечатся. Важно вовремя начать лечение!
Рекомендуем ознакомиться с подготовленным нами видеоматериалом на тему диагностики невусов, проведения анализов и гистологии:
Важно знать родителям о здоровье:
FitoSpray для похудения (Фитоспрей)
FitoSpray для похудения ( Фитоспрей) FitoSpray — спрей для похудения Многие мечтают похудеть, стать стройными, обрести фигуру мечты. Неправильное питание,…
02 06 2023 10:39:14
Фитостеролы в продуктах питания
Фитостеролы в продуктах питания Фитостерины Существует много питательных веществ, которые, как утверждают исследователи, могут положительно повлиять на…
01 06 2023 8:47:51
Фитотерапевт
Фитотерапевт Фитотерапевт Я, Ирина Гудаева — травница, массажист, ведущая семинаров по созданию натуральной косметики и курса « Практическое травоведение»…
31 05 2023 5:43:12
Fitvid
Fitvid Брекеты: минусы, трудности, проблемы Брекет-системы помогли избавиться от комплексов миллионам людей. Это действительно эффективный инструмент,…
30 05 2023 10:35:17
Фониатр
Фониатр Фониатрия – один из разделов медицины. Фониатры изучают патологии голоса, методы их лечения, профилактики, а также способы коррекции…
27 05 2023 6:59:42
Форель
Форель Форель относится к отряду лососеобразных, семейству лососевых. Ее тело удлинено, немного сжато с боков, покрыто мелкой чешуей. Замечательной…
26 05 2023 5:11:49
Формула идеального веса
Формула идеального веса Калькулятор нормы веса Вес 65 кг относится к категории Норма для взрослого человека с ростом 170 см . Эта оценка основана на…
23 05 2023 3:11:50
Формулы расчета идеального веса
Формулы расчета идеального веса Фoрмулa «идeальнoго вeса» То, что ожирение шагает семимильными шагами по планете – это факт. И, несмотря на то, что…
22 05 2023 3:29:27
Фосфатида аммонийные соли
Фосфатида аммонийные соли Аммонийные соли фосфатидиловой кислоты ( Е442) Е442 – это пищевая добавка, которую относят к категории эмульгаторов. Вещество…
21 05 2023 18:31:41
Фототерапия новорожденных
Фототерапия новорожденных Фототерапия новорожденных Применение фототерапии для новорожденных С момента своего рождения организм ребенка начинает адаптацию…
20 05 2023 0:10:50
Фототерапия новорожденных при желтухе
Фототерапия новорожденных при желтухе Фототерапия новорожденных После появления ребенка на свет его организм адаптируется к совершенно иным условиям…
19 05 2023 21:27:17
Французская диета
Французская диета Французская диета Эффективность: до 8 кг за 14 дней Сроки: 2 недели Стоимость продуктов: 4000 рублей на 14 дней Общие правила…
18 05 2023 1:13:43
Фрукт Кумкват — что это такое?
Фрукт Кумкват — что это такое? Фрукт Кумкват — что это такое? Впервые упоминают необычный для европейцев фрукт китайские летописи 11 века. Португальские…
17 05 2023 2:47:13
Фруктовая диета
Фруктовая диета Фруктовая диета Эффективность: 2-5 кг за 7 дней Сроки: 3-7 дней Стоимость продуктов: 840-1080 рублей в неделю Общие правила Фруктовая…
15 05 2023 15:47:10
Фруктоза при диабете
Фруктоза при диабете Можно ли фруктозу при сахарном диабете? Для многих диабет является той проблемой, которая вносит в жизнь ряд ограничений. Так, к…
12 05 2023 18:17:31
Фрукт свити – польза и вред
Фрукт свити – польза и вред Свити — что это за фрукт? Что такое свити? Продолжаем разбирать цитрусовые, но как всегда идем не по верхам, а копаем глубже и…
09 05 2023 7:32:18
Фрукты и ягоды
Фрукты и ягоды Разница между фруктом и ягодой Фрукты и ягоды любят практически все. Ведь они такие вкусные и полезные! Мы любуемся лежащими на столе…
08 05 2023 3:20:27
Фтизиатр
Фтизиатр Врачи фтизиатры Москвы Фтизиатр — это дипломированный специалист в области фтизиатрии. Он специализируется на профилактике, диагностике, лечении…
06 05 2023 1:47:52
Фтор в организме человека
Фтор в организме человека Фтор в организме человека Дневная норма потрeбления Мужчины старше 60 лет Женщины старше 60 лет Беременные (2-я половина)…
05 05 2023 2:23:58
Боли в спине после рождения ребёнка
Боли в спине после рождения ребёнка Почему после родов болит спина У мамочек нередко болит спина после родов. Причем, дискомфорт может длиться довольно…
02 05 2023 6:22:17
Фунчоза: польза и вред
Фунчоза: польза и вред Фунчоза: польза и возможный вред Увлечение восточной кухней год от года растет. Принято считать, что такой рацион полезен для…
01 05 2023 17:42:21
Фундук
Фундук В рационе здорового человека обязательно присутствуют орехи в различных вариациях. Среди них выгодно выделяется фундук. Высокая пищевая ценность и…
30 04 2023 7:59:44
Фуросемид таблетки инструкция по применению
Фуросемид таблетки инструкция по применению Инструкция по применению: Цены в интернет-аптеках: Фуросемид – синтетическое диуретическое лекарственное…
27 04 2023 14:16:34
Галактоза
Галактоза Галактоза – это представитель класса простых молочных сахаров. В человеческий организм поступает преимущественно в составе молока,…
26 04 2023 12:58:58
Галанга
Галанга С древних времен растения играют важную роль в жизни человека, в том числе и для поддержания здоровья. Некоторые травы известны как лучшие…
25 04 2023 4:56:35
Галега лекарственная
Галега лекарственная Галега лекарственная (Galega officinalis) Син: козлятник лекарственный, козлятник аптечный, козья рута, французская сирень, солодянка…
24 04 2023 8:24:35
Боли в суставах при беременности
Боли в суставах при беременности Боли в суставах при беременности В период беременности у женщины могут возникать различные боли в самых разных местах….
21 04 2023 19:59:28
Гастрит и изжога
Гастрит и изжога Лучшие лекарства от изжоги и гастрита Многие пациенты с гастритом и другими заболеваниями Ж К Т страдают от изжоги. Данный симптом может…
20 04 2023 0:35:28
Где находится ключица у человека на фото?
Где находится ключица у человека на фото? Ключица человека: анатомия, строение, функции Ключица – это единственное костное образование в теле человека,…
17 04 2023 3:15:30