Зачем нужно проводить гистологическое исследование?
Хирургическое вмешательство — рекомендуемый метод лечения при большинстве опухолей яичников. Удаленные во время операции ткани отправляют на гистологическое исследование (ГИ). Оно позволяет определить вид опухоли, стадию и прогноз. Это необходимо для выбора тактики лечения и наблюдения. Подробнее о гистологическом исследовании и его проведении можно прочитать тут.
По происхождению опухолей яичников выделяют:
- Эпителиальные — наиболее распространенный тип. Он развивается в слое окружающей яичники ткани — эпителии. В зависимости от того, как клетки выглядят под микроскопом, опухоли разделяют на подтипы — серозные, муцинозные, эндометриоидные, светлоклеточные, серозно-муцинозные, опухоли Бреннера. У каждого подтипа есть доброкачественный, пограничный и злокачественный (рак) вариант, отличающиеся тем, насколько сильно опухолевые клетки под микроскопом отличаются от нормальных. Это позволяет предположить насколько опасна опухоль для организма: оценить ее агрессивность, скорость роста, ее распространение за пределы яичников и возможность давать метастазы в другие органы.
- Герминогенные опухоли начинаются в зародышевых клетках яичника, из которых впоследствии в норме развиваются яйцеклетки. К ним относятся тератома, дисгерминома, опухоль желточного мешка, эмбриональная карцинома и хориокарцинома. Они редки и обычно развиваются у девушек и молодых женщин в возрасте до 30 лет. Чаще всего встречаются доброкачественные тератомы. Их можно удалить хирургически, но если опухоль оказалась злокачественной, требуется химиотерапия. Лечение обычно работает хорошо, и большинство женщин излечиваются.
- Опухоли стромы полового тяжа — редкие опухоли яичников. Они происходят из клеток стромы («поддерживающих» клеток яичника). Часть из этих клеток вырабатывают половые гормоны – эстроген, прогестерон и андрогены. Поэтому некоторые стромальные опухоли производят избыточное количество этих гормонов. К ним относятся: фиброма, текома, опухоли из клеток Сертоли и клеток Лейдига.
- Мезенхимальные опухоли — также редкие опухоли яичников. К ним относятся саркомы, лейомиомы, миксомы.
Также опухоли бывают доброкачественными, пограничными и злокачественными.
- Доброкачественные опухоли яичников — различные кисты и медленнорастущие, часто бессимптомные опухоли, например, цистаденома.
- Пограничные опухоли еще не являются злокачественными, не дают отдаленных метастазов, но распространяются больше, чем доброкачественный вариант. Например, они могут поверхностно без врастания в подлежащие ткани распространиться за пределы яичника (неинвазивный имплант). Пограничными могут быть только эпителиальные опухоли.
- Злокачественные опухоли могут распространяться с помощью инвазивных имплантов и отдаленных метастазов. Серозные карциномы — самые частые злокачественные опухоли в яичнике. Они делятся на два типа по агрессивности: низкой (low-grade) и высокой (high-grade) степени. Опухоли низкой и высокой агрессивности в яичнике в настоящее время считаются отдельными типами опухолей, поскольку имеют разную морфологию, патогенез, молекулярные события и прогноз.
На что нужно обратить внимание в заключении о гистологическом исследовании?
Необходимо обратить внимание на степень злокачественности опухоли, ее подтип, наличие лимфоваскулярной инвазии (неблагоприятный фактор, который показывает, что опухоль проникла в кровеносные и/или лимфатические сосуды и распространяется по ним, а значит, есть большой риск распространения в лимфоузлы или отдаленные органы).
Для определения стадии при гистологическом исследовании смотрят, врастают ли опухолевые клетки в другие ткани, имеются ли “импланты” (оторвавшиеся от первичной опухоли клетки) или метастазы в близлежащих органах и тканях.
Если до операции была проведена терапия, врач-патоморфолог с помощью различных шкал для оценки регресса (уменьшения) опухоли отмечает, насколько опухоль и метастазы (например, в большом сальнике) уменьшились в размерах. От степени ответа опухоли на терапию зависит план дальнейшего лечения.
Что делать, если результат долго не приходит?
Сроки проведения исследования зависят от того, использовались ли дополнительные методы. Если ГИ длится более 15 рабочих дней, необходимо обратиться в лабораторию, где проводится исследование.
С кем обсудить результат исследования?
Обсудить результат ГИ можно с лечащим врачом-онкологом. Информация бывает сложной, поэтому надо задавать врачу вопросы, если что‐то непонятно. Полезно сделать копию заключения и вести записи по ходу беседы с врачом.
Выводы
- Все, что было удалено во время операции, отправляют на гистологическое исследование.
- ГИ позволяет определить вид опухоли, где она первично появилась, ее стадию и прогноз. Это нужно для выбора правильной тактики лечения и наблюдения.
- Эпителиальные опухоли — наиболее распространенный тип опухолей яичников.
- К редким типам опухолей яичников относятся герминогенные (тератомы), опухоли стромы полового тяжа (из клеток Сертоли и Лейдига) и саркомы.
- Степень регресса опухоли указывается в заключении после предоперационной терапии. Это позволяет врачу оценить, насколько опухоль ответила на лечение.
- Обсудить результат ГИ можно с лечащим врачом-онкологом. Информация может быть сложной, можно и нужно задавать врачу вопросы, если что‐то непонятно.
Что еще почитать?
- Портал Cancer Research UK (на английском языке).
- Европейские рекомендации по лечению рака яичников (на английском языке).
- Американские рекомендации по лечению рака яичников NCCN (на английском языке).
- Статья по общим вопросам рака яичника (платный ресурс UpToDate на английском языке).
40 V.F. Snegirev Archives of Obstetrics and Gynecology. 2017, 4 (1) _DOI http://dx.doi.org/10.18821/2313-8726-2017-4-1-40-44
Original papers
© КОЛЛЕКТИВ АВТОРОВ, 2017 Удк 618.11-006.04-73.432-035.7
Востров А.И., Казакевич В.и. МитинаЛ.А., Степанов С.о., СкрепцоваИ.С., Иовикова Е.Г.
ошибки эхографии в диагностике распространенности рака яичников
Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, 125284, г. Москва
Для корреспонденции: Востров Александр Николаевич, канд. мед. наук, ст. науч. сотрудник отделения ультразвуковой диагностики МНИОИ им. П.А. Герцена, филиала ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России; Alexandr-V65@yandex.ru
Статья посвящена вопросам диагностики онкологических заболеваний яичников с использованием ультразвукового исследования. Оценены возможности и недостатки ультразвукового метода в оценке распространенности рака яичников. Исследование обобщает результаты наблюдения 500 пациенток с диагнозом рака яичников, перенесших комбинированное лечение. Для улучшения качества диагностики онкогинекологических заболеваний и выявления причин диагностических ошибок проведен сравнительный анализ ультразвуковых заключений, данных операционных находок и результатов морфологических исследований препаратов.
Ключевые слова: рак яичника; ультразвуковое исследование.
Для цитирования: Востров А.Н., Казакевич В.И. Митина Л.А. , Степанов С.О., Скрепцова Н.С., Новикова Е.Г. Ошибки эхографии в диагностике распространенности рака яичников. Архив акушерства и гинекологии им. В.Ф. Снегирева. 2017; 4 (1): 40—44. DOI http://dx.doi.org/10.18821/2313-8726-2017-4-1-40-44
Vostrov A.N., Kazakevich V.I., Mitina L.A., stepanov s.o., skreptsova N.s., Novikova E.G.
ERRORS OF SONOGRAPHY IN THE DIAGNOSIS OF THE PREVALENCE RATE OF OVARIAN CANCER
P. A. Gerzen Moscow Cancer Research Institute, branch of the «National Medical Research Center of Radiology», Moscow, 125284, Russian Federation
The article is devoted to the diagnosis of ovarian cancer diseases with the use of sonographic examination. There were evaluated possibilities and disadvantages of the sonographic ultrasonic method in the evaluation of the prevalence rate of ovarian cancer. The study summarizes the results of the observation of 500 patients with the diagnosis of ovarian cancer, underwent the comprehensive treatment. For the improvement of the quality ofgynecological cancer diagnosis of diseases and the identification of causes of diagnostic errors, there was performed a comparative analysis of ultrasound conclusions, data about operation findings and results of morphological studies of drugs.
Keywords: ovarian cancer; sonographic investigation.
For citation: Vostrov A.N., Kazakevich V.I., Mitina L.A., Stepanov S.O., Skreptsova N.S., Novikova E.G. Errors of sonography in the diagnosis of the prevalence rate of ovarian cancer. V.F. Snegirev Archives of Obstetrics and Gynecology, Russian journal. 2017; 4(1): 40—44. (In Russ.). DOI: http://dx.doi.org/10.18821/2313-8726-2017-4-1-40-44
For correspondence: Aleksandr N. Vostrov, MD, PhD, senior researcher of the Unit of Sonographic diagnostics of the P.A. Gerzen Moscow Cancer Research Institute, branch of the «National Medical Research Center of Radiology», Moscow, 125284, Russian Federation; e-mail: Alexandr-V65@yandex.ru
Conflict of interest. The authors declare no conflict of interest.
Acknowledgment. The study had no sponsorship.
Рак яичников составляет порядка 4—6% от числа всех злокачественных новообразований у женщин, однако даже в экономически развитых странах, в том числе и в России, данная патология по показателям смертности занимает первое место среди всех гинекологических опухолей. Ежегодно от рака яичников умирает больше женщин, чем от распространенных форм рака шейки и тела матки вместе взятых [1—3].
В России в период 2000—2013 г. распространенность рака яичников выросла с 44,7 до 68,1 на 100 тыс. женского населения [4]. Высокая смертность объясняется агрессивными биологическими свойствами злокачественных опухолей яичников, их способностью к рецидивирова-нию, быстрому и обширному метастастазированию. Наиболее часто (66—88% случаев) первичное выявле-
Received 11.01.2017 Accepted 27.01.2017
ние опухоли яичников происходит в III—IV стадиях. В поздних стадиях опухоль инфильтрирует смежные органы, характеризуется чрезвычайно злокачественным течением с плохим прогнозом вследствие массивного ре -гионарного и отдаленного метастазирования [5].
Своевременная диагностика рака яичников остается крайне затруднительной [6, 7]. Использование бимануального влагалищно-абдоминального и ректовагиналь-ного исследований не всегда позволяет констатировать факт наличия новообразования яичников. В связи с этим огромное значение приобретает использование дополнительных методов обследования, таких как ультразвуковое исследование (УЗИ).
Ультразвуковая диагностика в настоящее время занимает одно из ведущих мест в современной онкогине-
Архив акушерства и гинекологии им. В.Ф. Снегирева. 2017, 4 (1) РР! http://dx.doi.org/10.18821/2313-8726-2017-4-1-40-44_
Оригинальные статьи
кологии. Этому способствует достоверность получаемых результатов, неинвазивность метода, доступность, безопасность, возможность неоднократного применения и относительная простота исследования [8]. Однако если в кардиологии, акушерстве и клинике внутренних болезней ультразвуковое исследование начали применять практически сразу после создания первых приборов в А-режиме и с получением В-сканирования в конце 50-х годов, то история использования этого метода для диагностики гинекологических заболеваний началась с появлением приборов, дающих достаточно точное изображение исследуемых органов [9].
В 1969 г. в Вене на первом конгрессе «Ультразвук в медицине» были представлены приборы для биста-бильной обработки эхосигнала, которые сразу стали применяться в диагностике заболеваний малого таза. Но точность метода оказалась невелика из-за использования для трансабдоминального ультразвукового исследования только низкочастотных датчиков. При этом, с одной стороны, применение недостаточно совершенной аппаратуры не дает возможности выявить небольшие образования, с другой — возникали трудности в дифференциальной диагностике различных патологических процессов [10].
Информативность трансабдоминальной эхографии, несмотря на усовершенствование ультразвуковой сканирующей техники (улучшение разрешающей способности, использование электронных датчиков с переменной частотой и др.), ограничена пределами физических возможностей ультразвука. В то же время чувствительность методики достигает 75—80%, и использование ее на первом этапе ультразвуковой диагностики помогает в предварительном определении топического расположения органов и образований в малом тазу [6, 8, 10].
Внедрение в клиническую практику трансвагинальной эхографии привело к значительному повышению качества ультразвуковой диагностики патологии женских половых органов. Впервые результаты трансвагинальной ультразвуковой диагностики опухолей матки и яичников опубликовали А. Kratochwil и соавт. (1972 г.). Методика, предложенная авторами, заключалась в следующем: ультразвуковой датчик сравнительно малого размера помещали на указательном пальце исследователя под перчаткой; во время обследования больной использовали принцип обычного гинекологического осмотра, во время которого ультразвуковой преобразователь подводили к изучаемому органу. Результаты, полученные А. Kratochwil, позволили обосновать высокую диагностическую ценность этой методики, а также разработать критерии дифференциальной диагностики кистозных и солидных опухолей яичников [11, 12].
С появлением приборов, работающих в режиме реального времени по принципу «серой шкалы», связана новая эра трансвагинальной ультразвуковой диагностики. Шаг вперед в развитии данной методики сделали S.R. Schwimer и соавт. Исследователи разработали
специальную конструкцию датчика с рабочей частотой 3,6 МГц для введения во влагалище. Использование низкочастотных датчиков не позволило авторам добиться существенного улучшения результатов диагностики гинекологических заболеваний по сравнению с традиционным чрескожным исследованием. Впервые трансвагинальная эхография в том виде, в котором она используется в настоящее время, появилась в 1986 г., когда стали применять высокочастотные трансвагинальные датчики. Именно с этого времени трансвагинальная эхография получила должное признание в диагностике заболеваний женских половых органов [9, 10, 12].
В последние годы значительно возросла разрешающая способность ультразвуковой аппаратуры, что позволяет широко применять УЗИ в онкогинекологии. В настоящее время, пожалуй, нет другого объективного визуального метода, который бы так широко применяли на всех этапах обследования и ведения пациенток. Ультразвуковая диагностика используется с диагностической целью, для выбора объема оперативного вмешательства, планирования самостоятельной гормональной и лучевой терапии, контроля за эффективностью химиотерапии и лучевого лечения, динамического контроля за больными после хирургического или комбинированного лечения и выявления рецидива заболевания. Однако, несмотря на высокую разрешающую способность метода, частота ошибок при установлении топического диагноза у больных с новообразованиями в малом тазу, а также при определении характера и распространенности опухолевого процесса продолжает составлять около 10—30% [1, 13].
Поиск путей предупреждения диагностических ошибок при УЗИ у онкогинекологических больных требует углубленного изучения причин их возникновения. Мы считаем, что среди причин диагностических ошибок с известной степенью условности можно выделить те, которые связаны с разрешающей способностью аппаратуры, подготовкой больных к исследованию и проведением УЗИ [14].
Для улучшения качества диагностики онкогине-кологических заболеваний и выявления причин диагностических ошибок нами проведен сравнительный анализ ультразвуковых заключений, данных операционных находок и результатов морфологических исследований препаратов.
В МНИОИ им. П.А. Герцена с 2008 по 2015 г. были обследованы, а затем прооперированы 500 пациенток с диагнозом рака яичников в возрасте 21—69 лет, всем больным до операции проведено УЗИ. Распределение пациенток по стадиям ТКМ (международная классификация стадий злокачественных новообразований) представлено в табл. 1.
Пациенткам выполнялось ультразвуковое сканирование брюшной полости, малого таза (по стандартной методике: трансабдоминальное сканирование с тугим наполнением мочевого пузыря, затем трансвагинальное сканирование), забрюшинного пространства (па-
Таблица 1. Распределение больных раком яичников по стадиям TNM
Стадия Число больных Итого
абс. % (по стадиям), %
TIa 21 4,2 22,4
TIb 34 6,8
Tic 57 11,4
Tila 19 3,8 17,8
Tllb 39 7,8
Tllc 31 6,2
Tilla 32 6,4 46,4
TIIIb 37 7,4
Tille 163 32,6
TIV 67 13,4 13,4
Все го … 500 100
рааортальная область, области общих, наружных и внутренних подвздошных сосудов), надключичных и паховых областей на ультразвуковых аппаратах экспертного класса Logic 9 («GE», США) и Acuson Antares («Siemens», США) с использованием трех типов датчиков (конвексного с частотой 2—4 МГц, линейного — 7—9 МГц и 9—12 МГц, а также внутриполостного — 5—8 МГц).
В задачи ультразвукового исследования у больных раком яичников входило определение следующих особенностей:
• один или оба яичника поражает опухоль;
• имеется ли инфильтрация брюшины малого таза;
• наличие асцита, плеврита;
• наличие метастатического поражения печени, лимфатических узлов забрюшинного пространства, надключичных и паховых областей;
• вовлечение в опухолевый процесс большого сальника и наличие диссеминации по брюшине.
На последнее следует обратить особое внимание, поскольку визуализировать очаги поражения в большом сальнике и очаги диссеминатов на брюшине в виде узлов до 10 мм в диаметре трудно, особенно при отсутствии асцита. Если у больной в брюшной полости имеется небольшое или умеренное количество свободной жидкости, задача исследователя несколько облегчается. При наличии жидкости рядом с диссеминатами петли кишечника смещаются кпереди, к передней брюшной стенке, и опухолевые узлы на париетальной брюшине, капсуле печени или селезенки, петлях кишечника или наружной стенке желудка становятся видны в виде изо-эхогенных, гиперэхогенных или кистозных очаговых образований различных размеров, фиксированных к брюшине или капсуле органа. Большой сальник (в положении больной на спине) также вытесняется асцитом к передней брюшной стенке в верхний этаж брюшной полости. Это значительно облегчает осмотр опухоле-во-измененного сальника. В малом тазу инфильтраты
V.F. Snegirev Archives of Obstetrics and Gynecology. 2017, 4 (1) _DOI http://dx.doi.org/10.18821/2313-8726-2017-4-1-40-44
Original papers
могут быть видны при ультразвуковом исследовании в виде гипоэхогенных образований, расположенных в дугласовом кармане, а также на брюшине в виде гипоэхогенных и изоэхогенных стелящихся образований, протяженностью от 12—14 мм до 4—6 см и более, толщиной в пределах 3—25 мм. В брюшной полости инфильтраты визуализируются как на висцеральной, так и на париетальной брюшине в виде стелящихся гипоэхогенных образований различной протяженности.
Поражение яичников опухолью в большинстве случаев выражается в их увеличении. По структуре опухоли могут быть: солидными (54%), солидно-кистозными (15%), кистозными (20%), кистозно-солидными (11%). В 9% случаев при наличии выраженных вторичных метастатических проявлений (асцит, поражение большого сальника, плеврит, измененные забрюшинные лимфатические узлы и т. д.) сами яичники могут быть не увеличены, хотя при прицельном ультразвуковом исследовании удается выявить признаки их опухолевого поражения.
Вторично измененные забрюшинные лимфатические узлы визуализируются как единичные или в виде цепочки увеличенных умеренно гипоэхогенных лимфатических узлов. Метастазы рака яичников в печени визуализируются как кистозно-солидные, солидные изоэхоген-ные и (или) гипоэхогенные очаги различных размеров.
По результатам предоперационного ультразвукового исследования у 458 (91,6%) из 500 пациенток отмечено двухстороннее поражение яичников, а у 42 (8,4%) женщин — одностороннее поражение яичника. Асцит по результатам УЗИ выявлен у 253 (50,6%) женщин, плеврит — у 19 (3,8%).
Результаты распространенности опухолевого процесса по данным эхографии до оперативного лечения представлены в табл. 2.
Ошибки при предоперационном УЗИ, проведенном у 500 оперированных больных раком яичников, представлены в табл. 3.
Таким образом, у 102 (20,4%) пациенток, больных раком яичников, при предоперационном ультразвуко-
Таблица 2. Распространенность рака яичников по данным УЗИ
Анатомическая область, где обнаружен рак Число больных
абс. %
Большой сальник 264 52,8
Брюшина 185 37
Диафрагма 3 0,6
Желудок 4 0,8
Забрюшинные лимфатические узлы 76 15,2
Мягкие ткани 7 1,4
Надключичные лимфатические узлы 67 13,4
Паховые лимфатические узлы 28 5,6
Печень 19 3,8
Подмышечные лимфатические узлы 4 0,8
Селезенка 7 1,4
Архив акушерства и гинекологии им. В.Ф. Снегирева. 2017, 4 (1) РР! http://dx.doi.org/10.18821/2313-8726-2017-4-1-40-44_
Оригинальные статьи
Таблица 3. Ошибки при УЗИ в оценке распространенности рака яичников
Анатомическая область, Абсолютное число больных
где обнаружен рак данные данные
предоперацион- операционных
ного УЗИ находок
Большой сальник
Брюшина
Забрюшинные лимфатические узлы
Печень
264 185 76
19
366 228 122
42
вом исследовании не был выявлен измененный большой сальник. Из них у 87 (85,3%) больных с выявленным раком яичников не было асцита или небольшое количество жидкости локализовалось в полости малого таза за маткой, что не позволяло визуализировать большой сальник. Отсутствие жидкости способствовало установлению неполного диагноза и занижению степени распространенности опухолевого процесса. У 7 (6,9%) пациенток измененный сальник был коротким и подпаянным к передней брюшной стенке. У 8 (7,8%) пациенток при наличии асцита изменения сальника выявлены только интраоперационно, таким образом, в 8 (7,8%) случаях ошибка носила субъективный характер.
У 185 (37%) пациенток при первичной дооперацион-ной диагностике выявлены диссеминаты на брюшине, а в 43 (8,6%) случаях диссеминаты на брюшине не визуализировались. В 177 (35,4%) случаях одним из наиболее часто встречающихся диссеминатов был очаг на париетальной брюшине в дугласовом пространстве. При наличии небольшого количества жидкости за маткой при интраполостном исследовании этот диссеминат хорошо визуализируется. В 8 (1,6%) случаях диссеми-наты были выявлены в других отделах (париетальной и висцеральной брюшине, на стенке прямой кишки и т. д.). Из 43 (8,6%) случаев невыявленных диссеминатов большая часть ошибок носила объективный характер: у 37 (86%) пациенток диссеминаты были до 8—20 мм в диаметре, а выпот в брюшной полости и малом тазу — минимальным. У 6 (14%) пациенток сравнение данных до- и послеоперационного исследования показало, что ошибки носили субъективный характер.
У 23 (4,6%) пациенток на дооперационном этапе не были выявлены метастазы в печени. У трех (13,1%) из них метастазы выглядели как кистозные образования и были ошибочно приняты за обычные кисты печени. В 20 (86,9%) случаях очаги при первичном осмотре не визуализировались. Таким образом, в трех случаях ошибки были субъективными, а в 20 случаях — объективными. У 46 (9,2%) пациенток не были выявлены метастазы в забрюшинных лимфоузлах, из них у 6 (13%) метастазы отмечались в обтураторных областях, которые не визуализируются при ультразвуковом исследовании, так как находятся за костными структурами, непроницаемыми для ультразвуковой волны. В 32 (69,6%) наблюдениях
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
лимфатические узлы находились в парааортальной области, были менее 10 мм в диаметре и по структуре изо-эхогенными относительно окружающей забрюшинной клетчатки, что и не позволило их выявить. Таким образом, в 38 (82,6%) случаях невыявленных забрюшинных метастазов ошибка оказалась объективной. В остальных 8 (17,4%) случаях причину недооценки вторичного поражения забрюшинного пространства выявить не удалось и надо считать ошибки субъективными.
Выявленные ошибки носили объективный и субъективный характер. К первым были отнесены ошибки, связанные с пределом разрешающей способности аппаратуры и нарушением методики подготовки больных к исследованию, что является одной из частых причин установления ошибочного диагноза при выполнении ультразвукового исследования. При проведении эхографии органов малого таза и брюшной полости у больных раком яичников должен быть полностью опорожнен кишечник. При избыточном количестве газов и каловых масс в кишечнике значительно изменяется эхографическая картина, что может привести к ошибоч -ной интерпретации полученных данных. Объективные ошибки при ультразвуковом исследовании составляют значительный процент от общего числа неправильных заключений как при первичной, так и при уточняющей диагностике, и ни один врач от них не гарантирован.
В основе ошибочных заключений, связанных с проведением УЗИ, лежат также причины субъективного характера, которые приводят к установлению неполного, частично ошибочного или ошибочного диагноза.
Применительно к ультразвуковой диагностике в онкогинекологии диагноз считают неполным в том случае, если не распознаны осложнения опухолевого процесса и не выявлены сопутствующие заболевания. Частично ошибочный диагноз обусловлен отсутствием необходимой информации о распространении опухолевого процесса: степени специфической инфильтрации соседних органов и тканей, наличии метастатического поражения большого сальника, двухстороннем вовлечении в процесс яичников, метастатическом поражении лимфатических узлов.
Отсутствие знаний о путях метастазирования опухолей неизбежно приводит либо к поверхностному обследованию больных, либо к диагностической ошибке. Так, при метастазировании злокачественных опухолей по лимфогенным путям требуется тщательное исследование регионарных лимфатических узлов. Гематогенный путь метастазирования предполагает тщательное исследование органов-мишеней, например печени.
Снижение количества объективных ошибок связано в основном с техническим оснащением отделения ультразвуковой диагностики. Снижение же числа субъективных ошибок возможно при методически правильном выполнении ультразвукового исследования, состоящего в проведении на первом этапе трансабдоминального сканирования по стандартной методике с наполненным мочевым пузырем после активного
опорожнения кишечника, на втором этапе — трансвагинального ультразвукового сканирования органов малого таза. При невозможности трансвагинального сканирования у женщин с онкогинекологическими заболеваниями необходимо выполнять трансректальное УЗИ органов малого таза.
Нередко причиной ошибочных заключений при ультразвуковой диагностике опухолевых заболеваний гениталий является недостаточная осведомленность врача, проводящего исследование, о патологических процессах, которые могут протекать в том или другом органе. Высококвалифицированный врач должен знать симптоматику, а также диагностические и дифференциально-диагностические эхографические критерии каждого гинекологического заболевания, то есть быть хорошо подготовленным как в области ультразвуковой диагностики, так и в онкогинекологии.
Диагностическое отделение должно быть оснащено ультразвуковыми аппаратами высокой разрешающей способности с полным комплектом широкополосных датчиков со сменными частотами ультразвукового излучения, а для выполнения трансвагинального исследования необходимо иметь в комплекте панорамные датчики с углом сканирования 180—220°, а также аппаратуру для допплеровских исследований. Целесообразно более широкое внедрение в клиническую практику таких ультразвуковых методик, как цветовое доппле-ровское картирование с измерением кривых скоростей кровотока, потоковое допплеровское сканирование и, конечно же, 3Р- и 4Р-сканирование.
Таким образом, для исключения субъективных ошибок при диагностике рака яичников необходимо введение планомерного непрерывного обучения как онкологии, так и ультразвуковой семиотике специалистов ультразвуковой диагностики, выработки у диагностов онкологической настороженности. Специалисты должны помнить, что наличие даже небольшого выпота в полости таза должно иметь физиологическое объяснение. При невозможности такого объяснения, особенно при обследовании женщины в климактерическом периоде, наличие жидкости в животе должно приводить к дальнейшему обследованию пациентки для исключения рака яичников.
С целью исключения объективных ошибок необходимо стремиться к качественной подготовке пациентов и оснащению медицинских учреждений современными диагностическими аппаратами.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
ЛИТЕРАТУРА
1. Синицина М.Е. Роль ультразвуковой томографии в предоперационном стадировании и оценке эффективности лечения рака яичников: Дисс. … канд. мед. наук. М.; 2007.
2. Бохман Я.В. Лекции по онкогинекологии. М.: Медицинское информационное агентство; 2007.
V.F. Snegirev Archives of Obstetrics and Gynecology. 2017, 4 (1) _DOI http://dx.doi.org/10.18821/2313-8726-2017-4-1-40-44
Original papers
3. Савельева Г.М. и др. Значение дополнительных методов исследования в диагностике опухолей и опухолевидных образований яичников. Международный медицинский журнал. 2001; (1): 79-87.
4. Каприн А.Д., Старинский В.В., Петрова Г.В. (ред.). Состояние онкологической помощи населению России в 2013 году М.; 2014.
5. Jayde V., White K., Blomfield P. Symptoms and diagnostic delay in ovarian cancer: a summary of the literature. Contemp. Nurse. 2009; 34: 55-65.
6. Medeiros L.R., Freitas L.B., Rosa D.D., Silva F.R., Silva L.S., Birtencourt L.T. et al. Accuracy of magnetic resonance imaging in ovarian tumor: a systematic quantitative review. Am. J. Obstet. Gynecol. 2011; 204 (1): 67.e1-10.
7. Carter J. An experience with transvaginal sonography in gynecologic tumors surveillance Aust. N. Z. J. Obstet. Gynecol. 2000; 40 (4): 43841.
8. Jelovac D., Armstrong D.K. Recent progress in the diagnosis and treatment of ovarian cancer. C.A. Cancer J. Clin. 2011; 61(3): 183-203.
9. Levi S. The history of ultrasound in gynecology 1950-1980. Ultrasound Med. Biol. 1997; 23(4): 481-552.
10. Pfeifer S.M., Gosman G.G. Evaluation of adnexal masses in adolescents. Pediatr. Clin. N. Am. 1999; 46(3): 573-92.
11. Kratochwil A., Urban G., Friedrich F. Ultrasonic tomography of the ovaries. Ann. Chir. Gynaecol. Fenn. 1972; 61(4): 211-4.
12. Sassone A.M., Timor-Trish I.E., Artner A., Westhoff C., Warren W.B. Transvaginal sonographic characterization of ovarian disease: evaluation of a new scoring system to predict ovarian malignancy. Obstet. and Gynecol. 1991; 78: 70-6.
13. Fischerova D. Ultrasound scanning of the pelvis and abdomen for staging of gynecological tumors: a review. Ultrasound Obstet. Gynecol. 2011; 38(3): 246-66.
14. Трофимова Е.Ю., Новикова Е.Г., Востров А.Н. Ошибки ультразвуковой диагностики в онкогинекологии. Рос. онкол. журн. 1999; (1): 24-9.
REFERENCES
1. Sinitsina M.E. The Role of Ultrasound Imaging in Preoperative Staging and Evaluation of Treatment of Ovarian Cancer: Diss. Moscow; 2007. (in Russian)
2. Bokhman Ya.V. Lectures on Oncogynecology.[Lektsii po onk-oginekologii]. Moscow: Meditsinskoye informatsionnoye agentstvo; 2007. (in Russian)
3. Savel’yeva G.M. et al. The value of additional methods of research in the diagnosis of tumors and tumor-like formations of ovaries. Mezh-dunarodnyy medit.sin.skiy zhurnal. 2001; (1): 79-87. (in Russian)
4. Kaprin A.D., Starinskiy V.V., Petrova G.V. (Eds.). Status of Cancer Care the Population of Russia in 2013.[Sostoyaniye onkologicheskoy pomoshchi naseleniyu Rossii v 2013 godu]. Moscow; 2014. (in Russian)
5. Jayde V., White K., Blomfield P. Symptoms and diagnostic delay in ovarian cancer: a summary of the literature. Contemp. Nurse. 2009; 34: 55-65.
6. Medeiros L.R., Freitas L.B., Rosa D.D., Silva F.R., Silva L.S., Birtencourt L.T. et al. Accuracy of magnetic resonance imaging in ovarian tumor: a systematic quantitative review. Am. J. Obstet. Gy-necol. 2011; 204 (1): 67.e1-10.
7. Carter J. An experience with transvaginal sonography in gynecologic tumors surveillance Aust. N. Z. J. Obstet. Gynecol. 2000; 40 (4): 43841.
8. Jelovac D., Armstrong D.K. Recent progress in the diagnosis and treatment of ovarian cancer. C.A. Cancer J. Clin. 2011; 61(3): 183-203.
9. Levi S. The history of ultrasound in gynecology 1950-1980. Ultra-soundMed. Biol. 1997; 23(4): 481-552.
10. Pfeifer S.M., Gosman G.G. Evaluation of adnexal masses in adolescents. Pediatr. Clin. North Am. 1999; 46(3): 573-92.
11. Kratochwil A., Urban G., Friedrich F. Ultrasonic tomography of the ovaries. Ann. Chir. Gynaecol. Fenn. 1972; 61(4): 211-4.
12. Sassone A.M., Timor-Trish I.E., Artner A., Westhoff C., Warren W.B. Transvaginal sonographic characterization of ovarian disease: evaluation of a new scoring system to predict ovarian malignancy. Obstet. and Gynecol. 1991; 78: 70-6.
13. Fischerova D. Ultrasound scanning of the pelvis and abdomen for staging of gynecological tumors: a review. Ultrasound Obstet. Gynecol. 2011; 38(3): 246-66.
14. Trofimova E.Yu., Novikova E.G., Vostrov A.N. Errors ultrasound diagnostics in gynecological oncology. Ros. onkol. zhurn. 1999; (1): 24-9. (in Russian)
Поступила 11.01.2017 Принята к печати 27.01.2017
Борисова О.В.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Ермолаева А.Г.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Мельникова В.Ю.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Петров А.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Славнова Е.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Срочная интраоперационная морфологическая диагностика в онкологии
Авторы:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н.
Как цитировать:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н. Срочная интраоперационная морфологическая диагностика в онкологии. Онкология. Журнал им. П.А. Герцена.
2015;4(4):5‑11.
Volchenko NN, Borisova OV, Ermolaeva AG, Melnikova VYu, Petrov AN, Slavnova EN. Rapid intraoperative morphological diagnosis in oncology. P.A. Herzen Journal of Oncology. 2015;4(4):5‑11. (In Russ.)
https://doi.org/10.17116/onkolog2015445-11

Срочная интраоперационная морфологическая диа-гностика (СИМД) — цитологическая и гистологическая — применяется более 100 лет. В последнее время наблюдается общемировая тенденция к снижению количества срочных морфологических исследований во время операции. Это связано с широким применением минимально инвазивных методов получения материала в дооперационной диагностике с целью морфологической верификации процесса, определения факторов прогноза течения заболевания и показаний к назначению адекватной терапии. Благодаря развитию методов уточняющей морфологической диагностики, таких как иммуногистохимия (ИГХ) и цитохимия, и молекулярно-генетических методов расширяются знания об опухолях. Правильный диагноз возможен только при исследовании всего объема опухоли, включая соответствующие ИГХ и молекулярно-генетические исследования. В связи с применением методов уточняющей диагностики показания для СИМД значительно сокращаются. Однако важность срочного морфологического исследования остается несомненной. СИМД по-прежнему играет важную роль, так как определяет тактику хирурга во время операции, позволяет избежать повторных операций или излишне обширных оперативных вмешательств.
Целью интраоперационной морфологической диагностики является адекватное выполнение хирургического вмешательства. Основными задачами срочного интраоперационного морфологического исследования являются:
1) морфологическая верификация диагноза после нескольких неудачных попыток или невозможности дооперационной диагностики, а также при несоответствии морфологического диагноза операционным находкам;
2) уточнение степени распространенности опухолевого процесса путем изучения зон регионарного метастазирования, близкорасположенных органов, состояния органов высокого риска метастазирования, экссудатов и смывов из серозных оболочек;
3) установление абластичности операционных краев резекции;
4) контроль информативности взятого материала при некоторых диагностических операциях.
СИМД имеет ограниченные возможности для уточнения гистогенеза и степени дифференцировки опухоли, для определения характера опухоли (первичная или метастаз), диагностики опухолей кожи, сарком мягких тканей и костей, злокачественных лимфом, опухолевых узлов полиморфного строения, оценки степени лечебного патоморфоза. Не следует применять СИМД при подозрении на cr in situ или микроинвазию.
Показания для срочного цитологического или гистологического исследования определяет оперирующий хирург. Оба метода имеют свои преимущества и недостатки.
По данным литературы [1—6], точность СИМД в зависимости от объекта исследования составляет от 89% при исследовании лимфатических узлов до 98—99% при других локализациях. Ошибочный диагноз при СИМД возможен как ложноположительный, так и ложноотрицательный. Причинами ложноотрицательного морфологического заключения могут быть регрессия опухоли, вызванная неоадъювантной химиотерапией, некроз, замещение опухолевой ткани новообразованными сосудами, гистиоцитами, лимфоцитами и фиброзом, что может быть неправильно истолковано как хроническое воспаление. Причинами ложноположительных заключений являются резко выраженная пролиферация и реактивные изменения клеточных элементов. Эти ошибки могут быть вызваны неправильным толкованием морфологической картины, низким качеством замороженных срезов, неправильным забором материала для исследования, незнанием макроскопических признаков, сложными случаями для интерпретации, наличием только карциномы in situ в образце, гетерогенностью опухоли.
Следовательно, необходимо понимание различных проблем, с которыми может столкнуться как патологоанатом при исследовании замороженных срезов, так и цитолог при СИМД.
Для качественной интраоперационной морфологической верификации диагноза необходимо получение информативного операционного материала, правильное оформление сопроводительных документов с указанием анамнестических данных, стадии процесса, характера предоперационного лечения, сроков его проведения, макро- и микроскопического исследования операционного материала.
Цель исследования — оценить точность СИМД и проанализировать причины диагностических ошибок.
Материал и методы
В 2013 г. ФГБУ «ФМИЦ им. П.А. Герцена» выполнено 418 срочных гистологических исследований у 361 больного (7% общего количества операций) и 1198 срочных цитологических исследований у 646 (12,5%) больных. В 2014 г. выполнено 507 срочных гистологических исследований у 356 (8%) пациентов и 1356 срочных цитологических исследований у 676 (15,5%) пациентов. Для срочного гистологического исследования применяются криостатные срезы, препараты окрашиваются гематоксилином и эозином. Недостатком криостатных срезов является более низкое качество гистологических препаратов, чем при плановом гистологическом исследовании после приготовления парафиновых блоков. Срочное гистологическое исследование проводится в течение 20—30 мин. Для срочной окраски цитологических препаратов применяют набор для окраски Лейкодиф (Чехия). Срочное цитологическое исследование занимает 10—15 мин. Для исследования экссудатов из серозных полостей и диагностики метастатического поражения лимфатических узлов применяется иммунофлюоресцентное исследование (ИФИ) с антителом к эпителиальному антигену Ber-EP4 FITC («Dako»). ИФИ осуществляется на флюоресцентном микроскопе Carl Zeiss Imager M1.
Результаты
Морфологическая верификация диагноза
Интраоперационная морфологическая верификация диагноза применяется в основном при периферических образованиях легких, недоступных для дооперационного морфологического исследования, при опухолях яичников, а также при неуверенном дооперационном морфологическом диагнозе при опухолях молочной железы. Мы придерживаемся правила — не использовать срочное исследование при cr in situ, так как можно не получить категоричного заключения ни при срочном, ни при плановом исследовании.
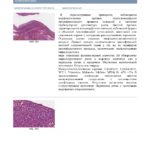
Гистологическая СИМД для верификации процесса в легком позволила установить туберкулез в 32,8%, гамартому в 8,2%, хроническое продуктивное воспаление в 6,6% наблюдений, что дало возможность избежать излишне радикальных операций. Нейроэндокринные опухоли (типичный и атипичный карциноид) выявлены в 8,2% наблюдений (рис. 1, 2 и далее). Злокачественный процесс установлен в 44,3% наблюдений, при этом 85% составила аденокарцинома легкого, преимущественно высокодифференцированная (прежний БАР) (рис. 3), а 14,8% — метастазы аденокарциномы кишечного типа, желудка и меланомы в ткани легкого. Расхождений срочного и планового гистологического исследований не отмечалось.
При срочном цитологическом исследовании образований в легком гиподиагностика составила 6,7% (4 наблюдения из 60), что связано с получением материала из очага некроза, воспаления, а также наличием микроочагов опухоли на фоне пневмонии. В 6,6% наблюдений цитологически было дано неуверенное заключение.
Опухоли яичников всегда подвергаются СИМД с целью верификации диагноза, что обусловлено отсутствием дооперационной морфологической диагностики — опухоли практически не пунктируют из-за опасности диссеминации. Изучение криостатных срезов является важным диагностическим инструментом определения характера поражений яичников. В 30% наблюдений проведено двустороннее исследование яичников. При СИМД сравнительно просто диагностируют неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и т. д. (54,4%). Доброкачественные опухоли яичников диагностированы в 15,8% случаев, пограничные опухоли яичников (ПОЯ) — в 8,5%, злокачественные — в 21,5%. В одном наблюдении при СИМД диагностирована аденокарцинома яичника, а при плановом гистологическом исследовании установлена тератома. Ошибка связана с выраженной пролиферацией и образованием сосочковых структур эпителиального компонента тератомы. СИМД опухолей яичников имеет ряд ограничений, особенно при ПОЯ, которые характеризуются некоторыми гистологическими особенностями — нарушением стратификации эпителиального пласта, увеличением митотической активности, в некоторых случаях ядерной атипией, но отсутствует стромальная инвазия. СИМД опухолей яичников определяет объем оперативного вмешательства. При доброкачественных и ПОЯ можно выполнить органосохраняющее лечение у молодых женщин, в то время как злокачественные эпителиальные опухоли, как правило, требуют обширного хирургического вмешательства с гистерэктомией, двусторонним удалением придатков матки и сальника, а также тазовой и ретроперитонеальной лимфаденэктомией. При исследовании опухолей яичников необходимо тщательное макроскопическое исследование материала в совокупности с клиническими данными и методами инструментального исследования. Желательно исследовать несколько криостатных срезов из разных участков. По нашим данным, ошибка при исследовании ПОЯ яичников имела характер гиподиагностики и составила 7%, что связано в основном с наличием лишь микроочагов опухоли (рис. 4). Большой размер опухоли, двустороннее поражение, а также муцинозный характер являются неблагоприятными факторами в определении злокачественного потенциала при СИМД. В 20% наблюдений при исследовании брюшины при СИМД выявлены импланты ПОЯ. Если имеются инфаркт и некротические изменения, а также киста, лишенная эпителиальной выстилки, окончательные выводы следует делать при плановом гистологическом исследовании на парафиновых блоках. В 14,3% случаев при СИМД выявлены метастазы в яичниках эндометриоидной аденокарциномы, аденокарциномы шейки матки, желудка, молочной железы и почки, подтвержденные плановым гистологическим исследованием.
Таким образом, чувствительность СИМД при опухолях яичников составляет 98,7%, специфичность — 99%.
Срочное цитологическое исследование яичников применяется при пункции кист или при невозможности гистологического исследования. В одном наблюдении при исследовании кисты цитологически имелась гиподиагностика ПОЯ, что связано с объективными трудностями — клеточная атипия отсутствовала. Однако при пересмотре цитологических препаратов имелись плотные опухолевые комплексы из мелких клеток, что характерно для ПОЯ.
СИМД при образованиях молочной железы в настоящее время применяют крайне редко, так как морфологический диагноз является результатом исследования дооперационных трепанобиопсий. При расхождении цитологического и гистологического диагнозов и при неуверенном дооперационном диагнозе проводится срочное морфологическое исследование. Доброкачественные поражения составили 57%, при плановом гистологическом исследовании подтверждены такие процессы, как аденоз, фиброаденома с дисплазией эпителия. Рак молочной железы установлен в 40% (18 наблюдений), из них 33% составил дольковый рак, в 2 наблюдениях выявлена cr in situ, в одном наблюдении имелся тубулярный рак на фоне склерозирующего аденоза (рис. 5). В другом наблюдении при СИМД диагностирована липогранулема, а при плановом гистологическом исследовании выявлен небольшой очаг инвазивного рака без признаков специфичности. Чувствительность интраоперационного гистологического диагноза при раке молочной железы составляет 97%, специфичность — 100%. Неуверенное заключение дается в 1—2% наблюдений. Противопоказаниями к срочному исследованию являются внутрипротоковый и внутридольковый рак (cr in situ), внутрипротоковая папиллома. Высокодифференцированная папиллярная и тубулярная карцинома, отсутствие клеточной атипии при инвазивном дольковом раке часто при СИМД неправильно диагностируются как доброкачественные поражения как при цитологическом, так и гистологическом исследовании. Инвазивный микрососочковый рак и лимфому молочной железы трудно диагностировать при СИМД.
Случаи гипердиагностики в нашем материале не выявлены, но такие ошибки возможны при пролиферирующем папилломатозе и аденоме соска с гиперплазией эпителия протоков соска с формированием железистых и папиллярных структур, особенно с центральным некрозом, что можно ошибочно принять за внутрипротоковый рак; при склерозирующем аденозе с радиальным рубцом, когда создается впечатление инвазивного роста рака; при гранулематозном мастите, эктазии протоков и некрозе жировых клеток. Для избежания морфологической ошибки необходимо тщательное исследование препарата: отсутствие атипии эпителия, наличие миоэпителиального слоя, плотная коллагеновая строма помогают в постановке правильного морфологического диагноза.
Интраоперационно цитологически опухоли молочной железы исследуют крайне редко: при наличии кист и отсутствии дооперационного морфологического диагноза. В нашем исследовании имелось одно наблюдение, когда цитологически диагностирована папиллярная киста молочной железы, а при плановом гистологическом исследовании диагностирован папиллярный рак.
Цитологическая гиподиагностика при исследовании первичной опухоли составила 3,8%, что связано с утратой морфологических особенностей опухолевых клеток, особенно при недифференцированных и мелкоклеточных новообразованиях (например, мелкоклеточный лимфоцитоподобный рак), а также выраженными дистрофическими изменениями опухолевых клеток. Цитологическая гипердиагностика не превысила 1% и связана с выраженными реактивными изменениями эпителия.
Уточнение степени распространенности опухолевого процесса
С развитием интраоперационного ультразвукового исследования, микрохирургических пособий во время операции, позволяющих обнаружить очаги опухоли, невыявленные на дооперационном обследовании, и интраоперационных находок при непосредственной ревизии операционной раны СИМД имеет неоценимые преимущества. Проведение СИМД в 10% случаев изменяет объем оперативного вмешательства [7]. Невозможность выполнения оперативного вмешательства должна быть подтверждена морфологически.
СИМД позволяет объективно оценить состояние лимфатического коллектора. В 30—40% макроскопически неизмененных лимфатических узлов обнаруживают метастазы, а в 25—30% макроскопически похожих на метастатические узлы при микроскопическом исследовании метастазы не выявляют. Срочное интраоперационное гистологическое исследование лимфатических узлов может быть неудачным в 25% наблюдений [7]. Большое количество ложноотрицательных заключений как цитологических, так и гистологических является серьезной проблемой для клинического применения СИМД в основном из-за ограниченной способности обнаруживать микрометастазы, особенно подкапсульные, которые просто не попадают в срез или соскоб с поверхности разрезанного лимфатического узла. Кроме того, возможна потеря отдельных опухолевых клеток при приготовлении гистологического препарата. Чувствительность и специфичность срочного цитологического исследования лимфатических узлов аналогичны исследованию криостатных срезов, поэтому цитологический метод является альтернативой срочному гистологическому исследованию лимфатических узлов.
В нашем центре проведена работа по исследованию лимфатических узлов при радикальной трахелэктомии у пациенток с начальным раком шейки матки [8]. Удаленные лимфатические узлы подвергали срочному цитологическому исследованию. При обнаружении увеличенных и подозрительных по метастатическому поражению тазовых и парааортальных лимфатических узлов срочное цитологическое исследование дополняли или заменяли срочным гистологическим исследованием. По результатам срочного цитологического и гистологического исследования у 5 (6%) пациенток из 81 выявлены метастазы в лимфатических узлах, в связи с чем произведена конверсия трахелэктомии в расширенную экстирпацию матки с удалением или транспозицией придатков. Метастатическое поражение лимфатических узлов во всех случаях было подтверждено при плановом гистологическом исследовании. В 3 случаях установлены микрометастазы (<2 мм), в 2 — макрометастазы. Число положительных лимфатических узлов варьировало от 1 до 5. Во всех наблюдениях отмечались метастазы плоскоклеточного рака [8].
В настоящее время широко применяется СИМД сторожевого (сигнального) лимфатического узла (СЛУ). Метастатическое поражение СЛУ является одним из основных прогностических и предиктивных факторов при раннем раке желудка, шейки матки, молочной железы и меланоме. СЛУ является первым лимфатическим узлом на пути оттока лимфы от первичной опухоли. Отрицательный СЛУ может исключать возможность метастазов в других лимфатических узлах, что не всегда подтверждается на практике. Например, у женщин с ранним раком шейки матки и молочной железы, которые хотят сохранить репродуктивный потенциал, можно избежать радикального хирургического вмешательства, если в сторожевом узле отсутствует метастаз. Исследование СЛУ проведено гистологически у 4 пациенток при раке шейки матки, метастазов не выявлено; цитологически исследовано 3 СЛУ при раке желудка (у 2) и молочной железы (у 1), метастазов не выявлено.
Причинами гиподиагностики является исследование не всех удаленных лимфатических узлов. Оптимально исследуют не более 5 лимфатических узлов из-за ограничения временны́х рамок. Пролиферация гистиоцитарных элементов при синус-гистиоцитозе с наличием крупных полиморфных гистиоцитов может служить причиной гипердиагностики. Для уточнения диагноза используется ИФИ лимфатических узлов, повышающее достоверность цитологической диагностики до 94%.
Часто для уточнения степени распространенности опухолевого процесса исследуются близкорасположенные органы, брюшина.
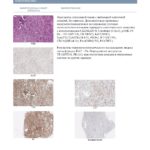
Важное значение в оценке степени распространенности опухолевого процесса имеет исследование экссудатов из серозных полостей. Остается сложной и нерешенной задачей цитологического исследования диссеминатов с брюшины при перстневидно-клеточном раке желудка из мелких клеток, ПОЯ, так как эти опухоли при микроскопическом исследовании крайне сложно дифференцировать с реактивным мезотелием. Срочное гистологическое исследование в большинстве наблюдений позволяет установить диссеминацию опухоли. Применение ИФИ повышает выявляемость клеток аденогенного рака до 98% (рис. 6, 7). Из исследованных 150 экссудатов при СИМД ИФИ проведено в 17 (11%) наблюдениях, из них наиболее часто при перстневидно-клеточном раке желудка (12 наблюдений) и ПОЯ (4 наблюдения), что позволило установить диссеминацию опухоли в брюшной полости.
Достоверность СИМД метастазов в печени составляет 98%, гиподиагностика отмечена в одном наблюдении из-за резко выраженной деформации материала. Наиболее часто метастазы в печени выявляют при аденокарциноме желудка и толстой кишки.
Установление абластичности операционного края резекции
Для морфологического контроля абластичности хирургического края интраоперационное исследование имеет важное значение, так как связано с расширением показаний для экономных резекций, особенно при раке молочной железы при трахелэктомии и микрохирургических операциях на органах головы и шеи, а также при раке желудка, толстой кишки, легкого и др.
В настоящее время имеется четкая тенденция к уменьшению расстояния между опухолью и краем резекции. В последние годы появились исследования, показывающие, что сокращения края резекции не приводит к увеличению частоты местных рецидивов и ухудшению выживаемости. По мнению многих исследователей, применение лучевой терапии расширяет возможности оперативного вмешательства.
При раке молочной железы патоморфолог, как правило, дает заключение о негативном крае при расположении опухоли от 1 до 5 мм от края резекции; о позитивном крае, если опухолевые клетки присутствуют в исследуемом материале, и о сомнительном или закрытом крае, когда опухолевые клетки располагаются на расстоянии менее 1 мм от края резекции. При раке молочной железы для срочного гистологического исследования доставляется удаленная опухоль и исследуется один или два края ближайших к опухолевому узлу. Из 87 исследованных краев резекции опухоль обнаружена в 12 (13,8%). В 3 (4%) наблюдениях положительный край резекции установлен только при плановом гистологическом исследовании, что потребовало повторной операции. Факторами, определяющими гистологическую гиподиагностику при СИМД, являются обширный внутрипротоковый компонент и инвазивная дольковая карцинома.
При раке молочной железы проводят срочное цитологическое исследование нижнего и верхнего краев резекции, подсосковой зоны, иногда исследуют медиальный и латеральный края. У 2,5% больных в крае резекции обнаружены опухолевые клетки. Ложноотрицательные цитологические заключения составили 1,2%.
Для исследования краев резекции при раке молочной железы часто доставляется жир, а паренхима молочной железы отсутствует, поэтому адекватно оценить абластичность не представляется возможным.
Оценка края резекции при раке желудка рекомендуется для пациентов при T3 или T4 стадии заболевания, интраоперационно исследуют, как правило, проксимальный край резекции. Срочное гистологическое исследование позволило выявить опухолевый рост в крае резекции при раке желудка в 8% наблюдений. Положительный край был обусловлен инвазией опухоли подслизистого слоя, неопределяемой при макроскопическом исследовании (рис. 8).
При резекции легкого гистологическое исследование краев резекции применяется редко, за 2 года всего 11 наблюдений. Опухолевые клетки обнаружены только в одном наблюдении при неходжкинской лимфоме. Цитологически край резекции бронха исследовали в 17 наблюдениях, опухолевые клетки не обнаружены.
При раке пищевода опухолевые клетки по краю резекции обнаружены в 11,5%, в одном наблюдении опухоль по краю резекции выявлена только при плановом гистологическом исследовании.
Для оценки адекватности удаления шейки матки при трахелэктомии, выполняли поперечный срез толщиной 1—2 мм с ее резидуальной части для срочного гистологического исследования. С помощью CytoBrush из сохраняемого отрезка цервикального канала получали материал с последующим проведением интраоперационного цитологического анализа. Положительная граница резекции интраоперационно установлена у 5 (6%) из 81 больной. В одном случае, по данным срочного гистологического исследования, выявили рак in situ по краю резекции, в связи с чем произвели дополнительное дисковидное иссечение шейки матки, что позволило обеспечить отрицательную границу резекции и выполнить органосохраняющую операцию. В остальных 4 случаях произведена конверсия трахелэктомии в расширенную экстирпацию матки с транспозицией яичников. Положительная граница резекции в 2 случаях из 5 обнаружена при аденокарциноме, в 2 случаях при аденоплоскоклеточном раке и лишь в одном случае при плоскоклеточном гистотипе [8].
Исследование краев резекции при раке поджелудочной железы проведено в 6 наблюдениях, из них в 3 гистологически выявлена аденокарцинома.
В нашем центре широко применяется цитологическое исследование краев резекции при операциях на органах головы и шеи — опухолевые клетки выявлены в 6,8% наблюдений.
С целью определения абластичности краев резекции при онкоортопедических операциях исследование костного мозга на криостатных срезах практически не применяется, поэтому используется срочное цитологическое исследование. Достоверность исследования составляет 98,8%.
В целом 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства, чтобы сделать его адекватным.
Контроль информативности взятого материала при некоторых диагностических операциях
При опухолях мягких тканей и костей, средостения диагноз возможен только при комплексном клинико-морфологическом исследовании с обязательным применением методов иммуногистохимии, а также во многих случаях молекулярно-генетических методов исследования. Интраоперационная морфологическая, в основном цитологическая диагностика применяется с целью контроля информативности взятого материала для планового гистологического исследования и по информативности не уступает исследованию замороженных срезов. По данным некоторых авторов, диагноз был бы невозможен без цитологического исследования. Это, как правило, лимфома, плазмоцитома, саркома Юинга, метастатическая карцинома, метастатическая меланома, рак из клеток Меркеля, липосаркома. Для малоклеточных, фиброзных, миксоидных и опухолей из жировой ткани роль цитологического исследования отпечатков ограничена.
Заключение
СИМД остается незаменимой в онкологии, так как способна уточнить информацию о характере патологического процесса, степени его распространения, состояния окружающих тканей и краев резекции, что необходимо при выборе адекватного хирургического вмешательства. Однако, при неясном диагнозе и при небольшом количестве полученного материала не следует любой ценой добиваться интраоперационного морфологического исследования, особенно если речь идет о редких опухолях и неинвазивном раке.
Чувствительность гистологического метода при СИМД составляет 98%, специфичность — 99%, чувствительность цитологического метода при СИМД составляет 95%, специфичность — 96%. Гистологическая гипердиагностика при срочном исследовании составляет 0,5%, гиподиагностика 1%, цитологическая гипердиагностика — 3%, гиподиагностика — 9%. Заключения в предположительной форме при срочном гистологическом исследовании составляют 2%, при цитологическом — 11%. В 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства. Неинформативный материал при срочном исследовании достигает 2—5%, в основном при срочном цитологическом исследовании.
Золотым стандартом морфологического исследования является комплексное цитологическое и гистологическое исследования, которые являются взаимодополняющими. Необходимо подчеркнуть значение междисциплинарного подхода к диагностике, в том числе и интраоперационной, включая клинические данные и результаты инструментальных методов исследования с целью достижения точного диагноза.
Участие авторов:
Концепция и дизайн исследования: Н.Н.В.
Сбор и обработка материала: В.Ю.М., А.Г.Е., О.В.Б., Е.Н.С.
Статистическая обработка: О.В.Б., А.Н.П.
Написание текста: В.Н.Н., О.В.Б.
Редактирование: В.Н.Н.
Конфликт интересов отсутствует.
Врач онколог, маммолог, хирург Алексей Галкин. Стаж 18+ лет. Принимает в Университетской клинике. Стоимость приема от 2000 руб.
Золотой стандарт для определения HER2 не установлен. Согласно ASCO/CAPs примерно 20% тестов HER2 могут быть неточными. К ним относятся преаналитические, аналитические и постаналитические переменные.
Причины неточностей анализа статуса HER2/neu
К таким преаналитическим переменным, которые влияют на производительность ИГХ или FISH относятся:
- время, необходимое для фиксации образца ткани;
- продолжительность его нахождения в растворе фиксатора;
- последующая обработка.
Такие переменные считаются менее значимыми при использовании методов гибридизации ISH, основанных на амплификации генов, и более значимыми для ИГХ, поскольку ДНК более стабильна, чем белок.
Время до фиксации, то есть время между биопсией или резекцией и помещением образца в фиксатор, должно быть как можно короче. Длительность фиксации оказывает большое влияние на результаты и является основным источником изменчивости. Для ИГХ предложен минимальный период фиксации 6-8 ч, руководящие принципы ASCO/CAP рекомендуют, чтобы фиксация не превышала 48 ч.
ИГХ обнаруживает сверхэкспрессию HER2 на уровне белка и зависит от условий проведения процедур тестирования. К ним относятся в дополнение к трем вышеперечисленным: денатурация, нагревание, извлечение антигена, используемая процедура окрашивания и интерпретация окрашивания. Несмотря на то, что существуют методы извлечения антигена, они могут привести к ложноположительным результатам иммуногистохимии.
Для определенного анализа нужно выбирать свой способ фиксации тканей.
Некоторые фиксаторы, химические вещества или тепло, могут помешать анализу FISH. Однако всегда применяется внутренний контроль для того, чтобы отличить отрицательный результат от неинформативного.
А например, иммуногистохимия способна ошибочно классифицировать опухоли на основе фиксированных формалином и внедренных в парафин образцов. А если использовать замороженный образец ткани того же пациента, то можно получить более точный результат. Фиксация формалином и парафиновое встраивание приводят к появлению множества артефактов, которые сбивают результаты анализа с толку. Очень трудно понять, получается действительно достоверный результат или ошибочный. Так утверждают многие специалисты. Результаты теста ИГХ наиболее надежны для свежих или замороженных образцов тканей. ИГХ является ненадежным способом тестирования тканей, которые сохраняются в воске или других химических веществах.
Тестирование FISH является предпочтительным способом оценки сохраненных образцов тканей.
- Аналитические факторы – аппаратура и квалификация специалиста также играют роль, и оказывают влияние на достоверность анализа HER2. Чтобы избежать ошибок, необходима регулярная калибровка микроскопов, использование стандартизированных лабораторных процедур, постоянное профессиональное развитие и специализированные программы обучения персонала.
- Постаналитические факторы связаны с интерпретацией результатов анализа, анализом изображений, отчетностью и постоянным обеспечением качества. Интерпретация ИГХ обычно выполняется вручную, включается субъективный фактор и результаты могут варьироваться в зависимости от опыта и бдительности наблюдателя. Например, при анализе ИГХ можно опросить двух патологоанатомов, смотрящих на один и тот же слайд, и один может назвать это 2+ положительное окрашивание, а другой может назвать это 3+ положительное окрашивание.
Оценка с помощью FISH и более новых методов тестирования HER2 CISH, SISH или DDISH, автоматизирована, поэтому является более объективным и количественным, чем с помощью иммуногистохимии. Например, интерпретация теста Fish HER2 – это гораздо более объективный процесс. С помощью анализа FISH патологоанатом подсчитывает фактические копии генов HER2, которые появляются в виде красного “сигнала” в окрашенном в синий цвет ядре раковой клетки, видимом через микроскоп.
Выделяют еще три основных фактора, которые могут привести к неправильному результату:
- Второй анализ на новом срезе фиксированной формалином, залитой парафином ткани, которая поступает из другой части опухоли, может дать другой результат. Хотя такие опухоли встречаются нечасто, но они могут быть HER2-положительными в одних местах и HER2-отрицательными в других.
- Иногда вся хромосома, на которой расположен ген HER2 (наряду с тысячами других генов), амплифицируется в опухолевой ткани. Это называется полисомией хромосомы 17, и ее можно неверно истолковать как амплификацию гена HER2.
- Техническая ошибка в анализе ИГХ (например, если дозатор, который выпускает каплю окрашивающего реагента на предметное стекло, не открывается) может быть обнаружена только путем включения контрольного образца ткани, а он, как известно, набирает 3+ на том же предметном стекле, что и тестируемая ткань. Если такой контрольный образец не используется, отсутствие окрашивания может быть неверно истолковано как отрицательный результат теста. Анализы FISH, в отличие от ИГХ, имеют встроенный контроль для предотвращения ложных отрицательных результатов.
Независимо от того, какой выбран метод определения HER2/neu статуса (иммуногистохимический или с помощью гибридизации FISH, CISH, SISH или DDISH), необходимо, чтобы он был проведен с соблюдением всех требований. Если получен двусмысленный результат, требуется проведение повторного анализа другим методом. Только так можно получить достоверные сведения о статусе HER2. И только таким образом определить возможность проведения таргетной терапии, которая значительно повышает выживаемость пациентов с раком молочной железы.
Продолжение статьи
- Часть 1. Статус HER2 при диагностике опухолей молочных желез. Характеристика. Часть 1.
- Часть 2. Статус HER2 при диагностике опухолей молочных желез. Иммуногистохимическое тестирование. Тесты ISH.
- Часть 3. Ошибки при определении статуса HER2.
Быстрая и надежная диагностика злокачественных новообразований — одна из основных задач современной онкологии. На поздней стадии многие опухоли выявляются достаточно просто, но прогноз в этом случае чаще всего оказывается неблагоприятным. Основные трудности для диагностики представляют именно ранние или редкие формы онкологических заболеваний, при которых симптомы еще отсутствуют, а опухоль при этом активно растет и метастазирует.
Вне зависимости от того, на какой стадии заболевания врачам удалось установить диагноз, известие о наличии онкологического заболевания, как правило, оказывается шоком для самого пациента и его близких.
Чтобы сократить время, необходимое для назначения оптимального лечения (а значит, в конечном счете, улучшить прогноз), следует убедиться в том, что лечащий врач достаточно компетентен и способен в сжатые сроки определить необходимый объем диагностических исследований.
Насторожиться следует в случаях, когда врач не может однозначно и просто описать имеющуюся проблему и предлагает, например, провести хирургическую операцию для диагностики или, напротив, предлагает лечение без обследования, не объясняя, какими средствами и с какой целью будет проводиться терапия.
В этих случаях рекомендуется обратиться к другому онкологу для уточнения диагноза и получения так называемого «второго мнения». В распоряжении врачей, работающих в современных клиниках, сегодня имеется широкий арсенал средств для диагностики и лечения онкологических заболеваний, важно лишь правильно выбрать место лечения и доктора, который обладает достаточной квалификацией для того, чтобы разобраться в проблемах конкретного пациента.
Также следует отметить, что лечение в специализированных медицинских центрах, работающих по самым современным протоколам, может оказаться более эффективным, нежели терапия по месту жительства, поскольку выбор препаратов для химиотерапии (равно как и других методов лечения) в таких клиниках, как правило, существенно шире.
Подозрение на рак — обследование
Для обследования пациента с подозрением на онкологическое заболевание или больного, диагноз которого уже установлен, но вызывает сомнения, могут применяться различные методы лабораторной и инструментальной диагностики.
Лабораторные общеклинические анализы показывают в основном неспецифические изменения. Особенно важны в онкологической практике показатели периферической крови и костного мозга, а именно — эритропоэз и изменения лейкоцитарной формулы. До 70–80% случаев рака сопровождаются гипохромной анемией с изменением формы и размеров эритроцитов. Количество лейкоцитов и степень их зрелости при разных заболеваниях значительно варьируют — от лейкопении до лейкоцитоза.
Рентгенодиагностика занимает одно из ведущих мест в онкологии, ее методы постоянно совершенствуются. Компьютерная, магнитно-резонансная томография и исследования с контрастом позволяют обнаружить опухоль и метастазы даже при небольших размерах.
Благодаря эндоскопическим методам можно провести детальный осмотр новообразования в полостях и полых органах, а также взять кусочек ткани на биопсию.
УЗИ чаще всего применяют в диагностике опухолей щитовидной и молочной желез, малого таза, брюшной полости и забрюшинного пространства, мягких тканей, лимфатических узлов. Это доступный и простой метод, чувствительность которого может достигать 90%. Под контролем УЗИ проводят аспирационную биопсию опухолей.
Гистологическое и цитологическое исследования позволяют установить морфологический диагноз, степень злокачественности процесса и выбрать подходящую тактику ведения пациентов. Без них в онкологии невозможно установить окончательный диагноз. Для обнаружения атипичных клеток на гистологический анализ берут кусочек ткани, полученный при биопсии или в ходе операции. Для цитологического исследования используется клеточный материал. На цитологии под микроскопом с высокой разрешающей способностью исследуют материал, полученный путем аспирации или отслаивания (эксфолиации) клеток. Его специально концентрируют, чтобы увеличить количество клеток в объеме материала. Его фиксируют, окрашивают и изучают под микроскопом на предмет атипичных клеток. Это позволяет провести дифференциальную диагностику между злокачественными и доброкачественными опухолями.
Уточняющие методы обследования
Существует ряд обследований, которые помогают уточнить онкологический диагноз в сомнительных случаях.
Иммунодиагностика позволяет обнаружить антигены опухолевых клеток, которые отличаются от нормальных клеточных антигенов. Кровь и моча пациента содержат опухолевые маркеры, их выявляют при помощи реагентов, содержащих специальные антитела, при реакции ИФА. Наибольшую практическую ценность имеют такие антигены, как α-фетопротеин, PSA, СА-125, раково-эмбриональный антиген, хорионический гонадотропин, трофобластический В-глобулин.
Уточняющие онкологический диагноз обследования чаще всего сложные и дорогостоящие, поэтому не применяются массово в качестве скрининга. Но они обладают высокой точностью и в спорных ситуациях помогают врачу поставить верный диагноз. Уточняющая диагностика необходима не для удовлетворения академического интереса лечебного учреждения или врача, она призвана разрешить серьёзные сомнения в диагнозе, которые не отмели традиционные и не столь дорогие исследования. Возможно, с её помощью удастся разрешить вопрос «рак или не рак» или подобрать лучшее – оптимальное лечение опухоли. В любом случае эти исследования – крайняя необходимость, без которой невозможно решить важнейший для жизни вопрос, и тогда цена процедуры – вопрос совсем не главный.
Важен комплексный подход к диагностике, когда на начальном этапе выполняется стандартное и утверждённое клиническими рекомендациями обследование, а далее, по мере необходимости – крайней диагностической необходимости, поэтапно проводятся дополнительные исследования. Не все сразу, а только после тщательного анализа информативности предыдущего этапа. Перед каждым обследованием врач должен рассказать, на какие важные для пациента вопросы он надеется получить ответ, какие варианты ответов возможны, какие трактовки результатов удовлетворят его и помогут пациенту скорее начать лечение.
Можно назначать всё известное науке, используя всю установленную в медицинском центре аппаратуру, но также можно делать только необходимое, в оптимальном объёме и в разумные сроки. Стоимость процедур очень важна, но не важнее жизни. Наша клиника может предложить оптимальный подход во всём – и в диагностике, и в лечении, тем более что у нас есть всё, что позволит сделать это быстро и очень качественно.
Случай №28:

Случай №27:

Случай №26:

Случай №25:

Случай №24:


При подозрении на лимфопролиферативное заболевание гистологическое исследование должно дополняться иммуногистохимическим. Довольно часто диагноз, предполагаемый по результатам гистологического исследования, корректируется по итогам иммуногистохимии! Этот случай не стал исключением. К нам поступил материал с входящим диагнозом ангиоиммунобластная лимфома. Проведенные иммуногистохимические исследования привели к корректировке диагноза на доброкачественный — у пациента диагностирована болезнь Кастлемана.

Материал следующего пациента пришел к нам на исследование из Казахстана. Входящий диагноз — неходжкинская лимфома (нодальная B-клеточная лимфома маргинальной зоны). Для качественной постановки диагноза при подозрении на лимфопролиферативное заболевание требуется иммуногистохимическое исследование! Данный случай показателен, так как по результатам иммуногистохимии онкологический диагноз не подтвердился. Пациенту был поставлен диагноз — реактивная фолликулярная гиперплазия лимфоидной ткани.

Входящий гистологический диагноз — эпителиоидно-клеточная малопигментная меланома без изъязвления. После проведения пересмотра гистологии диагноз был изменен на эпителиоидноклеточный невус Шпитц. Этот тип доброкачественных образований часто вызывает сложности при дифференцировании его с меланомой ранней стадии, поэтому очень важно в этом случае проводить пересмотр гистологических стекол у патоморфолога, специализирующегося в данной области. Так как это доброкачественное образование, удаленное радикально, то пациенту не потребуется дополнительное лечение.
Случай №20:
Этот случай иллюстрирует необходимость проведения пересмотров гистологических стекол при первоначальной постановке злокачественного диагноза. К нам на исследование поступили материалы девушки 1987 г.р. с диагнозом рак яичника. По результатам пересмотра материалов нашими специалистами было вынесено другое заключение — серозная пограничная опухоль. Пациентке потребуется иное лечение, чем в случае злокачественной опухоли.
Случай №19:
Еще один случай из практики, наглядно показывающий необходимость проведения иммуногистохимических исследований для постановки точного диагноза. Материал поступил к нам со входящим диагнозом — фибромиксоидная саркома (злокачественное новообразование). Для постановки диагноза были проведены иммуногистохимические исследования. По результатам этих исследований был поставлен другой диагноз — плеоморфная фиброма (это доброкачественное образование).
Случай №18:
Этот случай иллюстрирует важность своевременного получения «второго мнения» высококвалифицированных специалистов. 
Случай №17:
Этот случай — еще одно подтверждение необходимости проведения иммуногистохимических 
Случай №16:
Опухоли центральной нервной системы часто представляют диагностическую сложность.
Случай №15:

Случай №14:
Клинический диагноз, с которым поступил материал 52-летней женщины, — B-клеточная лимфосаркома
Случай №13:
Поступил материал с входящим клиническим диагнозом — нейробластома. Проведены
Случай №12:
Входящий гистологический диагноз — анапластическая ганглиоглиома (GIII). По результатам
Случай №11:
Поступили материалы пациента 9 лет из Новокузнецка с подозрением на миксоидную
Случай №10:
Входящий клинический диагноз — рак предстательной железы. Пациент обратился за 

Мужчина 65 лет, Улан Удэ, входящий диагноз рак простаты, после простого пересмотра стекол нашими специалистами поставлен диагноз гиперплазия (не рак). Интересно в этом случае то, что это самый часто встречающийся вид рака у мужчин после 50.
Случай №8:
Входящий диагноз пациентки 25 лет из Иркутска — рак печени. Проведены иммуногистохимические исследования, материал оказался очень сложным в диагностике и был проконсультирован через систему Digital Pathology с профессором из Германии Дитером Хармсом, причем консультация заняла менее суток. Онкологический диагноз был изменен на доброкачественный — у пациентки аденома печени.

Поступил материал с подозрением на периферический рак нижней доли правого легкого. Исследованная ткань внутрилегочного лимфатического узла содержала признаки фолликулярной гиперплазии и антракоза. По итогам консультирования опухолевое поражение не было выявлено.
Случай №6:
Материалы поступили с подозрением на мелкоклеточную лимфому. По результатам проведенных гистологических и иммуногистохимических исследований установлено отсутствие опухолевого материала. Онкологический входящий диагноз был изменен на доброкачественную гиперплазию лимфоузла, вероятно вирусного генеза. Доброкачественная гиперплазия лимфоузлов часто требует для дифференцировки с лимфомами мнения патоморфолога, специализирующегося на данном типе онкологических заболеваний.
Случай №5:
Входящий клинический диагноз — системное заболевание лимфатических узлов шеи, 
Рак яичников (РЯ) наряду со злокачественными опухолями шейки и тела матки является одним из наиболее распространенных заболеваний онкологической природы и в мировой статистике занимает третье место. По данным литературы, карцинома яичников составляет 6-8% из числа всех онкологических заболеваний и 20-25% среди злокачественных опухолей женских половых органов, причем рак яичников составляет около 80% всех опухолей придатков.
По данным международного агентства по изучению рака (МАИР) для большинства стран характерен рост заболеваемости злокачественными опухолями яичников (ЗОЯ). Между тем показатели смертности не имеют тенденции к снижению.
Из числа всей онкогинекологической патологии смертность от РЯ по показателю летальности находится на первом месте , и почти в половине случаев (47%) смертность от рака гениталий обусловлена РЯ. Более того, 2/3 злокачественных опухолей яичников выявляются на поздних стадиях, при переходе патологического процесса за пределы пораженного органа, хотя у 60% больных время от появления первых симптомов до постановки правильного диагноза составляет около 6 мес., у 80% из них уже обнаруживаются метастазы в различные органы. Поздняя диагностика обусловлена отсутствием специфических клинических проявлений на ранних стадиях развития опухолевого процесса, склонностью опухоли яичника к раннему метастазированию, трудностью выявления опухоли при физикальном, рентгенологическом и ультразвуковом исследовании в силу анатомо-топографических особенностей яичников, отсутствием строго детерминированных групп риска, требующих регулярного углубленного обследования. Общая 5-летняя выживаемость этой категории больных в ведущих онкологических центрах не превышает 20-35%.
Анализ тенденций заболеваемости и смертности и их географических особенностей позволяет приблизиться к пониманию некоторых аспектов этиологии и патогенеза данного заболевания (Макаров О.В., 1996).
В настоящее время накоплено значительное количество экспериментальных, эпидемиологических и клинических фактов, позволяющих обозначить многие стороны этиопатогенеза РЯ, несмотря на это причины возникновения большинства опухолей яичников остаются неизвестными. Обзоры многочисленных исследований указывают на высокую частоту рака яичника в индустриальных странах, за исключением Японии. Возможно, это обусловлено диетическими факторами, а именно, высоким потреблением животных жиров, хотя последние исследования не подтверждают связи развития РЯ ни с высококалорийной пищей, ни с употреблением алкоголя, кофеина и никотина. Нет и убедительных доказательств возможного канцерогенного эффекта радиации, применяемой в диагностических и терапевтических целях, в развитии РЯ, хотя в эксперименте моделей опухоли яичника создавали путем облучения грызунов рентгеновскими лучами или при помощи пересадки ткани яичника в селезенку или другие органы портальной системы. В нескольких исследованиях развитие карцином яичников связывают с использованием талька в гигиенических целях.
Наибольшая роль в развитии РЯ в настоящее время отводится гормональным и генетическим факторам.
Генетическая предрасположенность выявлена у 1/3 больных РЯ. Предпо-лагается наследование данного заболевания по рецессивному типу консти-туциональных и эндокринно-метаболических особенностей, характерных для РЯ. Наследственные формы РЯ имеют тенденцию скапливаться в семьях – отсюда их рабочее название «семейный рак». Семейный анализ указывает на ассоциацию РЯ с карциномой эндометрия и молочной железы по материнской линии , а по отцовской линии наибольшую опасность представляет рак толстой кишки . По данным мировой литературы семейные формы РЯ могут составлять 10% .
Л.В. Акуленко с соавт. (1998) предложили критерии идентификации наслед-ственных форм РЯ. Таковыми являются:
- наличие в семье 2-х и более родственниц I степени родства (мать и дочь, сестра и сестра) пораженных РЯ и/или раком эндометрия, и/или раком молочной железы;
- пропорция пораженных и непораженных членов семьи (женщин в возрасте 35 лет и старше) должна составлять 33-50%;
- наличие в семье заболевших раком в возрасте 20-49 лет (средний возраст пораженных – 43,0+-2,3г.;
- наличие в семье одного и более больных с первично множественными опухолями разных анатомических локализаций, включая рак органов репро-дуктивной системы;
- наличие в семье одного и более больных с двухсторонним раком молочной железы.
Выделяют три типа семейного ракового синдрома. При первом типе синдрома в нескольких поколениях прослеживается РЯ. Женщины в этих семьях имеют повышенный риск заболевания и другими злокачественными новообразованиями (равном среднему по популяции) . При втором типе синдрома наблюдается симптомокомплекс: яичник – молочная железа. Женщины болеют РЯ и РМЖ в 1,5 раза чаще, чем в общей популяции . Семейный раковый синдром третьего типа – общий раковый синдром ( синдром Линча –ІІ). Женщины и мужчины имеют резко повышенный риск заболевания раком толстой кишки и в меньшей степени аденокарциномами других локализаций.
Одним из важных современных достижений является доказательство генетических повреждений в этиологии РЯ на уровне онкогенов и генов-супрессоров и внедрение этих знаний в клиническую практику. Среди наиболее изученных генных факторов канцерогенеза является активация онкогена К-ras, выявление мутаций в котором может служить для дифференциальной диагностики муцинозного рака яичников. Амплификация с-erbB2HER2, встречающаяся при РЯ в 10-50% , указывает на неблагоприятный прогноз заболевания. Исследования супрессорного гена р53,отвечающего за апоптоз поврежденных клеток и участвующего в цикле клеточного деления, а также других генов апоптоза, которые инактивируются примерно в половине случаев опухолей яичников пограничной злокачественности, может служить прогностичесикм фактором РЯ. Значительные успехи молекулярной генетики достигнуты в выявлении роли наследственной мутации генов BRCA1, BRCA2, а также MSH2 , MLH1. У носительниц онкогенов BRCA1 , BRCA2 к 60-ти годам частота возникновения РЯ может достигнуть 70%. Таким женщинам строго показана офорэктомия после завершения репродуктивного периода.
Стали классикой исследования по созданию экспериментальных опухолей яичников путем облучения грызунов рентгеновскими лучами и посредством пересадки ткани яичника в селезенку и другие органы портальной сис-темы, которые позволили сформулировать теорию патогенеза с точки зрения нарушения гормонального равновесия в сторону преобладания гонадотропных гормонов. В многочисленных эпидемиологических исследованиях отмечено, что беременность снижает риск РЯ, а большое количество беременностей обладает значительным защитным действием. Бесплодие же повышает риск развития РЯ, а препараты стимулирующие овуляцию в течение более 12 циклов, увеличивают риск в 2-3 раза. В тоже время применение оральных контрацептивов снижает риск развития этого вида рака. В большом исследовании, проводившемся под эгидой ВОЗ, относительный риск развития РЯ у женщин когда-либо принимавших оральные конрацептивы, составил 0,75. Объяснения гормональным факторам можно найти в «овуляторной» гипотезе, постулирующей что риск развития РЯ находится в прямой зависимости от числа овуляторных циклов на протяжении жизни женщины. Покровный эпителий яичника, из которого развивается большинство опухолей яичника, подвергается пролиферации и репарации после каждого овуляторного цикла . Чем больше число овуляций, тем выше потенциальный риск отклонений в репаративных процессах, что ведет к злокачественной трансформации.
Другие патогенетические гипотезы развития РЯ раскрывают иммунологические, биохимические, гистохимические механизмы.
Таким образом, в вопросах этиологии и патогенеза исследователи не всегда приходят к единому мнению, а потому проблема дальнейших эпиде-миологических исследований остается актуальной. Поиск этиологических агентов РЯ, способствующих выделению корректных факторов риска для формирования групп риска и раскрывающих механизмы патогенеза, по-прежнему перспективен.
90% опухолей яичников происходят из целомического эпителия или мезотелия в результате метаплазии мезодермальных клеток. 75% эпителиальных опухолей яичников приходится на долю серозного рака, 20% — муцинозного и 2-3% — эндометриоидного рака. Все остальные формы злокачественных эпителиальных опухолей яичников составляют 3%. Пик заболеваемости раком яичников приходится на возрастной период 55-65 лет. Средний возраст больных эндометриоидным раком яичников примерно на 10 лет ниже, чем у больных муцинозным раком. Серозный рак яичников занимает промежуточную возрастную нишу.
Серозный рак яичников — это опухоль, которая имеет многокамерную кистозную или кистозно-солидную структуру. Клетки опухоли образуют серозную жидкость, аналогичную той, которая секретируется эпителием маточных труб. На ранних стадиях развития поверхность кистозной опухоли гладкая, белесоватого цвета. Серозный рак яичников отличается агрессивным течением. В 50% наблюдений серозный рак поражает оба яичника. Размеры опухоли большие или даже гигантские. Серозный рак яичников может быть высоко-, умеренно- и низкодифференцированным. Опухоль быстро прорастает капсулу, инвазирует в смежные органы и образует множество имплантационных метастазов различных размеров по париетальной и висцеральной брюшине, массивно поражает большой сальник. Асцит образуется у большинства больных.
Муцинозный рак яичников макроскопически — это многокамерная кистозная или кистозно-солидная опухоль, внутренняя капсула которой выстлана слизеобразующим эпителием. В 10-30% наблюдений опухолью поражаются оба яичника. Опухоль может достигать гигантских размеров и развиваться на фоне доброкачественной или пограничной муцинозной кисты. Часто опухоль имеет довольно длинную ножку, которая может перекручиваться. В таких случаях развивается клиника острого живота. Папиллярные разрастания при муцинозных опухолях встречаются реже, чем при серозном раке. У подавляющего большинства больных муцинозным раком опухоль не прорастает капсулу яичников и смежные органы, но имплантационные метастазы по брюшине и большом сальнике образует. Массивный канцероматоз больше характерен для серозного рака. Степень дифференцировки клеток составляющих опухоль может быть различной. При попадании содержимого муцинозной опухоли в брюшную полость может развиться псевдомиксома брюшины. В таком случае брюшная полость может содержать громадное количество слизистого содержимого с формированием множества участков спресовавшегося муцина , сдавливающего органы брюшной полости.
Эндометриоидный рак яичников может иметь как кистозную, так и солидную структуру. Примерно в половине наблюдений опухоль поражает оба яичника. Опухоль содержит папиллярные разрастания, которых больше, чем при муцинозном раке, но меньше, чем в серозных злокачественных опухолях. Эндометриоидные злокачественные опухоли яичников практически не достигают больших размеров. Гистологически эндометриоидный рак яичников сходен с аденокарциномой эндометрия. Степень дифференцировки клеток эндометриоидного рака может быть различной. Очаги доброкачественной плоскоклеточной метаплазии указывают на хороший прогноз, в то время, как смешанные железисто-плоскоклеточные опухоли отмечаются очень агрессивным клиническим течением и неблагоприятным прогнозом. Канцероматоз отмечается редко. Имплантационные метастазы наблюдаются в органы малого таза и большой сальник. Нередко эндометриодный рак развивается на фоне эндометриоза яичников. Эндометриоидный рак яичников может сочетаться с аденокарциномой эндометрия и если гистологическая структура этих опухолей различная, можно говорить о первично множественном эндометриоидном раке.
Ведущие клинические симптомы распространенных форм рака яичников обусловлены размерами первичных опухолей, инвазивным ростом в смежные органы и массивным имплантированием опухолевых клеток в различные анатомические структуры брюшной полости. Вторым по клинической значимости путем распространения рака яичников является лимфогенное метастазирование опухоли. В первую очередь лимфогенными метастазами поражаются поясничные лимфатические узлы, затем подвздошные и обтураторные. Нередко, при III — IV стадиях рака яичников можно наблюдать метастазы опухоли в лимфатические узлы надключичной области, шеи и паховой зоны. Уже при I клинической стадии рака яичников лимфогенные метастазы в поясничные группы лимфатических узлов составляют 18%, при II — 20%, III -42%, IV стадии — 67% наблюдений. Гематогенное метастазирование опухоли как правило реализуется вслед за имплантационным и лимфогенным, когда имеется значительное распространение опухоли. Наиболее часто отдаленные метастазы наблюдаются в печени и легких. Для рака яичников характерны метастатические плевриты.
На ранних стадиях развития рак яичников протекает бессимптомно. Рак яичников I и даже II клинических стадий в большинстве наблюдений является случайной находкой при различных хирургических вмешательствах на органах брюшной полости и обследований, проводимых по поводу гинекологической или экстрагенитальной патологии. Жалобы больных отражают уже значительное распространение процесса: увеличение живота, боли, нарушение менструальной функции или функции смежных органов малого таза, одышку. Иногда больные обнаруживают объемное образование в брюшной полости, отмечают снижение веса, повышение температуры, снижение аппетита, увеличение периферических лимфатических узлов.
Диагностика распространенных форм рака яичников несложна. Бимануальное ректовагинальное исследование позволяет у подавляющего большинства больных выявить объемное образование в малом тазу. Верхний полюс опухоли может пальпироваться в гипо- или мезогастральной области, нижний — в дугласовом пространстве. Часто в малом тазу определяется единый опухолевый конгломерат, включающий в себя внутренние гениталии, часть толстой и петли тонкой кишки. При незначительном количестве асцитической жидкости, можно пальпировать метастатически измененный большой сальник. Цитологическое исследование асцитической жидкости или экссудата из плевральной полости позволяет верифицировать диагноз. Высокоинформативными методами диагностики злокачественных эпителиальных опухолей яичников являются ультразвуковое исследование и определение уровня опухолевого маркера — антигена СА-125 в сыворотке крови. Установить распространенность злокачественного процесса позволяют рентгенологическое исследование органов грудной полости, колоноскопия, гастроскопия, ирригоскопия, цисто- и ректороманоскопия. При необходимости выполняются радиоизотопная ренография, экскреторная урография, компьютерная томография, лапароскопия.
Диагностика рака яичников в начальной фазе его развития затруднительна. При гинекологическом обследовании выявляются односторонние, реже двухсторонние образования, которые у женщин репродуктивного периода жизни следует дифференцировать, прежде всего, с функциональными кистами, псевдоопухолями воспалительного генеза, эндометриозом, миомой.
У женщин пременопаузального и постменопаузального периодов жизни выявление придаткового образования 8 см и более практически всегда требует хирургического вмешательства. Дифферециальный диагноз проводится с доброкачественными опухолями яичников, миомой матки и метастатическими поражениями яичников при раке желудка, толстой кишки и молочной железы. Окончательный диагноз устанавливается при диагностической лапаротомии с обязательным интраоперационным гистологическим исследованием.
Ранняя диагностика РЯ остается главной нерешенной проблемой в онкогинекологии. Клиническое ректо-вагинальное обследование малого таза нередко позволяет идентифицировать новообразование яичников. С 1970-х годов благодаря внедрению ультразвуковых технологий наступила новая эра в диагностике опухолей яичника. Ультразвуковое исследование малого таза стало рутинным методом в обследовании пациентки при подозрение на опухоль яичника. При небольших новообразованиях в малом тазу наибольшей информативностью обладает трансвлагалищная эхография, при образованиях более 6-7 см возрастает роль трансабдоминальной эхографии. Рак яичника на ранних стадиях эхографически представляет собой кистозное образование с единичными сосочковыми образованиями с нечеткими контурами, тогда как при 1С и ІІ стадиях уже визуадизируются обширные папиллярные разрастания с нарушением целостности капсулы кисты и в позадиматочном пространстве определяется небольшое количество жидкости. Для генерализованных стадий РЯ эхографически характерно наличие неправильной формы опухолевого конгломерата кистозно-солидного строения с размытыми границами разрастаниями по наружному контуру. Асцит выявляется в 70-80% набдюдений. При выявлении эхографических признаков злокачественности опухолевого процесса в яичниках и за их пределами необходимо дифференцировать первичность и вторичность поражения яичников.
Эхографические критерии дифференциальной диагностики первичного и метастатического рака яичников
Критерии: первичный рак, метастатический рак
Сторона поражения: чаще двустороннее всегда двустороннее
Структура кистозно-солидная: преимущественно кистозная Солидная,реже-с некрозом в центре
Размеры опухоли: свыше 10 см До 10 см
Контуры опухоли: нечеткие,неровные Четкие, бугристые
Связь с маткой: в конгломерате с маткой связь с маткой отсутствует
Достоинствами ультразвукового метода в диагностике опухолей яичников являются его высокая информативность, простота, быстрота, безвредность, безболезненность, возможность объективного документирования и многократного проведения.
В качестве следующего этапа углубленной диагностики РЯ может быть названа рентгеновская компьютерная томография в случаях, когда эхография не дает четкого представления о степени опухолевого поражения.
Большое значение в диагностике РЯ отводится поиску опухолевых маркеров- специфических биологических веществ, продуцируемых опухолью, которые можнобыло определить биохимическими или иммунологическими методами. Наиболее известны в настоящее время две группы опухолевых маркеров: онкофетальные антигены (альфа-фетопротеин и хорионический гонадотропин) и опухоль-ассоциированные антигены ( СА-125,СА-19-9 и СА-72-4).
Определение онкофетальных антигенов в крови у молодых пациенток с опухолевыми образованиями солидного строения в яичниках указывает на наличие герминогенной опухоли. Определение уровня онкофетальных антигенов в процессе лечения и после его окончания позволяет судить об эффективности терапии. Из опухоль-ассоциированных антигенов наиболее изучен СА-125. Данный опухолевый маркер представляет собой гликопротеиновый антиген, вырабатываемый клетками серозных злокачественных опухолей яичников и определяемый с помощью моноклональных антител. СА-125 не является строго специфичным только для РЯ , его уровень может быть повышен при циррозе печени, остром панкреатите, эндометриозе, миоме матки и беременности. У молодых женщин его концентрация в течение менструального цикла также может колебаться. Однако содержание СА-125 свыше 35 Емл определяется почти у 80 % больных РЯ: у 90 % с распространенным РЯ и у 50 % с ранними стадиями. Это значительно чаще, чем при неопухолевых патологических состояниях ( в 5-10 %) или у здоровых женщин ( до 1 %). Поэтому СА-125 является стандартом в обследовании женщин при обнаружении опухолевых масс в малом тазу, подозрительных по данным клинико-эхографических исследований на рак. При этом возможность получения ложноположительных результатов среди здорового контингента обследуемых не позволяет использовать СА -125 как опухолевый маркер для скрининговых программ с целью раннего выявления рака яичников. Наибольшее значение приобретает определение уровня СА-125 в динамике проведения лечения рака и в дальнейшем мониторинге за больными для выявления рецидивов заболевания.
Продолжаются поиски более чувствительных и специфических опухолевых маркеров РЯ. Макрофагальный колониестимулирующий фактор (М-СSF) , определяемый у 70 % больных РЯ, возможно , будет дополнением к СА-125. В настоящее время, в связи с развитием протеомики, разрабатываются и осваиваются новые методы поиска высокоспецифичных маркеров для различных опухолей , что является перспективным направлением в онкологии.
К сожалению, предлагаемые скрининговые программы для выявле¬ния рака яичников не отвечают большинству требований, сформулиро¬ванных экспертами ВОЗ к рутинным скринингам в онкологии. Во-первых, до настоящего времени не разрешены вопросы патогенеза забо¬левания, а именно, остается неясным вопрос прогрессии доброкачествен¬ной кисты яичника в пограничную, а той, в свою очередь, в инвазивную карциному. Во-вторых, предлагаемые диагностические тесты не являют¬ся строго специфичными для выявления рака яичника, особенно на ран¬них стадиях, т. к. дают высокий процент ложноположительных результа¬тов. В-третьих, окончательно не определена лечебная тактика при раз¬личной степени распространения опухолевого процесса, а результаты ле¬чения рака яичников остаются неудовлетворительными.
Одним из наиболее важных моментов, влияющих на планирование лечения является установка стадии заболевания.
До середины 60-х годов отсутствовала единая система клинической класси¬фикации опухолей яичников. Существовал ряд классификаций основанных на операционных находках. Latour I. P., Davis В. А. (1957), Holme G. М. (1957), Hen¬derson D. N (1957) относили к I стадии РЯ одностороннее поражение яичника, без прорастания капсулы и спаечного процесса, при котором возможно полное удаление опухоли. К II и III стадиям данные авторы относили случаи с разрывом или прорастанием капсулы, различные варианты распространения в пределах ма¬лого таза, а к IV — единодушно относили случаи с метастазами опухоли в пределах брюшной полости. Случаи с отдаленными метастазами некоторыми авторами вы¬делялись в отдельную группу — IV L, VI и др. Классификации предложенные Bean Z. L. (1957), Muller (1959), Hoffmann V. D. (1962) основывались на подвижности опухоли и возможности проведения операции. Они не отражали степень распро¬странения опухоли (Нечаева И. Д., 1972), но положили начало принципам после¬операционного стадирования и оценке результатов циторедуктивных операций.
В СССР до 1985 г., наряду с постоянно совершенствующимися классифи-кациями FIGO (1964, 1970, 1976, 1985) и TNM (1954, 1967, 1970, 1981, 1987, 1992) использовалась классификация Минздрава СССР 1956 г., по которой к I стадии относилось поражение только одного яичника, ко II стадии — переход на другие гениталии, к III стадии — диссеминация париетальной брюшины малого таза, во¬влечение в опухолевый процесс региональных лимфатических узлов и большого сальника. К IV стадии на ряду с прорастанием соседних органов, отдаленных ме¬тастазов, относились все асцитические формы и случаи с поражением брюшины за пределами малого таза . Только широкое развитие химиоте¬рапии, способной в значительной степени повлиять на состояние внутрибрюшинных метастазов позволило отказаться от прежнего стадирования РЯ и перейти к
современным классификациям FIGO и TNM . Тем не менее, до сих пор все клинические классификации РЯ остаются достаточно условными. Можно выделить истинно локализованную стадию, при которой очаг ограничен одним яичником, без повреждения капсулы, а пятилетняя выживаемость больных этой группы достигает 90%, с которой согласны все со¬временные авторы, и вторую, когда процесс вышел за пределы яичника, тем са¬мым приобрел системный характер. Даже при диагностированных «ранних» ста¬диях РЯ по современным классификациям, скрытые метастазы по брюшине или в лимфатических узлах снижают пятилетние показатели до 70-40% . Пятилетние результаты при Шс и IV ста¬диях по данным литературы не превышают 10% несмотря на прогресс в лечении.
Научное развитие знаний об опухолях яичников начинается с середины XIX века . В это время малоутешительными были непосредственные результаты лече¬ния РЯ из-за высокой послеоперационной летальности, и совсем неудовлетвори¬тельные отдаленные результаты 6-15%. С появлением луче¬вой терапии в начале XX века проводились попытки дополнить хирургическое вмешательство облучением, но процент излечений среди всех больных РЯ был на уровне 20-27%. Новый виток в развитии лечебной помощи больным РЯ в СССР относится к середине 50-х годов, когда был открыт один из первых отечест¬венных химиопрепаратов — сарколизин. Появились сообщения о небольшом числе объективных ремиссий при применении данного препарата.
До середины 70-х годов проводились бесчисленные исследования по оптими¬зации хирургического лечения РЯ от двусторонней аднексэктомии до сверх ради¬кальных операций на органах малого таза и брюшной полости (Бохман Я. В., 1993 и др.).
Новый этап развития лечебной помощи при раке яичников начался с 80-х
годов с внедрением в клиническую практику полихимиотерапии на базе препара¬-
тов платины. Данный этап отразился на результатах популяционных статистиче¬
ских исследованиях США. Так за период с 1974 г. по 1986-91 гг относительная пятилетняя выживаемость претерпела статистически значимый рост для белого населения с 36% до 44% . Следующим этапом в развитии химиотерапии
РЯ с первой половины 90-х годов являются клинические испытания и практиче-ское внедрение таксанов и широкого спектра препаратов второй линии лечения. Первые публикации о таксоле, касаются его использова¬ния в платино-резистентных случаях РЯ , а в настоящее время таксол и его аналоги прочно утвердили себя в качестве препаратов I линии в США и других развитых странах.
Современные стандарты лечения рака яичников были сформированы Интернацио¬нальной группой по изучению рака яичников на 7-ой международной конферен¬ции по онкогинекологии, проходившей в Риме в 1999.
При раке яичников различают пять типов хирургических вмешательств:
- Первичная циторедуктивная операция заключается в удалении возможно большого объема первичной опухоли и ее метастазов. Оптимальный объем этой операции-отсутствие визуальных признаков опухоли или минимальная остаточная опухоль.
- Промежуточная циторедуктивная операция. Выполняется при распространенном раке яичников после 2 курсов химиотерапии, с целью уменьшения размеров первичной опухоли и ее метастазов. Цель хирургического вмешательства заключается в максимально возможном удалении опухолевых масс для создания наиболее благоприятных условий последующей химиотерапии.
- Вторичная циторедуктивная операция. Операция выполняется больным раком яичников, которым проведено комбинированное лечение, но имеется остаточная опухоль или локализованная рецидивная опухоль размерами более 5 см.
- Операция “second-look”. Диагностическая лапаротомия, которая выполняется клинически излеченным больным раком яичников с нормальными показателями СА-125 и отсутствии ультразвуковых и рентгенологических признаков заболевания. Смысловая значимость этой операции состоит в морфологическом подтверждении излеченности больной и определении дальнейшей тактики ведения.
- Паллиативная повторная операция. Производится по экстренным или срочным показаниям у больных с прогрессированием заболевания в связи с внутрибрюшным кровотечением, кишечной непроходимостью, перитонитом. Цель операции — устранить причину острого живота (удаление распадающейся опухоли, остановка кровотечения, резекция блокированной или перфорированной опухолью части кишки)
При ранних стадиях РЯ, к которым относят la, Ib и Па, в качестве хирургиче¬ского этапа лечения необходимо выполнять пангистерэкгомию с экстирпацией боль¬шого сальника на уровне поперечно-ободочной кишки. Для обоснования ранней ста¬дии, обязательно производится цитологическое исследование перитонеальной жидко¬сти, при её наличии, смывов с брюшины малого таза, боковых карманов брюшной полости, печени и диафрагмы. При низкодифференцированных опухолях необходима биопсия тазовых и парааортальных лимфоузлов. У молодых женщин с высокодиффе-ренцированным раком яичников или опухолями пограничной злокачественности, при желании пациентки сохранить детородную функцию, возможен органосохраняющий объем операции: односторонняя аднексэктомия с обязательной резекцией второго яичника, оментэктомией и цитологическим контролем. В подобных наблюдениях, которые чрезвычайно редки, после родов выполняют экстирпацию матки с оставшимися придатками. Следует помнить, что органосохраняющие операции при раке яичников — это исключение, а не правило.
Лапароскопия при подозрении на РЯ выполняется только в диагностиче-ских целях. Рядом авторов этот метод рекомендован для биопсии тазовых и парааортальных лимфатических узлов, как стандартный. Необходимо избегать неадек¬ватных лапароскопических вмешательств для хирургического лечения рака яич¬ников.
При подтверждении ранней стадии РЯ, адьювантная химиотерапия может не выполняться в случаях пограничной злокачественности и при высокодифференциро-ванном раке. В остальных случаях рекомендована комбинированная химиотерапия в количестве 4-6 циклов препаратами платины с алкилирующими агентами. Примене¬ние таксанов и антрациклинов при индукционной химиотерапии при ранних стадиях РЯ остается дискуссионным. Эффективность таких методов, как лучевая терапия и гормональное лечение при ранних стадиях РЯ не доказана.
При местно-распространенном и диссеминированном процессе, к которому ряд авторов причисляет и 1с стадию, в связи с наличием опухолевых клеток по брюшине, хирургическое вмешательство всегда должно быть этапом комплексно¬го лечения и носить циторедуктивный характер. Оптимальной циторедуктивной операцией считается субтотальная гистераднексэктомия или пангистерэктомия с экстирпацией большого сальника, с уменьшением остаточных опухолевых масс, по мнению разных авторов, от 0,5 до 2 см3. Только оптимальная циторедукция может быть основанием для постановки ШЬ стадии, при которой отдаленные ре¬зультаты заметно лучше, по сравнению с Шс стадией, в которой к сожалению, на¬ходится более половины больных, получивших комплексное лечение. В повседневной клинической практике встречают ситуации, когда полное удаление опухоли невозможно. Массивный канцероматоз, тотально замещенный опухолью “панцирный” большой сальник, прорастание опухоли в диафрагму, ворота печени и ее паренхиму, малый сальник, брыжейку тонкой кишки, забрюшинные пространства часто вынуждают хирурга минимизировать объем хирургического вмешательства. Вместе с тем, всегда следует стремиться к удалению первичной опухоли, большей части сальника и крупных опухолевых узлов на париетальной брюшине.
При Шс стадии объем вмешательства может быть уменьшен только из-за невозможности удаления масс опухоли без повреждения жизненноважных органов. Удаление лимфатических узлов забрюшинного пространства при РЯ, по мнению многих хирургов, носит диагностический характер. Дополнение операции аппендэктомией, спленэктомией, удалением пораженных отделов кишки, может проводиться только с целью достижения условной радикальности операции. Паллиативные вмешательства при нарастании кишечной непроходимости производятся с целью улучшения качества жизни больных. При массивных отдаленных метастазах в пе¬чень и легкие циторедуктивное вмешательство не показано. В свою очередь, около 10% больных раком яичников при первичном обращении оперировать не представляется возможным. Основными причинами подобных клинических ситуаций являются прорастание первичной опухоли в смежные органы и мягкие ткани малого таза, тотальный канцероматоз и множественные метастазы в органы брюшной полости, асцит, плевриты, отягощенное соматическое состояние, пожилой и старческий возраст, резко ослабленное состояние больных. Лечение этой категории больных начинается с системной полихимиотерапии. В результате короткого курса индукционной химиотерапии (2-4 цикла) примерно 30% больных представляется возможным выполнить промежуточную циторедуктивную операцию. Операция предпринимается с целью уменьшения массы первичной опухоли и ее метастазов и, таким образом, повысить эффективность последующей химиотерапии, а также улучшить качество жизни больных. Доказано, что промежуточная циторедуктивная операция повышает выживаемость больных раком яичников.
Системная химиотерапия при местно-распространенной и метастатической формах РЯ является обязательным компонентом лечения, в количестве не менее 6 курсов. При неэффективности химиотерапии первой линии возможен переход на другие группы препаратов. Выбор вариантов химиотерапии не является задачей популяционных исследований при РЯ.
Ожидалось, что широкое внедрение новейших химиотерапевтических пре- паратов, таких как таксол, гемзар и др. должно увеличить медиану выживаемости больных РЯ на 12 мес. Однако до сих пор остается открытым вопрос об эффек- тивности таксанов в качестве химиотерапии первой линии, так как международ- ные клинические исследования Гинекологической онкологической группы — GOG-111, GOG-132, ICON-3 — дают противоречивые результаты о их преимуществе по сравнению с платиносодержащей комбинированной химиотерапией.
Вопрос о показаниях к лучевой терапии при распространенных формах РЯ
остается открытым .
Несмотря на разработанные стандарты, до сих пор поднимаются вопросы по оптимизации лечения РЯ, такие как: 1. Роль органосохраняющих операций и адъювантной химиотерапии при доказанных ранних стадиях РЯ. 2. Место лим-фаденэктомии в лечении РЯ. 3. Роль неоадьювантной химиотерапии и рацио-нальное число циклов химиотерапии перед попыткой циторедуктивной операции. 4. Значение чрезмерного радикализма при проведении хирургического этапа лече¬ния. 5. Роль повторных хирургических вмешательств после окончания первой ли¬нии химиотерапии.
Прогноз больных раком яичников зависит, прежде всего, стадии заболевания (распространенности процесса), гистологического строения опухоли и плоидности опухолевых клеток. Далее следуют: степень дифференцировки клеток опухоли, экспрессия онкогена HER-2/neu, скорость размножения опухоли, размеры остаточной опухоли после хирургического вмешательства, выраженность асцита и возраст больной. Наиболее неблагоприятным прогнозом отмечаются больные с массивными диссеминированными формами злокачественных эпителиальных опухолей яичников. Полисерозиты и отдаленные метастазы у больных пожилого и старческого возраста, у которых верифицирован светлоклеточный или низкодифференцированный серозный рак с анэуплоидией клеток опухоли сводят шансы на излечение больной практически к нулю. В то время, как высокодифференцированные злокачественные опухоли яичников любого гистологического строения IА и IВ стадий излечиваются в 95-100% наблюдений. Приведенные факторы прогноза у больных запущенными формами рака яичников в связи с массивным распространением и большим суммарным объемом опухоли существенного прогностического значения не имеют, а любые методы лечения носят лишь паллиативный характер.
27 марта 2013 г.
ДИАГНОЗ
История пациента
Впервые с онкологией я столкнулась в 2000 году. У меня несколько месяцев отсутствовала менструация. Я обратилась к гинекологу в районную больницу. Гинеколог направил в Брянскую областную больницу № 1. Я сдала анализы, мне назначили лекарственное лечение, но оно было неэффективно. На УЗИ обнаружили проблемы с яичником. Назначили лапароскопию.
В мае 2000 года мне сделали лапароскопическую операцию. Я делала ее платно, в гинекологическом отделении Брянской областной больницы № 1. Связано это было с тем, что в те времена этот вид вмешательства был не очень распространенным. Госпитализировалась на неделю. Опухоль обнаружили совершенно случайно, во время операции. Гистология показала, что это гранулезоклеточная опухоль. Врачи сомневались, какой вид операции проводить — органосохраняющую или нет. Мне рекомендовали, обратиться за консультацией в Москву.

После постановки диагноза со мной творилось что-то страшное. Наверное, дело в молодости. Мне казалось, что я умираю, очень сильно переживала. Я не хотела, чтобы кто-то знал о раке. Не понимаю, почему.
Мы тогда все прошли вдвоем с мужем. Родные узнали об этом
много лет спустя.
ДИАГНОЗ: Ответы и рекомендации врача
Что такое рак яичников и в чем его отличие от других опухолей?
Есть ли сегодня у пациенток с 3-4 стадией шансы на излечение?
Изменился ли характер заболевания за последние 20 лет?
Какова выживаемость при разных стадиях рака яичников?
БЕРИШВИЛИ Александр Ильич
доктор медицинских наук, онкогинеколог, хирург, доктор отделения онкологии ФНКЦ ФМБА России
О заболевании, симптомы, прогнозы
Что такое рак яичников и в чем его отличие от других опухолей?
Рак яичников — это один из наиболее агрессивных вариантов рака женских репродуктивных органов, отличающийся высокой инвазивностью и высокой способностью к метастазированию. Занимает пятое место в структуре смертности от рака у женщин.
У этой формы рака есть такая характерная черта, как «скрытый от лечения». Зачастую на ранних стадиях рак яичников протекает бессимптомно, а проявляется уже на распространённых стадиях — на 3−4 стадиях.
Есть ли сегодня у пациенток с 3−4 стадией шансы на излечение?
Что касается шансов на излечение, то они есть всегда. Даже несмотря на третью или четвёртую стадию рака яичников, всегда есть хорошие результаты, которые зависят в первую очередь, от ответа опухоли на химиотерапию.
Сейчас появились новые препараты — таргетные препараты, которые на генетическом уровне воздействуют на опухоль, её мутационные способности, и открываются хорошие перспективы.
Изменился ли характер заболевания за последние 20 лет?
Сегодня онкологических пациентов в целом стало больше. Это связано и с неблагоприятными факторами среды и с ионизирующей радиацией: все мы помним Чернобыльскую трагедию.
Конечно, эти факторы способствуют росту раковых заболеваний, в том числе и рака яичников. Поэтому сегодня важны меры профилактики, ранней диагностики, которые позволили бы своевременно выявлять рак яичников. Это самый главный критерий эффективности последующего лечения.
Кто входит в группу риска по раку яичников?
10% случаев рака яичников имеет наследственный характер. Эта группа больных, имеющих мутации генов BRC1, BRC2, CHEK1, CHEK2. Они попадают в группу усиленного контроля и требуют более уточнённой, своевременной диагностики и внимательного динамического наблюдения.
Если мы говорим про возраст развития рака яичников, то, к сожалению, у него нет каких-то жёстких рамок. Мы встречаемся со случаями рака яичников и у молодых девушек, и у пожилых женщин. Поэтому настороженность такая должна быть всегда.
Какая выживаемость при разных стадиях рака яичников?
Если говорить о результатах лечения рака яичников, то на первой стадии 5-летняя выживаемость составляет 90%, а в последующем при 3−4 стадии, она резко снижается — до 15% при 3 стадии
и 5% — при 4 стадии. Это ещё раз говорит о важности своевременной диагностики, раннего начала лечения и максимально раннего обращения к специалистам.
Морфологическая классификация

ЛЁВКИНА Наталья Васильевна
к.м.н, врач-онкогинеколог НМИЦ онкологии им. Н.Н. Блохина
Большинство опухолей яичников являются эпителиальными, составляя около 60% всех новообразований яичника и 80−90% их злокачественных форм. По морфологическому строению и клиническому течению они делятся на:
- доброкачественные
- пограничные (низкой степени злокачественности)
- злокачественные
Злокачественные эпителиальные опухоли яичников:
- серозная карцинома
- эндометриоидная карцинома
- муцинозная карцинома
- светлоклеточная карцинома
- злокачественная опухоль Бреннера
- переходноклеточная карцинома
- плоскоклеточная карцинома
- смешанная эпителиальная карцинома
- недифференцированная карцинома
Симптомы и сложности выявления рака яичников
БЕРИШВИЛИ Александр Ильич
доктор медицинских наук, онкогинеколог, хирург, доктор отделения онкологии ФНКЦ ФМБА России
Какие могут быть симптомы рака яичников на разных стадиях?
Что касается жалоб, то подавляющее большинство случаев на ранних стадиях протекает бессимптомно, и этим обуславливается высокая агрессивность этого заболевания. Но если говорить про жалобы, чаще всего встречается дискомфорт в малом тазу, боли,
нарушения менструального цикла, а в последующем, уже при распространении опухолевого процесса, конечно, снижение аппетита, снижение веса, увеличение живота в объёме за счёт жидкости, нарушение дефекации, мочеиспускания, и, конечно, болевой синдром.
К какому врачу обращаться, если есть подозрение на опухоль?
Если мы говорим про диагностику рака яичников, то, конечно, на первом этапе это обращение к районному гинекологу, который выполняет ряд простейших диагностических мероприятий: гинекологический осмотр, УЗИ органов малого таза, маркёры — СА125, РА, АФП, рентген лёгких. Если необходима уточняющая диагностика, то это компьютерная томография, магнитно-резонансная томография.
По результатам обследования следующий этап — это уже обращение или направление от гинеколога к онкогинекологу, если есть уже показания, подозрение на онкологию. Эти этапы, к сожалению, часто бюрократизированные и пугают наших больных. Наша задача — максимально минимизировать барьеры на этапе обращения онкологических больных в клинику.
Насколько сложно сегодня поставить диагноз и выявить тип опухоли?
Если мы будем говорить о лечении рака яичников и о возможных ошибках, которые могут при этом возникать и как этого избежать, я думаю, что в первую очередь необходимо знать и обращаться в онкологическое учреждение, имеющее опыт работы с данным заболеванием. Рак яичников — серьёзная проблема как в диагностике, так и в последующем правильном определении стадии, лечении.
Существует ряд факторов, которые знают специалисты, постоянно занимающиеся этим заболеванием. Если врач раз в год сталкивается с этой болезнью, то понятно, что ни о каком квалифицированном лечении речи идти не может. Существуют европейские и уже и наши стандарты для клиник, которые сертифицируются по лечению рака яичников. Например, минимальное количество пациентов за год должно составлять 50 человек. Если клиника имеет такой опыт, соответственно, она вызывает большее доверие у наших пациентов. Если это какие-то штучные, единичные операции, то следует обратиться в более квалифицированное учреждение, которое обладает и более мощной лабораторией, и более высококвалифицированными специалистами, в том числе
и морфологами, потому что зачастую для правильной диагностики формы рака яичников, которых существует несколько, необходимо применять иммуногистохимическое исследование, определённые панели, которые помогают точно поставить гистотип опухоли и правильно назначить последующее лечение.
Диагностика рака яичников сложна. Даже специалисту не всегда удаётся однозначно поставить диагноз из-за отсутствия на 100% специфичных симптомов. Есть критерии, которые помогают онкогинекологу разобраться в ситуации: УЗИ, маркёры, КТ, и МРТ. Сейчас добавились новые методы обследования. Это позитронно-эмиссионная томография, которая помогает уточнить диагноз, расставить все точки над i, но всё равно окончательный диагноз ставится уже во время операции. Поэтому важна настороженность гинекологов на местах, которые при первых симптомах заболевания должны проводить онкологический скрининг, онкологический контроль для того, чтобы не пропустить это грозное заболевание.
Прогрессирование опухоли при раке яичников

ЛЁВКИНА Наталья Васильевна
к.м.н, врач-онкогинеколог НМИЦ онкологии им. Н.Н. Блохина
При раке яичников прогрессирование происходит за счёт диссеминации (распространения опухолей) по брюшине.
Даже при наличии диссеминации злокачественных эпителиальных опухолей в брюшной полости клиника заболевания имеет стёртый характер, выражающийся в:
- «дискомфорте» со стороны желудочно- кишечного тракта
- увеличения живота в объеме за счёт асцита
- тупых ноющих болях внизу живота из-за механического давления опухоли на окружающие органы.
Из-за механического действия опухоли на окружающие органы появляются тупые ноющие боли внизу живота.
При запущенных формах рака яичников:
- верхняя половина малого таза частично или полностью заполняется конгломератом узлов опухоли
- пальпируется увеличенный в размерах большой сальник
- обнаруживаются метастазы в пупок
При распространении процесса на матку или маточные трубы появляются кровянистые выделения из половых путей.
СИМПТОМЫ РАКА ЯИЧНИКОВ
На ранних стадиях

специфические симптомы отсутствуют
При распространенном процессе

дискомфортные ощущения со стороны ЖКТ

увеличение живота в объемах

ноющие боли внизу живота
При запущенных формах

увеличение в размерах большого сальника

кровянистые выделения из половых путей

заполнение малого таза узлами опухолями

прорастание метастазов в пупок

Возможности онкострахования
Страхование помогает снизить тревожность пациентов и их родных, если человек сталкивается с диагнозом «онкология» и есть страх остаться без обследований и лечения.
Как с помощью онкострахования получить качественную медицинскую помощь в России, Европе и Азии, подобрать квалифицированных врачей и компенсировать расходы на лечение?

УШАКОВА Анна
онкопсихолог службы «Ясное утро»
ПОМОЩЬ ОНКОПСИХОЛОГА
Почему люди боятся постановки диагноза, и что может помочь принять решение об обследовании?

Служба «Ясное утро» — это круглосуточная информационная, психологическая и юридическая поддержка онкобольных людей. Вы можете позвонить и задать свой вопрос или поделиться с психологом своими переживаниями. Чтобы получив информационную и психологическую поддержку специалистов, идти дальше и победить болезнь. Круглосуточно и бесплатно по всей России