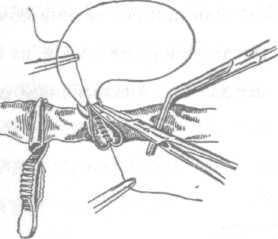
Техника сосудистого шва.
Успехи хирургии сосудов в значительной
степени связаны с разработкой и
совершенствованием техники сосудистого
шва. Сосудистый шов является одним из
важнейших этапов реконструктивных
операций на сосудах, часто его наложение
составляет главный этап, сущность
восстановительной операции. Применение
сосудистого шва как основного способа
восстановления магистрального кровотока
ограничено областью лечения травматических
или операционных повреждений сосудов,
аневризм, а также ограниченных по
протяженности сегментарных окклюзии,
тромбозов и эмболии сосудов.
Шовный материал и хирургические иглы.
Применяют нерассасывающиеся синтетические
монофиламентные нити (пролен, мерсилен,
эти-лон. этибонд и др.; № 3/0 — 10/0) и
атравматические режуще-колющие изогнутые
иглы («проникающий» кончик-острие и
тонкое круглое тело). Нити из этих
материалов, особенно пролена (международный
стандарт, с которым в сосудистой хирургии
сравнивают все остальные лигатуры),
обеспечивают прочность шва, надежность
узлов, инертность; они не задерживаются
наружными слоями сосудистой стенки,
что позволяет легко затягивать непрерывный
шов после завершения прошивания раны.
Тонкий раневой канал в тканях, оставляемый
конструкцией «игла — нить», сводит к
минимуму возможность кровотечения
через прокол, обуславливая тем самым
быстрое достижение гемостаза.
В хирургии коронарных артерий
(аортокоронарное шунтирование) широкое
применение получили проленовые нити
6/0 — 8/0, снабженные специальными иглами
(СС — Calcified Coronary). Отличительной особенностью
этих игл является очень тонкий кончик
иглы, в связи с чем для прокалывания
ткани требуется значительно меньше
усилий чем при использовании обычной
иглы круглого сечения с конусообразным
концом. Диаметр колющей части иглы СС
на 40% меньше чем диаметр остальной ее
части круглого сечения (170 — 345 микрон).
После прокола ткани (нередко
кальцинированной) заостренным концом,
оставшаяся снаружи конусовидная часть
иглы круглого сечения мягко раздвигает
ткани, которые затем смыкаются вокруг
шовной нити. Такие иглы значительно
облегчают прошивание атеросклеротически
измененных сосудов и сводят, практически,
к минимуму возможную негерметичность
анастамозов из-за повреждения хрупких
стенок сосуда.
Инструменты. Помимо стандартных
хирургических инструментов используют
специальные — сосудистые зажимы (бокового
отжатая, прямые и изогнутые бульдожки
и др.), ножницы — дессектор, анатомические
пинцеты.
Основные этапы и правила наложения
сосудистого шва. Важное условие наложения
шва — достаточная мобилизация сосуда и
тщательное обескровливание операционного
поля временным пережатием проксимального
и дистального отделов сосуда.
Если операция проводится по поводу
ранения, то кровотечение из поврежденного
сосуда останавливается путем пальцевого
(можно с помощью тупфера) прижатия его
в ране. Сосуд выделяется из окружающих
тканей выше и ниже места повреждения.
Просвет его пережимается турникетами
(резиновые перчаточные полоски) или
лучше зажимами. Рану осматривают и
приступают к основному этапу — наложению
сосудистого шва.
Следует помнить, что при рассечении
стенки сосуда (хирургическое,
травматическое) из-за большей сократимости
мышечно-интимального слоя, образуется
избыток наружной оболочки, что может
привести при наложении швов к вворачиванию
ее в просвет сосуда (риск стеноза), или
поверхностному прошиванию стенки:
мышечный слой и интима не захватываются
в шов. Чтобы избежать этого, адвентицию,
выступающую над краем рассеченной
стенки сосуда, захватывают анатомическим
пинцетом, натягивают и иссекают
ножницами (рис.1).
Шов накладывают через все слои стенки
сосудов, сшиваемые концы которых должны
соприкасаться своей внутренней
оболочкой. Иглу вкалывают примерно на
1 мм от края сосуда, с интервалом между
стежками 1—2 мм.
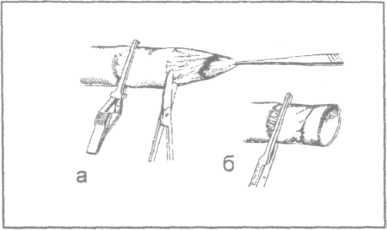
1. Иссечение избытка адвентиции. Стенка
сосуда до (а) и после (б) исссечения
наружной оболочки.
При сшивании патологически измененных
стенок артерий большого диаметра
(склонность к прорезыванию нитей) в шов
захватывают больше ткани и увеличивают
расстояние между отдельными стежками.
Сосудистый шов должен быть герметичным
как по линии соприкосновения стенок
сосуда, так и в местах прохождения нитей.
Это обеспечивается достаточным
затягиванием швов. При наложении шва
ассистент постоянно поддерживает нить
в натяжении. Контроль герметичности
осуществляют после наложения шва путем
снятия дистального зажима. При отсутствии
значительного кровотечения снимают
центральный зажим и прикладывают к
сосуд) на несколько минут тампон, с целью
остановки кровотечения по линии шва.
Профилактика тромбообразования в сосуде
при временном его пережатии обеспечивается
введением гепарина локально в приводящий
и отводящий сегменты сосуда или в общий
кровоток (в/в) за 5 — 10 мин до пережатая
сосуда. Можно вводить гепарин в вену
(5000 ЕД ) и одновременно местно (2500 ЕД
гепарина растворяют в 200 мл физиологического
раствора). При продолжительном пережатии
сосуда целесообразно перед наложением
последних швов слегка приоткрыть
дистальный и проксимальный зажимы с
целью удаления возможно образовавшихся
тромбов. После наложения шва и освобождения
артерии от зажимов или турникетов
следует убедиться в наличии пульсации
периферического отдела сосуда.
Швы накладывают, как правило, вручную,
реже с помощью специальных сосудосшивающих
аппаратов (механический шов).
ВИДЫ СОСУДИСТЫХ ШВОВ
Из многочисленных видов швов (циркулярный,
боковой, непрерывный, узловой, П —
образный, выворачивающий, механический),
разработанных в основном в течение
первой половины XX в. в
настоящее время наиболее часто применяют
первые два. Выбор шва определяется
условиями операции (восстановление
целостности сосуда при его полном
пересечении, боковом дефекте, резаной
или рваной ране; реконструктивная
хирургия — наложение шунта, соустья и
др.) и опытом хирурга.
Циркулярный (круговой) шов. Он может
быть непрерывным, узловым, матрацным
(рис. 2.).
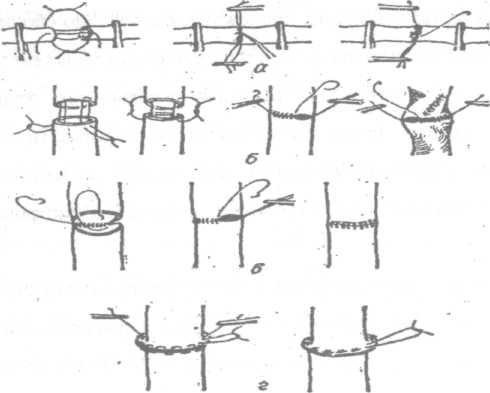
2. Схемы циркулярного сосудистого шва:
а — шов Карреля; б — методика А.И.Морозовой;
в — шов изнутри просвета задней стенки
сосуда крупного калибра; г — выворачивающий
матрацный, непрерывный и узловой швы.
Методика наложения непрерывного
(обвивного) шва разработана английским
хирургом Каррелем (1902).
Методика Карреля (рис. 2,3). Наложение шва
начинают со сближения концов сшиваемого
сосуда с помощью трех швов — держалок,
накладываемых на равном расстоянии
друг от друга (120°). Для этого оба конца
сосуда прошивают тремя атравматическими
нитями через все слои (один — со стороны
адвентициальной оболочки, другой —
интимы), отступя 1,0-1,5 мм от края. Концы
сосуда сближают и нити завязывают. При
растягивании за концы нитей просвет
сосуда приобретает треугольную форму,
что гарантирует от захватывания иглой
противоположной стенки при наложении
обвивного непрерывного шва между
держалками. После ушивания одной из
граней, основную лигатуру связывают с
нитью держалкой. Аналогичным
образом ушивают остальные грани.
Рис. 3. Циркулярный обвивной шов Карреля.
а — наложение швов-держалок, б — сближение
краев сосудов; в-ушивание отдельных
граней сосуда; г- за-конченный шов сосуда.
В настоящее время шов Карреля используется
лишь в микрохирургии (шов сосудов малого
диаметра). В хирургии средних и крупных
сосудов применяется его модификация —
способ А.И. Морозовой (1909).
Методика А.И.Морозовой (рис.4):
вместо трех ситуационных швов —
держалок применяют две. Роль третьей
держалки отводится основной нити (одна
из лигатур шва-держалки). При этом
накладывают простой обвивной шов сначала
на одну (переднюю) стенку сосуда, после
чего зажимы вместе с сосудом поворачивают
на 180° и сшивают другую полуокружность
сосуда. Удобнее шить нитью, снабженной
двумя атравматическими иглами. При шве
крупных сосудов, например аорты, в
глубине раны ушивают сначала заднюю
полуокружность сосуда со стороны
просвета сосуда (рис. 2, в), а затем
переднюю.
Рис.4. Схема наложения циркулярного
шва по методу А.И.Морозовой (шов задней
стенки сосуда).
При значительном несоответствии диаметра
анастомозируемых сосудов применяют
также типичный или упрощенный шов
Карреля с продольным рассечением
стенки сосуда меньшего диаметра для
лучшей адаптации краев.
С целью предупреждения сужения просвета
сосуда малого диаметра по линии шва
целесообразно применять так называемый
скошенный конце-концевой анастомоз,
косо срезая концы сшиваемых сосудов. В
отдельных случаях может быть применен
метод «заплаты» из аутовены.
Боковой шов. По методике существенно
не отличается от циркулярного. Он
также может быть непрерывным, отдельным
узловым, обвивным, П-образным,
комбинированным. Боковой шов применяется
при повреждении крупных магистральных
сосудов (нижняя полая вена, аорта и др.).
Т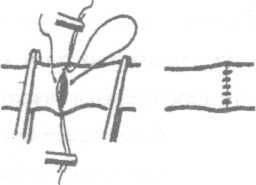
различна при ушивании поперечного и
продольного дефекта сосуда. В случае
поперечной раны, занимающей значительную
часть окружности сосуда, накладывают
обычно непрерывный обвивной шов через
все слои сосудистой стенки (рис.5). Удобнее
шить на себя — по направлению к
близлежащему к хирургу углу раны.
Наложение швов в поперечном направлении
уменьшает вероятность сужения просвета
сосуда по линии шва. При ушивании ран
малого размера, колотых ран применяют
также одиночные узловые и П-образные
швы. На сосуды малого калибра нецелесообразно
накладывать выворачивающий П-образный
шов, так как при захвате избыточного
количества ткани может наблюдаться
перегиб сосуда и сужение его просвета.
Рис.5. Схема наложения непрерывного
бокового шва (ушивание обвивным швом в
поперечном направлении).
Выбор метода ушивания продольного
бокового дефекта стенки артерии
определяется в первую очередь калибром
сосудов. На артерии больше 8 мм в диаметре
обычно накладывают непрерывный обвивной
шов. Раны сосудов малого и среднего
калибра закрывают обычно методом боковой
пластики заплатой из подкожной вены
бедра (рис.6.). Учитывая возможность
применения вены в будущем для обходного
шунтирования артерий, использовать
основной ствол большой подкожной вены
бедра для заплаты нежелательно. Берут
боковые ветви, а так же ее сегмент у
внутренней лодыжки.
Р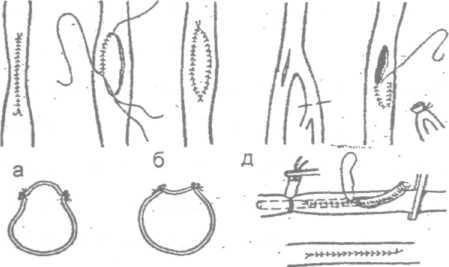
Способы предупреждения сужения просвета
сосудов среднего и малого диаметров
при ушивании продольной раны сосуда: а
— сужение сосуда; б — боковая венопластика
заплатой; в — неправильно выполненная
боковая венопластика — аневризматическое
расширение в месте заплаты; г — адекватные
размеры заплаты; д — боковая ангиопластика
с использованием боковой ветви сосуда;
е — шов на катетере или на специальном
зонде -дилататоре, введенном в просвет
сосуда.
Заплату шьют обычно двумя нитями,
используя их также как держалки.
Накладывая швы на венозный лоскут,
целесообразно вкалывать иглу в направлении
артерия — вена. Это позволяет избежать
втягивания адвентиции вены и подворачивания
ее краев. Поперечный размер заплаты
должен быть таким, чтобы не было сужения
просвета и в то же время не было
аневризматического расширения в месте
заплаты. В последнем случае нарушается
ламинарный кровоток, возникают
турбулентные потоки, создающие
благоприятные условия для образования
пристеночного тромба.
При высокой технике оперирования
допускается наложение прямого продольного
бокового шва на сосуды среднего и даже
малого калибра по специальным показаниям,
например, при большом операционном
риске у ослабленных больных для сокращения
продолжительности операции, при опасности
нагноения раны. В таких случаях
целесообразно накладывать обвивной
шов на пластмассовом катетере, введенном
в просвет сосуда с целью уменьшения
возможности его сужения (рис.6,е).
Техника сосудистого шва при наложении
боковых анастомозов типа бок в бок и
конец в бок в целом такая же, как при шве
конец в конец. Если раньше хирурги
сдержанно относились к анастомозам
подобного типа, то в настоящее время их
широко применяют в реконструктивной
хирургии сосудов, особенно при обходном
шунтировании.
Механический (аппаратный) шов. Для
упрощения техники шва, во избежание
возможного сужения просвета сосуда и
для сокращения времени операции были
предложены сосудосшивающие аппараты
(В.Ф.Гудов, П.И.Андросов). Концы сосуда
разбортовывают и фиксируют на втулках
скрепочной и упорной частей аппарата,
последние соединяют и с помощью
специального рычага прошивают стенки
сосуда танталовыми скрепками (клипсами).
Применение механического шва возможно
при достаточно широкой мобилизации
концов сосуда — не менее 1,5 — 2 см — и
наличии малоизмененной, эластичной
сосудистой стенки. Поэтому область
применения механического шва в целом
ограничена небольшим числом клинических
ситуаций.
Основное преимущество механического
шва, накладываемого с помощью современных
сшивающих аппаратов — это быстрота
наложения анастомоза, абсолютная его
герметичность, отсутствие шовного
материала (клипсы) в просвете сосуда,
исключение вероятности развития стеноза.
ВОЗМОЖНЫЕ ОШИБКИ И ОСЛОЖНЕНИЯ
Наложение сосудистого шва является
далеко не простым вмешательством и при
плохой технике оперирования или нарушении
основных правил наложения шва возможны
следующие осложнения.
Сужение просвета сосуда по линии шва
обусловлено чаше всего захватыванием
избыточного количества ткани. В таком
случае при циркулярном конце-концевом
и поперечном боковом шве целесообразно
иссекать края сосуда по линии шва и
накладывать новый анастомоз конец в
конец.
При продольном боковом шве увеличение
просвета сосуда достигается наложением
боковой венозной заплаты.
Кровотечение по линии швов обычно
обусловлено недостаточным затягиванием
нити при наложении шва, слабостью
сосудистой стенки при истончении,
воспалении и других патологических
изменениях ее. Для остановки кровотечения
к сосуду прикладывают тампоны,
гемостатическую марлю, накладывают
одиночные, П-образные и узловые швы,
используют фибриновый клей. При слабости
сосудистой стенки линию швов можно
укрепить кусочком клетчатки, полоской
из фасции по типу манжетки.
Тромбоз сосуда после наложения шва
может быть обусловлен различными
причинами: ошибками в технике наложения
шва (сужение просвета сосуда по линии
шва, подворачивание интимы периферического
конца сосуда, если она не захвачена в
шов или отслоена и не фиксирована
отдельными швами, не иссечены размозженные
участки сосуда), временным пережатием
сосуда. Для удаления тромба в зависимости
от конкретной ситуации артерию рассекают
по линии швов или же дистальнее ее. В
случае сомнения в отношении проходимости
периферического сосудистого русла
показаны ревизия его с помощью баллонных
катетеров, артериография на операционном
столе.
Литература
1. М Де Бэки. Экстренная хирургия сердца
и сосудов. Медицина, Москва., 1980. 248 с.
2. Шалимов А.А., Дрюк Н.Ф. Хирургия аорты
и магистральных артерий. Здоровье.,
Киев., 1979. 385 с.
3
Селянинов К.В.
АНО «Научно-исследовательский институт микрохирургии»
Анастомотические артериальные тромбозы в микрососудистой хирургии
Авторы:
Байтингер В.Ф., Селянинов К.В.
Как цитировать:
Байтингер В.Ф., Селянинов К.В. Анастомотические артериальные тромбозы в микрососудистой хирургии. Пластическая хирургия и эстетическая медицина.
2020;(3):84‑91.
Baytinger VF, Selyaninov KV. Anastomotic arterial thrombosis in microvascular surgery. Plastic Surgery and Aesthetic Medicine. 2020;(3):84‑91. (In Russ.)
https://doi.org/10.17116/plast.hirurgia202003184

Артериальный тромбоз после запуска кровотока в свободном осевом либо свободном перфораторном лоскуте является тяжелейшим осложнением в микрососудистой хирургии. Осложнение возникает в ходе оперативного вмешательства либо через несколько часов после него, приводя к тяжелым осложнениям, вплоть до потери лоскута. Если все количество фатальных и временных нарушений кровообращения в реперфузируемых лоскутах принять за 100% (артериальная, венозная и смешанная сосудистые недостаточности), то фатальные нарушения кровообращения составляют 86%: артериальные тромбозы — 20%, венозные — 54%, тромбозы артерии и вены сосудистой ножки — 12%. Большинство тромбозов (80%), приводящих к фатальным нарушениям кровообращения в реперфузируемых лоскутах, происходит в первые 2 сут после операции: артериальные тромбозы — в 1-е сутки, венозные и артериовенозные — на 2-е сутки после операции [1]. Признаки венозной и/или артериальной недостаточности можно легко выявить в первые 24 ч после операции. Для этого имеется достаточное количество клинических и технических возможностей (термометрия лоскута, УЗИ сосудистой ножки и др.). Явными клиническими признаками фатальной артериальной недостаточности лоскута являются белый цвет его кожи, замедление (более 3 с), а затем исчезновение капиллярного ответа. Проколы лоскута инъекционной иглой не оставляют следов крови. Представленный в литературе перечень причин артериальных анастомотических тромбозов весьма обширен и носит часто эмпирический характер. При этом остается совершенно необъяснимым факт низкой частоты анастомотических тромбозов у детей [2].
Цель работы — анализ литературных и собственных экспериментальных данных, касающихся причин артериальных анастомотических тромбозов.
Результаты
1. Технические ошибки при исполнении микрососудистого анастомоза и внешнее воздействие на сосудистую ножку
Перечень технических ошибок, возникающих при проведении микрососудистого анастомоза, довольно подробно приводят Е.В. Вербо и А.И. Неробеев [3]. Основные технические ошибки при выполнении микрососудистого шва они сводят к нарушениям техники выделения реципиентных и донорских сосудов, а также техники обработки сшиваемых концов этих сосудов, несоблюдению принципа конгруэнтности, т.е. соответствия диаметров сшиваемых сосудов. Что касается техники выделения донорских и реципиентных сосудов, то она должна предполагать осторожное нетравматичное их выделение, запрет коагуляции сосудистых ветвей вблизи сосуда, проходящего в сосудистой ножке лоскута (допускается коагуляция минимум в 0,5 мм от стенки сосуда), профилактику раздавливания стенки сосуда правильным подбором клипс.
В отношении непосредственного исполнения микрососудистого шва указывают на две ошибки: случайное прошивание противоположной стенки сосуда с перекрытием просвета сосуда либо неполный захват всех слоев сосудистой стенки с созданием препятствия току крови непрошитым эндотелиальным слоем. Отдельная проблема — неизвестного происхождения сосудистый спазм, создающий большие трудности для запуска кровотока. Его можно снять аппликацией 1% раствора лидокаина гидрохлорида либо 2% раствора папаверина гидрохлорида на сосудистую ножку. Артериальный тромбоз может развиться вследствие натяжения сосуда из-за недостаточной длины сосудистой ножки, ее перекрута, сдавления сосудистой ножки в туннеле, чрезмерной длины сосудистой ножки. Если сначала провизорно фиксировать лоскут в реципиентном ложе, а затем приступать к микрососудистому этапу, то не возникнет проблем с ножкой (перекрут, натяжение, избыток). Учет и ликвидация всех вышеперечисленных технических ошибок не дает гарантий профилактики анастомотических тромбозов.
Ретроспективный анализ различных источников литературы по результатам пересадок 1142 свободных лоскутов показал, что 9,9% лоскутов потребовали ревизии сосудистой ножки в связи с тромбозом [4]. Ревизия анастомоза предполагает в первую очередь установление и ликвидацию проблем, вызванных техническими ошибками исполнения микрососудистого анастомоза. Реанастомозирование проводят после промывания просвета сшиваемых артериальных сосудов теплым раствором гепарина (5000 МЕ в 10 мл физиологического раствора) для удаления сгустков крови. После реанастомозирования, перед запуском кровотока, проводят аппликацию 1% раствора лидокаина гидрохлорида либо 2% раствора папаверина гидрохлорида на сосудистую ножку. Наиболее высокие показатели спасения реперфузируемых лоскутов достигаются в тех случаях, когда хирург возвращается в операционную для ревизии сосудистой ножки не позднее чем через 90 мин после появления первого признака тромбоза [5]. По опыту H. Fong и L. Levin [6], показанием для ревизии сосудистой ножки является даже сомнение в адекватности кровотока. В этом случае авторы предлагают исходить из того, что ошибка совершения является меньшей ошибкой, чем ошибка упущения. После снятия кожных и подкожных швов обнажают сосудистую ножку. При наличии гематомы, сдавливающей ножку, последнюю эвакуируют и обильно отмывают рану гепаринизированным физиологическим раствором (лучше гепаринизированным Ringer Lactate). Гематома вокруг микрососудистого шва несет в себе две опасности: внешней компрессии и мощнейшего вазоконстрикторного эффекта оксигемоглобина из гемолизированных эритроцитов гематомы. Ножку нежно пальпируют, чтобы оценить наличие в просвете тромба. При определении тромба снимают 1—2 анастомотических шва с соответствующего сосуда. Через дефект можно попытаться выдавить тромб. Если сосуд дистальнее выполненного анастомоза не содержит тромба, то на него накладывают клипсу, чтобы предотвратить дистальную миграцию тромба.
Реанастомозирование, т.е. наложение вторичных 2—3 сосудистых швов, осуществляют после промывания просвета сшиваемых артериальных сосудов теплым раствором гепарина (5000 МЕ в 10 мл физиологического раствора) для удаления сгустков крови. При неудачном запуске артериального кровотока можно снять анастомоз, укоротить на 2 мм оба конца сшиваемых сосудов, а затем попытаться выполнить механическую тромбэктомию однокамерным баллоном Fogarty-3, проводя его проксимально на 10—20 см (надуть баллончик введением 0,2 мл физиологического раствора), а затем дистально к анастомозу, если это возможно [6]. После реанастомозирования, перед запуском кровотока, делают аппликацию раствора лидокаина либо папаверина на сосудистую ножку. Некоторые микрохирурги дополнительно обкалывают лоскут раствором папаверина [3].
2. Классическое исполнение микрососудистого шва
При выполнении микрососудистого анастомоза необходимо четкое исполнение всех рекомендаций R. Acland [7], официально признанных врачами мирового микрохирургического сообщества. Его основной принцип для достижения успеха: «Preparation is the only shortcut that you need». Все микрохирурги знают его наизусть. Кривая обучения микрососудистому шву, хотя и крутая, меняется в зависимости от приобретаемого опыта его исполнения на имитационных моделях и экспериментальных животных (крысах). Было продемонстрировано, что для преодоления кривой микрохирургического обучения в среднем необходимо выполнить 25 микрососудистых анастомозов на бедренной вене крысы. При этом доля состоятельных (проходимых) венозных микроанастомозов увеличивалась с 48 до 83,4%. Несмотря на все усилия, направленные на формирование 100% состоятельных венозных анастомозов, это удалось сделать только в 88% случаев (рис. 1) [8].

Рис. 1. Кривая микрохирургического обучения: зависимость проходимости венозных микрососудистых анастомозов от количества их наложения (по [8]).
R. Acland призывал врачей-микрохирургов быть в хорошей «технической форме». Осмысление своих результатов и постоянное совершенствование навыков исполнения микрососудистого шва — ключ к тому, чтобы получать максимум положительных результатов. Особое внимание он уделял выделению сосудов для последующего их анастомозирования. Вмешательство необходимо выполнять с использованием оптики и микрохирургического инструментария. Ткани, непосредственно окружающие сосуды, следует захватывать микропинцетом. Речь идет о периваскулярной оболочке сосудистого пучка, окружающей артерию, вены и vasa vasorum, которая является общей для них. Между артерией и венами имеется vague septum, где располагается большинство vasa vasorum. Для их коагуляции необходимо использовать микрокоагулятор с биполярным микропинцетом. Протяженное разобщение артерии и вен в сосудистой ножке нежелательно. После удаления периваскулярной оболочки и адвентициальной ткани осуществляют инструментальную дилатацию подготовленных ко шву сосудистых концов. Техника удаления периваскулярной оболочки, адвентициальной ткани (на протяжении 2 мм), а также дилатация сосудистых концов показаны на рис. 2 [7]. На стенке артерии технические приемы удаления периваскулярной оболочки и адвентициальной ткани выполнить легче, чем на вене. Каждый этап подготовки сосудов к анастомозированию должен сопровождаться 20-минутным перерывом. Наложенные клипсы должны оставаться на одном месте до конца выполнения обоих анастомозов (артериального и венозного). Перед наложением клипс и перед их снятием необходима аппликация раствора лидокаина либо папаверина на сосудистую ножку. Не должно быть в просвете сшиваемых сосудов (между клипсами) крови, которая бы контактировала с выполняемым анастомозом. Анастомоз следует проводить чисто и аккуратно цветной нитью на подложке зеленого или синего цвета. В ране также не должно быть крови, которая бы контактировала с зоной формируемого анастомоза. После завершения формирования обоих анастомозов клипсы с артерии и вены снимают одновременно! Важно наблюдать за анастомозами после снятия клипс не менее 20 мин и только затем приступать к ушиванию операционной раны. В настоящее время в клиническую микрохирургическую практику внедрена бесклипсовая технология выполнения микрососудистого шва после внутрипросветного введения специального термочувствительного геля LeGoo [9]. Тем не менее скрупулезное исполнение микрососудистых анастомозов микрохирургами, находящимися в хорошей технической форме, с учетов всех рекомендаций R. Acland не гарантирует профилактику анастомотических тромбозов [10].

Рис. 2. Этапы выделения сосудов и подготовки их к анастомозированию (по [7]).
а — выделение сосудов из общего соединительнотканного футляра; б — захват пинцетом сосуда за адвентициальную оболочку; в — снятие адвентициальной оболочки с сосуда; г — удаление адвентициальной оболочки с концов сосуда; д — дилатация концов сосуда пинцетом, введенным в просвет.
3. Особенности артериальной перфузии свободного лоскута
До недавнего времени в науке по физиологии кровообращения не было ответа на самый принципиальный вопрос «Как взаимодействуют сердце и артерии большого и малого круга кровообращения в пределах одного кардиоцикла?» И только в 80-х годах прошлого века было доказано, что центром управления сократительной активности аорты и ее ветвей, вплоть до артериол, является главный водитель ритма сердечных сокращений — синоатриальный узел (Кис-Фляка). Этот узел не содержит сократительных элементов, спонтанно генерирует электрические импульсы с частотой 60—80 в 1 мин, запуская сердечный цикл. Он располагается в миокарде правого предсердия, в устье полых вен. Его размеры: длина 15 мм, ширина 3,0 мм, толщина 1,0 мм. Синоатриальный узел имеет богатую чувствительную спинномозговую иннервацию. Эти нервы составляют афферентное звено кардиоваскулярного депрессорного рефлекса — рефлекса кардиосинхронизации сократительной активности артериальных сосудов. Эффекторное звено этого рефлекса реализуется постганглионарными нервными волокнами симпатических нервных ганглиев (шейных, грудных, нижних поясничных) пограничного симпатического ствола. Эти нервы проходят по наружной стенке артерий, формируя адвентициальное симпатическое нервное сплетение сосудов, вплоть до капилляров. Кровоток по капиллярам, не имеющим иннервации, регулируют артериолы, в стенке которых заканчиваются эффекторные постганглионарные симпатические нервные волокна. Непосредственный механизм кардиосинхронизации двигательной активности артериальных сосудов тела человека, включая артериолы, запускается иннервационным аппаратом синоатриального узла, обеспечивающим нисходящую (центробежную) сердечную модуляцию артериального базального тонуса. Эта модуляция запускается всякий раз в изоволюмический период сердечного цикла и всегда опережает по времени следующую за ней в фазу систолы пульсовую волну. В большом круге кровообращения этот временной зазор составляет 0,03 с [11]. Примечательно, что базальный мышечный тонус артериальных сосудов обеспечивает в артериальном давлении человека 50 мм рт.ст. Скорость распространения пульсовой волны у молодых здоровых людей нарастает в дистальном направлении с максимумом в сосудах мышечного типа и угасает в области артериол. В аорте и других артериях эластического типа она составляет 5,5—8,0 м/с, в артериях мышечного типа — 7,4—9,3 м/с. При этом скорость распространения пульсовой волны многократно превышает скорость продвижения эритроцитов по артериальному руслу (0,5—1,0 мм/с). В капиллярах скорость продвижения эритроцитов колеблется от 0,3 до 0 мм/с [12]. В основе этого эффекта общего периферического сопротивления, при котором скорость распространения пульсовой волны опережает скорость продвижения форменных элементов крови, лежат в основном вязкость крови, трение форменных элементов крови о стенку сосудов и нарушения ламинарного тока крови. В связи с денервацией в свободном лоскуте нарушен механизм опережающего пульсовую волну подавления базального тонуса в артериальных сосудах. Кровоток в денервированных сосудах лоскута, т.е. дистальнее зоны анастомоза, встречает повышенное периферическое сопротивление, вызванное нарушением механизма открытия артериальных сосудов — осевой артерии и ее ветвей, вплоть до артериол. Нарушение механизма открытия парализованных артериол приводит в свою очередь к капиллярной гипоперфузии (минус 50%) в тканях реперфузированного лоскута [13, 14]. В литературе имеется термин «синдром обкрадывания» кровотока в пересаженных свободных лоскутах на нижние конечности. Анестезиологи объясняют выявленный ими факт избирательного интраоперационного снижения параметров микроциркуляции в коже и мышцах реперфузированных лоскутов, пересаживаемых на нижнюю конечность (по данным лазерной допплерометрии — на 20—30%), уменьшением артериального перфузионного давления в ответ на экстра- или эпидуральную анестезию [15]. Избирательное снижение параметров кровотока в микроциркуляторном русле реперфузируемых лоскутов на фоне увеличения кровотока в коже и мышцах окружающих тканей конечностей анестезиологи объясняют «синдромом обкрадывания» непонятного пока происхождения. Особенность артериального кровотока в свободных лоскутах состоит также в нарушении ламинарного тока крови в денервированной осевой артерии и ее ветвях. Выраженность этих нарушений наверняка будет зависеть от длины сосудистой ножки. Считается, что 1—2 см — это оптимальная длина выделяемых реципиентных сосудов.
4. Предикторы (факторы риска) артериальных анастомотических тромбозов
Отбор пациентов для пересадки свободного лоскута — чрезвычайно ответственная задача. Здесь необходимо не только иметь уверенность в показаниях для этой операции, но и предусмотреть профилактику тех проблем, которые могут возникнуть после операции, например, в связи с ограничениями курения табака. Прекращение курения показано за несколько недель до и после операции. Кроме того, следует еще до госпитализации решить проблемы по коррекции системных сопутствующих заболеваний, таких как сахарный диабет, сердечно-легочные заболевания, периферические сосудистые заболевания. По данным Е.В. Вербо и А.И. Неробеева [3], основными факторами риска для свободной пересадки комплексов тканей являются курение, лучевое облучение зоны оперативного вмешательства, наличие у пациента сахарного диабета, а также сроки реконструкции (первичная или вторичная). После вторичной реконструкции частота некрозов аутотрансплантатов увеличивается на 9%. Интраоперационная оценка состоятельности артериального и венозного микрососудистых анастомозов с помощью теста R. Acland бывает недостаточной. Даже такая современная интраоперационная технология, как ICG-ангиография, не дает возможности прогнозировать тот кровоток, который будет в лоскуте, например через 24 ч после запуска кровотока. Для хирурга очень важно интраоперационно объективно оценить и вовремя скорректировать возможные нарушения кровотока в сосудистой ножке. В 2017 г. G. Shaughnees и соавт. [16] представили результаты экспериментальных исследований по оценке объемного кровотока в бедренной артерии 56 крыс (Sprague-Dawley) после пересечения и реанастомозирования в поле апроксиматора (наружный диаметр артерии — от 0,6 до 1,2 мм) ручным швом конец-в-конец. Анастомоз выполняли врачи с большим микрохирургическим опытом. Через 24 ч состоятельными (без тромбоза) остались 47 (83,9%) артериальных анастомозов, несостоятельными — 9 (16,1%). Кровоток более 0,30 мл/мин с высокой степенью достоверности свидетельствует о состоятельности анастомоза (без тромбоза). Предиктором начавшегося процесса развития артериального анастомотического тромбоза является уменьшение объемного кровотока в бедренной артерии с 0,30 до 0,21 мл/мин (чувствительность и специфичность показателя 95%). В клинической реконструктивной микрохирургии ситуация несколько другая. Пересаживаемый комплекс тканей из одной области тела в другую оказывается в совершенно новых условиях. Сам свободный лоскут изначально автономен, т.е. изолирован от тела человека в части нервной регуляции всех сосудов (за исключением капилляров, где в норме отсутствует нервная регуляция); в лоскуте возрастает периферическое сосудистое сопротивление току крови, вызванное параличом мелких артерий, артериол, венул и мелких вен. Нарушение нормального механизма открытия артериол в ответ на сердечную систолу, вызванное повреждением эфферентного звена кардиоваскулярного депрессорного рефлекса, приводит к капиллярной гипоперфузии тканей лоскута (минус 50%). Нельзя не учитывать факт включения анаэробного метаболизма в тканях в период первичной ишемии лоскута, которая сопровождается накоплением в тканях ишемизированного лоскута молочной кислоты, свободных радикалов и противовоспалительных медиаторов, а также снижением внутриклеточного Ph и АТФ. Тяжесть происходящих анаэробных метаболических процессов зависит от продолжительности ишемии (обычно 60—90 мин), т.е. во многом от работы микрохирургов, выполняющих микрососудистые анастомозы. При этом ткани с более высоким уровнем метаболизма более чувствительны к ишемии — например, мышцы более чувствительны к ишемии, чем кожа [17]. Развивающийся после реперфузии отек тканей лоскута необычный: он имеет как признаки отека, связанного с развитием метаболического ацидоза после первичной ишемии, так и признаки нарушения венозного дренажа. Отдельного внимания заслуживает научный факт 11-дневного отсутствия местного тканевого фибринолитического активатора в аутовенозной вставке у собак [18]. Возможно, это и есть причина потери реплантированных пальцев кисти в первые 11 сут после реплантации.
5. Тромболизис в ликвидации анастомотических тромбозов и спасении реперфузируемых лоскутов
Известно, что сосудистый эндотелий — это самый большой и активный «эндокринный орган», рассеянный по сосудам всех тканей, который обеспечивает сбалансированную продукцию различных регуляторных веществ: дилататорных и констрикторных, агрегатных и дезагрегантных, тромботических и антикоагулянтных, ангиогенных и др. Суммарная масса эндотелиоцитов у взрослого человека составляет 1,5—1,8 кг, что сопоставимо с массой печени. По современным представлениям, основным регулятором эфферентных процессов свертывания крови и фибринолиза является эндотелиальная сосудистая выстилка, которая вырабатывает местный тканевой фибринолитический активатор плазминогена (активатор плазминогена тканевого типа). Перевод плазминогена, вырабатываемого в печени, в активную форму (плазмин) запускает процесс тромболизиса, разрушающего фибрин. Известны три агента, способствующие прямому превращению плазминогена в плазмин: стрептокиназа (продуцируется ß-гемолитическим стрептококком), урокиназа (вырабатывается из плаценты человека), тканевой активатор плазминогена (продуцируется сосудистыми эндотелиальными клетками). Впервые коронарный тромболизис при остром инфаркте миокарда с помощью стрептокиназы (стрептазы) был выполнен в СССР в 1976 г. Первым тромболитическим препаратом в микрососудистой хирургии стала также стрептокиназа, которую впервые применили через 40 ч после операции пересадки малоберцового аутотрансплантата в связи с венозным анастомотическим тромбозом. Все попытки восстановить кровоток при ревизии сосудистой ножки не увенчались успехом. После шестикратного введения стрептокиназы в артерию сосудистой ножки (по 10 000 ЕД каждые 10 мин) и выведения препарата через венотомный разрез проксимальнее венозного анастомоза кровоток удалось восстановить. Никаких осложнений в дальнейшем не было отмечено [19]. В 1989 г. стало известно об успешном у всех 4 пациентов использовании стрептокиназы для ликвидации «no reflow phenomenon» при состоятельном артериальном анастомозе. Препарат (по 50 000 ЕД 3 раза через 10—15 мин) вводили через боковую ветвь аксиальной артерии либо через артериальный анастомоз. Выводили препарат через иглу, введенную в вену проксимальнее анастомоза [20]. Широкого применения этот тромболитик, как и урокиназа, в реконструктивной микрохирургии не получил. Это было вызвано серьезными недостатками, присущими данным препаратам (чужеродность, неспецифичность активации плазминогена). В 1989 г. G. Fudem и R. Walton [21] сообщили о спасении реперфузированного пахового лоскута с острым артериальным анастомотическим тромбозом уже через 15 мин после начала внутривенного введения тканевого активатора плазминогена rt-PA (12 мг/ч). В 1999 г. появилась первая публикация о применении рекомбинантного тканевого (прямого) активатора плазминогена rt-PA для тромболитической терапии в реплантологии [22]. Этот препарат является аллогенным ферментом, который не имеет антигенных свойств. Активация плазминогена и перевод его в активную форму (плазмин) происходит только на поверхности сгустка крови или фибрина. Активации системного фибринолиза при его внутривенном использовании не происходит. Необходимо учитывать тот факт, что тромболитическая эффективность этого препарата высокая, но только в первые 4—12 ч после тромбоза. Затем способность к расщеплению фибрина резко падает. В настоящее время рекомбинантный активатор плазминогена rt-PA нередко используют для подкожного введения в реконструктивной микрохирургии груди (DiEAP, free TRAM). Однако следует иметь в виду, что тромболитическая терапия в случае успеха не устраняет саму причину тромбоза и не снижает риск рецидива тромбоза [6].
6. Пути минимизации артериальных анастомотических тромбозов — правильный выбор реципиентного сосуда
Алгоритм выбора реципиентных сосудов, и в частности артерий, основан на анализе тканей реципиентной области, количестве предыдущих операций, данных ультразвуковой оценки их состояния. Дизайн анастомоза — это сугубо личный опыт каждого врача-микрохирурга. Считается, что артериальный анастомоз конец в конец целесообразно выполнять при близких диаметрах донорского и реципиентного сосудов, лучше 1:1. Именно соответствие диаметров сосудов и их правильная подготовка для анастомозирования — главные условия для благоприятного исхода операции. Е.В. Вербо, А.И. Неробеев [3] считают, что при соотношении диаметров артериальных донорских и реципиентных сосудов менее 1:2 необходимо выполнять анастомозы конец в конец, при соотношении диаметров сосудов более 1:2 — конец в бок. Однако результаты оценки архивного материала за 2005—2007 гг. [23] показали, что частота осложнений (анастомотических тромбозов) не зависит от дизайна анастомозов. Отдельно авторы обратили внимание на пациентов с вегетососудистой артериальной гипотензией, у которых возникает резкий спазм реципиентной артерии, не купирующийся ни одним из известных в настоящее время медикаментозных средств. При работе с реципиентными сосудами в ранее облученном операционном поле требуется большая осторожность, поскольку уже через 3 мес после облучения в используемых для включения в кровоток сосудах развивается периваскулярный склероз, нарушается строение стенки сосудов, что может привести к расслаиванию сосудов во время их диссекции [23].
Восстановленный в лоскуте кровоток из сосудов реципиентной области изначально становится неадекватным в части линейного и объемного кровотока. Он всегда будет отличаться от соответствующих параметров кровотока в донорских сосудах. Объем сосудистого русла в свободном аутотрансплантате также индивидуален. Один и тот же лоскут, например торакодорсальный, хирурги забирают для пересадок в разных разметках, т.е. разной площади, формы и объема. Большие проблемы ожидают лечащего врача и в связи индивидуальными величинами повышенного периферического сосудистого сопротивления в реперфузируемом свободном лоскуте. Величина периферического сосудистого сопротивления, как известно, зависит от градиента давления в начальном и конечном отделах большого круга кровообращения и объемной скорости кровотока. Основное сопротивление току крови создают в основном денервированные ветви осевой артерии и артериолы, которые регулируют капиллярную перфузию тканей. По нашим данным [24], в реперфузируемых свободных лоскутах нарушен механизм открытия артериол в ответ на пульсовую волну, который приводит к капиллярной гипоперфузии тканей. Это в свою очередь вызывает резкое повышение периферического сосудистого сопротивления в тканях лоскута. Нивелировать эту проблему, как и проблему нарушения ламинарного тока крови, только снижением вязкости крови вряд ли удастся.
Заключение
Каждый микрохирург испытывал тяжелые морально-психологические последствия безуспешных, хотя и героических усилий, по спасению лоскутов. Изучение патоморфологических и патофизиологических нарушений в сосудистом русле реперфузируемого комплекса тканей, выделенного из структуры одного ангиосома для закрытия тканевого дефекта в зоне другого ангиосома, очень важно.
Причины артериального анастомотического тромбоза при условии безупречного технического исполнения сосудистого шва, по нашему мнению, заключаются в гемодинамических расстройствах, обусловленных денервацией сосудов лоскута и продолжительной первичной ишемией, нарушающей фибринолитическую активность эндотелия сосудов в свободных лоскутах. Выбор дизайна микрососудистого анастомоза для профилактики серьезных нарушений ламинарного тока крови в артериальных сосудах реперфузируемых лоскутов невозможен без сопоставления параметров объемной скорости кровотока, подготавливаемых к анастомозированию реципиентных и донорских артерий.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Особенности микрохирургических операций — Основы реконструктивной пластической микрохирургии
Статьи
Опубликовано в журнале:
Мир Медицины
Издательство «Человек»
представляет:
С.А. Обыденнов, И.В. Фраучи
Оглавление
1.3. Особенности микрохирургических операций
| 1.3.1. Предоперационное обследование 1.3.2. Обстановка в операционной 1.3.3. Анестезия. 1.3.4. Температура тела пациента 1.3.5. Возмещение жидкости 1.3.6. Подготовка сосудов к наложению анастомозов 1.3.7. Техника микрососудистого шва 1.3.8. Микрохирургический шов нерва 1.3.9. Спазм сосудов 1.3.10. Послеоперационное наблюдение за больным |
Реконструктивные пластические операции с использованием микрососудистой пересадки технически сложны, состоят из четырех самостоятельных этапов:
1) подготовка реципиентного ложа, Свободная пересадка тканей требует филигранной хирургической техники. Необходим тщательный гемостаз, нежное обращение с сосудами. Среднюю продолжительность операции установить трудно. Так, например, первые наши операции продолжались 8-16 часов, в настоящее время продолжительность их составляет от 2,5 до 6 часов. По данным J. May с соавторами (1986), при использовании современных достижений анестезиологии продолжительность операции может составлять 46,5 часов (цитата по А.Е. Белоусову, 1988). В идеальном варианте желательно оперировать двумя бригадами хирургов: одна группа хирургов подготавливает дефект и выделяет реципиентные сосуды, другая формирует лоскут. В некоторых конкретных случаях приходится выполнять этапы операции последовательно. |
1.3.1. Предоперационное обследование
Полное физикальное обследование является необходимой частью предоперационного обследования каждого хирургического больного. Это особенно важно, если предполагается свободная трансплантация ткани, поскольку результаты внимательного осмотра и обследования могут вынудить хирурга изменить донорскую зону или способ реконструкции. Возраст пациента сам по себе не является противопоказанием к пересадке лоскута. Сейчас опытные хирурги могут произвести свободную пересадку тканей достаточно быстро, так что продолжительность анестезии не превысит четырех часов. Тем не менее, следует помнить, что по ходу операции могут возникнуть проблемы, требующие значительного увеличения времени операции, поэтому больные должны быть подготовлены к возможной длительной анестезии. Состояние сосудов больного также должно быть оценено перед операцией. Очень важно знать состояние местного кровотока в зоне дефекта, подлежащего реконструкции. Отсутствие подходящих реципиент-ных сосудов является абсолютным противопоказанием к свободной пересадке тканей. Поэтому особенно тщательно нужно обследовать больных с заболеваниями периферических сосудов. В таких случаях может быть показана ангиография, допплерография. Основным принципом всей хирургии является «пришивание здоровой ткани к здоровой ткани», это также верно и для микрососудистого анастомоза. Следовательно, в случае травмы или инфекции необходимо, чтобы анастомозы были наложены вдали от поврежденной или инфицированной зоны и хорошо от неe отграничены. Такие ситуации часто определяют выбор донорского участка, поскольку в этих случаях желательна длинная сосудистая ножка. При отсутствии у лоскута сосудистой ножки подходящей длины можно использовать аутовенозные вставки.
В случаях явно выраженного атеросклеротического изменения сосудов следует избегать наложения анастомозов в зоне атеросклеротической бляшки, а возможно, и вообще отказаться от операции.
1.3.2. Обстановка в операционной
Хирургия свободных пересадок требует огромного терпения и времени. Оптическое увеличение повышает остроту зрения хирурга и вместе с тем требует более четкой координации движений.
Каждому человеку свойственны нормальные физиологические движения рук, которые проявляются в виде тремора. Полностью устранить тремор невозможно, но его можно уменьшить. Это очень важно для микрохирурга, поскольку тремор затрудняет точные движения, требующиеся, например, при рассечении или сшивании тканей. Для уменьшения тремора за 24 часа до операции следует избегать употребления алкоголя, кофеина, никотина, желательно не подвергаться мышечному напряжению, нервному возбуждению и стрессовым состояниям (Дж.В. Рейньяк, Н.Х. Лоресен, 1986). Готовясь к микрохирургической операции, хирург должен хорошо отдохнуть. Он не должен сам двигать или укладывать больного на операционном столе, избегая сильного напряжения мышц рук.
Важно, чтобы операция проходила в дружеской и свободной атмосфере. В операционной должна быть спокойная управляемая обстановка, без резких или громких звуков. В то же время не возбраняется звучание легкой музыки. Рекомендуется периодически устраивать перерывы.
Во время работы с сосудами и нервами хирурги должны сидеть в удобных позах с хорошим упором для предплечий и кисти. (Р.С. Акчурин, 1978: В. O’Brien, 1977: А.Е. Белоусов 1988).
1.3.3. Анестезия
В настоящее время существует большое количество медикаментов для анестезии, многие из которых влияют на периферическую циркуляцию.
Существует много видов анестезии: общая, регионарная и местная. Регионарная анестезия удобна при операциях на конечностях. (Ю.А. Петренко, 1981) Так, например, эпидуральная анестезия дает эффект симпатической вазодилятации, что снижает до минимума спазм (А.Е. Дубицкий и др., 1981). В нашей практике мы часто используем комбинированное обезболивание. Так, например, при пересадке лоскута широчайшей мышцы спины на нижнюю конечность общий наркоз проводится только для взятия лоскута, а этап операции на ноге выполняется под эпидуральной анестезией. Управляемая гипотония может быть полезна на отдельных этапах операции, но, как только анастомоз наложен, давление должно быть нормализовано для обеспечения максимального пульсового кровотока через него.
Необходим мониторинг жизненно важных функций организма. Очень важным моментом анестезиологического пособия является борьба с болью, поскольку боль может стать причиной рефлекторного спазма мелких сосудов из-за выброса адреналина. Особенно необходимо бороться с болью в послеоперационном периоде. Адекватное использование лекарств, применение регионарной и местной анестезии приносят в этом периоде большую пользу.
1.3.4. Температура тела пациента
Во время операции желателен мониторный контроль температуры больного. В операционной должно быть, насколько возможно, тепло. Необходимо активно согревать больного. Некоторые хирурги используют операционный стол. оснащенный матрацем с водяным подогревом. Больного можно укрыть одеялом: жидкости, вводимые внутривенно, необходимо предварительно подогревать: все жидкости для промывания и орошения также должны быть подогреты.
Поддержание температуры тела жизненно необходимо для сохранения кровотока в лоскуте. Простое поднятие кожного лоскута может вызвать снижение его температуры на 10°С. Даже очень небольшое снижение температуры способно вызвать значительное снижение кровотока, при большем же снижении температуры кроваток может почти прекратиться.
1.3.5. Возмещение жидкости
Снижение объема циркулирующей жидкости приводит к рефлекторному сужению сосудов за счет раздражения вазорецепторов крупных вен. Поэтому необходимо предупреждать и восполнять любую потерю жидкости до наступления рефлекторной вазоконстрикции. Для поддержания водного баланса необходимо постоянно контролировать центральное венозное давление и диурез. Предпочтительна гемодилюция для поддержания высокообъемного пульсирующего кровотока (Гнездилов и др., 1989).
1.3.6. Подготовка сосудов к наложению анастомозов
Во время взятия лоскута питающие его сосуды выделяются отдельно. После того как лоскут перенесен на реципиентное место, он фиксируется одиночными швами так, чтобы донорские и реципиентные сосуды находились без натяжения и, в то же время, без избытка длины, вызывающего перегиб или скручивание сосудов. Наложение анастомозов, как правило, производят под увеличением от 5 до 20 крат. Главное условие, которое обязательно должно соблюдаться, это сшивание сосудов с неповрежденной интимой. Под увеличением 8-10 крат внимательно осматривают просвет сосудов, удаляют поврежденные концы и промывают физиологическим раствором с добавлением гепарина (10Ю МЕ/мл на 250 мл физиологического раствора) для удаления нитей фибрина и форменных элементов крови. Сосуды требуют очень бережного обращения, пинцетами можно захватывать только периадвентициальную ткань. Сaму адвентицию не удаляют, а периадвентициальную ткань тщательно сдвигают и иссекают, чтобы она не мешала при наложении анастомоза.
Как только донорский и реципиентный сосуды готовы, их можно сблизить с помощью регулируемого двойного микрососудистого зажима. Проведение иглы через все слои стенки сосудп должно совпадать с ее кривизной для избежания прорезывания стенки. Гемодинамически более выгодным является анастомоз «конец в конец». Он пригоден только для сосудов одинакового диаметра. Если сосуды имеют неодинаковый диаметр, но с разницей не более чем в 1,5-2 раза, то меньший сосуд необходимо срезать косо под углом. В остальных случаях используют аутовенозную вставку, уменьшающую различия в диаметре, или накладывают анастомоз «конец в бок».
1.3.7. Техника микрососудистого шва
Для успешного выполнения микрохирургических операций хирург должен хорошо владеть теxникой наложения анастомозов сосудов. Методика ручного шва, которую разработал и предложил французский хирург A. Carrel, совершенно не изменилась и применяется по сей день. В литературе постоянно появляются сообщения о разработках новых вариантов механическою шва, о попытках бесшовного соединения сосудов, но на сегодняшний день наилучшие результат получают при выполнении анастомоза вручную.
Чтобы сшить сосуды, хирург должен их хорошо видеть (O’Брайен, 1981). Если хирург испытывает сложности при наложении микрососудистого анастомоза, то это обычно связано с плохим доступом. В отличие от обычной хирургии, микрохирургической техникой нельзя овладеть путем ассисгирования в операционной. Основные навыки должны приобретаться в лаборатории. Будущий микрохирург должен научиться координировать свои движения, наблюдая за инструментом через операционный микроскоп при различном увеличении, и накладывать швы, минимально травмируя ткани.
Анастомоз «конец в конец». Первые два шва накладывают под углом 120 градусов друг к другу, что позволяет «свисать» задней стенке и снижает возможность захватить ее в шов (Cobbett, 1967). Ушивают сначала переднюю стенку, затем переворачивают микрососудистый зажим на 180 градусов и ушивают заднюю стенку. На сосуд с наружным диаметром 1 мм обычно накладывается 7-9 швов (нить 1О/О) (рис. 1-4.). Чем больше диаметр сосуда, тем реже нужно накладывать швы.
Рис. 1-4. Этапы наложения анастомоза «конец в конец» 1 — удаление периaадвентициальной ткани с зоны наложения анастомоза, 2 — наложение первого шва, 3 — ушивание передней стенки анастомоза, 4 — ушивание задней стенки, 5 — окончательный вид анастомоза.
Анастомоз «конец в бок». Показания к этому виду анастомоза ставятся в основном тогда, когда «выключение» реципиентного сосуда может привести к значительной ишемии кровоснабжаемых им тканей. Реципиентный сосуд пережимают двумя сосудистыми зажимами на достаточном для вшивания донорского сосуда расстоянии и выкраивают в нем соответствующих размеров боковой дефект. А.Е. Белоусов (1988) рекомендует для формирования бокового дефекта предварительно прошивать стенку сосуда нитью в центре этого участка. В отличие от анастомоза «конец в конец», вначале сшивают заднюю стенку, а затем переднюю, начиная с ее середины (рис. 1-5). При восстановлении кровотока прежде снимают дистальные, а затем проксимальные сосудистые зажимы.
Рис. 1-5. Техника наложения анастомоза «конец в бок». 1 — формирование бокового дефекта, 2, 3 — наложение фиксирующих швов, 4, 5 — ушивание задней стенки, 6 — окончательный вид анастомоза.
После восстановления кровотока герметичность анастомозов оценивают через 3-5 минут. На это время анастомоз можно либо обернуть полоской перчаточной резины (О’Брайен, 1981, А.Е. Белоусов, 1988), либо мягко прижать эту область марлевым тампоном, смоченным физиологическим раствором. Обычно за это время кровотечение из межшовных промежутков прекращается. Продолжение кровотечения говорит о недостаточном количестве швов в зоне анастомоза. Если сосудистые анастомозы выполнены качественно, после пуска кровотока сразу же наблюдается кровоточивость краев лоскута. Тромбоз любого анастомоза до окончания операции всегда связан с технической погрешностью при его выполнении. Единственным способом устранения ошибки является иссечение линии шва и переложение анастомоза.
Начинать наложение анастомозов можно как с артерий, так и с вен. Мы в нашей клинике практически всегда начинаем с анастомоза вен. Тем самым сокращается время пережатия вен клипсами, снижается опасность повреждения интимы и уменьшается вероятность тромбоза венозного анастомоза. Мы описали методику наложения узлового сосудистого шва, который рекомендуется начинающим микрохирургам. Считается, что непрерывный шов приводит к сужению просвета зоны анастомоза. С приобретением опыта статистически достоверных осложнений, связанных с применением непрерывного шва, мы не наблюдали. Зато время наложения анастомозов значительно сокращается.
Предостережения:
1. Опасность тробоза наиболее велика в течение 20 минут после восстановления кровотока по анастомозируемым сосудам.
Это время следует переждать, наблюдая за пульсацией сшитых артерий и кровенаполнением донорской вены. Для проверки проходимости анастомоза можно приводящий конец сосуда пережать пинцетом, вторым пинцетом осторожно «выдоить» кровь из сосуда и пережать его ниже анастомоза. Если теперь снять пинцет с приводящего сосуда, то при проходимом анастомозе можно наблюдать быстрое заполнение сосуда кровью.
2. Замедленная капиллярная реакция тканей пересаживаемого лоскута свидетельствует о неадекватности притока крови, синюшность его свидетельствует о затруднении венозного оттока. Если указанные признаки в течение короткого времени не исчезают, необходимо резецировать тромбировонный анастомоз и переложить его заново.
3. При неправильном наложении анастомоза предупредить тромбоз микрососудов нельзя никаким способом, включая применение антикоагулянтов. Если наступил тромбоз анастомоза, то это свидетельствует либо о грубой технической ошибке при наложении микрососудистых швов, либо о препятствии притока или оттока крови из-за перегиба или перекрута сосудов, сдавления их тканями лоскута.
4. Не следует пытаться накладывать сосудистые швы, особенно на сосуды диаметром менее 5 мм, хирургу, не прошедшему подготовку по микрохирургии.
Основные ошибки:
- Неправильный выбор шовного материала
- Недостаточный доступ и неадекватная мобилизация сосудов
- Чрезмерный захват краев сосуда при наложении шва, что приводит к сужению зоны анастомоза
- Редкие швы, следствием которых является негерметичность анастомоза
- Сильное затягивание узлов, что приводит к прорезыванию стенок сосудов
- Натяжение сшиваемых сосудов также приводит к прорезыванию шва и сужению линии анастомоза.
1.3.8. Микрохирургический шов нерва
В реконструктивной пластической микрохирургии необходимость в реиннервации пересаживаемых тканей возникает в 2-х случаях:
- Для восстановления чувствительности аутотрансплантата
- Для восстановления двигательной функции пересаживаемой мышцы.
Использование операционного микроскопа для сшивания нервов значительно увеличивает точность сопоставления пучков нерва, позволяет сшить нерв любого калибра, даже состоящий из одного пучка. Это особенно важно при свободной пересадке мыщцы, выполняемой с целью восстановления ее функции.
Для успешной реиннервации пересаживаемых тканей лучше всего использовать интраневральный или периневральный швы.
Шов пучков нерва должен быть узловым, так как он не вызывает сдавления. На каждый сшиваемый пучок нерва достаточно наложить 1-2 шва.
Эпиневральные швы могут использоваться дополнительно для повышения прочности линии шва или как основные, при шве нерва малого диаметра.
Если возникает необходимость в аутонервной вставке при реиннервации пересаживаемой ткани (что нежелательно), то чаще всего используется икроножный нерв.
1.3.9. Спазм сосудов
Одной из наиболее трудных проблем во время микрохирургической пересадки тканей является спазм мелких периферических сосудов. Сильный спазм приводит к остановке кровотока — «no-flow» — и может привести к гибели лоскута. Мы уже упоминали о важности поддержания стабильного водного баланса, температуры и жизненных функций пациента. Применение местной или регионарной анестезии также помогает предупредить спазм. Упоминали также о важности бережного обращения с сосудами и тканями аутотрансплантата. Если спазм наступил в месте предполагаемого анастомоза, некоторые авторы считают, что его можно преодолеть путем осторожной дилятации концов сосудов. При этом происходит временный паралич гладкой мускулатуры сосудов, что предупреждает спазм. Этот прием является спорным, поскольку опровергает положение, гласящее, что интима должна оставаться «интактной». Однако, если произвести дилятацию кончиками гладкого пинцета, и сделать это достаточно осторожно, опасность повреждения интимы будет невелика.
Другим спорным приемом является гидравлическая дилятация — введение гепаринизированной крови под давлением в артерию, питающую лоскут. При этом происходит дилятация сосудистой сети в пределах трансплантата. Конечно, эта процедура не обязательна, однако лоскуты подготовленные этим способом, после наложения анастомозов и снятия зажимов заполняются кровью значительно быстрее обычного.
Очень важен контроль температуры лоскута для предотвращения спазма. Для промывания и орошения во время операции следует использовать только подогретые растворы. Даже простое согревание лоскута может уменьшить сосудистый спазм. При упорном спазме помогает применение некоторых местных анестетиков и спазмолитиков, таких как растворы папаверина, но-шпы, праксилена. Зарубежные хирурги чаще применяют верапамил-гидрохлорид, прикладывая его непосредственно к сосудам.
Несмотря на наличие эффективных лекарственных препаратов, спазм лучше предупредить заранее.
1.3.10. Послеоперационное наблюдение за больным
Послеоперационное наблюдение должно быть таким же пристальным, как операционный мониторинг. Необходимо поддерживать температуру тела и баланс жидкостей. Исключительно важно обезболивание. Больной не должен испытывать чувство тревоги, недомогание. Необходим высокий уровень наблюдения и ухода за больным, что лучше всего достигается в палате интенсивной терапии, где больной должен находиться первые 24-48 часов. Помимо наблюдения за больным, необходимо тщательно контролировать состояние аутотрансплантата. Дежурный хирург или сестра должны постоянно контролировать наличие капиллярной реакции. В специализированных отделениях микрохирургии наблюдение за пациентом и состоянием аутотрансплантата проводится дежурной бригадой. При подозрении на тромбоз артериального или венозного анастомозов необходима срочная операция — тромбэктомия. Возникающие осложнения необходимо корректировать в кратчайшие сроки, пока жизнеспособность лоскута еще сохранена. Если во время операции при пересадке лоскута после снятия сосудистых зажимов все идет гладко, вероятность осложнений невелика. Она увеличивается в тех случаях, когда наблюдались трудности при наложении сосудистых анастомозов во время операции.
Для постоянного мониторинга предложено несколько доступных устройств. Одни работают по принципу фотоплетизмографии, другие основаны на эффекте Допплера. Эти приборы, несомненно, очень удобны, но не могут заменить клинических наблюдений.
Очень важно обучить сестринский персонал оценивать кровообращение в лоскуте по его температуре, реакции капилляров, цвету и тургору.
Нормальные реакция капилляров, цвет, тургор определяют путем исследования идентичной ткани на противоположной стороне.
Снижение температуры лоскута, по сравнению с температурой тела пациента, указывает на артериальную или венозную недостаточность, либо на оба осложнения вместе. Синюшность кожи лоскута, ускоренная капиллярная реакция указывают на неадекватность венозного оттока, и наоборот: побледнение, замедление капиллярной реакции — на артериальную недостаточность.
Сократительную способность мышечных лоскутов можно проверить следующим образом:
- Однократно легко уколите или ущипните мышцу кончиком пинцета — локальное сокращение мышечных волокон свидетельствует о жизнеспособности мышцы
- Мягко поцарапайте обнаженную мышцу кончиком иглы — нормальным является скудное выделение артериальной крови
Неправильно считать, что успех пересадки лоскута зависит только от личного умения хирурга и от того, насколько он искусно наложил анастомозы. Успех, как и неудача, зависит от выбора больного, мастерства хирургов, анестезиолога, персонала операционной и послеоперационных палат.
Приобрести монографию можно, обратившись в Издательство «Человек»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)