Неонатальный скрининг — это комплекс мероприятий, который дает возможность выявить какие-либо заболевания на доклинической стадии, что позволяет своевременно начать лечение. К сожалению, учитывая большое количество материала, возможны различные ошибки и получение как ложноположительных, так и ложноотрицательных результатов.
Впервые в 1962 году Роберт Маккриди совместно с Робертом Гатри организовали сбор бланков из фильтровальной бумаги с сухими пятнами крови от каждого новорожденного в штате Массачусетт и тестировали их на фенилкетонурию. В настоящее время массовый скрининг новорожденных проводится в 52 странах мира: США — на 45 нозологий, в Германии — 14, Великобритании -5, России -5 (фенилкетонурия, врожденный гипотиреоз, врожденная дисфункция коры надпочечников, галактоземия, муковисцидоз).
Впервые скрининг на врожденный гипотиреоз был проведен в Канаде в 1973 г. путем определения концентрации тироксина (Т4) в капле крови на фильтровальной бумаге радиоиммунологическим методом.
Почему же возникают ошибки при проведению скрининга с целью выявления врожденного гипотиреоза и врожденной дисфункции коры надпочечников (дефицита 21-гидроксилазы)?
Возникновение ошибок при проведении скрининга на врожденный гипотиреоз возможно на всех этапах обследования. Важно учитывать сроки и правила забора крови. Кровь забирается путём чрезкожной пункции (чаще из пятки) на 4-5 день после рождения у доношенных и на 7-14 день у недоношенных детей. Кровью объёмом 6-8 капель полностью пропитывают специальную фильтровальную бумагу.
Возможны ошибки при измерении результатов.
Так же есть ошибки, связанные с нарушением информирования, игнорировании полученных данных.
Существуют варианты гипотиреоза, прикоторых возможно более позднее повышение ТТГ (после взятия скрининговой программы).
Есть варианты гипотиреоза, при которых отсутствует повышение ТТГ (вторичный, резистентность тканей к тиреоидным гормонам).
Ложноположительные результаты могут возникать при ошибке метода. Ложноотрицательные методы — при вторичном гипотиреозе, гипотиреозе, связанном с резистентностью тканей к гормонам щитовидной железы.
В первые недели жизни ребенка заподозрить дефицит 21-гидроксилазы позволяет наличие вирилизации наружных гениталий у девочек и развитие синдрома потери соли у детей обоего пола. Вирильная форма заболевания у мальчиков диагностируется только к 4-5 годам жизни, при появлении симптомов преждевременного полового развития. Костный возраст при этом уже значительно опережает хронологический. Подобный клинический подход к диагностике 21-гидроксилазного дефицита приводит к большому количеству ошибок. До 30% девочек с тяжелыми проявлениями вирилизации наружных гениталий ошибочно регистрируются в мужском поле. До 35% мальчиков с сольтеряющей формой заболевания погибают в первые недели жизни, т.к. заболевание остается нераспознанным.
Своевременно поставить диагноз позволяет неонатальный скрининг на выявление 21-гидроксилазного дефицита, при котором определяется уровень 17 — гидроксипрогестерона. Этот метод был предложен Pung с соавт. в 1977 г. К 1991 г. Программу неонатального скрининга внедрили 29 стран мира.
При заборе крови в роддоме в сопроводительных документах, отсылаемых в лабораторию, помимо стандартной информации необходимо указать вес новорожденного, срок гестации при недоношенности, прием матерью и (или) ребенком дексаметазона, выраженная билирубинемия , применение в/в трансфузии до взятия крови на скрининг.
Выполняется исследование уровня 17ОНП, проводится выборка положительных результатов и повторно тестируются сомнительные результаты. Для детей, рожденных на различных сроках гестации, используются отдельные нормативные стандарты уровня 17ОНП. Это обусловлено тем, что уровень 17ОНП у недоношенных и маловесных детей значительно выше, чем у детей, рожденных в срок и имеющих нормальный вес. Отсутствие нормативной шкалы значений 17ОНР может приводить к большому числу ложноположительных результатов. В лабораториях, осуществляющих скрининг, необходим постоянный контроль качества проведения гормонального исследования. К 9-10 дню жизни доношенного ребенка лабораторная обработка результатов должна быть закончена. Информация о всех положительных результатах должна быть немедленно направлена в поликлинику по месту жительства ребенка или в стационар, где он еще может находиться.
Помимо недоношенности, ложноположительные результаты могут определяться у новорожденных детей с тяжелым общим соматическим состоянием, у детей на фоне в/в трансфузии, у детей с высокой билирубинемией. Ложноотрицательные результаты могут определяться у детей, матери которых (и/или сам ребенок) получали терапию дексаметазоном с целью профилактики и лечения легочной патологии новорожденных (недостаток сульфактана).
Учитывая значительный процент ложноположительных результатов, особенно у недоношенных детей, при отсутствии клинических симптомов следует дважды с интервалом 1-2 недели проводить определение 17ОНП в сыворотке крови, прежде чем начать лечение. Детям с диагностированным адреногенитальным синдромом необходимо проведение молекулярно-генетического исследования для выявления мутаций в гене CYP21. Молекулярно-генетическая диагностика у пациентов с положительным результатом гормонального исследования внедрена в качестве второго этапа скрининга в некоторых странах для уменьшения количества ложноположительных результатов. Проблемой, сдерживающей широкое внедрение данного метода, является его высокая стоимость. Выявление конкретных мутантных аллелей помогает подтвердить диагноз и дифференцировать форму заболевания, что позволяет адекватно подобрать дозы препаратов в периоде новорожденности и раннем детском возрасте. Исследование мутаций в гене СУР21 дает возможность провести дифференциальный диагноз между дефицитом 21-гидроксилазы и 11в-гидроксилазы — гипертонической формой ВДКН, имеющей сходную клиническую картину и сопровождающейся умеренным повышением 17-ОНП. Эффективным методом уточняющей диагностики является анализ стероидного спектра методом жидкостной хроматографии с тандемной масс-спектрометрией, позволяющей оценить уровни 17-ОНП, кортизола и андростендиона. Это дает возможность четко дифференцировать ферментативный дефект при заболевании.
В своей практике не редко приходится сталкиваться с ложноположительными результатами. За время появления скрининговой программы в Крыму по определению дефицита 21-гидроксилазы ложноотрицательных результатов не было.
Несколько отходя от основной темы, но о скрининге. За последние 6 мес. у нас выявлено 3 ребенка с синдромом Дауна. Двоим диагноз поставлен в роддоме. Третьего ребенка с фенотипом синдрома Дауна ко мне на консультацию прислал педиатр с жалобами на большой язык, плохую прибавку в массе, задержку психо-моторного развития. Направила на кариотипирование, результат — 47, ХХ+21. Двое детей от молодых здоровых родителей. Все матери даунят стали на учет на ранних сроках беременности, которые были желанные и запланированные. Соответственно, все скрининговые программы в период беременности проводились.
Поэтому, уважаемые коллеги, если у Вас есть какие-то подозрения, помните, что любой скрининг может выдавать ошибочный результат. Для уточнения диагноза нужно использовать более точные методы исследования.
Литература
1. Петеркова В.А. Врожденная дисфункция коры надпочечников у детей , М., 2003.
2. Дедов И.И., Петеркова В.А. Детская эндокринология., М., 2006
Скрининг в период новорожденности — это массовое обследование детей, практикуемое не только в нашей стране, но и в странах Европы и Америки. Обычно его еще называют «пяточным» тестом и проводят для всех детей, рожденных в любых учреждениях родовспоможения. Необходимость данного скрининга продиктована ростом заболеваемости тяжелыми, но вполне поддающимися коррекции в раннем возрасте заболеваниями у младенцев. Сегодня в число болезней, которые выявляет скрининг, относят пять серьезных патологий.
Скрининг новорожденного — что это и зачем?
Такой анализ выполняется всем детям без исключений в период 4-5 суток (либо, по показаниям, и позднее). Результат этого скрининга будут получены позднее, через три-четыре недели, уже в поликлинике, если выявлены те или иные отклонения. Переживать по поводу проведения подобного исследования не стоит — это нужное и важное мероприятие. По мнению докторов, скрининг новорожденного относится к наиболее эффективным мерам ранней диагностики генетических и обменных патологий в раннем возрасте, когда еще можно начать коррекцию и сохранить малышу здоровье. Данный скрининг новорожденного рекомендован к массовому проведению ВОЗ и внедрен во многих странах как обязательное и бесплатное для родителей исследование. Наша страна практикует подобное исследование уже более 15 лет, и его результаты позволили вовремя выявить детей с проблемами и оказать им квалифицированную помощь, не допуская серьезных осложнений.
Проведение скрининга у детей
У нас в стране проводится скрининг пяти самых серьезных и тяжелых патологий, другие страны практикуют выявление до 40 различных патологий. Если ребёнок относится к группе риска и родители хотят провести дополнительное обследование (оно платное), скрининг можно расширить до 16 возможных патологий. Возникает вопрос, почему именно пять патологий? В списке исследуемых находятся те болезни, которые при раннем их выявлении, поддаются лечению, или степень их тяжести может быть значительно уменьшена. В основном, это болезни обмена, а вот хромосомные аномалии сюда не включены.
Забор крови для анализа проводится по строгим срокам — дети, рожденные доношенными, обследуются на 4-5 сутки, для недоношенных сроки сдвигают позже 7 дня. При выписке новорожденного ранее этого срока, забор крови для анализа проводится на дому или в условиях поликлиники, за которой закрепили малыша. Исследуют капиллярную кровь, взятую из пяточки, отсюда и название метода. Капельки крови наносят по особым методикам на пять круглых бланков с особой фильтровальной бумагой. Важно, чтобы анализ был взят натощак, примерно 3 часа до забора ребёнка не кормят.
Важно, чтобы сроки скрининга были соблюдены. Дети, которым анализ взят ранее (на 1-3 сутки жизни), могут давать ложные результаты (как положительные, так и отрицательные). Но и позже 10 суток кровь забирать нежелательно, это затянет получение результата, для многих из выявляемых патологий ценным будет буквально каждый день.
Что может выявить скрининг новорожденного
Первое, что может выявить скрининг новорожденного, это состояние врожденного гипотиреоза (резко подавленные функции щитовидной железы). Если вовремя не начать терапию, последствия этой патологии серьезны — задержка как физического роста и развития, так и сильная психическая отсталость, вплоть до кретинизма. Встречается с частотой 1:5000 новорожденных, при своевременном выявлении дети имеют шансы на полную коррекцию патологии. Конечно, потребуется практически пожизненный прием замещающих гормонов, но это позволит детям расти и развиваться полноценно как физически, так и умственно.
Помимо этого, скрининг новорожденного помогает в выявлении муковисцидоза. Это генетическая патология, приводящая к нарушению секреции желез дыхательной и пищеварительной систем. Встречается у 1 из 3000 детей, при раннем начале заболевания, дети имеют благоприятные прогнозы для жизни и здоровья при условии адекватной терапии.
Реже выявляют адреногенитальный синдром (1:15тыс), но он проявляет себя нарушением выработки у детей гормонов корой надпочечников. Это существенно влияет на развитие органов и тканей, работу сердца. Патология без адекватной терапии смертельно опасна, лечение будет заключаться в пожизненном приеме препаратов.
Еще две патологии, которыми могут страдать дети, и которые выявляет скрининг — это галактоземия и фенилкетонурия. Это генетические заболевания, при которых страдает выработка особых ферментов, участвующих в метаболизме. Они приводят к тяжелым и необратимым последствиям, если своевременно их не выявить. Лечением подобных проблем будет пожизненная диета с исключением галактозы или фенилаланина.
Вопросы по результатам скрининга
Вокруг данного анализа существует много споров, и те родители, у кого результаты скрининга оказались ложно-положительными, пережили множество тяжелых минут. Но те, кому данный скрининг дал своевременные данные о болезни ребёнка, ему благодарны. Дети получили лечение своевременно, что позволило им сохранить здоровье и полноценно развиваться. Поэтому, важно знать ответы на основные вопросы, кающиеся данного обследования. И прежде всего, как узнать результаты скрининга. Готовится анализ до трех недель, поэтому, если в месячном возрасте на приеме педиатр вам ничего не сообщил, значит, результаты отрицательны. Если же результаты положительны — это ее не диагноз, но вам сообщат из клиники, что необходимо прохождение повторных анализов и углубленного обследования. Иногда бывают ложно-положительные результаты (особенно в случае муковисцидоза).
Если повторно выявлены позитивные результаты скрининга, необходимо посещение генетика и направление на обследование к врачам-специалистам и более прицельные анализы. После подтверждения диагноза, производится немедленное принятие решения о лечении крохи.
Насколько результаты скрининга достоверны, но могут ли они не показать болезнь? Если анализ взят правильно, натощак, то его результаты достаточно достоверны. Но это еще не диагноз. Кроме того, в редких случаях бывает так, что при отрицательном результате заболевание есть, и оно выявится уже позднее, при наличии первых симптомов.
Педиатрия. Национальное руководство / под ред. А. А. Баранова – 2014
Неонатальный скрининг новорожденных ХМАО в 1999-2003 гг / Кунцевич Н.В., Белошицкая Т.А., Урванцева И.А. // Медицинская генетика – 2005 – Т. 4 №5
Аудиологический скрининг новорожденных / Шилова Н.А., Харламова Н.В., Чаша Т.В., Толкачева Е.В. // Вопросы практической педиатрии – 2009 – Т. 4 №S1
Основными задачами неонатального скрининга муковисцидоза (НС МВ) являются раннее выявление детей с этим наследственным заболеванием, до развития клинической картины и сокращение (в перспективе) распространенности МВ в популяции. Доказаны очевидные преимущества ранней диагностики МВ на доклиническом этапе, такие как улучшение показателей выживаемости[1], физического и когнитивного развития[2], функции дыхательной системы[3], снижение психологической нагрузки в семье пробанда в процессе диагностического поиска.
За последние 30 лет НС МВ прошел три фазы развития:
- определение уровня иммунореактивного трипсиногена (ИРТ) в 1970-х гг.;
- оценка его применимости в качестве биомаркера в ряде клинических исследований в начале 1980-х гг.;
- внедрение и распространение измерения его содержания в программах НС в системах здравоохранения развитых стран (1980–1990-е гг.)[4, 5].
В России НС МВ был начат в ряде регионов с июня 2006 г. в качестве пилотного проекта, а с января 2007 г. является обязательным во всех регионах в соответствии с Приказом Минздравсоцразвития РФ № 185 от 22.03.2006 г. «О массовом обследовании новорожденных детей на наследственные заболевания».
При этом сохраняется необходимость совершенствования подходов к оценке результатов НС МВ, поскольку концентрация ИРТ в крови новорожденных весьма динамична. Считается, что даже у здоровых детей в первые три дня после рождения она может повышаться до 58 нг/мл,затем снижаться, на 4-й день вновь повышаться, снижаясь на 5-й день, и еще раз увеличиваться к 8-му дню[6]. Возможные причины таких скачков — недоношенность и неонатальный стресс[7].
Кроме того, показано, что факторы внешней среды могут значительно влиять на уровень ИРТ в исследуемых образцах: так, он снижался на 40% в течение недели при хранении сухих пятен крови на бланках НС при температуре 27 °С и влажности 80%[8]. Загрязнение сухих пятен крови фекалиями новорожденного ведет к ложноположительному результату[9]. Считается, что повышенная температура (особенно в летние месяцы) способствует снижению активной концентрации исследуемого аналита в пятнах крови[9]. Данное обстоятельство для территории ХМАО-Югры играет весомую роль вследствие сложной логистики доставки в центральную генетическую лабораторию образцов крови из отдаленных территорий округа.
Подобная индивидуальная вариабельность сильно осложняет определение корректных референсных интервалов, необходимых для выявления МВ. Более того, тип питания (грудное/искусственное вскармливание) и этническая гетерогенность исследуемой популяции (популяционная вариабельность) также вносят свой вклад в размытость референсных интервалов при их оценке[10, 11]. О проблеме ложноположительных результатов измерения содержания ИРТ говорится и в Национальном консенсусе «Муковисцидоз: определение, диагностические критерии, терапия»[12].
В ранее представленном нами исследовании, анализировавшем результаты НС МВ в ХМАО-Югры за период 2006–2014 гг., выявлено наличие большого количества ложноположительных результатов тестирования ИРТ-1[13] и обоснована по этой причине необходимость уточнения региональных референсных показателей ИРТ. Пороговое значение биомаркера является верхней точкой так называемого референсного интервала, который представляет собой интервал значений, куда входят данные пациентов с характеристиками, аналогичными подобным у участников референс-группы[14].
В практической работе многие лаборатории используют референсные интервалы, опубликованные другими исследователями, установленные на другом оборудовании и для других популяций[15]. Это может привести к значительным искажениям реальных операционных характеристик лабораторного теста (чувствительности, специфичности и пр.). Более того, сам производитель наборов для НС МВ (Pribory Oy) в инструкции к ним указывает на необходимость разработки локальных референсных пороговых значений ИРТ (DELFIA Neonatal IRT kit. Instructions for use. Reagents for 960 (384) assays (Perkin Elmer). Last revision Feb 2011).
По умолчанию предлагается использовать порог, соответствующий 99-му процентилю в исследуемой выборке (n = 1896). Однако его абсолютные значения для пороговой концентрации ИРТ довольно значительно различаются для разных наборов: для AutoDELFIA (автоматизированное измерение ИРТ) — 73,3 нг/мл, тогда как для DELFIA (полуавтоматическое измерение) — 57,8 нг/мл (для наборов, использующихся с 2014 г.). Такая неопределенность и побудила нас провести собственное исследование для выяснения оптимального алгоритма расчетов пороговых уровней (ПУ) ИРТ.
В русскоязычной научной литературе подобные вопросы до сих пор не обсуждались, а научные статьи описывают лишь практические результаты проведения НС на территории регионов РФ за последние годы. При анализе англоязычных научных публикаций мы опирались на исследования проблематики расчета ПУ ИРТ специалистами Школы медицины Висконсина, США[16, 17].
Целью настоящего исследования стало совершенствование НС МВ путем применения плавающего ПУ (ППУ) ИРТ и сравнение его эффективности с таковой использования фиксированного ПУ (ФПУ) ИРТ в региональных условиях ХМАО-Югры.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено сплошное ретроспективно-проспективное когортное исследование, в которое на этапе оценки эффективности НС МВ и определения ППУ ИРТ включались результаты всех новорожденных детей на территории ХМАО-Югры с 2006 по 2017 г. (ретроспективная часть) и результаты НС МВ за 2018 г. (проверочный этап исследования, проспективная часть).
Концентрацию ИРТ определяли с помощью коммерческих наборов DELFIA Neonatal IRT kit, AutoDELFIA Neonatal IRT kit (PerkinElmer, Wallac Oy, Финляндия) на флуориметрах Victor2, AutoDELFIA (PerkinElmer, Wallac Oy, Финляндия) методом флуоресцентного иммунного анализа с разрешением по времени.
Источником статистических данных стали лабораторные журналы НС МВ, оформленные в соответствии с упомянутым выше Приказом Минздравсоцразвития № 185 от 22.03.2006 г. Была проведена оцифровка рукописных данных (ИРТ-1, ИРТ-2, даты забора крови; для каждого образца создавался уникальный идентификационный ID-номер). Первичная статистическая обработка выполнялась в программе MS Office Excel.
ППУ ИРТ рассчитывали с помощью программного обеспечения floating Level of IRT (flIRT), разработанного нами совместно с IT-специалистами Сургутского государственного университета[18]. При этом выборка данных для расчета ППУ ИРТ производилась по принципу «скользящего» окна для всех подтвержденных случаев МВ (n = 32) за весь период ретроспективного наблюдения (2006–2017). Выбирались все показатели концентраций ИРТ-1, полученные за несколько дней лабораторных постановок, таким образом, чтобы общее число исследуемых образцов находилось в диапазоне 500–600. Для каждого случая МВ отбирали по 500 образцов, предшествующих случаю, и по 500 образцов, последующих за случаем МВ.
С помощью программного обеспечения flIRT строили гистограмму для каждой исследуемой совокупности случаев, после предварительного логарифмирования набора данных (по основанию натурального числа e) проводили первичное удаление «выбросов» методом «трех сигм» и расчет 99,5 процентиля с определением ID-номеров образцов, выходящих за границы ПУ ИРТ и предназначенных для повторного тестирования (ретеста, ИРТ-2). Образцы, выделенные в группу ретеста, экспортировались в таблицу в виде, максимально удобном для интерпретации врачами генетической лаборатории. Пороговым считали рекомендованный в указанном выше Национальном консенсусе 99,5 процентиль совокупности показателей ИРТ в пределах «скользящего окна».
В течение 2018 г. использовали стандартный (оценка ИРТ-1 по ФПУ = 57,8 нг/мл) и инновационный (оценка результатов НС МВ по ППУ > 99,5 процентиля) подходы и сравнивали их.
Идентичность происхождения сухих пятен крови для ложноотрицательного случая МВ (с ретестом ИРТ в пределах нормы) верифицировали методом ПЦР-диагностики 12 независимых полиморфизмов (тест-системы «КардиоГенетика Тромбофилия» и «Генетика Метаболизма Фолатов», «ДНК-Технология», Россия) для образцов сухих пятен крови, отобранных на первичный тест, ретест, и для образца цельной крови пациента с МВ.
При статистической обработке материала использовали непараметрические методы: определение моды, расчет процентилей, исследование операционных характеристик теста — чувствительности (Se), специфичности (Sp), прогностической ценности положительного (PPV) и отрицательного (NPV) результата[19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Массовый скрининг новорожденных на МВ в рамках Национального проекта «Здоровье» проводится в ХМАО-Югры с 01.06.2006 г. За период с июня 2006 г. по декабрь 2017 г. обследован 283 741 новорожденный, среднемноголетний охват скринингом составил 96,3%; при этом охват в период 2009–2017 гг. — в среднем 98,9% (табл. 1). Сниженные цифры охвата в начале проведения НС МВ связаны с рабочими моментами по внедрению инфраструктуры и логистики исследований на обширной территории ХМАО-Югры. В 2006–2017 гг. выявлены 32 пациента с подтвержденным диагнозом МВ.
Таблица 1
Результаты неонатального скрининга (НС) на муковисцидоз в ХМАО-Югры за период 2006–2017 гг.
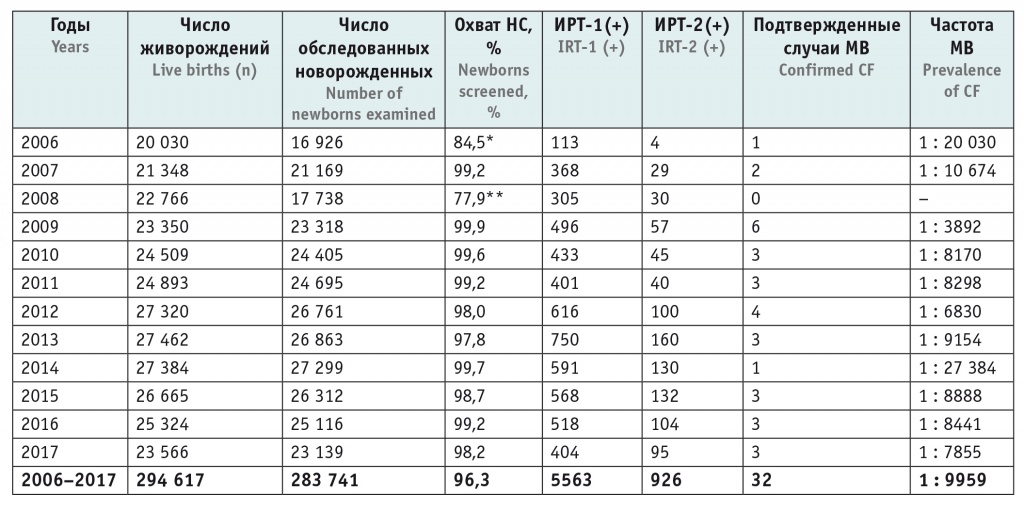
Примечание. Здесь и в таблице 2, рисунках: ИРТ — иммунореактивный трипсиноген, МВ — муковисцидоз.
* В 2006 г. неонатальный скрининг выполнялся с июня по декабрь.
** В 2008 г. неонатальный скрининг выполнялся в течение всего года, кроме марта.
Среднемноголетняя частота МВ в ХМАО-Югры составила 1 случай на 9207 новорожденных детей; среднемноголетние операционные характеристики теста: Se — 100,0%, Sp — 98,1%; PPV — 0,65%; NPV — 100,0%. Проведены 5563 ретеста (около 2,0% от всего количества первичных исследований), из них только 32 оказались истинно-положительными. Такое число ретестов при отсутствии МВ соответствует примерно 2,5-месячному объему выполняемых исследований НС МВ.
Накопленный 12-летний опыт по осуществлению НС МВ в ХМАО-Югры и большой объем данных позволили произвести полноценное объективное исследование полученных результатов с целью возможной оптимизации существующих алгоритмов. В сплошном ретроспективном исследовании, охватывающем период 2006–2017 гг., проанализирована информация по НС МВ обо всех 32 детях с подтвержденным диагнозом МВ.
На рисунке 1 приведены данные, отображающие показатели первичных тестов ИРТ и ретестов с соответствующим диапазоном концентраций для каждого случая МВ. У 16 человек концентрация ИРТ в ретесте была ниже концентрации первичного ИРТ (темные бары), у 14 человек — выше (светлые бары).
Рис. 1. Показатели первичного теста (иммунореактивный трипсиноген 1) и ретеста (иммунореактивный трипсиноген 2) для всех случаев муковисцидоза, выявленных во время неонатального скрининга за период 2006–2017 гг. Светлые бары: ИРТ-2 > ИРТ-1; темные бары: ИРТ-2 < ИРТ-1
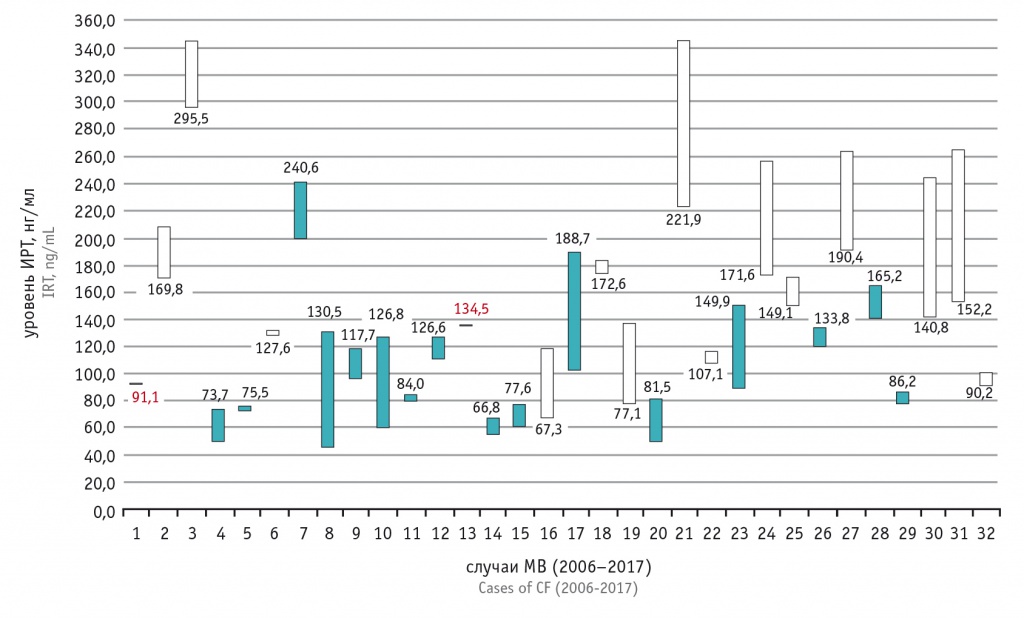
У ребенка № 1 ретест не проводился по причине отсутствия реактивов, у ребенка № 13 ретест оказался ложноотрицательным, однако при последующей проверке выяснилось, что на бланке НС была нанесена кровь другого человека (эти случаи выделены красным на диаграмме).
Красными линиями обозначены рекомендованные производителем реагента ФПУ ИРТ, при этом заметно последовательное снижение ПУ с 65,0 нг/мл до 57,8 нг/мл.
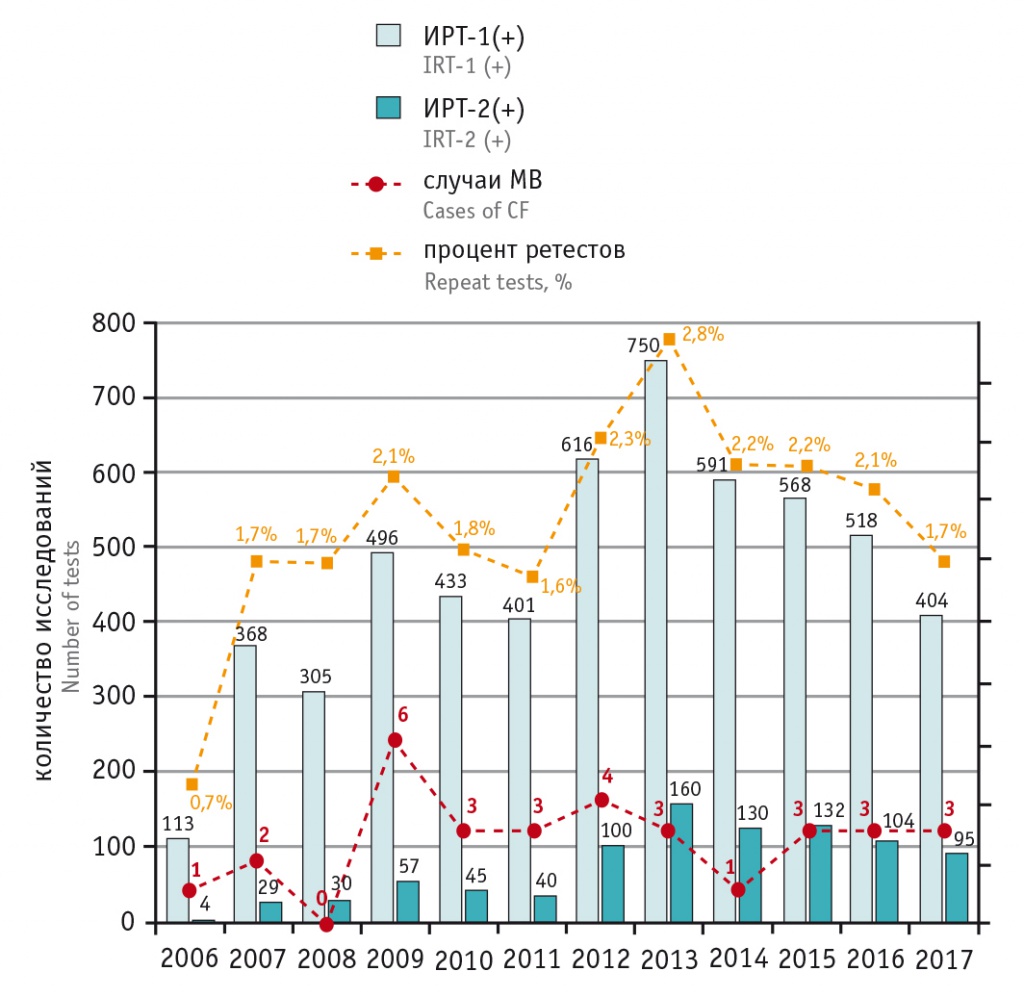
На рисунке 2 приведены диаграммы ежегодного сравнения количества образцов с концентрациями ИРТ-1, ИРТ-2 выше ФПУ и подтвержденных случаев МВ. Видно, что «просеивающая» способность НС для выявления МВ весьма высока, и в последовательных раундах скрининга возможно отобрать из десятков тысяч буквально несколько единиц образцов с истинно-положительным результатом, руководствуясь определенным пороговым значением концентрации ИРТ-1 для отбора образцов на повторное тестирование в рамках алгоритма ИРТ-1/ИРТ-2.
Рис. 2. «Просеивающая» способность неонатального скрининга на муковисцидоз в ХМАО-Югры: общее количество ретестов (абсолютное число и процент от числа первичных тестов); число положительных ретестов; число подтвержденных случаев муковисцидоза
Нами совместно с IT-специалистами СурГУ разработано программное обеспечение flIRT для быстрой статистической обработки наборов данных НС МВ. На первом этапе была визуализирована выборка из 5000 образцов ИРТ-1 за 2009 г. путем построения гистограммы (рис. 3), где наиболее частой оказалась концентрация ИРТ по величине моды в 12,5 нг/мл.
Рис. 3. Логнормальное распределение концентраций иммунореактивного трипсиногена 1 на гистограмме выборки из 5000 образцов сухих пятен крови неонатального скрининга муковисцидоза (2009)
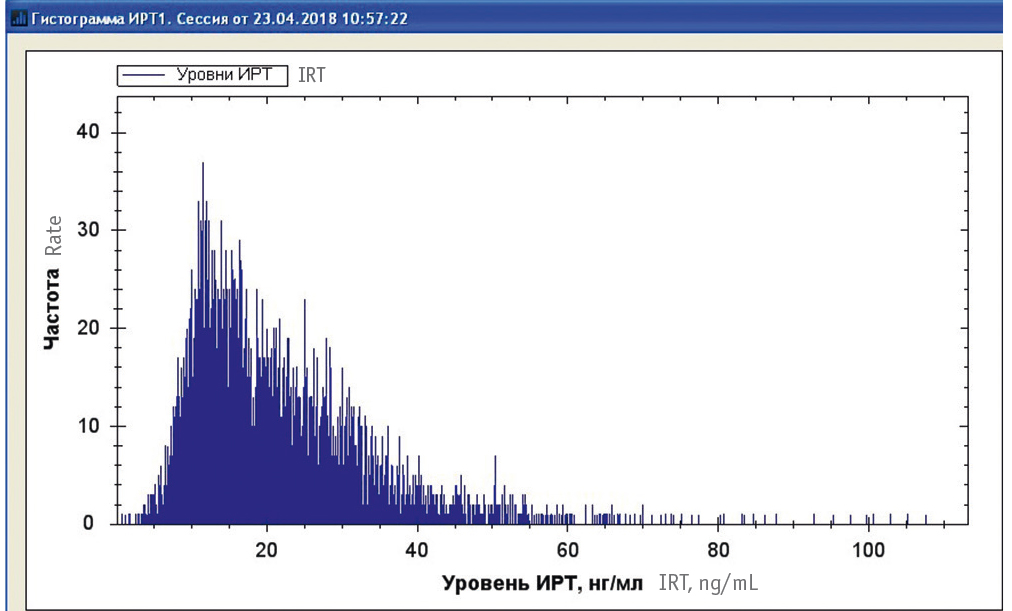
Предварительный анализ показал, что тип распределения такой выборки — логнормальный, т. к. при логарифмировании гистограмма принимает вид нормального распределения.
Большой набор неоцифрованных данных (более 283 тыс. показателей уровня ИРТ-1) значительно осложнил предстоящую задачу расчета региональных ППУ ИРТ. Поэтому мы использовали принцип «горячих точек», когда для подтверждения/опровержения применимости метода ППУ были оцифрованы и использованы для статистической обработки ограниченные, «локальные» сеты данных, группирующиеся вокруг каждого подтвержденного случая МВ с размером выборки n ≈ 1000 для каждого случая. Таким образом, при числе случаев подтвержденного МВ за всю историю проведения НС в ХМАО-Югре, равном 32, анализируемый объем выборки значительно уменьшился (≈ 32 000 уникальных данных).
Вся выборка была разбита на 32 локальных сета, причем в каждом сете позиция случая с МВ занимала такое место, чтобы была реализована возможность всестороннего анализа. Каждый сет данных разбивался на несколько частей, и каждая часть соответствовала объему ежедневной работы лаборатории и варьировала в пределах от 50 до 150 образцов.
Для каждого рабочего дня рассчитывался свой ППУ ИРТ, причем общее число образцов должно быть в пределах от 500 до 600[16]. Такая совокупность образуется при объединении результатов постановок за несколько (4–8) рабочих дней.
При вычислении (пересчете) ППУ для следующего рабочего дня некоторая часть прежних данных совокупности замещается новыми, полученными в текущий рабочий день, таким образом, чтобы соблюдался критерий 500 < n < 600. Подобное «окно» данных каждый следующий рабочий день сдвигается вправо при умозрительном расположении всех результатов на временно́й шкале (принцип «скользящего окна»). Необходимо обратить внимание на то, что для каждого сета данных ППУ вычисляется не для выборки, а для всей совокупности полученных результатов за несколько рабочих дней, что значительно повышает информационную емкость метода.
Путем последовательного отбора в качестве оптимального ПУ ИРТ был выбран 99,5 процентиль, что соответствует европейским[20] и российским[12]>/span> рекомендациям. Использование меньших значений процентилей при расчете ППУ (99-й, 95-й) показало сильное занижение порога ИРТ-1 и нецелесообразность дальнейшего моделирования с процентилями, меньшими, чем 99,5 (рис. 4). Использование алгоритма расчета ППУ ИРТ-1 для трех случаев МВ из 32 с самыми низкими цифрами ИРТ-1 (67,3; 66,8; 77,6 нг/мл) подтвердил его применимость даже для этих случаев (рис. 5).
Рис. 4. Использование программного обеспечения floating Level of IRT для расчета плавающего порогового уровня иммунореактивного трипсиногена 1 в соответствии с разными процентилями в локальной выборке из 500 образцов сухих пятен крови
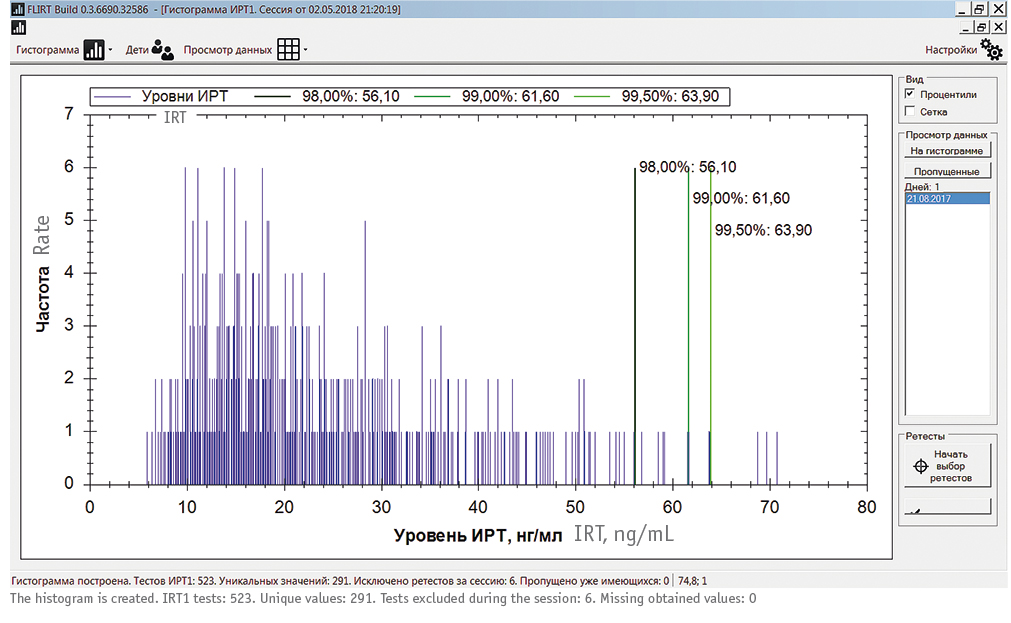
Рис. 5. Сравнение плавающего порогового уровня (ППУ) иммунореактивного трипсиногена 1 с фиксированным пороговым уровнем (ФПУ) для всех случаев муковисцидоза (МВ), выявленных в программе неонатального скрининга МВ за 2006–2017 гг. в ХМАО-Югры. Фиолетовые точки — уровни ИРТ-1 в диапазоне 60,0–90,0 нг/мл (выше 90,0 нг/мл на диаграмме не отражены); овалами выделены три случая МВ, для которых значения ППУ ИРТ-1 максимально приближены к значениям первичного теста ИРТ-1
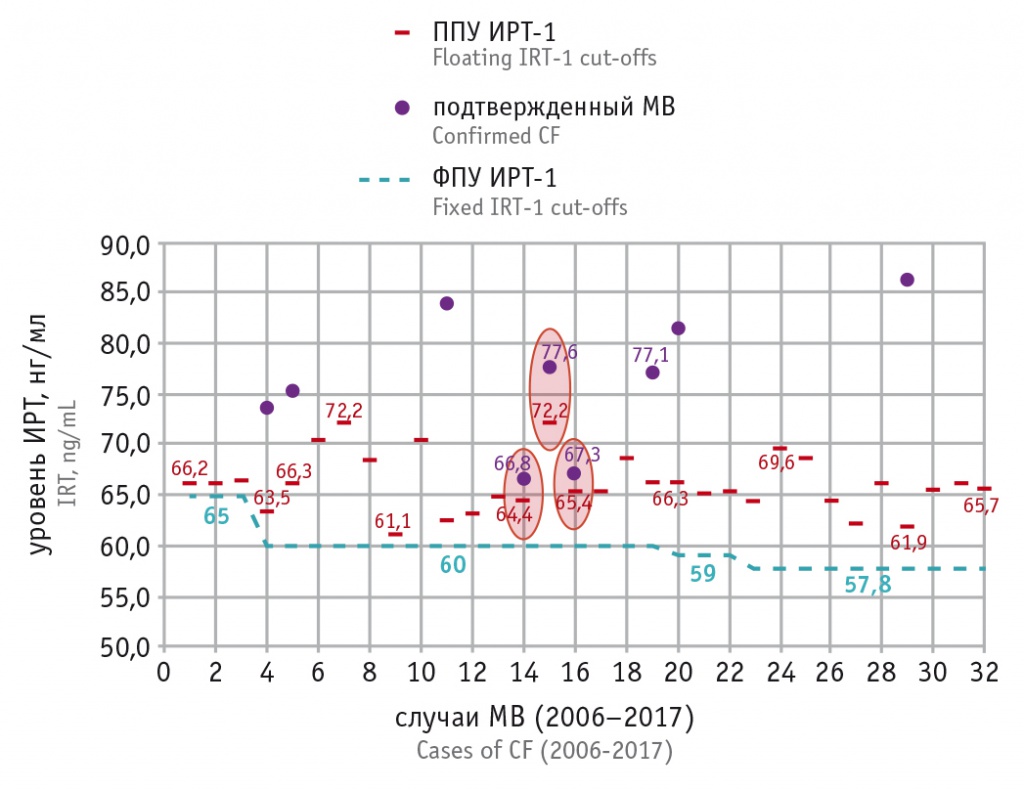
На рисунке 5 приведены ППУ ИРТ, рассчитанные для всех случаев МВ, в сравнении с фиксированными уровнями. Видно, что диапазон ППУ колеблется в пределах 61,1–72,2 нг/мл, и практически везде уровни ИРТ-1 при МВ слишком высоки, чтобы попасть в число ложноотрицательных результатов (на диаграмме обозначены только 9 таких случаев, все остальные уровни ИРТ-1 — за пределами области построения графика). Овалами выделены 3 случая МВ, при которых концентрация ИРТ-1 «вплотную» приближается к ППУ, однако во всех этих случаях ИРТ-1 > ППУ.
При анализе данных НС МВ за период 2014–2017 гг., когда применялся при расчетах ФПУ ИРТ 57,8 нг/мл, отмечено, что при использовании ППУ наблюдается значительное снижение количества результатов ИРТ-1 выше ППУ и, соответственно, количества направляемых на ретест образцов.
В течение 2018 г. проводился сравнительный анализ эффективности НС МВ с использованием двух подходов — стандартного (учет ФПУ = 57,8 нг/мл) и разработанного нами (оценка ИРТ-1 по ППУ > 99,5 процентиля), результаты представлены в таблице 2. Внедрение компьютерной программы по оценке ИРТ-1 на основе ППУ [18] позволило практически в 4 раза снизить необходимость проведения ретеста без уменьшения эффективности диагностики МВ. Всего в 2018 г. МВ впервые диагностирован у 3 детей, причем у всех этих новорожденных результат НС МВ расценен как положительный и при стандартном подходе, и при оценке показателя ИРТ-1 методом ППУ.
Таблица 2
Сравнительная оценка результатов неонатального скрининга муковисцидоза в 2018 г. при использовании фиксированного и плавающего пороговых уровней иммунореактивного трипсиногена
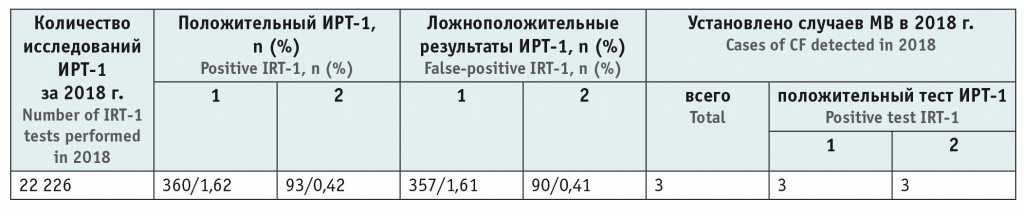
Примечание: 1 — стандартный подход (ИРТ > 57,8 нг/мл); 2 — метод плавающего порогового его уровня (ИРТ > 99,5 процентиля).
Se теста, по данным 2018 г., при использовании обоих методов оценки результатов НС МВ (ФПУ и ППУ) составила 100%, Sp при использовании ФПУ — 98,4%, ППУ — 99,6%.
Среднее значение (мода) ППУ ИРТ-1 в 2018 г. было 65,4 нг/мл против рекомендуемого изготовителем реагента ФПУ 57,8 нг/мл, минимальный ППУ — 61,9 нг/мл, максимальный — 66,2 нг/мл. Анализ НС всех случаев установленного МВ за период 2006–2018 гг. (35 детей) показал, что каждый из 35 показателей ИРТ-1 был больше соответствующего ему ППУ как при ретроспективном, так и при проспективном исследовании.
ЗАКЛЮЧЕНИЕ
Внедрение неонатального скрининга муковисцидоза (НС МВ) позволило обеспечить раннюю (уже в периоде новорожденности) диагностику заболевания и своевременно начать его базисную терапию. Ретроспективный анализ результатов НС МВ за период 2006–2017 гг. позволил установить среднемноголетнюю частоту МВ на территории ХМАО-Югры, которая составила 1 случай на 9207 живорожденных детей. Знание этого эпидемиологического показателя важно с точки зрения планирования ресурсов здравоохранения: затрат на диагностику (включая генную), дорогостоящее лечение и реабилитацию пациентов с МВ на региональном уровне.
Применение при НС МВ фиксированного порогового уровня (ФПУ) иммунореактивного трипсиногена (ИРТ) 1, рекомендованного изготовителем реагента, дает большое количество ложноположительных результатов (до 2,0% от общего числа ИРТ-1), следствием чего становятся нерациональные затраты на проведение ретеста (ИРТ-2). Негативным является и психологическое состояние родителей в ожидании повторного исследования уровня ИРТ в течение первого месяца жизни ребенка.
Разработанный метод расчета плавающего порогового уровня (ППУ) ИРТ (> 99,5 процентиля) продемонстрировал не меньшую результативность (критерий non-inferiority trial), чем традиционно используемый ФПУ ИРТ, по отсутствию ложноотрицательных результатов. Внедрение компьютерной авторской программы Floating Level of IRTV[18] по определению ППУ позволяет значительно (примерно в 4 раза) уменьшить число ложноположительных результатов, необходимость проведения ретеста и повысить специфичность теста с 98,4% до 99,6% с сохранением 100%-ной чувствительности.
Использование данной компьютерной программы максимально упрощает задачу гибкой статистической обработки данных (возможность для оператора менять по своему усмотрению размер «окна», изменять уровни процентилей и пр.). Визуализация совокупности данных на гистограмме позволяет провести наглядный контроль результатов, параллельная оцифровка результатов — аккумулировать доступную базу данных для обращений и более подробных расчетов, необходимых по каким-либо причинам в перспективе.
Благодарности: авторы выражают искреннюю благодарность ряду лиц, без которых данная работа была бы невозможна: заведующему Окружной медико-генетической консультацией (г. Сургут) Л.Н. Колбасину за информационную поддержку; врачу клинической лабораторной диагностики Н.В. Кунцевич за неоценимую помощь при оцифровке данных; IT-специалисту СурГУ И.Н. Девицыну за участие в разработке и постоянное совершенствование компьютерной программы flIRT, использованной в исследовании.
Массовое обследование (скрининг) является самым эффективным способом выявления наиболее распространенных наследственных заболеваний.
Неонатальный скрининг – исследование, проводимое в первые дни жизни ребенка, является самым эффективным способов выявления наследственных заболеваний. Именно неонатальный скрининг позволяет выявить максимальное количество заболеваний еще до появления первых симптомов. Вовремя поставленный диагноз и назначенное лечение, в свою очередь, способны остановить развитие тяжелых проявлений, ведущих к инвалидизации.
Неонатальный скрининг, нередко именуемый в РФ «пяточка», начинается в родильном доме: у каждого новорождённого берется несколько капель крови из пятки на специальный тест-бланк, который направляется в специализированную лабораторию для проведения исследования. Здоровый доношенный новорожденный допускается к скринингу на 2–5 сутки, недоношенный — на седьмой день после рождения.
В Российской Федерации до 2023 г. обязательный массовый неонатальный скрининг предполагал выявление 5 наследственных заболеваний: фенилкетонурии, врожденного гипотиреоза, врожденной дисфункции коры надпочечников, галактоземии и муковисцидоза. В ряде регионов приняты программы по расширению неонатального скрининга до 11-16 заболеваний, однако лучшие зарубежные практики предполагают расширение списка до 50-60 заболеваний.
С 31 декабря 2022 г. вступает в силу приказ №274н «ОБ УТВЕРЖДЕНИИ ПОРЯДКА ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ ПАЦИЕНТАМ С ВРОЖДЕННЫМИ И (ИЛИ) НАСЛЕДСТВЕННЫМИ ЗАБОЛЕВАНИЯМИ», согласно которому неонатальный скрининг на всей территории Российской Федерации расширяется до 36 групп нозологий.
С полным текстом приказа можно ознакомиться по ссылке: http://publication.pravo.gov.ru/Document/View/0001202207130023?ysclid=lbz0767oey298399166
В массовый неонатальный скрининг будут включены дополнительные наследственные болезни обмена (органические ацидурии, нарушения бета-окисления жирных кислот, нарушения цикла мочевины), первичные иммунодефициты, спинально-мышечная атрофия.
В приказе отражены ключевые этапы проведения расширенного неонатального скрининга:
- Для проведения неонатального скрининга на врожденные и (или) наследственные заболевания забор образцов крови осуществляют из пятки новорожденного через 3 часа после кормления, в возрасте 24 — 48 часов жизни у доношенного и на 7 сутки (144 — 168 часов) жизни у недоношенного новорожденного.
- Тест-бланки с образцами крови доставляются из медицинской организации, осуществившей забор образцов крови в медико-генетическую консультацию (центр), которые осуществляют скрининговые лабораторные исследования самостоятельно, либо в течение 24 часов отправляют образцы в медицинскую организацию, способную провести исследование.
- Время проведения скрининговых исследований составляет не более 72 часов от времени поступления тест-бланков с образцами крови в медико-генетические консультации (центры) медицинских организаций.
- Информация о результатах скрининговых исследований передается в медико-генетическую консультацию (центр) субъекта Российской Федерации по месту жительства ребенка.
- При получении результатов скрининговых исследований формируется группа детей «условно здоровых» по всем исследуемым заболеваниям и группам высокого риска врожденных и (или) наследственных заболеваний.
- Дети из группы «условно здоровые» не требуют дополнительных исследований и информирования медицинских организаций о результатах скрининговых исследований.
- В течение 24 часов после получения информации новорожденный из группы высокого риска приглашается в медико-генетическую консультацию (центр) субъекта Российской Федерации для забора образцов крови для повторного скринингового исследования в медико-генетической консультации (центре) субъекта Российской Федерации.
- При наличии медицинских показаний врач-генетик медико-генетической консультации (центра) субъекта Российской Федерации немедленно направляет новорожденного из группы высокого риска на госпитализацию в медицинскую организацию по профилю заболевания, назначает специализированные продукты лечебного питания до получения результатов повторного скринингового исследования и подтверждающей диагностики.
Для реализации программы закупается специализированное оборудование, осуществляется формирование центров для проведения диагностики и дальнейшей маршрутизации пациентов с целью оказания необходимой медицинской помощи.
При наследственных заболеваниях обмена нарушается функция ферментов, участвующих в обмене белков, жиров или углеводов. Поэтому для многих из заболеваний данной группы единственным патогенетическим лечением является диетотерапия, основанная на исключении из рациона патогенетически значимых нутриентов. Полноценного рациона у пациентов, соблюдающих с рождения строгие диетические ограничения, удается добиться за счет специализированных продуктов лечебного питания.
Симптомы наследственных болезней обмена нередко проявляются в первые дни жизни ребенка, а в дальнейшем пациентам необходимо соблюдать пожизненную диету. Это означает, что эффективность лечения вновь выявленных пациентов будет напрямую зависеть от возможности своевременного обеспечения специализированными продуктами лечебного питания.
Ниже представлены ключевые нозологии, выявляемые по программе массового неонатального скрининга с 2023 г., при которых в Российской Федерации зарегистрированы и доступны специализированные продукты производства Nutricia.
Фенилкетонурия
Основу рациона больных ФКУ составляют специализированные продукты, белок в которых замещен полноценной смесью аминокислот за исключением фенилаланина. Остальное меню составляется из низкобелковых продуктов и обычных продуктов со строгим учетом содержания в них фенилаланина.
Диета для пациентов с ФКУ должна начинаться с первых дней жизни и продолжаться пожизненно. Своевременная диагностика и адекватное лечение обеспечивают полноценную жизни пациентов и нормальное умственное развитие. Прекращение или отсутствие диетотерапии приводит к необратимым и тяжелым последствиям, глубокой инвалидизации и сокращению продолжительности жизни.
* Пищевая ценность на 100 г сухой смеси
** Пищевая ценность на 62,5 мл продукта
*** Продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей –инвалидов
Метилмалоновая ацидемия / Пропионовая ацидемия
Основной метод лечения при метилмалоновой и пропионовой ацидемии — соблюдение строгой диеты с ограничением потребления изолейцина, валина, треонина и метионина с пищей. Детям до 6 месяцев материнское молоко и детские молочные смеси полностью заменяют специальным питанием. При введении прикорма с 6 месяцев противопоказаны продукты с высоким содержанием белка: мясо, рыба, яйца, молочные продукты и бобовые.
* Пищевая ценность на 100 г сухой смеси
** Продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей –инвалидов
Глутаровая ацидемия тип I
Лечение заболевания направлено прежде всего на коррекцию метаболических нарушений. Для этого пациенту необходимо подобрать оптимальную диету, исключающую продукты, богатые лизином.
При ранней диагностике и соблюдении режима терапии у 80–90 % пациентов заболевание протекает относительно бессимптомно. При несоблюдении диеты нередко наблюдается прогрессирование развития неврологических симптомов.
* Пищевая ценность на 100 г сухой смеси
** Продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей–инвалидов
Тирозинемия тип I
Основа лечения – диета с назначением смесей, не содержащих тирозин и фенилаланин, т.к. фенилаланин – метаболический предщественник тирозина.
* Пищевая ценность на 100 г сухой смеси
** Продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей–инвалидов
Гомоцистинурия
Пациентам с гомоцистинурией рекомендована диетотерапия с применением специализированных продуктов, не содержащих метионин.
* Пищевая ценность на 100 г сухой смеси
** Продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей–инвалидов
Лейциноз (болезнь кленового сиропа)
Пациентам с лейцинозом рекомендована диетотерапия со строгим ограничением белка, в том числе грудного молока. Дефицит белка восполняется за счет специализированных продуктов, не содержащих лейцин, изолейцин и валин.
* Пищевая ценность на 100 г сухой смеси
** Продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей–инвалидов
Нарушения окисления жирных кислот
Наследственные нарушения окисления жирных кислот — группа наследственных заболеваний, при которых нарушается транспорт жирных кислот в митохондрии и их окисление:
- MCAD — Дефицит ацил-КoA-дегидрогеназы среднецепочечных жирных кислот
- LCHAD – Недостаточность длинноцепочечной З-ОН ацил КоА дегидрогеназы жирных кислот
- VLCAD – Дефицит ацил-КоА дегидрогеназы жирных кислот с очень длинной углеродной цепью
- SCAD — Дефицит ацил-КоА дегидрогеназы жирных кислот с короткой углеродной цепью
- SCHAD — Дефицит короткоцепочечной 3-гидроксиацил- КоА дегидрогеназы
Всем пациентам с VLCAD и LCHAD независимо от возраста необходим индивидуальный рацион, желательно с использованием специализированных смесей с жировым компонентом, представленным среднецепочечными триглицеридами.
* Пищевая ценность на 100 г сухой смеси
** Продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей–инвалидов
Муковисцидоз
Диетотерапия составляет важную часть комплексной терапии при муковисцидозе в связи тем, что установлена непосредственная связь между состоянием питания и функцией легких: существует прямая корреляция между показателем индекса массы тела, функцией легких и продолжительностью жизни.
Основной принцип в организации питания детей и подростков больных муковисцидозом – увеличение энергетической ценности рациона питания за счет увеличения потребления белка в 1,5 раза по сравнению с возрастной нормой и доведения жировой компоненты питания до 40-50% от общей энергетической емкости рациона.
Смеси с повышенной плотностью энергии и питательных веществ (специализированные продукты диетического (лечебного) питания)) имеют лучшее соотношение энергии и белка, более концентрированный профиль питательных микроэлементов. Своевременное назначение диетотерапии и соблюдение режима питания с применением высококалорийных смесей позволяет повысить качество жизни и снизить частоту бронхолегочных осложнений у больных с муковисцидозом.
* Пищевая ценность на 100 мл готового продукта
** Продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей–инвалидов
Реклама
ООО «Нутриция»
Pb3XmBtzszFbRWcs7gwQ7sYpsBYj2PpLK6SDeeU
Консультационную линию по проблеме муковисцидоза ведет Наталия Юрьевна Каширская (Главный научный сотрудник лаборатории генетической эпидемиологии, ФГБНУ «Медико-генетический научный центр», член рабочих групп экспертов по неонатальному скринингу и регистру Европейского общества по муковисцидозу (ECFS), д.м.н., профессор) получить консультацию
Privalov Aleksandr Nicolaevich, doctor of technical sciences, professor, priva-lov. 61@,mail.ru, Russia, Tula, Tula State Pedagogical University named after L.N. Tolstoy,
Gladkih Ilya Yurievich, postgraduate, gladkihiu@,mail. ru, Russia, Tula, Tula State Pedagogical University named after L.N. Tolstoy
УДК 519.252
АНАЛИЗ ФАКТОРОВ, ВЛИЯЮЩИХ НА ТОЧНОСТЬ РЕЗУЛЬТАТОВ МАТЕРИНСКОГО БИОХИМИЧЕСКОГО
СКРИНИНГА
Н.С. Просоедова, А.Г. Трошина
Рассмотрены и классифицированы основные факторы, учитываемые при расчете рисков развития врожденных пороков плода в ходе проведения материнского биохимического скрининга I и II триместра. Сформирована основная модель расчета рисков с учетом влияния выявленных факторов. Предложена структура автоматизированной системы для анализа результатов материнского скрининга.
Ключевые слова: материнский скрининг, пренатальный скрининг, биохимический скрининг, расчетная модель, статистический анализ.
В настоящее время все будущие мамы проходят скрининнговые исследования.Пренатальный скрининг — комплекс массовых диагностических мероприятий у беременных для поиска грубых аномалий развития и косвенных признаков (маркеров) патологии плода. В медицине под скринингом понимают простые, безопасные массовые (большой группе населения) исследования с целью выделения групп повышенного риска. Пренатальный скрининг включает в себя:
Ультразвуковой скрининг — ультразвуковое исследование (УЗИ) плода в течении беременности.
Биохимический скрининг — это определения в крови некоторых специфических веществ («маркеров»), которые изменяются при определенных патологиях [1].
Биохимический скрининг по анализу крови беременных на сывороточные маркеры служит средством формирования группы риска по хромосомной патологии плода. Фетоплацентарный комплекс, состоящий из плода и плодных оболочек (хорион, преобразующийся в плаценту, водная оболочка — амнион) вырабатывает специфические белки, проникающие в кровь беременной. Изменения состояния фетоплацентарного комплекса, происходящие по различным, том числе и генетическим, причинам, отражается на уровне специфических белков (сывороточных маркеров). В настоящее время биохимический скрининг проводится в два этапа — скрининг I триместра (10-14 недель) и скрининг II триместра (16-20 недель) [2].
227
Благодаря проведению таких исследований возможно с большой степенью вероятности выявить группы женщин с риском врожденной патологии плода. Кроме того, такие исследования совершенно безопасны как для матери, так и для будущего ребенка по сравнению с инвазивными методами.
С проведением скрининговых исследований связана проблема обеспечения точности результатов. Как показывает практика, результатам скрининга можно доверять на 70…80 %. Но в зависимости от целого ряда факторов этот процент может понижаться. Ошибки в результатах скрининга могут иметь два различных вида негативных последствий:
— при ошибочном определении высокого риска развития патологий плода для здоровой женщины может быть назначено более точное инва-зивное исследование, которое сопряжено с риском целого ряда осложнений беременности: выкидыша, развития конфликта по резус-фактору и группе крови, инфицирования плода, развития тугоухости у ребенка и т.д.;
— при ошибочном определении низкого риска развития патологий плода существует высокая вероятность не обнаружить такие патологии до рождения ребенка.
Таким образом, необходимо выделить факторы, влияющие на точность результатов скрининговых исследований. Относительно полную картину факторов, влияющих на качество расчетов, отражает диаграмма Исикавы, представленная на рис.1. Все эти факторы вносят определенный вклад в получаемые результаты исследования.
Погрешность установления нормативных параметров, обусловленная методом расчета
Погрешность установления нормативных параметров, обусловленная человеческим фактором
Нерегулярный цикл
Цикл более чем на неделю отличается от 28 дней
Беременность вскоре после родов
Точность результатов
Рис. 1. Факторы, влияющие на качество расчета рисков скринингового
исследования
Одним из факторов, влияющих на точность результатов, является неточность проведения расчетов. К сожалению, в большинстве медицинских учреждений (особенно государственных) обработка результатов
228
скрининговых исследований ведется вручную.Это связано с тем, что государственные медицинские учреждения не могут позволить себе разработку дорогостоящих автоматизированных систем (АС). Отсюда возникает ряд проблем, связанных с ручной обработкой данных:
— ручная обработка результатов скрининга требует много внимания, усилий и времени;
— сложно обеспечить должный уровень контроля точности результатов обработки;
— относительно высокая вероятность получения некорректных результатов обработки данных из-за влияния человеческого фактора;
— большинство видов отчетности выполняется медработниками вручную, что значительно повышает время и трудозатраты.
Скрининг I триместра имеет свои особенности. Он проводится в сроки 10 — 13 недель беременности и достаточно жестко ограничен по срокам. Если сдать кровь слишком рано или слишком поздно, если ошибиться в расчете сроков беременности на момент сдачи крови, точность расчета резко уменьшится. Сложности в расчете сроков беременности могут быть при нерегулярном менструальном цикле, при беременности, наступившей вскоре после родов, при цикле, более чем на неделю отклоняющегося от 28 дней.
Следует отметить, что качество реактивов — фактор, не зависящий от исследуемого материала. Он может значительно повлиять на точность получаемых результатов. В лабораторию реактивы могут поступить «свежие» — изготовленные совсем недавно или же пролежавшие на складе неопределенное количество времени. Также стоит учитывать и то, что химический состав реактивов может различаться по количественным и качественным критериям. Например, производитель может допустить к отпуску реактивы, не соответствующие нормативным документам, или же состав изменился в процессе пролеживания на складах предприятия. Весь этот комплекс факторов приводит к тому, что предоставленные производителем таблицы, на базе которых рассчитываются отклонения маркеров, не соответствуют реальному состоянию реактивов.
Пришедшие в лабораторию реактивы обычно не подвергают дополнительному контролю, так как любая процедура контроля качества влечет за собой определенные затраты. К тому же, если реактивы не закончились к моменту завершения их срока годности, их зачастую продолжают использовать вместо того, чтобы утилизировать. Это вносит дополнительные погрешности в результаты скрининговых исследований.
Из всех указанных факторов повысить точность результатов возможно только путем уменьшения погрешностей. Рассмотрим это более подробно.
Модель расчета медианных отклонений. Скрининговые исследования беременных — безопасный способ с достаточно высокой вероятностью определить, нет ли генетических патологий у ребенка на ранних этапах его развития. Но из-за многих факторов, влияющих на результат, принять решение о том, требуются ли дополнительные тесты, которые могут навредить ребенку или вовсе прервать беременность, довольно сложно, если результатам скрининга можно доверять лишь с малой вероятностью. Все перечисленные ранее факторы — лишь та часть факторов, которая известна постоянно. Многое зависит от организма матери, от общей экологической обстановки в регионе и т.д. Это приводит к тому, что нормальные значения маркеров могут быть непостоянны. В этом случае отталкиваться от табличных параметров, рекомендованных производителем реактивов, нецелесообразно, так как вероятность получить нормальные результаты резко понижается.
В связи с этим возникает задача нахождения базы для расчета, для того чтобы точность была приемлемой для принятия важных решений.
Очевидно, что наилучшие результаты могут быть получены, если рассчитать параметры, отклонения от которых и будут оцениваться при принятии решений, на основе медианных значений по результатам группы ранее обследованных женщин. Рассмотрим по порядку этапы получения результатов при таком подходе.
Рассчитывая базовые параметры, следует учитывать, что при анализе одного и того же материала с использованием разных реактивов получаем различные результаты. Отсюда делаем вывод о том, что смешивать в одну группу женщин, анализы которых делались на разных партиях реактивов, нельзя. Поэтому установим период времени, на котором производим расчеты базовых параметров в пределах времени использования одной и той же партии реактивов.
На тот момент, когда реактивы сменились, результаты скрининга, накопленные во время использования старых (предыдущих) реактивов, использовать нельзя, так как неизвестно, насколько старая партия реактивов отличается от новой. Поэтому, пока не накопится достаточное количество данных по каждой неделе беременности, необходимо производить расчеты по таблице параметров, рекомендуемой производителем. На данном этапе могут появляться большие отклонения расчетных значений от табличных. Если данные результаты повторяются при каждом новом проведенном анализе, то с высокой долей вероятности можно утверждать, что таблица некорректна. В этом случае из данных для перерасчета таблицы, которая заменит предоставленную вместе с реактивами, следует исключить только «грубые промахи» — результаты, которые резко отличаются от общей выборки.
В определенный момент времени статистических данных становится достаточно для того, чтобы рассчитать базовую таблицу параметров на их основе. Как уже было сказано ранее, необходимо исключить грубые результаты исследований из выборки. Причины необходимости этой операции в том, что значения, отклонения от которых требуются для определения рисков развития генетических патологий, должны основываться на результатах анализов только тех женщин, беременность которых протекает нормально, и ребенок развивается нормально.
Период, в течение которого велось накопление данных, назовем тестовым периодом. Тестовый период будем характеризовать как период, в течение которого не наблюдалось генетических патологий у детей и беременность женщин протекала нормально. Все дальнейшие анализы, выполненные по завершении тестового периода вынесем в отдельный период, который назовем опытным. Упрощенная структура процесса вычислений с течением времени представлена на рис.2.
Качество реактивов
Предыдущая партия реактивов
Тестовый период
Опытный период
и Дн.
Смена реактивов
Новая партия реактивов
Рис. 2. Структура процесса вычислений с течением времени
Как только грубые промахи исключены, можно рассчитать таблицу базовых параметров и заменить ею таблицу, поставляемую производителями реактивов. Далее на основе этой таблицы можно пересчитать результаты анализов, на которых базировались расчеты, и использовать при дальнейших исследованиях.
Структура автоматизированной системы расчета показателей скрининговых исследований. Для повышения точности расчетов показателей, уменьшения числа ошибок, вызванных человеческим фактором, а также сокращения временных и трудозатрат на обработку полученных результатов скрининговых исследований необходима разработка специализированной автоматизированной системы.
Такая система будет предназначена для использования врачами и лаборантами. В связи с этим система должна обладать такими функциями, как перенос данных из/в систему, формирование различных отчетных документов, и непосредственно работы с данными. Все функции системы условно можно разделить на следующие классы:
— функции аналитической обработки данных;
— функции работы с данными;
— функции взаимодействия с внешними источниками данных;
— функции генерации отчетных документов.
Расчет рисков развития пороков у плода должен быть максимально точным. Ранее был сделан вывод о том, что повысить точность результатов независимо от факторов, влияющих на нее со стороны матери, можно только за счет уточнения методов расчета отклонений параметров от медианных. Для этого требуется контролировать актуальность используемых данных, а также — точность получаемых медианных значений. В связи с этим к функциям аналитической обработки можно отнести следующие:
— автоматизированный контроль актуальности данных;
— автоматизированный контроль актуальности таблицы медиан и точности её расчета;
— прогнозирование длительности использования таблицы медиан;
— прогнозирование времени использования реактивов.
В целом, систему можно разделить на три независимых модуля, объединенных единой базой данных. Общая структура системы представлена на рис. 3.
Аналитический / вд Л Модуль экспорта/
модуль 1 исследований 1 импорта данных
а
Модуль генерации отчетов
Рис. 3. Общая структура системы
Аналитический модуль осуществляет взаимодействие с БД: внесение новых данных, изменение уже имеющихся, исключение дублирования информации, расчет всех необходимых статистических параметров для выявления отклонений в развитии плода, контроль точности производимых расчетов и прогнозирование. Данный модуль реализует автоматизированную работу с данными, которая включает автоматическое заполнение форм при наличии информации о вносимом в БД пациенте.
232
Модуль генерации отчетов отвечает за создание различных видов отчетных документов согласно параметрам, указанным пользователем системы. Доступ к данному модулю осуществляется из аналитического модуля как центрального модуля, взаимодействующего с пользователем.
Модуль импорта/экспорта данных обеспечивает внесение данных об исследованиях из внешних источников. Перенос информации осуществляется через файл формата CSV. Данный формат наиболее прост и предназначен для переноса табличных данных между разными источниками. Также предусмотрен импорт данных из excel-документов, что позволяет внести информацию в базу на начальном этапе использования программного комплекса.
При такой организации будет удобно разделить функции системы между модулями. Так, функции импорта/экспорта данных и генерации отчетных документов выделяются в отдельные модули, которые могут работать независимо от других модулей системы. Остальные же функции будут заложены в аналитический модуль.
Таким образом, в аналитическом модуле должны быть выделены следующие блоки:
— блок контроля актуальности данных;
— блок контроля точности расчета медиан;
— блок прогнозирования;
— блок расчетов.
Диаграмма компонентов модуля представлена на рис. 4.
Аналитический модуль
олок контроля
актуальности
данных
блок расчетов
77″»
блок
прогнозирования
I блок контроля I точности расчета медиан
Рис. 4. Диаграмма компонентов аналитического модуля
Основная задача блока контроля актуальности данных — отсеивание из общей статистической выборки тех исследований, которые имеют отклонения, превышающие нормальные значения хотя бы по одному из мар-
233
керов. Блок контроля точности расчета медиан необходим для перерасчета основной таблицы медиан на основе актуальных данных из выборки. Блок прогнозирования берет на себя задачу контроля периодов перерасчета таблицы медиан и позволит выявить моменты, когда реактивы становятся непригодными. Блок расчетов — общий блок, к которому могут обращаться другие блоки модуля, чтобы рассчитать требуемые данные и параметры.
Поскольку результаты биохимического материнского скрининга-важны, так как на их основе с большой долей вероятности можно оценить риски развития патологий и возможных проблем протекания беременности женщины, и соответственно принять решение о проведении дополнительных анализов, которые имеют более высокие риски нанесения вреда плоду или прерывания беременности, необходимо стремиться к наивысшей точности результатов исследований. Повысить точность результатов возможно за счет автоматизации процесса расчетов и учета статистических данных отклонений проверяемых маркеров от нормативов.
Список литературы
1. Блог акушера-гинеколога Владимира Сурякова [электронный ресурс] // Пренатальный скрининг [сайт]. URL: http://www.sursyakov.ru/ prenatalnyj-skrining.html (дата обращения: 18.12.2015).
2. Всероссийский медицинский портал «On-line диагноз» [электронный ресурс] // Биохимический скрининг [сайт]. URL: http://online-diagnos.ru/analiz/prenatalniy-skrining (дата обращения: 18.12.2015).
Просоедова Надежда Сергеевна, магистрант, nadezhda. sergienko 7116@yan-dex.ru, Россия, Тула, Тульский государственный университет,
Трошина Анна Геннадьевна, канд. техн. наук, доц., atroshina@,mail.ru, Россия, Тула, Тульский государственный университет
ANALYSIS OF FACTORS INFLUENCES TO AN ACCURACY OF THE MATERNAL BIOCHEMICAL SCREENING RESULTS
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
N.S. Prosoedova, A.G. Troshina
Base factors, that are taken into consideration when maternal biochemical screening for the I or II trimester is held and calculations risks of malformation of the fetus are performed, were considered and classified. The base model of the risks calculations was formed with the consideration of the identified factors.It was offered thestructureoftheautomatedsys-temfor analysis of the results of maternal screening.
Key words: maternal screening, prenatal screening, biochemical screening, model of calculations, statistic model.
Prosoedova Nadezhda Sergeevna, master, nadezhda. sergienko 7116@yandex. ru, Russia, Tula, Tula State University,
Troshina Anna Gennad’evna, сandidate of technical sciences, docent, atroshi-na@mail.ru, Russia, Tula, Tula State University
УДК 004.383.3
МАТЕМАТИЧЕСКОЕ И ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ ЛОГИЧЕСКОГО ПРОЕКТИРОВАНИЯ ОБЛАЧНЫХ НЕЙРОКОМПЬЮТЕРНЫХ СИСТЕМ
В. А. Романчук, В.Н. Ручкин
Предложена математическая модель облачной вычислительной системы на базе концептуально нового поколения вычислительной техники — нейропроцессоров. Показано разработанное программное обеспечение для логического проектирования и организации сложных, распределенных и облачных нейрокомпьютерных систем.
Ключевые слова: вычислительная система, облачные вычисления, логическое проектирование, нейропроцессор, нейрокомпьютер.
Идея облачных вычислений появилась еще в 1960 году, когда Джон Маккарти высказал предположение, что когда-нибудь компьютерные вычисления будут производиться с помощью «общенародных утилит». Считается, что идеология облачных вычислений получила популярность с 2007 года благодаря быстрому развитию каналов связи и стремительно растущим потребностям пользователей.
Под облачными вычислениями (от англ. cloud computing, также используется термин «облачная (рассеянная) обработка данных») обычно понимается предоставление пользователю компьютерных ресурсов и мощностей в виде интернет-сервиса. Таким образом, вычислительные ресурсы предоставляются пользователю в «чистом» виде, и пользователь может не знать, какие компьютеры обрабатывают его запросы, под управлением какой операционной системы это происходит и т.д.
В настоящее время крупные вычислительные облака состоят из тысяч серверов, размещенных в центрах обработки данных (ЦОД). Они обеспечивают ресурсами десятки тысяч приложений, которые одновременно используют миллионы пользователей [1, 2]. Облачные технологии являются удобным инструментом для предприятий, которым слишком дорого содержать собственные ERP, CRM или другие серверы, требующие приобретения и настройки дополнительного оборудования [3].
Необходимость массового обследования (скрининг) новорожденных на ряд врожденных заболеваний связана с тем, что в первые дни (недели) жизни отсутствует выраженная клиническая картина, достаточная для диагностики и своевременного начала лечения заболевания, а его выявление в процессе скриннинга позволяет предотвратить серьезные последствия для жизни и здоровья ребенка. Впервые в мире массовое обследование новорожденных было проведено в 1962 г. в США в штате Массачусетс: в сухих пятнах крови новорожденных начали определять уровень фенилаланина и диагностировать фенилкетонурию (ФКУ) в первые дни жизни ребенка [1]. Скриннинг новорожденных на ФКУ явился прорывом в области ранней диагностики наследственных заболеваний. Методы сбора крови, ее транспортировки, порядок обследования и организация лабораторной службы легли в основу разработки и внедрения неонатального скрининга на другие социально значимые заболевания и, прежде всего (учитывая частоту встречаемости заболевания), на врожденный гипотиреоз (ВГ). Впервые скрининг на ВГ организовали и осуществили в Квебеке (Канада) в 1974 г. Жан-Клод Дюссо и К. Лаберже [2], которые в сухих пятнах крови на фильтровальной бумаге определяли уровень Т4 с помощью радиоиммунологического анализа. Через 2 года в связи с высокой частотой ложно отрицательных результатов определение общего Т4 заменили на определение ТТГ в крови на 5-й день жизни [3]. В 1980 г. скрининг новорожденных на ВГ проводился уже в 36 центрах 12 стран Европы [4—6]. К 1992 г. во всем мире были обследованы около 50 млн детей и диагноз ВГ был установлен каждому из 3000—4000 новорожденных [7].
Организация, внедрение, проведение и мониторинг скрининга в любой стране требуют обязательного участия правительственных (и/или неправительственных) организаций, отвечающих за неукоснительное выполнение всех этапов массового обследования. Необходимы организация равной доступности процедуры скрининга для всех новорожденных и постоянный контроль за своевременностью назначения и проведения лечения. Тесты должны проводиться в специализированных лабораториях обученными специалистами, обладающими необходимой информационной и иной поддержкой. Важным мероприятием, во многом определяющим результаты и эффективность скрининга, является информирование населения о его значении и необходимости.
В нашей стране скрининг на ВГ начал внедряться поэтапно, начиная с 1994 г., сначала на отдельных «пилотных» территориях, число которых постоянно увеличивалось. С 2006 г. в рамках реализации приоритетного национального проекта «Здоровье» скрининг проводится на всей территории страны. В 1994 г. основным документом, регламентирующим организацию и проведение скрининга, был приказ Минздрава Российской Федерации №316 «О дальнейшем развитии медико-генетической службы Минздрава РФ» от 30.12.93. Были выпущены методические пособия по проведению скрининга [8, 9]. В настоящее время в Российской Федерации скрининг новорожденных проводится в соответствии с Приказом Минздравсоцразвития России №185 «О массовом обследовании новорожденных детей на наследственные заболевания» от 22.03.06. На основании этого приказа во всех субъектах Российской Федерации приняты территориальные ведомственные нормативные акты. Регулирование организационных вопросов скрининга осуществляется на основании распоряжения глав администраций субъектов РФ и муниципальных образований. Вопросы, касающиеся скрининга новорожденных, отражены и в «Порядке оказания неонатологической медицинской помощи» — приказе Минздравсоцразвития России №409н от 01.06.10. В 2014 г. профессиональным сообществом были приняты клинические рекомендации (Протокол) по ведению детей с ВГ [10], разработанные с учетом опыта наблюдения за пациентами с ВГ в Российской Федерации [11—14] и мире [15].
Цель исследования — проанализировать результаты неонатального скрининга на ВГ в Российской Федерации, оценить охват новорожденных скринингом во временном и территориальном аспектах.
Материал и методы
Дизайн исследования
Проведено наблюдательное ретроспективное исследование с анализом статистических данных о результатах неонатального скрининга на ВГ в Российской Федерации в 1997—2015 гг. (исключая 2005 г.).
Критерии соответствия
В исследование включали статистические отчеты территориальных органов управления здравоохранением (ТОУЗ), в которых имелись данные о количестве новорожденных, количестве обследованных и выявленных случаев ВГ в каждой отдельно взятой территории Российской Федерации за 18-летний период (в связи с недостаточной информативностью данные 2005 г. были исключены из анализа).
Условия проведения
Исследование проведено на базе Минздрава России (обрабатывались бумажные отчеты ТОУЗ о работе медико-генетической службы регионов, ежемесячно предоставляемые в Минздрава России), НИУ «Высшая школа экономики» (формирование электронной базы данных и статистический анализ) и в ФГБУ «НМИЦ эндокринологии» Минздрава России (разработка концепции, анализ полученных данных, описание результатов).
Продолжительность исследования
Исследование (сбор и обработка информации, статистический анализ данных) проведено в 2016 г.
Методика исследования
Данные (число новорожденных, обследованных и выявленных случаев заболевания) из ежегодных отчетов ТОУЗ были перенесены в электронную базу. Таким образом, материалом для проведенного анализа послужила совокупная выборка, содержащая данные о числе родившихся, обследованных новорожденных и количестве выявленных случаев ВГ в каждом субъекте Российской Федерации за 18-летний период с 1997 по 2015 г. (исключая 2005 г.). С 1997 по 2015 г. федеративное устройство нашей страны претерпело ряд изменений (произошло объединение некоторых территорий в один субъект, были вновь образованы два федеральных округа (ФО) — в 2010 г. Северо-Кавказский (выделен из состава Южного) и в 2015 г. — Крымский). В связи с этим для унификации данных все имеющиеся показатели были приведены к федеративному устройству по состоянию на 2015 г. Таким образом, сравнительный анализ проводился для 8 ФО и 83 субъектов Российской Федерации (данные по Крымскому ФО представлены отдельной строкой и только за 2015 г.).
Этическая экспертиза
Данная работа одобрена Локальным этическим комитетом ФГБУ «Эндокринологический научный центр» Минздрава России, протокол №6 от 13.05.15.
Статистический анализ
Статистическая обработка данных проводилась с использованием пакета программ Stata («Stata Corporation», США). Заболеваемость ВГ рассчитывалась за каждый календарный год, отдельно для каждого их 83 субъектов Российской Федерации, ежегодно для каждого ФО и в целом для Российской Федерации. Заболеваемость представлена в формате 1:Х, где X=A:B, А — число обследованных новорожденных за один календарный год, В — количество выявленных случаев ВГ за тот же календарный год.
Для изучения связи абсолютного числа выявленных случаев заболевания с долей (%) охвата новорожденных скринингом был выполнен линейный регрессионный анализ панельных данных в пакете прикладных программ Stata [16]. Панельные данные представляют собой двумерные массивы, одна из размерностей которых имеет временную интерпретацию (календарный год), а вторая — пространственную (субъекты РФ). Выбор типа модели (модель со случайными эффектами) осуществлялся на основании теста Хаусмана. В качестве так называемых фиктивных переменных были включены территориальные (ФО) и временные (4—5-летний интервал) двоичные переменные. Для проверки наличия случайных ошибок регрессионной модели применялся тест Бройша—Пагана. В дальнейшем проблема гетероскедастичности решалась двумя способами. Во-первых, было применено логарифмирование зависимой переменной (количество выявленных случаев заболевания) с целью снижения дисперсии, во-вторых, регрессионный анализ был проведен отдельно для двух интервалов, в зависимости от процента охвата скринингом (1 интервал — охват скринингом от 0 до 69%, и 2 — от 70 до 100%). Проверка значимости отличия коэффициентов уравнения от нуля проводилась при помощи статистики Вальда.
Результаты и обсуждение
В Российской Федерации ТТГ новорожденных определяют в медико-генетических лабораториях. Существует достаточно строгая система правил, стандартов и мер безопасности, которым должны отвечать лаборатории, осуществляющие анализ присланных образцов. В 1994 г. к началу скрининга на ВГ в России функционировали всего 32 медико-генетические лаборатории. За некоторыми из них были «закреплены» 7—9 близлежащих территорий. Наибольшая нагрузка приходилась на лаборатории, находящиеся в Красноярске, Ставрополе, Хабаровске и Нижнем Новгороде. Спустя 10 лет (2004) количество лабораторий, осуществляющих анализы, увеличилось до 48, а в 2014 г. — до 79. Таким образом, на начало 2014 г. не имели на своей территории собственных лабораторий только 4 субъекта Российской Федерации (Магаданская область, Ненецкий и Чукотский автономные округа, Еврейская автономная область). После включения Крыма в состав Российской Федерации количество лабораторий увеличилось до 80 (лаборатория в Крыму находится в Симферополе и в ней обследуются все новорожденные Крымского ФО, включая город федерального значения Севастополь).
Заболеваемость ВГ и охват новорожденных скринингом в Российской Федерации
Данные о доле (%) новорожденных, вовлеченных в скрининг на ВГ, и о количестве выявленных случаев заболевания в целом по Российской Федерации представлены в табл. 1. Можно видеть, что с 1997 г. ежегодно увеличивалось количество регионов, проводящих скрининг на ВГ на своей территории; отмечался положительный тренд охвата новорожденных скринингом на ВГ (исключение составил 2004 г.). Заболеваемость ВГ в целом по стране значительно варьировала: от 1 случая на 2909 новорожденных в 1999 г. до 1 случая на 4307 новорожденных в 2003 г.
Таблица 1. Доля (%) охвата новорожденных скринингом на ВГ, заболеваемость ВГ (совокупно по РФ) и количество субъектов РФ, проводящих скрининг
|
Год |
Доля охвата скринингом на ВГ, % |
Выявлено случаев ВГ |
Заболеваемость ВГ |
Количество субъектов РФ, проводящих скрининг |
|
1997 |
67,9 |
273 |
1:2992 |
72 |
|
1998 |
80,1 |
280 |
1:3938 |
77 |
|
1999 |
68,6 |
300 |
1:2909 |
77 |
|
2000 |
89,4 |
310 |
1:3556 |
76 |
|
2001 |
88,3 |
289 |
1:3969 |
80 |
|
2002 |
91,1 |
381 |
1:3279 |
81 |
|
2003 |
94,4 |
343 |
1:4307 |
80 |
|
2004 |
78,6 |
147 |
1:4274 |
59 |
|
2006 |
91,8 |
356 |
1:3672 |
83 |
|
2007 |
84,8 |
368 |
1:3626 |
83 |
|
2008 |
95,0 |
426 |
1:3683 |
83 |
|
2009 |
89,4 |
471 |
1:3271 |
83 |
|
2010 |
91,4 |
485 |
1:3359 |
83 |
|
2011 |
88,5 |
404 |
1:3902 |
83 |
|
2012 |
99,8 |
512 |
1:3689 |
83 |
|
2013 |
98,0 |
490 |
1:3695 |
83 |
|
2014 |
98,5 |
534 |
1:3516 |
83 |
|
2015 |
99,1 |
498 |
1:3838 |
85 |
|
Итого |
6867 |
1:3617 |
Начиная с 2006 г., ситуация с неонатальным скринингом в стране кардинально изменилась. В первую очередь это было связано с реализацией приоритетного национального проекта «Здоровье». В последнее десятилетие (2006—2015) скрининг на ВГ проводился во всех 83 субъектах Российской Федерации (с середины 2014 г. — в 85 субъектах). Принципиально изменилась и доля охвата новорожденных скринингом: в подавляющем большинстве территорий этот показатель стабильно превышал 90%, а после 2012 г. не опускался ниже 98%. Максимальный охват новорожденных (99,8%) скринингом наблюдался в 2012 г.
В последние 10 лет (2006—2015) ежегодно в результате неонатального скрининга на ВГ диагностируется свыше 350 новых случаев заболевания: от 356 случаев в 2006 г. до 534 случаев в 2014 г. Отмечается стойкая тенденция к ежегодному увеличению вновь выявленных случаев ВГ, связанная, с одной стороны, с увеличением рождаемости, а с другой — с возрастающей долей охвата новорожденных. Заболеваемость ВГ за анализируемый 18-летний период в Российской Федерации в различных ФО варьирует от 1:2379 в Уральском ФО до 1:4752 в Северо-Кавказском ФО; различается и охват новорожденных скринингом в различных территориальных округах. Обобщенные данные по охвату новорожденных и выявленным случаям заболевания в ФО представлены в табл. 2.
Таблица 2. Охват новорожденных скринингом и заболеваемость ВГ по ФО (совокупно за 1997—2015 гг., исключая 2005 г.)
|
ФО |
Доля охвата скринингом, % |
Количество выявленных случаев |
Заболеваемость |
|
Уральский |
93,3 |
991 |
1: 2379 |
|
Приволжский |
95,6 |
1533 |
1:3376 |
|
Центральный |
99,9 |
1681 |
1: 3665 |
|
Сибирский |
93,9 |
962 |
1: 3875 |
|
Южный |
97,7 |
560 |
1:4107 |
|
Северо-Западный |
96,0 |
520 |
1:4271 |
|
Дальневосточный |
96,0 |
265 |
1:4508 |
|
Северо-Кавказский |
81,7 |
350 |
1:4752 |
|
Крымский (только 2015 год) |
82,5 |
5 |
1:4891 |
Наименьший совокупный охват новорожденных скринингом на ВГ отмечается в Северо-Кавказском ФО (81,7%); в этом же федеральном округе регистрируется и наименьшая заболеваемость ВГ (1:4752). Максимальный охват скринингом наблюдался в Центральном ФО, где выявлено и наибольшее абсолютное количество случаев заболевания — 1681.
В табл. 3 представлены данные о ежегодной заболеваемости ВГ в различных ФО Российской Федерации за 18-летний период. Наибольшая заболеваемость ВГ в России наблюдается в Уральском ФО (1:2379). Этот показатель в Уральском регионе регистрируется практически на протяжении всего периода наблюдения (от 1:1711 в 1999 г. до 1:3231 в 2015 г.), исключение составляли 2003—2004 гг., когда этот показатель в УФО составлял 1:6074 и 1:6071 соответственно. Близкие показатели заболеваемости ВГ отмечаются в Дальневосточном (1:4508), Северо-Западном (1:4271) и Южном (1:4107) ФО. В Центральном, Приволжском и Сибирском ФО регистрируется умеренная заболеваемость ВГ (1: 3665, 1:3376 и 1: 3875 соответственно).
Таблица 3. Заболеваемость ВГ в различных ФО Российской Федерации (1997—2015 гг.)
|
Год |
Федеральные округа |
||||||||
|
ДФО |
ПФО |
СЗФО |
СКФО |
СФО |
УФО |
ЦФО |
ЮФО |
КФО |
|
|
1997 |
1:5307 |
1:1764 |
1:3756 |
1:2789 |
1:4836 |
1:3743 |
1:3299 |
1:3556 |
– |
|
1998 |
1:4520 |
1:2587 |
1:4177 |
1:3144 |
1:5197 |
1:2096 |
1:5847 |
1:5677 |
|
|
1999 |
1:5076 |
1:2371 |
1:3875 |
1:2178 |
1:2226 |
1:1711 |
1:4062 |
1:4910 |
|
|
2000 |
1:5468 |
1:2868 |
1:4604 |
1:5842 |
1:3595 |
1:1963 |
1:4410 |
1:3805 |
|
|
2001 |
1:6354 |
1:3755 |
1:3881 |
1:3612 |
1:3384 |
1:2101 |
1:6021 |
1:5188 |
|
|
2002 |
1:4008 |
1:2697 |
1:5139 |
1:3617 |
1:3177 |
1:1794 |
1:4482 |
1:4327 |
|
|
2003 |
1:2556 |
1:4291 |
1:4566 |
1:5041 |
1:4972 |
1:6074 |
1:3493 |
1:4099 |
|
|
2004 |
1:9006 |
1:3827 |
1:5816 |
1:3375 |
1:5424 |
1:6071 |
1:3250 |
1:4668 |
|
|
2006 |
1:4591 |
1:4183 |
1:3785 |
1:4815 |
1:4602 |
1:1350 |
1:3903 |
1:9789 |
|
|
2007 |
1:5767 |
1:4173 |
1:6047 |
1:3513 |
1:4016 |
1:1809 |
1:3518 |
1:3644 |
|
|
2008 |
1:6069 |
1:3942 |
1:5560 |
1:5599 |
1:4800 |
1:1860 |
1:3037 |
1:4696 |
|
|
2009 |
1:5729 |
1:3565 |
1:3779 |
1:5037 |
1:4082 |
1:1744 |
1:2854 |
1:4297 |
|
|
2010 |
1:3034 |
1:3456 |
1:3187 |
1:6961 |
1:4783 |
1:1978 |
1:3033 |
1:3619 |
|
|
2011 |
1:5070 |
1:3831 |
1:3864 |
1:4271 |
1:4536 |
1:2707 |
1:4292 |
1:3454 |
|
|
2012 |
1:3769 |
1:3560 |
1:4228 |
1:6577 |
1:3194 |
1:2847 |
1:3901 |
1:3499 |
|
|
2013 |
1:3683 |
1:4085 |
1:3801 |
1:4985 |
1:4003 |
1:3111 |
1:3392 |
1:3673 |
|
|
2014 |
1:4284 |
1:3194 |
1:4627 |
1:5906 |
1:4071 |
1:2547 |
1:3222 |
1:3430 |
|
|
2015 |
1:6146 |
1:3616 |
1:4429 |
1:6627 |
1:3360 |
1:3231 |
1:3574 |
1:3910 |
1:4891 |
|
1997—2015 |
1:4508 |
1:3376 |
1:4271 |
1:4752 |
1:3875 |
1:2379 |
1:3665 |
1:4107 |
Абсолютное количество случаев заболевания на каждой отдельно взятой территории существенно варьирует. В первую очередь это связано с различной рождаемостью. Так, в небольших по населению территориях, часто отмечается отсутствие выявленных случаев ВГ в отдельно взятом календарном году. В среднем за весь рассматриваемый период в каждом субъекте Российской Федерации выявляется 4,76 случая ВГ в год. Самое большое число новорожденных с ВГ ежегодно отмечается в Москве, где, например, в 2009 г., было диагностировано 85 новых случаев заболевания (это максимальное количество случаев ВГв отдельно взятом субъекте за весь период наблюдения).
Анализ связи между долей (%) охвата новорожденных скринингом на ВГ и количеством выявленных случаев
Очевидно, что неполный охват новорожденных процедурой скрининга может приводить к тому, что некоторое количество случаев врожденного гипотиреоза не будет своевременно выявлено. Представленные выше результаты демонстрируют положительную динамику охвата новорожденных скринингом на ВГ. На рисунке представлена диаграмма доли новорожденных, по разным причинам не вовлеченных в скрининг на ВГ в анализируемые годы, причем логарифмический тренд с высокой долей объясняемой дисперсии (66%) демонстрирует снижение этого показателя, стремящегося к нулю.
Доля (%) новорожденных, не вовлеченных в скрининг на ВГ, по годам наблюдения. Логарифмический тренд показывает снижение этого показателя.
С целью изучения связи между долей охвата новорожденных скринингом и количеством выявленных случаев заболевания был проведен регрессионный анализ по панельным данным 83 субъектов РФ за 16 лет. Перед анализом проверялась гипотеза о наличии гетероскедастичности (в данном случае — увеличении дисперсии числа случаев ВГ при увеличении доли охвата скринингом) с помощью теста Бройша—Пагана, который подтвердил ее наличие. Проблема гетероскедастичности была решена двумя способами. Во-первых, было применено логарифмирование зависимой переменной (количество случаев заболевания) с целью снижения дисперсии, при этом из анализа были исключены значения с нулевым значением выявленных случаев, что привело к уменьшению числа наблюдений. Во-вторых, регрессионный анализ был проведен отдельно для двух интервалов охвата скринингом (0—69 и 70—100%).
При регрессионном анализе построено 6 моделей; его основные результаты представлены в табл. 4. Они свидетельствуют о том, что зависимость между абсолютным числом выявленных случаев и долей охвата новорожденных скринингом присутствует как в целом, так и на каждом из двух выбранных интервалов охвата скринингом. Увеличение охвата на один процентный пункт приводит к тому, что в год выявляется больше на 3,784 случая заболевания в каждом субъекте РФ.
Важно отметить, что увеличение охвата скринингом на один процентный пункт в интервале охвата от 0 до 70% дает прирост выявляемых случаев 3460, тогда как в интервале от 70 до 100% прирост увеличивается почти в 2 раза, составляя 6761 случай. Иными словами, каждый процентный пункт охвата после 70% очень ценен. Аналогичная ситуация наблюдается и при исследовании зависимости между логарифмом числа выявленных случаев и охватом новорожденных. Проведенный регрессионный анализ свидетельствует о том, что зависимость между долей охвата новорожденных скринингом и количеством выявленных случаев заболевания вряд ли может считаться линейной, поэтому при организации неонатального скрининга на ВГ необходимо стремиться к максимально полному охвату всех новорожденных.
Таблица 4. Результаты регрессионного анализа числа случаев ВГ с учетом охвата скринингом
|
Показатель |
Зависимая переменная — число случаев ВГ |
Зависимая переменная — логарифм числа случаев ВГ |
||||
|
Охват скринингом, % |
0—100 |
0—69 |
70—100 |
0—100 |
0—69 |
70—100 |
|
Значения отклика регрессии |
3,784 |
3,460 |
6,761 |
0,924 |
0,758 |
1,418 |
|
Количество |
1115 |
199 |
916 |
903 |
143 |
760 |
|
Значение критерия Вальда |
107 |
38,14 |
68,84 |
126,18 |
26,10 |
77,25 |
|
p модели |
<0,001 |
<0,05 |
<0,001 |
<0,001 |
<0,1 |
<0,001 |
Заключение
За 1997—2015 гг. (исключая 2005 г.) в Российской Федерации в результате неонатального скрининга выявлено 6867 детей с ВГ; заболеваемость составила 1 на 3617 новорожденных (от 1 на 2379 до 1 на 4752 в различных ФО). Охват неонатальным скринингом на ВГ варьирует по годам и территориям: от 67,9% (в 1997 г.) до 99,8% (в 2012 г.) и от 81,7% (в СКФО) до 99,9% (в ЦФО). Заболеваемость ВГ различается по территориям: чаще всего, по данным скрининга, ВГ диагностируется в Уральском ФО, реже всего — в Северо-Кавказском ФО. При увеличении доли охвата новорожденных скринингом свыше 70% каждый следующий процент охвата позволяет выявить 6—7 новых случаев заболевания. Проведенный анализ свидетельствует о необходимости дальнейшего изучения особенностей заболеваемости ВГ в различных регионах Российской Федерации и совершенствовании организации неонатального скрининга на ВГ.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование проведено при поддержке ФГБУ «НМИЦ эндокринологии» Минздрава России.
Благодарности. Авторы благодарны всем медицинским работникам, вовлеченным в процесс организации и проведения скрининга на врожденный гипотиреоз: врачам акушерам-гинекологам, неонатологам, медицинским сестрам, лаборантам, врачам генетикам, педиатрам, детским эндокринологам, организаторам здравоохранения.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов:
Концепция и дизайн исследования — Дедов И.И., Петеркова В.А.; концепция и дизайн исследования, анализ полученных данных, написание текста — Безлепкина О.Б.; сбор материала — Байбарина Е.Н., Чумакова О.В., Караваева О.В.; анализ полученных данных, статистическая обработка материала — Вадина Т.А., Безлепкин А.С.
1. Guthrie R, Susi A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics. 1963;32:338-343.
2. Dussault JH, Coulombe P, Laberge C, et al. Preliminary report on a mass screening program for neonatal hypothyroidism. J Pediatr. 1975;86(5):670-674. doi: 10.1016/s0022-3476(75)80349-0
3. Fisher DA, Burrow GN, Dussault JH, et al. Recommendations for screening programs for congenital hypothyroidism. Am J Med. 1976;61(6):932-934. doi: 10.1016/0002-9343(76)90417-4
4. Newborn committee european thyroid association. Neonatal screening for congenital hypothyroidism in Europe. Eur J Endocrinol. 1979;92(1 Suppl):NP-S29. doi: 10.1530/acta.0.090S0NP
5. Delange F, Beckers C, Hofer R, et al. Progress report on neonatal screening for congenital hypothyroidism in Europe. In: Burrow GN, Dussault JH, editors. Neonatal thyroid screening. New York: Raven Press; 1980;107-131.
6. Fisher DA. Second international conference on neonatal thyroid screening: progress report. J Pediatr. 1983;102(5):653-654. doi: 10.1016/s0022-3476(83)80228-5
7. Delange F. Neonatal screening for congenital hypothyroidism results and perspectives. Horm Res. 1997;48(2):51-61. doi: 10.1159/000185485
8. Скрининг программа ранней диагностики и лечения врожденного гипотиреоза у детей. Методические рекомендации. / Под ред. Дедова И.И., Петерковой В.А., Безлепкиной О.Б. — М. 1996. [Dedov II, Peterkova VA, Bezlepkina OB, editors. Skrining programma ranney diagnostiki i lecheniya vrozhdennogo gipotireoza u detey. Guidelines. Moscow. 1996. (In Russ.)].
9. Врожденный гипотиреоз у детей. Национальный скрининг, диагностика и лечение. Методические рекомендации. / Под ред. Дедова И.И., Петерковой В.А., Безлепкиной О.Б. — М. 2006. [Dedov II, Peterkova VA, Bezlepkina OB, editors. Vrozhdennyy gipotireoz u detey. Natsional’nyy skrining, diagnostika i lechenie. Guidelines. Moscow. 2006. (In Russ.)].
10. Федеральные клинические рекомендации (протоколы) по ведению детей с эндокринными заболеваниями. / Под ред. Дедова И.И., Петерковой В.А. — М.: Практика; 2014. [Dedov II, Peterkova VA, editors.Federal’nye klinicheskie rekomendatsii (protokoly) po vedeniyu detey s endokrinnymi zabolevaniyami. Moscow: Praktika; 2014. (In Russ.)].
11. Ходунова A.A., Байков А.Д., Безлепкина О.Б., Петеркова В.А. Скрининг врожденного гипотиреоза в Российской Федерации. / Всероссийская научно-практическая конференция «Скрининг врожденного гипотиреоза в РФ. Опыт, проблемы, пути оптимизации». М. 2005. [Hodunova AA, Baikov AD, Bezlepkina OB, Peterkova VA. Skrining vrozhdennogo gipotireoza v Rossiyskoy Federatsii. In: Proceedings of the Russian Scientific-Practical Conference «Skrining vrozhdennogo gipotireoza v RF. Opyt, problemy, puti optimizatsii». Moscow. 2005. (In Russ.)].
12. Вадина Т.А. Врожденный гипотиреоз: эпидемиология, структура и социальная адаптация: Дис. … канд. мед. наук. — М. 2011. [Vadina TA. Congenital hypothyroidism: epidemiology, structure and social adaptation. Moscow. 2011. (In Russ.)].
13. Климентьева М.М. Эффективность ранней диагностики и реабилитации детей с врожденным гипотиреозом: Дис. … канд. мед. наук. — Пермь. 2006. [Klimentieva MM. Effektivnost’ ranney diagnostiki i reabilitatsii detey s vrozhdennym gipotireozom. [dissertation] Perm’. 2006. (In Russ.)].
14. Матулевич С.А. Массовый скрининг новорожденных на наследственные болезни обмена как часть системы медико-генетической помощи населению: Дис. … д-ра мед. наук. — M. 2009. [Matulevich SA. Massovyy skrining novorozhdennykh na nasledstvennye bolezni obmena kak chast’ sistemy mediko-geneticheskoy pomoshchi naseleniyu. [dissertation] Moscow. 2009. (In Russ.)].
15. Leger J, Olivieri A, Donaldson M, et al. European Society for Paediatric Endocrinology consensus guidelines on screening, diagnosis, and management of congenital hypothyroidism. J Clin Endocrinol Metab. 2014;99(2):363-384. doi: 10.1210/jc.2013-1891
16. Ратникова Т.А. Анализ панельных данных в пакете «STATA». — М. 2004. [Ratnikova TA. Analiz panel’nykh dannykh v pakete «STATA».Moscow. 2004. (In Russ.)].
В самом начале должны открыть правду — в медицине НИЧЕГО не бывает на 100%. Априори ни один метод диагностики и скрининга патологий плода не превышает точность 99.9999% Потому что медицина, генетика, биология, биоинформатика и прочие науки постоянно развиваются, всегда появляются новые теории и методы, что оставляет ученым всегда право на ошибку. В структуре хромосомной патологии человека 45% случаев относятся к анеуплоидиям половых хромосом, а 25% приходится на группу аутосомных трисомий, самыми частыми из которых являются трисомии по хромосомам 21, 18, 13 [1].
Клиническая картина хромосомных патологий:
- врожденные пороки развития,
- малые аномальные развития,
- умственная отсталость;
- неврологическая,
- психиатрическая,
- гематологическая патология,
- нарушения слуха,
- зрения.
Хромосомные аномалии одна из самых актуальных проблем здравоохранения, по данным ВОЗ:
- 0,8% всех новорождённых,
- 40% новорожденных с множественными пороками развития,
- 15% детей с умственной отсталостью,
- 7% случаев мертворождений,
- ХА причина 70% случаев инвалидности у детей,
- нет лечения социальная дезадаптация
По состоянию на 2021 год в России применяется несколько методов определения генетических патологий плода:
Ранний пренатальный скрининг
Инвазивная диагностика
Неинвазивное пренатальное тестирование
Ранний пренатальный скрининг
Или по другому комбинированный скрининг I триместра. В России широкое применение РПС по международному стандарту было инициировано Минздравсоцразвития России только в 2009 г. с поэтапным внедрением нового алгоритма диагностики хромосомных патологий плода в субъектах страны в период с 2010 по 2014 [1].
Данный вид диагностики был разработан фондом медицины плода (FMF) и подразумевает под собой проведение ультразвукового исследования и анализа сывороточных маркеров материнской крови (бетта-ХГЧ и PAPP-A). Расчет риска, с учетом индивидуальных особенностей беременной (возраст матери и срок беременности) происходит с помощью унифицированной программы “Astraia” (Астрайя).
Каждая беременная женщина, которая встает на учет знает, что данный вид скрининга предстоит ей в период с 11 до 14 недель. По результатам скрининга женщина может получить как низкий риск рождения ребенка с патологией, так и высокий (граница 1:100).
Какова же точность скрининга I триместра, который проводят каждой беременной женщине в России:
![Данные: Анализ результатов раннего пренатального скрининга в Российской Федерации АУДИТ – 2019. Информационно-справочные материалы. Письмо МЗРФ № 15-4/2963-07 от 11.10.2019 [2]](https://msk.medicalgenomics.ru/assets/components/directresize/cache/dr_unnamed%20(2)_w400_h266.png)
Стоит отметить что 20% детей рожденных с синдромом Дауна (с трисомией 21) были рождены в группе низкого риска. [3]
Также сравнительный анализ показал, что комбинированный скрининг эффективнее исследования только биохимических или ультразвуковых маркеров (87% вместо 71%) [4].
Инвазивная пренатальная диагностика
Данный вид диагностики включает в себя процедуру забора разного вида биоматериала (в зависимости от срока беременности) из полости матки с помощью пункции под контролем УЗИ. Среди беременных процедуру часто называют “прокол”, длительность процедуры (подготовки и самой пункции) от 5 до 7 минут.
У инвазивной пренатальной диагностики есть свои ограничения и риски осложнений [5]:
- Самопроизвольное прерывание беременности (выкидыш): после амниоцентеза — 0,81%; после биопсии ворсин хориона – 2,18%
- Внутриутробное инфицирование 0,001%
- У носителей хронических вирусных гепатитов, ВИЧ-инфекции, при острых инфекционных процессах – риск высокий.
- Наличие абсолютных противопоказаний к процедуре: истмико-цервикальная недостаточность, угроза прерывания (наличие кровотечения)
- Избыток подкожно-жировой клетчатки, возможные технические трудности при проведении процедуры
- Беременной с резус-отрицательным фактором необходим контроль уровня антител перед процедурой, при их отсутствии — введение антирезусного иммуноглобулина после процедуры.
По данным FMF риски < 1% — 1: 100 Т.е. у каждой 100 женщины, после процедуры случился выкидыш.
Несмотря на ограничения, противопоказания и возможные риски инвазивная пренатальная диагностика является признанным методом в России. В случае выявления высокого риска хромосомных аномалий, пациентке рекомендуется проведение инвазивного обследования (плацентоцентез, амниоцентез, кордоцентез) [6].
Точность инвазивной диагностики свыше 99%.
Однако есть ограничение метода, связанное с редким явлением плацентарного мозаицизма: в 1-2% биопсии ворсин хориона (плацентозентезе) [5]. Это два или более клона клеток с разным хромосомным набором. Может быть ложный результат диагностики или выявление мозаицизма. При этом мозаицизм у плода выявляется в 30-40% случаев.
При амниоцентезе может быть ложный результат в случае тканевого мозаицизма у плода. В амниотической жидкости представлены не все клеточные линии плода: только клетки кожи, ЖКТ, мочевого пузыря и легких.
Неинвазивная пренатальная диагностика
Неинвазивный пренатальный тест (НИПТ) — это скрининговый метод. Сегодня в России проводят около 30-40 тысяч НИПТ в год, всего НИПТ сделали от 4 до 6 млн женщин (по состоянию на 2017 год) [1].
Само исследование представляет собой технологически сложный и затратный по времени процесс, включающий такие этапы как:
- взятие образца крови у пациента и получение плазмы,
- выделение ДНК и пробоподготовка,
- секвенирование,
- биоинформатические анализ,
- подготовка заключения.
Точность НИПТ
Во всех метаанализах сделан вывод, что НИПТ с помощью анализа внеклеточной ДНК плода в материнской плазме является высокоэффективным методом скрининга частых хромосомных аномалий — трисомии 21,18 и 13 [8-11] как при одноплодной беременности, так и для близнецов.
В связи с низким процентом ложноположительных результатов специфичность НИПТ в подавляющем большинстве публикаций была высокой и колебалась в пределах 98-99,9%.
Авторы исследований отмечают, что скрининг на трисомию 21 (синдром Дауна) с помощью анализа фетальной внеклеточной ДНК в материнской крови превосходит все другие традиционные методы скрининга с более высокой чувствительностью и более низким процентом ложноположительных результатов [8].
Доля ложноположительных результатов исследований по пяти хромосомам оценивается от 0,1 до 0,9% [7].
У данного метода тоже есть ограничения и противопоказания:
- Синдром исчезающего близнеца
- Хромосомные аномалии или хромосомный мозаицизм у матери
- Не проводится ранее 10-ти недель беременности
- Для беременностей двойней не проводится тест на анеуплоидии половых хромосом
- Не проводится для беременности тройней и большим количеством плодов
- Не предназначен и клинически не подтвержден для определения мозаицизма, частичной трисомии или транслокаций, а также для выявления хромосомной патологии по незаявленным хромосомам
- Опухоли у женщины на данный момент или в прошлом, трансплантация органов или костного мозга, стволовых клеток в прошлом (в этих случаях повышен риск ложного результата тест).
Получить консультацию специалиста
Хотите пройти тест НИПТ?
Оставьте заявку, мы постараемся вам помочь!
Список литературы:
- Современное значение неинвазивного пренатального исследования внеклеточной ДНК плода в крови матери и перспективы его применения в системе массового скрининга беременных в Российской Федерации © Е.А. Калашникова, А.С. Глотов , Е.Н. Андреева, И.Ю. Барков , Г.Ю. Бобровник, Е.В. Дубровина, Л.А. Жученко
- Анализ результатов раннего пренатального скрининга в Российской Федерации АУДИТ – 2019. Информационно-справочные материалы. Письмо МЗРФ № 15-4/2963-07 от 11.10.2019
- Жученко, Л. А., Голошубов, П. А., Андреева, Е. Н., Калашникова, Е. А., Юдина, Е. В., Ижевская, В. Л. (2014). Анализ результатов раннего пренатального скрининга, выполняющегося по национальному приоритетному проекту «Здоровье» в субъектах Российской Федерации. Результаты российского мультицентрового исследования «Аудит-2014». Медицинская генетика, 13(6), 3-54.
- S Kate Alldred, Yemisi Takwoingi, Boliang Guo, Mary Pennant, Jonathan J Deeks, James P Neilson, Zarko Alfirevic First trimester ultrasound tests alone or in combination with first trimester serum tests for Down’s syndrome screening
- Queenan, J. T. et al. (2010). Protocols for high-risk pregnancies: an evidence-based approach. John Wiley & Sons. – 661 p. R. AKOLEKAR, J. BETA, G. PICCIARELLI, C. OGILVIE and F. D’ANTONIO. Procedure-related risk of miscarriage following amniocentesisand chorionic villus sampling: a systematic review and meta-analysis. Ultrasound Obstet Gynecol 2015; 45: 16–26.
- Приказ Минздрава России от 20.10.2020 N 1130н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (Зарегистрировано в Минюсте России 12.11.2020 N 60869)
- Lui X. Mils. «Financing reforms of public health services in China: Lessons for other nations». Social Science and Medicine, 2002; 54:1691-1698. «Non-invasive prenatal testing for fetal aneuploidy: charting the course from clin- ical validity to clinical utility». Ultrasound Obstet Gynecol 2013; 41: 2-6.
- Gil MM, Quezada MS, Revello R, et al. Analysis of cell-free DNA in maternal blood in screening for fetal aneuploidies: updated meta-analysis. Ultrasound Obstet Gynecol. 2015;45:249–266. doi: 10.1002/uog.14791
- Gil MM, Accurti V, Santacruz B, et al. Analysis of cell-free DNA in maternal blood in screening for aneuploidies: updated meta-analysis. Ultrasound Obstet Gynecol. 2017;50:302–314. doi: 10.1002/uog.17484
- Mackie FL, Hemming K, Allen S, et al. The accuracy of cellfree fetal DNA-based non-invasive prenatal testing in singleton pregnancies: a systematic review and bivariate meta-analysis. BJOG. 2017;124:32–46. doi: 10.1111/1471-0528.14050
- Taylor-Phillips S, Freeman K, Geppert J, et al. Accuracy of non-invasive prenatal testing using cell-free DNA for detection of Down, Edwards and Patau syndromes: a systematic review and meta-analysis. BMJ Open. 2016;6(1):e010002. doi: 10.1136/bmjopen-2015-010002




_w400_h273.png)