Индикаторные
погрешности – систематические
погрешности, связанные с используемыми
индикаторами. Эта погрешность связана
с тем, что рТ применяемого индикатора
не совпадает со значением рН в ТЭ.
Индикаторная
погрешность-это систематическая
погрешность.
%
или
%
Можно
выразить ПТ через f:
или
При
титровании HCl
с NаOH
возникает водородная погрешность. Она
возникает, если рТ<7, т.е при титровании
сильной кислоты сильным основанием,
после окончания титрования остается
избыток неоттитрованной кислоты (рТ<рН)
ПТ%
=
При
перетитровании HCl
(pT>pH):
ПТ%
=
При
титровании 0,5 М HCl
с 0,5 М NаОН
используем фенолфталеин, (рТ=9), значение
рН в ТЭ равно 7
При использовании
фф (рТ=9) погрешность титрования
положительна (раствор перетитрован ):
ПТ%
=
%
При использовании
метилоранжа (рТ=4) погрешность отрицательна
(раствор недотитрован):
ПТ%
=
%
Сравнивая значения
погрешностей можно сделать вывод, что
целесообразней использовать фенолфталеин.
Значительная погрешность возникает
при титровании, если использовать
индикатор с рТ<4
5. Вывод:
-
Был
построен график зависимости рН системы
от степени оттитрованности раствора
в процессе титрования 0,5 М HCl
и 0,5 М NаОН,
называемый кривой титрования. Эта
кривая является монологарифмической,
т.к до ТЭ показатель концентрации
зависит от концентрации другой формы. -
Определен
скачок титрования (рН=2.3-11.7) 8,9 единиц,
который зависит от :
I
Константы диссоциации : чем слабее
кислота, тем выше рН в начале титрования
и в области буферного действия,
следовательно, скачок уменьшается. Если
для кислоты К<5*10,
то скачок отсутствует.
II
Чем меньше концентрация титруемого
вещества и титранта, тем меньше скачок.
II
При повышении температуры (т.к степень
ионизации воды изменяется) скачок
уменьшается и смещается в более кислую
область.
c.
При титровании сильной кислоты сильным
основанием можно использовать
большое количество индикаторов точка
эквивалентности совпадает с точкой
нейтральности.
III Титрование 0,1 м раствора AgNo 0,1 м раствором kCl
1 Осадительное титрование.
Осадительные
методы имеют ограниченное значение.
Лишь очень немногие процессы осаждения
отвечают всем требованиям, предъявляемым
к реакциям в титриметрии. Ограничения
связаны главным образом с неколичественным
и нестехиометрическим протеканием
реакций. Удовлетворительны с этой точки
зрения реакции осаждения галогенидов
и тиоцианата серебра (аргентометрия),
а также ряда соединений ртути (I).
2 Вывод формул pCl на различных этапах титрования.
В
процессе титрования изменяется
концентрация осаждаемого иона – хлорид
иона Cl—,
поэтому кривые титрования целесообразно
строить в координатах pCl
– f
(логарифмические кривые).
1)
До начала титрования ( f=0)
определяется начальной концентрацией
AgNO3,
т.е. pCl
= -Lg
C0[Cl—]
=
=
=
=
=
2)
До первой точки эквивалентности ( 0<f<1),
Cl
осаждается ионами серебра Ag+.
Ag+
+ Cl—
= AgCl
Концентрация
хлорид — ионов определяется количеством
прибавленного титранта и произведением
растворимости образующегося осадка.
[Cl—]
=
+
Так
как KS
= 1,8*10-10,
<<
,
то слагаемым
можно пренебречь.
[Cl—]
=
=
= С0
* (1 —
)
= С0
* (1-f)
pCl
= — LgC0
– Lg(1-f)
3)
В точке эквивалентности ( f=1)
концентрация хлорид — ионов в титруемом
растворе определяется только произведением
растворимости хлорида серебра.
KS
= [Ag+][Cl—]
[Ag+]
= [Cl—]
[Cl—]
=
pCl
=
PKS
4)
После точки эквивалентности ( f>1)
концентрация хлорид – ионов определяется
произведением растворимости KOH,
но уже с учетом избытка титранта.
pCl
= pKS
+ Lg(СT(
f-1))
По
выведенным формулам вычислим значения
pCl
в различные моменты титрования и построим
кривую титрования.
Слайд 1
Осадительное титрование
Тиранты образуют с определяемым веществом малорастворимое соединение
Требования к реакциям:
1.
Определяемое вещество должно х.р. в воде и содержать ион, образующий
с титрантом малорастворимое соединение

Слайд 2
2. Реакция осаждения должна протекать стехиометрично
3. Не должно протекать побочных
реакций
4. Реакция должна протекать практически до конца
ПР
осадка ВА,
ПР<4·10–12 для осадков типа В2А или ВА2

Слайд 3Классификация методов осадительного титрования:
1. Аргентометрия (тирант — AgNO3)
2. Тиоцианатометрия (NH4SCN)
3.
Меркурометрия (Hg2(NO3)2)
4. Гексацианоферратометрия (K4[Fe(CN)6])
5. Сульфатометрия (H2SO4)
6. Бариметрия (BaCl2)
![Осадительное титрование
Тиранты образуют с определяемым веществом Классификация методов осадительного титрования:1. Аргентометрия (тирант - AgNO3)2. Тиоцианатометрия (NH4SCN)3. Меркурометрия Классификация методов осадительного титрования:1. Аргентометрия (тирант - AgNO3)2. Тиоцианатометрия (NH4SCN)3. Меркурометрия (Hg2(NO3)2)4. Гексацианоферратометрия (K4[Fe(CN)6])5. Сульфатометрия (H2SO4)6. Бариметрия](https://theslide.ru/img/thumbs/3dc75d9771173f99750f51206e309bc3-800x.jpg)
Слайд 4Аргентометрия
Титрант – 0,1 или 0,05 моль/л раствор AgNO3
Готовят раствор
приблизительно нужной концентрации
Стандартизацию проводят по хлориду натрия
(метод Мора)
Ind
– хромат калия K2CrO4

Слайд 5
Разновидности аргентометрии
метод Мора
метод Фаянса
метод Фольгарда

Слайд 6Метод Мора
Основан на определении Cl и Br прямым титрованием раствором
нитрата серебра в нейтральной или слабощелочной среде в присутствии индикатора
– хромата калия
Метод не позволяет определять I и SCN ионы, так как с осадками AgI и AgSCN происходит соосаждение хромата калия Ag2CrO4

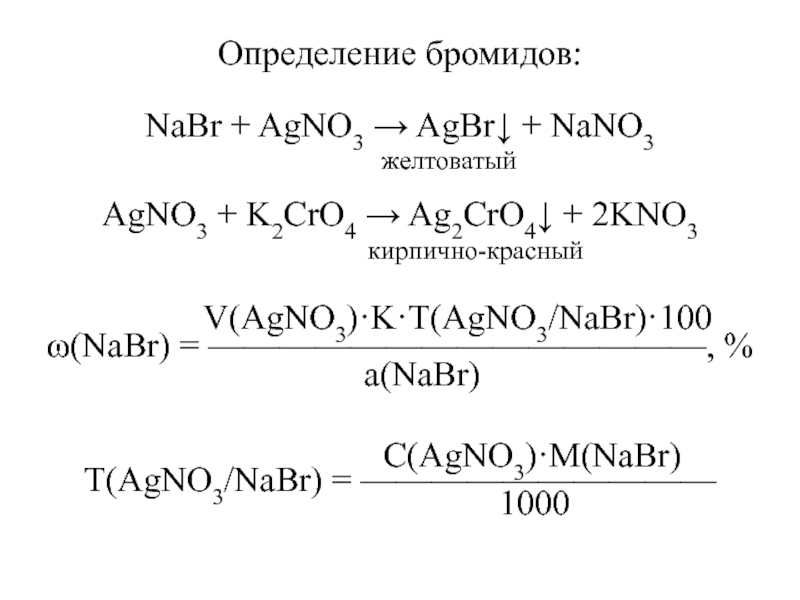
Слайд 7Определение бромидов:
NaBr + AgNO3 AgBr + NaNO3
желтоватый
AgNO3 + K2CrO4 Ag2CrO4 + 2KNO3
кирпично-красный
V(AgNO3)·K·T(AgNO3/NaBr)·100
(NaBr) = ——————————————, %
а(NaBr)
С(AgNO3)·M(NaBr)
Т(AgNO3/NaBr) = ——————————
1000
Слайд 8Ind – K2CrO4 (осадительный)
Осадительные индикаторы выделяются из раствора в виде
осадка в хорошо заметной форме в ТЭ или вблизи ее.
В
процессе титрования:
образуется желтоватый AgBr
Ag2CrO4 до ТЭ не образуется, т.к.
S(AgBr)< S(Ag2CrO4)
При добавлении избыточной капли AgNO3 образуется красный осадок Ag2CrO4

Слайд 9Особенности метода Мора:
1. Титрование проводится в нейтральной или слабощелочной среде
(рН=6,5-10,3), т.к.
В кислой среде Ag2CrO4 растворяется с образованием дихромат-ионов:
2 Ag2CrO4
+ 2H+ 4Ag+ + Cr2O7– + H2O
В щелочной среде образуется черный осадок
2Ag+ + 2OH– 2AgOH Ag2O + H2O

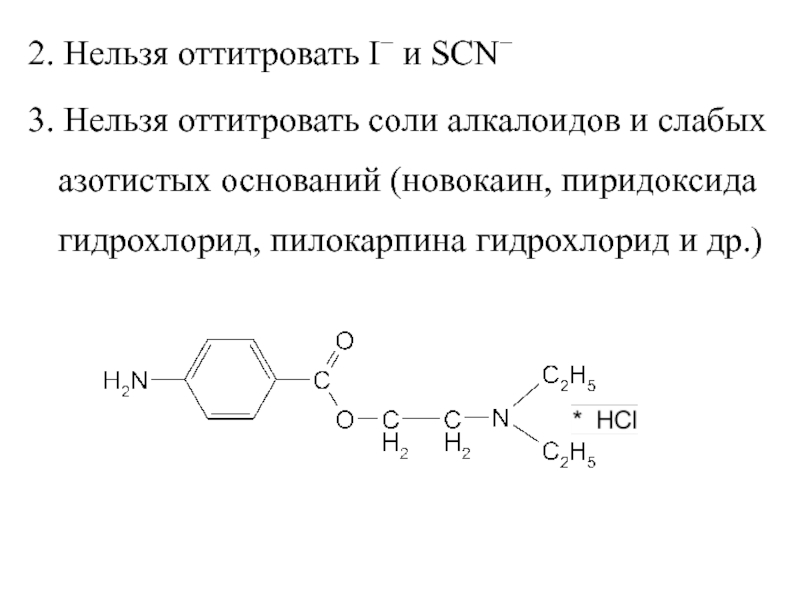
Слайд 102. Нельзя оттитровать I и SCN
3. Нельзя оттитровать соли алкалоидов
и слабых азотистых оснований (новокаин, пиридоксида гидрохлорид, пилокарпина гидрохлорид и
др.)
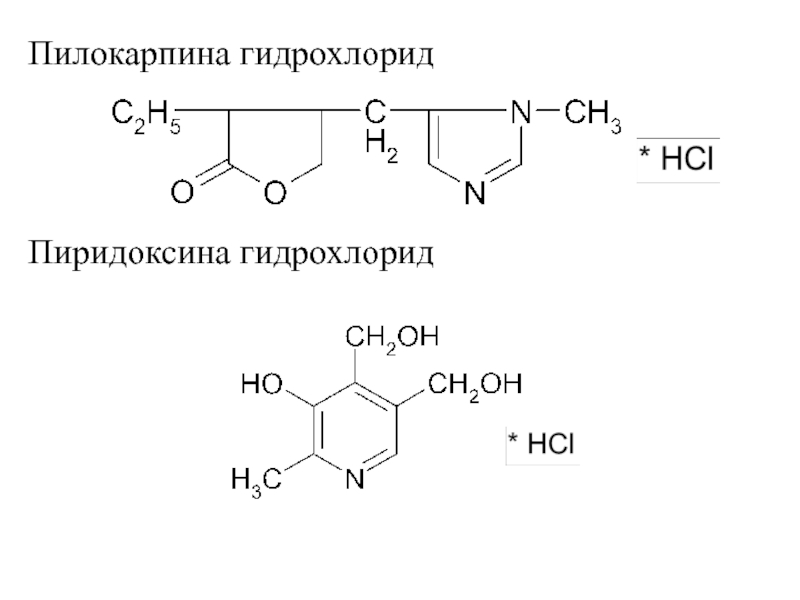
Слайд 11Пилокарпина гидрохлорид
Пиридоксина гидрохлорид
Слайд 12
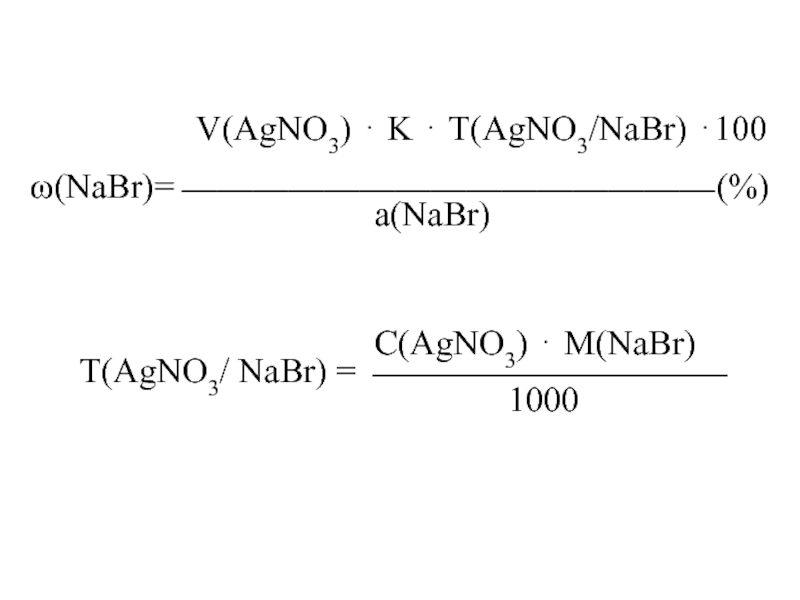
V(AgNO3) K Т(AgNO3/NaBr) 100
(NaBr)= (%)
а(NaBr)
С(AgNO3) М(NaBr)
Т(AgNO3/ NaBr) =
1000
Слайд 13Метод Фаянса
Основан на определении Cl , Br , I
и SCN ионов прямым титрованием раствором нитрата серебра в присутствии
адсорбционных индикаторов (флуоресцеин, эозинат натрия, бромфеноловый синий и др. индикаторы).

Слайд 14
Адсорбционные индикаторы – такие индикаторы, адсорбция или десорбция которых осадком
при осадительном титровании сопровождается изменением окраски в ТЭ или вблизи
ее

Слайд 15
Титрование по флуоресцеину проводят в растворах с рН от 6,5
до 10,3 (определяют Cl, Br, I, SCN)
Титрование по эозинату
натрия проводят при рН от 2 до 10,3, чаще в уксуснокислой среде (определяют Br, I, SCN).
Cl по эозинату натрия не определяют, так как осадок хлорида серебра адсорбирует анионы эозина еще до достижения точки эквивалентности.

Слайд 16Определение иодидов:
NaI + AgNO3 AgI + NaNO3
желтый
Принцип действия адсорбционных индикаторов
HInd H+ +
Ind
[AgI · I] [AgI] [AgI · Ag+]
до т.э. т.э. + 1 изб.
капля Ind
цвет индикатора меняется

Слайд 17Вначале титрования:
В растворе иодид-ионы
До ТЭ:
Осадок AgI и I . Иодид-ионы
адсорбируются на поверхности осадка AgI и поверхность осадка оказывается отрицатльно
заряженной (осадки адсорбируют в первую очередь те ионы, которые входят в их состав). Около поверхности осадка находятся катионы, присутствующие в растворе: Na+, H+

Слайд 18ТЭ:
осадок AgI.
За ТЭ:
осадок AgI и Ag+. Ионы серебра
адсорбируются на поверхности осадка и поверхность осадка оказывается заряженной положительно
и на ней сразу же адсорбируются отрицательно заряженные ионы индикатора. Происходит изменение цвета осадка.

Слайд 19Условия применения адсорбционных индикаторов:
1. Нельзя проводить титрование при больших концентрациях
реагентов и при повышенной ионной силе растворе, т.к. это вызывает
коагуляцию осадка и сокращению его поверхности. Чем больше поверхность осадка, тем отчетливее заметно изменение цвета индикатора при его адсорбции.

Слайд 20
2. Следует соблюдать оптимальный интервал изменения рН раствора
3. Индикатор не
должен адсорбироваться на поверхности осадка раньше определяемых ионов

Слайд 21Адсорбционная способность анионов при рН=7 на поверхности осадка AgCl
I– >
SCN– > Br– > анион эозина > Cl– >анион флуоресцеина
> ClO4–
Каждый предшедствующий анион этого ряда адсорбируется на поверхности осадка AgCl раньше последующего аниона, т.е.
В присутствии эозина можно определить I–, SCN–, Br– и нельзя определить Cl– и ClO4–

Слайд 22
V(AgNO3) K
Т(AgNO3/NaI) 100
(NaI)= (%)
а(NaI)
С(AgNO3) М(NaI)
Т(AgNO3/NaI) =
1000

Слайд 23Метод Фольгарда
Метод обратного титрования.
Титранты – AgNO3 и AgSCN
Среда
– азотнокислая
Ind – железоаммонийные квасцы NH4Fe(SO4)212H2O (сильнокислая среда подавляет
гидролиз соли железа (III))
Определяют Cl , Br , I

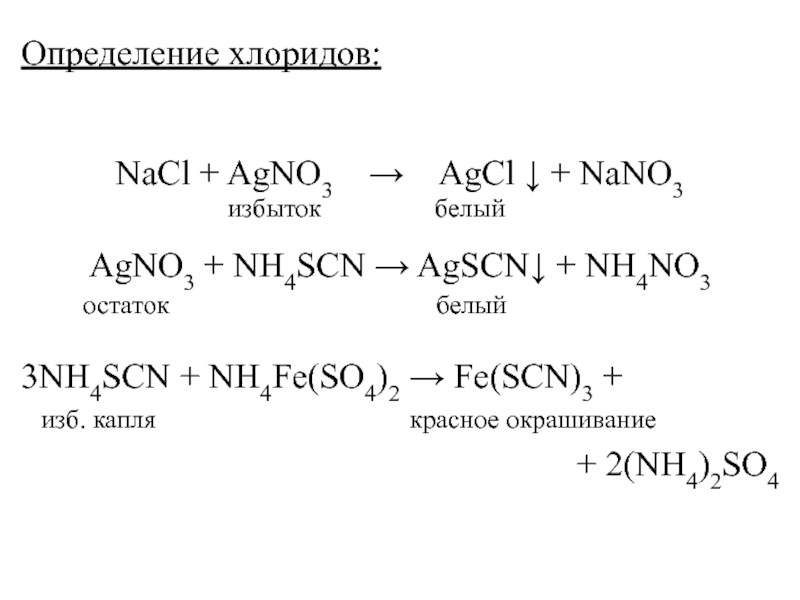
Слайд 24Определение хлоридов:
NaCl + AgNO3 AgCl +
NaNO3
избыток белый
AgNO3 + NH4SCN AgSCN + NH4NO3
остаток белый
3NH4SCN + NH4Fe(SO4)2 Fe(SCN)3 +
изб. капля красное окрашивание
+ 2(NH4)2SO4
Слайд 25Особенности определения хлоридов
т.к. SAgCl > SAgSCN
осадок AgCl удаляют:
либо
фильтрованием
либо добавлением хлороформа

Слайд 26
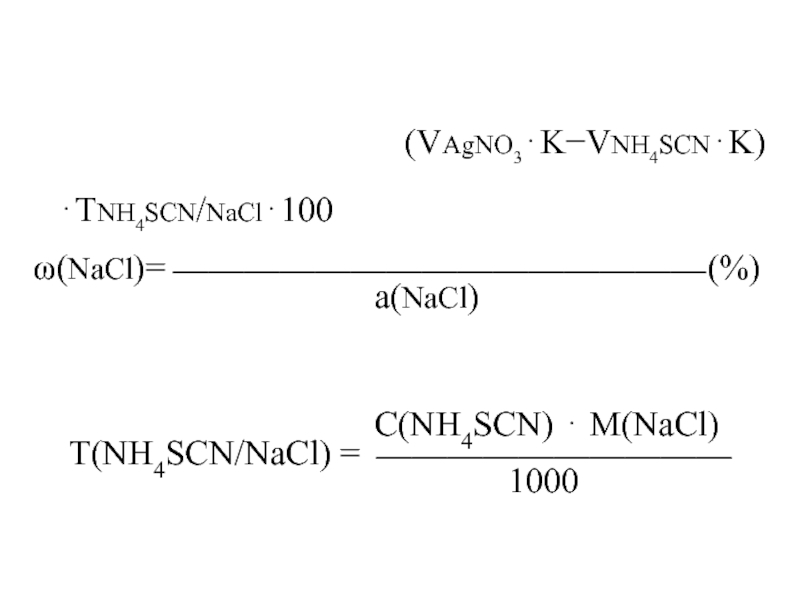
(VAgNO3KVNH4SCNK)ТNH4SCN/NaCl100
(NaCl)= (%)
а(NaCl)
С(NH4SCN) М(NaCl)
Т(NH4SCN/NaCl) =
1000
Слайд 27
В фарм. анализе аргентометрия применяется для количественного определения лекарственных препаратов:
NaCl, NaBr, NaI, KCl, KBr, KI, солей алкалоидов, слабых азотистых
оснований и др.

Слайд 28Роданометрия
Титрант – 0,1 моль/л раствор NH4SCN
Среда – азотнокислая
Ind – NH4Fe(SO4)212H2O
Стандартизация по стандартному р-ру AgNO3
AgNO3 + NH4SCN AgSCN +
NH4NO3
белый
3NH4SCN + NH4Fe(SO4)2 Fe(SCN)3 +
красное окрашивание
2(NH4)2SO4

Слайд 29
В фарманализе метод применяется для к.о. серебра в препаратах (протаргол,
колларгол, нитрат серебра).
В протарголе и колларголе серебро предварительно переводят
в ионогенное состояние обработкой серной и азотной кислотой при нагревании.
В полученном растворе ионы серебра оттитровывают стандартным раствором роданида аммония.

Слайд 30МЕРКУРОМЕТРИЯ
Титрант – 0,05 моль/л раствор нитрата ртути(I)
Hg2(NO3)2 (молярная концентрация
эквивалента 0,1 моль/л)
Готовят приблизительно нужной концентрации
Для перевода Hg(II) в Hg(I) добавляют металлической ртути, выдерживают сутки
Стандартизация по хлориду натрия
Ind – дифенилкарбазон, тиоцианатные комплексы железа(III)

Слайд 31
2NaCl + Hg2(NO3)2 Hg2Cl2 + 2NaNO3
В титруемый раствор вводят
NH4SCN и Fe(NO3)3 – образуется красный комплекс Fe(SCN)3
После достижения
ТЭ, избыточная капля титранта разрушает Fe(SCN)3, раствор обесцвечивается
Параллельно проводят контрольный опыт

Слайд 32
Дифенилкарбазон (C6H5NHNH)2CO – адсорбционный индикатор
Добавляется в конце титрования
Вблизи ТЭ индикатор
окрашивает осадок в интенсивный синий цвет

Слайд 33
Кривые
осадительного титрования
Отражают зависимость концентрации вещества от объема титранта
Концентрацию вещества выражают
через обратный логарифм (по аналогии с рН).

Слайд 34
Рассчитать и построить кривую титрования 0,1 н раствора NaCl
0,1 н раствором AgNO3 ПРAgCl = 1,810-10
Построим кривую титрования в
координатах «концентрация хлорид-ионов» — «объем титранта»
При этом концентрацию хлорид ионов выразим через pCl = –lg [Cl–].

Слайд 35Расчетные ф-лы в разные моменты титрования:
1) до начала титрования концентрация
Cl– равна концентрации NaCl:
[Cl–] = CNaCl; pCl = –lg CNaCl;
2) до точки эквивалентности [Cl–] = CNaCl (1 – f), где f – степень оттитровывания (показывает, какая часть анализируемого вещества оттитрована)
Тогда pCl = –lg CNaCl(1 – f)
Если оттитровано 30 %, то f = 30 / 100 = 0,3
50 % f = 50 / 100 = 0,5
90 % f = 90 / 100 = 0,9

Слайд 363) в т.э. концентрацию вещества вычисляют из произведения растворимости осадка.
[Cl–] = ПР рCl
= – ½ lg ПРAgCl
4) за т.э. [Cl–] рассчитывают из ПРAgCl , учитывая возрастание концентрации Ag+ с помощью степени оттитрованности f:
[Cl–] = ПР / [Ag+] = ПР / CAgCl(f – 1) рCl = –lg ПРAgCl + lg CAgCl(f – 1)
![Осадительное титрование
Тиранты образуют с определяемым веществом 3) в т.э. концентрацию вещества вычисляют из произведения растворимости осадка. 3) в т.э. концентрацию вещества вычисляют из произведения растворимости осадка. [Cl–] = ПР](https://theslide.ru/img/thumbs/1cf20898dcc40042738c0dee8094828b-800x.jpg)
Слайд 38Скачок титрования
рХ = рХ100,1 – рХ99,9 = -lgПР –
3 + lgС – 3 + lgC = -lgПР –
6 + 2lgС
Cкачок титрования зависит от ПР и концентрации анализируемого вещества
Чем меньше ПР, тем больше рХ
Чем больше концентрация, тем большерХ

Слайд 39
Скачок титрования лежит в интервале 4 – 6
При индикаторной фиксации
ТЭ выбирают индикатор, который резко меняет свои видимые свойства в
данном интервале

Слайд 40Индикаторная ошибка осадительного титрования обусловлена перетитровыванием раствора и равна:
n(T) 100
X% = —————
n(T)
n(T) – избыточное количество титранта в конечной точке титрования
n(T) – количество титранта в точке эквивалентности

Слайд 41
СT (VX +
VT)
X% = ———————— 100
СT VT
СT – концентрация титранта в конечной точке титрования
СT – исходная концентрация титранта
VT – объем титранта
VX – объем анализируемого раствора
Концентрация ионов титранта в к.т.т рассчиты-вается из значения ПР осадка титранта с Ind

Слайд 42
Рассчитать индикаторную ошибку при титровании 10 мл 0,1 н раствора
хлорида калия 0,1 н раствором нитрата серебра в присутствии индикатора
– 10-5 моль/л хромата калия

Слайд 43
СT (VX + VT)
X% = ———————— 100
СT VT
ПР(Ag2CrO4) = [Ag+]2[CrO42–] = 1,110–12
ПР(Ag2CrO4) 1,110–12
[Ag+] = ——————— = ——————— =
[CrO42–] 10-5
= 3,310–4 моль /л
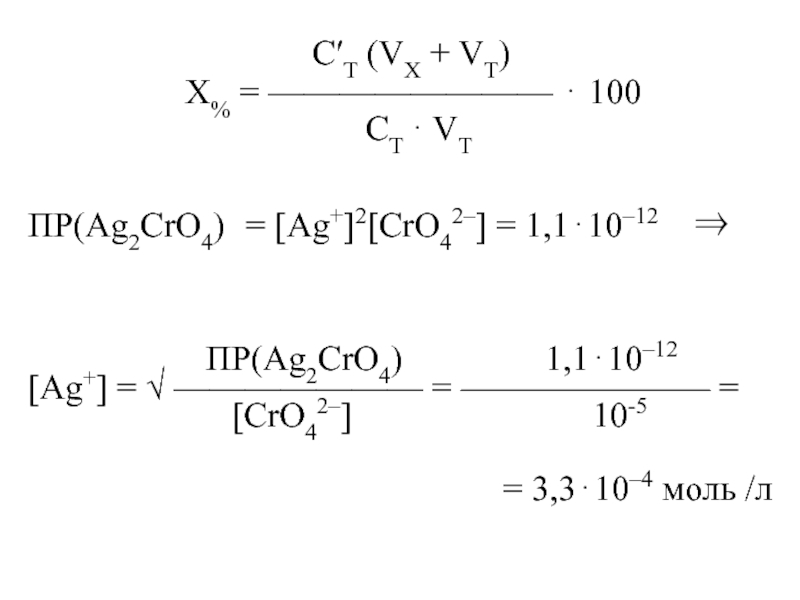
Слайд 44
3,310–4 (10 +
10)
X% = ——————— 100 = 0,66 %
0,1 10
Ошибка велика, целесообразно увеличить концентрацию индикатора
Тогда для концентрации индикатора 10–3 моль/л ошибка титрования составит:
3,310–5 (10 + 10)
X% = ——————— 100 = 0,066 %
0,1 10

И. М. Кольтгоф, В. А. Стенгер. Объемный анализ. Госхимиздат, 1950, (т. I. 376 стр.) и 1952, (т. И, 444 стр.). В т. I рассматриваются теоретические основы объемного анализа. Изложена теория методов нейтрализации и соединения ионов, приведены кривые титрования для различных случаев метода нейтрализации. Отдельные главы содержат материал ио теории методов окисления-восстановления, теории индикаторов, по ошибкам титрования. Рассмотрены явления адсорбции и соосаждения, катализа и индукции, применение объемных методов в органическом анализе описаны теоретические положения, касающиеся применения физико-химических методов для определения точки эквивалентности. В т. 11 книги изложено практическое применение методов нейтрализации, осаждения и комплексообразования. В томе 111 (840 стр., 1961 г.) описано применение окислительно-восстановительных методов объемного анализа. [c.486]
В заключение коротко остановимся на вычислении ошибок тнтрования в методах осаждения. Их вычисляют так же, как ошибки титрования в методах кислотно-основного титрования. Предположим, Ад+-ион титруют с индикатором, чувствительность которого к этому иону отвечает концентрации а, выраженной в грамм-эквивалентах на 1 л. Если объем раствора в конце титрования (в мл) равен V, то число грамм-эквивалентов Ag+ будет равно аУ/ 000. Можно принять, что это число эквивалентов Аё и отвечает ошибке титрования. Если первоначальный объем титруемого раствора составлял V мл и имел нормальность Ы, то общее число эквивалентов Ag которое было оттитровано, равно Л У/100. Отсюда ошибка титрования в процентах равна [c.329]
Какая концентрация хромата теоретически необходима при титровании бромида методом Мора, чтобы осаждение хромата серебра как раз началось в точке эквивалентности Какова относительная ошибка титрования 0,01 М бромида, если концентрация хромата райна 0,002 М. [c.246]
Ошибка титрования в методах осаждения [c.172]
При кондуктометрическом титровании методом осаждения ошибка может возникнуть также в результате обычных аналитических ошибок осаждения, например вследствие адсорбции (поглощения поверхностью) ионов из раствора осадком или неопределенности состава осадка. В некоторых случаях необходимо [c.354]
При потенциометрическом титровании методом осаждения встречаются с обычными ошибками весового определения явлением адсорбции,, увеличением растворимости осадка в присутствии посторонних электролитов и т. п. Кроме этого, встречаются со специфическими ошибками для потенциометрического титрования. Не вдаваясь в разбор их, отметим лишь, что при титровании многоосновных солей точка эквивалентности немного не [c.388]
При потенциометрическом титровании методом осаждения мы встречаемся с обычными ошибками весового определения явлением адсорбции, увеличением растворимости осадка в присутствии посторонних электролитов и т. п. Кроме этого, встречаемся со специфическими ошибками для потенциометрического титрования. Не вдаваясь в разбор их, отметим лишь, что при титровании многоосновных солей точка эквивалентности немного не совпадает с максимальным скачком потенциала и отклонения доходят до 0,15—0,20 в. [c.325]
Кривые титрования хлоридов нитратом серебра в расплавленных солях получаются такими же, как кривые титрования в водных растворах для экзотермических процессов. Относительная ошибка титрования для указанных выше концентраций приближалась к 4%. Применение метода ограничено в связи с трудностью достаточно точного измерения повышения температуры, происходящего в результате реакции. Необходимо, чтобы изменение температуры окружающей среды было на несколько порядков меньше, чем изменение температуры, происходящее в результате рассматриваемой реакции. Теоретически в среде расплавленных солей возможно проводить любые реакции осаждения, комплексообразования или окислительно-восстановительные реакции, однако практически сложность прибора, который требуется для этого, ограничивает применимость расплавленных солей в качестве растворителей. [c.110]
Один из методов объемного определения тория в виде оксалата предусматривает титрование перманганатом щавелевой кислоты, связанной с торием, либо титрование непрореагировавшего ее избытка [884]. Точные результаты получаются лишь в том случае, когда начальное осаждение проводится путем медленного добавления раствора соли тория к избытку раствора щавелевой кислоты. При указанном порядке добавления реактивов ошибка определения при осаждении на холоду составляет примерно 0,1% если осаждение оксалата тория ведут при нагревании, то получающимися ошибками можно пренебречь. При обратном порядке прибавления компонентов и недостатке щавелевой кислоты образуются основные соли промежуточного состава. Метод успешно применяли [c.52]
В работе [17] описано амперометрическое титрование меркаптанов стандартным раствором, содержащим ионы серебра. При этом сам процесс титрования и необходимое для него оборудование очень просты [17]. Однако основанный на этом титровании метод определения имеет недостатки, связанные а) с возможной нестабильностью образующихся меркаптидов серебра и б) с осаждением галогенидов серебра. Эти недостатки могут особенно сильно проявиться в анализах биологических образцов и привести к значительным ошибкам. Обсуждение некоторых из связанных с ними проблем имеется в работе [18]. [c.348]
Влияние растворимости выпадающего осадка на характер получаемой кривой титрования. Соединения, образующиеся в процессе титрования по методу осаждения, относятся к числу малорастворимых. Однако ошибки, вызываемые их растворимостью, могут искажать результаты анализа. Поэтому растворимостью все-таки нельзя пренебрегать. [c.234]
По второму варианту для титрования применяют раствор тиосульфата натрия, с которым золото образует достаточно прочный комплекс. Титрование ведется также без наложения напряжения относительно насыщенного каломельного электрода по току восстановления золота. Этот метод несколько менее чувствителен, он позволяет определять золото в количестве до 0,08 мг в 1Б мл раствора (концентрация золота порядка 10 М). При меньших количествах ошибка определения достигает 50—60%. Метод осаждения меркаптобензотиазолом, как -указывалось выше, позволяет определять меньшие количества золота. Однако тиосульфатный метод может быть применен в присутствии меди для устранения [c.207]
ОШИБКА ТИТРОВАНИЯ В МЕТОДАХ ОСАЖДЕНИЯ 173 [c.173]
Ошибки титрования в методах осаждения и нейтрализации [c.221]
Работа при высокой частоте в значительной мере устраняет свойственные обычной кондуктометрии ошибки, обусловленные поляризацией электродов или изменением их рабочей поверхности из-за налипания твердых частиц. Последнее обстоятельство дает неоспоримое преимущество безэлектродной кондуктометрии при титровании но методу осаждения или в анализе суспензий, с чем особенно часто приходится сталкиваться в химии лаков и красок. [c.78]
Как видно из результатов, приведенных в табл. 1, ионы РЬ» и Ва удается раздельно определять с достаточной точностью и скоростью. Но в присутствии больших количеств Ва ошибка определения РЬ несколько увеличивается ввиду частичного выпадения ферроцианида бария. При концентрациях Ва в растворе, превышающих в несколько раз концентрацию РЬ , результаты титрования оказались совершенно неудовлетворительными. Поэтому мы определяли сумму РЬ и Ba гидролитическим методом осаждения, а в отдельной порции того же раствора определяли Ва тем же методом после осаждения РЬ каким-нибудь реактивом. По разности вычисляют количество РЬ . [c.42]
Комплексонометрические методы. Широко применяется метод титрования магния комплексоном III после осаждения полуторных окислов аммиаком. Карбонатные породы содержат сравнительно небольшие количества Fe, AI, Сг и Мп, поэтому заметной ошибки из-за соосаждения магния осадком гидроокисей не наблюдается. [c.201]
Жидкость при титровании следует постоянно вращать или перемешивать палочкой. Обычно управляют краном бюретки при помощи левой руки и в то же время вращают жидкость правой рукой. Недостаточно сильное перемешивание жидкости может привести к заметны.м ошибкам вследствие образования избытков реактива в отдельных местах раствора. Этого особенно следует опасаться при выполнении титрований методами осаждения и окисления-восстановления, когда возмолсны побочные реакции. Для предупреждения перетитрования были предложены различные меры Одно нз самых простых мероприятий состоит в применении колб с маленьким отделением ( карманом ) на боку, в котором можно задержать небольшое количество титруемого раствора. Когда раствор перетитровывают, наклоняют колбу так, чтобы МОЖ1НО было слить раствор из кармана , присоединяя его к главной массе жидкости. При этОхМ раствор становится снова немножко недотитрованным и титрование его можно тогда очень осторожно довести до конца. [c.57]
При кондуктометрическом титровании методом осаждения ошибка может возникнуть также за счет обычных аналитических ошибок осаждения, например, вследствие адсорбции (поглощения поверхностью) ионов из раствора осадком кли неопределен ности состава молекулы осадка. В некоторых случаях необходимо считаться со скоростью образования осадка. Если скорость мала, то изменение электропроводности идет очень медленно иногда приходится выжидать 5—10 мин. после каждой порции осадителя до установления постоянной электропроводности, до полного образования осадка. Ясно, что в этом случае кондуктометрическое титрование теряет всякий смысл. [c.188]
Л етоды определения алюминия кондуктометрическим титрованием основаны на образовании алюминием прочных комплексов с некоторыми органическими кислотами, или на осаждении его в виде труднорастворимых соединений, Пасовская [328—331] предложила несколько методов, основанных на образовании ацетатного, тартратного, оксалатного и лактатного комплексов алюминия. Определению алюминия не мешают М и Са Ре необходимо восстанавливать аскорбиновой кислотой до Ре (II). Относительная ошибка этих методов Ио, В работе [959] предложено кондуктометри-ческое титрование алю.миния раствором двунатриевой соли вани-линазина, С ней в среде, близкой к нейтральной, алюминий образует труднорастворимое соединение состава 1 1, Возможно определение алюминия и цинка при совместном присутствии, в этом случае второй излом соответствует концу титрования алюминия, Худякова описала метод автоматического кондуктометрического титрования для определения хлорида алюминия и соляной кислоты в одном растворе [464а], В качестве титрантов можно использовать раствор буры или едкого натра. При титровании получаются два излома на кривой кондуктометрического титрования, первый соответствует титрованию соляной кислоты, второй—титрованию хлорида алюминия. [c.90]
Как впдно из графиков, кривые тптрованпя солей органических кислот по методу осаждения являются типичными кривыми радиометрического титрования нерадиоактивное — радиоактивным . Вероятная относительная ошибка составляет 1—2% при исходных концентрациях Беш,еств 0,01 N. Для получения таких результатов в воде произведение растворимости должно было бы быть не меньше 10 [4]. [c.451]
Этот метод отличается от бельгийского только тем, что к раствору, служащему для установки титра, прибавляют в виде проволоки или в виде рг-створа аммониево-железных квасцов определенное количество железа, отвечающее сумме содержащихся в навеске железа, алюминия и марганца. Этим компенсируется ошибка бельгийского метода, состоящая в том, что осадок гидроокисей при осаждении его из раствора пробы адсорбирует цинк компенсируется же потому, что здесь такая же адсорбция происходит и в растворе, служащем для установки титра. Работа с обоими растгорами должна производиться здесь одинаково. Способ титрования — тот же, как и в бельгийском методе S haffner а. Целесообразно прибавлять к титруемым растворам по нескольку миллилитров 10%-ного раствора сернистокислого натрия, чтобы разрушить окис.титель, который [c.572]
Наряду с прямой вольтамперометрией для определения растворимости труднорастворимых соединений используют амперометрическое титрование. Для определения растворимости в основном используют титрование по методу осаждения [136-140]. Сущность этого метода определения растворимости сводится к установлению точки эквивалентности по уменьшению диффузионного тока по мере образования осадка при добавлении к раствору титранта. А при избытке последнего диффузионный ток достигает некоторого предельного значения, сответствующего незначительному по величине остаточному току. Различные способы амперометрического определения растворимости рассмотрены Хадеевым [137-139]. Чаще всего используются два метода амперометрического определения растворимости а) по начальному скачку величины тока [138] и б) по «размытости» кривой вблизи точки эквивалентности [139]. Оба метода теоретически обоснованы, однако на практике дают недостаточно точные результаты первый из-за явления пересыщения, второй из-за резкого изменения тока вблизи точки эквивалентности (отклонения от последней на доли процента влекут за собой ошибки в десятки процентов). Гордиенко и Сидоренко [140] разработали метод, свободный от указанных недостатков. Сущность его заключается в титровании раствора, к которому предварительно добавлена твердая фаза в качестве затравки (для устранения пересыщения) при этом получается J-образная кривая титрования. Растворимость расчитывается по первым точкам кривой, достаточно удаленным от точки эквивалентности. Использование начального участка кривой сводит к минимуму ошибки за счет измерения объемов при титровании. Индикаторным электродом служит вращающийся игольчатый платиновый электрод длиной 5 мм, электродом сравнения — насыщенный каломельный электрод с площадью поверхности ртути около 30 см . Выведена и экспериментально проверена формула для определения растворимости осадка АВ (AglOs, Ag l, AgS N). [c.289]
Применяемые растворители должны обладать хорошей пропускающей способностью в спектральной рабочей области прИ бора. Ошибка, связанная с присутствием в растворе посторонних веществ, тем больше, чем меньше рабочая длина волны. Преимуществом метода является возможность использования его для серийных определений в одинаковых условиях. Метод фотометрического титрования достаточно полно описан в литературе. В нем можно использовать не только реакции кислотноосновного взаимодействия, но и окисления-восстановления, комплексообразования и осаждения. Метод осадительного фотометрического титрования называют также гетерометрией. [c.361]
При прямом титровании фосфатов раствором соли свинца [1172] при рн 2—3 в качестве индикатора применяют хлороформный раствор дитизона. Титруют до перехода зеленой окраски в фиолетовую. Метод применяют для определения фосфора в фосфатных удобрениях [1174]. В качестве индикатора применяют также эриох-ром черный Т (растворяют 0,2 г эриохрома черного Т в 5 мл С2Н5ОН и 15 мл триэтаНоламина) [950]. Титруют до появления красной окраски. Метод применяют для определения микроколичеств фосфора в органических веществах. Для определения микроколичеств фосфора применяют также титрование нитратом свинца в присутствии 2-азо-4-резорцина [1018]. Титруют до появления красного окрашивания. При содержании фосфора 20— 400 мкг средняя абсолютная ошибка определения составляет 2—3 мкг Р. При косвенном определении фосфатов с помощью нитрата свинца применяют окислительно-восстановительные индикаторы [732, 733]. Метод основан на осаждении РО/ в виде РЬз(Р04)2 нитратом свинца, избыток которого оттитровывают К4[Ге(СК)б1 в присутствии вариаминового синего и Кз[Ге(СК)б] в качестве индикатора. Титруют до перехода фиолетовой окраски в бледно-желтую. [c.37]
Избыток ионов бария после осаждения сульфатов в природных водах определяют пламенно-фотометрически [377] по линии 493 нм. Определение 500 мг 801″1л возможно с ошибкой 2,2%. Если сульфаты осаждают в виде PbS04, избыток ионов свинца определяют методом атомной адсорбции по линии РЬ 2170, 2833 А [1057], фосфаты, силикаты и сульфаты одновременно определяют косвенным титрованием солью магния в пламени Hj—войдух. Изменение поглощения происходит в силу связывания магния определяемыми ионами, кривая титрования имеет три характерные точки [1052]. [c.181]
В качестве титруюш его раствора при аналогичном определении может быть использован метапериодат [1176]. В работе [59] проведено титриметрическое определение ртути нри осаждении ее перйодатом калия в виде Hg5(100)2, растворении осадка в кислоте и иодометрическим титровании. При определении от 0,2 до 0,02 г Hg(II) ошибка равна +0,2%. Для анализа соединений Hg(II) можно также использовать данный метод, предварительно восстановив Hg(II) до Hg(I). [c.90]
Косвенный метод определения мышьяка, основанный на осаждении его в виде арсената серебра, последующем растворении осадка и титровании содерл ащегося в нем серебра, характеризуется хорошей точностью при определении 50 мг AsjOa ошибка составляет 0,4% для больших количеств (100—200 мг AnjOg) она снижается до 0,2% [74]. [c.51]
Эквивалентная точка титрования определяется преимущественно потенциометрическим способом [377, 623, 1837] с платиновым или другими электродами, при этом благоприятное действие на точность результатов оказывает нагревание раствора [377] и добавление ионов К в виде KNOз [ 1837]. Как уже отмечалось выше, в анализе рзэ могут мешать многие катионы, в том числе и ТЬ, образующие осадки с реагентом. Кроме того, влияют и такие элементы, как Ре, А1 и М , непосредственно не дающие осадков с реагентом. Известно также обнаружение конечной точки при помощи оксидиметрического индикатора (свободный иод и крахмал) [973, 974] или при помощи высокочастотного кондуктометрического метода [1379]. Область применения ферроцианидного осаждения характеризуется абсолютными количествами металла в 5—50 мг в объеме 50—100 мл. При этом относительная ошибка результатов не превышает + 0,3—0,4%. [c.170]
Амперометрическое определение сульфатов занимает меньше времени, чем весовой метод. Однако точность амперометрического титрования меньше, так как сернокислый свинец более растворим, чем сернокислый барий. Растворимость осадка РЬ304 можно понизить введением в раствор этилового спирта при этих условиях точка эквивалентности фиксируется лучше и ошибка определения уменьшается. Описываемый метод удобно применять для анализа различных производственных растворов, например для определения сульфатов в электролитах для никелирования, цинкования, хромирования и др. Никелевые ванны содержат помимо сернокислого никеля еще некоторое количество хлористого натрия и других солей. Чтобы предупредить осаждение хлористого свинца, [c.265]
В университете на практическом курсе аналитической химии мне приходилось много титровать. Я помню осторожное дозирование титранта стеклянной бюреткой, неудобный процесс повторного наполнения бюретки и постоянное опасение, что я неправильно выбрала конечную точку.
Все студенты в группе получали разные результаты, но мы так и не поняли почему. В те годы у меня было мало знаний. Сейчас, после 10 лет опыта титрования, я поняла, что результаты ручного титрования очень сильно зависят от человека, который проводит анализ. Ниже я перечислю основные источники ошибок, и как вы можете их избежать.

Правильный выбор индикатора
Значение pH конечной точки титрования зависит от константы кислотной диссоциации (Ka) используемых кислоты и основания. Если сильное основание титруют сильной кислотой, значение pH в конечной точке составляет около 7. Титрование сильного основания слабой кислотой смещает конечную точку в сторону диапазона щелочи. Титрование сильной кислоты слабым основанием – в зону кислот. Это объясняет, почему при кислотно-щелочном титровании используются несколько разных индикаторов. Какой мы выберем?
На приведенной выше диаграмме показаны самые популярные pH индикаторы. Из графика видно, что не получите правильных результатов при pH конечной точки = 7, если в качестве индикатора вы используете кристаллический фиолетовый или метиловый оранжевый. К счастью, в большинстве стандартов и в стандартных методиках работы индикатор уже указан. Если будете следовать инструкциям, все будет хорошо!

Субъективность распознавания конечной точки
Проблемы начинаются в процессе определения конечной точки. Вы когда-нибудь задумывались о тонкостях изменения цвета?
На рисунке вы видите пять стадий кислотно-щелочного титрования c(HCl) = 1 моль/л с c(NaOH) = 1 моль/л. Единственная разница между соседними фотографиями заключается в одной капле титранта. На каком из них истинная конечная точка?
Может это конечная точка на рисунке 1 с бледно-розовым оттенком? Или на картинке под номером 3 с более интенсивным цветом? Или даже на картинке 5, где розовый цвет наиболее яркий? Между 1 и 5 было добавлено всего четыре капли титранта. Одна капля – это 50 мкл, а добавленный в сумме объем составляет 200 мкл титранта или примерно 7,3 мг соляной кислоты. Для фармацевтического анализа – это колоссальная ошибка.

Считываем объем на бюретке
Вы помните, как правильно считывать значения на бюретке? Нужно убедиться, что фиксируете значение мениска четко по горизонтали. Знаете почему?
Значение объема зависит от угла, под которым вы смотрите на бюретку. На данном рисунке данные отличаются от фактического значения до 0,2 мл (200 мкл) в зависимости от угла обзора. Чем больше ваш ракурс отклоняется от горизонтали, тем более неточными будут значения и сам результат. Вы можете допустить среднюю ошибку 200 мкл. Но для титрования это недопустимо много, на предыдущем примере я рассказала почему.
Повышаем объективность и точность оценки
Как можно исключить эти ошибки? Легче всего просто обойти возможную неточность. Решением станет использование электронной бюретки. Все, что вам нужно сделать, это заполнить ее титрантом, а затем нажать кнопку. Устройство автоматически измерит объем и выдаст оцифрованный результат. Использование электронной бюретки уже обеспечит высокий уровень объективности ваших результатов.
Электронная бюретка также повысит и точность данных. Мне не нужно рассказывать вам, насколько важна точность в аналитической химии, но я приведу пример. Представьте, что вы определили чистоту золота в 90%, а на самом деле оно чистое на 99%. Вы бы потеряли много денег, продавая свое золото с этой иллюзией!
Ранее я показала, что визуальное распознавание конечной точки с цветовым индикаторам может привести к ошибкам до 200 мкл. Неточность ручной бюретки может вызвать погрешность в дополнительных 200 мкл. Хотя электронная бюретка не помогает добиться лучшей объективизации при распознавании конечной точки, она добавляет куда меньший объем титранта: вместо прежних 50 мкл на каплю, всего 0,25 мкл в зависимости от объема используемой бюретки. Это существенно снизит ошибку при распознавании конечной точки. Самые распространенные бюретки описаны ниже:
| Объем цилиндра бюретки (мл) | Мин. добавляемый объем (µл) |
| 5 | 0.25 |
| 10 | 0.50 |
| 20 | 1.00 |
| 50 | 2.50 |
Следующий шаг: автоматическое титрование
Если вы хотите закрыть все источники ошибок, про которые мы говорили, вам придется перейти на автоматическое титрование или автотитрование. В этом случае вы будете использовать электрод для анализа изменения pH в образце и математический алгоритм для детектирования конечной точки — индикатор вам больше не потребуется. Кроме того, вы получите ту же точность, что и с электронной бюреткой.
Ознакомьтесь с соответствующей записью в блоге для получения дополнительной информации.
How to Transfer Manual Titration to Autotitration
Author

Iris Kalkman
Product Specialist TitrationMetrohm International Headquarters, Herisau, Switzerland
1.
Меркуриметрия
Титрант – 0,05 М раствор нитрата ртути (II)
(0,1 н. раствор fэкв (Hg(NO3)2 ) = ½)
Готовят приблизительно нужной концентрации
(растворяют Hg(NO3)2 в присутствии азотной
кислоты для предотвращения гидролиза соли)
Стандартизация по хлориду натрия
Индикатор – дифенилкарбазон (C6H5NHNH)2CO
1
2.
2NaCl + Hg(NO3)2 HgCl2 + 2NaNO3
HgCl2 – малодиссоциируемое соединение
Дифенилкарбазон образует с Hg2+ сине-
фиолетовые комплексы
K(NaCl) V(NaCl)
K(Hg(NO3)2) =
V(Hg(NO3)2)
2
3.
В качестве индикатора используют также
нитропруссид натрия
Hg2+ + [Fe(CN)5NO]2– + 2H2O
Hg[Fe(CN)5NO]·2H2O
белый
Титруют до появления белого осадка
3
4.
Кривые комплексонометрического титрования
Отражают зависимость концентрации иона
металла от объема титранта
Концентрацию иона металла выражают через
обратный логарифм (по аналогии с рН).
4
5.
Рассчитать и построить кривую титрования
0,1 н. раствора ZnCl2 0,1 н. раствором ЭДТА
при рН=12.
lg = 16,3
Построим кривую титрования в координатах
«концентрация ионов цинка» — «объем
титранта»
При этом концентрацию ионов цинка выразим
через pZn = –lg [Zn2+].
5
6.
При титровании протекает реакция:
Zn2+ + Y4– ZnY2–
При рН=12 побочные
реакции не протекают
[ZnY2–]
= —————
[Zn2+]·[Y4–]
6
7.
Расчетные ф-лы в разные моменты титрования:
1) до начала титрования концентрация Zn2+
равна концентрации ZnCl2:
[Zn2+] = CZnCl2;
pZn = –lg CZnCl;
2) до т. э. [Zn2+] = CZnCl2·(1–f), где f – степень
оттитрованности (показывает, какая часть
анализируемого вещества оттитрована)
Тогда pZn = –lg CZnCl2·(1 – f)
7
8.
3) в т.э. концентрацию вещества вычисляют из
выражения для константы устойчивости:
[ZnY2–]
= —————
[Zn2+]·[Y4–]
[ZnY2–] = CZnCl2 – [Zn2+] CZnCl2
[Zn2+] = [Y4–]
CZnCl2
= —————
[Zn2+]2
CZnCl2
[Zn2+] = ————
8
9.
4) за т.э. [Zn2+] рассчитывают из , учитывая
возрастание концентрации Y4– с помощью
степени оттитрованности f:
[ZnY2–]
CZnCl2
= ————— = ———————
[Zn2+]·[Y4–] [Zn2+]·CZnCl2·(f – 1)
[Y4–] = CZnCl2·(f – 1)
1
= —————
[Zn2+]·(f – 1)
1
[Zn2+] = —————
·(f – 1)
9
10.
ЭДТА
[Zn2+]=
в%
f
1-f
=С(1–f)
pZn
рZn
30
0,3
7·10-1
7·10-1С
– lg7·10-1С
1,15
50
0,5
5·10-1
5·10-1С
– lg5·10-1С
1,3
90
0,9
1·10-1
10-1С
– lg10-1С
2
99
0,99
1·10-2
10-2С
– lg 10-2С
3
99,9
0,999
1·10-3
10-3С
– lg10-3С
4
10
11.
ЭДТА
в%
т.э.
100
f
1
1-f
—
[Zn2+]
pZn
(C/ )
½ lg – ½ lgC
рZn
8,65
lg = 16,3
f–1
100,1 1,001 10-3
16,3 – 3
1/( ·10-3)
lg + lg10-3
= 13,3
16,3 – 2
101,0
1,01
10-2
1/( ·10-2)
lg + lg10-2
= 14,3
16,3 – 1
110
1,1
10-1
1/( ·10-1)
lg + lg10-1
= 15,3
11
12.
Скачок титрования рZn = 13,3 – 4 = 9,3
рZn = рZn100,1–рZn99,9 = lg + lg10-3– (– lg10-3С)
= lg – 3 + lgС – 3 = lg – 6 + lgС
Cкачок титрования зависит от lg , концентрации анализируемого вещества и рН
Чем больше lg (больше ), тем больше скачок
Чем больше концентрация, тем больше скачок
При рН < 12 – протекают побочные реакции
12
13.
При рН = 2 комплексонометрически можно
определить Bi3+, двухзарядные катионы при
этом не титруются
Определение Bi3+ и Zn2+ при совместном
присутствии
Катионы Bi3+ и Zn2+ титруются отдельно:
Bi3+ титруются в кислой среде (рН=2)
Zn2+ титруются в щелочной среде (рН=9,5)
13
14.
Индикаторные ошибки
комплексонометрического титрования
n’(X)
Х = ———— · 100 %
n(X)
n’(X) – количество M2+ в к.т.т.
n(X) – количество M2+, взятого для титрования
14
15.
n’(X)
[M2+]·(Vx + Vt)
Х = ———— · 100 = ——————— · 100 %
n(X)
Cx·Vx
[M2+] – концентрация M2+ в растворе, при
которой металлохромный индикатор изменяет
свою окраску
pM = – lg [M2+]
10–pM · (Vx + Vt)
Х = ——————— · 100 %
Cx·Vx
15
16.
Задача: Рассчитать индикаторную ошибку
титрования 10 мл 0,1 М раствора MgCl2 0,1 М
раствором ЭДТА:
а) с индикатором КХЧС при рН=7
б) с индикатором КХЧС при рН=12
в) с индикатором КХТС при рН=12
Решение:
а) при рН=7 рMg = 2,4
10–2,4 · (10 + 10)
Х = ——————— · 100 = 7,96 %
0,1·10
16
17.
б) при рН=12 рMg = 6,9
10–6,9 · (10 +10)
Х = ——————— · 100 = 0,0003 %
0,1·10
в) при рН=12 рMg = 2,3
10–2,3 · (10 + 10)
Х = ——————— · 100 = 10 %
0,1·10
17
18.
рМInd при различных значениях рН
pH
Mn+
Ind
Ca2+
11
12
13
14
КХТС
1,5
3,1
4,3
4,3
Mg2+
КХЧС
6,3
6,9
7,0
7,0
Zn2+
КХТС
2,7
4,3
5,5
5,5
Пономарев В.Д. Практикум… стр. 259
18
19.
Осадительное титрование
Тиранты образуют с определяемым веществом
малорастворимое соединение
Требования к реакциям:
1. Определяемое вещество должно х.р. в воде и
содержать ион, образующий с титрантом
малорастворимое соединение
19
20.
2. Реакция осаждения должна протекать
стехиометрично
3. Не должно протекать побочных реакций
4. Реакция должна протекать практически до
конца
ПР<10–8 для бинарного осадка ВА,
ПР<4·10–12 для осадков типа В2А или ВА2
20
21.
Классификация методов осадительного
титрования:
1. Аргентометрия (тирант — AgNO3)
2. Тиоцианатометрия (NH4SCN)
3. Меркурометрия (Hg2(NO3)2)
4. Гексацианоферратометрия (K4[Fe(CN)6])
5. Сульфатометрия (H2SO4)
6. Бариметрия (BaCl2)
21
22.
Аргентометрия
Титрант – 0,1 М (0,1 н.) или 0,05 М (0,05 н.)
раствор AgNO3
Готовят раствор
концентрации
приблизительно
нужной
Стандартизацию проводят по хлориду натрия
(метод Мора)
Ind – хромат калия K2CrO4
22
23.
Разновидности аргентометрии
метод Мора
метод Фаянса
метод Фольгарда
23
24.
Метод Мора
Основан на определении Cl и Br прямым
титрованием раствором нитрата серебра в
нейтральной или слабощелочной среде в
присутствии индикатора – хромата калия
Метод не позволяет определять I и SCN ионы,
так как с осадками AgI и AgSCN происходит
соосаждение хромата серебра Ag2CrO4
24
25.
Определение бромидов:
NaBr + AgNO3 AgBr + NaNO3
желтоватый
AgNO3 + K2CrO4 Ag2CrO4 + 2KNO3
кирпично-красный
V(AgNO3)·K·T(AgNO3/NaBr)·100
(NaBr) = ——————————————, %
а(NaBr)
Сэкв(AgNO3)·Mэкв (NaBr)
Т(AgNO3/NaBr) = ——————————
1000
25
26.
Ind – K2CrO4 (осадительный)
Осадительные индикаторы выделяются из
раствора в виде осадка в хорошо заметной
форме в ТЭ или вблизи ее.
В процессе титрования:
образуется желтоватый AgBr
Ag2CrO4 до ТЭ не образуется, т.к.
S(AgBr)< S(Ag2CrO4)
При добавлении избыточной капли AgNO3
образуется красный осадок Ag2CrO4
26
27.
Особенности метода Мора:
1. Титрование проводится в нейтральной или
слабощелочной среде (рН=6,5-10,3), т.к.
В кислой среде Ag2CrO4 растворяется с
образованием дихромат-ионов:
2 Ag2CrO4 + 2H+ 4Ag+ + Cr2O7– + H2O
В щелочной среде образуется черный осадок
2Ag+ + 2OH– 2AgOH Ag2O + H2O
27
28.
2. Нельзя оттитровать I и SCN
3. Нельзя оттитровать соли алкалоидов и слабых
азотистых оснований (новокаин, пиридоксида
гидрохлорид, пилокарпина гидрохлорид и др.)
O
H2N
C2H5
C
O
C
H2
C N
H2
* HCl
C2H5
28
29.
Пилокарпина гидрохлорид
C2H5
O
C
H2
N CH3
* HCl
O
N
Пиридоксина гидрохлорид
CH2OH
CH2OH
HO
* HCl
H3C
N
29
30.
V(AgNO3) K Т(AgNO3/NaBr) 100
(NaBr)= (%)
а(NaBr)
Сэкв(AgNO3) Мэкв(NaBr)
Т(AgNO3/ NaBr) =
1000
30
31.
Метод Фаянса
Основан на определении Cl , Br , I и SCN
ионов прямым титрованием раствором
нитрата серебра в присутствии
адсорбционных индикаторов (флуоресцеин,
эозинат натрия, бромфеноловый синий и др.
индикаторы).
31
32.
Адсорбционные индикаторы – такие
индикаторы, адсорбция или десорбция
которых осадком при осадительном
титровании сопровождается изменением
окраски в ТЭ или вблизи ее
32
33.
Титрование по флуоресцеину проводят в
растворах с рН от 6,5 до 10,3 (определяют Cl ,
Br , I , SCN )
Титрование по эозинату натрия проводят в
уксуснокислой среде (определяют Br , I ,
SCN ).
Cl по эозинату натрия не определяют, так как
осадок хлорида серебра адсорбирует анионы
эозина еще до достижения точки
эквивалентности.
33
34.
Определение иодидов:
NaI + AgNO3 AgI + NaNO3
желтый
Принцип действия адсорбционных индикаторов
HInd H+ + Ind
[AgI · I ] [AgI]
до т.э.
т.э.
[AgI · Ag+]
+ 1 изб.
капля
Ind
цвет индикатора меняется
34
35.
Вначале титрования:
В растворе иодид-ионы
До ТЭ:
Осадок AgI и I . Иодид-ионы адсорбируются
на поверхности осадка AgI и поверхность
осадка оказывается отрицатльно заряженной
(осадки адсорбируют в первую очередь те
ионы, которые входят в их состав). Около
поверхности осадка находятся катионы,
присутствующие в растворе: Na+, H+
35
36.
ТЭ:
осадок AgI.
За ТЭ:
осадок AgI и Ag+. Ионы серебра
адсорбируются на поверхности осадка и
поверхность осадка оказывается заряженной
положительно и на ней сразу же
адсорбируются отрицательно заряженные
ионы индикатора. Происходит изменение
цвета осадка.
36
37.
Условия применения адсорбционных
индикаторов:
1. Нельзя проводить титрование при больших
концентрациях реагентов и при повышенной
ионной силе растворе, т.к. это вызывает
коагуляцию осадка и сокращению его
поверхности. Чем больше поверхность осадка,
тем отчетливее заметно изменение цвета
индикатора при его адсорбции.
37
38.
2. Следует соблюдать оптимальный интервал
изменения рН раствора
3. Индикатор не должен адсорбироваться на
поверхности осадка раньше определяемых
ионов
38
39.
Адсорбционная способность анионов при рН=7
на поверхности осадка AgCl
I– > SCN– > Br– > анион эозина > Cl– >анион
флуоресцеина > ClO4–
Каждый предшедствующий анион этого ряда
адсорбируется на поверхности осадка AgCl
раньше последующего аниона, т.е.
В присутствии эозина можно определить I–,
SCN–, Br– и нельзя определить Cl– и ClO4–
39
40.
V(AgNO3) K Т(AgNO3/NaI) 100
(NaI)= (%)
а(NaI)
Сэкв(AgNO3) Мэкв(NaI)
Т(AgNO3/NaI) =
1000
40
41.
Метод Фольгарда
Метод обратного титрования.
Титранты – AgNO3 и AgSCN
Среда – азотнокислая
Ind – железоаммонийные квасцы
NH4Fe(SO4)2 12H2O (сильнокислая среда
подавляет гидролиз соли железа (III))
Определяют Cl , Br , I
41
42.
Определение хлоридов:
NaCl + AgNO3 AgCl + NaNO3
избыток
белый
AgNO3 + NH4SCN AgSCN + NH4NO3
остаток
белый
3NH4SCN + NH4Fe(SO4)2 Fe(SCN)3 +
изб. капля
красное окрашивание
+ 2(NH4)2SO4
42
43.
Особенности определения хлоридов
т.к. SAgCl > SAgSCN
осадок AgCl удаляют:
либо фильтрованием
либо добавлением хлороформа
43
44.
(VAgNO3 K VNH4SCN K) ТNH4SCN/NaCl 100
(NaCl)= (%)
а(NaCl)
Сэкв(NH4SCN) Мэкв(NaCl)
Т(NH4SCN/NaCl) =
1000
44
45.
В фарм. анализе аргентометрия применяется для
количественного определения лекарственных
препаратов: NaCl, NaBr, NaI, KCl, KBr, KI,
солей
алкалоидов,
слабых
азотистых
оснований и др.
45
46.
Роданометрия
Титрант – 0,1 M (0,1 н.) раствор NH4SCN
Среда – азотнокислая
Ind – NH4Fe(SO4)2 12H2O
Стандартизация по стандартному р-ру AgNO3
AgNO3 + NH4SCN AgSCN + NH4NO3
белый
3NH4SCN + NH4Fe(SO4)2 Fe(SCN)3 +
красное окрашивание
2(NH4)2SO4
46
47.
В фарманализе метод применяется для к.о.
серебра в препаратах (протаргол, колларгол,
нитрат серебра).
В протарголе и колларголе серебро
предварительно переводят в ионогенное
состояние обработкой серной и азотной
кислотой при нагревании.
В полученном растворе ионы серебра
оттитровывают стандартным раствором
роданида аммония.
47
48.
МЕРКУРОМЕТРИЯ
Титрант – 0,05 M (0,1 н.) раствор нитрата
ртути(I)
Hg2(NO3)2 (fэкв = ½)
Готовят приблизительно нужной концентрации
Для перевода Hg(II) в Hg(I) добавляют
металлической ртути, выдерживают сутки
Стандартизация по хлориду натрия
Ind – дифенилкарбазон, тиоцианатные
комплексы железа(III)
48
49.
2NaCl + Hg2(NO3)2 Hg2Cl2 + 2NaNO3
В титруемый раствор вводят NH4SCN и Fe(NO3)3
– образуется красный комплекс Fe(SCN)3
После достижения ТЭ, избыточная капля
титранта разрушает Fe(SCN)3, раствор
обесцвечивается
Параллельно проводят контрольный опыт
49
50.
Дифенилкарбазон (C6H5NHNH)2CO –
адсорбционный индикатор
Добавляется в конце титрования
Вблизи ТЭ индикатор окрашивает осадок в
интенсивный синий цвет
50
51.
Кривые осадительного титрования
Отражают зависимость концентрации вещества
от объема титранта
Концентрацию вещества выражают через
обратный логарифм (по аналогии с рН).
51
52.
Рассчитать и построить кривую титрования
0,1 н. раствора NaCl 0,1 н. раствором AgNO3
ПРAgCl = 1,8 10-10
Построим кривую титрования в координатах
«концентрация хлорид-ионов» — «объем
титранта»
При этом концентрацию хлорид ионов выразим
через pCl = –lg [Cl–].
52
53.
Расчетные ф-лы в разные моменты титрования:
1) до начала титрования концентрация Cl– равна
концентрации NaCl:
[Cl–] = CNaCl; pCl = –lg CNaCl;
2) до точки эквивалентности [Cl–] = CNaCl (1 – f),
где f – степень оттитровывания (показывает,
какая часть анализируемого вещества
оттитрована)
Тогда pCl = –lg CNaCl(1 – f)
Если оттитровано 30 %, то f = 30 / 100 = 0,3
50 % f = 50 / 100 = 0,5
90 % f = 90 / 100 = 0,9
53
54.
3) в т.э. концентрацию вещества вычисляют из
произведения растворимости осадка.
[Cl–] = ПР
рCl = – ½ lg ПРAgCl
4) за т.э. [Cl–] рассчитывают из ПРAgCl ,
учитывая возрастание концентрации Ag+ с
помощью степени оттитрованности f:
[Cl–] = ПР / [Ag+] = ПР / CAgCl(f – 1)
рCl = –lg ПРAgCl + lg CAgCl(f – 1)
54
55.
99
f
0,99
1-f
10-2
[X–]=
=С(1–f)
10-2С
99,9
0,999
10-3
10-3С
3 – lgС
4
т.э.
100
1
—
ПР
– ½ lg ПР
1,001
1,01
f–1
10-3
10-2
4,87
5
10–4
=6
AgNO3
в%
100,1
101,0
pX
2 – lg С
рCl
3
ПР/(10-3C) –lgПР–3+lgС
ПР/(10-2C) –lgПР–2+lgС 10–3
=7
55
56.
Скачок титрования
рХ = рХ100,1 – рХ99,9 = -lgПР – 3 + lgС – 3 + lgC
= -lgПР – 6 + 2lgС
Cкачок титрования зависит от ПР и
концентрации анализируемого вещества
Чем меньше ПР, тем больше рХ
Чем больше концентрация, тем больше рХ
56
57.
Скачок титрования лежит в интервале 4 – 6
При индикаторной фиксации ТЭ выбирают
индикатор, который резко меняет свои
видимые свойства в данном интервале
57
58.
Индикаторная ошибка осадительного
титрования обусловлена перетитровыванием
раствора и равна:
n (T) 100
X% = —————
n(T)
n (T) – избыточное количество титранта в
конечной точке титрования
n(T) – количество титранта в точке
эквивалентности
58
59.
С T (VX + VT)
X% = ———————— 100
СT V T
С T – концентрация титранта в конечной точке
титрования
СT – исходная концентрация титранта
VT – объем титранта
VX – объем анализируемого раствора
Концентрация ионов титранта в к.т.т рассчитывается из значения ПР осадка титранта с Ind
59
60.
Рассчитать индикаторную ошибку при
титровании 10 мл 0,1 н. раствора хлорида
калия 0,1 н. раствором нитрата серебра в
присутствии индикатора – 10-5 моль/л
хромата калия
60
61.
С T (VX + VT)
X% = ———————— 100
СT VT
ПР(Ag2CrO4) = [Ag+]2[CrO42–] = 1,1 10–12
ПР(Ag2CrO4)
1,1 10–12
[Ag+] = ——————— = ——————— =
[CrO42–]
10-5
= 3,3 10–4 моль /л
61
62.
3,3 10–4 (10 + 10)
X% = ——————— 100 = 0,66 %
0,1 10
Ошибка велика, целесообразно увеличить
концентрацию индикатора
Тогда для концентрации индикатора 10–3 моль/л
ошибка титрования составит:
3,3 10–5 (10 + 10)
X% = ——————— 100 = 0,066 %
0,1 10
62
63.
63

