Аденокарцинома – это опасная для жизни опухоль, которая развивается в клетках, выделяющих слизь, пищеварительные соки и другие жидкости. Она представляет из себя разновидность карциномы – самого распространенного типа рака. Ее клетки способны прорастать в окружающие ткани, разрушать их, распространяться по телу и создавать различных его частях метастазы – дополнительные онкологические новообразования.
Что такое аденокарцинома и как она развивается?
В организме человека есть более 30 триллионов клеток, каждая из которых действует согласно строго определенной встроенной «программе»: рождается, работает и умирает. Иногда из-за влияния некоторых заболеваний, химических веществ, радиации, наследственных особенностей или случайных сбоев в процессе их деления возникают ошибки. В результате чего в теле появляются мутировавшие, или измененные клетки, обладающие особыми свойствами:
- Бесконтрольно размножаются.
- Не погибают по окончанию нормального жизненного цикла.
- Со временем из их множества формируется опухоль, которая не раздвигает окружающие ткани, а прорастает в них и разрушает.
- Они отрываются от основного, так называемого первичного очага, попадают в сосуды кровеносной и лимфатическойЛимфатическая система дублирует кровеносную. В ней циркулирует лимфа – межклеточная жидкость, которая омывает все клетки тела, доставляет в них необходимые вещества и забирает отходы. На всем протяжении ее сосудов расположены лимфоузлы – похожие на горошину маленькие органы, которые обезвреживают и выводят из организма опасные вещества. систем.
- С кровью и лимфой – жидкостью, омывающей все клетки организма, перемещаются в различные части тела.
- Закрепляются в других структурах и органах, таких как мозг, печень, легкие или кости, и создают в них метастазы – дополнительные раковые новообразования.
Со временем все большее количество жизненно важных тканей повреждается, а их работа нарушается.
Какие бывают метастазы и как они перемещаются по организму?
Измененными могут стать и клетки желез, выделяющие различные жидкости. Чаще всего аденокарциномы возникают в:
- Желудке, в котором происходит накопление и расщепление пищи.
- Легких, и составляют около 40% всех видов опасных опухолей дыхательных путей. Они развиваются в клетках, которые производят слизь, необходимую для выведения из тела пыли и микробов, содержащихся в воздухе. Обычно медленно растут и чаще встречаются у курильщиков, в том числе бывших.
- Молочной железе, и составляют большинство видов рака данного органа. Формируются в клетках, производящих грудное молоко.
- Пищеводе – трубке, по которой пища проходит из рта в желудок. Как правило, измененными становятся клетки, которые выстилают ее нижнюю часть и создают смазывающую слизь.
- Поджелудочной железе, расположенной за желудком. Около 85% всех случаев ее онкологических заболеваний – это аденокарциномы, возникающие в протоках, переносящих необходимые для пищеварения вещества.
- Предстательной железе у мужчин, находящейся чуть ниже мочевого пузыря. Развивается в клетках, производящих защищающую сперматозоиды жидкость.
- Прямой кишке, выводящей остатки переваренной пищи из организма.
- Толстой кишке, в которой происходит всасывание воды и питательных веществ. Аденокарцинома – это самый распространенный тип рака данного органа. Обычно они начинаются с небольшого полипа – нароста ткани на внутренней стенки.
Причины развития аденокарциномы
Сегодня научное сообщество не знает, почему именно возникают все случаи онкологии. Врачам известны только так называемые факторы риска, которые увеличивают вероятность появления в организме измененных клеток. Наличие одного или даже нескольких из них не гарантируют того, что заболевание обязательно разовьется. У каждого типа аденокарциномы есть свой список возможных причин.
Легкое:
- Курение, в том числе пассивное, то есть вдыхание табачного дыма.
- Загрязнение воздуха и химические вещества, такие как радиоактивный газ радон, диоксид кремния, прочие тяжелые металлы и использующийся в строительстве и другой промышленности асбест.
- Семейный анамнез – наличие кровных родственников, у которых уже есть подобный диагноз.
- Облучение: радиация, полученная в ходе диагностики и лечения различных видов онкологических заболеваний при воздействии на область грудной клетки.
Предстательная железа:
- Риск развития рака увеличивается после 50 лет, при этом большинство случаев выявляется у мужчин старше 65 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Курение.
- Ожирение и лишний вес.
- Семейный анамнез — наличие кровных родственников с подобным диагнозом.
- Неправильное питание: лишние калории, избыток животных жиров и сахара в рационе, а также нехватка фруктов и овощей.
- Недостаточная физическая активность.
- Воспалительные заболевания простаты.
Поджелудочная железа:
- Вероятность развития аденокарциномы повышается с возрастом. Большая часть случаев выявляется у пациентов старше 65 лет, причем у мужчин чаще, чем у женщин.
- Наследственные генетические синдромы, увеличивающие риск возникновения опухолей.
- Мутации, или изменения, вызывающие панкреатит – воспаление поджелудочной железы.
- Некоторые факторы образа жизни: курение, лишний вес, нехватка физической нагрузки, злоупотребление алкоголем и диета с высоким содержанием жира и красного мяса.
Пищевод:
- Пол и возраст: большинство случаев новообразований выявляется у мужчин старше 55 лет.
- Травмы и повреждения пищевода, в том числе от кислоты, забрасываемой из желудка, алкоголя и горячих жидкостей.
- Другие виды рака: легких, ротовой полости или горла.
- Наследственность – наличие кровных родственников, у которых уже есть подобный диагноз.
- Тилоз – чрезмерное разрастание верхнего слоя кожи на ладонях и подошвах стоп, а также образование папиллом, которые представляют из себя небольшие наросты ткани в пищеводе.
- Питание: нехватка в рационе фруктов и овощей.
- Воздействие химикатов и раздражителей, таких как сажа, табачный дым, выхлопные газы, металлическая пыль и других.
Кишечник:
- Чаще всего колоректальные аденокарциномы встречаются у мужчин старше 50 лет.
- Воспалительные заболевания, приводящие к постоянному повреждению стенок органа.
- Ожирение.
- Сидячий образ жизни и отсутствие физической нагрузки.
- Употребление алкоголя и табака.
- Полипы – разрастания тканей на стенке кишечника.
- Диета с низким содержанием клетчатки и высоким – жира и полуфабрикатов из мяса.
Молочная железа:
- Семейный анамнез – наличие родственников с подобным диагнозом.
- Возраст от 55 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Ранние менструации – до 12 лет, и менопауза после 55 лет.
- Лучевая терапия – облучение области грудной клетки.
- Плотная ткань молочной железы.
- Употребление алкоголя.
- Ожирение.
- Наличие рака груди или яичников, в том числе находящихся в ремиссииРемиссия – это полное отсутствие признаков заболевания.
- Нехватка физической активности.
- Отсутствие беременностей, грудного вскармливания и роды после 30 лет.
Желудок:
- Большинство пациентов – мужчины в возрасте от 60 лет.
- Избыточный вес.
- Алкоголь и табак.
- Полипы – разрастания ткани на стенке органа.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Избыток красного мяса в рационе, употребление большого количества соленой, маринованной или копченой пищи.
- Инфекция Helicobacter pylori – бактерии, повреждающие слизистую оболочку желудка и приводящие к развитию язвы и гастритаГастрит – это воспаление слизистой оболочки желудка..
- Наличие родственников с подобным диагнозом.
- Группа крови А (II).
- Наследственные синдромы, провоцирующие разрастание тканей или возникновение опухолей.
Аденокарцинома развивается из-за ошибок в генах, которые контролируют рождение, работу и смерть клеток. Такие изменения происходят по нескольким причинам.
- Часть возникает при делении клеток.
- Некоторые из них вызваны воздействием вредных веществ и образом жизни.
- И в части случаев они наследуются от родителей.
Так называемые онкогены стимулируют развитие клеток, а супрессоры опухолей – замедляют их рост и вызывают гибель по окончанию жизненного цикла. Если в результате различных нарушений первые из них активируются, а вторые «выключаются», в организме человека появляется рак.

Диагностика аденокарциномы
Сегодня медицина предлагает множество различных методов, позволяющих выявлять раковые опухоли даже на самых ранних этапах.
- Биопсия – изъятие небольшого количества тканей для изучения свойств ее клеток. Данное исследование – единственный способ постановки точного диагноза. Материал забирается в ходе хирургической операции или прокола иглой, после чего передается в лабораторию, где специалисты выявляют в нем раковые клетки и определяют их тип. Эта информация необходима врачам для подбора правильного лечения и определения прогнозов пациента.
- Рентгенография грудной клетки, а также маммография, обнаруживающая новообразования в молочной железе.
- УЗИ , или сонография – оценка состояния внутренних структур с использованием звуковых волн. Процедура не наносит вреда организму пациента и часто выполняется для выявления очагов заболевания, расположенных в том числе в лимфатических узлах – органах иммунной системы, задерживающих и уничтожающих опасные вещества.
- Магнитно-резонансная томография, МРТ – создание крайне подробного и детализированного изображения мягких тканей, включая мозг, нервы и сосуды при помощи мощных магнитов и радиоволн. МРТ обнаруживает опухоли и определяет их точные размеры и границы. Она не назначается людям с несовместимыми трансплантатами и протезами и не дает возможности исследовать части скелета, в которые часто проникают измененные клетки.
- Компьютерная томография, или КТ. Специальный аппарат делает множество рентгеновских снимков и объединяет их в одну четкую черно-белую картинку. КТ позволяет изучать не только мягкие структуры, но и кости, а также содержащие большое количество воздуха органы, такие как легкие.
- Позитронно-эмиссионная томография. До начала процедуры человек получает небольшое количество радиоактивного сахара, который накапливается в быстро делящихся клетках, в том числе раковых. Затем проводится сканирование, выявляющее любые, даже самые маленькие их скопления. ПЭТ применяется для поиска в организме метастазов – дополнительных очагов онкологии, если врачи точно не знают, в какой именно области они могут находиться. Некоторое оборудование позволяет одновременно выполнять ПЭТ и КТ, благодаря чему доктор получает гораздо больше информации, чем дает каждое из данных исследований.
- Анализы крови. Назначаются для поиска онкомаркеров – белков, выделяемых некоторыми типами измененных клеток, а также для оценки качества работы внутренних органов, таких как почки и печень.
Пройти полную диагностику аденокарциномы можно в онкологическом центре «Лапино-2».
У нас есть высококвалифицированные специалисты и современное оборудование, которое позволяет выявлять опасные опухоли на самых ранних стадиях.
У пациентов нашей клиники нет необходимости тратить времени на поездки по разным медицинским учреждениям – все процедуры выполняются на территории Центра. Исследования проводятся без очереди, в максимально сжатые сроки, а результаты анализов мы получаем из собственной лаборатории.
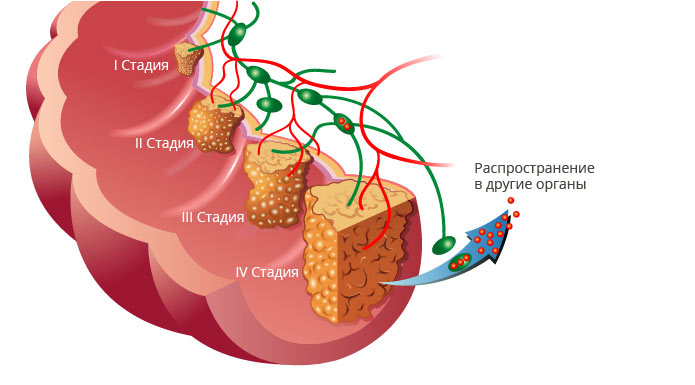
Стадии аденокарциномы
После выявления рака врачи выясняют его стадию – количество пострадавших от измененных клеток тканей. Для определения этапа аденокарциномы используется международная система TNM, основанная на 3 ключевых моментах:
- Т: размере основной опухоли.
- N: количестве поврежденных лимфатических узлов.
- М: наличии или отсутствии метастазов – дополнительных очагов заболевания в различных областях организма.
Стадии:
В тканях присутствуют измененные клетки, но они есть только там, где впервые возникли.
I. Опухоль имеет минимальные размеры и находится в пределах органа, в котором она образовалась.
II. На этом этапе очаг разрастается до более крупных габаритов, но другие структуры здоровы.
III. Новообразование увеличивается еще сильнее и выходит за границы органа, в котором появилось. Либо неправильные клетки обнаруживаются в лимфатических узлах – «фильтрах» иммунной системы, задерживающих и обезвреживающих опасные вещества.
IV. Единственная стадия, в медицинском шифре которой рядом с буквой «М» стоит цифра «1», а не ноль. Это значит, что в теле пациента присутствуют метастазы – дополнительные раковые опухоли в других областях организма, расположенных далеко от первичного очага.

Лечение аденокарциномы
Тактика борьбы с раком зависит от большого количества факторов: количества пострадавших тканей, размера и расположения опухоли, возраста человека, наличия у него других тяжелых заболеваний и его общего состояния здоровья.
Часто основным методом лечения аденокарциномы является хирургия – удаление новообразования и небольшого количества окружающей ее здоровой ткани. Нормальные структуры изымаются для того, чтобы в организме не осталось ни одной измененной клетки, которая могла бы размножиться и сформировать новый очаг заболевания.
Операции проводятся как классическим способом – с выполнением крупных разрезов, так и лапароскопически – с использованием специального инструмента через небольшие проколы. Такие вмешательства позволяют повреждать минимум тканей и сокращают кровопотерю, болевые ощущения и сроки восстановления, но требуют большого опыта и мастерства хирурга.
Химиотерапия – применение препаратов для уничтожения неправильных клеток. Они вводятся в вену или принимаются внутрь, попадают в кровоток, распространяются по всему телу и действуют во всех его областях. Благодаря такому свойству их можно использовать в том числе на запущенных стадиях, при распространении рака и появлении метастазовМетастаз – это новая, дополнительная онкологическая опухоль, возникшая в тканях или органах, расположенных далеко от основного ракового очага.. «Химия» проводится циклами, каждый из которых чередуется с периодом отдыха, необходимого для восстановления организма.
Лучевая терапия – разрушение измененных клеток радиацией. Лечение предполагает 2 вида воздействия:
- внешнее – облучение из специального аппарата, расположенного вне тела;
- и внутреннее, или брахитерапию – размещение радиоактивных веществ в опухоли или близких к ней тканях.
Может назначаться совместно с химиотерапией. Проводится до операции для уменьшения размеров опухоли и облегчения ее удаления, а также после хирургического вмешательства для уничтожения всех оставшихся неправильных клеток.
Таргетная терапия – прием препаратов, которые воздействуют только на определенные изменения в клетках. С их помощью можно остановить рост новообразования или уменьшить его размеры. В отличие от обычной «химии», влияющей на любые быстро делящиеся клетки, такие вещества практически не повреждают здоровые ткани.
Гормональная терапия. Гормоны – это вещества, которые создаются железами, с кровью перемещаются в различные ткани и сообщают им, как действовать – работать или отдыхать, поглощать что-то или выделять. Данные соединения влияют на развитие некоторых видов аденокарцином. Контроль их количества или прекращение выработки с помощью специальных лекарств может замедлить или прекратить увеличение опухолей.
Иммунотерапия – средства, которые помогают собственной иммунной системе человека выявлять и разрушать измененные клетки. Такие препараты обычно назначаются пациентам с распространенным раком для сокращения размеров новообразований и остановки их роста.
В онкологическом центре «Лапино-2» проводится лечение различных типов аденокарцином на любой стадии.
У нас работают отличные специалисты – врачи с мировым именем и огромным опытом в области выявления и борьбы с онкологическими заболеваниями.
Мы применяем все современные методики и используем исключительно оригинальные препараты, дающие предсказуемый результат.
Нашим пациентам не приходится терять драгоценное время – у нас нет очередей, а все процедуры проводятся точно в срок, с максимальным комфортом для каждого посетителя.
Прогнозы и выживаемость при аденокарциноме
Прогноз индивидуален для каждого человека и зависит от множества факторов: возраста, наличия других тяжелых заболеваний, типа рака, его распространенности, свойств его клеток и реакции на проводимую терапию.
Врачи определяют примерные перспективы пациента, ориентируясь на данные «пятилетней выживаемости». Этот показатель представляет из себя статистическую выборку – количество больных, оставшихся в живых через 5 или более лет с момента постановки диагноза.
Для различных типов аденокарциномы общая для всех стадий цифра выглядит следующим образом:
- опухоли желудка: 32%;
- кишечника: 90%;
- легких: 56%;
- молочной железы: 90%;
- пищевода: 47%;
- поджелудочной железы: 10%;
- тонкой кишки: 68%.
Эффективность лечения рака зависит не только от развития методов терапии — без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее — определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой — исследование образцов опухолевых клеток.
С каким образцами опухолевых клеток работает патоморфология?
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Зачем изучать опухоли под микроскопом?
Количество известных разновидностей опухолей — велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог — ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире — неверны. Половина этих ошибок не становятся фатальными — различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория — это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Гистология и иммуногистохимия — в чем отличие?
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли — т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению — иммуногистохимия.
Зачем нужно иммуногистохимическое исследование?
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
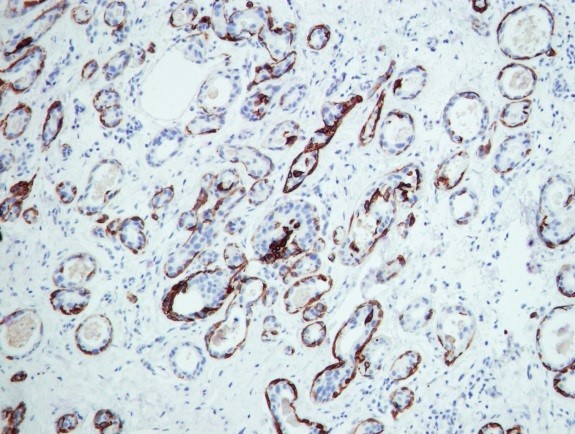
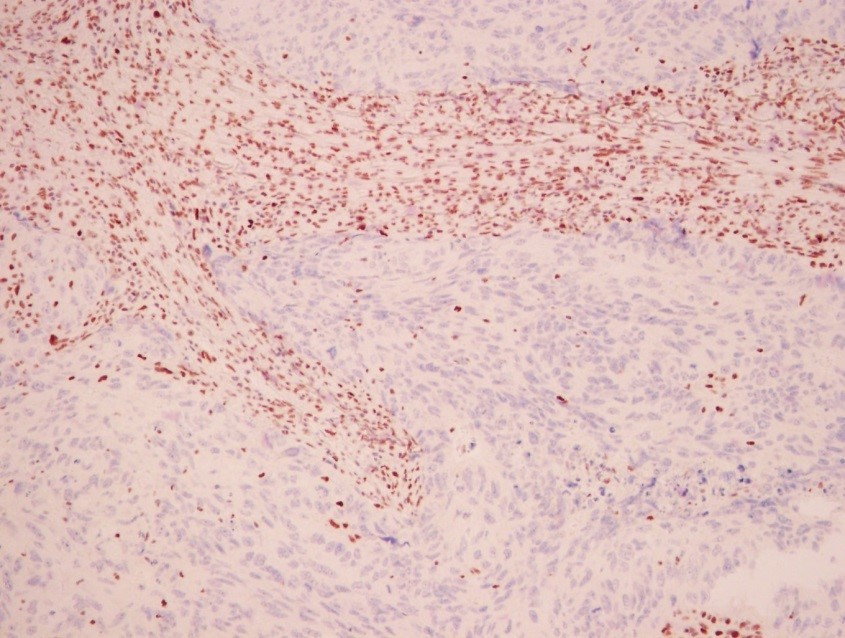
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
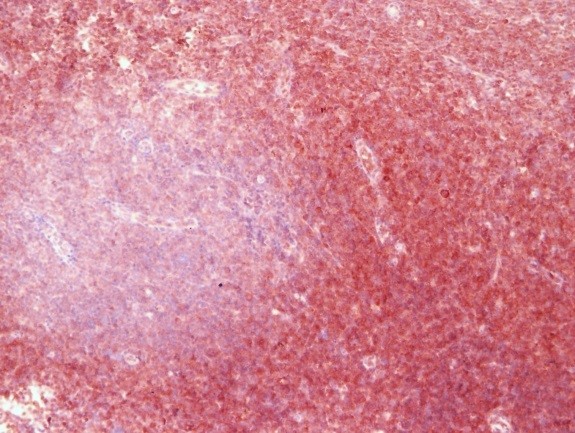
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Лечим метастазы. Когда не обойтись без патоморфолога?
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Молекулярные исследования + Таргетная терапия + Иммунотерапия = Эффективное лечение рака
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Какой рак можно вылечить без операции?
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
- рак молочной железы;
- рак простаты;
- рак кишечника;
- рак легкого;
- лимфомы;
- рак желудка;
- меланома
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Как повысить качество морфологической диагностики в клиниках России?
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
Почему следует выбрать патоморфологическую лабораторию МИБС?
- исследование и оценка рассматриваемого материала проводится одновременно несколькими ведущими специалистами в центральной патоморфологической лаборатории МИБС в Санкт-Петербурге, сотрудничающей с федеральными онкологическими центрами.
- все вопросы логистики центр МИБС в вашем регионе берет на себя.
- МИБС владеет всеми технологиями, необходимыми для постановки правильного патоморфологического диагноза. От вас не потребуется проводить дополнительные исследования в других лабораториях.
- Иммуногистохимическое исследование может быть проведено в полном объеме за счет средств ОМС (бесплатно для пациента) при наличии направления по форме 14у.
Как заказать морфологическое / иммуногистохимическое исследование в МИБС?
- позвоните в любой центр МИБС в вашем регионе;
- привезите материал (гистологические препараты, парафиновые блоки, копию выписки из истории болезни и прочие документы, описывающие характер заболевания) в центр МИБС вашего города;
- получите заключение через 3-10 дней (в зависимости от вида и объема исследования).
заместитель главного врача по лабораторной медицине МИБС
врач-патологоанатом
доктор медицинских наук
Аденокарцинома — это злокачественная опухоль, которая поражает железистые клетки организма. Практически все ткани человеческого тела содержат железистые клетки в том или ином количестве. Следовательно, аденокарцинома является одним из самых распространенных и опасных видов злокачественных новообразований.
Аденокарцинома может поражать органы желудочно-кишечного тракта, мочеполовой и дыхательной систем. Чаще всего диагностируют аденокарциному:
- у мужчин — в печени, кишечнике, легких, в предстательной железе,
- у женщин — в молочной железе и в шейке матки.
Опасность болезни и прогноз выживаемости зависит от стадии заболевания, наличия метастаз и обширности поражения.
Далее в статье вы узнаете, что такое аденокарцинома, какие виды, формы и стадии ее существуют, как проявляется болезнь, как ее диагностируют и лечат, а также прогноз выживаемости больных.
1. Что такое аденокарцинома
Чтобы разобраться в том, что такое аденокарцинома, рассмотрим более подробно виды и природу злокачественных новообразований.
Все злокачественные новообразования по типу строения клеток принято делить на два основных типа:
- рак или карцинома ( от др.-греч. — «рак», «опухоль») — это злокачественная опухоль, развивающаяся из клеток эпителиальной ткани, которая выстилает различные внутренние органы, слизистые оболочки, кожу;
- саркома — злокачественные образования в соединительной ткани (костной, мышечной, хрящевой, жировой, кровеносной, лимфатической). Основное отличие сарком от рака состоит в том, что рак происходит из эпителиальных клеток, которые выстилают внутренние полости органов, кожи и слизистой оболочка полости рта, а саркомы не привязаны к каким-либо органам.
Карциномы — это опухоли, привязанные к какому-либо органу в теле человека, так как развиваются они из клеток эпителиальной ткани. Эпителиальная ткань (эпителий) состоит из плотно прижатых клеток, вырабатывает железы, покрывает всю наружную поверхность тела и выстилает внутреннюю поверхность органов пищеварительной, дыхательной и мочеполовой систем, серозные оболочки. Из эпителиальной ткани построены паренхима (главная ткань) почки, печени и, за исключением некоторых отделов желез внутренней секреции, все железы организма. Эпителий выполняет функцию защиты, предохраняя другие ткани от повреждения.
По строению эпителия выделяют следующие его типы:
— покровный (однослойный и многослойный, плоский, кубический, цилиндрический) — является пограничной тканью и выполняет основные функции: защита от внешних воздействий и участие в обмене веществ;
— переходный — его строение изменяется в зависимости от степени растяжения стенки органа. В одних случаях он имеет строение, напоминающее многослойный эпителий, в других — многорядный эпителий;
— железистый — состоит из секреторных клеток — гландулоцитов, выделяющих активные вещества (секрет, гормон). Железистый эпителий характерен для желез (слюнных, поджелудочной и др.). Если секреты выделяются на поверхность кожи, слизистых оболочек и в полости ряда внутренних органов — это внешняя (экзокринная) секреция, а если в кровь и лимфу — внутренняя (эндокринная) секреция.
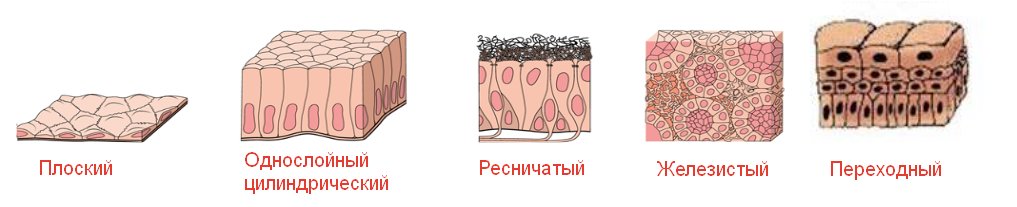
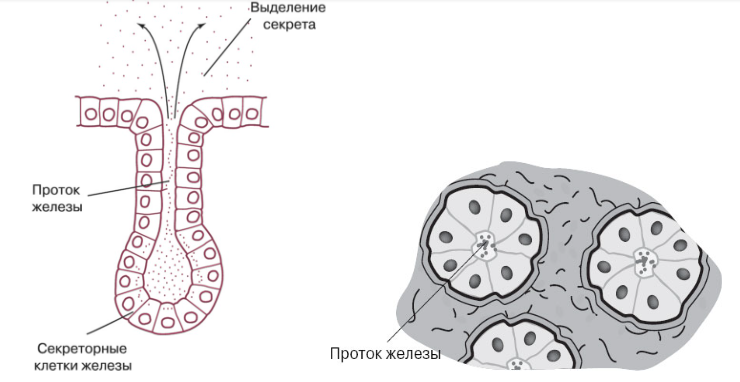
Строение железистого эпителия
Следовательно, карциномы могут брать начало от клеток плоского покровного, переходного или железистого эпителия:
- рак, происходящий из плоского эпителия, называется плоскоклеточным. К данному типу относятся злокачественные опухоли пищевода, кожи, прямой кишки;
- рак, происходящий из переходного эпителия, называется переходноклеточным или уротелиальный рак, так как переходный эпителий типичен для мочевыводящих органов;
- рак, происходящий из железистого эпителия, носит название аденокарцинома. Это очень обширная группа опухолей, локализующихся во многих органах, имеющих в своей структуре железистый эпителий. К этой разновидности относится карцинома молочных желез, бронхов, предстательной железы и др. органов.
Таким образом, аденокарцинома (железистый рак) (др.-греч. — «железа» и др.-греч. — «рак» и «опухоль») — наиболее распространенный тип злокачественных новообразований, которые развиваются из клеток железистого эпителия. Этот слой ткани покрывает большинство внутренних органов и слизистых оболочек в организме человека, поэтому опухоли аденокарциномы могут образовываться во всех органах с такой структурой (желудок, легкие, простата, молочная железа, кишечник и т.д.).
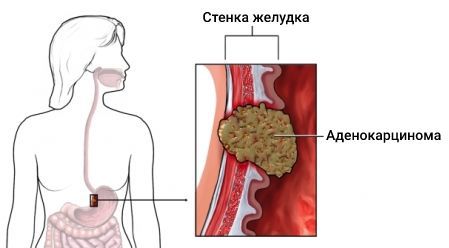
Особенности аденокарцином зависят от пораженного органа. В целом, аденокарцинома представляет собой новообразование, которое не имеет четких границ. Опухоль может достигать разнообразных размеров, что связано с длительностью опухолевого роста.
2. Виды аденокарциномы
Аденокарциному классифицируют по форме и скорости роста, строению, локализации и степени распространенности опухоли.
Выделяют две формы роста опухоли:
- эндофитную — опухоль растет вглубь подлежащих тканей,
- экзофитную — предполагает рост опухоли наружу.
В зависимости от скорости роста и реакции на лечение выделяют такие виды аденокарцином:
- высокодифференцированная аденокарцинома — опухоль медленно распространяется и хорошо поддается лечению, злокачественность малой степени;
- умеренно дифференцированная аденокарцинома — характеризуется средней агрессивностью и скоростью роста, умеренная степень злокачественности;
- низкодифференцированная аденокарцинома — самая опасная, так как новообразование быстро распространяется по организму, рано дает метастазы и плохо поддается лечению, высокая степень злокачественности.
Виды аденокарциномы в зависимости от локации (органа) поражения:
- аденокарцинома желудка;
- аденокарцинома пищевода;
- аденокарцинома поджелудочной железы;
- аденокарцинома молочной железы;
- аденокарцинома кишечника;
- аденокарцинома матки;
- аденокарцинома печени;
- аденокарцинома легких;
- аденокарцинома предстательной железы.
Виды аденокарциномы в зависимости от структуры новообразования:
- папиллярная (сосочковая) — структура такой аденокарциномы похожа на сосочки или папилломы. Именно такой вид аденокарциномы имеет хороший прогноз в большинстве случаев, если вовремя произвести лечение;
- фолликулярная — структура такой аденокарциномы представляет коллоидные частицы. Размер опухоли обратно пропорционален процессу протекания поражения: чем больше опухоль, тем протекание медленнее и наоборот. Метастазы при таком подвиде рака распространяются с током крови по различным частям тела;
- тубулярная — структура такой аденокарциномы состоит из цилиндров, трубок и кубиков (тубулярные структуры). Локализуются они в фиброзной соединительной ткани;
- солидная — в структуре опухоли много массивных пластов паренхимы (главная функциональная ткань печени, селезенки, легкого и некоторых других органов), а стромы (опорная структура органов, тканей и клеток) относительно мало;
- кистозная — в структуре таких опухолей практически всегда образуются кисты;
- ацинарная — такая аденокарцинома представляет собой опухоль предстательной железы, диагностируется чаще прочих и имеет долгое бессимптомное течение. При исследовании хорошо видна дифференцировка тканей: раковые клетки различного размера с ядрами и цитоплазмой;
- мелкоацинарная — это вид рака, находящийся в периферической (чаще всего) предстательной железе или переходной зоне простаты. Она состоит из небольших ацинусов с нарушениями структуры в нескольких местах;
- инвазивная — вид аденокарциномы, которая распространяется за границы пораженной области на здоровые части тела. Этот процесс подразумевает проникновение измененных онкологией клеток в ткани на глубину до 6 мм за пределами пораженного участка.
Виды аденокарциномы в зависимости от жидкости, которую вырабатывает опухоль:
- серозная — злокачественные клетки вырабатывают серозную жидкость;
- гнойная — такая опухоль характеризуется наличием выделений гнойного характера;
- слизисто-секреторная (муцинозная) — аденокарцинома с разными видами клеток, характеризующаяся наличием полости с содержанием муцина.
3. Стадии аденокарциномы и прогноз выживаемости
Важным показателем, влияющим на выбор тактики лечения и прогноз выживаемости, является стадия аденокарциномы. Онкологи всего мира используют общепринятую классификацию TNM, в которой буквы обозначают:
- T — размеры первичной опухоли и ее прорастание в окружающие ткани,
- N — поражение регионарных лимфоузлов,
- M — отдаленные метастазы.
Рядом с каждой буквой указывают соответствующее обозначение:
- Tis — рак «на месте» (in situ). Он находится в пределах слоя тканей, в котором возник, и не прорастает глубже. Это самая начальная стадия.
- T0 — первичная злокачественная опухоль отсутствует.
- T1-4 — увеличение размеров опухоли и ее прорастание в более глубокие слои стенки органа, распространение в соседние анатомические структуры.
- N0 — не обнаружено очагов в регионарных лимфатических узлах.
- N1-3 — поражение определенного количества лимфоузлов.
- M0 — отдаленные метастазы аденокарциномы отсутствуют.
- M1 — отдаленные метастазы аденокарциномы обнаружены.
Часто используют упрощенную систему стадирования и показатели T, N и M объединяют в пять стадий:
- стадия 0 — рак «на месте» без распространения в регионарные лимфоузлы и отдаленных метастазов;
- стадия 1 — инвазивная опухоль, которая может прорастать в стенку органа на разную глубину;
- стадия 2 — опухоль, которая прорастает в соседние органы;
- стадия 3 — поражение регионарных лимфоузлов;
- стадия 4 — аденокарцинома с отдаленными метастазами.
В зависимости от стадии, на которой начали лечение, локализации опухоли, наличия осложнений и сопутствующих заболеваний, прогноз выживаемости больного может быть разным. Прогноз выживаемости при раке измеряют 5-летней выживаемостью, т.е.процент людей с заболеванием, которые пережили рубеж в 5 лет. Примерный прогноз выживаемости при аденокарциноме:
- 0 стадия — 92-100%
- 1 стадия — 80-100%
- 2 стадия — 50-100%
- 3 стадия — 37-93%
- 4 стадия — 15-50%
Для каждого типа рака и каждой стадии существует свой прогноз выживаемости. Например, рак молочной железы, толстой и прямой кишки лечится довольно успешно, а при раке легкого, поджелудочной железы прогноз менее благоприятный.
4. Симптомы аденокарциномы
Симптомы аденокарциномы зависят от вида и локализации опухоли. На ранних стадиях аденокарциномы обычно не вызывают каких-либо симптомов. Чаще всего симптомы появляются на 2-3 стадии, когда болезнь начинает распространяться по организму.
Общие симптомы аденокарциномы:
- слабость, усталость;
- низкая работоспособность;
- потеря аппетита;
- снижение массы тела;
- анемия;
- потеря веса;
- проблемы с пищеварением;
- локализованная боль.
Симптомы болезни зависят от того, в каком органе находится злокачественная опухоль:
- аденокарцинома желудка: ухудшение аппетита, снижение веса, наполненность желудка, приступы тошноты и рвоты, слабость, болевые ощущения;
- аденокарцинома легких: кашель невыясненного происхождения, изменение голоса, охриплость, боль в грудной клетке, одышка, увеличение лимфоузлов, частые пневмонии;
- аденокарцинома молочной железы: изменение цвета и формы молочной железы и соска, уплотнение, болевые ощущения, выделения из соска, отечность железы;
- аденокарцинома предстательной железы (простаты): расстройство мочеиспускания, боли в паховой области, крестце, нарушение потенции, гипоспермия, боль во время семяизвержения, примесь крови в семенной жидкости;
- аденокарцинома яичника: нерегулярные менструации, вздутие живота, дискомфорт внизу живота, кишечная непроходимость;
- аденокарцинома кишечника: болезненный живот, диарея, выделение слизи, гноя из заднего прохода, ложные позывы к опорожнению, болезненная дефекация, кровь и слизистые выделения в кале;
- аденокарцинома матки: постоянные ноющие боли в прямой кишке, маточные кровотечения в период менопаузы, значительное увеличение размеров живота(на поздних стадиях), слишком обильные и продолжительные менструации;
- аденокарцинома пищевода: боли за грудиной, болезненное и затрудненное глотание (особенно твердой пищи), чувство давления, жжения за грудиной, рвота;
- аденокарцинома поджелудочной железы: боли в животе и в спине, обесцвеченный жирный стул, кожный зуд;
- аденокарцинома печени: болезненность в области правого ребра и подреберья, глаза и кожа желтоватого цвета;
- аденокарцинома полости носа: отек миндалин, не проходящее воспаление миндалин, боли в гортани, глотке, носу, неприятные ощущения при глотании, боль в ушах, нарушение речи, увеличение лимфоузлов.
Чтобы как можно раньше распознать рак, важно внимательно относиться к своему здоровью, обращать внимание на любые необычные симптомы, которые сохраняются в течение длительного времени.
Если вы на протяжении длительного времени замечаете у себя какие-либо из вышеперечисленных симптомов, незамедлительно обратитесь к врачу.
Качественную диагностику с применением самых передовых международных методик и инструментов пациенты клиники Onco.Rehab всегда могут провести у наших партнеров. Для записи и получения более детальной информации заполните ФОРМУ.
5. Причины появления аденокарциномы
Причины развития аденокарциномы индивидуальны для каждого органа. К основным факторам, которые способствуют формированию опухоли, относятся:
- нарушения в структуре слизистых оболочек;
- наличие язв, полипов, свищей;
- хронические заболевания какого-либо органа;
- генетическая предрасположенность;
- вредные привычки — курение, злоупотребление алкоголем;
- гормональные изменения;
- вирусные инфекции — папилломавирус, гепатит;
- генетическая мутация в клетках органа;
- ожирение;
- стрессы;
- неправильное питание;
- малоподвижный образ жизни;
- неблагоприятная окружающая среда;
- наличие сопутствующих болезней.
Если определять причину возникновения аденокарциномы связанные с каким-то конкретным органом, то стоит отметить¸
- аденокарцинома поджелудочной железы начинает развиваться из-за курения и хронического панкреатита;
- аденокарцинома желудка возникает в связи с хроническими язвами желудка, полипами;
- аденокарцинома толстой кишки — причинами могут быть колит, полипы, длительные запоры, свищи;
- аденокарцинома простаты может возникнуть в связи с генетической предрасположенностью, возрастными гормональными изменениями;
- аденокарцинома слюнных желез и легких — появлению способствует курение;
- аденокарциномы печени — злоупотребление спиртным, цирроз, вирусные гепатиты.
6. Алгоритм и методы диагностики аденокарциномы
Общий алгоритм диагностики аденокарциномы
Как правило, сначала больные обращаются со своими жалобами к врачам общего профиля — терапевтам. При подозрении на рак терапевт их направляют к онкологу.
Онколог проводит детальный осмотр, собирает данные анализов крови и мочи, и затем назначает необходимое обследование. Сначала назначают методы диагностики, которые помогают выявить опухоль: УЗИ, рентгенография (с контрастным усилением), эндоскопические исследования.
Если обнаружено подозрительное новообразование, выясняют является ли оно злокачественным с помощью биопсии. Во время биопсии врач частично или полностью удаляет злокачественную опухоль и отправляет ее в лабораторию для исследования под микроскопом. На этом этапе выясняют, представляет ли злокачественная опухоль собой аденокарциному.
Для того, чтобы уточнить подтип опухоли, подобрать наиболее эффективные препараты и оценить прогноз для пациента, проводят иммуногистохимический и молекулярно-генетический анализ клеток аденокарциномы.
Если рак подтвердился, то далее уточняют его стадию. Для этого назначают дополнительные методы диагностики: компьютерную томографию, МРТ, ПЭТ-сканирование, диагностическую лапароскопию и др.
Аденокарциному диагностируют с помощью лабораторных и инструментальных методов. Рассмотрим их далее более подробно.
Методы лабораторной диагностики
К лабораторным методам диагностики относятся клиническое и биохимическое исследования крови и мочи на онкомаркеры:
- Лабораторное исследование крови — с его помощью врачи выявляют нарушения в работе внутренних органов.
- Анализ крови на онкомаркеры — определяет наличие веществ, которые характерны для конкретного типа аденокарциномы.
- Анализ мочи — выявляет воспалительные процессы в организме.
- Гистологическое исследование — под микроскопом изучают тканевое строение взятого материала. Врачи определяют злокачественность и строение опухоли, прогнозируют эффективность гормональной и таргетной терапии.
- Цитологическое исследование — под микроскопом изучают клеточное строение взятого материала.
Методы инструментальной диагностики
Для диагностики аденокарциномы врачи применяют следующие методы инструментальных исследований:
- Биопсия — это забор материала (отдельных клеток, кусочка ткани или органа) для микроскопического исследования в диагностических целях. Она является крайне необходимой процедурой при любом подозрении на злокачественную опухоль. Врачи проводят процедуру с помощью шприца, биопсийных щипцов или эндоскопическим методом — через естественные отверстия.
- Ультразвуковое исследование — с помощью УЗИ врачи обследуют ткани органа и регионарные лимфатические узлы. Ультразвуковое исследование позволяет выявить новообразования и установить их размер.
- Эндоскопическое исследование — неинвазивное визуальное обследование внутренней поверхности органов. Врачи проводят процедуру с помощью гибкой трубки с камерой, которую вводят через естественное отверстие. Виды эндоскопических исследований в зависимости от органа:
- кишечник — колоноскопия;
- мочевой пузырь — цистоскопия;
- шейка матки — кольпоскопия;
- матка — гистероскопия;
- пищевод — эзофагоскопия;
- желудок — гастроскопия.
- Рентген или компьютерная томография (КТ) — с помощью рентгена или компьютерной томографии врачи выявляют метастазы в органах грудной, тазовой и брюшной полостей. КТ — это метод диагностики, при котором получают снимки сечения тела. Часто КТ проводят с контрастным веществом для получения более четких изображений. Компьютерную томографию проводят для уточнения диагноза после более простых исследований — рентгенографии, УЗИ. В случае диагностики аденокарциномы КТ проводят для органов грудной клетки, брюшной полости, органов малого таза. При помощи этого метода можно получить изображения послойных срезов любой области тела и ее трехмерную модель.
- Магнитно-резонансная томография (МРТ) позволяет определить строение и размер первичной опухоли, выявить вторичные новообразования в головном и спинном мозге. один из методов диагностики рака, который считается одним из самых информативных не только для обнаружения опухолей, но и для метастазов в любой точке тела человека. Диагностика аденокарценомы с помощью МРТ наиболее эффективна для молочной железы, головного мозга, органов брюшной полости и органов малого таза.
- Сцинтиграфия — метод, заключающийся во введении в организм радиоактивных изотопов и получении двумерного изображения путём определения испускаемого ими излучения. Врачи прибегают к процедуре при комплексной диагностике аденокарциномы почек, легких, печени, простаты, щитовидной железы. С помощью сцинтиграфии можно обнаружить метастазы от воспалительных процессов и оценить эффективность лечения. Сцинтиграфию проводят в Гамма-камерах.
- Позитронно-эмиссионная компьютерная томография (ПЭТ-КТ) — определяет точную локализацию основного очага и метастазов. С помощью процедуры специалисты выявляют даже самые маленькие опухоли — до 1 мм. Принцип действия у ПЭТ-КТ и Гаммы-камеры примерно схожий: больному вводят радиофармпрепарат (РФП), который накапливается в определенном органе или ткани и излучает слабые кванты энергии, а диагностическая установка улавливает это излучение и формирует снимки. Благодаря небольшому периоду полураспада РФП быстро выводятся из организма и не наносят вреда. Отличие же ПЭТ-КТ от Гамма-камеры заключается в количестве снимков. ПЭТ формирует объемное 3D-изображение исследуемой области, а Гамма-камера формирует только заданные проекции. Таким образом, ПЭТ (который обычно совмещен с КТ) дает более точную картину.
Аппараты ПЭТ-КТ и Гамма-сканер
7. Способы лечения аденокарциномы
Методы лечения аденокарциномы, а также их комбинации подбираются индивидуально, исходя из локализации опухоли, размеров, стадии, наличия метастазов и сопутствующих заболеваний и др.
Лечение при разных видах аденокарцином может сильно различаться. Если злокачественная опухоль не успела сильно распространиться в организме, основным методом лечения будет операция. Во время нее удаляют пораженную часть органа или весь орган целиком, а также ближайшие лимфатические узлы, в которые могли распространиться раковые клетки.
Хирургическое вмешательство
Цель операции при аденокарциноме — удалить опухоль. Хирургия, как метод лечения аденокарциномы, используется наиболее часто, особенно на ранних стадиях. Во время оперативного вмешательства удаляются пораженные железистые ткани и некоторые окружающие ткани. В современной хирургии используют методики малоинвазивного (лапароскопия, эндоскопия) и органосохраняющего вмешательства.
Операция при аденокарциноме может быть дополнена неоадъювантным (до хирургического вмешательства) или адъювантным (после хирургического вмешательства) курсом медикаментозного лечения, лучевой терапией.
Виды хирургических вмешательств:
- Открытая операция. Во время открытой операции врач делает большой разрез до 20 см и удаляет опухоль. Для поддержания ослабленного организма, как правило, назначается курс физиотерапевтических лекарств.
- Лапароскопическое удаление опухоли. Врач выполняет процедуру через несколько маленьких разрезов — до 2 см. Пораженные ткани удаляют специальными щипцами. Ход процедуры врач контролирует с помощью специального прибора с камерой. Шрамы после лапароскопии малозаметны.
- Удаление аденокарциномы на роботе «Да Винчи». Робот «Да Винчи» — робот-ассистированная хирургическая система для проведения хирургических операций. Операцию на «Да Винчи» хирург выполняет через разрезы до 2 см. Он управляет установкой дистанционно за пультом. Компьютер обрабатывает движения хирурга и переводит их в плавные манипуляции робота. Таким образом устраняется дрожание рук хирурга. Это позволяет не повредить нервы и крупные сосуды. Операция на «Да Винчи» имеет особые преимущества при аденокарциноме предстательной и щитовидной желез. Однако, с помощью «Да Винчи» нельзя удалить большие новообразования.
Удаление аденокарциномы с помощью робота «Да Винчи»
- Эндоскопическое удаление аденокарциномы. С помощью эндоскопа врачи удаляют опухоли на начальных стадиях, расположенные в органах ЖКТ, мужской и женской мочеполовых системах. Во время процедуры врач использует трубку с камерой и специальные щипцы, которые вводят через естественные отверстия в теле. С помощью эндоскопа нельзя также удалить большие опухоли.
Радиохирургия
Радиохирургия с помощью установки «КиберНож» — одна из самых современных методик лечения рака. Данная радиохирургическая система позволяет выполнять удаление опухолей и метастазов без хирургического вмешательства и наркоза. «КиберНож» активно используют в лечении аденокарциномы разной локализации, в том числе и тех, что двигаются при дыхании или сокращении гладкой мускулатуры — например, новообразования в легких или в предстательной железе. Врачи прибегают к процедуре при аденокарциноме легких, печени, предстательной, поджелудочной и молочной желез.
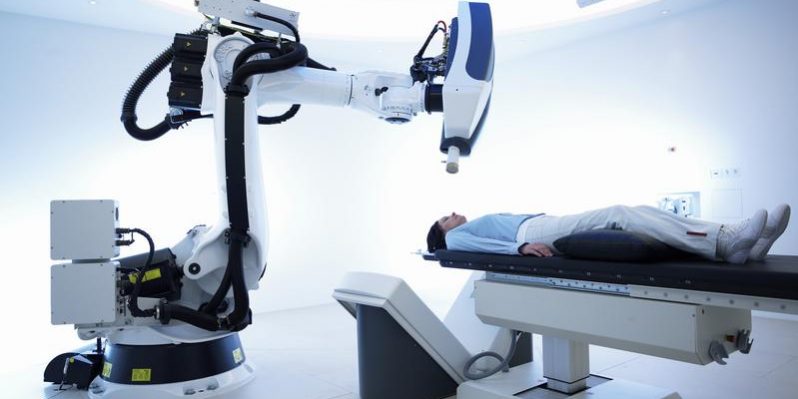
Радиохирургическая система «КиберНож»
Контактная радиотерапия (брахитерапия)
Во время брахитерапии врачи с помощью иголок помещают радиоактивные семена в опухоль. Радиация воздействует на новообразование локально и не повреждает здоровые ткани. Брахитерапию применяют при аденокарциноме простаты, шейки матки, прямой кишки.
Радиойодтерапия
Онкологи проводят радиойодтерапию после хирургического лечения некоторых видов аденокарциномы щитовидной железы. С помощью этого метода устраняются оставшиеся в железе злокачественные клетки. Во время процедуры пациент принимает капсулу с радиойодом. Опухолевые клетки железы притягивают вещество и разрушаются под его воздействием. В других тканях радиоактивный йод скапливается в незначительных объемах, поэтому процедура безопасна для организма.
Лучевая терапия
При лучевой терапии уничтожение раковых клеток происходит с помощью радиации. Врачи назначают радиотерапию до, после или вместо хирургического вмешательства. Цель предоперационного облучения — уменьшить опухоль, послеоперационного — уничтожить оставшиеся раковые клетки и предотвратить рецидивы. Лучевая терапия вместо операции показана при маленьких, неоперабельных новообразованиях и на поздних стадиях, чтобы облегчить симптомы.
Томотерапия
Томотерапия — это способ лечения, с помощью устройства для проведения лучевой терапии, в котором излучение подается послойно. Благодаря применению специального сканера 3D, который дает изображение зоны поражения в объеме, можно планировать высокоточное вмешательство. Томотерапия позволяет воздействовать за один сеанс на множество «мишеней-опухолей».
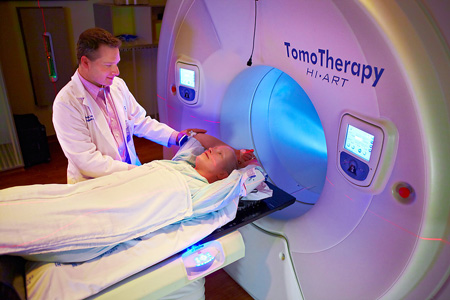
В томотерапии применяется современное оборудование лучевой терапии, уникальность и новизна которого состоит в облучении по спирали
Дистанционная лучевая терапия
Во время дистанционной лучевой терапии врачи используют высокоточный линейный ускоритель, который воздействует на опухоль и не вредит всему организму. Линейные ускорители позволяет целенаправленно подавать излучение на пораженные аденокарциномой ткани. Часто данный метод используют в комбинации с хирургией и химиотерапией для более действенного лечения аденокарциномы. Виды дистанционной радиотерапии:
- 3D-конформная лучевая терапия (3D-CRT) — аппарат создает трехмерную модель новообразования и облучает его под разными углами;
- лучевая терапия с модулированной интенсивностью (IMRT) — позволяет точно рассчитать дозу радиации и подстроить луч под размер и форму опухоли;
- лучевая терапия с визуальным контролем (IGRT) — во время процедуры аппарат выполняет КТ-снимки новообразования. Это позволяет доктору корректировать положение пациента, чтобы радиационный луч точно воздействовал на опухоль и не вредил здоровым тканям;
- гипофракционная стереотаксическая лучевая терапия SBRT — облучение новообразования высокой дозой радиации. Врачи назначают процедуру при некоторых формах аденокарциномы легких и печени;
- интраоперационная лучевая терапия — методику применяют, когда не получается удалить все новообразование. После иссечения видимой части опухоли они облучают близлежащие ткани.
Ультразвуковая абляция
Ультразвуковая абляция (HIFU) — это безоперационный высокотехнологичный метод локального лечения опухолей, который основан на воздействии высокоинтенсивных сфокусированных ультразвуковых волн, без повреждения кожных покровов, окружающих тканей и органов. Ультразвуковая абляция может применяться в тех случаях, когда применение всех других методов затруднительно или невозможно.
Суть метода заключается в двойном воздействии аппарата HIFU на раковые клетки:
- первый тип воздействия — тепловой. Нагревание опухолевых тканей происходит на протяжении 3 секунд и осуществляется за счет формирования ультразвукового пучка температурой 60-80 градусов. Термическая абляция вызывает необратимые изменения в раковых тканях;
- дополняет эффект второй тип воздействия — кавитация (образование воздушных пузырьков под влиянием ультразвуковой волны). С помощью кавитации раковые клетки подвергаются микровибрации, расширяются, переходят в газообразное состояние и наконец лопаются, вызывая некроз тканей опухоли.
Химиотерапия
Химиотерапия — это уничтожение злокачественных клеток с помощью химических веществ. Для применения этой терапии нужно смотреть, на какой стадии находится и как распространяется рак. Если после операции обнаружены лимфоузлы, подвергшиеся поражению, то затем проводится химиотерапия. Длительность курса химиотерапии зависит от самого препарата. Также химиотерапия делается при тяжелых случаях, запущенной форме и рецидивах после операции.
Системная химиотерапия
При системной химиотерапии пациент получает противораковый препарат методом капельного вливания. Виды системной химиотерапии:
- неоадъювантная — уменьшает опухоль перед операцией;
- адъювантная — уничтожает оставшиеся злокачественные клетки;
- лечебная — врачи ее применяют как единственную методику для уничтожения маленьких опухолей;
- паллиативная — уменьшает симптомы и улучшает качество жизни на поздних стадиях болезни.
Гипертермическая брюшная химиотерапия (HIPEC)
Врачи проводят HIPEC, если аденокарцинома дала множественные метастазы в органы брюшной полости. После удаления видимых частей опухоли врачи вводят в брюшную полость разогретый противораковый препарат. За счет высокой температуры он глубже проникает в ткани органов и уничтожает больше раковых клеток, чем традиционная химия. Через 90 минут врачи выводят препарат и накладывают шов.
Гормональная терапия
К лечению гормональными препаратами прибегают при аденокарциноме молочной и щитовидной желез, мужской и женской половых систем. Врачи назначают прием гормонопрепаратов до или после хирургического вмешательства. Предоперационная терапия уменьшает новообразование, послеоперационная — предотвращает возвращение болезни.
Таргетная терапия
Таргетная терапия применяется, если лабораторное исследование новообразования обнаружило генетическую мутацию клеток. Таргетные препараты останавливают их рост и деление. Онкологи назначают такое лечение при неэффективности всех других методик. Пациент получает лекарства в виде таблеток, инъекций или методом капельного вливания. Таргетные препараты прицельно воздействуют на определенные молекулы-мишени, которые необходимы для поддержания жизнедеятельности и размножения опухолевых клеток
Иммунотерапия
Иммунопрепараты активируют иммунную систему, помогают ей обнаруживать и уничтожать опухолевые клетки. Она помогает организму выявить злокачественные клетки и самостоятельно уничтожить их.
Гипертермия
Метод основан на применении высоких температур, воздействии их на ткани организма. Повышая температуру тела больного врачи добиваются гибели патогенных клеток, снижая устойчивость их к воздействию препаратов химиотерапии и радиоактивного лечения. Гипертермия, используемая в формате комплексной интегративной онкологии, значительно увеличивает эффективность других методов лечения.
Комплексное лечение
Комплексное лечение аденокарциномы — это сочетание методов лечения, которые подбираются индивидуально для каждого случая заболевания.
В Onco.Rehab мы предлагаем комплексный интегративный подход к лечению, который реализуются в формате интегративной онкологии. Наши методики лечения основаны на объединении лучших мировых практик и опирается на дополняющие методы, чья эффективность доказана клинической практикой.
В рамках интегративной онкологии, комплексно или отдельно, мы применяем химиотерапию, радиотерапию, а также иммунотерапию, таргетную (молекулярно-прицельную), гипертермию. Дополняя их комплементарными средствами, мы получаем высокий результат.
За консультацией к врачам нашей клиники вы можете обратиться заполнив ФОРМУ ниже.
Паллиативное лечение
При запущенной аденокарциноме с метастазами об излечении речи, как правило, не идет. Но правильное лечение помогает существенно продлить жизнь больного, нормализовать его состояние.
При поздних стадиях аденокарцином проводят паллиативные (то есть направленные не на устранение рака, а на улучшение состояния больного) хирургические вмешательства. Например, для восстановления проходимости кишечника, желчных, дыхательных путей. Лучевая терапия помогает бороться с болью, кровотечениями и некоторыми другими осложнениями.
Также на поздних стадиях, при неоперабельном раке, основу лечения аденокарциномы составляет медикаментозная терапия. Классически применяют комбинации различных химиопрепаратов, к которым чувствительна данная злокачественная опухоль.
8. Восстановление и профилактика аденокарциномы
Методов, которые бы на 100% предотвращали появление аденокарциномы, не существуют.
Однако, существуют специальные массовые скрининговые исследования, которые помогают выявить злокачественную опухоль на ранних стадиях, даже когда нет никаких симптомов. Например, для ранней диагностики рака молочной железы рекомендуется ежегодно проходить осмотры у врача-маммолога, после 45 лет — выполнять рентгенографию молочной железы (маммографию). В ранней диагностике рака толстой и прямой кишки помогает эндоскопическое исследование — колоноскопия. Её рекомендуют проходить всем людям от 50 лет. К сожалению, не для всех типов рака существуют скрининги. Поэтому, очень важно внимательно относиться к своему здоровью, своевременно посещать врачей, если появились симптомы.
Снизить вероятность развития аденокарциномы можно. Для этого необходимо:
- проходить ежегодные комплексные обследования начиная с 25 лет;
- обследоваться дважды в год, если врачи диагностировали аденокарциному у близких родственников;
- проводить регулярные самостоятельные осмотры тела;
- заниматься спортом;
- употреблять здоровую пищу;
- отказаться от вредных привычек;
- поддерживать здоровый вес;
- проводить профилактику заболеваний, передающихся половым путем.
Последствия аденокарциномы индивидуальны. На длительность реабилитации влияет метод лечения и общее состояние. В большинстве случаев после лечения наблюдаются:
- анемия;
- потеря веса;
- слабость;
- нарушение пищеварения;
- нарушение работы органа, на котором проводили операцию.
Чтобы ускорить восстановление, нужно избегать стрессов, переутомления, переохлаждения и длительного пребывания на солнце, а также нужно полноценно отдыхать и соблюдать диету, которую назначил врач.
Также, чтобы ускорить процесс восстановления и возвращения к обычной жизни, немаловажно поддерживать психологическое здоровье больного. Онкопсихологи клиники Onco.Rehab помогают онкобольным и их родственникам принять, правильно среагировать на диагноз, справиться с психоэмоциональными проблемами, тревожностью, стрессом, депрессией. Онкопсихолог помогает обрести смысл жизни, вернуть радость, взаимопонимание и проживать каждый день полной жизнью. И что самое главное, специалист помогает включить все ресурсы и резервы собственного организма, поднимая иммунитет на борьбу против заболевания. Если вам или вашим родным нужна такая помощь смело обращайтесь в клинику Onco.Rehab и наши врачи-онкопсихологи обязательно вам помогут.
Если опухоль операбельна, после хирургического вмешательства можно надолго достичь ремиссии — состояния, при котором во время контрольных обследований в организме не обнаруживают признаков присутствия злокачественной опухоли. Если рак не обнаруживается в течение 5 лет после завершения лечения, фактически можно считать, что человек здоров. Если произошел рецидив, лечение придется продолжить.
Опытные онкологи клиники Onco.Rehab знают, как помочь больным аденокарциномой. В клинике доступны наиболее современные виды лечения. У нас есть технологии, которые сегодня дают максимальную продолжительность жизни при раке. Чтобы получить первичную консультацию заполните ФОРМУ.
Источники
- Международная классификация болезней – онкология (МКБ-О), 3 издание, 1 пересмотр. Сост. Э. Фритц, К. Перси, Э. Джек, К. Шанмугаратнам, Л. Собин, Д.М. Паркин, Ш. Уилан / Пер. с англ. А.В. Филочкиной, под ред. А.М. Беляева, О.Ф. Чепика, А.С. Артемьевой, А.А. Барчука, Ю.И. Комарова – СПб.: Издательство «Вопросы онкологии», 2017. – 352 с. (URL:ссылка: https://apps.who.int/iris/bitstream/handle/10665/255148/9785990855700-rus.pdf?sequence=1&isAllowed=y)
- Клинические рекомендации. — МЗ РФ – Рак желудка. — 2020. (URL: https://oncology-association.ru/wp-content/uploads/2020/09/rak_zheludka.pdf)
- Клинические рекомендации. — МЗ РФ – Рак прямой кишки. — 2020 (URL: https://oncology-association.ru/wp-content/uploads/2020/09/rak_prjamoj_kishki.pdf )
- Саргсян С. А., Кузнецов В. В., Шабанов М. А., Лебедев А. И., Морхов К. Ю., Нечушкина В. М., Налбандян А. В. Аденокарцинома шейки матки // Вестн. РОНЦ им. Н. Н. Блохина РАМН. 2006. №3. URL: https://cyberleninka.ru/article/n/adenokartsinoma-sheyki-matki (дата обращения: 29.11.2022)
- Шима В., Кауэлблингер К. Аденокарцинома поджелудочной железы: выявление, определение стадии и дифференциальная диагностика. Медицинская визуализация. 2015;(5):52-72. URL: https://medvis.vidar.ru/jour/article/view/230/231 (дата обращения: 29.11.2022)
- Сидорук А. А., Ульрих Е. А., Новик В. И., Урманчеева А. Ф. Трудности диагностики аденокарциномы in situ шейки матки // Сибирский онкологический журнал. 2009. №S1. URL: https://cyberleninka.ru/article/n/trudnosti-diagnostiki-adenokartsinomy-in-situ-sheyki-matki (дата обращения: 30.11.2022).
- Сетдикова Г.Р., Паклина О.В., Шабунин А.В., Бедин В.В., Тавобилов М.М., Хатьков И.Е., Израилов Р.Е. Морфологическая оценка распространенности протоковой аденокарциномы поджелудочной железы // Рос. мед.-биол. вестн. им. акад. И.П. Павлова. 2015. №1. URL: https://cyberleninka.ru/article/n/morfologicheskaya-otsenka-rasprostranennosti-protokovoy-adenokartsinomy-podzheludochnoy-zhelezy (дата обращения: 30.11.2022).
Борисова О.В.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Ермолаева А.Г.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Мельникова В.Ю.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Петров А.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Славнова Е.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Срочная интраоперационная морфологическая диагностика в онкологии
Авторы:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н.
Как цитировать:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н. Срочная интраоперационная морфологическая диагностика в онкологии. Онкология. Журнал им. П.А. Герцена.
2015;4(4):5‑11.
Volchenko NN, Borisova OV, Ermolaeva AG, Melnikova VYu, Petrov AN, Slavnova EN. Rapid intraoperative morphological diagnosis in oncology. P.A. Herzen Journal of Oncology. 2015;4(4):5‑11. (In Russ.)
https://doi.org/10.17116/onkolog2015445-11

Срочная интраоперационная морфологическая диа-гностика (СИМД) — цитологическая и гистологическая — применяется более 100 лет. В последнее время наблюдается общемировая тенденция к снижению количества срочных морфологических исследований во время операции. Это связано с широким применением минимально инвазивных методов получения материала в дооперационной диагностике с целью морфологической верификации процесса, определения факторов прогноза течения заболевания и показаний к назначению адекватной терапии. Благодаря развитию методов уточняющей морфологической диагностики, таких как иммуногистохимия (ИГХ) и цитохимия, и молекулярно-генетических методов расширяются знания об опухолях. Правильный диагноз возможен только при исследовании всего объема опухоли, включая соответствующие ИГХ и молекулярно-генетические исследования. В связи с применением методов уточняющей диагностики показания для СИМД значительно сокращаются. Однако важность срочного морфологического исследования остается несомненной. СИМД по-прежнему играет важную роль, так как определяет тактику хирурга во время операции, позволяет избежать повторных операций или излишне обширных оперативных вмешательств.
Целью интраоперационной морфологической диагностики является адекватное выполнение хирургического вмешательства. Основными задачами срочного интраоперационного морфологического исследования являются:
1) морфологическая верификация диагноза после нескольких неудачных попыток или невозможности дооперационной диагностики, а также при несоответствии морфологического диагноза операционным находкам;
2) уточнение степени распространенности опухолевого процесса путем изучения зон регионарного метастазирования, близкорасположенных органов, состояния органов высокого риска метастазирования, экссудатов и смывов из серозных оболочек;
3) установление абластичности операционных краев резекции;
4) контроль информативности взятого материала при некоторых диагностических операциях.
СИМД имеет ограниченные возможности для уточнения гистогенеза и степени дифференцировки опухоли, для определения характера опухоли (первичная или метастаз), диагностики опухолей кожи, сарком мягких тканей и костей, злокачественных лимфом, опухолевых узлов полиморфного строения, оценки степени лечебного патоморфоза. Не следует применять СИМД при подозрении на cr in situ или микроинвазию.
Показания для срочного цитологического или гистологического исследования определяет оперирующий хирург. Оба метода имеют свои преимущества и недостатки.
По данным литературы [1—6], точность СИМД в зависимости от объекта исследования составляет от 89% при исследовании лимфатических узлов до 98—99% при других локализациях. Ошибочный диагноз при СИМД возможен как ложноположительный, так и ложноотрицательный. Причинами ложноотрицательного морфологического заключения могут быть регрессия опухоли, вызванная неоадъювантной химиотерапией, некроз, замещение опухолевой ткани новообразованными сосудами, гистиоцитами, лимфоцитами и фиброзом, что может быть неправильно истолковано как хроническое воспаление. Причинами ложноположительных заключений являются резко выраженная пролиферация и реактивные изменения клеточных элементов. Эти ошибки могут быть вызваны неправильным толкованием морфологической картины, низким качеством замороженных срезов, неправильным забором материала для исследования, незнанием макроскопических признаков, сложными случаями для интерпретации, наличием только карциномы in situ в образце, гетерогенностью опухоли.
Следовательно, необходимо понимание различных проблем, с которыми может столкнуться как патологоанатом при исследовании замороженных срезов, так и цитолог при СИМД.
Для качественной интраоперационной морфологической верификации диагноза необходимо получение информативного операционного материала, правильное оформление сопроводительных документов с указанием анамнестических данных, стадии процесса, характера предоперационного лечения, сроков его проведения, макро- и микроскопического исследования операционного материала.
Цель исследования — оценить точность СИМД и проанализировать причины диагностических ошибок.
Материал и методы
В 2013 г. ФГБУ «ФМИЦ им. П.А. Герцена» выполнено 418 срочных гистологических исследований у 361 больного (7% общего количества операций) и 1198 срочных цитологических исследований у 646 (12,5%) больных. В 2014 г. выполнено 507 срочных гистологических исследований у 356 (8%) пациентов и 1356 срочных цитологических исследований у 676 (15,5%) пациентов. Для срочного гистологического исследования применяются криостатные срезы, препараты окрашиваются гематоксилином и эозином. Недостатком криостатных срезов является более низкое качество гистологических препаратов, чем при плановом гистологическом исследовании после приготовления парафиновых блоков. Срочное гистологическое исследование проводится в течение 20—30 мин. Для срочной окраски цитологических препаратов применяют набор для окраски Лейкодиф (Чехия). Срочное цитологическое исследование занимает 10—15 мин. Для исследования экссудатов из серозных полостей и диагностики метастатического поражения лимфатических узлов применяется иммунофлюоресцентное исследование (ИФИ) с антителом к эпителиальному антигену Ber-EP4 FITC («Dako»). ИФИ осуществляется на флюоресцентном микроскопе Carl Zeiss Imager M1.
Результаты
Морфологическая верификация диагноза
Интраоперационная морфологическая верификация диагноза применяется в основном при периферических образованиях легких, недоступных для дооперационного морфологического исследования, при опухолях яичников, а также при неуверенном дооперационном морфологическом диагнозе при опухолях молочной железы. Мы придерживаемся правила — не использовать срочное исследование при cr in situ, так как можно не получить категоричного заключения ни при срочном, ни при плановом исследовании.
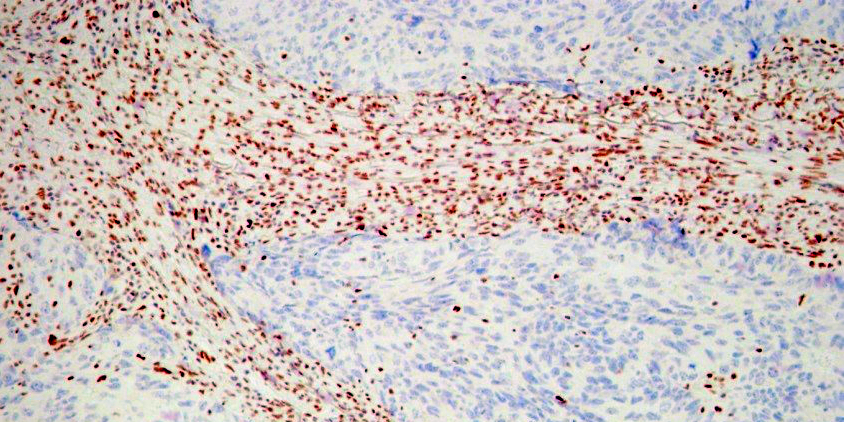
Гистологическая СИМД для верификации процесса в легком позволила установить туберкулез в 32,8%, гамартому в 8,2%, хроническое продуктивное воспаление в 6,6% наблюдений, что дало возможность избежать излишне радикальных операций. Нейроэндокринные опухоли (типичный и атипичный карциноид) выявлены в 8,2% наблюдений (рис. 1, 2 и далее). Злокачественный процесс установлен в 44,3% наблюдений, при этом 85% составила аденокарцинома легкого, преимущественно высокодифференцированная (прежний БАР) (рис. 3), а 14,8% — метастазы аденокарциномы кишечного типа, желудка и меланомы в ткани легкого. Расхождений срочного и планового гистологического исследований не отмечалось.
При срочном цитологическом исследовании образований в легком гиподиагностика составила 6,7% (4 наблюдения из 60), что связано с получением материала из очага некроза, воспаления, а также наличием микроочагов опухоли на фоне пневмонии. В 6,6% наблюдений цитологически было дано неуверенное заключение.
Опухоли яичников всегда подвергаются СИМД с целью верификации диагноза, что обусловлено отсутствием дооперационной морфологической диагностики — опухоли практически не пунктируют из-за опасности диссеминации. Изучение криостатных срезов является важным диагностическим инструментом определения характера поражений яичников. В 30% наблюдений проведено двустороннее исследование яичников. При СИМД сравнительно просто диагностируют неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и т. д. (54,4%). Доброкачественные опухоли яичников диагностированы в 15,8% случаев, пограничные опухоли яичников (ПОЯ) — в 8,5%, злокачественные — в 21,5%. В одном наблюдении при СИМД диагностирована аденокарцинома яичника, а при плановом гистологическом исследовании установлена тератома. Ошибка связана с выраженной пролиферацией и образованием сосочковых структур эпителиального компонента тератомы. СИМД опухолей яичников имеет ряд ограничений, особенно при ПОЯ, которые характеризуются некоторыми гистологическими особенностями — нарушением стратификации эпителиального пласта, увеличением митотической активности, в некоторых случаях ядерной атипией, но отсутствует стромальная инвазия. СИМД опухолей яичников определяет объем оперативного вмешательства. При доброкачественных и ПОЯ можно выполнить органосохраняющее лечение у молодых женщин, в то время как злокачественные эпителиальные опухоли, как правило, требуют обширного хирургического вмешательства с гистерэктомией, двусторонним удалением придатков матки и сальника, а также тазовой и ретроперитонеальной лимфаденэктомией. При исследовании опухолей яичников необходимо тщательное макроскопическое исследование материала в совокупности с клиническими данными и методами инструментального исследования. Желательно исследовать несколько криостатных срезов из разных участков. По нашим данным, ошибка при исследовании ПОЯ яичников имела характер гиподиагностики и составила 7%, что связано в основном с наличием лишь микроочагов опухоли (рис. 4). Большой размер опухоли, двустороннее поражение, а также муцинозный характер являются неблагоприятными факторами в определении злокачественного потенциала при СИМД. В 20% наблюдений при исследовании брюшины при СИМД выявлены импланты ПОЯ. Если имеются инфаркт и некротические изменения, а также киста, лишенная эпителиальной выстилки, окончательные выводы следует делать при плановом гистологическом исследовании на парафиновых блоках. В 14,3% случаев при СИМД выявлены метастазы в яичниках эндометриоидной аденокарциномы, аденокарциномы шейки матки, желудка, молочной железы и почки, подтвержденные плановым гистологическим исследованием.
Таким образом, чувствительность СИМД при опухолях яичников составляет 98,7%, специфичность — 99%.
Срочное цитологическое исследование яичников применяется при пункции кист или при невозможности гистологического исследования. В одном наблюдении при исследовании кисты цитологически имелась гиподиагностика ПОЯ, что связано с объективными трудностями — клеточная атипия отсутствовала. Однако при пересмотре цитологических препаратов имелись плотные опухолевые комплексы из мелких клеток, что характерно для ПОЯ.
СИМД при образованиях молочной железы в настоящее время применяют крайне редко, так как морфологический диагноз является результатом исследования дооперационных трепанобиопсий. При расхождении цитологического и гистологического диагнозов и при неуверенном дооперационном диагнозе проводится срочное морфологическое исследование. Доброкачественные поражения составили 57%, при плановом гистологическом исследовании подтверждены такие процессы, как аденоз, фиброаденома с дисплазией эпителия. Рак молочной железы установлен в 40% (18 наблюдений), из них 33% составил дольковый рак, в 2 наблюдениях выявлена cr in situ, в одном наблюдении имелся тубулярный рак на фоне склерозирующего аденоза (рис. 5). В другом наблюдении при СИМД диагностирована липогранулема, а при плановом гистологическом исследовании выявлен небольшой очаг инвазивного рака без признаков специфичности. Чувствительность интраоперационного гистологического диагноза при раке молочной железы составляет 97%, специфичность — 100%. Неуверенное заключение дается в 1—2% наблюдений. Противопоказаниями к срочному исследованию являются внутрипротоковый и внутридольковый рак (cr in situ), внутрипротоковая папиллома. Высокодифференцированная папиллярная и тубулярная карцинома, отсутствие клеточной атипии при инвазивном дольковом раке часто при СИМД неправильно диагностируются как доброкачественные поражения как при цитологическом, так и гистологическом исследовании. Инвазивный микрососочковый рак и лимфому молочной железы трудно диагностировать при СИМД.
Случаи гипердиагностики в нашем материале не выявлены, но такие ошибки возможны при пролиферирующем папилломатозе и аденоме соска с гиперплазией эпителия протоков соска с формированием железистых и папиллярных структур, особенно с центральным некрозом, что можно ошибочно принять за внутрипротоковый рак; при склерозирующем аденозе с радиальным рубцом, когда создается впечатление инвазивного роста рака; при гранулематозном мастите, эктазии протоков и некрозе жировых клеток. Для избежания морфологической ошибки необходимо тщательное исследование препарата: отсутствие атипии эпителия, наличие миоэпителиального слоя, плотная коллагеновая строма помогают в постановке правильного морфологического диагноза.
Интраоперационно цитологически опухоли молочной железы исследуют крайне редко: при наличии кист и отсутствии дооперационного морфологического диагноза. В нашем исследовании имелось одно наблюдение, когда цитологически диагностирована папиллярная киста молочной железы, а при плановом гистологическом исследовании диагностирован папиллярный рак.
Цитологическая гиподиагностика при исследовании первичной опухоли составила 3,8%, что связано с утратой морфологических особенностей опухолевых клеток, особенно при недифференцированных и мелкоклеточных новообразованиях (например, мелкоклеточный лимфоцитоподобный рак), а также выраженными дистрофическими изменениями опухолевых клеток. Цитологическая гипердиагностика не превысила 1% и связана с выраженными реактивными изменениями эпителия.
Уточнение степени распространенности опухолевого процесса
С развитием интраоперационного ультразвукового исследования, микрохирургических пособий во время операции, позволяющих обнаружить очаги опухоли, невыявленные на дооперационном обследовании, и интраоперационных находок при непосредственной ревизии операционной раны СИМД имеет неоценимые преимущества. Проведение СИМД в 10% случаев изменяет объем оперативного вмешательства [7]. Невозможность выполнения оперативного вмешательства должна быть подтверждена морфологически.
СИМД позволяет объективно оценить состояние лимфатического коллектора. В 30—40% макроскопически неизмененных лимфатических узлов обнаруживают метастазы, а в 25—30% макроскопически похожих на метастатические узлы при микроскопическом исследовании метастазы не выявляют. Срочное интраоперационное гистологическое исследование лимфатических узлов может быть неудачным в 25% наблюдений [7]. Большое количество ложноотрицательных заключений как цитологических, так и гистологических является серьезной проблемой для клинического применения СИМД в основном из-за ограниченной способности обнаруживать микрометастазы, особенно подкапсульные, которые просто не попадают в срез или соскоб с поверхности разрезанного лимфатического узла. Кроме того, возможна потеря отдельных опухолевых клеток при приготовлении гистологического препарата. Чувствительность и специфичность срочного цитологического исследования лимфатических узлов аналогичны исследованию криостатных срезов, поэтому цитологический метод является альтернативой срочному гистологическому исследованию лимфатических узлов.
В нашем центре проведена работа по исследованию лимфатических узлов при радикальной трахелэктомии у пациенток с начальным раком шейки матки [8]. Удаленные лимфатические узлы подвергали срочному цитологическому исследованию. При обнаружении увеличенных и подозрительных по метастатическому поражению тазовых и парааортальных лимфатических узлов срочное цитологическое исследование дополняли или заменяли срочным гистологическим исследованием. По результатам срочного цитологического и гистологического исследования у 5 (6%) пациенток из 81 выявлены метастазы в лимфатических узлах, в связи с чем произведена конверсия трахелэктомии в расширенную экстирпацию матки с удалением или транспозицией придатков. Метастатическое поражение лимфатических узлов во всех случаях было подтверждено при плановом гистологическом исследовании. В 3 случаях установлены микрометастазы (<2 мм), в 2 — макрометастазы. Число положительных лимфатических узлов варьировало от 1 до 5. Во всех наблюдениях отмечались метастазы плоскоклеточного рака [8].
В настоящее время широко применяется СИМД сторожевого (сигнального) лимфатического узла (СЛУ). Метастатическое поражение СЛУ является одним из основных прогностических и предиктивных факторов при раннем раке желудка, шейки матки, молочной железы и меланоме. СЛУ является первым лимфатическим узлом на пути оттока лимфы от первичной опухоли. Отрицательный СЛУ может исключать возможность метастазов в других лимфатических узлах, что не всегда подтверждается на практике. Например, у женщин с ранним раком шейки матки и молочной железы, которые хотят сохранить репродуктивный потенциал, можно избежать радикального хирургического вмешательства, если в сторожевом узле отсутствует метастаз. Исследование СЛУ проведено гистологически у 4 пациенток при раке шейки матки, метастазов не выявлено; цитологически исследовано 3 СЛУ при раке желудка (у 2) и молочной железы (у 1), метастазов не выявлено.
Причинами гиподиагностики является исследование не всех удаленных лимфатических узлов. Оптимально исследуют не более 5 лимфатических узлов из-за ограничения временны́х рамок. Пролиферация гистиоцитарных элементов при синус-гистиоцитозе с наличием крупных полиморфных гистиоцитов может служить причиной гипердиагностики. Для уточнения диагноза используется ИФИ лимфатических узлов, повышающее достоверность цитологической диагностики до 94%.
Часто для уточнения степени распространенности опухолевого процесса исследуются близкорасположенные органы, брюшина.
Важное значение в оценке степени распространенности опухолевого процесса имеет исследование экссудатов из серозных полостей. Остается сложной и нерешенной задачей цитологического исследования диссеминатов с брюшины при перстневидно-клеточном раке желудка из мелких клеток, ПОЯ, так как эти опухоли при микроскопическом исследовании крайне сложно дифференцировать с реактивным мезотелием. Срочное гистологическое исследование в большинстве наблюдений позволяет установить диссеминацию опухоли. Применение ИФИ повышает выявляемость клеток аденогенного рака до 98% (рис. 6, 7). Из исследованных 150 экссудатов при СИМД ИФИ проведено в 17 (11%) наблюдениях, из них наиболее часто при перстневидно-клеточном раке желудка (12 наблюдений) и ПОЯ (4 наблюдения), что позволило установить диссеминацию опухоли в брюшной полости.
Достоверность СИМД метастазов в печени составляет 98%, гиподиагностика отмечена в одном наблюдении из-за резко выраженной деформации материала. Наиболее часто метастазы в печени выявляют при аденокарциноме желудка и толстой кишки.
Установление абластичности операционного края резекции
Для морфологического контроля абластичности хирургического края интраоперационное исследование имеет важное значение, так как связано с расширением показаний для экономных резекций, особенно при раке молочной железы при трахелэктомии и микрохирургических операциях на органах головы и шеи, а также при раке желудка, толстой кишки, легкого и др.
В настоящее время имеется четкая тенденция к уменьшению расстояния между опухолью и краем резекции. В последние годы появились исследования, показывающие, что сокращения края резекции не приводит к увеличению частоты местных рецидивов и ухудшению выживаемости. По мнению многих исследователей, применение лучевой терапии расширяет возможности оперативного вмешательства.
При раке молочной железы патоморфолог, как правило, дает заключение о негативном крае при расположении опухоли от 1 до 5 мм от края резекции; о позитивном крае, если опухолевые клетки присутствуют в исследуемом материале, и о сомнительном или закрытом крае, когда опухолевые клетки располагаются на расстоянии менее 1 мм от края резекции. При раке молочной железы для срочного гистологического исследования доставляется удаленная опухоль и исследуется один или два края ближайших к опухолевому узлу. Из 87 исследованных краев резекции опухоль обнаружена в 12 (13,8%). В 3 (4%) наблюдениях положительный край резекции установлен только при плановом гистологическом исследовании, что потребовало повторной операции. Факторами, определяющими гистологическую гиподиагностику при СИМД, являются обширный внутрипротоковый компонент и инвазивная дольковая карцинома.
При раке молочной железы проводят срочное цитологическое исследование нижнего и верхнего краев резекции, подсосковой зоны, иногда исследуют медиальный и латеральный края. У 2,5% больных в крае резекции обнаружены опухолевые клетки. Ложноотрицательные цитологические заключения составили 1,2%.
Для исследования краев резекции при раке молочной железы часто доставляется жир, а паренхима молочной железы отсутствует, поэтому адекватно оценить абластичность не представляется возможным.
Оценка края резекции при раке желудка рекомендуется для пациентов при T3 или T4 стадии заболевания, интраоперационно исследуют, как правило, проксимальный край резекции. Срочное гистологическое исследование позволило выявить опухолевый рост в крае резекции при раке желудка в 8% наблюдений. Положительный край был обусловлен инвазией опухоли подслизистого слоя, неопределяемой при макроскопическом исследовании (рис. 8).
При резекции легкого гистологическое исследование краев резекции применяется редко, за 2 года всего 11 наблюдений. Опухолевые клетки обнаружены только в одном наблюдении при неходжкинской лимфоме. Цитологически край резекции бронха исследовали в 17 наблюдениях, опухолевые клетки не обнаружены.
При раке пищевода опухолевые клетки по краю резекции обнаружены в 11,5%, в одном наблюдении опухоль по краю резекции выявлена только при плановом гистологическом исследовании.
Для оценки адекватности удаления шейки матки при трахелэктомии, выполняли поперечный срез толщиной 1—2 мм с ее резидуальной части для срочного гистологического исследования. С помощью CytoBrush из сохраняемого отрезка цервикального канала получали материал с последующим проведением интраоперационного цитологического анализа. Положительная граница резекции интраоперационно установлена у 5 (6%) из 81 больной. В одном случае, по данным срочного гистологического исследования, выявили рак in situ по краю резекции, в связи с чем произвели дополнительное дисковидное иссечение шейки матки, что позволило обеспечить отрицательную границу резекции и выполнить органосохраняющую операцию. В остальных 4 случаях произведена конверсия трахелэктомии в расширенную экстирпацию матки с транспозицией яичников. Положительная граница резекции в 2 случаях из 5 обнаружена при аденокарциноме, в 2 случаях при аденоплоскоклеточном раке и лишь в одном случае при плоскоклеточном гистотипе [8].
Исследование краев резекции при раке поджелудочной железы проведено в 6 наблюдениях, из них в 3 гистологически выявлена аденокарцинома.
В нашем центре широко применяется цитологическое исследование краев резекции при операциях на органах головы и шеи — опухолевые клетки выявлены в 6,8% наблюдений.
С целью определения абластичности краев резекции при онкоортопедических операциях исследование костного мозга на криостатных срезах практически не применяется, поэтому используется срочное цитологическое исследование. Достоверность исследования составляет 98,8%.
В целом 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства, чтобы сделать его адекватным.
Контроль информативности взятого материала при некоторых диагностических операциях
При опухолях мягких тканей и костей, средостения диагноз возможен только при комплексном клинико-морфологическом исследовании с обязательным применением методов иммуногистохимии, а также во многих случаях молекулярно-генетических методов исследования. Интраоперационная морфологическая, в основном цитологическая диагностика применяется с целью контроля информативности взятого материала для планового гистологического исследования и по информативности не уступает исследованию замороженных срезов. По данным некоторых авторов, диагноз был бы невозможен без цитологического исследования. Это, как правило, лимфома, плазмоцитома, саркома Юинга, метастатическая карцинома, метастатическая меланома, рак из клеток Меркеля, липосаркома. Для малоклеточных, фиброзных, миксоидных и опухолей из жировой ткани роль цитологического исследования отпечатков ограничена.
Заключение
СИМД остается незаменимой в онкологии, так как способна уточнить информацию о характере патологического процесса, степени его распространения, состояния окружающих тканей и краев резекции, что необходимо при выборе адекватного хирургического вмешательства. Однако, при неясном диагнозе и при небольшом количестве полученного материала не следует любой ценой добиваться интраоперационного морфологического исследования, особенно если речь идет о редких опухолях и неинвазивном раке.
Чувствительность гистологического метода при СИМД составляет 98%, специфичность — 99%, чувствительность цитологического метода при СИМД составляет 95%, специфичность — 96%. Гистологическая гипердиагностика при срочном исследовании составляет 0,5%, гиподиагностика 1%, цитологическая гипердиагностика — 3%, гиподиагностика — 9%. Заключения в предположительной форме при срочном гистологическом исследовании составляют 2%, при цитологическом — 11%. В 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства. Неинформативный материал при срочном исследовании достигает 2—5%, в основном при срочном цитологическом исследовании.
Золотым стандартом морфологического исследования является комплексное цитологическое и гистологическое исследования, которые являются взаимодополняющими. Необходимо подчеркнуть значение междисциплинарного подхода к диагностике, в том числе и интраоперационной, включая клинические данные и результаты инструментальных методов исследования с целью достижения точного диагноза.
Участие авторов:
Концепция и дизайн исследования: Н.Н.В.
Сбор и обработка материала: В.Ю.М., А.Г.Е., О.В.Б., Е.Н.С.
Статистическая обработка: О.В.Б., А.Н.П.
Написание текста: В.Н.Н., О.В.Б.
Редактирование: В.Н.Н.
Конфликт интересов отсутствует.
Что такое аденокарцинома толстой кишки? Это злокачественная опухоль, развивающаяся из железистого эпителия. В структуре всех онкологических новообразований толстого кишечника она занимает первое место, на ее долю приходится до 95% раков данной локализации.
- Причины развития аденокарциномы толстой кишки
- Классификация аденокарциномы толстой кишки
- Симптомы аденокарциномы толстой кишки
- Обследование при аденокарциномах толстого кишечника
- Диагностика аденокарцином толстой кишки
- Лечение аденокарциномы толстой кишки
- Метастазирование аденокарциномы
- Осложнения аденокарциномы толстой кишки
- Прогноз
Причины развития аденокарциномы толстой кишки
Причины, из-за которых развивается аденокарцинома кишечника, до конца не ясны, но есть некоторые данные, позволяющие определить факторы риска, увеличивающие вероятность развития данной патологии:
- Характер питания — аденокарцинома кишки чаще развивается при избыточном потреблении животных жиров, высокобелковых продуктов и недостатке в рационе клетчатки, а также при переедании, злоупотреблении алкоголем.
- Наличие полипов толстого кишечника. В большинстве случаев аденокарцинома ободочной кишки развивается из уже имеющихся полипов, причем чем дольше они существуют и чем больше их размер, тем выше риски малигнизации. Во многих странах людям старше определённого возраста (50 лет) рекомендуют проходить периодическую колоноскопию с одновременным удалением полипов. На сегодняшний день это наиболее эффективное средство профилактики.
- Генетическая предрасположенность. В большинстве случаев аденокарцинома толстой кишки является спорадическим заболеванием, т. е. не связана с наследственными факторами, но есть два случая, где генетика играет ключевую роль. Это семейный аденоматозный полипоз и наследственный неполипозный рак толстого кишечника (он же синдром Линча).
- Наличие неспецифического язвенного колита и болезни Крона.
- Наличие в анамнезе рака женских половых органов.
- Иммунодефицитные состояния.
Классификация аденокарциномы толстой кишки
В зависимости от гистологического типа, выделяют следующие виды аденокарцином:
- Тубулярная аденокарцинома толстой кишки. Состоит из специфических трубчатых структур. Опухоль, как правило, имеет малые размеры и нечеткие границы.
- Муцинозная (слизистая аденокарцинома). Характеризуется секрецией большого количества слизи. Во время гистологического исследования видно, что слизь занимает до половины объема злокачественных клеток. Опухоль относится к низкодифференцированным формам аденокарциномы, характеризуется быстрым ростом и ранним метастазированием.
- Перстневидноклеточная. Также относится к высокой степени злокачественности, на момент постановки диагноза, как правило, обнаруживаются отдаленные метастазы. Чаще диагностируется у молодых людей.
В зависимости от степени зрелости опухолевых клеток, аденокарциномы делят на следующие типы:
- Высокодифференцированная аденокарцинома толстой кишки G1. Характеризуется относительно «нормальным» строением клеток, в которых отмечается увеличение размеров ядер. Клеточные функции сохранены. Таким образом, это аденокарцинома низкой степени злокачественности. Опухоль характеризуется относительно благоприятным прогнозом, поскольку растет медленно. Но в то же время высокодифференцированная аденокарцинома толстой кишки и высокодифференцированная аденокарцинома прямой кишки (аденокарцинома G1 прямой кишки) с трудом диагностируются на ранних стадиях, поскольку внешне клетки сходны с нормальной тканью.
- Умеренно дифференцированная аденокарцинома толстой кишки G2 характеризуется более неблагоприятным прогнозом. Клетки полиморфны, склонны к быстрому делению и, как следствие, быстрому росту опухоли. Таким образом, аденокарцинома G2 толстой кишки и аденокарцинома толстой кишки G2, или умеренно дифференцированная опухоль, более агрессивная по сравнению с высокодифференцированной.
- Низкодифференцированная и недифференцированная аденокарцинома наиболее неблагоприятны. Это аденокарцинома высокой степени злокачественности. Клетки отличаются более высоким полиморфизмом, чем аденокарцинома толстой кишки G2, опухоль не имеет четких границ, инфильтрирует (прорастает) кишечную стенку и характеризуется быстрым агрессивным ростом и ранним метастазированием.
В зависимости от распространенности опухолевого процесса выделяют следующие стадии аденокарциномы:
- 1 стадия — раковые клетки обнаруживаются только в слизистой оболочке кишечной стенки.
- 2 стадия — опухоль прорастает все слои стенки кишки.
- 3 стадия — рак дает метастазы в регионарные лимфатические узлы.
- 4 стадия — обнаруживаются отдаленные метастазы, которые поражают внутренние органы.
Существует такой термин, как инвазивная аденокарцинома толстой кишки. Так обозначают злокачественные опухоли, которые вторгаются в окружающие ткани. Неинвазивными являются только аденокарциномы стадии 0 – опухоли in situ («на месте»), представляющие собой небольшие скопления раковых клеток, не распространяющиеся за пределы места своей изначальной локализации.
Симптомы аденокарциномы толстой кишки
Аденокарцинома толстой кишки долгое время никак себя не проявляет. При аденокарциноме кишечника симптомы могут появиться, когда опухоль достигает больших размеров и затрагивает другие органы. В ряде случаев имеются косвенные признаки наличия злокачественных новообразований:
- Необъяснимое снижение веса.
- Потеря аппетита.
- Упадок сил.
- Анемия, которая развивается на фоне скрытого кровотечения из опухоли.
Симптоматику определяет и место локализации аденокарциномы. Если опухоль расположена в правом отделе ободочной кишки, то, как правило, из первых симптомов наблюдаются явления диспепсии, связанные с нарушением работы соседних органов (желудок, поджелудочная железа, печень и желчный пузырь). Возможны скрытые кровотечения, на фоне которых развивается анемия и слабость. Поскольку в этом месте кишка имеет широкий просвет и жидкое содержимое, обтурация (закупорка просвета) развивается только на последних стадиях и то, не во всех случаях. Если опухоль имеет большие размеры, ее можно прощупать через стенку живота.
Левый отдел ободочной кишки имеет меньший диаметр, а кишечное содержимое более плотную консистенцию, поэтому опухоли данной локализации чаще проявляются явлениями кишечной непроходимости. Застой кишечного содержимого приводит к усилению процессов гниения и брожения, что вызывается вздутие живота и коликообразные боли. На смену запору приходит диарея со зловонным стулом. В ряде случаев кале могут обнаруживаться примеси крови.
Обследование при аденокарциномах толстого кишечника
Золотым стандартом обнаружения аденокарциномы толстой кишки на ранней стадии является тотальная колоноскопия. Специалисты «Евроонко» рекомендуют ее делать всем людям старше 50 лет раз в десятилетие. Это позволит предотвратить озлокачествление существующих доброкачественных полипов. Данный метод доставляет пациентам определенный дискомфорт, поэтому зачастую выполняется под внутривенным наркозом. Стоимость такого обследования довольно высока, к тому же оно требует специальной подготовки.
Далеко не всегда пациенты готовы к данной процедуре, поэтому есть более простой и доступный вариант, хотя и менее точный — исследование кала на скрытую кровь. Если результат анализа оказывается положительным, пациента направляют на тотальную колоноскопию.
Диагностика аденокарцином толстой кишки
Диагноз аденокарцинома толстой кишки выставляется только на основании гистологического заключения — исследования кусочка опухолевой ткани под микроскопом. Процесс изъятия фрагмента ткани называется биопсия, ее проводят с помощью эндоскопической техники во время проведения колоноскопии. Если диагноз подтверждается, назначается дальнейшее обследование, которое направлено на определение гистологического типа опухоли, ее молекулярно-генетических особенностей. Также проводится комплексное обследование, направленное на установление степени распространенности злокачественного новообразования. С этой целью проводится КТ, МРТ, УЗИ. Все вместе это позволит выбрать оптимальную тактику лечения. Также назначаются анализы на онкомаркеры: РЭА, СА19-9, СА-72-4. Они хоть и не помогают в обнаружении опухоли как таковой, но отслеживание динамики их концентрации позволяет оценить эффективность дальнейшего лечения и вовремя определить рецидив заболевания.
Лечение аденокарциномы толстой кишки
Для лечения аденокарциномы применяют хирургические операции и химиотерапию. При расположении опухоли в прямой кишке возможна лучевая терапия.
Хирургическое лечение
Хирургическое лечение предполагает удаление аденокарциномы в пределах здоровых тканей кишки. В зависимости от объема удаляемого кишечника выделяют следующие виды операции:
- Резекция толстой кишки. Иссекается опухоль в пределах здоровых тканей. Концы сшиваются, образуя анастомоз.
- Гемиколэктомия. Удаляется половина толстого кишечника. Соответственно, выделяют правостороннюю и левостороннюю гемиколэктомию.
- Колэктомия — удаляется вся толстая кишка.
Если опухоль проросла на соседние органы, выполняется комбинированная операция с удалением всех пораженных тканей единым блоком с соблюдением правил абластики. Как правило, это обширные травматичные вмешательства.
Отдаленные одиночные метастазы (в печени, легких, яичниках) также удаляются оперативным путем, единовременно с основной опухолью или отдельной операцией, которая проводится через несколько недель. Этот вопрос решается консилиумом.
В ряде случаев после удаления аденокарциномы не удается наложить анастомоз, тогда вышележащий отдел кишки выводят на брюшную стенку, это называется колостомой. Она может быть временной или постоянной. В первом случае через некоторое время после удаления опухоли проводят реконструктивные вмешательства, восстанавливающие целостность кишечника.
Альтернативой колостоме может стать эндоскопическое стентирование — установка специальной конструкции, поддерживающей просвет кишки в месте поражения опухолью в расправленном состоянии. Его могут выполнять в двух вариантах:
- Предоперационная декомпрессия. Она позволяет подготовить пациента к одномоментной операции без наложения колостомы. Расправление кишки устраняет явления кишечной непроходимости, нормализует водно-электролитный баланс и подготавливает кишечную стенку к наложению анастомоза. Кроме того, стентирование дает время для проведения адъювантной химиотерапии, что позволит уменьшить размер опухоли и провести операцию, не удаляя большой объем кишки.
- Паллиативное лечение — эндоскопическое стентирование может стать альтернативой постоянной колостоме или наложению обходного анастомоза для пациентов, которым по каким-либо причинам невозможно провести хирургическое вмешательство.
Химиотерапия
Химиотерапия при аденокарциномах толстой кишки проводится в двух режимах:
- Неоадъювантный, который назначается на дооперационном этапе. Его целью является уменьшение размеров опухоли, что позволяет легче удалить ее во время хирургического вмешательства. Неоадъювантная терапия в некоторых случаях позволяет перевести опухоль из нерезектабельного состояния в резектабельное и провести операцию, которая изначально была невозможна.
- Адъювантный режим предполагает применение химиопрепаратов в послеоперационном периоде. Его целью является уничтожение оставшихся раковых клеток и предотвращение развития рецидивов заболевания.
Для химиотерапевтического лечения аденокарциномы имеется несколько протоколов, все они включают цитостатики на основе фторпиримидинов.
Также может использоваться и таргетная терапия, которая действует на молекулярные механизмы, обеспечивающие опухолевый рост. Используются препараты, подавляющие действие фактора роста эндотелия сосудов (бевацизумаб, рамуцирумаб) или блокаторы рецептора эпидермального фактора роста (цетуксимаб). Их назначение происходит в соответствии с молекулярно-генетическим тестированием.
Лучевая терапия
Лучевая терапия используется только при лечении аденокарцином прямой кишки, поскольку остальные отделы толстого кишечника обладают высокой подвижностью, что не позволяет произвести разметку поля облучения. Лучевая терапия может использоваться на дооперационном и послеоперационном этапе. В первом случае преследуется цель уменьшения опухолевой массы, а во втором — уничтожение раковых клеток в окружающих тканях.
Иммунотерапия аденокарциномы при наличии микросателлитной нестабильности
Около 15% случаев аденом толстой кишки развивается в результате поломки системы восстановления ошибочно спаренных нуклеотидов — особой системы, которая призвана своевременно распознавать и устранять мутации ДНК. Если она не работает, генетический код не защищен и клетки активно накапливают мутации, которые выявляются в повторяющихся нуклеотидных последовательностях — микросателлитах. Такое состояние называется микросателлитной нестабильностью. Опухоли, имеющие данную особенность, хорошо отвечают на иммунотерапию.
В норме иммунная система должна уничтожать чужеродные клетки и агенты, но раковой опухоли удается избежать этого процесса с помощью особых процессов взаимодействия с иммунитетом. Иммунотерапия блокирует эти процессы и делает опухоль заметной мишенью, что позволяет уничтожить ее. За разработку данного метода лечения в 2018 году была вручена Нобелевская премия.
Одним из иммунологических препаратов является пембролизумаб. Его назначение позволяет значительно улучшить результаты лечения пациентов с метастатической формой аденокарциномы толстой кишки, характеризующейся микросателлитной нестабильностью.
Метастазирование аденокарциномы
Метастазирование аденокарциномы осуществляется несколькими способами:
- Лимфогенный — с током лимфы опухолевые клетки сначала попадают в регионарные лимфатические узлы, а оттуда в более отдаленные группы, например, в надключичные.
- Гематогенный способ метастазирования предполагает рассеивание раковых клеток с током крови. Чаще всего образуются метастазы в печени (по воротной вене) и легких. При низкодифференцированных и недифференцированных аденокарциномах возможно поражение костного мозга.
- Если аденокарцинома толстой кишки проросла окружающие органы, возможно имплантационное метастазирование в результате контакта опухоли с воспринимающей поверхностью. В этом случае возможны множественные метастазы по брюшине (канцероматоз).
Осложнения аденокарциномы толстой кишки
Осложнения аденокарциномы обычно развиваются на распространенных стадиях онкологического процесса, однако бывают случаи, что именно они и являются первыми признаками заболевания:
- Кишечная непроходимость. Она может быть компенсированная, субкомпенсированная и декомпенсированная. Декомпенсированная кишечная непроходимость (полная обтурация) наблюдается в конечных отделах толстой кишки, чаще всего на уровне сигмовидной или прямой кишки, поскольку в этих местах кишечный просвет уже, чем в выше расположенных отделах, а кишечное содержимое имеет плотную структуру. В любом случае кишечная непроходимость требует оперативного лечения. Раньше с этой целью накладывалась колостома — вышележащий отдел кишки выводится на живот. Сейчас же предпочтение отдается резекции участка кишечника вместе с опухолью, с наложением анастомоза. Если это невозможно, тогда уже прибегают к стомированию.
- Перфорация стенки кишки. Очень грозное осложнение, поскольку способствует выходу кишечного содержимого в брюшную полость или забрюшинное пространство с развитием тяжелейших перитонитов.
- Воспалительные процессы в опухоли. Чаще встречается перифокальное воспаление, реже внутриопухолевое. Воспаление связано с наличием в просвете кишки патогенной микрофлоры, которая инфицирует опухоль. Опасность таких процессов заключается в образовании инфильтратов, флегмон, абсцессов, а также перфорации кишечной стенки и развитием перитонита.
- Кровотечение. Хроническая кровопотеря приводит к развитию железодефицитной анемии и, как следствие, к снижению гемоглобина, общей слабости, головокружению. Клиническая картина будет определяться местом локализации опухоли. При выраженных кровотечениях опухоли вышележащих отделов наблюдается черный стул. Если кровоточит опухоль терминальных отделов толстого кишечника, в кале обнаруживаются алая кровь или ее сгустки. Многие пациенты принимают их за проявления геморроя.
- Прорастание опухоли в соседние органы, сопровождающееся нарушением их работы. Например, при прорастании опухоли в печень могут развиваться симптомы холецистита. Если аденокарцинома толстой кишки прорастает в полые органы, возникают свищи.
Прогноз
Главным образом, прогноз аденокарциномы зависит от гистологического типа опухоли и стадии заболевания на момент начала лечения. Наиболее благоприятная ситуация при начальных стадиях, когда еще нет регионарных и отдаленных метастазов. Пятилетняя выживаемость таких пациентов составляет 95% при первой стадии и 75% при второй стадии (учитываются все типы опухоли, даже самые злокачественные). Пятилетний рубеж при третьей стадии переживает только половина пациентов, при четвертой — около 5%.
Таким образом, чем скорее начато лечение, тем более благоприятный будет прогноз. «Евроонко» проводит лечение аденокарциномы толстой кишки на всех стадиях заболевания, в том числе и в терминальных. Если излечение невозможно, мы направляем свои усилия на улучшение качества жизни пациентов.

.png)