55 лет ^
УДК 616. 33 — 076
Н.А. НУГМАНОВА, Л.Н. ВЛАСОВА, А.Б. РАМАНКУЛОВА
ПРИЧИНЫ ДИАГНОСТИЧЕСКИХ ОШИБОК ПРИ ИССЛЕДОВАНИИ БИОПСИЙ ЖЕЛУДКА
Актюбинское областное патологоанатомическое бюро
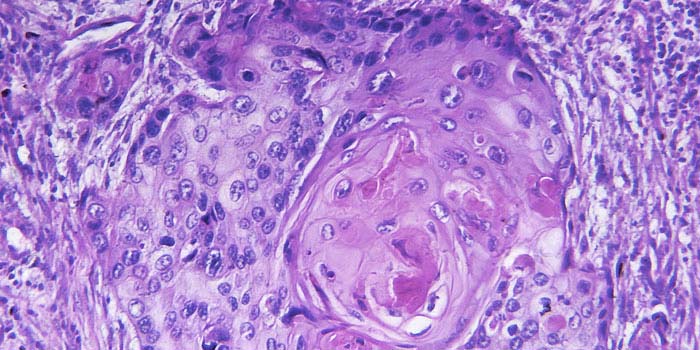
Морфологические исследование вследствие высокой информативности стали особенно приоритетными в современное время для диагностики болезней желудочно-кишечного тракта. Особое место принадлежит биопсийному исследованию, как одному из достоверных и быстрых. Этот метод требует от специалистов определенных знаний и навыков. Особенно это касается биопсий слизистой оболочки желудка.
Правильность диагностики в данной ситуации зависит не только от врача морфолога, а прежде всего от врача эндоскописта.
Наиболее достоверные результаты дает прицельная биопсия, важным принципом которой, является иссечение достаточного количество кусочков (3-5 и более) из различных отделов слизистой оболочки желудка. Опыт показывает, что единичная биопсия, особенно при подозрении на злокачественную опухоль, не столько полезна, сколько вредна для больного, так как результат не всегда может быть достоверным. Кроме того структура слизистой оболочки желудка неодно-
родна в его различных отделах, поэтому судить о состояние желез различных отделов нельзя. Это обязывает любого врача эндоскописта обязательно указывать отдел желудка из которого взят материал. Заключение гистологического анализа не всегда должны успокаивать врача, поскольку некоторые формы злокачественных опухолей желудка длительное время не дают экзофитного роста и эндоскопист не всегда может видеть этот патологический очаг и своевременно его верифицировать. Допускаются случаи, когда материал взят поверхностно, т.е только слизистая оболочка, что не позволяет морфологу дать заключение, а это значит, что больной не будет получать во время правильное лечение и потребуется повторное взятие материала.
Для качественного изучения биопсийного материала необходимо, что бы врач-эндоскопист правильно дал макроморфологическую картину исследуемого органа, четко описал анатомо- топографическое место взятие биоптата и их количество.
УДК 616.89; 615.832.9; 615.851
А.З. НУРГАЗИНА, К.Ж. АЛИНА
ОСНОВНЫЕ СВОЙСТВА ПСИХОЛОГИЧЕСКОГО ЗДОРОВЬЯ
Республиканский научно-практический Центр медико-социальных проблем наркомании, Павлодар
В ходе проведения масштабных эпидемиологических, экспериментально-психологических и клинических исследований (Бохан Н.А., Катков А.Л., Россин-ский Ю.А., 2005) были идентифицированы следующие личностные свойства, высокий уровень развития которых обеспечивал устойчивость в агрессивной среде: полноценное завершение личностной идентификации; наличие позитивного (идентификационного) жизненного сценария; сформированность навыков свободного и ответственного выбора; сформированность внутреннего локуса контроля; наличие психологических ресурсов, необходимых для реализации позитивного жизненного сценария; наличие адекватной информированности об агентах, агрессивных и деструктивных по отношению к основным жизненным сценариям.
Согласно главному тезису данной концепции психологическое здоровье представляет собой качественную составляющую категории психического здоровья, обеспечивающую возможность адекватной адаптации и свободного развития индивида в агрес-
сивной среде. Таким образом, понятие «психологическое здоровье» отнюдь не сводимо к набору базисных характеристик психических процессов (сознание, память, внимание, мышление, поверхностная рациональность и пр.), обеспечивающих возможность появления субъектности как таковой. Уровень организации психического, имеющий непосредственное отношение к феномену психологического здоровья, в данной концепции обозначен как индивидуально-пластический (А.Л.Катков, 2004).
Идентифицированные в масштабных научных и экспериментальных исследованиях свойства являются универсальными качественными характеристиками феномена психического здоровья, адекватными для всех наиболее значимых возрастных групп.
Таким образом, с точки зрения данной концепции, психологическое здоровье (в функциональном значении данного термина), способность к эффективной самоорганизации, обеспечивающая устойчивость и адекватную адаптацию человека в агрессивной среде.
Медицинский журнал Западного Казахстана 3 (35) 2012 г.
Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
61456
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
Пересмотр гистологических стекол: опухолевая ткань
Полученный во время операции или на биопсии образец ткани (или клеточный материал) специальным образом фиксируют и окрашивают, чтобы изучить под микроскопом и иммуногистохимическими методами. Последние позволяют даже определить органопринадлежность опухоли. [1]
Что такое блоки и стекла?
Эти термины обозначают ткань, полученную во время биопсии и подготовленную особым образом. В первую очередь образцы заливают раствором формалина и проводят специальную обработку. Это нужно для того, чтобы зафиксировать материал, чтобы клетки не разрушились. Затем ткани необходимо придать нужную степень плотности. Для этого ее помещают в парафин – так получаются гистологические блоки.
Гистологические блоки, образец ткани помещен в парафин
Но и такие образцы пока еще не готовы к исследованию. Ткань в блоке нельзя рассмотреть под микроскопом, потому что она не пропускает свет, а слои клеток накладываются друг на друга. Чтобы ткань стала прозрачной и доступной для изучения, блок нужно нарезать на очень тонкие слои с помощью специального инструмента – микротома. Эти тоненькие слои помещают на стекла и фиксируют – получаются гистологические стёкла. [2,3]
Гистологические стекла
Если у пациента обнаружен рак, то лаборатория обязана хранить гистологические блоки пожизненно, а если патологии не выявлено – в течение пяти лет. Гистологические стекла при диагностированном онкологическом заболевании тоже хранятся пожизненно. Если нужно выполнить пересмотр, то можно обратиться в лабораторию, где проводилось исследование, и получить оба этих вида материала. [4]
Когда и почему необходим пересмотр стекол?
Если морфологическое заключение не соответствует клинической картине опухоли, а также снимкам МРТ или КТ, то стекла отправляют на пересмотр в другое лечебное учреждение. Обычно пересмотром стекол занимаются специалисты с многолетним стажем работы и уникальным опытом диагностики редких опухолей. Дополнительный ручной пересмотр исключает возможность ошибки, связанной с использованием автоматических анализаторов.
Почему могут возникать ошибки при первичном просматривании стекол?
- неправильный забор материала, например, захвачен не весь слой эпителия, и невозможно судить о глубине поражения;
- проведена биопсия участка здоровой ткани;
- некачественная обработка материала в лаборатории;
- малое количество изученных срезов;
- недостаточная квалификация патоморфолога. [5]
Качественное микроскопическое и иммуногистохимическое исследование позволяет начать оправданное и своевременное лечение опухоли, а значит, увеличивает шансы на излечение и выживаемость пациента при онкологических заболеваниях. Оптимально, если морфологический диагноз будет подтвержден двумя специалистами.
Список литературы:
- Tatyana S. Gurina; Lary Simms. Histology, Staining. Treasure Island (FL): StatPearls Publishing; 2021 Jan-.
- В. А. Корьяк, Л. А. Николаева. Основы гистологической техники. Учебное пособие.
- Гистологическое изучение микропрепаратов тканей и органов. Гистология, эмбриология, цитология. Под ред. д.м.н., доц. Н. Ю. Матвеевой. Владивосток, Медицина ДВ, 2015.
- Приказ МЗ РФ № 179н от 24.03.2016 г. «О правилах проведения патолого-анатомических исследований».
- P. Morelli, E. Porazzi, M. Ruspini, U. Restelli, and G. Banfi. Analysis of errors in histology by root cause analysis: a pilot study. J Prev Med Hyg. 2013 Jun; 54(2): 90–96.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Третьякова Ю.И.
1
Патрикеева М.С.
1
Меньшикова Н.С.
1
1 ФГБОУ ВО Пермский государственный медицинский университет им. ак. Е.А. Вагнера Минздрава России
В статье представлен клинический случай с описанием пациента 28 лет с агрессивным течением перстневидно-клеточного рака желудка, диагностированного на последней стадии. Из анамнеза известно, что в течение 2,5 месяцев больной наблюдался с диагнозом «гастропатия, индуцированная нестероидными противовоспалительными препаратами (НПВП), с назначением ингибиторов протонной помпы». В связи с ухудшением состояния и неэффективностью терапии пациент был госпитализирован в гастроэнтерологическое отделение клиники. На рентгенографии желудка были выявлены признаки инфильтративных изменений стенок желудка и канцероматоз брюшины. По данным фиброгастроскопии — слизистая желудка ярко гиперемирована, плотная при инструментальной пальпации. По результатам патогистологического исследования выявлен недифференцированный аденогенный рак с образованием перстневидных клеток. Больному проведен один курс полихимиотерапии в краевом онкодиспансере без положительного эффекта. Пациент скончался в связи с прогрессированием основного заболевания и развитием полиорганной недостаточности. Был поставлен заключительный патологоанатомический диагноз: Злокачественное новообразование желудка: низкодифференцированная аденогенная карцинорма G3-4 (перстневидно-клеточный вариант – гистологически) с метастазами в парааортальные, периэзофагальные лимфоузлы, легкие, надпочечники; канцероматоз плевральных полостей и брюшины рТ4N3M1b. В заключение статьи даны рекомендации по мерам профилактики онкологических заболеваний.
клинический случай
рак желудка
поздняя диагностика
перстневидно-клеточный рак
онкология.
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
2. Абдуллаев А.Г., Аллахвердиев А.К., Бесова Н.С., Бяхов М.Ю., Горбунова В.А., Давыдов М.И., Давыдов М.М., Ибраев М.А., Карселадзе А.И., Кувшинов Ю.П., Малихова О.А., Неред С.Н., Стилиди И.С., Трякин А.А. Клинические рекомендации по диагностике и лечению больных раком желудка. Ассоциация онкологов России, 2017. 40 с.
3. Денисов И.Н., Артемьева Е.Г., Маленкова В.Ю., Бусалаева Е.И. Рак желудка. Руководство для врачей общей практики (семейных врачей). Ассоциации врачей общей практики РФ, 2015. 14 с.
4. Белковец А.В., Курилович С.А., Решетников О.В. Наследственный рак желудка (научный обзор) // Международный журнал прикладных и фундаментальных исследований. 2016. № 1-4. С. 516-522.
5. Джемал А., Паоло В., Брей Ф., Торре Л., Форман Д. Атлас современной онкологии. Издание второе. Американское онкологическое общество, 250 Williams Street, Atlanta, Georgia 30303 USA (США), 2014. 136 с.
6. Бойкова С.П., Зайратьянц О.В., Зотова Л.А. Патологическая анатомия: атлас: учеб. пособие для студентов медицинских вузов и последипломного образования. М.: «ГЭОТАР-Медиа», 2014. 961 с.
7. Рыбакова Д.В., Давыдов М.М., Казанцев А.П., Керимов П.А., Матинян Н.В. Рак желудка у пациента 16 лет: описание клинического случая // Онкопедиатрия. 2017. Т. 2. №4. С.147–151.
8. Вашакмадзе Л.А., Филоненко Е.В., Бутенко А.В., Кириллов Н.В., Хомяков В.М. Отдаленные результаты хирургического лечения больных местнораспространенным и диссеминированным раком желудка в сочетании с интраоперационной фотодинамической терапией. // Фотодинамическая терапия и фотодиагностика. 2013. Т. 1. №2. С.3-10.
9. Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2017 году. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 236 с.
10. Бойцов С.А., Чучалин А.Г., Арутюнов В.Г. Биличенко Т.Н., Бубнова М.Г., Ипатов П.В., Калинина А.М., Карпин А.Д., Марцевич С.Ю., Оганов Р.Г., Погосова Н.В., Старинский В.В., Стаховская Л.В., Ткачева О.Н., Чиссов В.И., Шальнова С.А., Шестакова М.В. Профилактика хронических неинфекционных заболеваний. Клинические рекомендации. Москва. 2013. 136 с.
Смертность от онкологических заболеваний занимает второе место после болезней сердечно-сосудистой системы. В 2017 г. в России выявлено почти 541 тыс. онкобольных, а умерло 290,7 тыс., что составило 15,9% в общей структуре смертности [1, с. 3].
В последние годы отмечается тенденция к снижению заболеваемости раком желудка (РЖ), тем не менее в структуре заболеваемости злокачественными новообразованиями населения России РЖ занимает 4-е место у мужчин (7,6%) и 5-е место у женщин (4,7%) [1, с. 9, 10]. Пик заболеваемости приходится на возраст старше 50 лет. Злокачественные новообразования желудка занимают вторую позицию в структуре смертности у мужчин и женщин. Ежегодно в РФ регистрируют около 36 тыс. новых случаев РЖ, и более 34 тыс. больных умирает от этого заболевания. Этиология заболевания до конца не выяснена [2, с. 6].
Имеется связь возникновения патологии с определенными факторами риска. Их можно разделить на немодифицируемые: пол (мужчины страдают чаще), возраст (по мере увеличения возраста увеличивается частота возникновения РЖ), генетическая предрасположенность (5–10% пациентов, страдающих РЖ, имеют отягощенный семейный анамнез); и модифицируемые: инфекция Helicobacter Pylori (HP), характер рациона, ожирение, курение, алкоголь, профессиональная деятельности [3, с. 4-6].
В настоящее время установлено, что почти 90% случаев РЖ в мире обусловлено инфицированием бактерией HP. При этом средства лечения HP-инфекции существуют, но широко не применяются из-за недостатка подтвержденных данных эффективности в профилактике рака желудка и высокой стоимости [5, с. 22]. К возникновению РЖ могут привести фоновые заболевания: хронический атрофический гиперпластический гастрит, аденоматозные полипы, пернициозная анемия, состояния после резекции желудка, болезнь Менетрие [2, с. 6]. Различают три гистологических типа РЖ (по Lauren, 1965 г.): кишечный, диффузный, смешанный. При диффузном раке опухоль представлена слабоорганизованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки). Для данного типа характерен диффузный инфильтративный рост [2, с. 7].
Перстневидно-клеточный рак желудка содержит не менее половины клеток с признаками внутриклеточного образования слизи. Скапливающаяся в цитоплазме слизь сдвигает ядро к периферии, и клетка приобретает сходство с перстнем [6, с. 589]. Согласно результатам клинических наблюдений неблагоприятный прогноз при диффузном раке желудка связывают с низкой выявляемостью на ранних стадиях, быстрым течением, более злокачественным потенциалом опухолевых клеток и ранним метастазированием [7].
Приводим случай летального исхода пациента с перстневидно-клеточным раком желудка, диагностированным на последней стадии.
Клиническое наблюдение. Пациент В., 28 лет, поступил в гастроэнтерологическое отделение клинической медико-санитарной части г. Перми 14.11.2017 г. с жалобами на постоянные боли в области правого фланка живота, преимущественно в нижней части; интенсивные боли в правом подреберье и правом боку при глубоком дыхании; тошноту, рвоту желчью, вздутие живота, Также пациента беспокоили отсутствие аппетита, отвращение к пище, жидкий стул 2–3 раза в сутки без примесей. Отмечались выраженная общая слабость, повышение температуры тела до 37,4°С. За 1 месяц больной похудел на 13 кг.
Анамнез. В начале сентября 2017 г. больной получал терапию антибактериальными и нестероидными противовоспалительными препаратами (НПВП) по назначению стоматолога (после экстракции зуба) в течение 7 дней. В начале октября 2017 г. были вновь назначены антибактериальная терапия и НПВП по поводу гайморита. На фоне приема препаратов появились боли в эпигастрии, изжога, неустойчивый стул. Больной обратился в поликлинику по месту жительства, где обследовался у участкового терапевта. 7 октября 2017 г. выполнена фиброгастродуоденоскопия (ФГДС), на которой выявлены множественные язвы желудка (6 дефектов), язва двенадцатиперстной кишки (ДПК) в стадии эпителизации, застойная гастропатия, дуоденогастральный рефлюкс. Уровень антител к HP составил 1,44. Получал терапию ингибиторами протонной помпы (ИПП), антацидами без эффекта – сохранялись тошнота и абдоминальный болевой синдром с локализацией в эпигастрии.
Участковым терапевтом дано направление на экстренную госпитализацию в терапевтическое отделение городской больницы с диагнозом: Множественные язвы желудка и язва луковицы ДПК, ассоциированные с HP. Гастринома? Синдром Золлингера–Эллиссона?, где больной находился с 12.10.2017 г. по 24.10.17 г. При обследовании в общем анализе крови (ОАК) от 13.10.2017 г.: гемоглобин – 157 г/л; умеренное повышение лейкоцитов до 11х109/л; ускоренная скорость оседания эритроцитов (СОЭ) – 40 мм/час. В биохимическом анализе крови от 13.10.2017 г. общий белок, амилаза, холестерин, печеночные тесты, электролиты крови в пределах нормальных значений. На ультразвуковом исследовании органов брюшной полости (УЗИ) от 13.10.2017 г. выявлены признаки диффузных изменений видимых участков поджелудочной железы. Кал на скрытую кровь – слабоположительный.
23.10.2017 г. выполнена повторная ФГДС: слизистая желудка диффузно гиперемирована с выраженным отеком, утолщена, сосудистый рисунок смазан. Слизистая оболочка в области привратника отечна, гиперемирована. По всем стенкам множественные точечные лимфоидные высыпания. Заключение: Диффузный катаральный гастрит выраженной степени активности. Дуоденогастральный рефлюкс. Диффузный катаральный бульбит выраженной степени активности. Косвенные признаки панкреатита. Гистологическое исследование не проводилось.
В стационаре по результатам обследований был поставлен диагноз: Язвенная болезнь желудка, луковицы ДПК. Множественные острые язвы желудка в активной стадии. НПВП-ассоциированная гастропатия. Язва луковицы ДПК в стадии эпителизации. Больной получал терапию спазмолитиками, ИПП 40 мг в сутки, антацидами.
На фоне лечения отмечалась положительная клиническая и эндоскопическая динамика в виде уменьшения болевого синдрома и эпителизации язвенных дефектов. Пациент был выписан из стационара с рекомендациями продолжить прием ИПП в дозе 40 мг в сутки и явиться на прием к участковому терапевту.
После выписки боли в эпигастрии усилились, появилась острая боль справа в боку в области ребер. Участковый терапевт назначил прием прокинетика, антацидных препаратов, НПВП внутримышечно (в/м) № 3. 4.11.2017 г. у пациента внезапно возникла острая боль в области верхнего левого фланка живота и межреберьях, связанная с дыханием. Больной обратился в приемное отделение клинической больницы, где был поставлен диагноз: Межреберная невралгия. Проведена терапия НПВП в/м, и больной был отпущен домой под наблюдение невролога и терапевта с рекомендациями приема НПВП. Далее по назначению гастроэнтеролога поликлиники принимал висмута трикалия дицитрат, спазмолитики, даларгин без эффекта – сохранялись абдоминальный болевой синдром, неустойчивый стул; также появились выраженное вздутие живота, рвота, отвращение к пище, прогрессирующее похудание. 13.11.2017 г. выполнена ректороманоскопия: стенка прямой кишки с трудом расправлялась воздухом, с эрозиями, утолщенными складками, сосудистый рисунок смазан. Заключение: эрозивно-катаральный проктосигмоидит.
14.11.2017 г. пациент был экстренно госпитализирован в гастроэнтерологическое отделение клиники для дальнейшего обследования и лечения.
Из анамнеза жизни известно, что пациент рос и развивался соответственно возрасту. Курил в течение 8 лет по 10 сигарет в день. Профессиональных вредностей не было. Со слов больного, ранее лечился по поводу мочекаменной болезни. Наследственность по заболеваниям органов пищеварения не отягощена.
При физическом исследовании обращала на себя внимание бледность кожных покровов с сероватым оттенком. Кожа чистая, отеков не отмечалось. Пульс – 92 удара в минуту, ритмичный. Тоны сердца ясные, ритм правильный. Дополнительные шумы не выслушивались. Дыхание везикулярное, ослаблено в нижних отделах, хрипы не выслушивались. Перкуторный звук несколько притуплен в нижних отделах легких. ЧДД – 16 в минуту.
Язык обложен бело-желтым налетом у корня, влажный. Живот плотный, увеличен за счет вздутия и асцита; пальпация резко болезненная в эпигастрии, в области правого фланка живота, по ходу толстой кишки. Ординаты Курлова 10х8х7 см. Стул оформленный, чередующийся с кашицеобразным, без патологических примесей, 1–2 раза в сутки. Со стороны почек и мочевого пузыря без видимой патологии.
Результаты лабораторно-инструментальных исследований представлены ниже.
ОАК: эритроциты 4,7х109/л, гемоглобин 140 г/л, среднее содержание гемоглобина (ССГ) 29%, тромбоциты 307х109/л, лейкоциты 8,4х/л, палочкоядерные нейтрофилы 7%, сегментоядерные нейтрофилы 75%, лимфоциты 15%, моноциты 3%, повышение СОЭ до 43 мм/час.
ОАМ: цвет – желтый, мутная, pH 6,0, умеренная протеинурия 0,39 г/л, лейкоциты 4–6 в поле зрения (п/з), эритроциты 0–1 в п/з, эпителий 2–3 в п/з, слизь +.
Биохимический анализ крови от 15.11.2017 г.: глюкоза 4,8 ммоль/л, Ca 2,29 ммоль/л, AСТ/АЛТ 16/18 Ед/л, ГГТП 84 Ед/л, ЩФ 285 Ед/л, общий белок 54 г/л, альбумины 27 г/л, билирубин общий 12 мкмоль/л, прямой 4,1 мкмоль/л, холестерин общий 3,7 мкмоль/л, калий 4,5 ммоль/л, натрий 134 ммоль/л, креатинин 51 ммоль/л, резкое повышение С-реактивного белка (СРБ) 105 мг/л, снижение железа сыворотки до 4,5 мкмоль/л, повышение общей железосвязывающей способности сыворотки до 75, незначительное повышение прокальцитонина до 0,2 нг/мл. При форезе белков выявлены снижение альбумина до 37,95% и повышение α1-глобулинов до 8,77%, α2-глобулинов до 13,28%, β-глобулинов до 18,5 3%, γ-глобулин 21,47%.
Коагулограмма от 15.11.2017 г.: протромбиновое время 14,9 секунд (11–15 секунд), тромбиновое время – 17,2 секунд, активированное частичное протромбиновое время – 28 секунд (24–35 секунд), резкое повышение фибриногена до 9,56 г/л.
Копрограмма от 16.11.2017 г.: консистенция жидкая, цвет темно-коричневый, переваренные мышечные волокна 0–1–2 в п/з, неизмененные мышечные волокна 0–1 в п/з, форменные элементы крови 0–1 в п/з, лейкоциты 10–20 в п/з, эпителий плоский – единичный в п/з, нейтральных жиров нет, жирных кислот нет, крахмал внеклеточно скудно, йодная флора +, детрит +++.
ФГДС от 14.11.2017 г.: складки желудка гипертрофированные, отечные. Слизистая желудка ярко гиперемирована, плотная при инструментальной пальпации, ранимая при контакте с линейными рубцами неправильной формы. Луковица ДПК деформирована, рыхлая с увеличенными эрозированными фолликулами, на верхушках – фибрин. Заключение: Болезнь Крона? Дуоденогастральный рефлюкс. Косвенные признаки панкреатита. Выполнена биопсия.
Результаты патогистологического исследования слизистой желудка (20.11.2017 г.): в слизистой оболочке пилородуоденальной области очаговое скопление крупных клеток округлой и овальной формы, со светлой слизьсодержащей цитоплазмой, периферически расположенными уплощенными ядрами, единичные клетки с гиперхромными ядрами, скудной цитоплазмой. Диагноз: недифференцированный аденогенный рак с образованием перстневидных клеток.
16.11.2017 г. выполнена КТ органов брюшной полости. Выявлен выпот в реберно-диафрагмальные синусы с обеих сторон. Желудок в области тела и антрального отдела с неравномерно утолщенными стенками до 0,8 см. Большой сальник в области эпигастрия уплотнен, с узловыми образованиями. В брюшной полости большое количество свободного выпота. Заключение: Признаки двустороннего гидроторакса, инфильтративных изменений стенок желудка. Большой сальник в эпигастральной области уплотнен с узловыми образованиями (канцероматоз брюшины). Асцит. Аденопатия гепатодуоденальных лимфатических узлов.
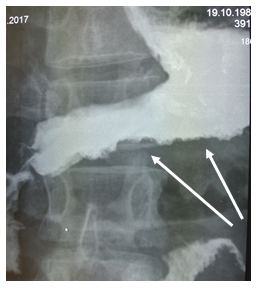
На рентгеноскопии пищевода, желудка, ДПК с бариевой взвесью диагностировано стойкое сужение просвета тела, синуса, выходного отдела желудка (рис. 1) с неровными фестончатыми контурами, атипичным рельефом слизистой (рис. 2). Заключение: Рентгенологические признаки инфильтративного поражения желудка.
Рис. 1. Рентгенологическое исследование желудка пациента В., 28 лет: сужение просвета тела, синуса, выходного отдела желудка
Рис. 2. Рентгенологическое исследование желудка пациента В., 28 лет: неровность и фестончатость контуров, атипичный рельеф слизистой
В условиях стационара проводилась инфузионная, антибактериальная, спазмолитическая, обезболивающая терапия. Амитриптилин 6,25–12,5 мг на ночь. Больной выписан из отделения 22.11.2017 г. с диагнозом:
Основной: Недифференцированный аденогенный рак выходного отдела желудка IV ст. Сопутствующий: Эрозивно-катаральный проктосигмоидит.
Осложнения: Канцероматоз брюшины. Аденопатия гепатодуоденальных лимфоузлов. Асцит. Двусторонний гидроторакс. Дефицит железа.
Пациенту выдано направление в онкологический диспансер. Даны рекомендации приема Амитриптилина 25 мг на ночь; Прегабалина 75 мг 1 раз в день; Нейробиона по 1 табл. 3 раза в день.
С 23.11.2017 г. по 30.11.2017 г. пациент находился в краевом онкологическом диспансере, где был подтвержден диагноз: Злокачественное новообразование желудка (ЗНО) IV ст. Т4NxMx».
Проведен 1 курс полихимиотерапии (ПХТ). После выписки, несмотря на проводимое лечение, состояние пациента прогрессивно ухудшалось. 18.12.2017 г. проведена эвакуация 10 литров асцитической жидкости в условиях стационара. 20.12.2017 г. – консультативный прием в онкологическом диспансере. Диагноз: Злокачественное новообразование желудка IV ст. Т4NxMx. Тотальное поражение. Канцероматоз брюшины. Прогрессирование. Кахексия. Асцит. Было рекомендовано продолжить симптоматическую терапию по месту жительства, а также попытка проведения гастростомии. Учитывая тяжесть состояния, ПХТ не показана.
22.12.2017 г. больной отметил появление одышки. На следующий день самостоятельно обратился в приемное отделение краевой больницы и был госпитализирован в отделение торакальной хирургии. На КТ органов грудной клетки (23.12.2017 г.) выявлен двусторонний гидроторакс. По легочным полям определялись очаги уплотнения по типу «матового стекла».
23.12.2017 г. и 25.12.2017 г. – плевральная пункция – эвакуирован 1 л серозно-геморрагического отделяемого. 26.12.2017 г. состояние больного тяжелое, с отрицательной динамикой. Появились рвота темной кровью, боли в эпигастрии, слабость, сухость во рту. На ФГДС – кровотечение интрагеморрагическое. Эрозивный эзофагит. Гемостаз системой EndoClot.
27.12.2017 г. состояние было крайне тяжелым. Сохранялась рвота темной кровью. Пациент переведен в ОРИТ, где проводилась инфузионная терапия, получал Метоклопрамид, Трамадол, Кетопрофен, Верошпирон, Транексам, Нексиум. При обследовании нарастала тромбоцитопения – 11569-41-19х109л, показатели очищения: мочевина 20,01 ммоль/л; креатинин 140,9 ммоль/л; гипопротеинемия 46,4 г/л.
27.12.2017 г. в 22:15 – асистолия. Реанимационные мероприятия в полном объеме – без эффекта.
27.12.2017 г. в 22:45 констатирована биологическая смерть. Труп В., 28 лет, был направлен на патологоанатомическое исследование с диагнозом: Перстневидноклеточный рак желудка с переходом на нижнюю треть пищевода T4NхM1. Канцероматоз плевры. Метастатическое поражение легких. Двусторонний экссудативный плеврит. Асцит. Осложнения: Кахексия. Желудочно-кишечное кровотечение. Геморрагический шок. Синдром полиорганной недостаточности.
Патологоанатомический диагноз:
Основное заболевание: Злокачественное новообразование желудка: низкодифференцированная аденогенная карцинорма G3-4 (перстневидно-клеточный вариант – гистологически) с метастазами в парааортальные, периэзофагальные лимфоузлы, легкие, надпочечники; канцероматоз плевральных полостей и брюшины рТ4N3M1b.
Осложнение основного заболевания: Отек головного мозга. Двусторонний гидроторакс (1200/1200 мл). Асцит 3500 мл. Кахексия. Венозное полнокровие и паренхиматозная дистрофия миокарда, печени, почек.
Сопутствующие заболевания: Хронический пиелонефрит, ремиссия.
Обсуждение. В структуре заболеваемости РЖ возрастает доля молодого контингента больных (до 45 лет) с преобладанием низкодифференцированных и сложных форм, характеризующихся крайне плохим прогнозом [7, 8]. В настоящее время показатели несвоевременной диагностики рака желудка (IV стадия) являются одними из лидирующих, составляя в России 39,9% [9, с. 10].
Врач первичного звена является первой линией защиты в борьбе с онкопатологией. Первичная профилактика направлена на выявление и устранение влияния неблагоприятных факторов окружающей среды (канцерогенов) на процесс возникновения злокачественной опухоли, а также на устранение модифицируемых факторов риска [10]. У описанного нами пациента к факторам риска можно отнести длительный стаж курения и инфекцию НР.
Вторичная профилактика направлена на выявление и устранение предраковых заболеваний и диагностирование злокачественного новообразования на ранней стадии процесса при помощи ряда лабораторных и инструментальных методов обследования, включая полное гистологическое и молекулярно-генетическое исследование. При этом важно помнить о «симптомах тревоги» [10]. У пациента имели место снижение массы тела и повышение СОЭ, что должно было насторожить врачей. В течение 1,5 месяцев пациента вели с диагнозом «НПВП-гастропатия» с назначением ИПП, которые могли маскировать клинику рака желудка. Кроме того, отсутствие анамнестических данных о наличии фоновых заболеваний желудка и наследственной предрасположенности, молодой возраст пациента, неспецифическая симптоматика в начале заболевания, а также несвоевременное гистологическое исследование слизистой желудка послужили причиной поздней диагностики.
Заключение. Важно помнить, что рак желудка может быть диагностирован и в молодом возрасте, имея при этом крайне агрессивное течение. Необходимо выделять группы риска и своевременно проводить скрининг онкологических заболеваний. Регулярное диспансерное наблюдение является важнейшей массовой и высокоэффективной медицинской технологией сбережения здоровья и снижения преждевременной смертности населения.
Библиографическая ссылка
Третьякова Ю.И., Патрикеева М.С., Меньшикова Н.С. ПОЗДНЯЯ ДИАГНОСТИКА РАКА ЖЕЛУДКА У ПАЦИЕНТА 28 ЛЕТ (СЛУЧАЙ ИЗ ПРАКТИКИ) // Современные проблемы науки и образования. – 2018. – № 6.
;
URL: https://science-education.ru/ru/article/view?id=28401 (дата обращения: 06.06.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Рак желудка представляет собой один из самых распространенных видов онкологических заболеваний. Эффективное, информативное и точное средство диагностики этого и ряда других заболеваний – гистологическое исследование тканей желудка. Гистологический анализ подразумевает взятие образцов тканей желудка посредством биопсии и их микроскопическое исследование. Эта процедура дает врачу возможность поставить точный диагноз и назначить оптимальное лечение. Прежде всего, биопсия тканей желудка и их гистологическое исследование обязательно производится, если врач подозревает у пациента опухоль. Гистологический анализ предоставляет информацию о типе новообразования, клеточном составе опухоли. Если расшифровка результатов гистологии желудка дает положительный результат (наличие злокачественной опухоли), он расценивается как окончательный диагноз. Важно понимать, что плохой анализ гистологии – еще не приговор, так как многие виды опухолей, обнаруженные своевременно, успешно излечиваются. Если же результат отрицательный, нельзя исключать ошибку, виной которой может быть несовпадение местонахождения раковых клеток и места взятия биоптата. Если результат гистологического исследования отрицательный, однако симптомы опухолевого процесса присутствуют, процедура повторяется.
Показания для проведения гистологического исследования
— гипоацидный гастрит (это заболевание желудка считается предраковым);
— диагностика особых форм гастрита (гранулематозный, эозинофильный, лимфоцитарный гастрит);
— хроническая язвенная болезнь;
— дисфагия;
— пищевод Барретта;
— снижение веса, отсутствие аппетита, малокровие;
— стабильный дискомфорт в желудке, отвращение к мясной пище и другие.
Как подготовиться к эндоскопическому исследованию
— Лучшее время для проведения биопсии с последующим гистологическим анализом – утро. Исследование должно проводиться натощак, накануне вечером допустим лишь легкий ужин, исключается употребление жареной, жирной пищи.
— Необходимо прекратить принимать препараты, в которых содержится активированный уголь, железо.
— Накануне гистологического исследования исключаются жевательные резинки, курение. Мнительным пациентам показан прием успокоительных препаратов за день до процедуры.
Процедура забора биоптата
Биопсия забирается в ходе эндоскопического исследования. При этом врач вводит через рот и пищевод в желудок эндоскоп, который снабжен камерой и небольшими щипцами. При помощи камеры врач определяет подозрительные места на слизистой желудка, из которых необходимо взять биопсию. Затем подводит эндоскоп к данным дефектам, и при помощи щипцов откусывает небольшие кусочки. Поскольку в ходе биопсии отрываются небольшие кусочки, данная процедура практически безболезненная. После забора всех необходимых кусочков эндоскоп выводится наружу. Кусочки обрабатываются, как гистологические препараты, а затем врач-патологоанатом изучает их под микроскопом, выявляя наличие или отсутствие атипических (раковых) клеток. Иногда даже опытные специалисты не в состоянии взять кусочки из всех частей язвы. В этом случае необходимо провести биопсию повторно через некоторое время. Правильная биопсия является множественной, то есть врач забирает несколько кусочков для исследования из краев и дна каждого язвенного дефекта. Кроме того, забирается несколько кусочков из каждого рубца, видимого на месте зажившей язвы. Также рекомендуется забирать по нескольку кусочков биопсии из каждого подозрительного места на слизистой оболочке желудка. В настоящее время доказано, что 100%-я точность диагностики рака достигается забором не менее 6 кусочков из разных частей каждого язвенного и рубцового дефекта. Исследование только 1 – 2 кусочков является неинформативным, поскольку позволяет обнаружить рак на ранних стадиях только в половине случаев.
Стоимость и срок исследования
| Наименование | Срок | Стоимость, руб. |
|---|---|---|
| Гистологическое исследование биопсийного материала | от 3 дней | 5000* |
| Гистологическое исследование операционного материала | от 3 дней | 19500* |
* Организация и оплата доставки сырого материала (не в блоках) осуществляется клиентом.
По всем возникшим вопросам Вы можете проконсультироваться у нашего медицинского администратора по телефону: 8-800-555-92-67 или написать нам в WhatsApp: +7 925 740 05 87
Не всегда результат диагностического исследования в рамках проводимой биопсии оказывается точным, бывают ошибочные. Тому виной служит как человеческий фактор, так и другие причины, например, ошибка аппаратуры.
Ошибки в гистологии
В рамках малоинвазивной хирургии образцы тканей для последующего гистологического анализа могут быть получены различными методами.
Пункционный вид биопсии предполагает забор биоматериала при помощи трубки и иглы. Не всегда необходимый для точного анализа объем биопата попадает в шприц, что сказывается на достоверности результата. В этом случае не исключен повторный забор материала.
Если нет возможности удалить опухоль полностью, производится иссечение ее части. Результат диагностики и в этом случае может быть ошибочный, так как образец, попавший на анализ, может отличаться от основной массы и объема опухоли.
Полное удаление новообразование в данном случае – это точный метод диагностики.
Ошибки в биопсии и основные причины
Основными причинами ошибки в диагностике служат следующие факторы:
● место, где производится прокол, выбрано неправильно, что приводит к поверхностному забору биопата, который не сможет продемонстрировать клиническую картину течения заболевания;
● в связи с особенностью роста новообразования, из его очага невозможно забрать необходимое для точного исследования количества материала;
● несоблюдение правил, этапов приготовления, неправильная технология исследования забранного биоматериала;
● забор произведен с нарушениями, материал в дальнейшем хранился неправильно;
● неквалифицированный специалист, производивший забор биопата.
Не меньшую роль играет квалификация медика, который в дальнейшем анализирует собранный материал и интерпретирует полученные результаты лабораторных исследований.
Что еще влияет?
Если накануне забора материала пациент принимал определенные медикаменты, это также способно повлиять на конечный результат исследования.
Конечно, ошибки при исследовании биоптата на гистологию возникают не так часто. Это случаи исключительные, с минимальным процентом риска возникновения. То же можно сказать об ошибочной трактовке результатов исследования. Такой вариант не может влиять на итог всей диагностики заболевания.
28.09.2022