Согласно И.В. Давыдовскому, «врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Сегодня врачебная ошибка трактуется как неправильные действия или бездействие врача при исполнении им своих профессиональных обязанностей, не являющиеся следствием его недобросовестности и не содержащие состава преступления или признаков проступка.
Согласно И.В. Давыдовскому, «врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Сегодня врачебная ошибка трактуется как неправильные действия или бездействие врача при исполнении им своих профессиональных обязанностей, не являющиеся следствием его недобросовестности и не содержащие состава преступления или признаков проступка.
Врачебные ошибки могут быть нескольких видов. 1. Диагностические, т.е. связанные с постановкой диагноза. 2. Лечебно–тактические: сюда входят ошибки в выборе методов исследования и в оценке их результатов. 3. Лечебно–технические: это неполное обследование больного и ошибки диагностических или лечебных манипуляций. 4. Организационные: сюда включаются неправильная организация рабочего места и лечебного процесса. 5. Ошибки ведения медицинской документации. 6. Ошибки поведения медицинского персонала.
Практически все виды вышеперечисленных ошибок совершаются врачом на различных этапах курации больных внебольничной пневмонией (ВП) – заболеванием потенциально курабельным, но тем не менее являющимся причиной летального исхода у 5–30% заболевших. По данным ВОЗ, пневмония занимает 4–е место в структуре причин смертности. В США ежегодно регистрируют от 5 до 6 млн случаев этого заболевания у взрослых. По данным официальной статистики по РФ, формирующейся на основании анализа отчетов лечебных учреждений, заболеваемость ВП среди взрослых несколько превышает 400 тыс. случаев, что скорее всего значительно ниже реальной заболеваемости. Согласно расчетным данным, ежегодно в РФ возникает не менее 1,5 млн случаев ВП, хотя вполне вероятно, что это тоже далеко от истинной ситуации.
Основные ошибки ведения пациентов с пневмонией могут быть сведены к следующим:
– диагностика и верификация пневмонии;
– оценка тяжести заболевания;
– выбор антибактериального препарата;
– оценка эффективности назначенного антибактериального препарата;
– коррекция антибактериальной терапии;
– длительность антибактериальной терапии;
– полипрагмазия при лечении больных пневмонией.
Диагностика и верификация пневмонии
Уже при первом контакте с больным врача подстерегают опасности совершения ошибок, связанных с диагностикой пневмонии в качестве основной нозологической формы. По мнению академика РАМН проф. А.Г. Чучалина, «процент врачебных ошибок в России очень высок, более 30%. Так, например, из 1,5 млн заболеваний пневмонией диагностируется не более 500 тыс. Причин тому несколько, в том числе и полное отсутствие в стране системы контроля качества оказания врачебной помощи».
Диагностика ВП основывается на умении врача своевременно выявлять и правильно трактовать ряд признаков, являющихся критериями и составляющих так называемый золотой стандарт диагностики ВП – кашель, лихорадка (свыше 3 суток), клинические признаки легочного инфильтрата, лейкоцитоз, рентгенологические признаки легочного инфильтрата. Поскольку последние два признака не могут быть оценены при первичном осмотре, то, по мнению экспертов Британского торакального общества, для своевременной диагностики ВП может быть достаточно трех других признаков. Несмотря на, казалось бы, однозначность и доступность вышеуказанных диагностических критериев диагностика ВП, прежде всего в системе первичного звена (врач–терапевт), остается в настоящее время несовершенной. Около 30% случаев пневмонии диагностируются поздно или вообще не диагностируются. Причины поздней или ошибочной диагностики ВП можно условно разделить на объективные и субъективные. Так, несвоевременное обращение больного к врачу в силу различных причин может быть одной из причин поздней диагностики. С другой стороны, возможно атипичное течение пневмонии, при котором на первый план выступает внелегочная симптоматика, признаки декомпенсации сопутствующей патологии (сердечная недостаточность, сахарный диабет и др.). Такие ситуации нередко встречаются у лиц пожилого и старческого возраста, а также у больных, страдающих различными хроническими заболеваниями. Однако основным источником ошибок в диагностике ВП является недостаточная компетентность врача, которая сказывается в несовершенстве умения и навыков выявления клинических признаков (перкуторных, аускультативных) легочного инфильтрата, неправильной трактовке выявленных симптомов, затянувшемся обследовании больного. Основными дифференциально–диагностическими проблемами остаются заболевания с синдромно сходной симптоматикой (туберкулез, опухолевые заболевания, пневмониты неинфекционной природы, интерстициальные заболевания легких, ТЭЛА и некоторые другие). Невыполнение рекомендаций, возведенных в ранг стандартов диагностики пневмонии, само по себе считается ошибкой (лечебно–технические ошибки в виде неполного обследования больного по И.В. Давыдовскому). К таким диагностическим стандартам относится рентгенологическое исследование грудной клетки у больных с подозрением на пневмонию до начала лечения. Между тем анализ качества диагностики пневмонии в различных регионах России свидетельствует о том, что данное исследование проводилось лишь у незначительного количества больных до начала антибактериальной терапии (АТ) [1]. К этой же категории ошибок на этапе диагностики заболевания относится отсутствие бактериологического исследования мокроты и крови у госпитализированных больных пневмонией.
Таким образом, врачи не всегда следуют имеющимся клиническим рекомендациям по диагностике пневмонии, что может быть обусловлено недостаточным знакомством или вообще незнанием и игнорированием таковых.
Оценка тяжести ВП и принятие решения о месте лечения больного
Ошибки в определении тяжести ВП не позволяют адекватно оценить прогноз заболевания у больного и обосновать тактику лечения. Прежде всего, тяжесть пневмонии определяет место пребывания пациента с ВП (амбулаторное или стационарное лечение). Более того, в случае необходимости госпитализации степень тяжести заболевания позволяет врачу принять решение о переводе больного в ОРИТ. Общепринятыми показаниями для госпитализации больных ВП являются наличие дыхательной недостаточности, декомпенсация сопутствующей патологии (сердечная недостаточность, сахарный диабет и др.), невозможность обеспечить адекватное лечение и уход в домашних условиях
Тяжесть пневмонии является одним из клинических ориентиров для выбора антибактериального препарата (АП), адекватного данной ситуации. Практически все рекомендации по антибактериальной терапии ВП приводятся с учетом тяжести течения заболевания.
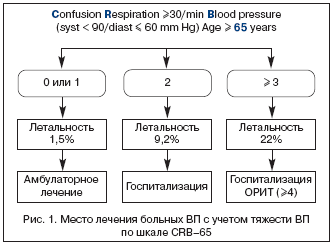
Предложены различные системы–шкалы, позволяющие оценить тяжесть пневмонии (РОRT, PSI, CURB, CURB–65). Некоторые шкалы громоздки, трудны для быстрой оценки и принятия решения. Наиболее практически приемлемой для оценки тяжести ВП можно считать шкалу СURB–65 (Confusion – спутанность, Urea – уровень мочевины в крови, Respiration – число дыханий/мин. – >30/мин., Blood pressure – артериальное давление: систолическое ≤90 мм рт. ст., диастолическое ≤60 мм рт. ст. Age >65 лет), однако она требует определения показателя мочевины в крови, что практически малореально в условиях первичного врачебного звена. С учетом этого можно использовать шкалу CRB–65, позволяющую прогнозировать летальность и, следовательно, определять показания к госпитализации либо в общетерапевтические отделения, либо в ОРИТ (рис. 1).
Антибактериальная терапия внебольничной пневмонии
Пожалуй, на этапе принятия решения о назначении АТ больным пневмонией совершается наибольшее число ошибок, касающихся различных аспектов АТ. К таким ошибкам относятся:
– своевременность начала АТ;
– выбор АП (доза, режим дозирования, путь введения и др.);
– оценка первоначальной эффективности АП;
– необходимость коррекции АТ;
– длительность АТ.
Сроки начала АТ пневмонии являются одним из факторов, влияющих на конечные результаты лечения. Особенно важным является как можно более раннее назначение АП больным пожилого и старческого возраста в связи с более тяжелым течением пневмонии и худшим прогнозом. Показано, что смертность в первые 30 дней среди больных тяжелой пневмонией в возрасте старше 65 лет, у которых АТ была начата в первые 8 ч с момента поступления, была значительно ниже по сравнению с больными, которым антибиотик назначался в более поздние сроки [2]. В другом исследовании отмечено значительное снижение смертности среди больных пневмонией, госпитализированных в отделение интенсивной терапии, у которых АТ начиналась в течение 4 ч с момента поступления по сравнении с более поздним началом лечения [3]
Несвоевременное начало АТ у госпитализированных больных ВП было отмечено при анализе качества ведения больных ВП в некоторых регионах России [1].
Выбор АП. Наиболее важным и ответственным решением, от которого во многом зависит эффективность лечения и исход заболевания, является выбор первоначального АП.
Между тем обращает на себя внимание частое несоответствие стартового АП принятым клиническим рекомендациям, составляющее, по некоторым данным, 22,8%, а также недостаточная суточная доза АП (18,6%) или неадекватный режим дозирования (5,6%) [4]. По данным НИИ АХ СГМУ (2007), у 85% больных тяжелой ВП стартовый АП не соответствовал клиническим рекомендациям, внутривенное введение АП назначалось только в 59% случаев, а у большинства пациентов (68%) АТ проводилась в режиме монотерапии. Несмотря на достаточную осведомленность врачей о препаратах выбора при лечении ВП в реальной амбулаторной практике назначение АП не всегда соответствует современным рекомендациям (высокая частота назначения ципрофлоксацина, цефазолина, парентеральных цефалоспоринов III поколения, «увлечение» макролидами в ущерб b–лактамам). Если для врача основными критериями выбора АП является эффективность и удобный режим приема, то для пациентов это эффективность и возможность перорального приема [1].
Ошибочным следует считать назначение больным ВП следующих АП:
• цефалоспорины I поколения;
• аминогликозиды (гентамицин);
• ранние фторхинолоны (ципрофлоксацин);
• тетрациклины (высокий уровень устойчивости);
• ко–тримоксазол (высокий уровень устойчивости, побочные эффекты);
• ампициллин внутрь (низкая биодоступность);
• ампиокс;
• клиндамицин.
Тем не менее, по данным Л.В. Юдиной [4], цефалоспорины I поколения при лечении ВП назначались 12,4% больным, фторхинолоны II поколения (главным образом ципрофлоксацин) – 17,4%, аминогликозиды – 7,4%, ко–тримоксазол – 6,6%, рифампицин и доксициклин – по 4,1%, линкомицин – 1,7%
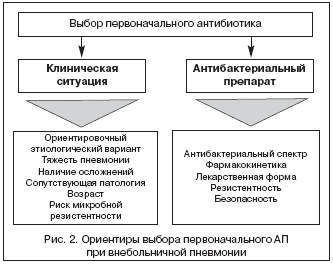
В подавляющем большинстве случаев врач принимает решение о выборе первоначального антибиотика, не имея данных о характере возбудителя пневмонии, а зачастую и перспектив получения таких данных. С учетом этого АТ носит не целенаправленный, а эмпирический характер, в чем должен отдавать себе отчет врач, курирующий больного ВП. В реальной клинической практике выбор первоначального АП для лечения больных ВП должен определяться, с одной стороны, клинической ситуацией, а с другой – свойствами самого АП (рис. 2).
При амбулаторном ведении больных ВП, согласно рекомендациям Российского респираторного общества, следует выделять две группы пациентов:
1–я группа – больные в возрасте до 60 лет без сопутствующей патологии;
2–я группа – больные старше 60 лет с наличием различной сопутствующей патологии (ХОБЛ, сахарный диабет, хроническая алкогольная интоксикация и др.), которая с одной стороны может определять этиологический вариант (риск наличия грамотрицательной флоры) ВП, а с другой – прогноз заболевания. У больных этой группы выше риск антибиотикорезистентности микроорганизмов (пенициллинорезистентность S. pneumoniae, выработка b–лактамаз грамнегативными микроорганизмами).
Больным 1–й группы рекомендовано назначение внутрь амоксициллина или макролидов с оптимальной фармакокинетикой (азитромицин, кларитромицин). Макролиды предпочтительнее при непереносимости β–лактамных антибиотиков или при подозрении на ВП, вызванную атипичными микроорганизмами (микоплазма, хламидия). В качестве альтернативных АП у этой группы больных возможно назначение внутрь респираторных фторхинолонов (Таваник, моксифлоксацин, гемифлоксацин). Несмотря на неактивность аминопенициллинов в отношении атипичных возбудителей, клинические исследования не выявили различия в эффективности между аминопенициллинами, различными макролидами и респираторными фторхинолонами [5].
Больным 2–й группы также рекомендуется АТ внутрь с использованием защищенных пенициллинов (амоксициллин/клавуланат, амоксициллин/сульбактам), комбинация защищенных пенициллинов с макролидами или респираторные фторхинолоны в режиме монотерапии. Преимущество парентерального введения АП в амбулаторном лечении ВП не доказано.
Госпитализированным больным с более тяжелым течением заболевания следует назначать АП парентерально. Общепринято применение β–лактамов (амоксициллин, защищенные пенициллины, цефалоспорины II–III поколений) в сочетании с макролидами (азитромицин, кларитромицин). Летальность при внебольничных пневмониях, особенно среди больных пожилого возраста, ниже при назначении комбинированной терапии цефалоспоринами II–III поколения в сочетании с макролидами по сравнению с монотерапией цефалоспоринами III поколения. Доказано, что комбинированная АТ β–лактамами и макролидами улучшает прогноз больных ВП, сокращает сроки пребывания в стационаре, что делает оправданной подобную комбинацию [6]. Альтернативными АП могут быть респираторные фторхинолоны (левофлоксацин – Таваник, моксифлоксацин). Имеются данные о том, что Таваник в режиме монотерапии оказывает клинический и бактериологический эффект, сравнимый с комбинацией β–лактамов и макролидов [7–9].
В одном из последних метаанализов сравнивалась эффективность комбинированной АТ β–лактамами и макролидами с респираторными фторхинолонами (Таваник) в режиме монотерапии [10]. Анализу были подвергнуты результаты 23 рандомизированных контролируемых исследований, включивших 7885 больных. По результатам проведенного метаанализа было установлена более высокая клиническая эффективность респираторных фторхинолонов по сравнению с комбинированной АТ больных тяжелой ВП. В то же время при лечении пациентов с нетяжелой пневмонией респираторные фторхинолоны не имели преимуществ перед комбинированной АТ. Если у госпитализированных больных (тяжелая ВП) при приеме респираторных фторхинолонов внутрь не отмечено различий между двумя исследуемыми группами, то при внутривенном введении респираторные фторхинолоны оказывали более выраженный клинический и бактериологический эффект по сравнению с комбинацией β–лактамов и макролидов. Кроме того, по результатам метаанализа, побочные эффекты, особенно со стороны желудочно–кишечного тракта, регистрировались достоверно реже. Следует отметить, что в большинстве исследований, включенных в метаанализ, левофлоксацин (Таваник) применялся в суточной дозе 500 мг.
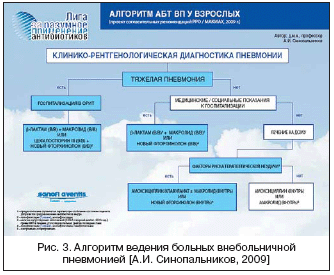
На рисунке 3 представлен алгоритм АТ больных ВП в соответствии с последними рекомендациями Российского респираторного общества и МАКМАХ.
Дозирование АП. Нередко встречаются ошибки в выборе дозы назначенного АП без учета тяжести пневмонии. В недостаточной суточной дозе АП назначался у 18,6% больных ВП [11].
Стандартные дозы β–лактамов и других АП у больных тяжелой ВП могут оказаться недостаточно эффективными. Наличие признаков сепсиса и септического шока при тяжелой ВП требует назначения более высоких доз β–лактамов (амоксициллин/клавуланат 1,2–2,4 г 2–3 раза/сут.; цефотаксим 2–3 г 2–3 раза/сут.) или Таваника (500 мг/сут.). При тяжелой ВП дозирование АП имеет свои особенности в отношении как суточных доз, так и кратности введения. Предпочтительным путем введения АП у данной категории пациентов является внутривенное введение.
Путь введения АП определяется многими факторами, в том числе тяжестью пневмонии, состоянием больного, фармакокинетической характеристикой АП и др. Если в целом ряде ситуаций при инфекциях нижних дыхательных путей парентеральный путь введения не имеет альтернативы (нарушение сознания, стволовые расстройства с нарушением глотания, патология кишечника и др.), то в остальных случаях парентеральная АТ требует определенных показаний и должна быть обоснованной, а не произвольной. При достижении клинического эффекта от парентеральной АТ рекомендуется переход на оральную форму того же или сходного по антимикробному спектру другого антибиотика (ступенчатая терапия). Критериями для перехода с парентерального на оральный путь введения антибиотиков следует считать нормальные показатели температуры на протяжении 2–кратного измерения за последние 16 ч, нормальное количество лейкоцитов или тенденция к нормализации, субъективное улучшение (уменьшение кашля, одышки), стабилизация показателей дыхания и гемодинамики, отсутствие признаков нарушения всасывания [12]. Оптимальными сроками перехода с парентеральной на оральную терапию являются 48–72 ч. Для обеспечения комплайентности следует отдавать предпочтение антибиотикам с высокой биодоступностью и удобным режимом дозирования (1–2 раза/сут.). Таким требованиям отвечают современные респираторные фторхинолоны (Таваник, моксифлоксацин).
В то же время ошибочным является назначение АП внутрь с целью «облегчить и упростить» лечение как для больного, так и для среднего медперсонала без учета конкретной клинической ситуации и фармакокинетики АП. У больных с тяжелой пневмонией это может стать одной из причин недостаточного эффекта или вообще неэффективности лечения. Не следует назначать АП внутрь при тяжелых пневмониях, особенно препараты с низкой биодоступностью (ампициллин, цефуроксим аксетил), что не позволяет достигать оптимальной концентрации АП в крови. В то же время у больных нетяжелой ВП при отсутствии осложнений и фоновой патологии допустима оральная АТ. В подобных ситуациях парентеральный путь введения АП оказывается не только необоснованным, но и более дорогостоящим.
Оценка эффективности первоначального АП. При амбулаторном ведении больного ВП обязательной является оценка эффективности и переносимости назначенного АП (правило второго визита) через 48–72 ч. АТ внебольничной пневмонии следует считать неэффективной, если отсутствуют признаки клинической стабилизации, которыми считаются:
– температура – < 37,8 °С
– ЧСС <100 уд./ мин.
– систолическое АД >90 мм рт. ст.
– ЧД < 24 /мин.
– Sa02 > 90%
При анализе ведения больных ВП приходится нередко сталкиваться с такими ошибками, когда больной продолжает получать назначенный АП в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Необоснованно длительная АТ при отсутствии эффекта и необходимость смены АП наблюдалась у 20,6% [11]. Ошибочность подобной практики имеет немало негативных последствий. Во–первых, затягивается назначение другого, более адекватного АП, что способствует прогрессированию легочного воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией), развитию осложнений, удлинению сроков лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов АТ, развития антибиотикорезистентности. Не следует игнорировать и значение негативного влияния неэффективности проводимой терапии на больного и его родственников, влекущего за собой утрату доверия к врачу и потерю комплайенса. Очевидна и неэкономичность такой ошибочной тактики АТ (напрасный расход неэффективного АП, задержка пребывания больного в стационаре, дополнительные затраты на лечение токсических эффектов и др.).
При отсутствии эффекта в указанные сроки следует пересмотреть тактику АТ (замена амоксициллина на Таваник или добавление последнего к β–лактамному АП) или решить вопрос о госпитализации пациента.
Коррекция АТ. Наряду с серией ошибок при оценке эффективности АП встречаются ошибки при коррекции АТ, т.е. смене одного АП на другой. При отсутствии данных микробиологического исследования принцип выбора АП остается тем же самым, т.е. ориентировка на клиническую ситуацию с учетом, однако, неэффективности первоначального АП и других дополнительных признаков. Отсутствие эффекта от первоначального АП в известной степени должно быть дополнительным ориентиром, позволяющим обосновать выбор второго АП. Так, отсутствие эффекта от β–лактамных АП (пенициллины, цефалоспорины) у больного ВП позволяет предполагать или делает более вероятным предположение о легионелезной или микоплазменной пневмонии (с учетом, разумеется, других признаков). В свою очередь, это делает обоснованным назначение АП из группы макролидов (азитромицин, кларитромицин и др.) или респираторных фторхинолонов (Таваник, моксифлоксацин).
Во избежание ошибок при коррекции АТ следует иметь в виду возможные причины неэффективности АП, к которым относятся:
– неправильный диагноз (туберкулез, опухоль, отек легких и др.);
– наличие осложнений (легочные, внелегочные);
– тяжелая сопутствующая и фоновая патология;
– неадекватный первоначальный АП;
– неадекватный режим дозирования АП;
– антибиотикорезистентность;
– поздно начатая АТ.
Длительность АТ. По различным данным, необоснованно длительная антибиотикотерапия проводится у 11,5% [11]. Согласно рекомендациям IDSA/ATS (2007), больной ВП должен лечиться как минимум в течение 5 дней (уровень доказательности I), лихорадка должна стойко отсутствовать в течение 48–72 ч, при этом не должно быть более 1 признака клинической нестабильности (уровень доказательности II). При высокой вероятности «атипичной» пневмонии рекомендуется более продолжительная АТ, до 14 дней, хотя имеются данные об эффективности и более коротких курсов в подобных клинико–эпидемиологических ситуациях. Наличие таких признаков, как астения, субфебрилитет, неполное рентгенологическое разрешение пневмонии, отсутствие полного рентгенологического разрешения пневмонии и нормализации показателей СОЭ не должны являться показанием для продолжения АТ и тем более для назначения другого АП.
Полипрагмазия. Среди большинства врачей укоренилось ошибочное мнение о необходимости назначения больным ВП наряду с АП различных лекарственных средств (антигистаминные, иммуномодуляторы, витамины, НПВП, противогрибковые препараты и др.). Подобная полипрагмазия не имеет достаточной доказательной основы, а только лишь удорожает лечение и повышает риск побочных эффектов лекарственного лечения.
Так, например, одной из распространенных ошибок при проведении АТ пневмонии является назначение одновременно с АП противогрибковых средств с целью как профилактики грибковых осложнений, так и «лечения» кандидоза в случаях обнаружения в полости рта грибков из рода Сandida. Обычно назначается нистатин внутрь, что трудно объяснимо с позиций его фармакокинетики: этот АП обладает весьма низкой биодоступностью и практически не всасывается из ЖКТ. Действие нистатина в основном местное. Кроме того, врач при назначении нистатина ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза и факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.). В свое время Б.Е. Вотчал писал: «…кандидамикоз – это не грибки, а болезнь, т.е. должны быть не только грибки в мазке, но и симптомы кандидамикоза».
Учет различных клинических ситуаций. В повседневной клинической практике при назначении любого медикаментозного средства, в том числе и АП, приходиться учитывать многочисленные факторы конкретной клинической ситуации (возраст, сопутствующая патология, прием других медикаментов и т.д.), определяющей тактику АТ и ее особенности. Недоучет всех факторов и неадекватная оценка особенностей данной ситуации влечет за собой ошибки в АТ, наиболее часто встречающиеся при следующих ситуациях:
• возраст больных (дети, старики);
• беременность;
• тяжелая сопутствующая патология с функциональными нарушениями различных органов и систем;
• медикаментозная терапия сопутствующих заболеваний;
• аллергические реакции на различные АП.
Ошибочно назначение беременным фторхинолонов, клиндамицина, метронидазола для лечения пневмонии. Кроме того, с осторожностью должны назначаться аминогликозиды, ванкомицин, имипенем.
Наличие сопутствующей патологии в ряде случаев создает сложности в проведении АТ, что может приводить и к ошибкам в выборе АП, его дозировки, путях введения, длительности АТ и т.д. При этом в основе ошибок может лежать либо невыявление сопутствующей патологии, либо ее недооценка в отношении токсического влияния АП, либо, наконец, недостаточное знание фармакокинетических особенностей выбранного АП. При наличии у больного почечной недостаточности следует отдавать предпочтение выбору АП с преимущественно внепочечным выведением (цефоперазон) или с двойным путем элиминации (ципрофлоксацин). Ошибочно назначение потенциально нефротоксичных АП (аминогликозиты, карбапенемы) без корректировки дозы у больных с сопутствующей почечной недостаточностью. Опасно также в подобных ситуациях сочетание АП, обладающих нефротоксическими свойствами (аминогликозиды и цефалоспорины, за исключением цефоперазона).
Особенно следует учитывать наличие сопутствующей, нередко множественной патологии с функциональными нарушениями органов и систем у больных пожилого и старческого возраста. Возрастное снижение показателей клубочковой фильтрации наряду с высокой частотой нефроангиосклероза у пожилых должны быть одним из факторов, влияющих на выбор АП, что, к сожалению, не всегда учитывается в клинической практике.
При наличии достоверно установленной гиперчувствительности к пенициллину ошибочно назначение других b–лактамных АП (цефалоспорины, карбаменемы). Альтернативными АП могут быть фторхинолоны, макролиды. Однако следует иметь в виду, что нередко за «аллергию на антибиотики» принимаются реакции другого происхождения (сосудистые, вегетативные и др.), в связи с чем следует критически оценивать указания больных на такую «непереносимость» и более тщательно анализировать имеющуюся ситуацию. Вместе с тем опасны внутрикожные пробы на АП, поскольку существует такая же опасность тяжелых анафилактических реакций.
По данным исследования С.А. Рачиной и соавт. [1] об индикаторах качества ведения больных ВП, основные ошибки ведения госпитализированных больных ВП сводятся к следующим:
• рентгенологическое исследование позже 24 ч с момента поступления;
• отсутствие бактериологического исследования мокроты и крови (при тяжелых ВП) до назначения АП;
• задержка начала АТ более 8 ч с момента верификации диагноза;
• несоответствие режима АТ национальным рекомендациям;
• недостаточное использование режима ступенчатой терапии;
• отсутствие профилактики у пациентов из группы риска.
Современная ситуация, свидетельствующая об ошибках диагностики и ведения больных ВП, обусловлена многими причинами, и прежде всего недостаточным следованием клиническим рекомендациям (КР). Основными барьерами на пути внедрения КР по ведению больных ВП в практику врача–терапевта являются следующие [13]:
• недостаточная осведомленность врачей о существовании КР;
• недостаточное знакомство и знания КР;
• консервативность клинического менталитета врача;
• отсутствие у врачей мотивации;
• невозможность контроля преимущества следования КР в лечении больных ВП;
• неуверенность в улучшении исходов ВП в случаях следования КР.
В то же время следование КР способствуют повышению эффективности лечения и благоприятному исходу заболевания, а также уменьшают риск принятия ошибочных решений при ведении больных ВП. Имеются доказательные данные о том, что, если врач следует клиническим рекомендациям, доля неэффективной терапии уменьшается на 35–40%, а вероятность летального исхода – на 45% [14]. Таким образом, основными реальными путями, которые позволят избежать или по крайней мере минимизировать ошибки ведения больных ВП является строгое следование КР. С учетом этого первоочередной задачей органов здравоохранения и постдипломного обучения следует считать внедрение КР в практику врачей первичного звена здравоохранения, и прежде всего врачей–терапевтов [15].
Внебольничная пневмония (ВП) занимает первое место в структуре заболеваемости и смертности от инфекционных болезней [1–3]. Количество случаев ВП в Российской Федерации составляет 1,5 млн в год [2]. Число пациентов с ВП увеличивается в периоды подъема заболеваемости ОРВИ. Наиболее распространенной причиной ВП у взрослых является инфекция Streptococcus pneumoniae [4].
Высокие уровни заболеваемости и смертности населения России от пневмонии указывают на необходимость адекватных мер на федеральном и региональном уровнях: повышения качества первичной медицинской помощи, улучшения профилактики, увеличения объема вакцинации против респираторных инфекций в группах риска [5]. Больные тяжелой пневмонией нуждаются в лечении в условиях стационара, поэтому от первоначальной оценки тяжести ВП врачом первичного звена зависит решение о тактике ведения пациента и режиме антимикробной терапии. Вместе с тем промедление с направлением пациента с тяжелой ВП в стационар ухудшает течение и прогноз заболевания [6]. Для повышения эффективности диагностики и лечения ВП в некоторых странах, в том числе в Российской Федерации, разработаны национальные клинические рекомендации, неукоснительное соблюдение которых позволяет снизить социальноэкономические потери от пневмонии [7, 8].
Цель исследования: анализ ошибок при диагностике и лечении ВП врачами первичного звена в районах Краснодарского края.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный анализ 1500 медицинских карт амбулаторных и стационарных пациентов из 45 муниципальных территорий Краснодарского края и г. Краснодара с оценкой выполнения национальных клинических рекомендаций по диагностике и лечению ВП врачами первичного звена. Работа выполнена в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской декларации. Протокол исследования одобрен локальным Этическим комитетом.
Статистическую обработку данных проводили с помощью программы Statistica 7.0.
РЕЗУЛЬТАТЫ
Анализ 1500 медицинских карт больных ВП, в том числе 974 (64,9%) амбулаторных и 526 (35,1%) стационарных пациентов, обнаружил несколько системных ошибок при оказании лечебнодиагностической помощи врачами первичного звена. Национальные стандарты ведения пациентов с тяжелой ВП не соблюдали в 71,3% случаев.
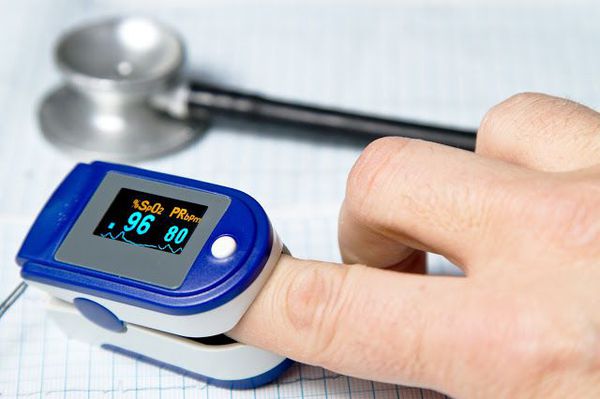
При диагностике и лечении больных тяжелой ВП на амбулаторном этапе также отмечены некоторые недостатки. В 42,2% случаев врачитерапевты поликлинического звена недооценивали тяжесть пневмонии, поскольку не использовали клиниколабораторные критерии ее классификации по тяжести, разработанные экспертами Российского респираторного общества и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии [1, 2], и прогностическую шкалу CURB65 [7, 8]. Пульсоксиметрия для оценки тяжести дыхательной недостаточности не была выполнена у 45,1% больных тяжелой ВП.
Рентгенография органов грудной клетки с целью верификации диагноза пневмонии проведена только у 60,7% (n = 591) всех больных пневмонией, обратившихся в поликлинику. В этих случаях диагноз ВП устанавливал врач на основании жалоб и данных физикального обследования пациента. Кроме того, врачи первичного звена в амбулаторных условиях несвоевременно выполняли рентгенографию органов грудной клетки в двух проекциях.
При первичном обращении больного направляли на флюорографию для уточнения присутствия инфильтрата в легком, и только через 6 ± 4 дня после начала болезни ему выполняли рентгенографию органов грудной клетки в одной проекции. Эти действия не согласуются с современными стандартами диагностики ВП, где единственным методом первичной лучевой диагностики пневмонии служит рентгенография органов грудной клетки в двух проекциях. Данная ошибка привела к увеличению времени верификации диагноза пневмонии, усугублению тяжести состояния пациента, позднему началу антимикробной терапии.
Частота таких неправильных действий на амбулаторном этапе составила 12,4% (n = 121). Неверная интерпретация результатов рентгенографии врачомрентгенологом поликлиники и дальнейшая ошибочная маршрутизация пациентов с ВП зарегистрированы у 18 (1,8%) человек. В большинстве случаев (60,5%) врачи не использовали пульсоксиметры для выявления дыхательной недостаточности при осмотре пациентов с ВП на дому.
Не всем больным ВП антимикробную терапию проводили в соответствии с национальными клиническими рекомендациями. В рамках амбулаторного лечения 521 (53,5%) пациенту был назначен цефтриаксон в/м в дозе 1 г 2 раза в день. Однако данная схема лечения нерациональна и приводит к увеличению числа осложнений в амбулаторных условиях. В настоящее время, согласно национальным рекомендациям по диагностике и лечению ВП, всем больным, оставленным на амбулаторное лечение, показана терапия антимикробными препаратами для приема внутрь. Кроме того, признано ошибочным назначение таких антибиотиков, как гентамицин (5,9%), цефазолин (7,8%), ципрофлоксацин (7,1%), неэффективных в отношении основных возбудителей ВП. Безосновательное использование таких устаревших лекарственных препаратов, как аскорбиновая кислота, глюконат кальция, кокарбоксилаза и т. д., зарегистрировано в 482 (49,5%) проанализированных случаях.
Вместе с тем отмечена и недостаточная осведомленность пациентов о последствиях самолечения ВП. Так, большинство больных (n = 695; 71,4%) поздно (позднее 24 ч) обращались за помощью к амбулаторному врачу.
Основной ошибкой оказания медицинской помощи в стационаре было невыполнение пульсоксиметрии с целью определения тяжести дыхательной недостаточности у пациентов с тяжелой пневмонией (n = 452; 85,9%) на этапе приемного отделения. Недооценена тяжесть состояния 78,5% больных, так как врачи стационара не использовали прогностические шкалы. Эти недостатки привели к несвоевременному переводу пациентов с жизнеугрожающей дыхательной недостаточностью в отделение реанимации и интенсивной терапии (ОРИТ) (n = 421; 80,0%). Вместе с тем хорошо известно, что адекватную интенсивную терапию пациенты с ВП и жизнеугрожающей дыхательной недостаточностью могут получить только в условиях ОРИТ.
Наряду с недооценкой тяжести состояния обнаружены ошибки и в назначении медикаментозной терапии. Так, устаревшие схемы антимикробной терапии, не соответствующие современным клиническим рекомендациям, использованы у 16,1% пациентов с тяжелой ВП. Нерациональные режимы дозирования антибиотиков (например, цефтриаксон по 1 г/сут, левофлоксацин по 500 мг/сут) зафиксированы в 101 (19,2%) случае. К сожалению, врачи попрежнему назначают антимикробные препараты, неэффективные в отношении основных возбудителей ВП, в том числе ципрофлоксацин (n = 14; 2,6%), гентамицин (n = 9; 1,7%), цефазолин (n = 15; 2,9%).
В качестве иллюстрации нерациональной тактики ведения пациентов с ВП приводим два клинических примера.
Больная Г., 44 лет, доставлена 02.07.2017 г. по линии санитарной авиации в пульмонологическое отделение ГБУЗ «НИИККБ № 1 им. проф. С. В. Очаповского» с диагнозом «двусторонняя пневмония, острая дыхательная недостаточность III степени, ИВЛ»; по тяжести состояния госпитализирована в анестезиологореанимационное отделение № 8.
При анализе медицинской документации выявлены следующие недостатки ведения больной по месту жительства. При поступлении пациентки в стационар 24.06.2017 г. сильно недооценена степень тяжести заболевания: при признаках дыхательной недостаточности (SpO2 на воздухе — 88%) и артериальной гипотензии до шоковых значений (АД 90/60 мм рт. ст.) пациентка не переведена в ОРИТ, что ухудшило прогноз заболевания.
Назначенная терапия при установленном диагнозе не соответствовала стандартам оказания медицинской помощи пациентам с пневмонией, принятым в национальных клинических рекомендациях. Стартовое антимикробное лечение состояло в монотерапии цефтриаксоном, что следует считать грубой ошибкой, так как стартовая терапия при диагнозе «двусторонняя пневмония, тяжелое течение», требующем госпитализации в ОРИТ, должна включать парентеральное введение двух антимикробных препаратов. С целью коррекции АД проводили парентеральную инфузию преднизолона, что также является грубой ошибкой, так как преднизолон не входит в схему лечения артериальной гипотензии, обусловленной тяжелой инфекционной патологией.
Через 48 ч от момента поступления в стационар по месту жительства 29.06.2017 г. ввиду нарастания явлений дыхательной недостаточности пациентке однократно в/в введен метронидазол, а затем офлоксацин, что тоже надо признать серьезной ошибкой, так как ни метронидазол, ни офлоксацин не рекомендованы для лечения ВП. В связи с прогрессированием дыхательной недостаточности 30.06.2017 г. пациентка была переведена в ОРИТ центральной районной больницы (ЦРБ).
В условиях ОРИТ антибиотик поменяли на меропенем по 2 г/сут, что меньше терапевтической дозы данного препарата, в комбинации с ципрофлоксацином по 200 мг/сут в/в (также меньше терапевтической дозы), кроме того, ципрофлоксацин не рекомендован для лечения ВП ввиду низкой чувствительности ее возбудителей к этому противомикробному средству.
Изложенные ошибки в лечении привели к прогрессированию дыхательной недостаточности, что потребовало экстренного перевода пациентки в ГБУЗ «НИИККБ № 1 им. проф. С. В. Очаповского».
Больной И., 82 лет, поступил в терапевтическое отделение ЦРБ 27.03.2014 г. в тяжелом состоянии с явлениями энцефалопатии и психомоторного возбуждения. Госпитализирован в неврологическое отделение. По результатам рентгенографии органов грудной клетки заподозрена пневмония. Лейкоцитоз — 23 × 109/л. Пульсоксиметрию на протяжении всей госпитализации ни разу не проводили. Начата неадекватная стартовая терапия цефтриаксоном по 2 г/сут в режиме монотерапии. Необоснованно назначены аскорбиновая кислота, метамизол натрия, дифенгидрамин, папаверин. Психомоторное возбуждение лечащий врач расценил как проявление хронической ишемии мозга.
На 2й день для исключения ОНМК выполнили КТ головного мозга, а КТ органов грудной клетки не сделали. Несмотря на психомоторное возбуждение, пациента для динамического наблюдения не перевели в ОРИТ, не контролировали диурез и витальные функции. Больного на протяжении 3 дней пребывания в стационаре четырежды консультировал невролог, однократно психиатр.
Состояние пациента ввиду неадекватной антимикробной терапии прогрессивно ухудшалось вследствие нарастания интоксикации и дыхательной недостаточности. На 3й день пребывания в отделении во время планового обхода терапевт в истории болезни зафиксировал показатели АД 60/0 мм рт. ст.Несмотря на инфекционнотоксический шок, пациента в ОРИТ не перевели, назначили преднизолон. Через 2 ч врач констатировал смерть больного.
При патологоанатомическом исследовании обнаружены тотальная левосторонняя пневмония, левосторонний гнойнофибринозный плеврит. Приведенный пример демонстрирует грубую недооценку тяжести состояния больного, отсутствие должного динамического наблюдения, неадекватную антимикробную терапию, полипрагмазию. Неврологические симптомы появились у пациента не вследствие хронической ишемии мозга, а от тяжелой интоксикации, развившейся на фоне тяжелой ВП.
ОБСУЖДЕНИЕ
Несмотря на существование национальных клинических рекомендаций, отмечены ошибки при диагностике и лечении ВП в виде недооценки тяжести состояния больных и назначения нерациональной антимикробной терапии. Аналогичные данные получены и в других исследованиях. Так, С. А. Рачиной и соавт. [9] выявлена низкая частота использования прогностических шкал при диагностике ВП в клинической практике, а также определенное недоверие к ним врачейтерапевтов. По мнению нескольких экспертов, основной системный недостаток при оказании помощи пациентам с ВП состоит в несоблюдении национальных клинических рекомендаций [1, 2]. Полученные нами данные согласуются и с результатами исследования Р. И. Хамитова, проведенного в Казани [10].
Согласно нашим результатам, ошибки при диагностике и лечении пациентов с ВП обусловлены как недостатками организации первичной медицинской помощи (отсутствием пульсоксиметров в амбулаторных и стационарных учреждениях), так и недостаточной квалификацией врачей первичного звена (недооценка тяжести состояния пациента, выполнение флюорографии органов грудной клетки или рентгенографии органов грудной клетки в одной проекции, невыполнение пульсоксиметрии, нерациональная антимикробная терапия).
ЗАКЛЮЧЕНИЕ
Неукоснительное выполнение национальных клинических рекомендаций по диагностике и стартовой эмпирической антимикробной терапии позволит значительно уменьшить число ошибок при диагностике и лечении пациентов с внебольничной пневмонией и улучшить прогноз заболевания.
Пневмонии относятся к числу самых распространенных болезней. Заболеваемость пневмониями среди взрослых в развитых странах составляет 3—16‰ в год (больше у пожилых пациентов и детей). При этом, по оценкам специалистов, примерно в 60% случаев заболевание остается нераспознанным. Госпитализации требуют от 20 до 50% пациентов. Около 1% больных любого профиля, поступающих в стационары, заболевают внутригоспитальными пневмониями. Смертность от пневмоний в Европе колеблется от 7,1 (Венгрия) до 55,4 (Великобритания) на 100 тыс. населения (среди пожилых — в 10 — 15 раз выше).
Трудности, с которыми сталкиваются клиницисты при диагностике и лечении пневмоний, обусловлены многообразием возбудителей и клинических вариантов течения болезни, появлением множества новых лекарственных средств, необходимостью начинать терапию с эмпирического подхода (до выявления возбудителя), сложностью дифференциальной диагностики и сравнительно быстрым изменением клинической картины заболевания за последние годы.
Определение
Пневмонии – группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации.
В Международной классификации болезней, травм и причин смерти 10-го пересмотра (МКБ-10, 1992 г.) пневмонии четко отграничены от очаговых неинфекционных воспалительных заболеваний легких. Так, заболевания, вызываемые физическими и химическими факторами (лучевой пневмонит, бензиновая пневмония), поражения легких аллергического характера (эозинофильная пневмония), сосудистого происхождения (инфаркт-пневмония на фоне тромбоэмболии ветвей легочной артерии) кодируются, согласно МКБ-10, в соответствующих разделах. Из рубрики «Пневмонии» исключены также воспалительные процессы в легких, вызываемые облигатными инфекционными агентами (Ку-лихорадка, корь, краснуха, грипп и др.). Эти заболевания рассматриваются в качестве осложненного течения соответствующих нозологических форм.
Классификация
Традиционно классификации отечественных ученых (Н.С. Молчанов, 1964; Е.В. Гембицкий, О.В. Коровина, 1968; В.П. Сильвестров, 1982) подразделяли пневмонии по этиологии, морфологии, течению, осложнениям. В обобщенном виде эти классификации выглядят следующим образом:
· По этиологии: бактериальные; вирусные; микоплазменные; прочие.
· По клинико-морфологическим признакам: паренхиматозные: крупозные и очаговые; интерстициальные; смешанные.
· По течению: остротекущие; затяжные.
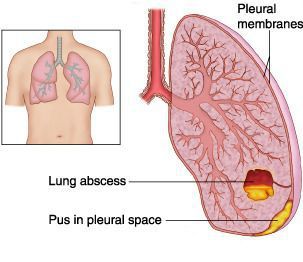
· По наличию осложнений: неосложненные; осложненные: легочные осложнения (абсцедирование, деструкция легочной ткани, плеврит, эмпиема плевры и др.), внелегочные осложнения (инфекционно-токсический шок, коллапс, нефропатия, гломерулонефрит, миокардит и др.).
В настоящее время рекомендуется к использованию классификация легочных воспалений, учитывающая условия, в которых развилось заболевание, некоторые особенности инфицирования легочной ткани, а также состояние иммунологической реактивности больного (клинико-эпидемиологический принцип). В соответствии с этой классификацией выделяют следующие виды пневмоний:
· Внегоспитальная пневмония (ВП). Синонимы: домашняя, амбулаторная, внебольничная.
· Госпитальная пневмония (ГП). Синонимы: нозокомиальная, внутрибольничная, внутригоспитальная. Диагностируется в том случае, если клинические и рентгенологические признаки легочного воспаления появляются спустя 48 часов пребывания больного в стационаре.
· Аспирационная пневмония.
· Пневмония у лиц с тяжелыми дефектами иммунитета (врожденный иммунодефицит, ВИЧ-инфекция, ятрогенная иммуносупрессия).
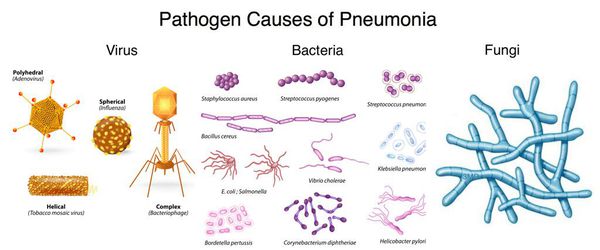
Этиология
Основными возбудителями ВП являются Str. pneumoniae (30—50 %), Mycoplasma pneumoniae (2—30 %), Chlamydophila pneumoniae (2—20 %), Haemophilus influenzae (2—18 %). Более скромную роль в этиологии ВП играют Mоraxella catarrhalis (1—10 %), Staph. aureus (2—10 %), Legionella pneumophila (2—10 %), грамотрицательные микроорганизмы (Klebsiella pneumoniae, E. coli, Pseudomonas aeruginosa — до 5 %), анаэробы.
Роль вирусов может рассматриваться как фактор, способствующий бактериальной суперинфекции, однако не исключается возможность «чистых» вирусных пневмоний.
Доминирующими возбудителями нозокомиальных пневмоний являются грамотрицательные микроорганизмы (Ps. aeruginosa, E. coli, K. pneumoniae, Proteus mirabilis, Acinetobacter spp.), а также Staph. aureus и анаэробы. Особенность возбудителей — высокая устойчивость ко многим антибактериальным препаратам.
Аспирационные пневмонии почти всегда вызваны анаэробной и/или грамотрицательной микрофлорой. В этиологии пневмоний у лиц с иммунодефицитами помимо стандартной внутригоспитальной флоры (грамотрицательных бактерий и стафилококков) велика роль сравнительно малопатогенных микроорганизмов — стрептококков группы Viridans, грибов (Candida spp., Aspergillus spp.) и др.
Принято выделять ряд клинических ситуаций, в которых пневмония чаще вызывается определенными агентами. У лиц молодого возраста, не отягощенных сопутствующими заболеваниями, пневмонии часто обусловлены пневмококками, микоплазмой, хламидией. У людей старше 60 лет при пневмониях из мокроты обычно выделяются пневмококки и гемофильные палочки. При предшествующих легочно-сердечных заболеваниях, особенно у страдающих хронической обструктивной болезнью легких, вероятными патогенами являются пневмококки, гемофильные палочки, моракселла. Развитие пневмонии в условиях семейной вспышки ОРВИ настораживает в отношении не только вирусной природы заболевания, но и таких агентов, как микоплазма и хламидия. При контактах с птицами высока вероятность хламидийной инфекции. Наличие верхнедолевой пневмонии требует уточнения возможных контактов с больными туберкулезом и исключения этой специфической инфекции. При аспирационном синдроме причиной пневмонии нередко являются анаэробы. У алкоголиков часто развиваются пневмонии, вызванные клебсиеллой и другими грамотрицательными палочками. У наркоманов отмечаются случаи туберкулеза легких, стафилококковых и анаэробных пневмоний. Для ВИЧ-инфицированных характерны пневмоцистные пневмонии и микобактериозы. У длительно обездвиженных пациентов (инсульты, переломы шейки бедра) пневмонии часто обусловлены стрептококками, стафилококками, грамотрицательными палочками.
Для некоторых возбудителей пневмонии выявлены сезонные колебания заболеваемости. Так, большинство случаев пневмонии, вызванной легионеллой, приходится на летние и осенние месяцы, а инфекция, обусловленная M. pneumoniae, подвержена цикличности с периодом от 3 до 5 лет.
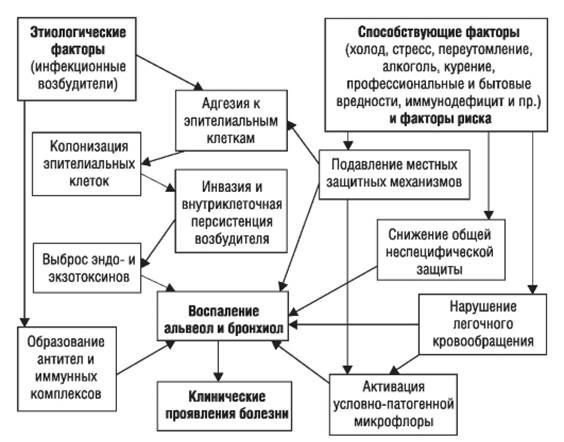
Патогенез
Выделяют четыре основных патогенетических механизма развития пневмонии:
— аспирация секрета ротоглотки;
— вдыхание аэрозоля, содержащего микроорганизмы;
— гематогенное распространение микроорганизмов из внелегочного очага инфекции (например, при инфекционном эндокардите, септическом тромбофлебите);
— непосредственное распространение инфекции из соседних пораженных органов (например, при абсцессе печени) или в результате инфицирования при проникающих ранениях грудной клетки.
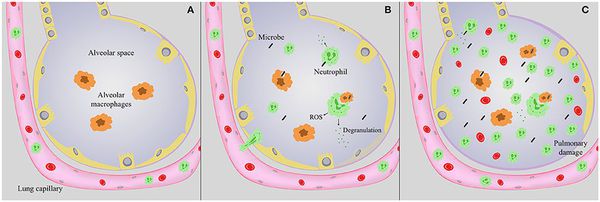
Основным путем инфицирования и важнейшим патогенетическим механизмом развития пневмонии, как было установлено исследованиями последних лет, является аспирация содержимого ротоглотки. Не менее распространенным механизмом развития пневмонии признается активация собственной микрофлоры нижних дыхательных путей больного, которая может отмечаться у ослабленных лиц, на фоне снижения иммунитета, под воздействием факторов, повреждающих эпителий дыхательных путей, а также при дисбактериозе (в том числе ятрогенном).
Факторы риска развития пневмонии
К наиболее важным факторам риска развития ВП относятся курение, нарушения иммунитета (терапия ГКС и др.), наличие в анамнезе пневмонии и некоторых профессиональных факторов. Пациенты, получающие внутривенные инъекции, инъекционные наркоманы особенно подвержены риску развития пневмонии. Каждому фактору риска соответствуют определенные потенциально значимые возбудители.
Факторами риска нозокомиальной пневмонии являются возраст более 60 лет; тяжесть состояния при оценке по шкале APACHE II > 16; черепно-мозговая травма; кома; бронхоскопия; назогастральный зонд; эндотрахеальная интубация; хирургическая операция на органах верхнего отдела брюшной полости или на грудной клетке; гипоальбуминемия; нервно-мышечные расстройства; наличие хронических обструктивных заболеваний легких (ХОЗЛ) и дыхательной недостаточности; назначение препаратов внутривенно; наличие у больного монитора внутричерепного давления; полиорганная недостаточность; аспирация содержимого желудка в больших объемах; предшествующий прием антибиотиков; назначение Н2-гистаминоблокаторов; pH желудка > 4,0; развитие заболевания в осенне-зимний период. Для больных на ИВЛ к дополнительным факторам риска относятся проведение реинтубации; ИВЛ продолжительностью более 2 сут; трахеостомия; низкое давление в манжете интубационной трубки; пассивное положение головы; неудачи при аспирации из подсвязочного пространства.
Клиническая картина
Для пневмонии характерны сравнительно острое начало заболевания, лихорадка, интоксикация, кашель с гнойной или слизисто-гнойной мокротой (коричнево-красной, «ржавой» окраски, что чаще отмечается при крупозном воспалении). Возможно появление в грудной клетке болей, связанных с кашлем и актом дыхания.
У пожилых, а также у больных с острым нарушением мозгового кровообращения может наблюдаться только нарушение сознания или ухудшение общего самочувствия.
Данные осмотра, пальпации, перкуссии и аускультации при пневмонии зависят от величины пораженного участка легких, его локализации и фазы воспалительного процесса. Медицинские работники обязаны знать не только симптомы развернутой клинической картины, но и ранние признаки болезни. Циклическое течение более характерно для крупозной пневмонии. В первые дни заболевания перкуторный звук над пораженной долей имеет тимпанический оттенок, дыхание ослаблено. В дальнейшем перкуторный тон быстро притупляется, и появляется характерное для крупозного воспаления бронхиальное дыхание. В этот же период может выслушиваться крепитация (crepitatio index). Голосовое дрожание усилено. Феномен бронхофонии положительный. В фазе разрешения интенсивная тупость постепенно сменяется легочным звуком, дыхание при аускультации меняет свой характер с бронхиального на жесткий. Появляется конечная крепитация (crepitatio redux), переходящая впоследствии в звучные влажные мелко- и среднепузырчатые хрипы. На губах и крыльях носа отмечаются герпетические высыпания, характерно отставание при дыхании одной стороны грудной клетки.
Очаговая пневмония отличается менее выраженной интоксикацией. Физикальная симптоматика нередко бывает скудной. Притупление легочного звука и усиление голосового дрожания определяются далеко не во всех случаях. При аускультации помимо влажных можно выслушать рассеянные сухие (жужжащие и свистящие) хрипы.
Скудная симптоматика характерна для госпитальных, послеоперационных и травматических пневмоний, для легочного воспаления у лиц с поражением ЦНС. Основными клиническими проявлениями послеоперационной пневмонии нередко выступают необъяснимая местным процессом в послеоперационной ране лихорадка, общая интоксикация, одышка, тахикардия. Диагностика нозокомиальных пневмоний затруднена в связи с невозможностью адекватного физикального обследования пациента из-за его малой подвижности, нарушения сознания или невозможности глубокого дыхания.
Принято различать пневмонии типичные и атипичные, требующие иной антибактериальной терапии. Классические типичные пневмонии протекают в виде острого очагового заболевания, характеризующегося внезапным началом, высокой температурой, ознобами, продуктивным кашлем, болями в грудной клетке, аускультативными признаками очагового поражения легочной ткани, нейтрофильным лейкоцитозом, наличием рентгенологического очага и затемнения и положительным цитобактериологическим анализом мокроты. Наиболее частыми возбудителями являются внеклеточные микроорганизмы — Str. pneumoniae или (реже) H. influenzae, Staph. aureus, анаэробы. Атипичные пневмонии характеризуют нарастающее начало, лихорадка, не сопровождающаяся ознобами, непродуктивный кашель, головные боли, миалгии, диффузные крепитирующие хрипы, незначительный лейкоцитоз, наличие интерстициальных инфильтратов, отрицательный бактериологический анализ мокроты; нередко отмечается инфекция верхних дыхательных путей. Этиологическими агентами атипичных пневмоний являются внутриклеточные возбудители (M. pneumoniae, C. pneumoniae и др.) или вирусы.
Впрочем, пневмонии, вызываемые вирусами или внутриклеточными возбудителями, по клинической картине могут напоминать типичные пневмонии, и наоборот, заболевания, связанные с внеклеточными агентами, могут имитировать атипичные пневмонии. Таким образом, основываясь только на клинической картине, нельзя достоверно выявить тип возбудителя, а разделение пневмоний на типичную и атипичную лишено особого клинического смысла. Тем более что определенную путаницу в терминологию внесла зафиксированная в 2003 г. вспышка тяжелого острого респираторного дистресс-синдрома (ТОРС, SARS), получившего в средствах массовой информации и ряде медицинских изданий название «атипичной пневмонии».
Методы диагностики
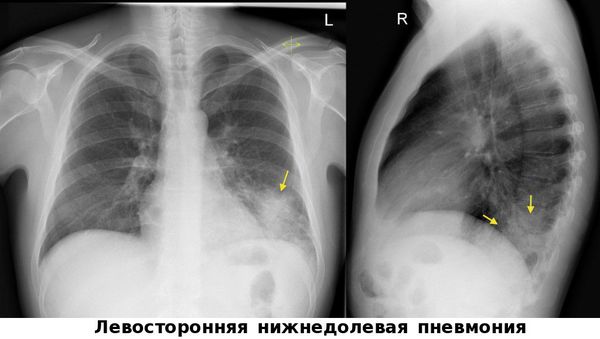
Всем больным, имеющим клинические и физикальные симптомы пневмонии, показано проведение рентгенографии легких в прямой и боковой проекциях. Рентгенологически определяемая инфильтрация легочной ткани является основным диагностическим критерием пневмонии.
Рентгенография позволяет оценить тяжесть пневмонии (по объему поражения легочной ткани, наличию осложнений), ориентировочно предположить этиологию заболевания, провести дифференциальную диагностику, определить прогноз и эффективность лечения. Рентгенологическое исследование легких показано также при длительно сохраняющейся лихорадке (более 5 дней) у больных с острой респираторно-вирусной инфекцией.
Вместе с тем нельзя считать диагноз пневмонии неправомочным в случае отсутствия по тем или иным причинам его рентгенологического подтверждения, т.е. диагноз пневмонии может быть установлен только на основании клинической картины заболевания и данных физикального обследования.
Несмотря на высокую диагностическую ценность метода, следует помнить о существовании рентгеннегативных пневмоний. Последние могут иметь место в случаях, если рентгенография выполнена в первые часы после начала заболевания, когда клинические признаки пневмонии уже определяются, а рентгенологически значимая инфильтрация в легких еще не сформировалась. В связи с этим и во избежание дополнительной лучевой нагрузки на больного нецелесообразно проведение рентгенографии легких в первые 12 — 24 ч заболевания. Рентгенологические изменения могут не определяться или быть невыраженными при вирусных интерстициальных пневмониях. В таких случаях для уточнения диагноза полезной может оказаться компьютерная томография. По сравнению с рентгенографией она обладает в 2 раза более высокой чувствительностью при диагностике пневмоний и незаменима при проведении дифференциальной диагностики с опухолями и рядом других заболеваний.
Каждая пневмония требует установления этиологического диагноза. Некоторую, хотя и ограниченную, ценность в решении этой задачи имеют клинические и эпидемиологические данные. Ведущая же роль принадлежит микробиологическим методам. Биологическим материалом для исследования могут служить мокрота, кровь, плевральная жидкость, бронхоальвеолярная лаважная жидкость, пунктат инфильтрата или абсцесса легких, ткань (биоптат) легкого. Наиболее доступным материалом является мокрота, но в связи с тем, что она легко подвергается контаминации микрофлорой верхних дыхательных путей, трактовка результатов микробиологического исследования не всегда однозначна. Необходимо соблюдать следующие правила забора мокроты: до начала антибактериальной терапии после полоскания зева и полости рта кипяченой водой или раствором питьевой соды свободно откашливаемую мокроту (лучше первую утреннюю порцию, до еды) собирают в стерильную посуду с плотно закрывающейся крышкой. Для улучшения отхождения мокроты пациенту натощак дают отхаркивающие средства, проводят ингаляцию ультразвуком солевого раствора. Сроки доставки мокроты в лабораторию не должны превышать 1,5 — 2 ч с момента ее получения (допускается хранение в холодильнике не более 6 ч).
Достаточно информативной и оправданной считается окраска мазка по Граму перед микробиологическим исследованием. Ее целесообразно осуществлять в условиях экспресс-лаборатории приемного отделения. Выявление в мазке значительного количества грамположительных или грамотрицательных бактерий может служить ориентиром для эмпирической терапии.
Следует отметить, что интерпретация результатов бактериоскопии и посева мокроты должна проводиться с учетом клинических данных. Разграничение «микроба-свидетеля» и «микроба-возбудителя» в некоторых случаях вызывает немалые затруднения.
Несмотря на важность получения лабораторного материала (мокрота, кровь) до назначения антибиотиков, микробиологическое исследование не должно служить причиной задержки начала антибактериальной терапии. Особенно это относится к больным с тяжелым течением заболевания.
Проведение инвазивных процедур для получения диагностического материала (игольная экспирация, бронхоальвеолярный лаваж – БАЛ, биопсия и т.п.) большинству больных с ВП не показано, но может быть оправдано в случаях тяжелого течения заболевания и неэффективности проводимой терапии.
Общеклинические и биохимические анализы крови не имеют решающего значения для верификации диагноза и установления этиологии пневмонии. Однако лейкоцитоз более (10 — 12)х109/л указывает на высокую вероятность бактериальной инфекции, а лейкопения ниже 3х109/л или лейкоцитоз выше 25х109/л являются неблагоприятными прогностическими признаками. Отклонения в функциональных тестах печени, почек, уровне гликемии могут указывать на поражение ряда органов/систем, что имеет определенное клиническое и прогностическое значение.
Исследование газового состава артериальной (не капиллярной!) крови показано больным с явлениями дыхательной недостаточности, обусловленной распространенной пневмонической инфильтрацией, массивным плевральным выпотом, развитием пневмонии на фоне хронической обструктивной болезни легких. Эти анализы помогают определить необходимость госпитализации больного и показания к назначению ингаляций кислорода.
Серологическая диагностика, разработанная для легионеллезной, микоплазменной, хламидийной и пневмококковой инфекций, носит ретроспективный характер и не рассматривается в ряду обязательных методов исследования.
Перспективным методом диагностики таких возбудителей, как С.pneumoniae и М. pneumoniae, является полимеразная цепная реакция (ПЦР). Однако место ПЦР еще не определено, поэтому метод не может быть рекомендован для внедрения в широкую клиническую практику.
Критерии диагноза
Диагностика пневмоний в большинстве случаев не вызывает затруднений, если соблюдать определенные правила. Существует понятие «золотого стандарта» при постановке диагноза пневмонии; он складывается из следующих пяти признаков (А.Г. Чучалин, 1997):
1) острое начало заболевания, сопровождающееся лихорадкой и повышением температуры;
2) появление кашля и отделение мокроты гнойного характера;
3) укорочение легочного звука, появление аускультативных феноменов пневмонии над пораженным участком легкого;
4) лейкоцитоз с нейтрофильным сдвигом или – реже – лейкопения;
5) выявляемый с помощью рентгенологического метода инфильтрат в легких, который ранее не определялся.
В последние годы многие зарубежные клинические рекомендации в зависимости от степени достоверности диагноза пневмонии предлагают использовать термины «определенный», «неопределенный», «маловероятный».
Диагноз пневмонии считается определеннымпри наличии у больного рентгенологически подтвержденной очаговой инфильтрации легочной ткани и по крайней мере двух клинических признаков из следующих: а) острая лихорадка в начале заболевания (t > 38,0 °С); б) кашель с мокротой; в) физикальные признаки (фокус крепитации и/или мелкопузырчатые хрипы, жесткое бронхиальное дыхание, укорочение перкуторного звука); г) лейкоцитоз (> 10х109/л) и/или палочкоядерный сдвиг (> 10%).
Отсутствие или недоступность рентгенологического подтверждения очаговой инфильтрации в легких делает диагноз пневмонии неточным/ неопределенным. В таком случаедиагноз заболевания основывается на учете данных эпидемиологического анамнеза, жалоб и соответствующих локальных симптомов.
Если при обследовании больного с лихорадкой, жалобами на кашель, одышку, отделение мокроты и/или боли в груди рентгенологическое исследование органов грудной клетки недоступно и отсутствует соответствующая локальная симптоматика (укорочение/тупость перкуторного звука над пораженным участком легкого, локально выслушиваемое бронхиальное дыхание, фокус звучных мелкопузырчатых хрипов или инспираторной крепитации, усиление бронхофонии и голосового дрожания), то предположение о пневмонии становится маловероятным.
Подобным же образом и этиологический диагноз пневмонии в последние годы принято подразделять на определенный, вероятный и возможный. Об определенном диагнозе свидетельствует выделение Staph. aureus, Str. pneumoniae, Н.influenzae, М. catarrhalis, энтеробактерий, Ps. aeruginosa из крови или плевральной жидкости, т.е. из тех сред, в которых контаминация микроорганизмами невозможна. Другими случаями, когда диагноз представляется определенным, являются четырехкратное нарастание титра антител к L. pneumophila (>1:128), М. pneumoniae (>1:64), С. pneumoniae; обнаружение значимого титра вируса гриппа (>1:32); выделение Legionella spp. из респираторных секретов и положительные результаты теста на наличие антигена L. pneumophila в моче (иммуноферментный метод). О вероятном диагнозе можно говорить при выделении Staph. aureus, Str. pneumoniae, Н. influenzae, M. catarrhalis, энтеробактерий или Ps.aeruginosa из гнойной мокроты, содержащей умеренное или значительное количество нейтрофилов при окраске по Граму. При этом бактериоскопически обнаруживаются умеренное или значительное количество возбудителей. Наконец, о возможном диагнозе принято говорить в том случае, когда из гнойной мокроты выделен потенциальный возбудитель пневмонии (но не Legionella spp.), а при бактериоскопии окрашенного по Граму мазка мокроты обнаружено умеренное количество морфологически сходных микроорганизмов. Однократное определение высокого титра антител к L. pneumophila (>1:1024), М. pneumoniae (>1:64) и С. pneumoniae (IgG>1:512 или IgM>1:16) также является критерием возможного диагноза.
Для нозокомиальных пневмоний разработаны критерии диагностики, представленные в табл. 1.
|
Достоверный диагноз |
· Рентгенологические признаки абсцесса · Получение культуры возбудителя при игольной биопсии легкого · Гистологическое подтверждение диагноза по материалам открытой биопсии ткани легкого (в том числе и при аутопсии) в сочетании с положительными результатами микробиологического исследования ткани легкого (>104 КОЕ в 1 г легочной ткани) |
|
Вероятный диагноз |
· Определение возбудителя в мокроте, БАЛ (полученных при минимальном риске контаминации дыхательных путей микроорганизмами извне, т.е., как правило, забор материала защищенными щетками) · Положительные результаты при исследовании гемокультуры в двух последовательных заборах, полученных с интервалом в 48 ч и после 48 ч с момента появления респираторной симптоматики · Выделение культуры возбудителя в плевральной жидкости · Наличие гистологической картины пневмонии в материалах открытой биопсии легкого или материалах аутопсии при сочетании с отрицательными результатами микробиологического исследования ткани легкого (<104 КОЕ в 1 г легочной ткани) |
|
Достоверное исключение диагноза |
· Материалы аутопсии, проводимой позже 3 сут с момента выставления предположительного диагноза пневмонии, не выявляют картины воспаления в легких · Выявление альтернативной этиологии в сочетании с отрицательными данными микробиологического исследования · Цитологическое выявление патологического процесса в ткани легкого, отличного от пневмонии, в сочетании с отрицательными данными микробиологического исследования |
|
Вероятное исключение диагноза |
· Выздоровление больного произошло в отсутствие антибиотикотерапии, при этом имеется альтернативная диагностическая концепция · Имеется альтернативный диагноз, объясняющий персистирование лихорадки и инфильтративных изменений в легких |
Таблица 1. Критерии диагноза нозокомиальной пневмонии
Дифференциальная диагностика
В плане дифференциальной диагностики следует учитывать, что под маской плохо поддающейся лечению пневмонии могут скрываться онкологические (бронхогенный или бронхоальвеолярный рак, лимфома), иммунологические (васкулиты, альвеолиты, эозинофильная пневмония, альвеолярный протеиноз) заболевания, а также сердечно-сосудистая патология – застойная сердечная недостаточность и тромбоэмболия легочной артерии.
В качестве дополнительных объективных критериев для уточнения диагноза используются рентгенотомография и КТ легких; посевы крови, мокроты, мочи; посев и цитологическое исследование плевральной жидкости; серологические исследования (определение антител к микоплазме, хламидиям, легионелле, цитомегаловирусу) при нетипичном течении и иммунодефицитах, у пожилых людей, алкоголиков, наркоманов; биохимическое исследование крови при тяжелом течении пневмонии, сопутствующих заболеваниях, почечной недостаточности, диабете, печеночной недостаточности. Цитологическое исследование мокроты проводится у курильщиков старших возрастных групп, при раковом семейном анамнезе. Бронхоскопия показана при отсутствии эффекта от лечения, при подозрении на рак легкого, инородное тело, аспирацию. При дифференциальной диагностике сепсиса и эндокардита проводится ультразвуковое исследование сердца и органов брюшной полости. Изотопное сканирование легких и ангиопульмонография показаны для исключения тромбоэмболии легочной артерии.
Оценка тяжести и прогноз
По степени тяжести пневмонии целесообразно делить на легкие, средней тяжести и тяжелые. Цель такой группировки — определение прогноза заболевания, выбор рациональной лечебной тактики, объема реабилитационных мероприятий, решение экспертных вопросов. Тяжесть состояния больных пневмонией оценивается по выраженности общей интоксикации, наличию и степени дыхательной недостаточности, по осложнениям со стороны сердечно-сосудистой системы (шок, коллапс), местным осложнениям (плеврит, деструкция легочной ткани, пневмоторакс и т.п.), инфекционно-аллергическим осложнениям со стороны других органов и систем (гломерулонефрит, миокардит, эндокардит и др.).
Тяжелая пневмония характеризуется резко выраженной интоксикацией, сопровождающейся гипертермией, адинамией, острой сосудистой и сердечно-сосудистой недостаточностью (коллапсы, шок, предотечные состояния и отек легких), резко выраженной дыхательной недостаточностью. Возможно развитие в легких деструктивных процессов и инфекционно-аллергических осложнений со стороны различных органов и систем.
Пневмония средней тяжести характеризуется фебрильной лихорадкой, головной болью, слабостью и другими проявлениями умеренно выраженной интоксикации. Дыхательная недостаточность не выражена, обнаруживается при инструментальном обследовании, физической нагрузке.
Легкая пневмония отличается отсутствием выраженных симптомов интоксикации, незначительными отклонениями со стороны сердечно-сосудистой системы. Дыхательная недостаточность, как правило, отсутствует.
Широкое распространение в мире получил алгоритм объективизации степени тяжести состояния больного ВП, разработанный в 1997 г. M.Fine et al., по которому тяжесть состояния пациентов подразделяется на пять классов. Эта шкала оценки тяжести состояния пациентов и прогноза заболевания рекомендуется рядом авторитетных руководств по клинической практике. Исследование с использованием шкалы M.Fine показало, что смертность больных, отнесенных к I–II классам риска, составляет 0,1–0,6%, с IV классом риска – 8,2%. Максимальный показатель смертности (29,2%) отмечен при V классе риска. Балльная оценка исхода, классы риска и алгоритм оценки прогноза течения ВП представлены в табл. 2, 3 и на рисунке.
|
Характеристика больного |
Оценка в баллах |
|
Демографические факторы |
|
|
Возраст |
|
|
Мужчины |
Возраст (годы) |
|
Женщины |
Возраст (годы)–10 |
|
Обитатели дома престарелых |
+ 10 |
|
Сопутствующие заболевания |
|
|
Злокачественные новообразования |
+ 30 |
|
Заболевания печени |
+ 20 |
|
Застойная сердечная недостаточность |
+ 10 |
|
Цереброваскулярные заболевания |
+ 10 |
|
Патология почек |
+ 10 |
|
Физикальные признаки |
|
|
Нарушение сознания |
+ 20 |
|
Тахипноэ >30/мин |
+ 20 |
|
Гипотензия (АД сист.) <90 мм рт. ст. |
+ 20 |
|
Гипотермия (< 35oС) или гипертермия (>40oС) |
+ 15 |
|
Тахикардия >125/мин |
+ 10 |
|
Лабораторные признаки |
|
|
pH <7,35 |
+ 30 |
|
Азот мочевины крови >10,7 ммоль/л |
+ 20 |
|
Na+ <130 мэкв/л |
+ 20 |
|
Глюкоза > 13,9 ммоль/л |
+ 10 |
|
Гематокрит <30% |
+ 10 |
|
РаО2 <60 мм рт. ст. |
+ 10 |
|
Плевральный выпот |
+ 10 |
Таблица 2. Оценка исхода внебольничной пневмонии (M. Fine et al., 1997)
|
Класс риска |
Баллы |
Летальность |
Лечение |
|
I |
Нет предикторов неблагоприятного исхода |
0,1 |
Амбулаторное |
|
II |
< 70 |
0,6 |
Амбулаторное |
|
III |
71 — 90 |
2,8 |
Стационарное |
|
IV |
91 — 130 |
8,2 |
Стационарное |
|
V |
> 130 |
29,2 |
Стационарное |
Таблица 3. Классы риска внебольничной пневмонии (M. Fine et al., 1997)
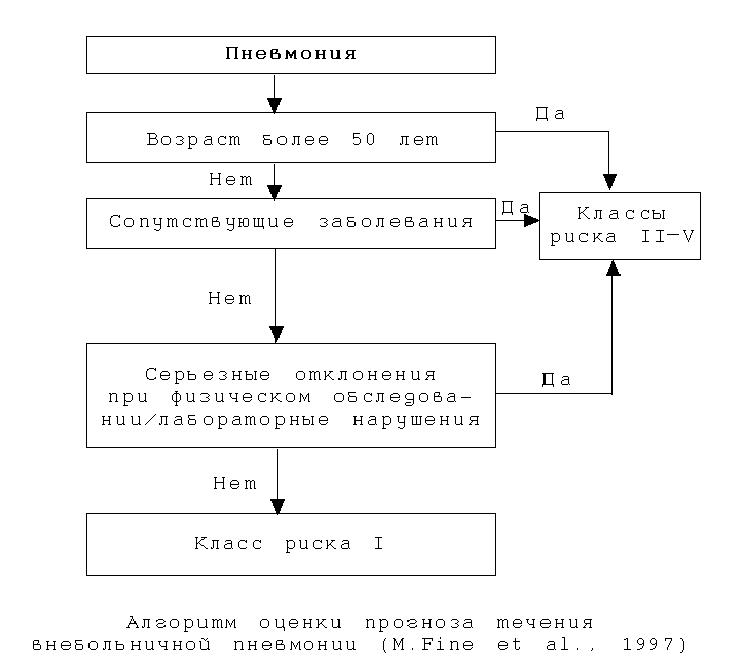
Рисунок.
В Беларуси все шире применяется достаточно простая и доступная градация пневмоний по степени тяжести, предложенная Н.Ф. Сорокой и М.А. Савченко в 2001г. (табл. 4).
|
Показатели |
Легкая |
Средняя |
Тяжелая |
|
|
Лихорадка |
До 38°С |
38 — 39°С |
> 39°С |
|
|
Легкие |
Число дыханий в минуту |
до 20 |
20 — 30 |
> 30 |
|
Сердце |
Частота пульса в минуту |
до 90 |
90 — 110 |
> 110 |
|
Систолическое АД, мм рт.ст. |
> 110 |
90 — 110 |
< 90 |
|
|
Лейкоциты, х109/л |
4 — 8 |
8 — 20 |
>20 или <4 |
|
|
Общий анализ крови |
Палочкоядерные нейтрофилы, % |
До 10 |
10 — 30 |
> 30 |
|
Токсогенная зернистость нейтрофилов |
Нет |
+/++ |
+++ |
|
|
Рентгенография легких (объем поражений) |
1—2 сегмента |
> 2 сегментов или полисегментарная |
Полисегментарная, долевая, двусторонняя (при объеме поражения > 2 сегментов) |
Таблица 4. Степени тяжести пневмонии (Н.Ф. Сорока, М.А. Савченко, 2001)
Затяжные (медленно разрешающиеся/не разрешающиеся) пневмонии
У большинства больных пневмонией к исходу 3 — 5-го дня от начала потенциально эффективной антибактериальной терапии нормализуется температура тела и регрессируют другие клинические проявления заболевания. При этом рентгенологическое выздоровление, как правило, отстает от клинического. В тех же случаях, когда на фоне улучшения клинической картины к исходу 4-й недели от начала заболевания не удается достичь полного рентгенологического разрешения очагово-инфильтративных изменений в легких, следует говорить о не разрешающейся (медленно разрешающейся), или затяжной, пневмонии.
В подобной клинической ситуации необходимо прежде всего установить возможные факторы риска затяжного течения заболевания: а) возраст более 55 лет; б) хронический алкоголизм; в) наличие сопутствующих инвалидизирующих заболеваний внутренних органов (ХОБЛ, застойная сердечная недостаточность, почечная недостаточность, злокачественные новообразования, сахарный диабет и др.); г) тяжелое течение пневмонии; д) многодолевая распространенность пневмонической инфильтрации; е) вирулентные возбудители заболевания (L. pneumophila, Staph. aureus, грамотрицательные энтеробактерии); ж) курение; з) клиническая неэффективность проводимой терапии (сохраняющиеся лейкоцитоз и лихорадка); и) вторичная бактериемия.
Среди возможных причин медленного разрешения пневмонии может быть приобретенная возбудителем заболевания антибиотикорезистентность. В связи с этим следует принимать во внимание известные факторы риска резистентности ведущих возбудителей заболевания. Исключительное значение имеет дифференциальная диагностика пневмонии затяжного течения с очагово-инфильтративным туберкулезом легких. Кроме того, необходимо иметь в виду широкий круг неинфекционных заболеваний, порой весьма напоминающих пневмонию (табл. 5).
Новообразования
— Первичный рак легкого (особенно так называемая пневмоническая форма бронхиоло-альвеолярного рака)
— Эндобронхиальные метастазы
— Аденома бронха
— Лимфома
Тромбоэмболия легочной артерии и инфаркт легкого
Иммунопатологические заболевания
— Системные васкулиты
— Волчаночный пневмонит
— Аллергический бронхолегочный аспергиллез
— Облитерирующий бронхиолит с организующейся пневмонией
— Идиопатический легочный фиброз
— Эозинофильная пневмония
— Бронхоцентрический гранулематоз
Прочие заболевания/патологические состояния
— Застойная сердечная недостаточность
— Лекарственная (токсическая) пневмопатия
— Аспирация инородного тела
— Саркоидоз
— Легочный альвеолярный протеиноз
— Липоидная пневмония
— Округлый ателектаз
Таблица 5. Неинфекционные причины очагово-инфильтративных изменений в легких
Формулировка диагноза
При формулировке диагноза указывается клинико-морфологический вариант пневмонии (крупозная, очаговая, интерстициальная), этиология заболевания (в том случае, если ее удалось установить), локализация воспалительного процесса (сегменты, доля, сторона поражения), степень тяжести, осложнения. Учитывая, что пневмония в принципе и в соответствии с приведенным выше определением является острым инфекционным процессом, а диагноз «хроническая пневмония» практически вышел из употребления, в настоящее время признано нецелесообразным использовать сочетание «острая пневмония», лучше заменить его термином «пневмония». При формулировке диагноза пневмонии могут опускаться также термины «внебольничная», «бытовая», «приобретенная».
Примеры формулировки клинического диагноза:
· Крупозная пневмококковая пневмония в С8, С9, С10 нижней доли правого легкого с тяжелым затяжным течением, осложненная инфекционно-токсическим шоком, правосторонним парапневмоническим экссудативным плевритом.
· Очаговая пневмония в С4, С5 верхней доли левого легкого средней степени тяжести.
Лечение
В случаях легкого течения неосложненных пневмоний пациенты могут лечиться амбулаторно или в условиях дневного стационара лечебного учреждения.
Показания для госпитализации:
— возраст более 60 лет;
— частота дыхания – 30 и более в 1 минуту;
— нарушение сознания;
— тяжелые сопутствующие заболевания (ХОБЛ, сахарный диабет, ХПН, алкоголизм, наркомания, алиментарная дистрофия, гепатит, цирроз печени, остеомиелит, сердечная недостаточность, спленэктомия в анамнезе, цереброваскулярные заболевания и др.);
— среднетяжелая (в большинстве случаев) и тяжелая пневмония;
— долевая и полисегментарная пневмония;
— быстрое прогрессирование процесса (увеличение инфильтрации за 2 сут более чем на 50 %);
— систолическое АД < 90 мм рт.ст., диастолическое АД < 60 мм рт.ст., температура тела < 35°С или >40°С, гемоглобин крови менее 90 г/л;
— лейкопения (число лейкоцитов менее 4х109/л) или лейкоцитоз (число лейкоцитов более 25х109/л);
— подростки, бомжи, одинокие пожилые люди и проживающие в общежитии;
— в случае затруднений дифференциальной диагностики;
— при неэффективности амбулаторного лечения в течение 3 — 5 дней;
— невозможность обеспечения адекватного ухода и лечения на дому;
— предпочтение пациента или членов его семьи.
Больные должны госпитализироваться в отделения интенсивной терапии и реанимации при наличии следующих признаков:
— нарушение сознания;
— ЧД более 30 в 1 минуту;
— необходимость искусственной вентиляции легких;
— шоковое состояние (систолическое АД < 90 мм рт. ст. и/или диастолическое АД < 60 мм рт. ст.);
— диурез < 20 мл/ч;
— РаО2 артериальной крови менее 50 — 60 мм рт. ст., РаСО2 > 50 мм рт.ст.;
— потребность в вазопрессорах > 4 ч;
— достоверное распространение инфильтрации легочной ткани в течение 48 ч от момента поступления.
Основой лечения пневмонии является назначение антибактериальных средств. Этиотропная терапия должна удовлетворять следующим условиям (Е.Н. Гайдар, 2000):
1. Эмпирический подход к выбору оптимального антибактериального средства.
2. Выделение двух типов пневмоний по условиям возникновения (внебольничная и госпитальная) и с учетом дополнительных факторов (возраст, тяжесть заболевания, сопутствующая патология).
3. До назначения антибактериальной терапии у стационарных больных необходим забор мокроты (и желательно крови) для бактериального исследования.
4. Лечение больных пневмонией в стационаре следует проводить с бактериологическим контролем во время и после окончания антибактериальной терапии.
5. При получении результатов бактериологического исследования возможна коррекция лечения для более целенаправленной антибактериальной терапии с учетом чувствительности выделенных микроорганизмов.
6. Наличие современных высокоэффективных антибактериальных средств широкого спектра действия позволяет проводить монотерапию пневмонии, за исключением особо тяжелых форм заболевания (реанимация, иммунодефицит, бактериемия, наличие полирезистентных штаммов микроорганизмов или инфекции, вызванной синегнойной палочкой).
7. Аминогликозидные антибиотики не следует применять для лечения внебольничной пневмонии; в случае госпитальной пневмонии аминогликозиды могут назначаться только в сочетании с другими антибактериальными средствами.
8. При наличии двух альтернативных средств с одинаковой антибактериальной активностью и переносимостью предпочтение следует отдавать препарату с меньшей стоимостью, а при равенстве и этого параметра – с более удобным режимом дозирования.
9. Первоначальную оценку эффективности антибактериальной терапии пневмонии следует проводить через 48 — 72 ч от начала лечения при снижении лихорадки и уменьшении интоксикации. В случае отсутствия клинического эффекта в эти сроки необходимо заменить антибактериальный препарат.
10. Оптимальная длительность антибактериальной терапии составляет в большинстве случаев 5 — 7 дней при внебольничной пневмонии (исключение – атипичные и сложные пневмонии) и 7 — 10 дней при госпитальной пневмонии. Большая продолжительность антибактериальной терапии увеличивает риск суперинфекции и существенно повышает стоимость лечения.
11. Снижение стоимости лечения больных пневмонией в стационаре может быть достигнуто при последовательном (парентерально – внутрь) применении антибактериальных средств.
В структуре пневмоний ведущее место занимают внегоспитальные пневмонии, приобретенные за пределами лечебного учреждения.
Для рациональной эмпирической антибиотикотерапии ВП разделены на три подгруппы:
1) Нетяжелые пневмонии у пациентов в возрасте до 60 лет без сопутствующих болезней. Препараты выбора: пенициллин, аминопенициллины, макролиды (ампициллин, амоксициллин, эритромицин, азитромицин, кларитромицин). В качестве резервного антибиотика может использоваться доксициклин.
2) Пневмонии у пациентов старше 60 лет и/или с сопутствующими заболеваниями (сахарный диабет, сердечная недостаточность, хронические болезни печени, ХПН, алкоголизм, пониженное питание, психические болезни, состояние после спленэктомии, подозрение на аспирацию, госпитализация в течение последнего года по поводу пневмонии). Лечение рекомендуется начинать с «защищенных» оральных аминопенициллинов (ампициллин/сульбактам, амоксициллин/клавуланат) или цефалоспоринов II поколения также в пероральной форме (цефуроксим). Учитывая вероятность в данной группе хламидийной и легионеллезной этиологии ВП, оправдано комбинирование указанных β-лактамов с макролидными антибиотиками.
3) Клинически тяжелые пневмонии независимо от возраста. Средства выбора: парентеральные цефало-спорины III поколения (цефотаксим, цефтриаксон) в комбинации с макролидами для парентерального введения (эритромицин, спирамицин).
Использование гентамицина в виде монотерапии у больных пневмонией нецелесообразно в связи с неактивностью аминогликозидных антибиотиков в отношении пневмококков.
Эмпирическая антибактериальная терапия нозокомиальных пневмоний должна проводиться с учетом локальных данных об этиологической структуре госпитальных инфекций и частоты распространения антибиотикорезистентности среди их возбудителей.
Наиболее распространенной формой госпитального легочного воспаления является вентилятор-ассоциированная пневмония (ВАП), которая возникает у больных, находящихся на ИВЛ.
В целях проведения рациональной антибактериальной терапии госпитальные пневмонии подразделяют на две подгруппы:
1) Пневмонии, развивающиеся у пациентов в отделениях общего профиля без факторов риска, а также ранние ВАП (при продолжительности ИВЛ менее 5 — 7 дней), развившиеся в отделениях интенсивной терапии и реанимации. Препаратами выбора при эмпирической терапии являются парентеральные цефалоспорины III поколения (цефотаксим или цефтриаксон) в максимальных дозах. В качестве альтернативы можно использовать фторхинолоны (ципрофлоксацин, офлоксацин и др.). В случае высокой вероятности псевдомонадной этиологии ГП целесообразно назначить антисинегнойные цефало-спорины III—IV поколений (цефтазидим, цефоперазон, цефпиром, цефепим) в сочетании с аминогликозидами (амикацин, тобрамицин, нетилмицин).
2) Поздние ВАП в отделениях интенсивной терапии и пневмонии у пациентов в отделениях общего профиля при наличии факторов риска (предшествующей антибактериальной терапии или антибиотикопрофилактики). В данной подгруппе особенно высока вероятность этиологической роли псевдомонад и полирезистентных штаммов микроорганизмов. Могут использоваться следующие варианты эмпирической терапии: карбапенемы внутривенно (имипенем, меропенем), антипсевдомонадные цефалоспорины III—IV поколений (цефтазидим, цефепим) + аминогликозиды, антипсевдомонадные пенициллины (азлоциллин, мезлоциллин, пиперациллин) + аминогликозиды, азтреонам + аминогликозиды, ципрофлоксацин (в виде монотерапии или в комбинации с аминогликозидами); при подозрении на легионеллезную инфекцию — макролиды (эритромицин, азитромицин, кларитромицин и др.); при высокой вероятности или подтверждении этиологической роли метициллинрезистентных стафилококков и энтерококков — гликопептиды (ванкомицин); при неэффективности предшествующей терапии, включавшей гликопептиды, — противогрибковые препараты (амфотерицин В, флуконазол).
Аспирационные пневмонии могут быть как внебольничными, так и госпитальными. В их лечении используются защищенные β-лактамы, карбапенемы, цефамицины (цефокситин, цефотетан, цефметазол) в сочетании с метронидазолом, линкозамидами.
Пневмонии у лиц с иммунодефицитом чаще являются госпитальными. Эмпирическая антибиотикотерапия проводится по схемам лечения ГП при наличии факторов риска (подгруппа 2).
Из соображений фтизиатрической настороженности и в целях профилактики резистентности микобактерий туберкулеза к антибиотикам в терапии пневмоний нерационально использовать препараты, обладающие противотуберкулезной активностью (стрептомицин, канамицин, рифампицин).
Средства выбора для лечения пневмоний известной этиологии представлены в табл. 6. Однако перечень препаратов, обладающих подтвержденной клинической эффективностью при лечении пневмоний известной этиологии, не ограничивается приведенными в этой таблице. Отбор препаратов для включения в таблицу в качестве средств выбора основан на экспертной оценке опубликованных результатов клинических испытаний.
|
Этиологические агенты |
Препараты |
|
|
Str. pneumoniae |
Чувствительные Устойчивые к пенициллину |
Бензилпенициллин, аминопенициллины Бензилпенициллин, амоксициллин, парентеральные цефало-спорины III поколения, цефалоспорины IV поколения, карбапенемы, ванкомицин |
|
H. influenzae |
Чувствительные Продуцирующие β-лактамазы |
Аминопенициллины Защищенные аминопенициллины, оральные цефалоспорины II—III поколений, парентеральные цефалоспорины II—III поколений |
|
M. catarrhalis |
Чувствительные Продуцирующие β-лактамазы |
Аминопенициллины Защищенные аминопенициллины, оральные цефалоспорины II—III поколений, парентеральные цефалоспорины II—III поколений |
|
Staph. aureus |
Чувствительные Продуцирующие β-лактамазы |
Бензилпенициллин, аминопенициллины Оксициллин, защищенные аминопенициллины, парентеральные цефалоспорины I—II поколений |
|
M. pneumoniae C. pneumoniae Legionella spp. |
Метициллин-резистентные |
Ванкомицин, фузидиевая кислота Макролиды, доксициклин Макролиды, доксициклин Эритромицин ± рифампицин |
|
Enterobacteriaceae |
Чувствительные Полирезистентные |
Парентеральные цефалоспорины III поколения Цефалоспорины IV поколения, защищенные аминопенициллины, азтреонам, карбапенем, аминогликозиды, фторхинолоны |
|
Ps. аeruginosa |
Чувствительные Полирезистентные |
Цефтазидим + тобрамицин Антипсевдомонадные цефалоспорины III поколения + аминогликозиды, антипсевдомонадные пенициллины + аминогликозиды, цефалоспорины IV поколения, азтреонам, карбапенемы, ципрофлоксацин |
Таблица 6. Препараты выбора для лечения пневмоний известной этиологии
Критериями эффективности антибактериальной терапии являются в первую очередь клинические признаки: снижение температуры тела, уменьшение интоксикации, улучшение общего состояния, лейкоцитарной формулы, уменьшение количества гноя в мокроте, положительная динамика аускультативных и рентгенологических данных. Эффективность оценивается через 24 — 72 ч. Лечение не изменяется, если нет ухудшения.
Лихорадка и лейкоцитоз могут сохраняться 2 — 4 дня, физикальные данные – более недели, рентгенологические признаки инфильтрации — 2 — 4 недели от начала болезни. Рентгенологические данные часто ухудшаются в начальный период лечения, что является серьезным прогностическим признаком у больных с тяжелым течением заболевания.
Методы введения антибиотиков. При пневмонии легкого, а у молодых пациентов — и среднетяжелого течения применяют таблетированные формы препаратов. Безопасность и клиническая эффективность парентеральной и пероральной антибиотикотерапии сопоставима. Препараты вводят парентерально в следующих случаях: 1) при сомнении в регулярности приема медикаментов со стороны больного; 2) при сомнении в полноте всасывания пероральной формы; 3) если пациент по ряду причин не может принимать таблетированный препарат; 4) если используется антибиотик, выпускаемый только в форме для парентерального введения.
Современная тактика применения антибиотиков предусматривает два принципиально различных подхода (схемы) антимикробной терапии:
— Схема эскалации (нарастания) применяется в лечении амбулаторных, нетяжелых больных. При отсутствии эффекта от первоначально начатой терапии антибиотиком выбора осуществляется переход к использованию антибактериального препарата (или комбинации антибиотиков) с более широким спектром действия.
— Схема деэскалации (понижения) может быть использована в лечении тяжелых больных в условиях стационара, отделений интенсивной терапии и реанимации. При деэскалационной терапии лечение сразу начинается с антибиотика широкого спектра действия (например, карбапенема), а затем, по мере улучшения состояния больного и получения результатов антибиотикочувствительности возбудителя, назначается антибиотик с более узконаправленным спектром действия.
Стремление обеспечить высокую эффективность лечения при уменьшении его стоимости и сокращении количества инъекций привело к созданию ступенчатой (step-down) антибактериальной терапии, которая может рассматриваться как один из вариантов режима деэскалации. При использовании этой методики лечение начинается с парентерального применения антибиотика с последующим ранним переходом на пероральный прием. Критериями перехода являются уменьшение интенсивности кашля, объема мокроты, одышки; стойкая нормализация температуры тела, высокая биодоступность пероральной формы антибиотика. Обычно возможность перехода на пероральный прием антибиотика появляется через 2 — 3 дня после начала лечения. В США ступенчатая терапия одобрена FDA и изложена в Общих рекомендациях этой организации по проведению клинических испытаний (1992).
Патогенетическая терапия. Наряду с антибактериальными препаратами в терапии пневмонии используются иные направления. Во всех случаях обязательно назначение отхаркивающих препаратов (3% раствор йодида калия, настой травы алтея, термопсиса и др.). Показано назначение муколитиков (бромгексин, ацетилцистеин, амброксол и др.), при наличии клинических признаков бронхоспазма — бронхолитиков.
При тяжелом течении заболевания и выраженности явлений интоксикации проводится дезинтоксикационная терапия (солевые растворы, реополиглюкин, 5% раствор глюкозы) — до 1,5 — 2,0 л жидкости под контролем ЦВД и диуреза.
Противопоказано плановое назначение антигистаминных средств из-за увеличения вязкости мокроты.
Физиотерапевтическое лечение пневмонии проводится после нормализации температуры тела и при отсутствии кровохарканья. Используются тепловые процедуры, ингаляции, электрофорез рассасывающих препаратов.
Критерии выздоровления:
· Нормализация самочувствия и состояния больного
· Исчезновение признаков пневмонии при перкуссии и аускультации легких
· Исчезновение рентгенологических признаков инфильтрации легочной ткани
· Исчезновение лабораторных признаков воспалительной реакции крови.
Ошибки в лечении больных пневмониями
В настоящее время отсутствуют соответствующие доказательства целесообразности назначения при пневмонии различных биогенных стимуляторов, антигистаминных препаратов, витаминов, нистатина, иммуномодуляторов (исключая гранулоцитарный колониестимулирующий фактор и препараты IgG для внутривенного введения), а также длительного применения нестероидных противовоспалительных средств и ненаркотических анальгетиков. Эффективность и безопасность названных лекарственных препаратов не подтверждены результатами рандомизированных контролируемых исследований, что требует дальнейшего изучения и не дает оснований рекомендовать их для лечения пневмонии.
Ошибки при проведении антибактериальной терапии пневмоний можно сгруппировать следующим образом:
— неправильный выбор антибиотика для эмпирической антибактериальной терапии;
— неадекватная доза антибиотика;
— неадекватный путь введения антибиотика;
— необоснованная продолжительность антибактериальной терапии;
— неправильная замена одного антибиотика другим;
— необоснованная комбинация антибиотиков;
— недоучет токсичности и переносимости антибиотиков;
— недоучет антибиотикорезистентности.
Следует подчеркнуть, что при внебольничной пневмонии не являются показанием для смены антибиотика или продолжения антибиотикотерапии следующие ситуации:
— сохранение субфебрильной температуры (37,0–37,5°С) при отсутствии других признаков бактериального воспаления;
— сохранение остаточных изменений (инфильтрация, усиление легочного рисунка) на рентгенограмме;
— сохранение сухого кашля или выделение негнойной мокроты;
— сохранение хрипов при аускультации;
— увеличенная СОЭ;
— сохраняющаяся слабость, потливость.
Это объясняется тем, что собственно небактериальная воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками, регрессирует медленнее и не требует продолжения антибактериальной терапии. Кроме того, некоторые клинические симптомы после перенесенной пневмонии (субфебрилитет, слабость, потливость, снижение работоспособности) обычно обусловлены вегетативной дисфункцией (постинфекционная астения) и могут сохраняться в течение нескольких недель.
Профилактика пневмоний
Первый и главный путь профилактики пневмоний состоит в прогнозировании возникновения и распространения эпидемических вспышек острых респираторных вирусных заболеваний, в своевременной и надежной изоляции заболевших и проведении иммунопрофилактики.
Второй путь — повышение неспецифической резистентности организма, а также предупреждение действия простудно-холодового фактора.
Все профилактические мероприятия должны быть применены к так называемым «группам риска» по пневмонии:
· болеющие ОРВИ три и более раз в году;
· имеющие очаги инфекции в верхних дыхательных путях (хронический тонзиллит, гайморит, кариозные зубы);
· болеющие хроническим бронхитом;
· лица, работающие в неблагоприятных условиях.
В настоящее время с целью профилактики пневмоний используются пневмококковая и гриппозная вакцины. Целесообразность применения пневмококковой вакцины объясняется прежде всего тем, что Str. pneumoniae остается ведущим возбудителем пневмонии у взрослых и, несмотря на доступную эффективную антибактериальную терапию, обусловливает значительную заболеваемость и летальность. С целью специфической профилактики пневмококковых инфекций применяют 23-валентную неконъюгированную вакцину, содержащую очищенные капсулярные полисахаридные антигены 23 серотипов Str. pneumoniae. Поскольку пациентам, нуждающимся во введении пневмококковой вакцины, нередко требуется применение и гриппозной вакцины, следует иметь в виду, что обе вакцины могут вводиться одновременно (в разные руки) без увеличения частоты нежелательных явлений или снижения иммунного ответа.
Литература
1. Бартлетт Дж. Дж. Инфекции дыхательных путей. — М.; СПб., 2000.
2. Бова А.А., Метельский С.М. Стандарты диагностики и лечения больных пневмониями в Вооруженных Силах Республики Беларусь. — Мн., 2001.
3. Хвещук П.Ф., Раков А.Л., Синопальников А.И., Рудакова А.В. // Воен.-мед. журнал. — 1999. — N 1. — С. 25 — 36.
4. Чучалин А.Г., Синопальников А.И., Яковлев С.В. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике /Пособие для врачей. – Смоленск, 2003.
5. Юшон Ж. // Пульмонология. — 1997. — N 1. — С. 56 — 60.
6. Bartlett J.G. et al. // Clin. Infect. Dis. — 2000. — V. 31.— P. 347–382.
7. British Thoracic Society Guidelines for the management of community-acquired pneumonia in adult // Thorax. — 2001. — V. 56, Suppl. 4. — P. 1—64.
8. Fine M.J., Auble T.E., Yealy D.M. et al. // New Engl. J. Med.— 1997. —V. 336. — P. 243–250.
9. Guidelines for management of adult community-acquired lower respiratory tract infections /Ed. G. Huchon, M. Woodhead // Eur. Respir. J. —1998. — V. 11. — P. 986–991.
10. Niederman M.S., Mandell L.A., Anzueto A. et al. // Amer. J. Respir. Crit. Care Med. — 2001. — V. 163.— P. 1730–1754.
11. Pneumoniae. European Respiratory Monograph / A. Torres, M. Woodhead eds. — 1997.
Медицинские новости. – 2005. – №6. – С. 23-35.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Как быстро следует начинать проведение антибактериальной терапии при пневмонии? Какова продолжительность антибактериальной терапии и от чего она зависит? Есть ли смысл применять сочетание двух антибиотиков и при каких обстоятельствах используется подобная терапия?

Назначение и проведение АТ при пневмонии требует от врача принятия целого комплекса мер, причем каждое из его решений определяет эффективность назначенного лечения. При назначении АТ врач должен руководствоваться следующими ключевыми параметрами:
- выбор первоначального АП для эмпирической АТ;
- доза и путь введения АП;
- оценка эффективности первоначального АП;
- адекватная замена неэффективного АП;
- продолжительность АТ;
- возможность ступенчатой АТ;
- обоснование необходимости комбинированной АТ;
- оценка токсичности и переносимости АП.
Выбор первоначального АП
АТ должна начинаться как можно раньше, с момента диагностирования пневмонии. По некоторым данным, при задержке введения первой дозы АП более чем на 8 часов с момента госпитализации достоверно увеличение летальности среди больных пожилого и старческого возраста. Необходимость как можно более раннего назначения антибиотиков (до получения результатов микробиологического исследования) обусловлена:
- быстрой декомпенсацией сопутствующей патологии;
- ухудшением прогноза;
- отсутствием мокроты или трудностями ее получения для исследования в некоторых ситуациях;
- частыми негативными результатами исследования мокроты;
- трудностями при интерпретации полученных данных (колонизация респираторных слизистых, контаминация мокроты);
- невозможностью выделения из мокроты некоторых возбудителей (микоплазма, легионелла).
Основными ориентирами при выборе первоначального АП для лечения пневмонии являются:
- клинико-эпидемиологическая ситуация;
- антимикробный спектр действия выбранного препарата;
- результаты окраски мокроты по Граму;
- фармакокинетика АП;
- тенденция и вероятность антибиотикорезистентности;
- тяжесть пневмонии;
- безопасность АП в конкретной ситуации;
- возможность ступенчатой терапии;
- стоимость АП.
«Ситуационный подход» при выборе первоначального антибиотика для лечения пневмонии оправдан «привязанностью» некоторых возбудителей пневмонии к определенным клинико-эпидемиологическим ситуациям. Кроме того, назначение АТ осуществляется сразу после постановки диагноза при отсутствии данных микробиологического исследования мокроты, а нередко и без перспектив этиологической верификации этиологического варианта пневмонии.
Пожалуй, наибольшее число ошибок возникает в самом начале АТ, на этапе эмпирической терапии, при выборе АП. Чаще всего ошибки оказываются связаны с недооценкой или неправильной оценкой клинической и эпидемиологической ситуаций, данных рентгенологического и лабораторного исследования, позволяющих предположить ориентировочный этиологический вариант пневмонии. Необходимо помнить о различной этиологии пневмонии у молодых и пожилых людей, у ранее здоровых пациентов и больных с различной фоновой патологией, у заболевших пневмонией дома или в стационаре, у пациентов, находящихся в хирургическом или реанимационном отделении и т. д. Отсутствие четких критериев выбора первоначального АП приводит к тому, что врач руководствуется совершенно другими субъективными критериями, например отдает предпочтение наиболее знакомому, хорошо известному и часто назначаемому АП, или, наоборот, назначает новый, более эффективный, по его мнению, АП, или останавливает свой выбор на более дешевом и доступном АП и т. д. Так, например, ошибочно назначаются цефалоспорины, обладающие антисинегнойной активностью (цефтазидим, цефпиром), или антисинегнойные пенициллины (мезлоциллин, карбенициллин) при внебольничной пневмонии нетяжелого течения у молодых пациентов, не отягощенных никакой сопутствующей патологией. В этом случае наиболее вероятными этиологическими агентами наряду с пневмококком могут быть так называемые атипичные возбудители (легионелла, микоплазма, хламидия). Неоправданно назначение больному с нетяжелой внебольничной пневмонией таких антибиотиков, как, например, ванкомицин или меропенем, считающихся «резервными». Такой подход не только противоречит принципам выбора первоначального АП, но и экономически нерационален. К тому же врачебная ошибка в этом случае чревата формированием микробной резистентности к указанным АП. Более оправданно в вышеприведенной ситуации внебольничной пневмонии у молодого, не отягощенного сопутствующей патологией больного назначение аминопенициллинов (амоксициллин, ампициллин) или макролидов (эритромицин, азитромицин, кларитромицин, спирамицин), активных также и против вероятных атипичных возбудителей (Legionella, Chlamydia, Mycoplasma). Это позволяет максимально полно охватить всех этиологически значимых возбудителей (цефалоспорины третьего поколения, ванкомицин и меропенем не активны против атипичных возбудителей). В табл. 2 приводятся возможные причины неэффективности АТ и способы их коррекции.
Среди фторхинолоновых АП при внебольничной пневмонии оправданно назначение новых фторхинолонов (левофлоксацин, моксифлоксацин), обладающих высокой активностью по отношению к S. pneumoniae, H. influenzae и атипичным возбудителям. В то же время назначение грамотрицательных фторхинолонов (ципрофлоксацин, офлоксацин) нерационально, поскольку эти АП обладают невысокой антипневмококковой активностью.
С другой стороны, при выборе АП для лечения госпитальных пневмоний следует ориентироваться на высокую вероятность этиологической роли грамнегативных микроорганизмов, и в том числе P. aeruginosa (поздние пневмонии в отделениях интенсивной терапии, длительное лечение глюкокортикоидами и др.). В таких ситуациях более оправданно назначение цефалоспоринов третьего поколения с антисинегнойной активностью (цефтазидим), либо антисинегнойных пенициллинов (пиперациллин), либо фторхинолонов (ципрофлоксацин)
Фармакокинетические свойства препаратов могут служить еще одним ориентиром при выборе первоначального АП. Основные фармакокинетические свойства, которые необходимо учитывать при выборе АГ:
- концентрация в легочной ткани и в альвеолярных макрофагах;
- биодоступность препарата при приеме внутрь;
- длительность периода полувыведения — режим дозирования;
- наличие постантибиотического эффекта;
- отсутствие взаимодействия с другими медикаментами;
- пути элиминации из организма.
Хорошо проникают в ткани макролиды, тетрациклины и фторхинолоны. При проникновении внутрь клетки препарат не должен вызывать повреждений, что в наибольшей степени свойственно тетрациклинам. Проникновение макролидов внутрь клетки настолько выражено, что их внеклеточные концентрации могут оказываться недостаточными для подавления пневмококков при пневмококковой бактериемии. С учетом этого при тяжелых пневмониях с высокой вероятностью бактериемии монотерапия макролидами неоправданна.
Фармакокинетические свойства некоторых АП (ципрофлоксацин, цефалоспорины третьего и четвертого поколения и др.) позволяют применять их не более 2 раз в сутки. Оптимальные фармакокинетические параметры новых (респираторных) фторхинолонов (левофлоксацин, моксифлоксацин), их высокая, практически полная биодоступность при приеме внутрь дают возможность назначать их однократно в сутки как парентерально, так и перорально.
Антибиотикорезистентность. При выборе АП для эмпирической АТ пневмоний следует учитывать тенденцию ряда микроорганизмов к антибиотикорезистентности (АР) и региональную «микробную экологическую ситуацию», то есть преобладающий спектр микроорганизмов и их чувствительность к антибиотикам в различных регионах, стационарах, отделениях и т. д.
Одной из основных проблем, имеющих важное клинические значение, является резистентность S. pneumoniae к пенициллину. Риск пенициллинорезистентности S. pneumoniae возрастает при наличии следующих факторов: возраст больных менее 7 лет и старше 60 лет, наличие тяжелых соматических заболеваний, частое и длительное лечение антибиотиками, проживание в домах престарелых. Возможна перекрестная резистентность к макролидам. В то же время резистентность S. pneumoniae к пенициллину и макролидам не коррелирует с резистентностью к респираторным фторхинолонам, что делает рациональным и обоснованным выбор в подобных ситуациях респираторных фторхинолонов (левофлоксацин, моксифлоксацин). Резистентность S. pneumoniae к левофлоксацину по-прежнему остается низкой и не превышает 0,8%. Согласно рекомендации Американского торакального общества, именно левофлоксацин и моксифлоксацин разрешены к применению при внебольничной пневмонии, вызванной резистентным S. pneumoniae.
Другой проблемой, которая встает в связи с антибиотикорезистентностью, является продукция H. influenzae b-лактамазы, что обычно наблюдается у больных ХОБЛ, часто получающих АП в связи с обострениями заболевания. С учетом этого фактора при развитии пневмонии на фоне ХОБЛ оправданно назначение защищенных пенициллинов (амоксициллин/клавуланат, ампициллин/сульбактам). Поскольку механизмы резистентности к пенициллину у S. pneumoniae и H. influenzae различны (изменения мембраны и выработка b-лактамазы соответственно), то защищенные пенициллины активны против H. influenzae, продуцирующей b-лактамазу, и неэффективны в отношении пенициллинорезистентного S. pneumoniae. В то же время «защищенные» пенициллины могут сохранять активность по отношению к пенициллинорезистентным стафилококкам (стафилококки вырабатывают b-лактамазу). Поэтому в ситуациях, когда высока вероятность стафилококковой внебольничной пневмонии (после перенесенного гриппа, хроническая алкогольная интоксикация), обоснованно назначение ингибитор-защищенных пенициллинов.
Важное клиническое значение имеет выявление резистентности у больных внутрибольничной пневмонией (метициллинорезистентный S. aureus), что определяет тактику АТ и служит обоснованием для назначения ванкомицина. В то же время выбор последнего в качестве эмпирической АТ при пневмониях даже тяжелого течения, как упоминалось выше, следует считать ошибочным, и его назначение должно быть обосновано выделением резистентного S. aureus.
Нерационально назначение в качестве первоначального АП при внебольничной пневмонии ко-тримоксазола или тетрациклина в связи с высоким уровнем резистентности к этим АП основных возбудителей пневмонии.
Окраска мокроты по Граму является важным ориентиром для выбора первоначального антибиотика с учетом грампринадлежности микроорганизмов. Целесообразно проведение бактериоскопии и посева мокроты, содержащей достаточное количество нейтрофилов. Отрицательный результат при окраске мокроты по Граму не всегда свидетельствует об отсутствии микроорганизмов в мокроте, а может быть обусловлен недостаточным их количеством (менее 104). Если в одном поле зрения обнаруживается около 10 микроорганизмов, это означает, что их количество составляет не менее 105 и приближается к диагностическому титру.
Стоимость АП. При первоначальном выборе антибиотика его стоимость должна рассматриваться с учетом адекватности АП в данной ситуации, а также дополнительных затрат на лечение в случае неэффективности, развития осложнений, нежелательных эффектов и т. д. Следует иметь в виду, что важна не только стоимость самого АП, но и общие затраты на лечение, которые в случае назначения более дешевого, но неэффективного в данной ситуации АП могут оказаться выше.
Увеличение затрат на лечение обычно связано с неправильным первоначальным выбором АП, комбинированной АТ без должных показаний, неадекватной длительностью АТ, недоучетом риска возникновения нежелательных токсических эффектов АП.
Доза АП и пути введения
Нередко для лечения пневмонии используются неадекватные дозы АП, причем могут назначаться как недостаточные, так и избыточные дозы препарата. Если доза АП недостаточна и в крови не создается концентрации препарата, необходимой для эрадикации соответствующего возбудителя, то это не только является одной из причин неэффективности АП, но и создает реальные предпосылки для формирования резистентности микроорганизма. Ошибки в выборе оптимальной дозы могут быть связаны как с назначением недостаточной разовой дозы, так и с неправильным режимом дозирования (недостаточная кратность введения).
Неправильный выбор интервалов между введениями АП обычно обусловлен не столько сложностями парентерального введения препаратов в амбулаторных условиях или негативным настроем больных, сколько неосведомленностью врачей о фармакодинамических и фармакокинетических особенностях АП, которые должны определять режим их дозирования. Так, ряд АП обладает так называемым постантибиотическим эффектом, то есть способностью подавлять рост микроорганизмов даже при снижении уровня АП в крови ниже МПК. Таким постантибиотическим эффектом в отношении грамотрицательных микроорганизмов обладают аминогликозиды, фторхинолоны, тетрациклины. Выраженность бактерицидного эффекта указанных групп АП зависит главным образом от пиковой концентрации в крови, в связи с чем при назначении данных препаратов важно, чтобы больной получил достаточную разовую дозу, а интервалы между введениями могут быть более длительными. С другой стороны, b-лактамные АП, за исключением карбапенемов, практически лишены постантибиотического эффекта. Их бактерицидный эффект не усиливается при повышении уровня препаратов в крови. Поэтому при выборе b-лактамных АП (пенициллины, цефалоспорины) для их оптимального действия гораздо важнее длительное поддержание в крови МПК, то есть более частые (без пропусков) введения препарата. С учетом вышесказанного дву- или трехкратное введение пенициллинов или цефалоспоринов первого и второго поколения даже в адекватной разовой дозе следует считать ошибочным. С другой стороны, при назначении аминогликозидов необходима достаточная разовая доза, которая может вводиться даже однократно. Назначение АП в дозах, превышающих оптимальные, может вызывать развитие суперинфекции в связи с активизацией собственной микрофлоры больного. Суперинфекция возникает обычно при назначении АП, снижающих уровень бесспоровой анаэробной флоры в кишечнике (пенициллины, линкомицин, тетрациклины). При этом обычно после кратковременного эффекта на фоне АТ отмечается повышение температуры, ухудшение состояния больного, что ошибочно трактуется как неэффективность АТ и влечет за собой неоправданную замену АП, который в свою очередь также не оказывает ожидаемого эффекта.
Следует помнить, что применение больших доз АП повышает риск возникновения токсических эффектов. Это относится прежде всего к таким потенциально токсичным препаратам, как аминогликозиды, для которых установлены строгие суточные дозы. Превышение таких «пороговых» доз недопустимо, особенно у больных с высоким фактором риска осложнений (пожилой и старческий возраст, нарушения функции почек, прием других потенциально нефротоксичных препаратов и др.)
Назначение больших доз АП может, однако, быть оправданным при высоком риске резистентных штаммов или при выделении возбудителя с умеренной резистентностью к соответствующим АП. Так, возможно назначение больших доз амоксициллина (до 3 г/сутки) при пневмониях, вызванных пенициллинорезистентным пневмококком, поскольку пеницилллины и цефалоспорины могут сохранять при этом свою эффективность.
Путь введения АП определяется многими факторами, в том числе тяжестью пневмонии, состоянием больного, фармакокинетической характеристикой АП и др. Если в целом ряде ситуаций при инфекциях нижних дыхательных путей парентеральный путь введения не имеет альтернативы (нарушение сознания, стволовые расстройства с нарушением глотания, патология кишечника и др.), то в остальных случаях парентеральная АТ требует определенных показаний и должна быть обоснованной, а не произвольной. Стремление врача «облегчить и упростить» лечение (как для больного, так и для среднего медперсонала), назначая АП внутрь без учета конкретной клинической ситуации и фармакокинетики АП, может стать одной из причин недостаточного эффекта или вообще неэффективности лечения пневмонии. Не следует назначать АП внутрь при тяжелых пневмониях, особенно это касается препаратов с низкой биодоступностью (ампициллин, цефуроксим аксетил), не позволяющих достигать оптимальной концентрации АП в крови. В то же время у пациентов с внебольничной пневмонией легкого течения при отсутствии осложнений и тяжелой фоновой патологии допустима оральная АТ. В подобных ситуациях парентеральный путь введения АП оказывается не только необоснованным, но и более дорогостоящим. Между тем оральные формы некоторых АП в лечении внебольничных пневмоний используются недостаточно широко. Так, например, частота парентерального и перорального применения цефалоспориновых антибиотиков в России составляет 94,2 и 5,8% соответственно.
Оценка эффективности первоначального АП
Критическим сроком оценки эффективности АП считается 48—72 ч с момента его назначения. Обычно критерием эффективности АП является снижение или нормализация температуры тела больного, уменьшение признаков интоксикации. В тех случаях, когда лихорадка с самого начала заболевания не выражена или вообще отсутствует, приходится ориентироваться на другие признаки интоксикации (головная боль, анорексия, общемозговая симптоматика и т. д.), а также на отсутствие прогрессирования заболевания за период проводимого лечения.
К сожалению, нередко приходится сталкиваться с тем, что больной продолжает получать назначенный АП в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Продолжение АТ, несмотря на ее неэффективность, чревато множеством негативных последствий. При этом затягивается назначение другого, более адекватного АП, что способствует прогрессированию легочного воспаления (что особенно актуально при тяжелых пневмониях и у больных с сопутствующей патологией), развитию осложнений, удлинению сроков лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов АТ, развития антибиотикорезистентности. Не следует игнорировать и тот факт, что неэффективность, проводимой терапии влечет за собой утрату доверия к врачу больного, а также его родственников. Нельзя также сбрасывать со счетов и экономические затраты, связанные с неадекватным назначением АП (напрасный расход неэффективного АП, чересчур длительное пребывание больного в стационаре, дополнительные затраты на лечение токсических эффектов АП и др.).
Встречаются также ошибки, связанные не только с оценкой эффективности АТ, но и с заменой неэффективного АП на другой, то есть со сменой АП. При отсутствии данных микробиологического исследования принцип выбора АП остается прежним, то есть ориентироваться приходится на клиническую ситуацию с учетом неэффективности первоначального АП и других дополнительных признаков. Отсутствие эффекта от первоначального АП в известной степени должно служить дополнительным ориентиром для выбора второго АП. Так, например, отсутствие эффекта от b-лактамных АП (пенициллины, цефалоспорины) у пациента с внебольничной пневмонией позволяет предполагать наличие у него легионеллезной или микоплазменной пневмонии (с учетом, разумеется, других признаков). В свою очередь, это может рассматриваться как обоснование для назначения АП из группы макролидов (эритромицин, азитромицин, спирамицин, кларитромицин и др.) или фторхинолонов нового поколения (левофлоксацин, моксифлоксацин).
Комбинированная АТ
Сегодня, когда в распоряжении врачей имеется широкий арсенал АП, показания к комбинированной АТ значительно сужены и приоритет в АТ пневмоний остается за монотерапией. Основными показаниями к назначению комбинированной АТ являются тяжелое течение пневмонии, высокая вероятность смешанной флоры, наличие пневмонии на фоне выраженного иммунодефицита (злокачественные опухоли, лечение цитостатиками и иммунодепрессантами и др.). К сожалению, приходится сталкиваться с ситуациями, при которых больным с нетяжелым течением пневмонии, при отсутствии осложнений, тяжелой фоновой патологии назначается два АП. Назначение двух АП обычно аргументируется доводами, что каждый из АП имеет различных спектр действия и при этом имеется больше шансов быстрого достижения терапевтического эффекта в условиях эмпирической АТ.
Целесообразность комбинации макролидов с цефалоспоринами при лечении тяжелой пневмонии обусловлена вероятностью легионеллезной пневмонии и трудностями ее этиологической верификации. Показано, что летальность при внебольничных пневмониях, особенно среди больных пожилого возраста, ниже при назначении комбинированной терапии цефалоспоринами второго–третьего поколения в сочетании с макролидами по сравнению с монотерапией цефалоспоринами третьего поколения. Однако летальность при монотерапии современными респираторными фторхинолонами (левофлоксацин) оказывается также более низкой, чем при монотерапии цефалоспоринами третьего поколения.
Негативные стороны необоснованной комбинированной АТ заключаются в селекции множественных устойчивых штаммов микроорганизмов и возникновении суперинфекции, увеличении риска развития токсических эффектов вследствие того, что неблагоприятные воздействия препаратов суммируются, а также в повышении стоимости лечения. Особенно нежелательно комбинированное назначение АП, которые выводятся почечным путем, так как подобная терапия создает реальный риск нефротоксических эффектов. Более того, при нерациональных комбинациях возможно снижение эффективности терапии вследствие антагонизма АП. Примером нерациональных комбинаций могут служить такие фиксированные сочетания АП, как олететрин и тетраолеан (препараты в настоящее время практически не применяются), в которых макролид олеандомицин содержится в недостаточной дозе, а тетрациклин не может быть использован в большинстве случаев в качестве первоначального АП для лечения пневмоний. Недостаточная доза оксациллина и ампициллина, содержащаяся в комбинированном препарате ампиокс, не позволяет рекомендовать данный препарат при внебольничной пневмонии, в том числе и при подозрении на стафилококковую этиологию пневмонии.
Продолжительность АТ пневмонии
Основная цель АТ сводится прежде всего к эрадикации возбудителя или угнетению его дальнейшего роста, то есть к подавлению микробной агрессии. Длительность АТ может определяться многими факторами, в том числе этиологическим вариантом пневмонии, наличием осложнений и т. д.
В случаях неосложненного течения внебольничной пневмококковой пневмонии длительность АТ составляет 7—10 дней. Легионеллезная и микоплазменная пневмония требуют длительной АТ — до 3 недель, поскольку указанные этиологические агенты имеют внутриклеточную локализацию. При осложненных пневмониях, часто вызываемых стафилококком (легочная деструкция, эмпиема, абсцессы) длительность АТ также не должна составлять менее 3 недель.
Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками (аускультативная картина, сохраняющаяся рентгенологическая инфильтрация, ускорение величины СОЭ), регрессирует медленнее и не требует продолжения АТ. В связи с этим следует считать ошибочной тактику, в соответствии с которой больному с сохраняющимися рентгенологическими признаками легочной инфильтрации, крепитирующими хрипами (crepitacio redux), увеличением СОЭ при нормализации температуры тела и исчезновении (или уменьшении) признаков интоксикации продолжают проводить АТ. Еще более грубая ошибка — замена одного АП на другой в подобных ситуациях, которые врач квалифицирует как неэффективность первоначально назначенной АТ. У некоторых больных после исчезновения признаков интоксикации и даже регрессии воспалительных изменений в легких в течение длительного времени может сохраняться слабость, потливость, субфебрильная температура. Последняя нередко ошибочно расценивается врачом как проявление не полностью купированной бронхолегочной инфекции, что к тому же «подтверждается» рентгенологическими данными в виде изменения легочного рисунка или «остаточными явлениями пневмонии» и обычно влечет за собой продолжение АТ или дополнительное назначение АП, несмотря на отсутствие изменений со стороны крови. Между тем подобная клиническая ситуация часто обусловлена вегетативной дисфункцией после легочной инфекции (постинфекционная астения) и не требует АТ, хотя, разумеется, в каждом конкретном случае необходимы тщательное обследование больного и расшифровка всей имеющейся симптоматики. Необоснованно длительная АТ пневмоний повышает риск развития суперинфекции, микробной резистентности, побочных и токсических эффектов АП, а также увеличивает затраты на лечение. Ситуации с замедленным рентгенологическим разрешением пневмонии требуют особого рассмотрения.
Ступенчатая терапия
Неоправданно редко используется так называемая ступенчатая терапия, предусматривающая в качестве первого этапа парентеральное назначение АП, а в дальнейшем, после достижения клинического эффекта, переход на оральный путь введения того же АП. Такая возможность имеется при выборе АП, имеющих как парентеральную, так и оральную лекарственную форму. Исследования показали, что ступенчатая терапия не ухудшает результаты лечения пневмонии и прогноз заболевания. Очевидными преимуществами ступенчатой АТ являются обеспечение большей комфортности лечения, сокращение сроков госпитализации и возможность продолжения лечения в амбулаторных условиях, а также снижение затрат на лечение
Среди факторов, влияющих на эффективность ступенчатой АТ, можно назвать низкую биодоступность препарата, нарушение кишечного всасывания, риск невыполнения больным режима дозирования. Однако указанных недостатков в большинстве случаев можно избежать.
Основными требованиями к переходу с парентерального на оральный путь введения АП являются следующие:
- наличие антибиотика в оральной и парентеральной форме;
- эффект от парентерально вводимого антибиотика;
- стабильное состояние больного;
- возможность приема препаратов внутрь;
- отсутствие патологии со стороны кишечника;
- высокая биодоступность орального антибиотика.
Этим требованиям соответствуют многие имеющиеся в арсенале врача современные АП, в том числе макролиды (эритромицин, азитромицин), респираторные фторхинолоны (левофлоксацин, моксифлоксацин), что наряду с другими свойствами (спектр антимикробной активности, фармакокинетика, безопасность) позволяет считать рациональным их назначение при внебольничной пневмонии.
Предупреждение и контроль побочных и токсических эффектов
При назначении и проведении АТ пневмоний повышенное внимание следует уделять безопасности АП, в связи с чем следует учитывать многочисленные факторы (возраст, сопутствующая патология, прием других медикаментов и т. д.), определяющие тактику АТ. Неадекватная оценка особенностей данного больного влечет за собой развитие побочных токсических эффектов. Чаще всего ошибки могут встречаться в следующих ситуациях:
- возраст больных (дети, старики);
- беременность;
- тяжелая сопутствующая патология с функциональными нарушениями различных органов и систем;
- медикаментозная терапия сопутствующих заболеваний;
- аллергические реакции на различные АП.
Беременным женщинам не следует назначать фторхинолоны, клиндамицин, метронидазол. Кроме того, с осторожностью должны применяться аминогликозиды, ванкомицин, имипенем.
Наличие сопутствующей патологии в ряде случаев создает сложности в проведении АТ, что может приводить и к ошибкам в выборе АП, его дозировки, путей введения, длительности АТ и т. д. В основе ошибок могут лежать либо невыявление сопутствующей патологии, либо ее недооценка в отношении токсического влияния АП, либо, наконец, недостаточное знание фармакокинетических особенностей выбранного АП. При наличии у больного почечной недостаточности следует отдавать предпочтение выбору АП с преимущественно внепочечным выведением (цефоперазон) или с двойным путем элиминации (ципрофлоксацин). Ошибочно назначение потенциально нефротоксичных АП (аминогликозиды, карбапенемы) без корректировки дозы у больных с сопутствующей почечной недостаточностью. Опасно также в подобных ситуациях применять сочетание АП, обладающих нефротоксическими свойствами (аминогликозиды и цефалоспорины, за исключением цефоперазона).
Особенно следует учитывать наличие сопутствующей, нередко множественной патологии с функциональными нарушениями органов и систем у больных пожилого и старческого возраста. Возрастное снижение показателей клубочковой фильтрации наряду с высокой частотой нефроангиосклероза у пожилых должно рассматриваться в качестве одного из факторов, влияющих на выбор АП, что, к сожалению, не всегда учитывается в клинической практике.
При наличии достоверно установленной гиперчувствительности к пенициллину ошибкой следует считать назначение других b-лактамных АП (цефалоспорины, карбапенемы). В качестве альтернативы АП могут назначаться фторхинолоны, макролиды. Однако следует иметь в виду, что нередко за аллергию на антибиотики принимают реакции другого происхождения (сосудистые, вегетативные и др.), в связи с чем следует критически оценивать указания больных на такую «непереносимость» и более тщательно анализировать имеющуюся ситуацию. Вместе с тем внутрикожные пробы на АП опасны, поскольку при этом существует такой же риск тяжелых анафилактических реакций.
Таким образом, ведение больного пневмонией требует от врача принятия ключевых решений с учетом имеющихся на сегодняшний день стандартов лечения и соответствующей коррекции назначенной АТ, в зависимости от клинической ситуации. Алгоритм ведения пациента с внебольничной пневмонией представлен на рисунке.
Дата публикации 31 июля 2018Обновлено 3 августа 2021
Определение болезни. Причины заболевания
Пневмония, или воспаление лёгких (Pneumonia) — вариант острой респираторной инфекции, поражающей лёгочную ткань. Лёгкие состоят из небольших мешотчатых образований (альвеол), которые в ходе акта дыхания здорового человека должны наполняться воздухом. При пневмонии альвеолы заполнены жидкостью (экссудатом) и гноем, которые ухудшают газообмен.[1]
Внебольничная пневмония (ВП) — это острое инфекционное заболевание, особенно часто встречающееся среди жителей городов. По статистике, предоставленной разными авторами, в России пневмонией ежегодно заболевает около 1 500 000 человек. В структуре смертности на долю пневмоний в России в 2015 году приходилось до 50% (в группе болезней органов дыхания), в 2016 году смертность от этого заболевания достигла 21 на каждые 100 тысяч жителей.[2]
Перечень возможных возбудителей ВП включает более сотни микроорганизмов (вирусы, грибы, простейшие, но главным образом — бактерии). Однако чаще всего заболевание ассоциировано с относительно небольшим кругом микробных агентов, среди которых:
- пневмококк (S. pneumoniae);
- микоплазма (M. pneumoniae);
- хламидофила (C. pneumoniae);
- гемофильная палочка (H. influenzae);
- респираторные вирусы;
- энтеробактерии;
- золотистый стафилококк (S. aureus);
- легионелла пневмофила (L. pneumophila).
Факторы риска
Наибольшему риску развитию пневмонии подвержены:
- дети до двух лет;
- люди старше 65 лет.
К другим факторам риска относятся:
- лечение в больнице;
- хронические заболевания — астма, хроническая обструктивная болезнь легких (ХОБЛ) или болезни сердца;
- ослабленная иммунная система — высокому риску подвержены пациенты с ВИЧ, а также люди, перенёсшие трансплантацию органов, получающие химиотерапию или длительно принимающие стероиды;
- курение [12].
Факторами риска неблагоприятного исхода являются: возраст, мужской пол и сопутствующие заболевания [3].
Заразна ли пневмония
Пневмонию может вызывать множество различных микроорганизмов. Многие из них передаются от человека к человеку, однако не у всех при воздействии одних и тех же микробов развивается пневмония.
Как передаётся пневмония
Вирусы и бактерии, приводящие к развитию пневмонии, могут передаваться воздушно-капельным и контактно-бытовым путём. Грибковая пневмония обычно развивается, когда люди вдыхают микроскопические частицы грибка из окружающей среды.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы пневмонии
Переохлаждение организма нередко становится причиной, запускающей процесс развития воспаления лёгких у взрослых. Затем последовательно появляются симптомы заболевания.
Как распознать симптомы пневмонии:
- неожиданный и очень быстрый подъём температуры тела до фебрильных цифр (свыше 38 °C);
- неспецифические проявления системной интоксикации организма (подавленность, вялость, утомляемость, мышечная слабость, сонливость, головная боль);
- через 3-4 дня возникает сухой кашель, который спустя ещё несколько дней становится влажным — начинает откашливаться слизь (мокрота), часто она имеет ржавый или бурый цвет;
- может появиться боль в грудной клетке на стороне пораженного лёгкого (или же с обеих сторон, если воспаление двустороннее), которая усиливается при кашле и дыхании;
- при дыхании могут выслушиваться хрипы в грудной клетке (слышны не у всех больных);
- одышка (частое дыхание) — является результатом массивного поражения лёгкого и проявлением дыхательной недостаточности;
- одна из сторон грудной клетки (поражённая) может отставать при дыхании.[4]
Признаки пневмонии у взрослого:
Признаки пневмонии у ребёнка
У детей симптомы пневмонии обычно выражены сильнее — они болеют с более высокой температурой, при которой могут развиться фебрильные судороги. Кроме того, дети, особенно совсем маленькие, зачастую плохо умеют откашливать мокроту, поэтому не всегда удаётся заметить её гнойный характер — жёлтый или зелёный цвет и неприятный запах.
Патогенез пневмонии
Ведущие механизмы, которые приводят к развитию ВП:
- проникновение в нижние дыхательные пути содержимого ротоглотки (аспирация);
- вдыхание аэрозольной взвеси, содержащей различные микробные агенты;
- проникновение микроорганизмов из очага инфекции, расположенного за пределами лёгких, через кровь;
- перемещение инфекционных агентов из соседних поражённых органов (прямой контакт) или в результате присоединения инфекции с ранящими предметами (оружие) в грудную клетку.[3]
Стартовым импульсом развития пневмонии лёгких становится прикрепление (адгезия) микробных агентов к поверхностной мембране клеток эпителия бронхов, особенно при предшествующей дисфункции реснитчатого мерцательного эпителия и изменении мукоцилиарного клиренса.
Следующим шагом в образовании воспаления является размножение микробного агента в клетках бронхиального эпителия. Нарушение целостности мембраны этих клеток приводит к интенсивной продукции биологически активных веществ — цитокинов. Они вызывают направленное движение (хемотаксис) макрофагов, нейтрофилов и целого ряда иных клеток в область воспаления.
На следующих стадиях воспалительного процесса очень значимую роль играет последовательное проникновение (инвазия), жизнедеятельность микроорганизмов внутри клеток и продукция токсинов. Все эти процессы в итоге заканчиваются экссудативным воспалением внутри альвеол и бронхиол. Наступает фаза клинических проявлений болезни.[4]
Классификация и стадии развития пневмонии
В Международной классификации болезней 10-го пересмотра (МКБ-10) в разделе «Х. Болезни органов дыхания» выделяют следующие виды пневмонии:
- неклассифицированную вирусную пневмонию (аденовирусную и другие);
- пневмококковую пневмонию (S. pneumoniae);
- пневмонию, вызванную гемофильной палочкой (H. influenzae);
- неклассифицированную бактериальную пневмонию, возникшую по причине воздействия клебсиеллы (Klebsiella pneumoniae), стафилококка (Staphylococcus spp), стрептококка группы В и других срептококков, кишечной палочки (Escherichia coli), других аэробных грамотрицательных бактерий и миклопазмы (Mycoplasma pneumoniae). Также к этой группе относятся другие бактериальные пневмонии и пневмонии неуточненной этиологии.
- пневмонию, возникшую по причине воздействия других инфекционных возбудителей: хламидий (Chlamydia spp), а также иных установленных возбудителей инфекций.
- пневмонию, возникающую при заболеваниях, классифицированных в других рубриках (при актиномикозе, сибирской язве, гонорее, нокардиозе, сальмонеллёзе, туляремии, брюшном тифе, коклюше; при цитомегаловирусной болезни, кори, краснухе, ветряной оспе; при микозах; при паразитозах; при орнитозе, ку-лихорадке, острой ревматической лихорадке, спирохетозе);
- пневмонию без уточнения возбудителя.
Данная классификация построена по этиологическому принципу, то есть основывается на виде возбудителя, послужившего причиной воспаления лёгких.[5]
Также отдельно выделяют аспирационную пневмонию, которая возникает при вдыхании или пассивном попадании в лёгкие различных веществ в большом объёме, чаще всего — рвотных масс, которые вызывают воспалительную реакцию.
К аспирационной пневмонии приводят:
- затекание желудочного содержимого в дыхательные пути при реанимации, шоке, нарушениях сознания (в том числе при алкогольной и героиновой интоксикации);
- нарушение глотания при различных неврологических нарушениях и заболеваний пищевода.
Особенности лечения аспирационной пневмонии — использование эндоскопических методов промывания и очищения дыхательных путей, антибактериальных и отхаркивающих препаратов.
В современной клинической практике самой популярной является классификация, учитывающая три основных фактора: условия появления пневмонии, особенности инфицирования лёгочной ткани и статус иммунной системы пациента. В этом аспекте очень важно отличать внебольничную пневмонию (ВП) и внутрибольничную пневмонию (нозокомиальную, НП), поскольку концепции их лечения разнятся. Внебольничной считают пневмонию, развившуюся за пределами стационара либо выявленную в первые 48 часов после госпитализации в стационар. С 2005 года ряд авторов выделяет пневмонию, связанную с медицинским вмешательством.[6]
Признаки внебольничной, внутрибольничной (нозокомиальной) и связанной с оказанием медицинской помощью пневмонии
Осложнения пневмонии
Многие авторы выделяют две категории осложнений, развивающихся при пневмонии — «лёгочные» и «внелёгочные».
К «лёгочным» осложнениям относятся:
- парапневмонический плеврит;
- эмпиема плевры;
- абсцесс и гангрена лёгкого;
- острая дыхательная недостаточность;
- респираторный дистресс-синдром.
«Внелёгочными» осложнениями являются:
- септический шок;
- полиорганная недостаточность;
- менингит;
- миокардит;
- ДВС-синдром.
В настоящее время такое деление представляется весьма условным, поскольку интоксикационный синдром при пневмонии распространяется на весь организм.
Плеврит — воспалительное заболевание, при котором в плевральной полости скапливается избыточное количество жидкости. Наблюдается особенно часто при бактериальной и вирусной природе возбудителя.
Абсцесс лёгкого — патологический инфекционный процесс, проявляющийся образованием в лёгочной ткани более или менее ограниченной полости (> 2 см в диаметре) из-за местного отмирания тканей и последующего гнойного распада. Очень часто к развитию абсцессов приводит инфицирование анаэробными микроорганизмами.
Эмпиема плевры — скопление гноя в плевральной полости, довольно часто становится крайне неблагоприятным исходом течения экссудативного плеврита.
Острая дыхательная недостаточность — резкое нарушение дыхания, при котором уменьшается транспорт кислорода в лёгкие, а обеспечение должного газового состава артериальной крови становится невозможным. В результате недостаточного поступления кислорода наступает «кислородное голодание» (гипоксия). Значительный дефицит кислорода угрожает жизни больного и может потребовать развёртывания мероприятий неотложной интенсивной терапии.
Сепсис — является самым грозным и тяжёлым осложнением пневмонии. Он развивается при проникновении инфекционного агента в кровь, и далее происходит его циркуляция по кровяному руслу. Особенность сепсиса заключается в образовании гнойных очагов во всём теле. Клинические проявления сепсиса очень яркие: температура тела повышается до фебрильных цифр, возникает тяжёлый синдром интоксикации, проявляющийся головной болью, тошнотой, рвотой, реже диареей, кожа становится «землистого» оттенка).
ДВС-синдром — патология со стороны системы гемостаза (свёртывающей и противосвёртывающей системы крови), приводящее к изменению нормальной микроциркуляции в сосудистом русле за счёт массивного кровотечения с одновременным образованием тромбов.[7]
Диагностика пневмонии
Диагностические исследования при ВП направлены на уточнение диагноза, определение возбудителя, оценку тяжести течения и прогноза заболевания, а также на обнаружение осложнений.
Алгоритм диагностики при подозрении на ВП включает:
- подробный сбор анамнеза;
- анализ жалоб пациента;
- физикальное обследование;
- лабораторные и инструментальные исследования, объём которых может быть определен в индивидуальном порядке и обусловлен тяжестью течения ВП, появлением и характером осложнений, сопутствующими болезнями пациента.
Диагноз ВП является доказанным при выявлении у пациента очаговой инфильтрации лёгочной ткани, подтвержденной рентгенологически и, как минимум, двух из перечисленных ниже признаков:
- остро возникшая лихорадка вначале заболевания (температура тела > 38,0 °С);
- кашель с мокротой;
- физические признаки, выявленные в ходе полного физикального обследования (местная крепитация или мелкопузырчатые хрипы, бронхиальное дыхание, притупление звука при перкуссии);
- увеличение общего количества лейкоцитов (> 10·109/л) и/или палочкоядерный сдвиг (> 10%).
Важно! При отсутствии или недоступности рентгенологического подтверждения очаговой инфильтрации в лёгких диагноз «ВП» считается неуточненным. При этом диагноз «Пневмония» может быть обоснован данными эпиданамнеза (истории болезни), наличием соответствующих жалоб и местных проявлений.[3]
Очень важным моментом в диагностике пневмоний является использование метода пульсоксиметрии. Во всех клинических рекомендациях озвучена необходимость измерения сатурации у каждого пациента с воспалением лёгких.[9]
В настоящий момент существует целый ряд диагностических приёмов, позволяющих разделить все ВН на две категории — тяжёлые и нетяжёлые. Так, главной задачей шкал оценки тяжести (бальных систем) является выявление пациентов с неблагоприятным прогнозом и высоким риском осложнений.[8] Примеры таких шкал являются:
- PSI – индекс тяжести пневмонии;
- Шкала CURB-65;
- Шкала SMART-COP.
После определения степени тяжести лечащий врач принимает решение о месте лечения — амбулаторное наблюдение или госпитализация.
Как отличить воспаление лёгких от ОРВИ, гриппа и бронхита
Чтобы отличить воспаление лёгких от сезонных ОРВИ, гриппа и бронхита необходима визуализация лёгких — рентгенография органов грудной клетки, цифровая флюорография или компьютерная томография органов грудной клетки. Эти методы позволяют обнаружить инфильтраты в лёгочной ткани.
Лечение пневмонии
Какой врач лечит заболевание
Пневмонию лечит терапевт или пульмонолог.
Когда обратиться к врачу
К врачу следует обратиться при появлении проблем с дыханием, болях в груди, постоянной лихорадке (свыше 38 °C) и кашля, особенно с мокротой.
Показания при заболевании
Лечение пациентов с ВП является комплексным и основывается на нескольких базовых принципах:
- назначение антимикробных препаратов;
- адекватная респираторная поддержка при необходимости;
- использование неантибактериальных лекарственных средств (только в случае появления показаний);
- профилактика осложнений.
Чрезвычайно важным является своевременное обнаружение и лечение декомпенсации или обострения сопутствующих заболеваний, так как их наличие/тяжесть может кардинальным образом влиять на течение пневмонии.[10]
Антимикробные препараты
Важно! Антибактериальная терапия (АБТ) может быть назначена только врачом, в противном случае резко возрастает риск лекарственной устойчивости (резистентности) микроорганизмов.
Основные группы антимикробных препаратов, используемых при лечении пневмонии:
- бета-лактамные антибиотики (пенициллины и цефалоспорины);
- макролиды;
- респираторные фторхинолоны.
В некоторых случаях при наличии особых показаний могут быть использованы препараты других групп (тетрациклины, аминогликозиды, линкозамиды, ванкомицин, линезолид).
При вирусных пневмониях (как правило, ассоциированных с вирусом гриппа) наибольшее значение имеют ингибиторы нейраминидазы (оселтамивир и занамивир), которые обладают высокой активностью в отношении вирусов гриппа А и Б.
При лечении амбулаторных пациентов предпочтение отдают пероральным антибиотикам (обычно в таблетированной форме). При лечении пациентов в стационаре используют ступенчатый подход: начинают с парентерального введения антибиотиков (предпочтителен внутривенный путь), в дальнейшем по мере клинической стабилизации пациента переводят на пероральный приём (таблетки).
Длительность антимикробной терапии нетяжёлой ВП определяется индивидуально, при тяжёлой ВП неуточнённой этиологии — продолжается как минимум 10 дней. Осуществление более длительных курсов АБТ (от 14 до 21 дней) рекомендовано только при развитии осложнений болезни, наличии очагов воспаления за пределами лёгочной ткани, инфицировании S.aureus, Legionella spp., неферментирующими микроорганизмами (P.aeruginosa).
В клинической практике очень важным является решение о возможности прекращения АМТ в нужный момент. Для этого разработаны критерии достаточности:
- стойкое снижение температуры тела < 37,2ºС в течение не менее 48 часов;
- отсутствие проявлений интоксикационного синдрома;
- нормализация частоты дыхания (< 20/мин);
- отсутствие гнойной мокроты;
- снижение количества лейкоцитов в крови (< 10·109/л), нейтрофилов (< 80 %), юных форм (< 6 %);
- отсутствие отрицательной динамики на рентгенограмме.[3]
Респираторная поддержка
Острая дыхательная недостаточность (ОДН) является ведущей причиной смерти пациентов с ВП, поэтому адекватная респираторная поддержка — важнейший компонент лечения таких пациентов (конечно же, в совокупности с системной антибиотикотерапией). Респираторная поддержка показана всем пациентам с ВП при РаО2 < 55 мм рт.ст. или SрO2 < 88 % (при дыхании воздухом).[4]
Кислородотерапия проводится в случае умеренной нехватки кислорода в крови при помощи простой носовой маски или маски с расходным мешком.
Искусственная вентиляция лёгких (ИВЛ) используется в том случае, если даже при ингаляциях кислородом целевой уровень насыщения крови кислородом не достигается.
Показания к ИВЛ при ОДН на фоне ВП:
- абсолютные: остановка дыхания, нарушение сознания (сопор, кома), психомоторное возбуждение, нестабильная гемодинамика (АД сист < 70 мм рт.ст., ЧСС < 50/мин);
- относительные: ЧДД >35/мин РаО2/FiО2 < 150 мм рт.ст., повышение РаСО2 > 20 % от исходного уровня, нарушение сознания.
Неантибактериальная терапия
Представлена тремя основными классами препаратов:
- системные глюкокортикостероиды (ГКС);
- внутривенные иммуноглобулины (ИГ);
- некоторые иммуностимуляторы.
Глюкокортикостероиды
Вопрос о назначении ГКС рассматривается в первую очередь при тяжёлой ВП, которая осложнена септическим шоком. ГКС способствуют ограничению разрушающего влияния системного воспаления с помощью различных геномных и негеномных эффектов.
Иммуноглобулины
Применение ИГ при терапии инфекций, осложнённых сепсисом, основано на разнообразных эффектах: от нейтрализации бактериальных токсинов до восстановления реактивности клеток при феномене «иммунного паралича».
В лечении сепсиса наиболее эффективны поликлональные ИГ, которые по сравнению с плацебо снижают относительный риск смерти. Рутинное применение внутривенных ИГ пациентами с тяжёлой ВП, осложнённой сепсисом нецелесообразно.
Иммуностимуляторы
Интерес к этим препаратам связан с их способностью усиливать фагоцитоз, образование и созревание нейтрофилов. Однако в связи с отсутствием убедительной доказательной базы на текущий момент они практически не используются в рутинной практике.
Противопоказания при заболевании
При пневмонии крайне не рекомендуется заниматься самолечением, особенно с использованием антибиотиков. В настоящий момент существует много групп антибактериальных препаратов, для подбора адекватной терапии врач задаст несколько вопросов об истории заболевания, лекарственной непереносимости, предыдущем использовании антибиотиков и о том, какие ещё препараты пациент принимает регулярно. В остром периоде заболевания рекомендовано воздержаться от активного использования физиотерапевтических методов лечения, особенно связанных с нагреванием тканей.
Прогноз. Профилактика
Благоприятный или неблагоприятный исход при ВП зависит от нескольких факторов:
- возраст пациента;
- тяжесть течения;
- наличие/отсутствие сопутствующих заболеваний.
Риск смерти минимален у пациентов молодого и среднего возраста с нетяжёлым течением ВП и не имеющих сопутствующие заболевания. У пациентов пожилого и старческого возраста существует риск летального исхода при наличии значимой сопутствующей патологии (ХОБЛ, злокачественные новообразования, алкоголизм, диабет, хроническая сердечная недостаточность), а также в ситуациях развития тяжёлой ВП.
Основная причина смерти больных с тяжёлой ВП — устойчивая нехватка кислорода, септический шок и недостаточность всех органов и систем. Согласно исследованиям, основными факторами, связанными с неблагоприятным прогнозом больных с тяжёлой ВП, являются:
- возраст > 70 лет;
- проведение ИВЛ;
- двусторонняя локализация пневмонии;
- сепсис и инфицирование сине-гнойной палочкой.
Говоря о России, отдельно следует упомянуть позднее обращение пациентов за квалифицированной медицинской помощью. Это становится дополнительным фактором риска неблагоприятного исхода.
Как предотвратить пневмонию
В настоящий момент во всём мире доступны весьма эффективные средства, позволяющие защитить себя и своих близких от этого грозного заболевания — пневмококковые и гриппозные вакцины.
С целью специфической профилактики пневмококковых инфекций, в том числе пневмоний, у взрослых используются две вакцины:
- 23-валентная неконъюгированная вакцина (содержит очищенные капсулярные полисахаридные антигены 23 серотипов S.pneumoniae);
- 13-валентная пневмококковая конъюгированная вакцина.
Все пациенты с высоким риском пневмоний должны быть защищены такими вакцинами.[11]