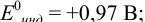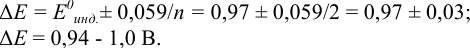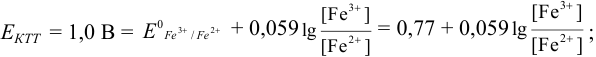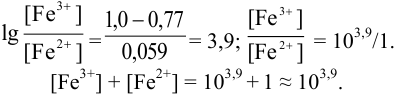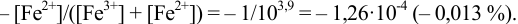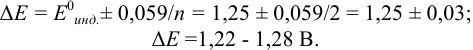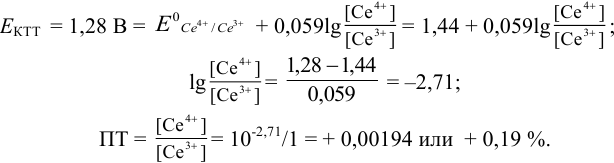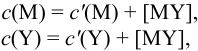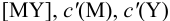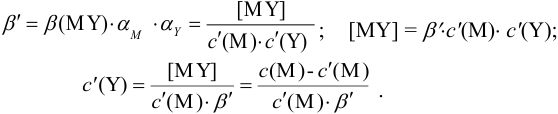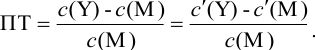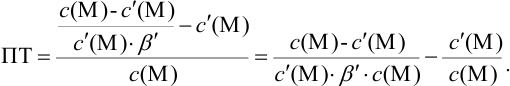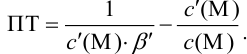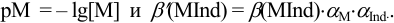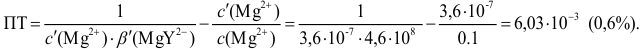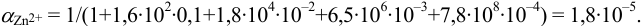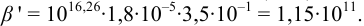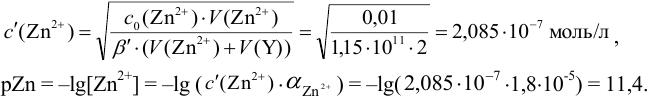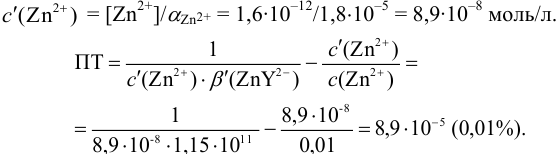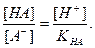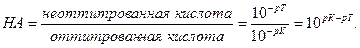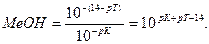Точность
зависит от многих факторов. Один из них
– точность отсчёта объёма рабочего
раствора по бюретке; обычно применяемой
для титрования. Погрешность отсчёта по
шкале, разделённой на десятые доли
миллилитра, составляет не менее 0,02 мл.
Оптимальный V
расходуемого рабочего раствора примем
равным 20мл.
Таким
образом, при принятых условиях
относительная погрешность ()отсчёта
объёма рабочего раствора по бюретке
составляет:
=
Погрешность
можно уменьшить, применяя специальные
приспособления, например весовую
бюретку, когда измеряют не V
раствора, а его массу. Однако такой
способ работы сопряжен со значительными
трудностями и увеличивает продолжительность
анализа. В обычных же условиях следует
считать неизбежной погрешность 0,1%.
Отсюда следует, что и при других операциях,
связанных с определением нет необходимости
стремиться обеспечить погрешность
меньшую, чем 0,1%.
Погрешности,
источниками которых являются неправильный
выбор индикатора, можно разделить на
две группы.
-
Индикатор
выбран так, что резкое изменение окраски
наблюдается после введения некоторого
избытка рабочего раствора по сравнению
с эквивалентным количеством. В этом
случае раствор перетитрован. -
Индикатор
выбран так, что переход окраски происходит
до того, как достигнута точка
эквивалентности. В этом случае раствор
недотитрован.
Погрешности
первой группы легко найти по объему
избытка рабочего раствора, прибавленного
для изменения окраски индикатора.
pH
в ТЭ HCOOH
равен 9,0 следовательно необходим
индикатор с рТ = 9, т.е. фенолфталеин.
Предположим, что индикатор выбран
неудачно – вместо фенолфталеина взят
тимолфталеин с рТ = 10. Индикатор изменит
цвет при рН=10 и раствор, следовательно,
будет перетитрован. Примем, что V
раствора в конце определения составляет
200мл. Для изменения цвета индикатора
необходимо прибавить такой избыток
раствора 0,2М раствора NaOH,
чтобы он был достаточен для создания
рН = 10. По соотношению между концентрацией
и объёмом находим V1M1
= V2M2,
где V1
– объём раствора в конце титрования
(200мл); M1
[H+]
= 10-10
или [OH—]
= 10-4,
M2
– молярность рабочего раствора NaOH
(0,2M),
V2
– необходимый
объём щелочи, необходимый для изменения
окраски индикатора,мл.
Таким
образом, для изменения цвета индикатора
необходимо прибавить избыток 0,2М раствора
NaOH
равный 0,1мл.
Если
принять, что исходное количество 0,2М
муравьиной кислоты составляет 100мл, то
относительная погрешность титрования
будет равна:
.
Погрешности
второй группы можно определить как
отношение неоттитрованного объёма
вещества к его первоначальному объёму,
или отношение концентрации неоттитрированной
части к первоначальной концентрации
вещества:
Во
многих случаях, когда погрешность не
слишком велика, принимают, что
первоначальная концентрация вещества
равна концентрации в оттитрированной
части:
,
Рассмотрим,
как влияет расхождение между рТ и рН
точки эквивалентности на погрешность
титрования 0,2M
раствора HCOOH
HCOOH
+ OH—
HCOO—
+ H2O
Равно
9,0.Предположим, что взят индикатор с рТ
= 9, в этом случае окраска изменится при
рН = 9, т.е. когда некоторая часть HCOOH
останется неоттитрированной, поэтому:
.
Отношение
в правой части уравнения находим из k
диссоциации кислоты:
.
Из
уравнения следует:,
где [H+]
– концентрация водородных ионов, при
которой индикатор изменяет окраску,
т.е. [H+]
= 10-9.
Принимая
во внимание, что ka
= 1,74 · 10-5,
получим
или
Δ=0,057 %
Таким
образом HCOOH
можно определить с погрешностью 0,057%,
если для титрования взят индикатор
фенолфталеин с рТ = 9.
При титровании
возможны случайные и систематические
погрешности (ПТ). Случайные погрешности
связаны с измерением объема и массы
навески, систематические- с несовпадением
ТЭ и конца титрования.
Случайные
погрешности обрабатывается
по законом математической статистики.
Они тем меньше, чем больше индекс крутизны
кривой титрования, поскольку стандартное
отклонение объема титранта St
связано с крутизной соотношением
где
s(V)
— стандартное
отклонение объема в конечной точке
титрования.
Индекс крутизны
при титровании слабых электролитов
меньше, чем при титровании сильных,
поэтому случайные погрешности в последнем
случае имеют меньшие значения.
Систематические
погрешности могут
быть положительными (перетитровывание)
и отрицательными (недотитровывание).
Для
оценки систематической погрешности
можно воспользоваться графическим и
расчетным способами. Графический
способ является
лишь ориентировочным. Опустим перпендикуляр
из точки с ординатой рТ на ось абсцисс.
Отрезок между полученным значением f
и f
в ТЭ и есть погрешность титрования.
При
расчетном
способе погрешность
вычисляют, используя формулы, связывающие
рН и f.
При недотитровывании ПТ=-(1-f),
при перетитровывании ПТ= f
-1. При титровании сильных кислот, для
которых
а с учетом изменения
объема
При титровании
сильных оснований
а с учетом изменения
объема
При
перетитровывании ПТ рассчитывают по
аналогичным формулам, но изменяет знак.
При
титровании слабых кислот относительная
погрешность титрования ПТ=f
-1. Учитывая, что
получаем
При титровании
слабого основания
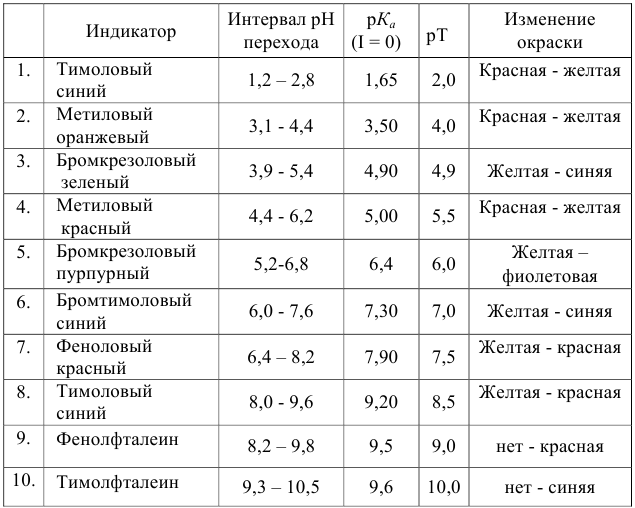
Таблица №2.
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 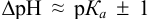
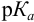
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 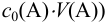
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
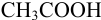
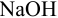
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
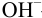
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 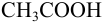



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 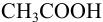
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 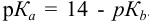
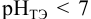
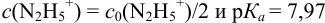
Сравнивая рТ индикаторов и 
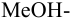
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 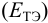

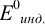
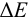
Таблица 8.14
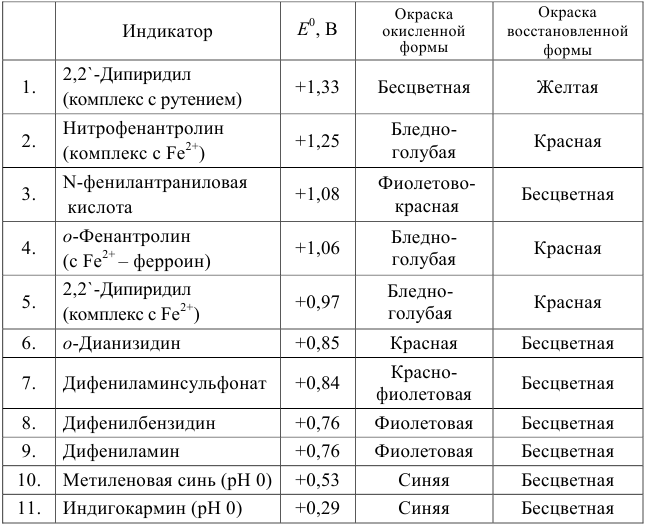
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 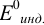
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 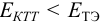
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 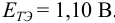
Выберем для рассмотрения порядка расчета два индикатора:
а) с 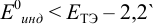
б) с 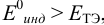
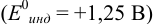
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
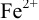



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

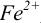
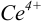
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 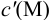
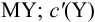
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 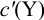
Вблизи ТЭ 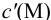
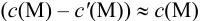
следовательно:
Выражение (8.21) тождественно выражению: 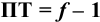
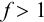
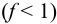
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
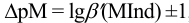
Интервал перехода окраски 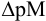
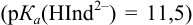
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 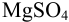

Решение:
В данных условиях 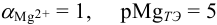
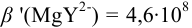
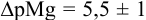
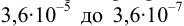

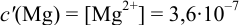
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 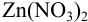

Решение:
1. Рассчитаем условную константу 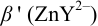
Общие константы устойчивости для аммиачных комплексов 
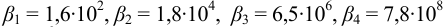

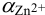
По табл. 7 и табл. 4 приложения находим 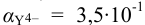
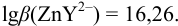

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 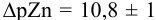
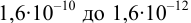

2. Конечная точка титрования наступает при [
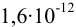

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Химические методы анализа
кислот как H3BO3 (pKa = 9,2) или NH4+ (pKa = 9,24) в водных растворах с удовлетворительной погрешностью невозможно и поэтому для их определения используют специальные приёмы.
Температура и ионная сила влияют на величину скачка титрования менее заметно, чем концентрация или сила титруемой кислоты или основания. При повышении температуры константа автопротолиза воды увеличивается, поэтому величина скачка кислотно-основного титрования в водном растворе уменьшается. Аналогичным образом влияет на величину скачка титрования ионная сила раствора.
Методика титриметрического анализа многостадийна, погрешности могут возникать на любой стадии её проведения: при измерении массы навески, объёма приготовленного раствора или аликвоты, при проведении титрования, обнаружении конечной точки титрования. В зависимости от причины возникновения погрешности в титриметрических методах анализа, как и погрешности вообще, могут быть:
случайные
ПОГРЕШНОСТИ

|
положительные |
отрицательные |
||||
|
определяемое вещество |
определяемое вещество |
||||
|
всё время перетитровывается |
всё время недотитровывается |
К появлению систематических погрешностей в титриметрических методах анализа может приводить:
•использование неверно градуированной посуды;
•неправильная техника титрования (слишком быстрое добав-
ление титранта);
•неточное считывание объёма титранта, израсходованного для титрования;

Погрешности, обусловленные несовпадением точки эквивалентности и рТ индикатора, называются индикаторными.
Индикаторные погрешности в кислотно-основном титровании удобно разделить на 4 вида:
161

|
Раздел 2 |
|||||||||||
|
в КТТ в растворе присутствует |
в КТТ в растворе остаётся |
||||||||||
|
избыток OH— по сравнению с ТЭ |
недотитрованная слабая кислота |
||||||||||
|
гидроксидная |
кислотная |
||||||||||
|
ИНДИКАТОРНАЯ |
|||||||||||
|
водородная |
ПОГРЕШНОСТЬ |
основная |
|||||||||
|
в КТТ в растворе присутствует |
в КТТ в растворе остаётся |
||||||||||
|
избыток H3O |
+ |
по сравнению с ТЭ |
недотитрованное слабое основание |
||||||||
Водородная индикаторная погрешность может возникнуть при недотитровании сильной кислоты (в таком случае погрешность отрицательная) либо когда сильная кислота используется в качестве титранта и добавлена в избытке (положительная погрешность).
|
n(H |
3 |
O+ ) |
конечн |
C |
V |
10 |
−pT V |
||||
|
∆ |
H |
+ = ± |
= ± |
2 конечн |
= ± |
конечн |
|||||
|
С0V0 |
|||||||||||
|
n(H3O+ )исх |
С0V0 |
Если концентрации титруемого вещества и титранта одинаковы, то Vконечн = 2V0, тогда
|
2 10−pT |
||||
|
∆ |
H |
+ = ± |
[ 100%] |
|
|
С0 |
||||
Гидроксидная погрешность может возникнуть при недотитровании сильного основания (отрицательная погрешность) либо в том случае, когда сильное основание используется в качестве титранта и добавлено в избытке (положительная погрешность).
|
10pT−pKW V |
10pT−pKW |
||||||
|
∆ |
OH |
− = ± |
конечн |
≈ ±2 |
[ 100%] |
||
|
C0 V0 |
C0 |
||||||
Кислотная и основная индикаторные погрешности могут быть только отрицательными (если, конечно, исключить гипотетический случай использования слабой кислоты или основания в качестве титранта).
Величина кислотной погрешности представляет собой молярную долю неоттитрованной кислоты.
|
[HA] |
[H |
3O+ ] |
||||||||
|
∆HA = − |
= − |
= |
− |
1 |
[ 100%] |
|||||
|
pT−pKa |
||||||||||
|
C(HA) |
+ |
+10 |
||||||||
|
[H3O |
] + K a |
1 |
||||||||
162

Химические методы анализа
Если 10pT−pKa >>1, то ∆HA = −10pKa −pH [ 100%]
Формула для расчёта основной погрешности выводится аналогичным образом и выглядит следующим образом
|
∆B = − |
1 |
[ 100%] |
||||
|
1 +10 |
pK |
BH |
+ −pT |
|||
или в упрощённом виде
∆B = −10pT−pKBH+ [100%]
Пример 13.1. Рассчитать систематическую индикаторную погрешность титрования 0,1 М HCl и 0,1 М HCOOH при использовании в качестве титранта 0,1 М NaOH и индикатора метилового оранжевого (рТ = 4).
В случае HCl титрование заканчивается при рН меньшем (4), чем рН в точке эквивалентности (7), поэтому имеет место водородная индикаторная погрешность. Поскольку в конечной точке титрования определяемое вещество будет недотитровано, величина систематической индикаторной погрешности будет отрицательной
∆H+ = −2 1 10−4 100% = −0,2% 0,1
При титровании HCOOH в конечной точке титрования будет оставаться неоттитрованная слабая кислота, поэтому в данном случае будет кислотная индикаторная погрешность.
|
∆HA = − |
1 |
100% |
= −36% |
|
|
+100,25 |
||||
|
1 |
Совершенно очевидно, что метиловый оранжевый не может быть использован для обнаружения конечной точки титрования раствора HCOOH раствором NaOH.
Даже в том случае, если систематическая индикаторная погрешность равна 0 (pHэкв = рТ), всё равно будет иметься случайная погрешность визуального обнаружения конечной точки титрования с помощью индикатора. Вследствие физиологических особенностей нашего зрения рТ индикатора можно определить лишь с неопределённостью примерно ± 0,4 ед. рН. Величина случайной индикаторной погрешности зависит от крутизны скачка титрования — чем она больше, тем случайная погрешность меньше. Индекс крутизны скачка титрования рассчитывается следующим образом:
163

Раздел 2
η = dpHdf ≈ ∆∆рНf
При титровании слабых кислот (оснований) крутизна скачка титрования меньше, следовательно, случайная индикаторная погрешность больше, чем при титровании сильных кислот (оснований) (рис 13.5). Для 0,1 М сильных кислот и оснований величина случайной индикаторной погрешности составляет ±2 10-7. По мере уменьшения силы кислоты (основания) и концентрации случайная погрешность увеличивается.
|
pH |
|||
|
10 |
|||
|
9 |
|||
|
8 |
|||
|
7 |
1 |
||
|
6 |
|||
|
5 |
|||
|
4 |
2 |
||
|
3 |
f |
||
|
0,99 |
1 |
1,01 |
Рис. 13.5. Влияние крутизны скачка титрования на случайную индикатор-
ную погрешность: 1 – 0,1 М HCOOH; 2 – 0,1 М HCl
В виде полосы показана область неопределённости обнаружения конечной точки титрования для индикатора, имеющего рТ 8
13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
Анализ смеси карбоната и гидроксида, карбоната и гидрокарбоната щелочного металла с применением двух индикаторов
При титровании смеси гидроксида и карбоната щелочного металла, например, NaOH и Na2CO3 и обнаружении конечной точки титрования с помощью фенолфталеина протекают реакции:
NaOH + HCl → NaCl + H2O
Na2CO3 + HCl → NaHCO3 + NaCl,
При обнаружении конечной точки титрования с помощью метилового оранжевого реакция взаимодействия гидроксида натрия с кислотой протекает точно также, а карбонат натрия титруется до уголь-
164

Химические методы анализа
ной кислоты. Разность между объёмами раствора титранта, израсходованного для титрования смеси в присутствии метилового оранжевого и фенолфталеина, будет соответствовать протеканию реакции:
NaHCO3 + HCl → H2CO3 + NaCl
Фактор эквивалентности NaHCO3 в данной реакции равен 1. Если принять, что NaHCO3 в исходной смеси не было, то n(NaHCO3) = n0(Na2CO3) и массу карбоната натрия можно рассчитать следующим образом
m(Na2CO3) = C(HCl) (VМО – VФ) 10-3 M(Na2CO3)
Для взаимодействия с NaOH, находящимся в анализируемой пробе, будет расходоваться объём стандартного раствора титранта
равный VФ – (VМО – VФ) = 2VФ — VМО, поэтому массу NaOH рассчитывают по следующей формуле
m(NaOH) = C(HCl) (2VФ – VМО) 10-3 M(NaOH)
Если на титрование смеси щелочи и карбоната с фенолфталеином и метиловым оранжевым затрачивается практически одинаковый объём стандартного раствора титранта, то содержание карбоната в смеси очень мало. Напротив, если объёмы раствора титранта, затраченные для титрования, значительно отличаются, то в анализируемой смеси содержится много карбоната
Анализ смеси гидрокарбоната и карбоната щелочного металла титрованием её раствором сильной кислоты в присутствии двух индикаторов основан на том же принципе, что и анализ смеси гидроксида и карбоната. При титровании смеси с фенолфталеином с титрантом взаимодействует лишь карбонат
Na2CO3 + HCl → NaHCO3 + NaCl
С метиловым оранжевым титруются и карбонат и гидрокарбонат. По объёму раствора HCl, затраченному для титрования с фенолфталеином, можно рассчитать содержание Na2CO3 (fэкв = 1), а по разности между объёмом раствора HCl, затраченным для титрования с метиловым оранжевым и удвоенным объёмом, затраченным для титрования с фенолфталеином — содержание NaHCO3:
m(Na2CO3) = C(HCl) VФ 10-3 M(Na2CO3) m(NaHCO3) = C(HCl) (VМО – 2VФ) 10-3 M(NaHCO3)
Чем больше титранта требуется для титрования с фенолфталеином, тем больше карбоната содержится в анализируемой пробе. Если при добавлении к титруемому раствору фенолфталеина последний окрашивается в слабо розовый цвет и для его обесцвечивания требуется лишь несколько капель раствора титранта, то содержание карбоната в пробе очень мало.
165

Раздел 2
Определение азота в органических соединениях по Кьельдалю и ионов аммония
Определение азота в органических соединениях методом Кьельдаля проводят следующим образом (устройство прибора показано на рис. 13.6). Точную навеску анализируемого образца помещают в колбу Кьедьдаля и подвергают минерализации с помощью концентрированной серной кислоты, к которой добавлены K2SO4 и СuSO4, а в некоторых случаях ещё и селен или HgO. В процессе окисления органической части молекулы азот восстанавливается до иона аммония. По-
|
сле окончания минерализации к раство- |
||||
|
ру добавляют NaOH. При этом образу- |
||||
|
ется NH3, который отгоняют и погло- |
||||
|
щают раствором H3BO3 или стандарт- |
||||
|
ным раствором сильной кислоты (H2SO4 |
||||
|
или HCl). В первом случае при взаимо- |
||||
|
действии борной кислоты с аммиаком |
||||
|
образуется эквивалентное NH3 количе- |
||||
|
ство иона BO2—, который затем титруют |
||||
|
стандартным раствором HCl (титрова- |
||||
|
ние заместителя). Во втором случае оп- |
||||
|
ределяют избыток сильной кислоты, не |
||||
|
вступивший в реакцию с NH3, титруя |
||||
|
Рис. 13.6. Прибор для определе- |
раствор стандартным раствором NaOH |
|||
|
ния азота в органических соеди- |
(обратное титрование). |
|||
|
нениях (по ГФ XI) |
Обычный метод Кьельдаля ис- |
|||
|
1 – парообразователь; 2 – колба |
пользуют для органических соединений, |
|||
|
Кьельдаля; 3 – воронка для вво- |
содержащих аминный азот (амины, |
|||
|
да щелочи; 4 – брызгоуловитель; |
аминокислоты и т.д.). Для определения |
|||
|
5 – холодильник; 6 — приёмник |
||||
|
азота в нитратах, нитритах, нитросоеди- |
нениях и т.п. необходимо ещё предварительное восстановление данных азотсодержащих групп до иона аммония или аминогруппы.
Методику, похожую на описанную выше, можно использовать также и для веществ, которые легко гидролизуются с образованием аммиака или аминов. Такие вещества не подвергают минерализации, а сразу проводят их щелочной гидролиз. Например, определение азота в соединении (1) требует обязательной минерализации, а для соединения (2) достаточно щелочного гидролиза.
|
O |
O |
||
|
C |
NH |
C |
NH2 |
|
(1) |
(2) |
||
|
OH |
OH |
166
Химические методы анализа
Ион аммония является достаточно слабой кислотой (pKa = 9,24), поэтому его прямое титриметрическое определение при концентрации в водном растворе, например, 0,1 моль/л, невозможно.
ОПРЕДЕЛЕНИЕ NH4
|
формальдегидный способ |
обратное титрование |
||||||||||
|
(титрование заместителя) |
|||||||||||
|
+ |
∆ |
||||||||||
|
+ 6CH2O → (CH2)6N4 + |
+ |
NH |
+ |
+ OH |
— |
↑ + H O |
|||||
|
4NH4 |
4H + 6H2O |
4 |
→ NH |
||||||||
|
3 |
2 |
||||||||||
|
титруют стандартным раствором |
избыток щелочи, не вступивший в |
||||||||||
|
щёлочи в присутствии фенолфталеина |
реакцию, титруют стандартным |
||||||||||
|
раствором сильной кислоты |
Определение борной кислоты
Борная кислота является слабой одноосновной кислотой (pKa ≈ 9,3). Её кислотные свойства обусловлены реакцией:
B(OH)3 + 2H2O î [B(OH)4]— + H3O+
Борная кислота является слишком слабой для того, чтобы её можно было с удовлетворительной погрешностью оттитровать щелочью в водном растворе. Однако, она может взаимодействовать с органическими веществами, в состав которых входит α-диольная группа (глицерин, глюкоза, фруктоза, маннит, сорбит и др.), с образованием более сильных комплексных кислот (например, у маннитборной кислоты pKa = 5,3). Последние могут быть оттитрованы раствором щёлочи в присутствии фенолфталеина.
|
C |
OH |
C |
O |
O |
C |
+ H |
O+ + 2H O |
|||||||||||||||||
|
2 |
+ B(OH) |
î |
B |
|||||||||||||||||||||
|
C |
OH |
3 |
3 |
2 |
||||||||||||||||||||
|
C |
O |
O |
C |
|||||||||||||||||||||
Наиболее часто используемым на практике комплексообразователем при определении борной кислоты является глицерин, хотя по сравнению, например, с маннитом или моносахаридами данное вещество является менее активным комплексообразующим реагентом. Кроме того, глицерин очень вязкий и работать с ним неудобно. Глицерин, используемый в лаборатории, может содержать примеси кислот. Перед применением его необходимо нейтрализовать раствором щёлочи до появления слабо-розового окрашивания фенолфталеина.
167
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
I вариант.
1. Что изучает аналитическая химия?
а) Изучает соединения с углеродом различных элементов, а также их свойства и методы определения
б) Это наука о методах идентификации и обнаружения элементов и их соединений+
в) Наука о законах строения, структуры и превращения химических веществ
2. Что из перечисленного не является химическим методом анализа?
а) Гравиметрия
б) Титриметрия
в) Рентгенография+
3. В чем состоит особенность сильных электролитов?
а) Степень диссоциации более 30 % +
б) Степень диссоциации стремиться к нулю
в) Степень диссоциации находится в пределах 5-30 %
4. Чему равно ионное произведение воды?
а) 10-14 +
б) 14
в) < 1
5. Что такое буферная емкость раствора?
а) Это предельное количество воды, которые можно прибавить к данному буферу, с изменения его рН не более, чем на 1
б) Это предельное количество кислоты или основания, которые можно прибавить к данному буферу с изменением рН не более 10 %
в) Это предельное количество кислоты или основания, которые можно прибавить к данному буферу без изменения его рН +
6. Какая из приведенных формул соответствует расчету рН?
а) pH = 14 -[OH–]
б) pH= -lg[H+] +
в) рН= -lg[OH–]
7. Гидролиз – это процесс:
а) растворения в воде
б) взаимодействия ионов растворенных в воде соли с ионами воды +
в) растворения в воде под действием тока
8. Как снизить ошибку титрования?
а) Максимально растянуть величину скачка и правильно подобрать индикатор +
б) Сделать несколько раз титрование
в) При титровании применять более концентрированные растворы
9. Что такое конечная точка титрования?
а) Момент или точка титрования, в которой некоторое свойство раствора (например, окраска) претерпевает заметное изменение +
б) Это точка титрования, при которой добавлен избыток титранта
в) Это точка титрования, при которой достигнут рН=7
10. Условие, при котором выпадает осадок:
а) Если ионное произведение меньше величины произведения растворимости
б) Если ионное произведение превышает величину произведения растворимости +
в) Если ионное произведение равно величине произведения растворимости
11. Что такое декантация?
а) Укрепление дисперсных частиц, с последующим перенесением на фильтр
б) Промывание осадка, перенесенного на фильтр
в) Промывание осадка в стакане с отстаиванием и сливанием жидкости с раствора +
12. В каком из ниже перечисленных методов рабочим раствором является раствор соли ртути?
а) Аргентометрия
б) Роданометрия
в) Меркуриметрия +
13. Какое из ниже приведенных названий не соответствует трилону Б?
а) Хелатон III
б) Комплексон II +
в) ЭДТА
14. Что из перечисленного не является металлоиндикатором?
а) Мурексид
б) Метиленовый голубой +
в) Эрихром чёрный Т
15. Какой из реагентов не используют при щелочном сплавлении?
а) Пиросульфат калия +
б) Едкий натр
в) Кальцинированную соду
16. Что такое маскирование?
а) Осаждение мешающих веществ с последующим отделением осадка
б) Перевод определяемого вещества в более удобную для анализа форму
в) Устранение влияния присутствующих в растворе веществ на определение какого-либо элемента+
17. Какой может быть ошибка определения?
а) Постоянной
б) Временной
в) Систематической+
18. Что такое точность анализа?
а) Близость результатов друг к другу из выборки n
б) Это значение, до которого необходимо округлить полученный результат
в) Это качественная характеристика близости к нулю всех видов ошибок+
19. Что такое воспроизводимость?
а) Эта мера того, как повторяются результаты при многократном проведении анализа+
б) Параметр, характеризующий близость экспериментальных и истинных значений измеряемой величины
в) Это минимальное расхождение между результатами, полученными при испытании одной пробы
20. В каком из случаев используют метод добавок?
а) При больших концентрациях элементов
б) При малых концентрациях элементов+
в) При невозможности использования метода сравнения
II вариант.
1. Как выбрать длину волны при проведении фотометрических определений?
а) Измерения проводят при длине волны, соответствующей максимуму поглощения+
б) Измерения проводят при длине волны, соответствующей минимуму поглощения
в) Измерения проводят при любой длине волны при условии, что прибор измерит данную оптическую плотность
2. В каких координатах строят калибровочный график?
а) Оптическая плотность – длина волны
б) Аналитический сигнал – концентрация+
в) Объем раствора – концентрация
3. Какая из горючих смесей, используемых в атомно-абсорбционной спектроскопии, дает наибольшую температуру?
а) Ацетилен – воздух
б) Закись азота – ацетилен+
в) Пропан – воздух
4. Что определяют методом пламенно-эмиссионной спектрометрии?
а) Содержание тугоплавких элементов
б) Содержание тяжелых металлов
в) Содержание щелочных металлов+
5. На чем основан потенциометрический метод?
а) На измерении разности потенциалов между электродами+
б) На измерении ЭДС
в) На измерении концентрации определяемого иона в растворе
6. Что такое хроматография?
а) Метод определения массы вещества, полученного на погруженном в раствор электроде
б) Метод анализа, основанный на исследовании взаимодействия излучения с атомами и молекулами вещества
в) Метод разделения веществ, основанный на распределении компонентов между двумя фазами подвижной и неподвижной+
7. Фактор пересчета в гравиметрическом анализе – это:
а) пересчет определяемого вещества на сухое состояние
б) сколько граммов определяемого вещества содержится в 1 г осадка+
в) отличие количества полученного осадка от теоретического выхода
8. Какой крепости получится кислота при смешении 2 кг 50% H2SO4 и 1 кг 20%?
а) 40 %+
б) 35 %
в) 45 %
9. Что такое стандартизация раствора?
а) Это установление его точной концентрации+
б) Приготовление раствора из стандарта
в) Установление срока годности раствора
10. Пробу массой m высушили и масса высушенной пробы m1, какой формулой воспользоваться для расчета влаги в %:
а) m1*100/ m
б) m*100/ m1
в) (m – m1)*100/ m+
11. У.Бергман:
а) основатель качественного анализа
б) основатель химической науки
в) основатель количественного анализа
г) предложил колориметрический метод анализа
д) разработал основы систематического анализа катионов металлов+
12. Что такое инструментальные индикаторы?
а) средства качественного определения степени мешающего влияния сопутствующих веществ на определение данного вещества
б) предельная селективность
в) количественная характеристика селективности
г)приборы, фиксирующие рН, окислительно-восстановительный потенциал, электрическую проводимость раствора или другие свойства среды.+
13. Пробоотборным устройством является:
а) биосенсор
б) барометр
в) батометр+
г) фотометр
14. Что из представленного является методом проведения качественного анализа?
а) дробный анализ+
б) гравиметрический метод
в) титрования
г) биохимический
15. Что такое относительная масса структурного элемента вещества, эквивалентная в химической реакций одному атому водорода или одному электрону?
а) молярная атомная масса
б) моль
в) относительная эквивалентная масса (эквивалент)+
г) молярная эквивалентная масса (грамм/эквивалент)
16. Отметьте метод количественного анализа, не используемый в хромотографии:
а) абсолютная калибровка
б) внутренняя нормализация
в) внутренного стандарта
г) метод осаждения+
17. Что служит индикатором в йодометрии?
а) свежеприготовленный 3% раствор гидроксида меди (II)
б) свежеприготовленный 1% раствор уксусной кислоты
в) свежеприготовленный 2% раствор гидроксида кальция (II)
г) свежеприготовленный 1% раствор крахмала+
18. Какое соединение образуется в результате двух процессов комплексообразования и адсорбции в йодометрии?
а) красного цвета
б) синего цвета+
в) зеленого цвета
г) фиолетового цвета
19. Выберите типы стандартных рабочих растворов используют в титриметрическом анализе:
а) вторичный/третичный
б) первичный/третичный
в) первичный/четвертичный
г) первичный/вторичный+
20.Условная или реальная частица, которая может присоединять, высвобождать, замещать один ион водорода в кислотно-основных реакциях или быть эквивалентна одному электрону в окислительно-восстановительных реакциях это:
а) эквивалент+
б) моль
в) титрант
г) аликвот
Погрешности титрования
Методика титриметрического анализа многостадийна, погрешности могут возникать на любой стадии её проведения: при измерении массы навески, объёма приготовленного раствора или аликвоты, при проведении титрования, обнаружении конечной точки титрования. В зависимости от причины возникновения погрешности в титриметрических методах анализа, как и погрешности вообще, могут быть:
К появлению систематических погрешностей в титриметрических методах анализа может приводить:
· использование неверно градуированной посуды;
· неправильная техника титрования (слишком быстрое добавление титранта);
· неточное считывание объёма титранта, израсходованного для титрования;

Погрешности, обусловленные несовпадением точки эквивалентности и рТ индикатора, называются индикаторными.
Индикаторные погрешности в кислотно-основном титровании удобно разделить на 4 вида:
Водородная индикаторная погрешность может возникнуть при недотитровании сильной кислоты (в таком случае погрешность отрицательная) либо когда сильная кислота используется в качестве титранта и добавлена в избытке (положительная погрешность).
Если концентрации титруемого вещества и титранта одинаковы, то Vконечн = 2V, тогда
Гидроксидная погрешность может возникнуть при недотитровании сильного основания (отрицательная погрешность) либо в том случае, когда сильное основание используется в качестве титранта и добавлено в избытке (положительная погрешность).
Кислотная и основная индикаторные погрешности могут быть только отрицательными (если, конечно, исключить гипотетический случай использования слабой кислоты или основания в качестве титранта).
Величина кислотной погрешности представляет собой молярную долю неоттитрованной кислоты.
Если 
Формула для расчёта основной погрешности выводится аналогичным образом и выглядит следующим образом
или в упрощённом виде
Пример 13.1.Рассчитать систематическую индикаторную погрешность титрования 0,1 М HCl и 0,1 М HCOOH при использовании в качестве титранта 0,1 М NaOH и индикатора метилового оранжевого (рТ = 4).
В случае HCl титрование заканчивается при рН меньшем (4), чем рН в точке эквивалентности (7), поэтому имеет место водородная индикаторная погрешность. Поскольку в конечной точке титрования определяемое вещество будет недотитровано, величина систематической индикаторной погрешности будет отрицательной
При титровании HCOOH в конечной точке титрования будет оставаться неоттитрованная слабая кислота, поэтому в данном случае будет кислотная индикаторная погрешность.
Совершенно очевидно, что метиловый оранжевый не может быть использован для обнаружения конечной точки титрования раствора HCOOH раствором NaOH.
Даже в том случае, если систематическая индикаторная погрешность равна 0 (pHэкв = рТ), всё равно будет иметься случайная погрешность визуального обнаружения конечной точки титрования с помощью индикатора. Вследствие физиологических особенностей нашего зрения рТ индикатора можно определить лишь с неопределённостью примерно ± 0,4 ед. рН. Величина случайной индикаторной погрешности зависит от крутизны скачка титрования — чем она больше, тем случайная погрешность меньше. Индекс крутизны скачка титрования рассчитывается следующим образом:
При титровании слабых кислот (оснований) крутизна скачка титрования меньше, следовательно, случайная индикаторная погрешность больше, чем при титровании сильных кислот (оснований) (рис 13.5). Для 0,1 М сильных кислот и оснований величина случайной индикаторной погрешности составляет ±2×10 -7 . По мере уменьшения силы кислоты (основания) и концентрации случайная погрешность увеличивается.
Рис. 13.5. Влияние крутизны скачка титрования на случайную индикаторную погрешность: 1 – 0,1 М HCOOH; 2 – 0,1 М HCl
В виде полосы показана область неопределённости обнаружения конечной точки титрования для индикатора, имеющего рТ 8
13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
Анализ смеси карбоната и гидроксида, карбоната и гидрокарбоната щелочного металла с применением двух индикаторов
При титровании смеси гидроксида и карбоната щелочного металла, например, NaOH и Na2CO3 и обнаружении конечной точки титрования с помощью фенолфталеина протекают реакции:
NaOH + HCl ® NaCl + H2O
При обнаружении конечной точки титрования с помощью метилового оранжевого реакция взаимодействия гидроксида натрия с кислотой протекает точно также, а карбонат натрия титруется до угольной кислоты. Разность между объёмами раствора титранта, израсходованного для титрования смеси в присутствии метилового оранжевого и фенолфталеина, будет соответствовать протеканию реакции:
Фактор эквивалентности NaHCO3 в данной реакции равен 1. Если принять, что NaHCO3 в исходной смеси не было, то n(NaHCO3) = n(Na2CO3) и массу карбоната натрия можно рассчитать следующим образом

Для взаимодействия с NaOH, находящимся в анализируемой пробе, будет расходоваться объём стандартного раствора титранта равный VФ – (VМО – VФ) = 2VФ — VМО, поэтому массу NaOH рассчитывают по следующей формуле
Если на титрование смеси щелочи и карбоната с фенолфталеином и метиловым оранжевым затрачивается практически одинаковый объём стандартного раствора титранта, то содержание карбоната в смеси очень мало. Напротив, если объёмы раствора титранта, затраченные для титрования, значительно отличаются, то в анализируемой смеси содержится много карбоната
Анализ смеси гидрокарбоната и карбоната щелочного металла титрованием её раствором сильной кислоты в присутствии двух индикаторов основан на том же принципе, что и анализ смеси гидроксида и карбоната. При титровании смеси с фенолфталеином с титрантом взаимодействует лишь карбонат
С метиловым оранжевым титруются и карбонат и гидрокарбонат. По объёму раствора HCl, затраченному для титрования с фенолфталеином, можно рассчитать содержание Na2CO3 (fэкв = 1), а по разности между объёмом раствора HCl, затраченным для титрования с метиловым оранжевым и удвоенным объёмом, затраченным для титрования с фенолфталеином — содержание NaHCO3:
Чем больше титранта требуется для титрования с фенолфталеином, тем больше карбоната содержится в анализируемой пробе. Если при добавлении к титруемому раствору фенолфталеина последний окрашивается в слабо розовый цвет и для его обесцвечивания требуется лишь несколько капель раствора титранта, то содержание карбоната в пробе очень мало.
Определение азота в органических соединениях по Кьельдалю и ионов аммония
Читайте также:
- II. Погрешности измерений, обработка результатов, выбор средств измерений.
- Абсолютные и относительные погрешности
- Аддитивные погрешности
- Анализ составляющих погрешности измерительного канала
- Вопрос № 3. Оценка погрешности измерений
- Вычисление элементов эллипса погрешности при ОМС по 2-м навигационным параметрам.
- Измерения и их погрешности
- Индикаторные погрешности
- Истинное и действительное значение физической величины. Погрешность результата измерения. Причины возникновения погрешности.
- Какие погрешности и почему возникают при нарушении принципа постоянства баз.

Определение азота в органических соединениях методом Кьельдаля проводят следующим образом (устройство прибора показано на рис. 13.6). Точную навеску анализируемого образца помещают в колбу Кьедьдаля и подвергают минерализации с помощью концентрированной серной кислоты, к которой добавлены K2SO4 и СuSO4, а в некоторых случаях ещё и селен или HgO. В процессе окисления органической части молекулы азот восстанавливается до иона аммония. После окончания минерализации к раствору добавляют NaOH. При этом образуется NH3, который отгоняют и поглощают раствором H3BO3 или стандартным раствором сильной кислоты (H2SO4 или HCl). В первом случае при взаимодействии борной кислоты с аммиаком образуется эквивалентное NH3 количество иона BO2 — , который затем титруют стандартным раствором HCl (титрование заместителя). Во втором случае определяют избыток сильной кислоты, не вступивший в реакцию с NH3, титруя раствор стандартным раствором NaOH (обратное титрование).
Обычный метод Кьельдаля используют для органических соединений, содержащих аминный азот (амины, аминокислоты и т.д.). Для определения азота в нитратах, нитритах, нитросоединениях и т.п. необходимо ещё предварительное восстановление данных азотсодержащих групп до иона аммония или аминогруппы.
Методику, похожую на описанную выше, можно использовать также и для веществ, которые легко гидролизуются с образованием аммиака или аминов. Такие вещества не подвергают минерализации, а сразу проводят их щелочной гидролиз. Например, определение азота в соединении (1) требует обязательной минерализации, а для соединения (2) достаточно щелочного гидролиза.
Ион аммония является достаточно слабой кислотой (pKa = 9,24), поэтому его прямое титриметрическое определение при концентрации в водном растворе, например, 0,1 моль/л, невозможно.
Определение борной кислоты
Борная кислота является слабой одноосновной кислотой (pKa » 9,3). Её кислотные свойства обусловлены реакцией:
Борная кислота является слишком слабой для того, чтобы её можно было с удовлетворительной погрешностью оттитровать щелочью в водном растворе. Однако, она может взаимодействовать с органическими веществами, в состав которых входит a-диольная группа (глицерин, глюкоза, фруктоза, маннит, сорбит и др.), с образованием более сильных комплексных кислот (например, у маннитборной кислоты pKa = 5,3). Последние могут быть оттитрованы раствором щёлочи в присутствии фенолфталеина.
Наиболее часто используемым на практике комплексообразователем при определении борной кислоты является глицерин, хотя по сравнению, например, с маннитом или моносахаридами данное вещество является менее активным комплексообразующим реагентом. Кроме того, глицерин очень вязкий и работать с ним неудобно. Глицерин, используемый в лаборатории, может содержать примеси кислот. Перед применением его необходимо нейтрализовать раствором щёлочи до появления слабо-розового окрашивания фенолфталеина.
Дата добавления: 2015-08-05 ; просмотров: 13 ; Нарушение авторских прав
Источник
Лекция 15. Кислотная и основная индикаторные погрешности титрования
Ключевые слова:показатель титрования индикатора, рН в точке эквивалентности,
кислотная индикаторная погрешность титрования, основная индикаторная
Кислотная погрешность (δHA)вызвана присутствием в растворе недотитрованной слабой кислоты и имеет отрицательное значение. Для вычисления кислотной погрешности составим выражение для константы диссоциации слабой кислоты и преобразуем это выражение:
НА 
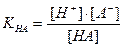
Поскольку НА кислота слабая, концентрация недиссоциированных молекул кислоты — [НА] — практически равна общей концентрации свободной кислоты в растворе. Величина [А − ] равна концентрации полученной соли. В результате нейтрализации 1 моля кислоты образуется 1 моль соли. Следовательно, отношение [НА]/[А − ] можно рассматривать как отношение концентрации неоттитрованной части кислоты к оттитрованной ее части, и оно позволяет оценить величину кислотной ошибки титрования (δНА). Поскольку [Н + ]=10 −р T , а KНА=10 −рК , из приведенного выше уравнения находим
δ
Если титрование необходимо провести так, чтобы индикаторная ошибка титрования не превышала 0,1%, то есть чтобы оставшаяся неоттитрованная кислота составляла не более 0,001 от количества оттитрованной кислоты, нужно, чтобы 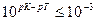
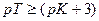
Значит, в тех случаях, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только при условии, если величина показателя титрования индикатора рТ не менее, чем на 3 единицы, превышает величину показателя диссоциации кислоты рК.
Например, достаточно точно оттитровать уксусную кислоту (рКкисл=4,73) можно только при применении таких индикаторов, показатель титрования которых рТ≥7,73. Значит, ни метиловый оранжевый (рТ≈4), ни метиловый красный (рТ≈5,5), ни лакмус (рТ≈7) не подходят. Наоборот, фенолфталеин (рТ≈9) можно использовать для титрования уксусной кислоты щелочью.
Величина кислотной погрешности в процентах (%) представляет собой молярную долю неоттитрованной кислоты и может быть рассчитана через соотношение
δНА(%) = 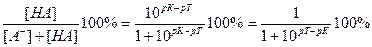
Основная погрешность титрования(δМеОН) вызвана присутствием в растворе недотитрованного слабого основания, как правило, имеет отрицательное значение. Учитывая диссоциацию слабого основания, составим выражение для константы диссоциации и преобразуем его.
МеОН 
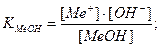
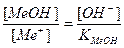
δМеОН = 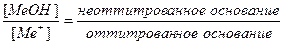
В конце титрования рН = рТ, а рОН =(14−рТ), и [OH — ] = 10 -(14- pT ) . Следовательно: δ
Достаточно точным титрование может быть при условии, если δМеОН-ошибка равна или меньше величины 10 −3 , то есть если 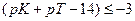
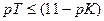
Величина основной погрешности в процентах (δМеОН(%)) представляет собой молярную долю неоттитрованного основания и может быть рассчитана через соотношение
δМеОН(%) = 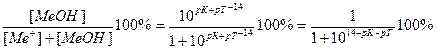
Пример 1. Вычислить ошибку титрования 0,1 н. раствора уксусной кислоты 0,1 н. раствором гидроксида натрия с индикаторами: а) метиловым оранжевым; б) фенолфталеином.
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 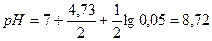
А. Титрование с метиловым оранжевым заканчивается при рН≈4. По окончании титрования в растворе будет присутствовать избыточная уксусная кислота СН3СООН. А так как это кислота слабая, она вызовет δНА-ошибку:
δ 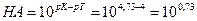
Это значит, что неоттитрованная часть уксусной кислоты относится к оттитрованной ее части, как 5,4 к 1. Другими словами, из 6,4 части первоначально взятой СН3СООН остаются неоттитрованными 5,4 части. Отсюда легко вычислить δНА-ошибку в процентах, составив пропорцию:
5,4 − х% . Следовательно: δНА(%) = 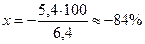
Вывод — титровать уксусную кислоту с метилоранжем нельзя. Тот же вывод можно получить без вычислений, применяя соотношение рТ≥(рК+3). Можно использовать индикаторы, для которых рТ≥ (4,76 + 3) = 7,76. Для метилоранжа это условие не выполняется: рТ≈4 − -ошибка:
δ 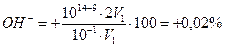
Фенолфталеин можно использовать для титрования уксусной кислоты щелочью.
Пример 2. Чему равна индикаторная ошибка титрования 0,1 н раствора NН4ОН 0,1 н раствором НСl с индикаторами: а) фенолфталеином, б) метиловым оранжевым?
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 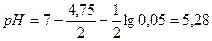
А. Титрование с фенолфталеином заканчивается при рН≈9; в растворе по окончании титрования будет некоторый избыток NН4ОН. Поэтому в данном случае возникает δМеОН-ошибка: δ 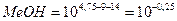
Следовательно, из 1,56 весовых частей первоначально взятого NН4ОН не оттитрованными остаются 0,56 весовой части. Составим и решим пропорцию:
0,56 — х% Следовательно: δМеОН(%) = 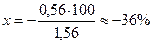
Индикатор фенолфталеин непригоден для титрования гидроксида аммония сильной кислотой. Тот же вывод получаем при применении соотношения для индикаторов: рТ≤(11−pK) = 11 – 4,76 = 6,24.
Тогда как для фенолфталеина рТ≈9 > 6,24.
Б. В случае титрования NН4ОН с метиловым оранжевым титрование заканчивается при рН≈4,0 вместо рН=5,28. В этом случае возникает δН + -ошибка: δ 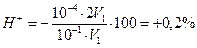
Контрольные вопросы
1.В каком титровании возникает кислотная индикаторная погрешность?
2.В каком титровании возникает основная индикаторная погрешность?
3.Как рассчитывается кислотная индикаторная погрешность?
4.Как рассчитывается основная индикаторная погрешность?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. — М.: Дрофа, 2005. — С. 139 – 140, 149 – 151.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.123 — 125.
Источник
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 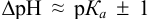
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 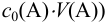
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
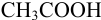
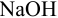
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
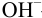
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 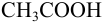



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 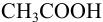
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 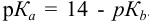
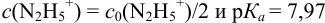
Сравнивая рТ индикаторов и 
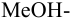
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 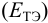

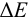
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 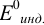
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 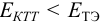
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 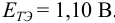
Выберем для рассмотрения порядка расчета два индикатора:
а) с 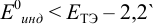
б) с 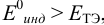
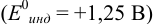
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
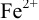



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

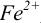
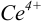
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 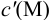
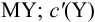
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 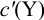
Вблизи ТЭ 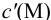
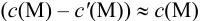
следовательно:
Выражение (8.21) тождественно выражению: 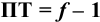
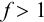
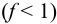
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
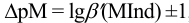
Интервал перехода окраски 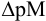
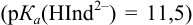
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 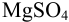

Решение:
В данных условиях 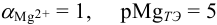
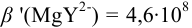
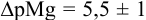
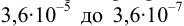

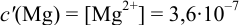
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 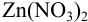

Решение:
1. Рассчитаем условную константу 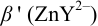
Общие константы устойчивости для аммиачных комплексов 
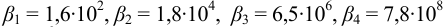

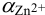
По табл. 7 и табл. 4 приложения находим 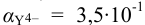
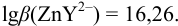

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 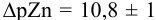
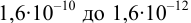

2. Конечная точка титрования наступает при [
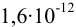

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:



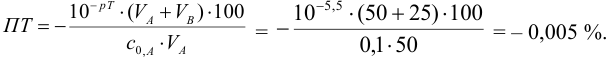
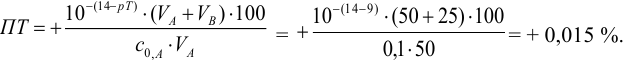
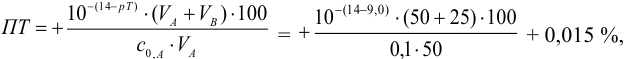
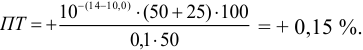
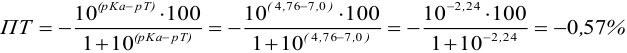
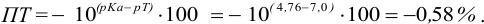
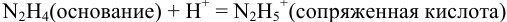
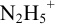
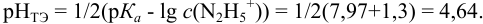
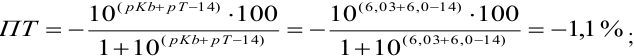
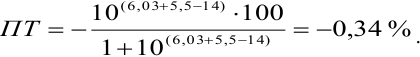

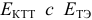 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.