Добрый день, дорогие друзья! Я рад вас слышать. Точнее я рад вас видеть, и рад, что вы меня видите и слышите в нашем эфире. Сегодняшняя тема у нас была запланирована как продолжение прошлой о невынашивании беременности, но в этот план немножко вмешались события, которые происходят сейчас в Денвере. Вы знаете, что сейчас проходит большая конференция американского общества репродукции человека. И на прошлой неделе, точнее даже не на прошлой неделе, а в ночь с субботы на воскресенье была онлайн-конференция, посвящённая преимплантационной генетической диагностике, точнее преимплантационному генетическому тестированию, как это сейчас предлагается называть. И я посчитал, что мы должны по горячим следам на эту тему поговорить.
Преимплантационная диагностика
Итак, преимплантационная диагностика, схватка над чашкой Петри — the fight over the Petri dish. Это не мое выражение, а Джудит Дар, специалиста по биоэтике, которая давно работает в комитете по биоэтике при Американской ассоциации по репродукции человека. Она так назвала те события, которые происходят сейчас.
Мне хотелось бы немного рассказать об истории вопроса, прежде чем мы перейдём к разбору тех дискуссий, которые проходили в Денвере в 5 часов 15 минут по горному времени и в 2 часа 15 минут по московскому времени. Но я абсолютно не жалею о том времени, о той бессонной ночи, когда я смотрел в прямом эфире эту интереснейшую дискуссию. Итак, преимплантационная диагностика. Что это такое?
Механизм редукционного деления
Основной механизм: когда хромосомные сбои возникают у эмбриона в момент оплодотворения, это проблемы, связанные со сбоем, с неправильным течением мейоза. Это так называемое редукционное деление, которое лежит в основе созревания половых клеток – яйцеклеток и сперматозоидов. Вначале проходит первое деление, и хромосомный набор удваивается, потом проходит два последовательных деления, в результате которых получается яйцеклетка с 23 хромосомами и два полярных тельца, которые не участвуют в процессе репродукции. А при созревании сперматозоидов, материнская клетка даёт начало четырём сперматозоидам, в каждом из сперматозоидов имеется 23 хромосомы.
Сбои в процессе деления и его последствия
Процесс мейоза очень важен в процессе созревания половых клеток, потому что он позволяет поддерживать у потомства одинаковый по количеству и по составу набор хромосом. То есть 23 хромосомы сперматозоида встречаются с 23 хромосомами яйцеклетки и образуется новый организм, зигота, который имеет уже нормальный 46-хромосомный набор. Так бывает, если всё происходит правильно. Но в очень большом проценте случаев происходят ошибки – имеется очень высокий процент брака в процессе деления, мейоза. И в результате этого получаются сбойные сперматозоиды, сбойные яйцеклетки. Если такой сперматозоид или такая яйцеклетка участвует в процессе оплодотворения, то уже на момент зачатия возникают патологические по хромосомному набору эмбрионы, которые могут до какого-то этапа развиваться, а потом останавливаются в развитии. И если мы посмотрим на хромосомный состав эмбрионов, останавливающихся в развитии в первом триместре беременности, то около 60% из них будут иметь хромосомные сбои, которые были заложены на момент зачатия. Это так называемые мейотические сбои.
Кариотипирование плода
И тогда, поскольку это всё было известно достаточно давно, и все последующие исследования, которые проводились после Буэ и другими исследователями и в последующие годы, только подтвердили, уточнили концепцию о том, что сбои возникают именно на этапе мейоза. В очень большом проценте случаев вполне логично предположить, что если мы возьмём одну клеточку у эмбриона или несколько клеточек у эмбриона, если он уже немножко продвинулся в развитии, и если мы определим у эмбриона хромосомный набор, то уже совершенно чётко можем предполагать, какие эмбрионы хорошие, без хромосомных сбоев, а какие эмбрионы плохие.
Эти методики возникли и по сути своей развиваться начали параллельно с самой методикой ЭКО. Мы с вами знаем про нашего соотечественника, Юрия Верлинского, биолога, который в годы, предшествующие перестройке, эмигрировал в США и он начал этим заниматься – определением кариотипа развивающегося плода, ещё до того как появилась методика ЭКО. И в Чикаго он создал свой центр и предложил целый ряд методик, которые потом вошли в состав методики ЭКО, а именно различные варианты преимплантационной диагностики и на первом этапе всё было очень логично.
Как происходит определение кариотипа эмбриона?
Мы берём у эмбриона одну клетку, определяем хромосомный набор, получаем информацию о хромосомном наборе эмбриона и дальше можем разобрать хорошие и плохие эмбрионы. И дальше вы помните, как это всё было в начале 2000-х годов, в конце 90-х годов, когда методика преимплантационной диагностики только появилась, сколько надежд было связано с этой методикой. Они были ещё не такие совершенные, как сейчас и в основном проводились на трёхдневных эмбрионах. То есть на стадии, от 6 до 8 клеток у них брали одну клетку, определяли хромосомный набор и отбраковывали. А дальше хорошие эмбрионы подсаживались, первые результаты были очень обнадеживающие.
Когда методика только начала развиваться, это смотрели на малых группах, и у молодых женщин, там, где был большой выбор эмбрионов. Но когда экстраполировали на всю популяцию, оказалось, что в общем никакого увеличения процента живорождений при такой методике, когда мы смотрим хромосомный набор у трехдневного эмбриона, нет. Более того, выживаемость таких эмбрионов, у которых брали 1 клетку на стадии 6-8 клеток, была очень пониженная. Исследователи, которые смотрели большие ряды результатов, в результате такой преимплантационной диагностики пришли к выводу, что такого типа преимплантационная диагностика слишком травмирующая для эмбриона и нужно смотреть наружную, так называемую трофоэктодерму у эмбриона на более поздней стадии – пятидневной, где количество клеток составляет 20-250 клеток, и можно взять сразу несколько клеток путём пункции.
Развитие кариотипирования и преимплантационной диагностики
И постепенно с начала 2000-х годов начала развиваться методика именно определения кариотипа путём пункции трофэктодермы и определения кариотипа наружной трофэктодермы эмбриона. Мы с вами помним, что ещё где-то десять лет назад эта методика редко использовалась, потому что те методики определения кариотипа точнее диагностики анеуплоидии были недостаточно совершенными, занимали большое время, чтобы успеть подсадить этот зародыш на стадии пяти дней. Поэтому на первом этапе, когда начали производить диагностику преимплантационную первых эмбрионов, то часто эти эмбрионы криорезервировались и потом уже после разморозки шли на подсадку в следующие циклы. Потому что физически врачи-лаборанты и генетики не успевали дать результат врачам-клиницистам, которые позволили бы выбрать, какие эмбрионы хорошие, с хорошим кариотипом, какие плохие.
И вот, начиная где-то с конца нулевых и все эти десятые годы мы видели, как последовательно шло развитие преимплантационной диагностики. Метод преимплантационной диагностики всё более и более усложнялся, возникла целая индустрия, которая включает в себя не только специалистов, которые умеют делать всё, но и сложное оборудование. Цитогенетические методы были вначале заменены методами Фиш: гибридизацией энсибом. Методика Фиш была заменена микроматочным анализом, но и микроматочный анализ перестал удовлетворять специалистов.
Приход к NGS и ее механизм
Спустя какое-то время, в 16-м году международная организация PGDIS – это международная организация, которая объединяет специалистов по преимплантационной диагностике, опубликовала заявление о том, что они ответственно заявляют, что происходит переход на новую систему NGS, которая заменила собой все пять платформ, использовавшихся на Западе для преимплантационной диагностики. Этот скрининг нового поколения представляет из себя секвенирование всей ДНК, получаемой при пункции эмбриона на пятые сутки, при этом технология позволяет давать заключение по наличию или отсутствию анеуплоидии достаточно быстро. Таким образом, врачи имеют возможность при получении неправильного, аномального или положительного результата принять решение сразу, в этом же цикле.
Методика, которая предложена, и является сейчас той, которая продвигается во всём мире, но прежде всего на Западе, в США и в странах Европы предполагает пункцию пятидневного эмбриона, т.е. пункцию наружной трофэктодермы. И в результате этой пункции получается примерно 5 клеток, от 5 до 6 ядер, которые идут дальше в исследование. Таким образом, мы получаем 3 вида результатов. Один результат, когда анализ абсолютно нормальный и хромосомные аномалии не обнаружены и более, чем в 80% клеток нормальный кариотип. Второй анализ, это когда меньше чем в 20% клеток нормальный кариотип, то есть по крайней мере 4 из 5 ядер имеют хромосомные аномалии. И дальше появляются промежуточные результаты, когда процент клеток с хромосомными аномалиями составляет от 20 до 80%. Есть такая градация, которая была определена самой этой реализацией и специалистами, которые эту реализацию представляют. И эта методика получается с июля 16 года активно продвигается на Западе и активно используется во всем мире, в том числе в США.
Проблема освоения: мозаики наружной трофэктодермы
И с чем столкнулись специалисты, когда начали работать внутри этой парадигмы? Они столкнулись с проблемой мозаик наружной трофэктодермы, когда разные клетки могут иметь разный кариотип. Что может быть часть клеток с нормальным кариотипом, так называемые эуплоидные клетки, а другие будут иметь аномальный кариотип, так называемые анеуплоидные клетки. И случилась эта загвоздка, которая привела к настоящей битве титанов. Битве, как очень точно выразилась специалист по биоэтике, профессор, кто недавно написала статью с таким названием, которая вышла в августе 2018 года, над чашкой Петри. Оказалось, что по своей природе трофэктодерма является тканью с очень нестабильным процессом деления клеток. То есть мозаики являются характерной особенностью делящихся клеток трофэктодермы. И это так называемые мейотические аберрации.
Мы с вами говорили сегодня, когда начали обсуждать эту тему, что существуют мейотические аберрации, которые 100% дают начало аномальному эмбриону, которые с вероятностью более 99,5% остановятся в развитии в первом триместре. А во многих случаях даже не дойдёт до процесса имплантации. То есть даже мейотические аномалии хромосомные это те аномалии, которые закладываются либо в момент зачатия либо на самых-самых первых этапах деления зиготы. А когда мы имеем дело с подавляющим большинством случаев, так называемых мозаик трофэктодермы, это не мейотические аномалии, а митотические аномалии. Это аномалии, которые возникают в момент деления клеток трофэктодермы. Клетки делятся, они делятся быстро и должны делать экспансию, внедряться в материнский организм, дальше идти и заселять. Колонии этих клеток заселяют стенки спиральных артерий, которые питают матку.
Процесс абсолютно аналогичный процессу сперматогенеза, когда на качество можно не обращать внимания, важно как можно быстрее успеть продвинуться в этой экспансии для того, чтобы взять в дальнейшем под свой контроль материнский организм. Оказалось, что эти мозаики являются очень важной особенностью, биологической особенностью трофэктодермы, о которой ещё недавно мало что знали. Предполагали, что такое может быть, и иногда в литературе вы встретите заявления, что это бывает в 3% случаев, 5% случаев, в 1% случаев. На самом деле если внимательно смотреть весь геном трофэктодермы, то в 90% вы будете находить то или иное число клеток с мозаиками. Исходя из этого, промежуточные результаты преимплантационного тестирования являются показанием к тому, чтобы с позиции сторонников преимплантационного тестирования эти зародыши использовать дальше для подсадки.
Почему убрали слово преимплантационная диагностика относительно хромосомных аномалий?
Если мы признаем большой процент мозаик, которые могут быть внутри такого анализа, то получается, что сама диагностика неточная. То есть мы имеем дело или с преимплантационным скринингом на аномалии, который может иметь определённый процент ошибки, и ложноположительных и ложноотрицательных результатов. И также могут быть и ложноположительные и ложноотрицательные результаты в зависимости от того, в какую точку трофэктодермы попадёт пункционная игла, с помощью которой добываются эти клетки. То есть точной диагностики методика дать не может. Поэтому и ушли от слова «преимплантационная диагностика», которое до сих пор ходит внутри сообщества наших специалистов, но по-тихоньку заменяется «преимплантационным скринингом», «преимплантационным тестированием» с добавлением буквы «А» — на анеуплоидию. И врачи, то есть мы с вами, которые ведут пациентов, и которые занимаются методикой ЭКО, должны об этом знать.
Если мы получаем результат преимплантационного тестирования пятидневного эмбриона с помощью определения кариотипа трофэктодермы наружной, то мы должны понимать: определённый процент ошибок существует. И те врачи, акушеры-гинекологи, которые ведут беременность, и врачи тех клиник ЭКО, внутри которых достаточно широко применяются методы преимплантационного тестирования, сталкивались с такими ситуациями и должны об этом знать. У меня такие случаи возникают раз в несколько месяцев.
В чём сложность определения результата скрининга
Когда ко мне приходят пациентки после ЭКО и говорят: вот я пришла, сдала НИПТ. В 11-12 недель она сдаёт анализ на определение свободных витальных ДНК и определение хромосомных аберраций с помощью такого скринингового метода, который определяет 4-5 хромосом. Х, У и три основных трисомии. И вдруг оказывается, что пациентке делали преимплантационную диагностику, преимплантационное тестирование, подсадили по виду нормальный зародыш. Ей говорили, что больше ничего делать не нужно, её уверяли, что скрининга первого триместра, скрининга второго триместра, тем более какого-нибудь преимплантационного тестирования ей не нужно проводить, потому что они уверены, что хромосомный набор был нормальный.
И вот пациентки приходят все в слезах, говорят: вот я пошла, сдала и у меня идёт хромосомная аномалия. Она идёт в другое место, сдаёт и там тоже подтверждается. И дальше: я подам на них в суд, как они могли! Я успокаиваю пациентку всегда в таких случаях, потому что очень важно, чтобы пациентка понимала: здесь врач абсолютно не при чем. То есть врач и пациент в такой ситуации сталкиваются с обычной биологической проблемой. Ложноположительным или ложноотрицательным результатом, который лежит в самой основе скрининга, в самой основе методики. То есть на сегодняшний момент мы столкнулись с биологической проблемой, в том виде, в каком она используется и не даёт нам точной диагностики. И нам говорят, что вот эта методика будет заменена на другую, но пока можно её использовать.
Острый вопрос в сохранении верного зародыша
Тогда встаёт вопрос – как нам быть с пациентками более старшего возраста, которые составляют львиную долю пациенток, обращающихся в клиники ЭКО? И если мы не уверены в том, что тот кариотип, который мы получаем при преимплантационной диагностике, является правильным, значит мы можем потерять хороший зародыш, который внешне может казаться по результатам тестирования аномальным, но он даст хорошее развитие в полости матки. Эта проблема она очень серьёзная. Первое – мы имеем определённый процент ошибок, о которых врач должен понимать. Причём, ошибок не врача, не лаборатории, не самой диагностики, а ошибок из-за биологии самого эмбриона, того как развивается плацента. Развивается инвазия трофобласта. Это быстро растущая, быстро делящаяся агрессивная ткань.
И второй момент, о котором очень часто забывают врачи. А ведь получается, что у нас нет преемственности между врачом, который делал ЭКО, и врачом, который наблюдает беременность. Эти пациентки потом могут приходить в женские консультации и говорить – вот я там делала и у меня всё хорошо. Ей подсадили хороший, нормальный, правильный зародыш, но пациентке не делают тех тестов, которые должны были делать. Это пренатальный скрининг первого триместра и возможно второго триместра на хромосомные аномалии. А делать их нужно обязательно, потому что возможны коллизии, связанные с этой проблемой.
Нужна ли преимплантационная диагностика?
И вот возвращаемся к Денверу. Профессор Гляйхер в прошлом году, вернее в этом году, а это очень известный американский генетик, который заведовал кафедрой акушерства и гинекологии и занимался и иммунологией репродукции и очень глубокой генетикой, он выступил со статьей, в которой утверждает: методика несовершенна. В результате этой методики много эмбрионов потенциально нормальных не подсаживается в полость матки, и те преимущества, которые даёт преимплантационная диагностика, когда отбирается хороший хромосомный набор, внутри этих эмбрионов процент плохих эмбрионов будет гораздо меньше. Подсадка такого эмбриона даёт больший успех при имплантации и больший процент вынашивания беременности.
Профессор говорит – если «плохой эмбрион» окажется хорошим, потому что мы не в ту точку случайно попали, и его не использовали, какой у него процент имплантации? Равняется нулю, потому что мы его не довели до имплантации. И поэтому идёт большое количество медицинских центров в Америке и всё больше врачей, занимающихся ЭКО, отказываются принципиально от методики преимплантационного тестирования, скрининга на хромосомные аномалии. С точки зрения этих врачей, мы получаем неприемлемо высокий процент ошибок, которые принимаем за тактики ведения.
Два мнения об одной проблеме диагностики
Посмотрите журнал, последний номер «Fertility and sterility», «За и против преимплантационного тестирования на генетическую анеуплоидию; клиническое и лабораторное исследование». Вы знаете, со времен Войны Роз в иммунологии 2000-х я ничего подобного не видел никогда. Чтобы американское общество репродуктологии опубликовало статью, в которой два мнения идут параллельно.
Профессор Ричард Скотт, достаточно известная личность, мы можем о ней поговорить, но не сегодня. И профессор Ричард Паульсен — две совершенно разных идеи. Профессор Скотт является одним из ведущих промоутеров идеи, что преимплантационное тестирование на анеуплоидии полезно и должно проводиться в широком масштабе, всем практически своим пациенткам. В 97% случаев в его клинике идёт подсадка одного эмбриона с достаточно высокой частотой наступления беременности и вынашивания беременности до срока. Это очень известный специалист по ЭКО.
Так вот профессор Ричард Паульсен, является принципиальным и очень активным противником этой методики. И дальше, если мы спускаемся на несколько страниц, мы видим: одна колонка, левая, это сторонники, правая это специалисты, в том числе профессор Норберт Гляйхер – два совершенно противоположных мнения. И это абсолютно беспрецедентный факт. Как вы понимаете, я отслеживаю медицинскую прессу очень активно, и такого никогда не видел – идёт самая настоящая схватка. И очень важно и очень интересно, что Соединенные штаты указали на то, что в принципе, они здесь открыто могут выходить на такую дискуссию, а не кулуарно. Ведь многие вещи решаются очень закрытыми кулуарными вещами, где-то за закрытыми дверями и потом все выходят с единым решением. Здесь этого единого решения мы не видим, они позволили выйти настоящей дискуссии с предъявлением двух несовместимых и абсолютно противоречащих друг другу мнений.
«За» и «против» преимплантационной диагностики
Вот эта вот статья из августовского номера «Fertility and sterility» с огромным списком литературы. И что ещё отрадней для нас, врачей, потому что мы с вами должны понимать, о чём идет речь – то, что в рамках Денверской конференции те из нас, кто не смогли туда поехать, потому что я думаю, что часть специалистов из России наверняка там присутствует, имели возможность принять участие в онлайн-конференции и видеть практически всех участников дискуссии по поводу за и против преимплантационной диагностики, которая прошла по московскому времени в ночь с субботы на воскресенье.
Посмотрите пожалуйста, здесь мы видим участников дискуссии, здесь мы видим зал, в котором проходила вот эта конференция. И мнения сторон были абсолютно друг другу несовместимы. Те люди, которые выступали за преимплантационную диагностику, говорили, что она очень важна, хороша и позволяет повышать процент. Те люди, которые выступали против, аргументировали свою точку зрения и говорили, что в том виде, в котором она сейчас существует, она не годится, для широкого применения такая дорогостоящая методика не пригодна. В начале конференции, как и в журнале «Fertility and sterility» мы видим: левая сторона занимается сторонниками процедуры преимплантационного скрининга, а правая противниками. И здесь мы видим профессора Скотта, профессора Пальмера, профессора Гляйхера, то есть всех тех участников, которые активно публиковали статьи в защиту или против этой вот методики.
И что здесь можно сказать? Каждый из участников получил по пять минут, и в течение пяти минут должен был высказать свою точку зрения. Вот посмотрите типичный совершенно приём, который используют противники преимплантационного тестирования, посмотрите на профессора Паульсона, который держит в руках футбольный мяч. Этот футбольный мяч имеет красные пятна, остальная часть белая. Он очень хорошо демонстрирует, что мы получаем, когда проходит преимплантационная диагностика. Мы внедряемся, случайным образом абсолютно, биопсийной иглой в зону наружной трофэктодермы. И по техническим условиям, когда происходит засасывание внутрь биопсийного материала, туда попадает 5 или 6 клеток трофэктодермы, которые идут дальше для исследований.
Если мы имеем ситуацию, которую я вам описал, когда процент этих зон с анеуплоидией достаточно большой, то включается элемент случайности. Или игла попадает в абсолютно нормальную зону или игла попадает в ненормальную зону. Если игла попала в ненормальную зону, то это вовсе не значит, что эмбрион плохой. А если игла попала в нормальную зону, это вовсе не говорит о том, что у эмбриона не может быть каких-то проблем.
Профессор Польсон отстаивает следующую точку зрения: для молодых женщин, у которых много эмбрионов, вы можете позволить себе много. Но что поделать, если пациентка не молода (а он работает с пациентками, которым за 40, много пациенток, которые наблюдаются у него в центре, это пациентки старшего репродуктивного возраста, когда само получение яйцеклеток достаточно проблемно), и если с эмбрионами идут какие-то сбои? Да, у них есть какой-то процент сбоев, которые могут дать основания для остановки беременности или неприживления или каким-то проблемам, но зато мы можем это всё испытать. А если зародыш не будет использоваться, что мы тогда получим? Мы получим нулевой эффект. Как я и говорил, этот зародыш, который хороший, мы просто считаем его плохим, не будет иметь никаких шансов. Поэтому они говорят «дайте матке шанс!». Дайте организму, самой матке возможность распознать, какой эмбрион хороший, какой плохой.
Важный вопрос безопасности эмбриона
Второй вопрос касается безопасности самой процедуры для эмбриона. Потому что сторонники процедуры преимплантационного скрининга на анеуплоидии, говорят, что сейчас проводятся перспективные исследования, которые показывают, что всё очень-очень хорошо. Но правая сторона, она говорит: ребята, мы с вами знаем, проводились исследования, что количество открытий двери шкафа термостатного, в котором происходит развитие эмбриона, влияет на развитие будущего ребенка, как вы думаете, ему безразлично, что вы возьмете из этих двухсот клеток 5-6 и сделаете пункцию этого эмбриона? Что с ним будет происходить? И тоже не получаем никакого ответа. Якобы все эти перспективные исследования не показывают никаких проблем.
В дискуссии вышла доктор, которая говорит: я делаю эти процедуры, я сама делаю эти биопсии, но я не уверена в том, что на здоровье детей, которые родятся, это никак не отражается. Потому что мы знаем, сколько сейчас проводится исследований, которые изучают влияние различных манипуляций с эмбрионами на здоровье уже будущего человека, который родится. Поэтому вопрос очень острый. Если мы имеем методику, которая не даёт нам 100% результата, то нужно ли применять её в таком масштабе? Практически рекомендуют делать это чуть ли ни 100% женщин. Причём, основные исследования проводятся на достаточно молодой группе женщин, тех, которые дают достаточно большой выход эмбрионов и процент женщин более старшего возраста там меньше, потому что меньше выход этих эмбрионов.
Поэтому они говорят, что не совсем точно идёт формирование этих групп, и что эти исследования сдвинуты в сторону того, что мы экстраполируем данные молодых женщин на всех женщин в целом, которые участвуют в процессе ЭКО. И дальше получается, мы видим выступали другие участники дискуссии, по одному рассказывали, что хорошо, что плохо. В процессе самого исследования был онлайн-опрос, в котором принимали участие все те, которые, как и я, участвовали онлайн. Можно было задавать вопросы, и нас спрашивали, что каждый думает по этому поводу.
Влияние мозаик требует доказательств
И очень интересно было выступление профессора Гляйхера: он сказал, если вы предложили такую методику, то по идее вы должны были провести все исследования. Как влияет процесс на мозаики, какой процент мозаик, что делать с этими мозаиками. Он сравнивает с теми фармацевтическими компаниями, которые проводят исследования различных препаратов, прежде чем выводят их на рынок. Ещё до того, как препараты выводятся на рынок, проводятся все исследования на животных, потом проводятся преклинические и клинические исследования. После этого принимается, хороший препарат или плохой. Очень многие препараты, на которые тратятся огромные суммы денег, так и не доходят до рынка, потому что в процессе исследования что-то меняется.
Основная мысль профессора Гляйхера заключалась в том, что ребята, если вы нам хотите доказать, что эта методика хороша во всех отношениях – доказывайте. Почему мы должны проводить какие-то исследования, смотреть, годится эта методика или нет. Методика ещё достаточно сырая с точки зрения биологии, и мы должны использовать её с осторожностью. Основная проблема в том, что мы получаем информацию о так называемых митотических хромосомных аберрациях, митотических анеуплоидиях, которые не имеют никакого отношения к тому, какой набор хромосом внутри клеточной массы. А для того, чтобы получить набор информации о внутренней клеточной массе, мы должны получить хотя бы хромосомы яйцеклетки. Если мы будем получать хромосомы яйцеклетки, то мы тогда будем получать информацию о том, что со стороны яйцеклетки нет никаких проблем. И тогда вопрос пациенток старшего возраста решается достаточно просто – мы выбираем для исследования только те яйцеклетки, которые имеют нормальный хромосомный набор. Причём, профессор Гляйхер говорит, что для этого можно использовать кариотип полярного тельца. И вот здесь мы получаем выход на очень интересную тему.
Вывернутый наизнанку кариотип яйцеклетки и снижение вероятности анеуплоидий
Сам профессор Гляйхер говорит: вот у нас был этот русский так называемый Верлинский Юрий, который туда эмигрировал и начал заниматься преимплантационной диагностикой и предложил определять кариотип полярного тельца. То есть можно определять кариотип первого полярного тельца, и тогда яйцеклетка будет иметь все то, чего нет в этом первом полярном тельце. То есть первое полярное тельце получит в результате разделения кариотипа вторую половинку хромосомного набора материнского организма, которая дальше не попадёт в яйцеклетку. Это вывернутый наизнанку кариотип яйцеклетки. Либо же мы смотрим кариотип второго полярного тельца, который полностью соответствует кариотипу яйцеклетки. Если пойти по этому пути, мы уходим от проблемы мозаик, уходим от проблемы митотических анеуплоидий, спускаемся чисто на проблему мейотических анеуплоидий. То есть мы сразу можем отсечь те яйцеклетки, которые будут хромосомно неполноценны.
Причём, определение кариотипа полярного тельца предложил еще в 90-е годы Верлинский. Он говорил: почему в Европе определяют кариотип полярного тельца, и я думаю, что те наши слушатели, которые слушали несколько лет назад доклад профессора Файфингера из Вены, помните, насколько это было интересно, и насколько он интересно рассказывал, как они в Вене не используя преимлантационную диагностику эмбрионов, определяют кариотип полярного тельца и насколько это позволяет улучшить методику. Мы не знаем, какой сперматозоид оплодотворит яйцеклетку, и не знаем кариотип сперматозоида, но можем очень чётко определить кариотип полярного тельца и можем резко снизить вероятность анеуплоидии.
Основной источник анеуплоидии все-таки яйцеклетка, а не сперматозоид. И вот здесь интересно, что Нобелевская премия по химии в этом году присуждена исследователю, который придумал так называемую лазерную ловушку. Эта ловушка позволяет очень нетравматично получать полярное тельце при получении яйцеклетки и таким образом совершенно чётко понимать, какой набор идёт у яйцеклетки. Интересное пересечение – профессор вряд ли думал об этой Нобелевской премии, когда выступал, но тем не менее он затронул очень важный и перспективный вопрос.
Новая перспектива для процесса оплодотворения
Если мы сейчас начнём заниматься методикой определения полярного тельца, то мы можем получить совершенно другую перспективу. То есть другое видение того, какие яйцеклетки лучше использовать для процесса оплодотворения. Интересно также то, что я разговаривал с эмбриологами и всё время задавал вопрос: вы не делаете кариотип полярного тельца? И мне всё время отвечают: нет, мы этим не занимаемся.
Я не знаю, занимаются ли у нас определением кариотипа полярного тельца, и вообще, какие методики используются у нас для преимплантационного скрининга на анеуплоидию. Потому что если смотришь те результаты, с которыми приходят пациентки, большинство тех результатов, которые используются это метод fish, что на западе практически заменено новым поколением. Редко видишь микроматричный анализ, в основном методики fish. Здесь конечно отдельная тема – экстраполяция того опыта, который сейчас есть на Западе.
В процессе дискуссии было сказано «Я вам сейчас кое-что покажу» и появился такой же футбольный мяч, но говорилось здесь уже о другом. Почему процент мозаик, который получается в результате нынешнего вида преимплантационного скрининга, такой маленький? Потому что он показывает – для того, чтобы получить мозаику, нужно чтобы игла попала вот в эту зону. Между белым и красным. Там, где эти зоны сходятся друг с другом. Тогда вы получите и нормальные и ненормальные клетки. Но вероятность этого очень маленькая. Поэтому процент мозаик, который получается в результате этого преимплантационного скрининга получается гораздо меньше, чем мог бы быть в реальности.
Поэтому интересная дискуссия прошла в эти выходные и дальше была достаточно интересная дискуссия внутри зала. Вот этот доктор задавала вопросы по поводу здоровья будущего ребёнка, и как может преимплантационная диагностика отразиться на здоровье будущего ребёнка. Дальше вышел пожилой доктор из Египта и задал вопрос: вы говорите, что это всё удешевляет, саму процедуру ЭКО, но мы знаем насколько это удорожает процедуру ЭКО.
Сторонники преимплантационной диагностики говорят, что это удешевляет процедуру ЭКО, потому что мы уменьшаем количество подсадок, добиваемся сокращения сроков наступления беременности. А на какой срок уменьшается срок необходимый для наступления беременности? Ответ – на 11 дней такой период. Это несерьезно, ребята. На такой ноте закончилась интереснейшая дискуссия, которая проходила в рамках форума, который сейчас проходил в Денвере.
Итоги и выводы участников конференции
И также я хотел сказать, что были объявлены результаты голосования. Они показали следующее: в самом начале конференции примерно 75% участников и виртуальных участников используют PGD в своей практике и 25% не используют. В результате конференции большая часть участников сказала, что они не поменяют своих подходов. Кто использовал, те будут продолжать использовать, кто не использовал – те не будут использовать. Но интересно дальше был вопрос – какой процент участников будет использовать преимплантационную диагностику чаще, чем она используется сейчас? И оказалось, что таких было 12 процентов.
Следующий вопрос – какой процент участников конференции будет использовать преимплантационную диагностику реже чем сейчас? Таких оказалось 16%. Мы видим чёткий совершенно тренд в сторону того, что всё большее количество специалистов по IVF будет снижать использование преимплантационного скрининга на ануеплоидию, особенно у пациенток старшего возраста, там где каждый эмбриончик на вес золота. Что лучше такой эмбрион подсадить в полость матки и дать ему возможность развиваться, чем утилизировать. У нас есть целый ряд методик, которые позволяют в дальнейшем, если идёт развитие после 8 недель беременности, чётко провести и скрининговые исследования и диагностические исследования на предмет наличия или отсутствия анеуплоидии.
Вот такая любопытная была пресс-конференция. Никакой точки здесь не поставлено, но я так полагаю, что такая осторожная организация как Американское общество репродукции человека, если она вынесла это все на дискуссию, значит внутреннее недовольство результатами самой методики нарастает, и, возможно, это приведёт к тому, что мы получим более совершенную неинвазивную методику преимплантационного исследования эмбриона возможно с использованием свободной фетальной ДНК, которая позволит дать более точную информацию по крайней мере в отношении мозаик и не мозаик.
Мозаицизм в женском организме и его влияние на ребёнка
Исследования профессора Муннэ на мышах показали, что в общем-то процесс мозаицизма он достаточно интересен. Сама по себе наружная трофэктодерма обладает очень высокой склонностью к мозаицизму. Но женский организм каким-то образом отслеживает сигналы мозаицизма, и если процент мозаицизма у трофобласта превышает определённый размер, то тогда беременность останавливается в развитии. Организм не даёт ей развиваться. Если мозаицизм трофобласта находится в рамках, условно говоря, нижней границы, то мы будем получать нормальное развитие эмбриона.
В связи с этим я ещё раз хотел бы сказать то, что говорил на прошлой нашей встрече, наружный кариотип плаценты и мозаицизм плаценты может быть настолько высок, что он может абсолютно не соответствовать кариотипу плода. И вот на последней конференции по перинатальной медицине, которая проходила в Петербурге в начале сентября, был доклад клинического случая, документально подтвержденного, когда с помощью ПИД была получена трисомия по второй паре, редчайшая трисомия, а при этом они сделали кариотипирование плода путём амниоцентеза и был получен нормальный кариотип. И беременность развивалась до 34 недель и родилась здоровая недоношенная девочка без каких-либо проблем со здоровьем. И кариотип ребёнка оказался абсолютно нормальным женским кариотипом, а кариотип плаценты оказался 90% по-моему 47+2, т.е. 46ХХ + вторая хромосома. То есть трисомия была по второй паре – редчайшая трисомия, редчайшая аномалия.
Поэтому я ещё раз хочу обратить ваше внимание, что когда мы определяем кариотип трофобласта или плаценты, он не всегда совпадает с кариотипом эмбриона. Поэтому очень важен амниоцентез. Он никуда не уходит, амниоцентез и кордоцентез остаётся. Даже если неинвазивный пренатальный тест даёт вам неправильный результат, западники все-таки ждут дальше и делают амниоцентез, и если он показывает аномальный кариотип плода, тогда уже предпринимаются действия какие-то. Здесь уже вопрос и этически и медицинский сложный.
Возможно ли возродить неандертальцев и методика CRISPR CAS 9
Вот, собственно, что мне хотелось рассказать по поводу такого интересного направления. И в связи с предыдущей нашей беседой, когда я говорил о кариотипировании неандертальцев, возникали разные вопросы, почему мы этот вопрос затрагиваем вообще. Вопрос достаточно интересный.
Потому что во-первых, мы, по крайней мере люди европейского происхождения, являемся носителями 2% генов неандертальцев. А жители, которые имеют азиатские корни, они имеют в достаточно большом проценте случаев, континентальная Азия в 75% случаев, являются носителями генов, так называемых денисовцев. Непонятно, как они выглядели, но их геном нам известен лучше, чем геном многих людей. То есть настолько хорошо помогли исследования нескольких костных остатков, обнаруженных на Алтае, определить то, что это были родственники человека.
Есть такой профессор Джордж Черч. Это профессор Гарвардского университета, который занимается проблемами синтетической биологии. И вы видите вот здесь скелет мамонта, ДНК мамонта и дальше вы уже видите мамонта во плоти. В настоящее время вопрос о том, что возможно возрождение умерших видов, он достаточно широко обсуждается и по крайней мере в лаборатории профессора Дэвида Рейха на поток поставлено определение кариотипов костных останков неандертальцев и других видов вымерших. И эти геномы расшифрованы достаточно хорошо. Одновременно то, что пишет профессор Джордж Черч, и вы в интернете можете послушать его лекции, он достаточно интересный лектор, он говорит о том, что методика CRISPR, редактирование генов, так хорошо в настоящее время развита, что можно отредактировать всё.
Берётся стволовая клетка человека, и дальше внутри этой стволовой клетки происходит редактирование генов. Гены, характерные для современного человека, заменяются, редактируются, заменяются генами, которые были у неандертальцев, а это не такой сложный процесс, потому что у нас с неандертальцами 99,5% генов общих. Разница идёт только по половине процента генов. И после этого клетка идёт по пути развития эмбриона, подсаживается в матку женщины и женщина рождает уже неандертальца.
В интервью журналу «Шпигель» несколько лет назад Джордж Черч сказал, ему задали вопрос – может ли вот так родиться неандерталец? Он говорит: технически никаких проблем нет. Если женщины захотят, мы не против, только не хватает тех женщин, которые бы согласились. И вы представляете, после того, как это интервью было опубликовано в журнале «Шпигель», в журнал посыпались предложения со стороны женщин. Это были сотни предложений, сотни писем – женщины предлагали себя в качестве суррогатной мамы для того, чтобы возродить неандертальцев.
И вот в этой книжке «Ориджинезис», я рекомендовал бы вам её прочесть, написано, как синтетическая биология обновит природу и нас самих. Может быть появятся мамонты, если мы отредактируем стволовую клетку слона, можно подсадить слонихе и родится мамонт. Шерстистые носороги, саблезубые тигры, саблезубые коты, все эти млекопитающие, которые вымерли в последние несколько десятков тысяч лет, от которых остались ДНК, их можно возрождать. Поэтому вопрос этот встаёт достаточно интересный. И много публикуется по этому поводу, о проблеме неандертальцев очень интересной. И вообще проблема эволюции человека, проблема, которая должна быть в принципе интересна для врачей, которые занимаются проблемами репродукции.
Я бы здесь конечно рекомендовал – некоторые здесь читали, но большинство конечно не читали – книгу Уэллса «Машина Времени», где описывается путешествие во времени и деградация человека, если оно пойдёт по пути удовлетворения всех бесконечно возникающих потребностей. Описывается общество, которое пошло по пути марксизма. Капиталисты, условно говоря, или аристократия и пролетариат дали направление двум разным ветвям человечества, которое стало пожирать друг друга и деградировало морально. Поэтому он говорит – наш 19 век! А в том рассказе, который послужил прообразом и первоосновой «Машины времени», «Кроник Эргонотс» — аргонавты по времени или аргонавты времени, она есть в переводе на современный русский язык, там очень чётко описывается священник, которого этот аргонавт на машине времени прокатил по времени. И он попадает в итоге на небольшой островок в болоте, выходит оттуда и говорит: какой век сейчас? 19й. Слава богу! То есть тот век, в котором жил Уэллс, при том, что у него были достаточно пессимистичные взгляды на будущее человечества, это мы видим по главе «Серые человечки», которая не вошла в основной текст, но достаточна интересна. Поэтому я бы советовал эту книгу прочитать. И может быть формат наших встреч не позволяет, но Уэллс является одним из моих любимых писателей. И возможно все-таки как-нибудь мы поговорим отдельно на такую отвлечённую литературную тему.
Я надеюсь, что сегодняшняя встреча была вам интересна. В следующий раз мы будем говорить о невынашивании беременности, продолжим наш разговор, будем говорить о HLA-совместимости и HLA-несовместимости в генах HLAи их связи с процессом репродукции. А через одну беседу это будут ответы на вопросы, поэтому если есть какие-то вопросы, пожалуйста задавайте. Я очень рад всем тем, кто дослушал нашу беседу до конца, я желаю вам всего самого хорошего и прощаюсь с вами! Удачи вам, господа.
ПГД эмбриона при ЭКО — что это значит?
Содержание:
На какой день выполняют диагностику
Техника проведения манипуляции
ПГД эмбриона – это процедура, которая используется при проведении протокола экстракорпорального оплодотворения. Манипуляция позволяет получить максимум информации об эмбрионе, что дает возможность отобрать самые качественные клетки для переноса. Предимплантационная генетическая диагностика выполняется по показаниям и чаще назначается возрастным парам, но также может проводиться по желанию партнеров.
Что это такое
Предимплантационное генетическое обследование является способом обследования клеток эмбриона до переноса их в полость матки. Манипуляция не требует каких-либо усилий со стороны партнеров и осуществляется эмбриологами. Для будущих родителей, использующих методы ВРТ, разница в проведении протокола ЭКО с ПГД и без нее отсутствует.
Исследование генетических нарушений эмбриона – это манипуляция, с помощью которой специалисты могут предвидеть нарушения и прогнозировать результат переноса клеток. Данная процедура дает возможность определить, унаследует ли ребенок хромосомные патологии от родителей. Также диагностика позволяет выбрать эмбрион с определенным генетическим набором, что часто требуется при необходимости донации.
Предимплантационное обследование не представляет угрозы для будущей беременности и не способно навредить эмбриону. Сложно переоценить достоинства данной процедуры, поскольку она в разы снижает риск рождения детей с отклонениями.
Изучение генетического строения выполняется только при ЭКО. Во время естественного зачатия провести данную процедуру невозможно. Альтернативным способом обследования является пренатальная диагностика. Однако при получении негативных показателей дородового обследования паре будет предложено сделать прерывание. ПГД позволяет избежать таких проблем и при выявлении генетических нарушений у плода отказаться от его переноса.
Делать ли ПГД эмбриона
Предимплантационное обследование может быть проведено по желанию пары в протоколе экстракорпорального оплодотворения за свой счет.
Показания для выполнения ПГД:
- рождение в прошлом ребенка, который имеет генетические отклонения;
- наличие у родителей генетических заболеваний, которые имеют половую принадлежность;
- возраст партнеров – женщин от 35 лет, а мужчины от 40;
- неудачные попытки проведения ЭКО в анамнезе;
- привычное невынашивание беременности, самопроизвольное прерывание на одинаковом сроке;
- серьезные патологии спермы у мужчины, морфологические изменения в большинстве клеток;
- риск резус-конфликта между матерью и будущим ребенком.
Пары, которые не могут забеременеть естественным путем, в обязательном порядке получают консультацию генетика на этапе подготовки к использованию ВРТ. Специалист при необходимости назначает анализы с целью определения кариотипа и дает индивидуальные рекомендации относительно необходимости проведения ПГД эмбриона перед переносом.
На какой день выполняют диагностику
В большинстве медицинских учреждений, специализирующихся на использовании вспомогательных репродуктивных технологий, предимплантационное обследование выполняется на 3 сутки. К этому времени количество клеток эмбриона достигает 8, что позволяет без ущерба для дальнейшего развития провести анализ. Некоторые клиники предпочитают выполнять исследование на 5 день, когда количество клеток превышает 100. Такой метод считается более точным, однако не дает достаточно времени для проведения расширенного анализа.
В зависимости от вида протокола ЭКО специалисты индивидуально выбирают сроки проведения ПГД. Если предполагается криопротокол, то лучше выполнить биопсию на 5 сутки. В этом случае перенос эмбрионов планируют не ранее следующего цикла, что позволяет получить детальную информацию о генетическом материале и выбрать самые качественные клетки. Если протокол ЭКО не предполагает витрификации эмбрионов, то стоит сделать биопсию на 3 сутки развития зародыша.
У партнеров на этапе подготовке к экстракорпоральному оплодотворению часто возникают вопросы по поводу того, сколько делается ПГД и когда следуют перенос клеток. При стандартном протоколе без криоконсервации исследование проводится в сжатые сроки. Перенос эмбриона должен быть выполнен не позднее 5 дней его развития. Если биопсию взяли на 3 сутки, то у эмбриологов остается не больше 48 часов для генетического анализа.
Техника проведения манипуляции
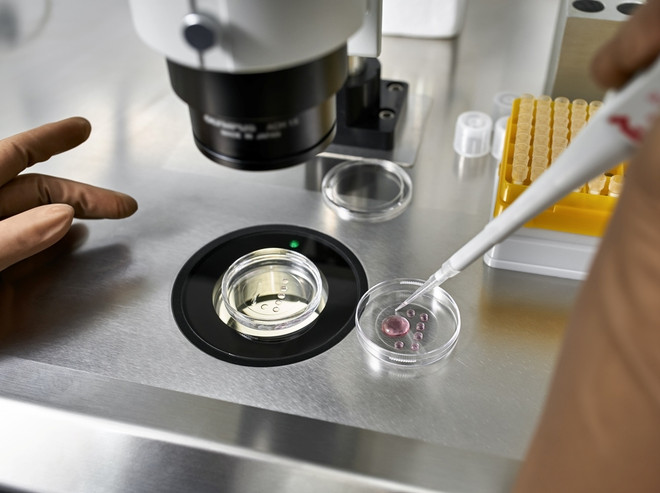
Для партнеров, вступивших в протокол ЭКО, методика проведения процедуры с генетическим исследованием или без него не имеет существенных отличий. На начальном этапе женщина принимает гормональные средства для стимуляции, после чего выполняется забор ооцитов с помощью пункции через влагалище. Мужчина в это время сдает сперму, необходимую для оплодотворения эмбрионов. Для повышения качества клеток рекомендуется выполнить интрацитоплазматическую инъекцию, если у мужчины недостаточно хорошие показатели семенной жидкости.
После оплодотворения яйцеклетки сперматозоидом полученный материал выращивается в специальных условиях. Для проведения биопсии берется один эмбрион и помещается в чашу. С помощью миниатюрных инструментов под контролем оптической системы выполняется повреждение его оболочки лазерным лучом. Затем пипеткой берется необходимое количество клеток – обычно 1 или 2.
На следующем этапе специалисты проводят генетическое исследование полученного материала. В это время эмбрион продолжает развиваться в искусственных условиях, напоминающих полость матки. Полученным клеткам присваиваются цифирные значения в соответствии с нумерацией эмбрионов. Поэтому любые ошибки в результатах проведенных манипуляций исключены.
Результаты анализа
По прошествии двух суток специалисты оценивают полученные результаты и сопоставляют их с развитием соответствующего эмбриона. На сегодняшний день используются 3 методики предимплантационного исследования эмбрионов. Способ проведения анализа выбирается индивидуально и зависит от исходных показаний.
В полость матки женщины переносятся только те эмбрионы, у которых в процессе обследования не было обнаружено хромосомных поломок. Если процедура выполнялась с целью рождения ребенка определенного пола, то подсаживаются соответствующие клетки. Когда ПГД делают для предотвращения резус-конфликта, осуществляется перенос клеток с нужным показателем крови. Важным моментом при выборе клеток является оценка их развития на момент получения результата исследования.
Преимущество ПГД заключается в следующем:
- повышает вероятность успешного результата протокола;
- снижает риск самопроизвольного прерывания беременности на ранних сроках;
- позволяет избежать многоплодной беременности;
- практически исключает рождение ребенка с генетическими патологиями.
Эмбриологи уверены, что лучше выполнять ПГД с последующей витрификацией клеток. Это позволяет сделать доскональный анализ. Последующий перенос выполняется в естественном цикле, что значительно снижает нагрузку на организм женщины и создает условия, максимально близкие к естественному оплодотворению.
Видео
Читайте далее: предимплантационная диагностика эмбрионов
Фото: © Depositphotos
1 июня 2019 18:42 | Отредактировано: 16 декабря 2021 09:15
ПГД, или перимплантационная генетическая диагностика с использованием метода CGH (comparative genomic hybridisation) – сравнительной геномной гибридизации – позволяет получить максимум объективно достоверной информации о геноме. Наши специалисты используют его, чтобы отобрать генетически полноценный эмбрион, который будет перенесен в женскую матку. CGH-метод позволяет провести анализ всех 24 хромосом мужских и женских половых клеток. Выявляет:
- Анеуплоидии (наличие в ДНК цепочке лишних хромосом);
- Делеции, или отсутствие участка хромосом;
- Дупликации, или удвоения.
В нашем центре можно провести как полный анализ, так и ограниченное количество хромосом. Нарушенный кариотип хромосом препятствует зачатию, то есть при слиянии гамет образуется нежизнеспособный эмбрион. Благодаря проведенному анализу производится отбор полноценных клеток.
Содержание статьи
- Что такое сравнительная геномная гибридизация на чипах?Принцип метода
- Как подготовится к сравнительной геномной гибридизации?
- Сравнительная геномная гибридизация. Особенности проведения
- Преимущества сравнительной геномной гибридизации
- CGH: недостатки метода
- Показания к проведению сравнительной геномной гибридизации
- Ошибки при ПГД методом CGH
Что такое сравнительная геномная гибридизация на чипах?
Технология, обладающая высоким разрешением, с помощью которой появилась возможность проведения объективной оценки количественного и качественного нарушения в структуре хромосомного набора, получила название «Сравнительная геномная гибридизация на микрочипах (aCGH)». Данная методика позволяет провести полноценный анализ всех 24 хромосом из набора гаметы. Для проведения анализа специалисту нашего центра достаточно 1 клетки. Высокая достоверность метода подтверждена много численными исследованиями экспериментальным путем. Погрешность составляет всего 1,9% и только 2,9% всех отобранных эмбрионов оказались непригодны для проведения диагностики.
Принцип метода
Чтобы инсеминация дала положительные результаты, требуется отобрать наиболее здоровый и жизнеспособный эмбрион. Выполнение анализа происходит по классической экспериментальной схеме: используется два образца генетического материала – контрольный, заведомо здоровый, с полностью проверенным набором хромосом, и исследуемый. Применяется в отношении мужских и женских клеток.
На образцы клеток наносятся специальные зонды, после чего материал переносится на микрочип, который несет последовательности олигонуклеотидов. На 1 хромосому приходится 60000 точек покрытия. Далее проводится проверка с использованием цветных маркеров. Интенсивность получаемого сигнала соответствует численности участка. Красный цвет сигналит о том, что на участке численность увеличена. Зеленый напротив сигнализирует о том, что участок «потерян».
Компьютер проводит сканирование и в результате наш специалист получает диаграмму о состоянии генома. График представлен в виде прямой, на которой отмечены пары хромосом. Напротив каждой пары отображаются дефектные хромосомы – прямая разрывается с помещением метки зеленого или красного цвета, сигналящих о нехватке или удвоении участка.
Как подготовится к сравнительной геномной гибридизации?
В зависимости от потребности специалист нашего центра выберет метод проведения диагностики. Иногда задача ставится таким образом, что достаточно провести частичное сканирование. То есть использовать метод FISH вместо более расширенного CGH. В этом случае подбор материалов, реактивов и подготовки материала будет существенно различаться. ФИШ метод не показывает дупликации и отсутствующие участки, но в некоторых случаях в этом нет необходимости. ФИШ-метод позволяет провести диагностику образцов за короткий промежуток времени в 5-6 часов, в то время как полное сканирование 24 хромосом займет до 48 часов, а в некоторых случаях все 72 часа. Важным аспектом будет количество набранных эмбрионов. Требуется от 12 до14 штук, которые не всегда принадлежат одной женщине.
Сравнительная геномная гибридизация. Особенности проведения
Выбор метода ЭКО определяется превалирующим фактором бесплодия. Если спермограмма мужчины имеет нормальные показатели, то оплодотворение яйцеклетки проводит путем «in vitro». Искусственная инсеминация в данном случае производится не в цервикальном канале женщины, а в пробирке.
При наличии проблем в мужском генетическом материале выбираются методы инъекции сперматозоида (ИКСИ, ИМСИ, пИКСИ), когда врач отбирает необходимую половую клетку и микроиглой вводит ее в женский ооцит.
Для проведения анализа CGH метод «in vitro» не подходит. Дело в том, что при его применении участвуют несколько сперматозоидов и часть из них, хоть и не оплодотворяют яйцеклетку, но делают попытки проникнуть сквозь ее оболочку, тем самым оставляя свой генетический след на ее поверхности. В последствие эти «следы» могут дать ложные показатели, которые снизят валидность (достоверность) результатов исследования.
При проведении анализа эмбрионы подвергаются криоконсервации. Дело в том, что процедура проводится на 5-6 день после оплодотворения, когда уже началось первичное деление клеток оплодотворенного яйца и образовалась бластоциста. Бластоцисты маркируют и дублируют маркер на соответствующих образцах биопсийных проб. Отобранные образцы материалов отправляются на сканирование, а бластоцисты консервируют. По результатам анализа клетки с выявленными аномалиями утилизируют, а эмбрионы прошедшие проверку размораживаются для переноса в женскую матку.
Для анализа используется специальный микрочип, который рассчитан на 12-14 эмбрионов. Стоимость чипа довольно высокая, что заставляет женщин ждать набора образцов для полного заполнения. Если пара хочет ускорить процедуру, то «свободные места» придется оплатить дополнительно. В среднем нашему центру требуется 7-10 дней, чтобы набрать требуемое количество эмбрионов для анализа.
По результатам анализа специалист-генетик НМК делает заключение, с которым женщину знакомят на очередной консультации. Выбор эмбриона для переноса осуществляется совместно, после чего нужный образец размораживают и производится подсадка в полость матки.
Преимущества сравнительной геномной гибридизации
В процедуре геномной гибридизации выделяют 3 объективных достоинства:
- Так как весь процесс сканирования возлагается на компьютерную программу, фактор человеческой ошибки минимален. Генетик занимается исключительно интерпретацией результатов.
- При использовании анализа продуктивность ЭКО составляет до 70%. Более того, отбор единственного идеального эмбриона позволяет исключить фактор многоплодной беременности.
- Возможность деления процедуры на этапы с проведением анализа ограниченного числа эмбрионов, в то время как остальной материал консервируется. Если выбранная партия полностью отбраковывается, то требуется обследование следующей группы.
Специалисты нашего центра дают возможность парам в период поведения исследований комфортно распределять финансовые расходы.
CGH: недостатки метода
Кроме очевидных достоинств CGH-метод имеет ряд неприятных сторон:
- Цена. Высокая, так как требует привлечение опытного специалиста и дорогостоящих материалов. В прайсе стоимость может указываться за 1 эмбрион. В нашем центре предоставляется вариант оплаты этапов и проведения анализа по отдельности.
- Учитывая все особенности, требует больше времени, чем ФИШ-метод.
- При обнаружении сбалансированных транслокаций метод все же имеет ограничения, которые возможно преодолеть дополнительными способами.
Показания к проведению сравнительной геномной гибридизации
Методику можно проводить как по показаниям, так и по желанию пары, для повышения эффективности процедуры ЭКО. В качестве базовых показаний выступают:
- Подтвержденный кариотипический дефект у одного или обоих партнеров.
- Повторные выкидыши;
- Если ЭКО неоднократно оканчивалось неудачей при использовании высококачественных эмбрионов для подсадки.
- Если зафиксированы факты рождения детей с ДНК аномалиями.
- Возраст женщины от 30 лет, так как процент эмбрионов, а аномалиями в этом случае увеличивается.
Ошибки при ПГД методом CGH
Методика может дать недостоверный результат в случае фактора «мозаицизма» — ситуации, когда среди клеток эмбриона присутствуют как нормальные, так и аномальные клетки и в образец при заборе попадает качественный материал. Если специалист обнаруживает в пробе типа клеток, такой материал бракуется.
Помимо этого на положительный результат ЭКО оказывают влияние и другие факторы: поддержание лютеиновой фазы, своевременное открытие имплантационного окна, рецептивность и толщина эндометрия. Все это влияет на успешность крепления эмбриона к стенке матки.
Многие будущие родители хотят сделать предимплантационное генетическое тестирование. Одни потому, что знают, как тяжело воспитывать особенного ребенка, и хотят гарантированно здорового малыша. Другие думают, что генетический тест выберет лучший эмбрион, и у них родится гений, спортсмен или талантливый музыкант. Вот как на самом деле работает ПГТ и кому его назначают.
Что это такое
Предимплантационное генетическое тестирование — это анализ мутаций, ответственных за болезни. В лаборатории эмбриолог берет участок оболочки эмбриона, отправляет на исследование, получает результаты и переносит в матку только здоровых эмбрионов.
До ПГТ люди узнавали о патологиях через выкидыш, результаты скрининга во время беременности и рождение больного ребенка. Это травматичный опыт, а некоторые женщины проходят через него много раз. Поэтому ПГТ — защита психики будущих родителей и повод надеяться, что беременность закончится рождением здорового ребенка. Помешать этому может три вида мутаций, для каждого из них есть свой тест.
ПГТ-А — анализ количества хромосом, его делают даже тем, у кого нет наследственных патологий. В норме у человека их 46 «обычных», разбитых на пары, и две половые — X и Y. При мутации хромосомы могут удваиваться и из две хромосомы в паре получается три — ребенок рождается больным. Если удвоилась 21 хромосома, появляется ребенок с синдромом Дауна, 18 хромосома — с синдромом Патау. А вот при потере или деформации одной из X хромосом, девочка рождается с синдромом Шерешевского-Тернера.
ПГТ-СП — анализ структуры хромосом. Он выявляет структурные перестройки в каждой хромосоме, наследуемые от близких родственников. Эмбрион в этом случае получается нежизнеспособным.
«Бывают такие наследственные перестройки, когда в хромосоме не хватает одного важного участка, и такой эмбрион получается жизнеспособный, живой, но несущий генетические пороки, — объясняет репродуктолог, акушер-гинеколог Клиники Фомина Оксана Селиверстова. — И зная, какая структурная перестройка в хромосомах встречалась в семье у бабушек, дедушек, можно сделать анализ ПГТ-СП».
ПГТ-М — поиск моногенных нарушений. Даже если хромосомы в порядке, мутация порой скрывается в одном гене. Так наследуются фенилкетонурия, муковисцидоз, поликистоз почек. Мы уже писали о генетических тестах, позволяющих выявить эти болезни.
«ПГТ-М ищет конкретную патологию, это исследование сложнее и дороже ПГТ-А. для конкретного моногенного заболевания готовят специальные профили и элементы тест-систем, — рассказывает Оксана Селиверстова. — ПГТ-М на все моногенные заболевания — дорогой и неоптимальный путь, как и вариант сделать все три вида ПГТ исследования сразу».
Кому показано
Это выход для пар с высоким риском наследственных патологий у детей. Часто они знают о своей особенности и хотят, чтобы ребенок появился здоровым. Но даже если только догадываются, перед ПГТ обязательна консультация генетика. Он назначает обоим супругам анализ на кариотип — хромосомный набор.
«Кариотипирование позволяет убедиться, что у будущих родителей нет структурных хромосомных перестроек, хотя нарушения кариотипа у здоровых людей выявляются редко — до 1%, в группе пациентов с бесплодием — до 2%, в группе привычного невынашивания беременности ещё чаще — до 4%, — говорит к.м.н., репродуктолог, акушер-гинеколог GMS Clinic Мария Клименко. — Если каждый из пары носит в себе «больной» ген одного заболевания, с вероятностью 25% родится больной ребенок — он получит от каждого из родителей по больному гену и заболевание у него проявится».
ПГТ рекомендуют женщинам позднего репродуктивного возраста — старше 35 лет, когда повышается риск генетических аномалий. А еще тестирование рекомендовано тем, кто столкнулся с двумя и больше выкидышами и двумя-тремя неудачными переносами эмбрионов в программе ЭКО. Считается, что ПГТ у бесплодных пар увеличивает шансы наступления и вынашивания беременности на перенос. То есть, шансы наступления беременности и рождения ребёнка на одну попытку ЭКО одинаковые, а на перенос разные, так как в ходе тестирования отсеиваются нездоровые эмбрионы и количество переносов снижается
«У женщин младше 35 лет примерно половина яйцеклеток здорова и несет нормальный хромосомный набор — проводить ПГТ-А им не обязательно. Рано или поздно один из перенесенных эмбрионов окажется с нормальным хромосомным составом и даст здоровую беременность, — говорит Мария Клименко. — Совсем другая ситуация в позднем репродуктивном возрасте: у женщин старше 40 лет из 5-8 полученных в результате ЭКО эмбрионов может не оказаться ни одного здорового, так что ПГТ-А более оправданно и целесообразно, когда достаточно эмбрионов и есть выбор. Если у женщины позднего репродуктивного возраста еще и снижен овариальный резерв, то проведение ПГТ-А нецелесообразно и лучше полученным 1-2 эмбрионам дать шанс и перенести в матку без тестирования»
ПГТ советуют при тяжелом мужском бесплодии, когда по результатам спермограммы в эякуляте мало подвижных сперматозоидов нормальной формы. А еще рекомендуют женщинам с отрицательным резусом, чтобы избежать резус-конфликта с плодом в утробе. Обычно закон не разрешает выбирать пол будущего ребенка, но случаи мутаций, сцепленных с полом — исключение. Если один из родителей — носитель гемофилии, пара может выбрать генетически здоровый эмбрион.
ПГТ не защищает от всех болезней и не помогает выбрать лучший эмбрион, который гарантированно станет великим математиком, получит Оскар или хотя бы поступит на бюджет в МГУ. Этот ребенок просто не будет иметь те мутации, на которые его проверяли.
«ПГТ — это не редактура генома, а исследование. Оно выявляет только генетически здоровые эмбрионы, и ребенок не будет лучше, чем он был до анализа. Без разницы, как зачат ребенок: естественным способом или через ЭКО. В естественной среде яйцеклетка и сперматозоид встречаются друг с другом в теле женщины — получается эмбрион, — объясняет Оксана Селиверстова. — Те же материалы мы берем и в программе ЭКО. Соединяем их в чашке Петри, выращиваем в инкубаторе и переносим в матку. Эти клетки не генномодифицированные, не улучшенные и не очищенные. Просто оплодотворяются вне организма, так как внутри они не могут встретиться — например, из-за непроходимости маточных труб».
Как делают
Тестирование проводят только в программе ЭКО. Врач назначает стимуляцию суперовуляции, чтобы в яичниках созрело несколько фолликулов. Из них врач тонкой иглой под анестезией забирает яйцеклетки и оплодотворяет их сперматозоидами партнера или донора. Эмбрионы отправляются в инкубатор и дозревают до 5-7-дневного возраста, затем их строение оценивают в микроскопе. И на этом можно было бы остановиться, но нет: «красивый» эмбрион не значит генетически полноценный. Поэтому качественные эмбрионы отправляют на ПГТ.
«Необходимое условие ПГТ — ЭКО с заморозкой эмбрионов. ПГТ в большинстве лабораторий проводят на нескольких клетках трофэктодермы — наружной оболочки эмбриона, с помощью которой он прикрепляется к матке, — рассказывает Мария Клименко. — Сразу после биопсии эмбрионы замораживаются и 7-30 дней ждут результата генетического тестирования».
Аппарат считывает и анализирует генетический код эмбриона, а затем выдает заключение. Многие критикуют ПГТ, ведь образец слишком мал, и не отражает состояние всего эмбриона. Встречаются мозаичные образцы, когда одна часть клеток нормальная, а другая — с измененным хромосомным набором.
«ПГТ не отменяет генетические скрининги при наступлении беременности. Вот почему: взять на анализ можно только клетки трофобласта, из которого в будущем формируются плодные оболочки и плацента. А клетки эмбриобласта пунктировать нельзя — эмбрион погибнет, — говорит Оксана Селиверстова. — Может быть, что в трофобласте один хромосомный набор, а в эмбриобласте— немного другой, измененный. И ПГТ это не покажет, ведь анализ брался из трофобласта.
ПГТ — всегда платная услуга. Она стоит дорого: придется заплатить не только за тестирование, но и за ЭКО с криоконсервацией эмбрионов. Если у пары бесплодие, можно получить квоту на ЭКО по ОМС и отдать деньги только за генетическое тестирование.
«ПГТ не гарантирует рождение здорового ребёнка. Это хороший метод, позволяющий избежать бессмысленный перенос нездоровых эмбрионов, а, значит — пустой траты времени и бестолкового приема препаратов. Он предохраняет от ненужных волнений пациентов, и врачей, но, к сожалению, не на 100% точный и безопасный для эмбрионов, — говорит Мария Клименко. — В ходе исследования в редких случаях от некоторых образцов не получают сигнал. Приходится брать еще одну порцию клеток эмбриона, снижая его шансы на имплантацию. А некоторые пороки развития вообще не связаны с хромосомной патологией и моногенными заболеваниями».
ПГТ — достоверное исследование, но ошибки у него бывают. Все зависит от метода и «возраста» эмбриона. Раньше эмбриологи не дожидались стадии бластоцисты и пунктировали эмбрион гораздо раньше, а генетический анализ выполняли методом FISH или PCR. Сейчас эти методики считаются устаревшими: клиники используют NGS — метод секвенирования нового поколения.
«Я ни разу в своей практике не сталкивалась с тем, что по результату тестирования эмбрион был здоров, а родился больной ребенок. Однако теоретически это возможно с очень низкой вероятностью — примерно 1%, — рассказывает Мария Клименко. — Зато благоприятных ситуаций с эмбрионами сомнительного хромосомного состава гораздо больше: иногда пациентам, у которых не получилось ни одного здорового эмбриона мы все-таки переносим эмбрионов-мозаиков и рождаются здоровые дети. Эмбрионов с аномальным хромосомным составом мы не переносим».
Важно запомнить
- ПГТ выявляет нарушения у будущего ребенка до того, как он окажется в матке
- Есть три вида ПГТ для разных мутаций. Делать все три одному эмбриону бессмысленно
- Без ЭКО сделать ПГТ не получится. А еще придется заплатить за обе услуги в клинике. Исключение — бесплодные пары, которым ЭКО оплатит страховая, если одобрят квоту
- Во время ПГТ узнают пол ребенка, но выбрать не дают — по закону это доступно только по медицинским показаниям
- ПГТ не гарантирует рождение здорового ребенка — все равно придется ходить на скрининги и обследоваться.
Подпишитесь на рассылку новых статей и полезных материалов
ЭКО является не только высокоэффективным методом лечения бесплодия, но и
вспомогательным методом диагностики многих наследственных заболеваний до
наступления беременности.
Дополнительной процедурой к вспомогательным репродуктивным технологиям является преимплантационная генетическая
диагностика эмбрионов – ПГД (PGD) или преимплантационное генетическое тестирование – ПГТ. Главное преимущество данного метода —
отсутствие селективного прерывания беременности, а также высокая вероятность рождения ребёнка без
диагностируемого генетического заболевания.
ПГД — это проверка эмбриона, полученного с использованием экстракорпорального оплодотворения (ЭКО) на
наличие генетических аномалий до его имплантации в полость матки. В этом случае возможно отобрать здоровые
эмбрионы еще до стадии переноса.

Настоящая технология применяется почти 30 лет, и с каждым годом ее востребованность растет вместе с
увеличением количества женщин, желающих родить после 35 лет. Манипуляция выполняется только при ЭКО, не
предоставляет угрозы для женщины и не влияет на будущую беременность. Во время естественного зачатия
провести такое исследование невозможно, но как альтернативный метод проводят пренатальную диагностику.
Однако, при получении негативных результатов обследования — паре будет предложено прервать беременность.
Преимплантационная диагностика наследственных болезней позволяет избежать этого, так как манипуляция предоставляет максимум
информации о зародыше, что дает возможность отобрать самые качественные клетки.

Процедуру проводят не всем, только, когда известно, что родители либо болеют, либо носители моногенного
заболевания. Таким образом, можно определить, унаследует ли ребенок хромосомные патологии от родителей или нет.
У пар, страдающих бесплодием, проводят не тестирование, а скрининг, поэтому потребность в таком исследовании
небольшая.
Обследование выполняется для исключения мутаций или несбалансированной хромосомной перестройки. Перенос
недиагностированных бластоцист не проводится.
В настоящее время известно более 40 моногенных генетических заболеваний. Самые распространенные:
1Муковисцидоз
2Спинальная мышечная атрофия
3Нейросенсорная тугоухость
4Фенилкетонурия
5Адреногенитальный синдром
6Синдром Мартина-Белл (ломкая Х хромосома)
Типы ПГД
ПГС – преимплантационный генетический скрининг.
ПГТ – преимплантационное генетическое тестирование – то же самое, что и диагностика.
Под
диагностикой
понимают анализ методом FISH по определенному числу хромосом, а под тестированием – методом CGH/NGS с
диагностикой всех хромосомных пар.
Несколько типов ПГТ исследований:
ПГТ-А – анализ анеуплоидий выявляет лишние или недостающие хромосомы в клеточном ядре, то
есть направлен на
выбор бластоцист с нормальным количеством хромосом. Он позволяет быстрее получить желаемую беременность
(повышает шансы до 70-75%) и избежать переноса анеуплоидов, например, с синдромом Дауна.
ПГТ-М – тестирование на наличие наследственных болезней. Диагностика проводится только на
выявление
конкретной патологии, поэтому необходима дополнительная диагностика родителей для уточнения, в каком участке
гена могла произойти мутация. Данный тип исследования гарантирует отсутствие конкретного дефекта, но не дает
гарантии на отсутствие других нарушений в геноме.
ПГТ – SR – тестирование на наличие специфических перестроек в их ДНК, которые так же могут
приводить к разным
заболеваниям и передаваться по наследству.
Чтобы определить, какой метод диагностики будет наиболее
эффективным для вашей пары, нужно записаться на консультацию к генетику.
Показания к проведению

Преимплантационное обследование рекомендуется парам с рисками передачи известных хромосомных аномалий
своим детям. Наличие показаний для осуществления ПГД первоначально определяет репродуктолог, а решение о
целесообразности такого исследования принимает врач-генетик. Оно может быть проведено в протоколе
экстракорпорального оплодотворения за свой счет. Противопоказаний к проведению нет.
- Пары с Х-сцепленными нарушениями (риск для ребёнка 25%, половина из них мужского пола);
- Пары с хромосомными транслокациями, которые могут вызвать отсутствие имплантации, невынашивания
беременности, или психические или физические нарушения у детей; - Носители аутосомно-рецессивных расстройств (риск для ребёнка составляет 25%);
- Носители аутосомно-доминантный расстройств (риск для ребёнка составляет 50%).
Примерами распространенных заболеваний могут служить:
- муковисцидоз,
- фенилкетонурия,
- болезнь Тэй-Сакса,
- болезнь Гоше,
- пигментный ретинит,
- серповидно-клеточная анемия,
- талассемия,
- анемия Фанкони,
- гемофилия,
- миодистрофия Дюшенна,
- миодистрофия Бейкера,
- пузырчатка,
- поликистоз почек,
- болезнь Альцгеймера,
- ретинобластома,
- семейный рак груди,
- семейный аденоматозный полипоз,
- семейный канцероидный синдром,
- нейрофиброматоз,
- гидроцефалия,
- хорея Гентингтона,
- синдром Х-ломкой хромосомы,
- спиноцеребральная атаксия.
Делать ли ПГД?
Преимплантационное тестирование может потребоваться в следующих случаях:
- Возраст партнеров – женщин от 35 лет, а мужчины от 40;
- Невынашивание беременности, повторные самопроизвольные аборты, замершие беременности;
- Неудачные попытки ЭКО (две и более) в анамнезе;
- Генетические отклонения были ранее выявлены у детей или у плода;
- Причины мужского бесплодия;
- Тяжёлые нарушения сперматогенеза;
- Наличие у родителей наследственных болезней, имеющих половую принадлежность;
- Присутствие высокого риска рождения ребенка с моногенным заболеванием (например, с муковисцидозом,
спинальной мышечной атрофией, фенилкетонурией и другими патологиями); - Возможность резус-конфликта между матерью и будущим ребенком.
По желанию пар можно сделать ПГД эмбриона на:
- Тестирования на совместимость по человеческим лейкоцитарным антигенам (HLA)
- Исключения болезней с поздним проявлением (болезнь Альцгеймера, РМЖ)
- Исключения болезней, не угрожающих жизни
- Тестирования наследственных предрасположенностей
Супружеские пары, которые не могут забеременеть естественным путем, получают консультацию генетика.
Специалист при необходимости назначает анализы с целью определения кариотипа и дает индивидуальные
рекомендации относительно необходимости проведения ПГД перед переносом.
ПГД эмбриона цена
Биопсия |
|
| Биопсия трофэктодермы 1 эмбриона | 25 000 |
| Доплата за биопсию | 5000 |
Криоконсервация, витрификация, хранение |
|
| Последующее хранение криоконсервированных эмбрионов (в год) | 14 000 |
| Криоконсервация (в т.ч. методом витрификации эмбрионов (бластоцист)) до 4 криотопов (хранение не включено, оплачивается отдельно) | 22 000 |
Генетика |
|
| Преимплантационное генетическое тестирование на хромосомные аномалии (ПГТ-А) методом NGS/SNP — 1 эмбрион | 27 000 |
|
Преимплантационное генетическое тестирование на хромосомные аномалии (ПГТ-А) высокого разрешения методом NGS — 1 эмбрион |
35 000 |
|
ПГТ моногенного заболевания 1 категории сложности, включая подготовительный этап (заболевания, для которых разработаны элементы тест-системы) |
193 000 |
|
Определение уровня рецептивности эндометрия – тест ERA |
89 000 |
|
Определение микрофлоры эндометрия – тест EMMA |
49 000 |
|
Определение патогенной микрофлоры эндометрия – тест ALICE |
35 000 |
|
Комбинированный тест ENDOMETRIO определение уровня рецептивности (тест ERA, микробиоты (тест EMMA) и патогенной микрофлоры эндометрия (тестАLICE) |
106 000 |
|
ERT тест для определения уровня рецептивности эндометрия |
55 000 |
Техника проведения манипуляции

Предимплантационное обследование рекомендуется парам с рисками передачи известных хромосомных аномалий
своим детям. Наличие показаний для осуществления ПГД первоначально определяет репродуктолог, а решение о
целесообразности такого исследования принимает врач-генетик. Оно может быть проведено в протоколе
экстракорпорального оплодотворения за свой счет. Противопоказаний к проведению нет.
С чего начинается ПГД?
Подготовка к лечебному циклу ЭКО с ПГД практически не отличается от обычного лечебного цикла ЭКО:
- женщина принимает гормональные препараты для стимуляции суперовуляции;
- производится забор фолликулов с помощью пункции через влагалище;
- в условиях эмбриологической лаборатории проводится оплодотворение (ЭКО/ИКСИ) яйцеклеток сперматозоидами;
- культивирование в специальных условиях;
- тщательный отбор, отдается предпочтение нормально делящимся и морфологически полноценным зародышам;
- лабораторная биопсия трофэктодермы на 5-6 день культивирования (с помощью механического или лазерного
метода), фиксация бластомера. Ранее ПГД проводилось на 3 день культивирования, однако проведение биопсии на
этом этапе заметно снижает жизнеспособность эмбрионов. В то же время забор клеток на 5 день после
оплодотворения не влияет на их дальнейшее развитие. - криоконсервация после биопсии трофэктодермы;
- генетический тест зафиксированных клеток и получение результатов;
- эмбриотрансфер в полость матки эмбрионов без генетических дефектов;
- через две недели стандартная процедура диагностики беременности.
Сопутствующие риски и результаты исследования зависят от навыков и квалификации эмбриолога, проводящего
биопсию. Такая процедура относится к высокотехнологичным и дорогим исследованиям. Поэтому предпочтительно
сразу обращаться в крупные специализированные центры с возможностью проведения цитогенетического
тестирования.
Результаты
По прошествии двух суток специалисты оценивают результаты и сопоставляют их с развитием соответствующего
зародыша.
Если у него обнаружены отклонения, это означает обязательный отказ от переноса. В полость матки переносятся
только те эмбрионы, у которых не было обнаружено патологий. Если исследование проводилось с цель рождения
ребенка определенного пола (только по показаниям) или для предотвращения резус-конфликта, то подсаживаются соответствующие эмбрионы.
Схема ПГД применяется для конкретного случая своя. Если нарушение наследуется от женщины, то можно
тестировать только полярные тельца. Можно также тестировать только бластомеры. Либо может проводиться
последовательное изучение полярных телец, затем бластоцист. Какая именно схема будет применяться,
определяется на консультации с врачом-генетиком.

Трофэктодерма: что это такое
В настоящее время предпочитают проводить биопсию трофэктодермы, а не забирать образцы еще не
дифференцированной эмбриональной ткани. Такой подход позволяет увеличить жизнеспособность зародышей и
минимизировать вред от манипуляции PGD.
Развитие эмбриона происходит по определенным закономерностям. После оплодотворения образуется зигота, которая
начинает активно делиться, и количество зародышевых клеток растет в геометрической прогрессии. Продолжительность
этого этапа до 3–4 суток. Затем происходит разделение клеток на 2 порции: наружную и внутреннюю. В толще
эмбриональной клеточной массы формируется эксцентричная внутренняя полость – бластоцель, а достигшие этого этапа
называются бластомерами. Трофэктодерма – наружный слой бластомера. Она является предшественником внезародышевых
тканей, необходимых для нормальной имплантации эмбриона и последующего формирования плаценты. А внутренняя
клеточная масса бластомера дает начало самому зародышу.
Внешний и внутренний листки бластоцисты имеют практически идентичный генный и хромосомный состав, поэтому
информативность анализа трофэктодермы такая же высокая, как и при исследовании на более ранних этапах развития
зародыша.
На какой день выполняют диагностику

На этапе подготовке к ЭКО у пар часто возникают вопросы: сколько делается ПГД и когда следует
эмбриоперенос. Во многих клиниках, преимплантационная генетическая диагностика эмбрионов выполняется на 3 сутки. После
оплодотворения яйцеклеток сперматозоидами в условиях эмбриологической лаборатории эмбрион развивается —
клетки делятся. На третий день количество клеток достигает 6-8, что позволяет провести генетический анализ эмбриона без ущерба
для дальнейшего развития зародыша.
В этот день происходит биопсия, то есть извлечение одного бластомера с помощью специальных микроинструментов. При
стандартном протоколе без криоконсервации исследование выполняется за короткое время, так как эмбрион не может
продолжать развиваться вне организма матери далее стадии бластоцисты (5-е сутки после оплодотворения). Пока
выполняется генетическая диагностика, эмбрионы продолжают развиваться в соответствующей культуральной среде,
после чего переносятся в полость матки на 5-е сутки развития. К этому времени эмбрион достигает стадии
бластоцисты. Альтернативный подход – анализ ПГД в криоцикле. В этом случае биопсия производится на 5 день развития, а
затем они подвергаются криоконсервации. Если в протоколе без верификации у эмбриологов остается не больше 48
часов для анализа, то в криоцикле специалист в течение месяца проводит генетическую диагностику.
Практика разобщённого цикла по сравнению со стандартным протоколом без криконсервации характеризуется:
меньшим риском гиперстимуляции, большим количеством материала и временем для анализа, а также менее
травматичной для эмбриона процедурой биопсии. В зависимости от вида протокола ЭКО специалисты
индивидуально выбирают сроки проведения ПГС.

Используемые методы ПГД
У каждого метода свои преимущества и недостатки. Основные различия связаны с хромосомным числом, точностью
результата и ценой процедуры.
Многоцветная FISH — флуоресцентная гибридизация применяется для числовых и структурных
хромосомных поломок. С помощью FISH- гибридизации исследуется только часть хромосом: три, пять или семь
хромосом, чаще всего хромосомы — 13, 18, 21, X и Y. Так как некоторые хромосомы остаются непроверенными, то
этот
метод не гарантирует высокую точность результата, но выявляет распространенные генетические заболевания.
Сравнительная геномная гибридизация на микрочипах CGH/aCGH (comparative genomic
hybridization)
тестирует все 23 хромосомы одновременно, поэтому обеспечивает высокую результативность в отбраковке
зародышей с
анеуплоидией. Стоимость CGH выше, чем FISH.
При исследовании моногенных заболеваний применяются методы на основе ПЦР. Полимеразная цепная реакция
многократно
и избирательно копирует определенный геномный сегмент, который содержит ген для его дальнейшего
исследования.
NGS — секвенирование нового поколения (next-generation sequencing) – это метод определения
последовательности нуклеотидов ДНК, метод расшифровки генома человека. В настоящее время это наиболее
распространенный метод оценки генетического статуса эмбриона. Он определяет изменения генов, связанные с
полом,
наследственные и эмбриональные мозаичные мутации. С помощью секвенирования удается избежать множества ошибок
в
диагностике, так как метод имеет очень высокую чувствительность и специфичность.
ПГД эмбриона: за и против
Преимущества
Сегодня такое обследование является альтернативным способом снижения вероятности беременности больным плодом
и рождения ребёнка с генетическим заболеванием. Необходимо учитывать, что ПГД не может быть полной заменой
пренатальной диагностики.
Преимущества тестирования:
1 Выбор и перенос в матку только тех эмбрионов, которые не имеют хромосомных патологий
2 Снижение риска самопроизвольного прерывания беременности на ранних сроках
3 Снижение риска рождения ребёнка с определёнными дефектами
4 Снижение риска невынашивания беременности (примерно в 2 раза)
5 Снижение риска многоплодной беременности (примерно в 2 раза)
6 Увеличение шанса на успешную имплантацию (примерно на 10 %)
7 Увеличение шансов на благополучное рождение ребёнка (примерно на 15-20 %).
Стоит подчеркнуть, что когда женщины, находящиеся в старшей возрастной группе (40+) принимают решение зачать
ребенка с помощью ЭКО, то диагностика генетических нарушений является самым разумным подходом, позволяющим
повысить шансы на здоровое потомство.
Риски
1 возможность случайного повреждения зародыша (< 1%)
2 ошибки (до 10%)
3 вероятность ошибочной диагностики эмбриона с патологией, как нормального (3,5%)
4 вероятность ошибочной диагностики нормального эмбриона, как патогенного (10%)
5 отмена процедуры из-за того, что во всех зародышах была найдена патология (до 20%)
Основные недостатки методики:
— Возможность повреждения эмбриона при недостаточной квалификации врача (менее 1%).
— Получение ложноотрицательных и ложноположительных результатов при наличии у зародыша клеточного
мозаицизма (состояние, при котором в организме присутствуют клетки с 2 и более вариантами кариотипа,
при
этом, чаще всего, один пул клеток содержит нормальный кариотип, а другие – «патологический»). При
использовании современного цитогенетического теста такой риск существенно снижается (не более 10%).
— Длительность анализа ведет к откладыванию момента эмбриопереноса и использованию криоконсервации.
Однако эмбриологи утверждают, что процедуру следует выполнять с последующей витрификацией. Это не
только
позволяет осуществить доскональное тестирование, но и осуществить перенос в естественном цикле, что
значительно снизит нагрузку на женский организм и создает условия, максимально близкие к
естественному
оплодотворению.
— Высокая стоимость методики. Ее проведение ощутимо повышает стоимость протокола ЭКО.
— Необходимость прохождения лечебного цикла ЭКО при генетических заболеваниях родителей.
ПГД – это сложнейшая манипуляция по изъятию у бластомера нескольких клеток, которая должна быть
проведена специалистом, прошедшим специальную подготовку и имеющим опыт осуществления таких
исследований. Во всем мире возможность проведения такого обследования ограничивается стоимостью.
Цены в Санкт-Петербурге приблизительно одинаковы во всех клиниках, так как само тестирование
выполняется
ограниченным числом лабораторий, которые имеют необходимое оборудование и обученный персонал.
Разница
между клиниками в наличии эмбриологов, умеющих проводить биопсию бластомеров.
Записаться на прием