Тест с ответами по теме «Особенности проведения лабораторных исследований с использованием гематологических анализаторов»
Вашему вниманию представляется Тест с ответами по теме «Особенности проведения лабораторных исследований с использованием гематологических анализаторов» в рамках программы НМО: непрерывного медицинского образования для медицинских работников (врачи, медсестры и фармацевты).
Тест с ответами по теме «Особенности проведения лабораторных исследований с использованием гематологических анализаторов» в рамках программы НМО: непрерывного медицинского образования для медицинского персонала высшего и среднего звена (врачи, медицинские сестры и фармацевтические работники) позволяет успешнее подготовиться к итоговой аттестации и/или понять данную тему.
1. Вид контроля качества, выявляющий систематические ошибки
1) внешняя оценка качества;+
2) внутрилабораторный;
3) международный;
4) межлабораторный.
2. Вид салфеток для процедуры взятия крови на исследование с применением гематологического анализатора
1) безворсовые;+
2) ватно-марлевые;
3) ворсистые;
4) марлевые.
3. Виды обязательного контроля качества для исследований на гематологическом анализаторе
1) внешняя оценка качества и внутрилабораторный;+
2) внешняя оценка качества и межлабораторный;
3) внутрилабораторный и международный;
4) международная и межлабораторный.
4. Внутрилабораторный контроль качества проводится
1) ежедневно;+
2) ежеквартально;
3) ежемесячно;
4) еженедельно.
5. Дифференцировку макроцитарной, микроцитарной и нормоцитарной анемии проводят по показателю
1) HCT;
2) MCH;
3) MCHC;
4) MCV.+
6. Каким реагентом заполняют систему гематологического анализатора при длительном перерыве в работе?
1) гемолитик;
2) изотонический разбавитель;
3) консервирующий раствор;+
4) промывающий раствор.
7. Количество лейкоцитов крови в норме, 109/л
1) 2,5-7,5;
2) 3,9-4,5;
3) 4-5;
4) 4-9.+
8. Количество ретикулоцитов в норме, промилле
1) 1,0-4,0;
2) 10,0-12,0;
3) 2,0-10,0;+
4) 4,0-9,0.
9. Концентрация спирта (%) для дезинфекции места прокола пальца при заборе крови с целью исследования на гематологическом анализаторе
1) 55;
2) 70;+
3) 90;
4) 96.
10. Метод подсчета, применяемый в 3 диф анализаторах
1) кинетический;
2) кондуктометрический;+
3) рассеивания;
4) фотометрический.
11. Норма гематокрита у женщин
1) 25-36;
2) 30-33;
3) 33-46;+
4) 38-49.
12. Норма гематокрита у мужчин
1) 25-36;
2) 30-33;
3) 33-46;
4) 38-49.+
13. Норма среднего содержания гемоглобина в эритроците, пг
1) 21-26;
2) 27-31;+
3) 33-37;
4) 40-47.
14. Норма средней концентрации гемоглобина в эритроците, г/л
1) 150-200;
2) 250-300;
3) 300-380;+
4) 390-450.
15. Нормальное количество эритроцитов в крови у женщин, 1012/л
1) 3,7-5,1;
2) 3,9-4,7;+
3) 4-5;
4) 4-9.
16. Нормальное количество эритроцитов в крови у мужчин, 1012/л
1) 3,7-5,1;
2) 3,9-4,7;
3) 4-5;+
4) 4-9.
17. Оптимальное количество переворачиваний вакуумной пробирки с кровью после взятия
1) 1-2;
2) 15-20;
3) 5-7;
4) 8-10.+
18. Оптимальный период голодания перед забором крови для гематологических исследований (часов)
1) 20-24;
2) 4-5;
3) 6 -7;
4) 8-12.+
19. Оптимальный период забора крови для гематологических исследований между (часы)
1) 10-12;
2) 12-14;
3) 6-7;
4) 7-9.+
20. Период хранения венозной крови при температуре 20 -25 ºС для исследования на гематологическом анализаторе (часы)
1) 2;
2) 4;
3) 6;+
4) 8.
21. Период хранения капиллярной крови при температуре 20 – 25 ºС для исследования на гематологическом анализаторе (часы)
1) 2;
2) 4;+
3) 6;
4) 8.
22. Период хранения крови при температуре 4 – 8 ºС для исследования на гематологическом анализаторе (часы)
1) 10;
2) 12;
3) 20;
4) 24.+
23. Показатель насыщения эритроцита гемоглобином
1) HCT;
2) MCH;
3) MCHC;+
4) MCV.
24. Показатель ошибок анализатора
1) HCT;
2) MCH;
3) MCHC;+
4) MCV.
25. Показатель среднего объема одного тромбоцита
1) MCH;
2) MPV;+
3) PDW;
4) PLT.
26. Показатель, указывающий на массу гемоглобина в одном эритроците
1) HCT;
2) MCH;+
3) MCHC;
4) MCV.
27. Предпочтительный антикоагулянт при подсчете форменных элементов
1) ЭДТА-содержащий алюминий;
2) ЭДТА-содержащий калий;+
3) ЭДТА-содержащий кальций;
4) ЭДТА-содержащий натрий.
28. Содержание гемоглобина в норме у женщин составляет, г/л
1) 110-120;
2) 120-140;+
3) 130-160;
4) 170-195.
29. Содержание гемоглобина в норме у мужчин составляет, г/л
1) 110-120;
2) 120-140;
3) 130-160;+
4) 170-195.
30. Средний объем эритроцита в норме, фм
1) 110-130;
2) 50-70;
3) 70-90;
4) 80-100.+
31. Типы гематологических анализаторов в зависимости от количества определяемых субпопуляций лейкоцитов
1) 1- и 2-диф;
2) 3- и 5-диф;+
3) 4- и 6-диф.
Специальность для предварительного и итогового тестирования:
Лабораторная диагностика.
Уважаемые пользователи!
Каждый тест проходится вручную.
Это колоссальный труд авторов.
В это непростое время мы делаем все, чтобы сохранить Ваше время. Если хотите сказать Спасибо, то можете просто отправить ДОНАТ.
Спасибо, что Вы с нами!
1. Вид контроля качества, выявляющий систематические ошибки
1) внешняя оценка качества;+
2) внутрилабораторный;
3) международный;
4) межлабораторный.
2. Вид салфеток для процедуры взятия крови на исследование с применением гематологического анализатора
1) безворсовые;+
2) ватно-марлевые;
3) ворсистые;
4) марлевые.
3. Виды обязательного контроля качества для исследований на гематологическом анализаторе
1) внешняя оценка качества и внутрилабораторный;+
2) внешняя оценка качества и межлабораторный;
3) внутрилабораторный и международный;
4) международная и межлабораторный.
4. Внутрилабораторный контроль качества проводится
1) ежедневно;+
2) ежеквартально;
3) ежемесячно;
4) еженедельно.
5. Дифференцировку макроцитарной, микроцитарной и нормоцитарной анемии проводят по показателю
1) HCT;
2) MCH;
3) MCHC;
4) MCV.+
6. Каким реагентом заполняют систему гематологического анализатора при длительном перерыве в работе?
1) гемолитик;
2) изотонический разбавитель;
3) консервирующий раствор;+
4) промывающий раствор.
7. Количество лейкоцитов крови в норме, 109/л
1) 2,5-7,5;
2) 3,9-4,5;
3) 4-5;
4) 4-9.+
8. Количество ретикулоцитов в норме, промилле
1) 1,0-4,0;
2) 10,0-12,0;
3) 2,0-10,0;+
4) 4,0-9,0.
9. Концентрация спирта (%) для дезинфекции места прокола пальца при заборе крови с целью исследования на гематологическом анализаторе
1) 55;
2) 70;+
3) 90;
4) 96.
10. Метод подсчета, применяемый в 3 диф анализаторах
1) кинетический;
2) кондуктометрический;+
3) рассеивания;
4) фотометрический.
11. Норма гематокрита у женщин
1) 25-36;
2) 30-33;
3) 33-46;+
4) 38-49.
12. Норма гематокрита у мужчин
1) 25-36;
2) 30-33;
3) 33-46;
4) 38-49.+
13. Норма среднего содержания гемоглобина в эритроците, пг
1) 21-26;
2) 27-31;+
3) 33-37;
4) 40-47.
14. Норма средней концентрации гемоглобина в эритроците, г/л
1) 150-200;
2) 250-300;
3) 300-380;+
4) 390-450.
15. Нормальное количество эритроцитов в крови у женщин, 1012/л
1) 3,7-5,1;
2) 3,9-4,7;+
3) 4-5;
4) 4-9.
16. Нормальное количество эритроцитов в крови у мужчин, 1012/л
1) 3,7-5,1;
2) 3,9-4,7;
3) 4-5;+
4) 4-9.
17. Оптимальное количество переворачиваний вакуумной пробирки с кровью после взятия
1) 1-2;
2) 15-20;
3) 5-7;
4) 8-10.+
18. Оптимальный период голодания перед забором крови для гематологических исследований (часов)
1) 20-24;
2) 4-5;
3) 6 -7;
4) 8-12.+
19. Оптимальный период забора крови для гематологических исследований между (часы)
1) 10-12;
2) 12-14;
3) 6-7;
4) 7-9.+
20. Период хранения венозной крови при температуре 20 -25 ºС для исследования на гематологическом анализаторе (часы)
1) 2;
2) 4;
3) 6;+
4) 8.
21. Период хранения капиллярной крови при температуре 20 – 25 ºС для исследования на гематологическом анализаторе (часы)
1) 2;
2) 4;+
3) 6;
4) 8.
22. Период хранения крови при температуре 4 – 8 ºС для исследования на гематологическом анализаторе (часы)
1) 10;
2) 12;
3) 20;
4) 24.+
23. Показатель насыщения эритроцита гемоглобином
1) HCT;
2) MCH;
3) MCHC;+
4) MCV.
24. Показатель ошибок анализатора
1) HCT;
2) MCH;
3) MCHC;+
4) MCV.
25. Показатель среднего объема одного тромбоцита
1) MCH;
2) MPV;+
3) PDW;
4) PLT.
26. Показатель, указывающий на массу гемоглобина в одном эритроците
1) HCT;
2) MCH;+
3) MCHC;
4) MCV.
27. Предпочтительный антикоагулянт при подсчете форменных элементов
1) ЭДТА-содержащий алюминий;
2) ЭДТА-содержащий калий;+
3) ЭДТА-содержащий кальций;
4) ЭДТА-содержащий натрий.
28. Содержание гемоглобина в норме у женщин составляет, г/л
1) 110-120;
2) 120-140;+
3) 130-160;
4) 170-195.
29. Содержание гемоглобина в норме у мужчин составляет, г/л
1) 110-120;
2) 120-140;
3) 130-160;+
4) 170-195.
30. Средний объем эритроцита в норме, фм
1) 110-130;
2) 50-70;
3) 70-90;
4) 80-100.+
31. Типы гематологических анализаторов в зависимости от количества определяемых субпопуляций лейкоцитов
1) 1- и 2-диф;
2) 3- и 5-диф;+
3) 4- и 6-диф.
a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:76136:»
5. Реагенты. Важный компонент системы «автоматизированный анализ крови» — реагенты. Часто лаборатории, купив анализатор, сталкиваются с необходимостью нести довольно ощутимые постоянные затраты на реагенты. Количество разных реагентов, используемых анализатором, существенно влияет на себестоимость и качество исследований.
Каждый конкретный тип гематологического анализатора рассчитан на свою собственную реагентную систему, однако между ними есть много общего.
Основными составляющими комплектов реагентов для гематологических анализаторов являются:
— изотонический разбавитель;
— лизирующий раствор;
— промывающий раствор (после каждой пробы);
— промывающий раствор (для качественной очистки системы);
— очищающий раствор (для экстренной очистки датчика и/или сервисных работ).
В зависимости от конкретной конструкции анализатора в базовый комплект может входить лишь часть указанных реагентов.
Изотонический разбавитель — это буферный раствор с фиксированными параметрами рН, электропроводности и осмолярности. Слово «изотонический» указывает только на одно и не самое важное свойство реагента — поддержание требуемого осмотического давления с целью обеспечения постоянства объема клеток крови. Дело в том, что эритроциты принимают тот объем, который им диктует осмолярность раствора. При увеличении осмолярности, в течение 3-5 с эритроциты сжимаются до некоторого равновесного объема. Если осмолярность раствора уменьшается, объем эритроцитов, соответственно, увеличивается. Таким образом, средний объем эритроцитов (MCV) увязывается с осмолярностью изотонического разбавителя. Использование изотонического разбавителя, не соответствующего марке анализатора, может привести к ложному завышению/занижению MCV.
Стабилизирующие добавки в изотоническом разбавителе должны обеспечивать сохранность форменных элементов крови в первом разведении в течение достаточно длительного времени. Присутствие в растворе антикоагулянта должно эффективно предотвращать образование фибриновых сгустков и агрегацию тромбоцитов.
Очень важными компонентами гематологических реагентов и, в частности, изотонических разбавителей являются антибактериальные добавки, которые препятствуют бактериальному заражению гидравлических магистралей анализаторов. Учитывая тот факт, что бактериостатики, как правило, негативно влияют на клеточные мембраны, их выбор довольно ограничен. Следует иметь в виду, что для всех гематологических анализаторов с дифференциацией лейкоцитов на три популяции основным режимом является работа с цельной кровью. В случае гематологических анализаторов, проводящих дифференциацию лейкоцитов на три популяции, изотонический разбавитель содержит специальные добавки, модифицирующие мембраны лейкоцитов. В этом случае изотонический разбавитель должен применяться в согласованной паре с соответствующим лизирующим раствором.
NB! Нельзя совмещать в пару «изотонический раствор — лизирующий реагент» компоненты от разных производителей!
Другим важнейшим реагентом является лизирующий раствор (гемолитик), который при добавлении в разведение крови вызывает лизис эритроцитов и в то же время сохраняет лейкоциты. Необходимо, чтобы гемолиз эритроцитов был качественный и полный, поскольку в гемолизате подсчитываются лейкоциты, которых первоначально примерно в 1000 раз меньше, чем эритроцитов. Для обеспечения этих свойств лизирующий раствор, как правило, содержит сложную композицию ионных поверхностно-активных соединений. Современные гемолитики обеспечивают быструю реакцию и высокую степень отделения лейкоцитов от стромы независимо от настройки дискриминатора конкретного прибора.
В анализаторах с дифференциацией лейкоцитов на три популяции лейкоциты под действием лизирующего раствора изменяют свои размеры так, что выделяются фракции лимфоцитов (первый пик лейкоцитарной гистограммы), гранулоциты (крайний правый пик лейкоцитарной гистограммы). В средней части гистограммы, в области так называемых средних клеток, расположены моноциты, базофилы и эозинофилы. Наряду с факторами пробоподготовки свойства реагентной системы оказывают существенное влияние на качество дифференциации лейкоцитов.
Промывающие растворы непосредственно не участвуют в процессе измерения, однако их свойства существенно влияют на стабильность аналитических характеристик анализаторов. Характерной особенностью гематологических анализаторов, использующих принцип Культера, является наличие счетных апертур малого диаметра. Кровь содержит в себе ряд веществ, которые имеют тенденцию осаждаться на апертуре и внутренней поверхности гидравлической системы. Это постепенно приводит к уменьшению диаметра, закупорке апертуры и ошибочным результатам. В некоторых случаях прибор просто останавливается и требует тщательной промывки. Таким образом, качество промывающих растворов влияет на долговременную стабильность работы прибора.
Промывающие растворы бывают в основном трех типов. Первый тип — растворы для мягкой промывки магистралей анализатора между пробами, они не содержат поверхностно-активных веществ (детергенты) в значительных концентрациях. К сожалению, детергентные промывающие растворы практически не удаляют белки. Поэтому для очистки от белковых осадков применяют растворы на основе гипохлорита натрия — второй тип промывающих растворов. Эти растворы являются очень сильными депротеинезаторами. Однако раствор гипохлорита натрия — очень едкое вещество, долгого контакта с ним не выдерживают детали из пластика (они трескаются), металла (подвергаются коррозии). Поэтому злоупотреблять такими растворами нельзя. Данные растворы в основном применяются в экстренных случаях, когда необходимо быстро очистить счетную апертуру, а также для сервисных работ.
Современное решение проблемы качественной промывки прибора — применение ферментативных промывающих растворов. Благодаря наличию ферментов, такие растворы эффективно удаляют адсорбированные на стенках гидравлической системы белки и другие вещества. При этом они совершенно нейтральны и не оказывают вредного действия на детали прибора. Трудность создания таких промывающих растворов заключается в известном свойстве ферментов быстро терять активность.
6. Калибровка и контроль качества. Система управления качеством любого исследования складывается из оценки адекватности каждого этапа. Общеклинический анализ крови — не исключение, этапы его выполнения во многом схожи с другими видами лабораторных исследований и отличаются только применяемыми антикоагулянтами и аналитическим оборудованием:
1. Основание для назначения анализа.
2. Подготовка пациента.
3. Взятие биологического материала.
4. Идентификация проб.
5. Обработка биологического материала с использованием антикоагулянтов.
6. Транспортировка проб.
7. Аналитическое исследование на гематологическом анализаторе.
8. Оформление бланка с результатами теста (может выполняться на самом анализаторе).
9. Оценка результата по интервалам норм.
10. Использование результатов в диагностическом процессе.
Первые 6 пунктов включаются в понятие преаналитического этапа. Анализ назначается врачом и, как правило, берется натощак. Раздел 8 руководства подробно описывает правила и условия взятия и обработки проб.
Аналитический этап
Качество результатов исследования крови на гематологических анализаторах определяется следующими факторами:
— качеством используемых реагентов;
— точностью дозирования цельной или разведенной крови;
— точностью дозирования изотонического раствора при разведении крови;
— точностью определения объема суспензии клеток, пропущенной через апертуру;
— точностью самого подсчета клеток;
— точностью определения размеров клеток;
— корректностью математических методов обработки первичных результатов измерения.
Для настройки приборов производители применяют специальные калибровочные микросферы, которые представляют собой стандартные частицы латекса, а также фиксированные эритроциты. Обычно стандарт, выпущенный одной фирмой, не совсем подходит для калибровки приборов других фирм.
Говоря о калибровке, хочется привести пример искажения результатов MCV, связанный с самим методом определения объема частицы. Если откалибровать анализатор взвесью эритроцитов, имеющих нормальную двояковогнутую форму, а затем измерить сферические клетки такого же объема, они будут восприняты как микроциты. И наоборот, если при калибровке применить сфероциты, то прибор будет регистрировать двояковогнутые нормоциты как макроциты. В коммерческих препаратах контрольной крови, применяемой для настройки приборов, эритроциты имеют сферическую форму, поэтому трудно говорить об адекватной калибровке MCV. До настоящего времени нет общепринятого стандарта для MCV.
Калибровка гематологических анализаторов представляет до сих пор не решенную до конца проблему. Если, например, для калибровки ручных методов определения гемоглобина существуют стандарты гемиглобинцианида, то признанных стандартов для калибровки счета клеток не существует. Те взвеси частиц и контрольная кровь, которые предлагают фирмы-производители для контроля своих приборов, калибраторами не являются и предназначены для проведения процедур контроля правильности положения дискриминаторов и счета импульсов. Все применяемые для «калибровки» и контроля работы приборов материалы имеют доверительные интервалы, в которые необходимо уложиться.
Если при калибровке гематологического анализатора показатели не укладываются в допустимые границы паспортных значений, необходимо исключить преаналитические ошибки: недостаточное перемешивание, отличие температуры контрольной крови, извлеченной из холодильника, от комнатной, нарушение режима хранения, приводящее к порче крови. Например, иногда приходилось наблюдать, как контрольную кровь замораживали. При замораживании наблюдается сильное занижение количества эритроцитов. Это бывает при хранении крови в старых моделях холодильников, встречающихся во многих лабораториях, рядом с морозильной камерой. Здесь температура может опускаться на несколько градусов ниже нуля, и этого достаточно для замораживания и последующего разрушения эритроцитов.
Необходимо также провести ряд мероприятий по обслуживанию прибора, по промывке и очистке апертур, затем вновь провести калибровку.
Клетки (частицы) контрольной крови должны удовлетворять следующим требованиям:
— отсутствие электропроводности;
— сопоставимость по размерам с контролируемыми клетками;
— сходная плотность;
— стабильность размеров во времени;
— химическая инертность.
Выпускаемая сегодня контрольная кровь представляет собой химеру, содержащую стабилизированные эритроциты, частицы латекса вместо лейкоцитов, тромбоциты животных и др. Поэтому стабилизированная кровь не является идеальным контрольным материалом, так как у содержащихся в ней клеток изменены размеры, форма поверхности, реологические свойства и специфическая электропроводность.
Следует заметить, что коммерческая контрольная кровь позволяет исследовать от 8-18 параметров и более. Для контроля приборов с дифференциацией лейкоцитов на 3 части используется кровь на 16-18 параметров. Однако необходимо понимать, что калиброванные латексные частицы, имитирующие лейкоциты, не реагируют на действие лизирующего раствора и при анализе не отражают правильность работы всей системы, а лишь правильность установки дискриминаторов. По сути, особого смысла в приобретении такой, более дорогой, крови нет, достаточно использовать контрольную кровь на 8-10 параметров.
Контрольная кровь применяется:
— для проверки правильности и воспроизводимости счета клеток;
— для проверки правильности разведения;
— для «калибровки» прибора.
Ежедневный контроль гематологических исследований включает исследование контрольной крови на анализаторе с каждой серией значений — в области нормы и в области низких и высоких значений. Все правила построения контрольных карт Леви-Дженнингса и оценка результатов по правилам Вестгарда применимы для работы с контрольной кровью, исследуемой на гематологических анализаторах. Поскольку коммерческая контрольная кровь до вскрытия флакона стабильна 4-6 мес, а после вскрытия — 20-30 дней, возможно и необходимо проводить ее анализ через каждые 20 проб пациентов и, конечно же, в каждой серии проб. Это позволяет:
1. Выявить отклонения в результатах исследований еще до того, как они станут клинически значимыми.
2. Получить необходимое количество результатов для более быстрого накопления статистики и построения карт, а также для оперативной оценки воспроизводимости работы прибора.
Многие современные гематологические анализаторы имеют встроенную программу оценки качества исследований, включающую построение контрольных карт.
Для повышения качества проводимых лабораторией исследований очень важно организовать не только внутрилабораторную, но и внешнюю межлабораторную систему управления качеством в форме локального, городского, федерального контроля. Внешний контроль качества позволяет справиться с наиболее трудной задачей — выявлением и устранением систематических ошибок измерений.
7. Обслуживание, консервация прибора. При эксплуатации гематологических анализаторов важную роль играет качество электрической сети и заземления. Внезапные отключения электропитания, перепады напряжения могут привести к выходу из строя микросхем и плат, сбоям в гидравлической системе, что неизбежно повлечет увеличение расходов на ремонт и обслуживание прибора. Приобретая гематологический анализатор, как и любое другое лабораторное оборудование, надо привыкнуть к необходимости затрат не только на расходные материалы, но и на такую важную «деталь», как источник бесперебойного питания с надежной стабилизацией напряжения.
Отключение электропитания на несколько часов в момент отбора и обработки пробы может привести к засорению трубок, апертур, клапанов. Это повлечет сбой дальнейшей работы, необходимость дополнительных процедур промывки и очистки прибора или даже незапланированное обслуживание прибора.
При получении прибора специалист, осуществляющий установку и обучение работе с анализатором, обязательно обратит ваше внимание на необходимость контроля фоновых значений, получаемых при счете в камерах без пробы. Многие приборы делают такой подсчет автоматически при запуске (процедура «start up»). Эта проверка фона дает уверенность в правильном определении параметров. В руководстве оператора к прибору обычно приводятся фоновые значения (табл. 1).
У большинства современных анализаторов есть процедура завершения работы («shut down»). Она позволяет удалить остатки биологического материала из системы, провести промывку прибора и подготовить его к отключению. Процедуры начала и окончания работы обязательны для выполнения.
Одно из действий прибора — заполнение счетных камер и микроотверстий моющим раствором, содержащим протеолитический фермент. Этот раствор находится в камерах несколько часов (ночь). Кровь, даже разведенная анализатором для подсчета, содержит достаточное количество белковых компонентов, постоянно оседающих на трубках, апертурном отверстии. К этим белкам прилипают микроскопические частицы, обломки клеток, бактерии. За несколько десятков циклов счета эта белково-детритная «пленка» может значительно увеличиться и привести к уменьшению диаметра отверстия. В результате — нарушение правильности подсчета (см. рис ).
Фермент, входящий в состав промывающего (моющего, очищающего) раствора, за несколько часов полностью растворяет белковую матрицу пленки и прибор вновь готов к работе.
Неукоснительное выполнение процедуры выключения является одним из факторов нормальной работы гематологического анализатора. Прибор, эксплуатируемый круглосуточно, не подвергается ферментативной очистке, что может привести к значительному изменению диаметра апертуры и нарушению счета. В таком отверстии могут застревать более мелкие частицы (ранее миновавшие апертуру беспрепятственно) и останавливать работу анализатора.
При закупоривании апертуры (сигнал «clog», «clogging») микросгустками, волокнами, частицами, прибор отмечает увеличение времени счета или разницу в количестве частиц, сосчитанных за несколько временны`х отрезков, в зависимости от конструкции прибора. При возникновении такой ситуации прибор обычно реализует запрограммированную процедуру автоматического устранения закупорки. Если самоочистка не приносит успеха, оператору необходимо вручную выполнить следующие действия:
— провести очистку концентрированным ферментативным раствором;
— провести очистку раствором специально приготовленного гипохлорита натрия;
— активизировать из меню прибора процедуру специальной очистки апертуры токами высокой частоты («прожиг» апертуры).
Неэффективность всех этих действий указывает на серьезную механическую закупорку микроотверстия и требует снятия и чистки апертуры в соответствии с инструкцией на прибор. В некоторых случаях может даже потребоваться вмешательство сервисной службы.
Важно помнить, что для обслуживания прибора необходимо всегда четко следовать инструкциям производителя.
Иногда, при эксплуатации гематологических анализаторов, большой проблемой становится высокий фон в канале счета тромбоцитов. Это часто наблюдается при загрязнении разбавителя штаммами бактерий, устойчивых к антибактериальным добавкам. Смена канистры с изотоническим раствором дает кратковременный успех — трубка, перенесенная из одной канистры в другую, заселяет микроорганизмами новую канистру. Через некоторое время бактерии размножаются и фон снова увеличивается. Эта ситуация требует полной дезинфекции гидравлических магистралей прибора, а иногда и замены состава реагентов и антибактериальных добавок в них.
Другой причиной увеличения фона и ложного цитоза может стать рост бактерий и попадание их в счетные камеры по трубкам слива от емкости отходов («waste»). Поверхности от камер до контейнера с отходами покрываются белково-липидной пленкой, на которой, как на питательной среде из агара, прорастают микроорганизмы. Несмотря на антибактериальные добавки, содержащиеся в дилюенте, бактерии быстро размножаются в банке с отходами и «дорастают» до камер счета. Для предотвращения этой проблемы необходимо:
1. Чаще опорожнять емкость с отходами.
2. Периодически проводить дезинфекцию емкости и сливных шлангов (о частоте и способе запросите инструкции у вашей сервисной службы).
3. НЕ ДОПУСКАТЬ соприкосновения конца сливного шланга с поверхностью отходов в канистре.
Консервация прибора
Гематологический анализатор, как и любой прибор, приобретается для того, чтобы работать непрерывно и избавлять лабораторию от трудоемких ручных операций. Приобретение анализатора является осознанной необходимостью. Ситуация с остановкой прибора из-за недостатка финансирования покупки расходных материалов — нонсенс, но встречается часто.
Если все же работу прибора приходится остановить, самое главное — это подготовить анализатор к длительному простою.
Большинство гематологических анализаторов можно остановить не более чем на одну неделю почти без последствий (летом, в жару, опаснее). Более долгий период простоя прибора с реагентами внутри системы приводит к размножению бактерий, высыханию солевых растворов, склеиванию трубок, прижатых клапанами, кристаллизации солей в апертурах, микротрубках. Привести прибор в рабочее состояние после такого безответственного отношения к нему требует множества сил и времени. Случаи оставления приборов с растворами не являются гарантийными, и пользователь вынужден будет оплачивать услуги сервисной службы в гарантийный срок, если не выполнит нескольких простых действий.
Эти действия чаще описаны в руководстве оператора или могут быть запрошены у сервис-инженеров. Процедура консервации в общих чертах выполняется с использованием соответствующих команд меню анализатора следующим образом:
1. Произвести очистку апертур, камер, трубок, гидравлической системы дезинфицирующим раствором (гипохлоритом).
2. Слить из жидкостной системы все реагенты (изотонический разбавитель, лизирующий и моющий растворы).
3. Промыть систему дистиллированной водой.
4. Осушить систему, прокачав воздух.
Теперь прибор готов к длительному ожиданию следующей поставки реагентов.
Совет: если есть небольшой запас изотонического разбавителя и поставка реагентов ожидается в ближайшее время, лучше прекратить выполнять анализы. Прибор необходимо включать и выключать 2-3 раза в неделю, выполняя процедуры начала и окончания рабочего дня («start up» и «shut down») с оставшимися растворами. Это будет поддерживать прибор в рабочем состоянии до поступления новой партии реактивов. Не следует проводить описанные процедуры с использованием дистиллированной воды, в ней нет антибактериальных добавок, прибор в этом случае может стать инкубатором для бактерий и грибков.
8. Преаналитика, ошибки и проблемы. Даже при наличии современного гематологического анализатора лаборатория иногда выдает результаты, не отражающие истинное состояние пациента, вводящие в заблуждение лечащих врачей. Денег в прибор вложено много, а результат не всегда удовлетворительный. В чем причина?
От 70 до 80% лабораторных ошибок связаны с нарушениями на преаналитическом этапе, ошибки аналитического этапа составляют 10-15%, постаналитического — 15-20%.
Ошибки внелабораторного этапа отличают случайность, бессистемность и трудноуловимость. Именно внелабораторные ошибки вносят самый весомый вклад в искажение результатов анализа, маскируются под проблемы, связанные с приборами и реагентами. В таких случаях несоответствие результатов клинической картине или результатам предыдущего обследования заставляет сотрудников лаборатории перепроверять аппаратуру или заменять реагенты. Это приводит к нерациональной трате рабочего времени и средств, а выявить истинную причину проблемы, как правило, не удается.
Взятие образца, его транспортировка, хранение требуют постоянного контроля со стороны лаборатории. Для получения качественных результатов необходимо учитывать присутствие в пробе интерферирующих веществ, индивидуальные особенности пациента, его подготовку к взятию пробы на анализ. Усилия по предотвращению ошибок на этом этапе окупятся ощутимым улучшением качества гематологических исследований, снижением необоснованных повторов, расходов рабочего времени и средств на обследование больного.
Только полностью стандартизуя все этапы гематологического, да и любого другого исследования от назначения до интерпретации результатов, можно ожидать получения адекватных данных.
Техника взятия крови, используемые иглы, скарификаторы, капилляры, пробирки для транспортировки и хранения проб, реагенты и аналитические системы — все должно быть «однородным» изо дня в день. Часть проблем устраняется с внедрением коммерческих систем взятия венозной и капиллярной крови (вакуумных и невакуумных пробирок с антикоагулянтами).
Взятие крови
Материал для анализа. Вена или палец?
Наилучшим материалом для выполнения анализа на гематологических анализаторах является венозная кровь. Несмотря на распространенное среди медицинских работников отечественных ЛПУ мнение, что «часто в вену лазить» плохо, во всем цивилизованном мире кровь на общий анализ у взрослых берется именно из вены. Важным подспорьем для взятия венозной крови на гемограмму стала разработка и широкое внедрение вакуумных пробирок, содержащих антикоагулянт. Принудительное всасывание крови под действием вакуума позволило использовать для венозной венепункции тонкие атравматичные иглы. Капиллярная кровь в других странах используется реже, в основном у маленьких детей, и связано это с техническими трудностями получения у них венозной крови. Очевидно, что для медицины развитых стран намного важнее получение достоверных результатов из более адекватного материала, чем лозунги об опасности венепункции. Тканевая жидкость, обрывки тканей и микросгустки в капиллярной крови — причина ошибок и сбоев анализатора.
В пробах капиллярной крови более активно происходит агрегация тромбоцитов, больше травмируются форменные элементы, Венозная же кровь, взятая в объеме 2-3 мл, может быть проанализирована повторно, из нее можно выполнить дополнительные исследования.
Взятие капиллярной крови рекомендовано:
— у новорожденных, детей младшего возраста;
— у лиц со склонностью к венозному тромбозу;
— при обширных ожогах и выраженном ожирении;
— при мелких и труднодоступных венах.
На преаналитическом этапе взятия биологического материала имеется более сотни (!) условий, регламентирующих получение адекватных результатов.
Взятие венозной крови как метод выбора имеет свои правила и ограничения, обсуждаемые в специальной литературе. Стоит напомнить, что для исключения общих факторов, влияющих на результаты гематологического исследования, необходимо соблюдение следующего:
— кровь берется после 15-минутного отдыха пациента;
— исключается прием алкоголя и курение непосредственно перед исследованием;
— кровь берется натощак, утром (7-9 ч), пациент во время процедуры сидит или лежит;
— наложение жгута на руку более чем на 1 мин приводит к сосудистому стазу и завышению уровня гемоглобина в венозной крови;
— для взятия венозной крови необходимо избегать мест травм, шрамов, гематом; вен, используемых для переливания растворов; ножных вен у больных диабетом, при нарушениях периферического кровотока, ангиопатиях.
Антикоагулянт
Стабилизация крови, анализируемой на автоматических счетчиках, проводится натриевыми или калиевыми солями этилендиаминтетрауксусной кислоты (ЭДТА — этилендиаминтетраацетат). Гепарин и цитрат натрия для этих целей не применяется. Кровь, стабилизированная цитратом натрия, используется при исследовании гемостаза и СОЭ.
Обычно указываемая в справочниках и инструкциях к приборам концентрация ЭДТА — 1-2 мг на 1 мл для венозной крови. В случае капиллярной крови концентрация антикоагулянта должна быть увеличена в 2-3 раза. Увеличение концентрации ЭДТА в 5 раз не опасно и приводит лишь к небольшому снижению MCV, но увлекаться не стоит.
Одно из важных условий получения качественного образца — тщательное перемешивание крови с антикоагулянтом. Имеет значение и форма нанесения антикоагулянта. Лучшие результаты дает применение пробирок с аэрозольным покрытием и мелкодисперсным порошковым напылением. Кристаллическая форма солей ЭДТА плохо растворима в крови. Применение кристаллических солей приводит к образованию фибриновых нитей в верхней части пробы крови.
Для предотвращения свертывания крови пробирку следует перевернуть, НЕ ВСТРЯХИВАЯ (!), около 10 раз.
Недостаток антикоагулянта в пробе (крови взято больше отмеченного на пробирке уровня) приводит к образованию микросгустков и нарушению работы прибора. Избыток антикоагулянта может повлиять на некоторые показатели только при очень большом превышении оптимальной концентрации.
Анализ СОЭ может быть выполнен из крови, стабилизированной ЭДТА.
Все, как обычно: 4 части крови смешать с 1 частью 3,8% раствора цитрата или физиологического раствора, выдержать 60 мин в капилляре, измерить.
Из стабилизированной ЭДТА можно приготовить мазки крови для подсчета лейкоформулы, но как можно быстрее от момента получения крови.
Авторы надеются, что в самое ближайшее время во всех отечественных лабораториях методы взятия венозной и капиллярной крови с использованием стандартизованных коммерческих систем, обработанных антикоагулянтом, станут нормой жизни. Медицинским сестрам, сопротивляющимся внедрению взятия крови на общий анализ из вены («мы не будем работать на лабораторию!»), необходимо помнить, что вся деятельность учреждений здравоохранения и персонала больниц и поликлиник направлена, в первую очередь, на благо пациента.
Безопасность
Взятие венозной крови с помощью вакуумных систем также называют бесконтактным методом. При работе с вакуумными пробирками, кроме всех прочих преимуществ, отсутствует контакт медицинского персонала с кровью (как при взятии через обычную иглу в пробирку) и, особенно, с аэрозолями крови, образующимися в большом количестве при взятии шприцем. Этот самый излюбленный метод, когда кровь струей устремляется в пробирку (травмирование клеток, гемолиз и пр.), одновременно является и самым опасным, самым «грязным» способом!
Кроме того, взятие крови шприцем с последующим разливанием аликвот по пробиркам вообще недопустимо из-за опасности образования микросгустков, травмирования иглой оператора, высокой вероятности попадания следов крови на руки медсестры, окружающие предметы!
Лозунги о недостатке средств на одноразовые изделия для взятия крови, исключающие преаналитические ошибки, меркнут перед статистикой заражения медицинского персонала вирусным гепатитом. Качество лабораторных исследований и безопасность работников здравоохранения должны чего-то стоить!
Кроме этих систем: стерильные одноразовые пособия: иглы, скарификаторы, перчатки, салфетки. Все, как всегда, плюс маски, дезрастворы, система утилизации.
Салфетки
Взятие крови для автоматического гематологического анализатора возможно только с использованием безворсовых материалов.
Никакой ваты для обработки кожи! Ворсинки ваты вместе с кровью попадают в гемоглобиновую и счетные камеры анализатора, нарушают точность и воспроизводимость анализа, это приводит к увеличению расхода реагентов (повторные промывки) и необходимости внепланового технического обслуживания прибора. Экономия на салфетках оборачивается увеличением затрат на ликвидацию последствий экономии.
Специальные салфетки, пропитанные дезинфицирующими составами и упакованные в индивидуальные пакеты в заводских условиях, — лучшая альтернатива ватным и марлевым шарикам.
Пробирки из пластика являются единственно возможными при взятии крови для последующей обработки на анализаторе.
Кровь, взятая в правильном соотношении с адекватным антикоагулянтом в пластиковую пробирку, сохраняется несколько часов (до 24 ч при 4 °С) без существенных изменений количества и морфологии клеток. Однако скорейшее выполнение анализа предпочтительно, так как патологические клетки менее устойчивы к хранению.
Контакт со стеклом, как и недостаточное количество антикоагулянта, неизбежно приводит к активации тромбоцитов и их агрегации. Результат агрегации — ложная «преаналитическая» тромбоцитопения 50-80·109/л, ошибка счета лейкоцитов может достигать 150% (ложный лейкоцитоз/лимфоцитоз), число эритроцитов может быть завышено почти на 0,5 Т/л, отсюда — неправильно рассчитанные эритроцитарные индексы. Это же может наблюдаться при появлении в кровотоке гигантских форм тромбоцитов, фрагментов мегакариоцитов, но уже относится к факторам физиологии пациента.
Кровь в пластиковых пробирках значительно меньше подвергается травмированию при транспортировке.
Как только цельная кровь взята в пробирку с антикоагулянтом и установлена в штатив, запускается процесс седиментации клеток (подобный СОЭ). Уже в первые минуты стояния образца эритроциты продолжают беспорядочно перемещаться и агрегируют с образованием «монетных столбиков». Спустя 4 мин эритроцитарные агрегаты состоят примерно из 10 эритроцитов, далее они постепенно становятся крупнее (до 50 и более эритроцитов) и разветвляются.
При хранении пробирок со стабилизированной кровью в вертикальном положении появляется лейкоцитарная пленка, состоящая из лейкоцитов и тромбоцитов. Они скапливаются на границе между эритроцитами и плазмой. Недостаточное перемешивание осевшей крови может стать одним из наиболее серьезных источников погрешности при анализе.
Пробирки типа «эппендорф»
В некоторых лабораториях кровь берут в эти «микроконические» пробирки. Цельная кровь имеет высокую вязкость, качественно перемешать ее в пробирке типа «эппендорф» очень трудно. После оседания клеток крови в этот маленький конус оператор может погрузить пробоотборник в более жидкую или более густую фракцию. Результатом будет неправильный счет. Поэтому специалисты не рекомендуют такие пробирки для гематологических исследований.
Нельзя трясти пробу крови! Ручное перемешивание даже в круглодонных микропробирках — процесс с большой долей человеческого фактора — источник ошибок.
Качественное перемешивание пробы возможно с использованием специальных гематологических миксеров. Эффект от приобретения дорогого анализатора часто сводится к нулю из-за экономии нескольких сотен рублей на покупке ротационного или качающего пробирки устройства (шейкера, гематологического миксера).
Продолжительность перемешивания до непосредственного анализа крови должна составлять не менее нескольких минут. Это время зависит от скорости перемешивания, конфигурации пробирок, вязкости крови и других факторов, но в среднем должно составлять не менее 2 мин.
Необходимо помнить, что длительное перемешивание может привести к травмированию и распаду патологических клеток.
Правильное решение проблемы — применение уже упоминавшихся вакуумных пробирок, гематологического миксера и приборов с автоматической системой отбора пробы (автосамплера).
Для преаналитического и аналитического этапов гематологического анализа оптимально:
— применение одноразовых безворсовых салфеток, обработанных дезинфицирующим составом;
— применение одноразовых стерильных вакуумных систем для венозной и микропробирок для капиллярной крови;
— применение перемешивающих устройств для гомогенизации крови или приставки-автосамплера к прибору.
Одноразовые системы для взятия крови не только обеспечивают качество исследований, но и помогают соблюдать санитарно-эпидемиологические требования.
Использование вакуумных систем позволяет:
— снизить опасность возможного инфицирования персонала при работе с кровью (так как кровь сразу же из вены поступает в герметично закрытую пробирку), конструкция систем полностью исключает контакт крови пациента с окружающей средой;
— повысить достоверность результата анализа за счет исключения ошибок преаналитического этапа, связанных с транспортировкой и центрифугированием пробирок;
— обеспечить сохранность проб, исключить разбивание пробирок при транспортировке и центрифугировании и уменьшить риск соприкосновения с кровью при порезе колотым краем стеклянной пробирки; отсутствует необходимость уравновешивания пробирок при центрифугировании;
— исключить ошибки идентификации пациента, пробирки снабжены этикеткой для маркировки;
— соблюсти правильное соотношение кровь-антикоагулянт, важное для точности результатов анализа;
— набрать кровь в одну, две пробирки и более за очень короткий промежуток времени и без повторного
6.1. Определения коэффициента ошибок
6.2. Математическое выражение коэффициента битовых ошибок
6.3. Нормы на параметры ошибок систем передачи
6.4. Принципы построения измерителей ошибок
6.5. Техника измерения коэффициента ошибок
6.1. Определения коэффициента ошибок
Коэффициент ошибок – важнейшая характеристика линейного тракта. Он измеряется как для отдельных участков регенерации, так и для тракта в целом. Определяется коэффициент ошибок kОШ, по формуле:
kОШ = NОШ /N, (6.1)
где N – общее число символов, переданных за интервал измерения; NОШ – число ошибочно принятых символов за интервал измерения.
Измерение коэффициента ошибок носит статистический характер, так как получаемый за конечное время результат является случайной величиной. Относительную погрешность измерения в случае нормального закона распределения числа ошибок, что допустимо при N≥10, можно определить по формуле:
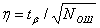
Здесь — коэффициент, зависящий от доверительной вероятности результата измерений:
, (6.3)
где — обратная функция интеграла вероятности
:
. (6.4)
Значение kОШ позволяет оценивать вероятность ошибки pОШ – количественную оценку помехоустойчивости. Область возможных значений оценки, в которой с заданной доверительной вероятностью будет находиться значение pОШ, определяется верхней (pВ) и нижней (pН) доверительными границами. При нормальном законе распределения числа ошибок значения pВ и pН определяются по формулам:
, (6.5)
, (6.6)
Очевидно, что точность оценок вероятности ошибки и коэффициента ошибки растет с увеличением N. Общее число символов цифрового сигнала, переданных за интервал измерения T, зависит от скорости передачи B: N = TB. Отсюда следует, что чем больше скорость передачи, тем быстрее и точнее можно оценить коэффициент ошибок.
6.2. Математическое выражение коэффициента битовых ошибок
Определим коэффициент битовых ошибок для реальных приёмников, которым свойственно наличие различных источников шумов. При этом будем считать, что приёмник принимает решение, какой бит (0 или 1) был передан в каждом битовом интервале путем стробирования фототока. Очевидно, что из-за наличия шумов данное решение может быть неверным, что приводит к появлению ошибочных битов. Поэтому, чтобы определить коэффициент битовых ошибок, необходимо понять, каким образом приемник принимает решение относительно переданного бита.
Обозначим через I1 и I0 фототоки, стробированные приемником в течение 1 и 0 битов, соответственно, а через s12 и s02 соответствующие шумы. Принимая, что последние имеют гауссовское распределение, проблема установления истинного значения принятого бита имеет следующую математическую формулировку. Фототок для битов 1 и 0 является выборкой гауссовской переменной со средним значением I1 и вариацией s1, а приёмник должен отслеживать этот сигнал и решать, является ли переданный бит 0 или 1. При этом существует много возможных правил принятия решения, которые могут быть реализованы в приёмнике с целью минимизации коэффициента битовых ошибок. Для значения фототока I этим оптимальным решением является наиболее вероятное значение переданного бита, которое определяется путём сравнения текущего значения фототока с пороговым значением Iп, используемым для принятия решения.
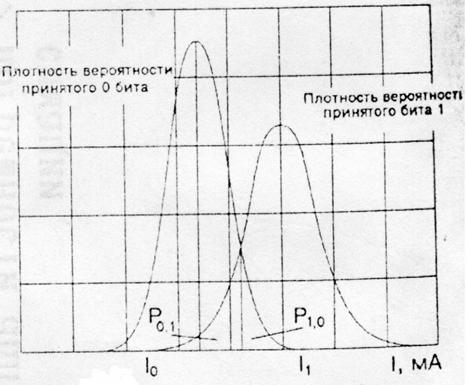
Рисунок 6.1. Функция плотности вероятности фототока принятых сигналов
Пусть при I ³ Iп принимается решение о том, что был передан бит 1, в противном случае – бит 0. Когда биты 1 и 0 равновероятны, что и рассматривается в дальнейшем, пороговый ток приблизительно равен:
(6.7)
Геометрически Iп представляет собой значение тока I, для которого две кривые плотности вероятностей (рис. 6.1) пересекаются.
Вероятность того, что I < Iп, т. е. вероятность ошибки при передаче бита 1, обозначим через Р0,1, а вероятность решения для переданного бита 1, когда I ³ Iп при переданном 0, обозначим Р1,0.
Пусть Q(х) обозначает вероятность того, что нулевая средняя вариация гауссовской переменной превышает значение х, тогда:
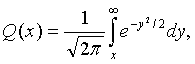
а
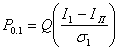
а
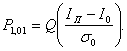
Можно показать [14], что BER определяется,
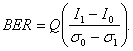
Очень важно отметить, что в ряде случаев эффективным является использование изменяемого в зависимости от уровня сигнала порога принятия решения, как, например, шума оптического усилителя. Многие высокоскоростные приёмники обладают такой особенностью. Однако более простые приемники имеют порог, соответствующий среднему уровню принимаемого тока, а именно (I1 + I0)/2. Такая настройка порогового значения дает большой коэффициент битовых ошибок, определяемый выражением [14].
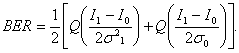
Выражение (6.11) можно использовать для оценки BER, когда известны как мощность полученного сигнала, соответствующего битам 0 и 1, так и статистика шумов.
6.3. Нормы на параметры ошибок систем передачи
Битовые ошибки являются основным источником ухудшения качества связи, проявляющегося в искажении речи в телефонных каналах, недостоверности передачи информации или снижении пропускной способности передачи данных, и характеризуются статистическими параметрами и нормами на них, которые определены соответствующей вероятностью выполнения этих норм. Последние делятся на долговременные и оперативные нормы, первые из которых определяются рекомендациями ITU-T G.821 и G.826, а вторые – М.2100, М.2110 и М.2120, при этом, согласно М.2100, качество цифрового тракта по критерию ошибок делят на три категории:
- нормальное – BER < 10-6;
- пониженное – 10-6 ≤ BER < 10-3 (предаварийное состояние);
- неприемлемое – BER ≥ 10-3 (аварийное состояние).
Так как появление ошибок является следствием совокупности всех текущих условий передачи цифровых сигналов, имеющих случайный характер, то при отсутствии данных о законе распределения ошибок его отдельные элементы могут быть определены с определенной степенью достоверности только по результатам продолжительных измерений. В то же время на практике необходимо, чтобы значения параметров ошибок для ввода в эксплуатацию и технического обслуживания систем передачи основывались на достаточно коротких интервалах времени измерения. Исходя из этого, были определены следующие параметры ошибок [14]:
- секунда с ошибками (error second, ES) – односекундный интервал, содержащий хотя бы один ошибочный бит;
- секунда, пораженная ошибками (severely error second, SES) – односекундный интервал с BER ≥ 10-3.
Данные параметры ошибок должны оцениваться в течение времени готовности (available time), отсчет которого начинается с первой секунды из десяти следующих друг за другом секунд, в каждой из которых BER<10-3. ITU-T M.2100 регламентирует нормы качества (performance objectives, PO) на выраженные максимальным процентом времени параметры ошибок, которые зависят только от скорости передачи и приводятся для условного эталонного соединения (hypothetical reference connection, HRC/HRX/) длиной 27500 км. При этом нормы качества распределяются по участкам соединения соответствующей категории качества. В качестве эталонной модели такого распределения принимается участок высокой категории качества протяженностью 25000 км, которому присваивается 40% от общей нормы качества на параметры ошибок передачи точка-точка, что в пересчете на 1 км, дает 0.0016 %/км.. Остальные 4 участка (2 среднего качества и 2 с приемлемым качеством) длиной 2 х 1250 км расположены по обе стороны от центрального. Поэтому распределение, пропорциональное протяженности L км тракта высокой категории качества, будет определяться, как
AL = 0.0016 · L %/км. (6.13)
Нормы качества на цифровые тракты и каналы подразделяются на настроечные и эксплуатационные, причем вводимые в эксплуатацию впервые или после проведения корректирующих действий они должны сдаваться по настроечным нормам качества, а в процессе эксплуатации должны соответствовать эксплуатационным нормам. Обычно [105] эксплуатационная норма представляется в виде эталонной нормы качества (reference performance objective, RPO)
RPO = A · T · PO, (6.14)
а настроечная, включающая запас на старение, используемая при вводе в эксплуатацию (bringing into service objective, BISO), определяется, как половина RPO, т.е.
BISO = RPO/2. (6.15)
Здесь PO – норма качества оцениваемого параметра, а T = 86400 с (одни сутки) – продолжительность измерений (количество односекундных интервалов).
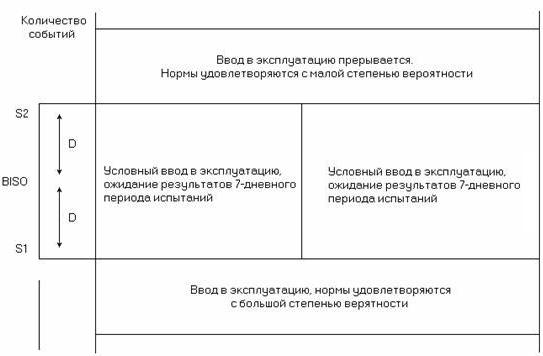
Для анализа результатов, полученных в процессе измерений, используются также предельные значения S1и S2 норм (рисунок 6.2), которые соответствуют числу событий (ES,SES) и определяются, как:
S1 = RPO/2 – D и S2 = RPO/2 + D, (6.16)
где D = 2 — дисперсия оцениваемого параметра.
Рисунок 6.2. Предельные значения и условия ввода в эксплуатацию системы передачи
При соответствии результатов измерений норме S1 цифровой тракт может быть введен в эксплуатацию без всякого сомнения, а при превышении нормы S2 в обязательном порядке требуется повышение качества испытываемого цифрового тракта, т.е. должны быть проведены корректирующие действия с повторными измерениями. Если значение ES или SES лежит в интервале от S1 до S2, цифровой тракт может быть введен в эксплуатацию условно или временно с продолжением измерений в течение 7 суток. Данный подход к оценке качества цифровых систем передачи по параметрам ошибок позволяет сократить время измерений и получить норму цифрового тракта суммированием норм цифровых участков. При этом значения RPO, D, S1 и S2 выражаются в виде числа событий за установленный интервал времени, а не в виде процентов времени.
Для измерения коэффициента ошибок разработан ряд специальных BER анализаторов – измерителей коэффициента ошибок, включающих генераторы псевдослучайных и детерминированных последовательностей передаваемых кодированных символов, а также приемное оборудование, осуществляющее собственно измерение коэффициента ошибок. В случае посимвольного сравнения кодов измерение может быть выполнено с использованием шлейфа, т.е. путем измерения ошибок с одной оконечной станции при установке на противоположном конце шлейфа. Другой метод основан на выделении ошибок благодаря избыточности используемых кодов и используется для измерений от передающей до приемной сторон тракта или участка линии, т.е. когда выделение и фиксация ошибок производятся на ее приемном конце. Очевидно, что в первом случае требуется использование одного комплекта, а во втором – двух комплектов приборов. При этом измеренное значение коэффициента ошибок отражает качество передачи при прохождении сигнала в обоих направлениях и в каждом направлении соответственно.
6.4. Принципы построения измерителей ошибок
В зависимости от скорости передачи контролируемой системы передачи в анализаторе используются различные схемотехнические решения.
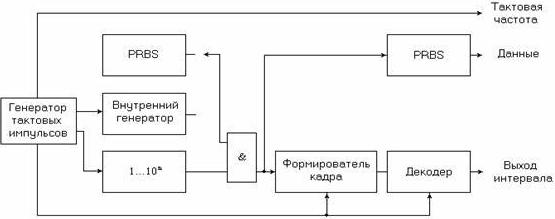
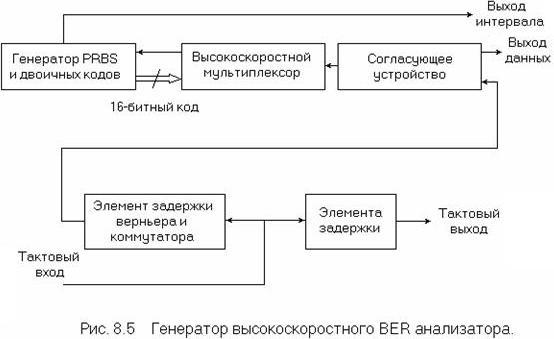
Рисунок 6.3. Генератор низкоскоростного BER анализатора
Низкоскоростной генератор тестовых кодов и детектор ошибок. Используемый в телекоммуникациях анализатор BER, состоящий [106] из генератора тестовых кодов и собственно анализатора ошибок, представлен на рисунках 6.3 и 6.4. Он предназначен для невысоких (до 200 Мбит/с) битовых скоростей, учитывая, что максимальные типовые скорости составляют 44.736 Мбит/с (DS3) в Северной Америке и 139.364 Мбит/с – за пределами Северной Америки.
PRBS с генератором кодовых групп, представленный на рис. 6.16, синхронизируется либо от источника тактового сигнала с фиксированной частотой (согласно G.703), либо от синтезатора, осуществляя тем самым изменение частоты синхронизации. В связи с этим использование данных средств требует задания некоторых определенных частот синхронизации и наличия возможности обеспечения их небольших смещений от ±15 до ±50 ppm. Для повторения тестовых кодов схема PRBS и генератор кодовых групп обычно имеют триггерную схему, управляющую либо выходным усилителем бинарных данных, который обеспечивает данные и данные с сопровождающим синхросигналом, либо выходную схему кодированных данных. Это позволяет создавать цикловую синхронизацию сигнала в соответствии с требованием, например, системы SONET/SDH. Кроме этого, данная схема способствует созданию соответствующего интерфейсного кода для эффективного восстановления тактовой синхронизации. Выходной усилитель обеспечивает необходимый уровень сигнала в соответствии со спецификацией электрического интерфейса, в том числе сигнала с чередованием полярности импульсов.
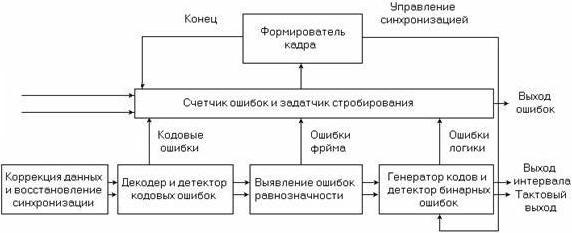
Рисунок 6.4. Низкоскоростной детектор ошибок
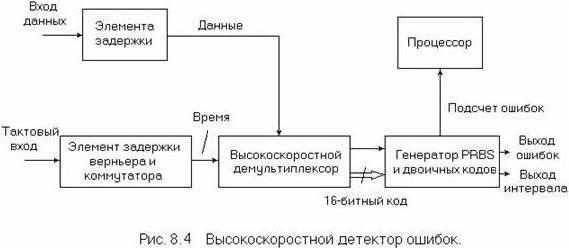
Детектор ошибок, показанный на рисунке 6.4, получает стандартный кодированный сигнал, восстанавливает генератор синхросигнала и устраняет кодирование для обеспечения бинарной даты и синхросигналов. Он обнаруживает любые нарушения алгоритма интерфейсного кода и посылает сигналы на счетчик ошибок, что составляет первый уровень процесса обнаружения ошибок. При работе с цикловыми сигналами приемник захватывает любой присутствующий элемент цикловой синхронизации, проверяет наличие цикловых ошибок и декодирует любые встроенные сигналы тревоги, или CRC биты, тем самым обеспечивая возможность измерения.
Наконец, бинарные данные и синхросигнал направляются на детектор ошибок и генератор эталонных тестовых кодов, которые проверяют полученный тестовый код бит за битом на предмет обнаружения логических ошибок. Временная база контролирует пропускание измерения для непрерывного, периодического и ручного режима. Накопленное количество ошибок обрабатывается для получения значения BER и анализа функционирования при наличии ошибок.
Высокоскоростной генератор тестовых кодов и детектор ошибок. На рисунках 6.5 и 6.6 показаны схемы [14] для 3 Гбит/с генератора тестовых кодов и детектора ошибок. Вследствие высокой битовой скорости генерация последовательных PRBS и кодовых групп на этой скорости не представляется целесообразной. Поэтому тестовые коды генерируются (рисунок 6.5) как параллельные 16-битные кодовые группы при максимальной скорости 200 Мбит/с, используя затем выполненные по биполярной технологии регистраторы смещения и высокоемкостную память. Высокоскоростные схемы обычно выполняются на основе арсенид-галлиевых логических схем, преобразующих параллельные данные в последовательный поток на скорости до 3 Гбит/с.
Согласно данной схеме, вход синхросигнала генерируется синтезатором частоты, согласующее устройство управляется через линию фиксированной задержки, а генератор тестовых кодов и выходной усилитель синхронизируются через схему дискретной и плавно изменяемой задержки, так что фаза синхросигнала/данных может изменяться как в положительном направлении, так и в отрицательном. Дискретные значения задержки составляют 250, 500 и 1000 пс, тогда как диапазон плавной задержки лежит в пределах от 0 до 250 пс с 1 пс инкрементом.
Корректор временной диаграммы, связанный с выходным усилителем, пересинхронизирует данные через триггер D типа для поддержания минимального фазового дрожания. Так как подобный тип тестового устройства обычно используется при проведении лабораторных измерений, выходные уровни синхросигнала и данных и постоянные смещения могут варьироваться для того или иного конкретного случая использования.
Детектор ошибок, показанный на рис. 6.6, имеет простое параллельное соединение, в связи с чем входы синхросигнала и данных проходят через схемы дискретной и плавной задержки, обеспечивая оптимальную настройку при обнаружении ошибок для любой фазы синхросигнала/данных. Действительно, путем настройки под контролем внутреннего процессора решающего порога и фазы синхросигнала условия функционирования детектора ошибок могут быть оптимизированы автоматически. Высокоскоростной демультиплексор преобразует последовательный поток данных в 16-битные параллельные кодовые группы наряду с поделенным на 16 синхросигналом. Параллельно соединенный генератор эталонных тестовых кодов синхронизируется с входными данными и осуществляет сравнение битов, поэтому любая ошибка фиксируется одним из двух счетчиков, первый из которых подсчитывает число ошибок, а второй – общее число битов. Процессор измерения обеспечивает анализ функционирования при наличии ошибок с разрешением до 1 мс.
6.5. Техника измерения коэффициента ошибок
Рассмотрим измерение коэффициента ошибок путем посимвольного сравнения и подсчета ошибочно принятых элементарных импульсов. Для этого вначале (перед измерением) на передающей станции с помощью оптического аттенюатора устанавливают заданный в технических условиях на аппаратуру линейного тракта уровень оптического излучения. Затем на передающем конце подключают генератор испытательных сигналов, а на приемном – измеритель коэффициента ошибок и, изменяя значения уровней средней мощности, измеряют коэффициент ошибок. Время измерения определяют в зависимости от скорости передачи, объема информации и значений коэффициента ошибок Кошi (BERi).
Коэффициент ошибок при заданном уровне оптического излучения вычисляют по формуле [14]
(6.17)
где
,
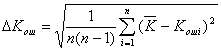
где и
— погрешность и среднее значение коэффициента ошибок при пяти и более измерениях с интервалом 3 мин, соответственно, a — коэффициент, учитывающий наличие погрешности измерения при проведении n измерений.
Синонимы: mchc, Средняя концентрация гемоглобина в эритроцитах
Научный редактор: М. Меркушева, ПСПбГМУ им. акад. Павлова, лечебное дело.
Сентябрь, 2018.
Одним из обязательных диагностических тестов является общий анализ крови. Благодаря данному исследованию квалифицированный специалист может иметь представление об отклонениях от нормы форменных элементов крови. Особое значение при этом имеет изучение эритроцитарного индекса.
Что такое MCHC
Поддержание данного показателя в норме очень важно для человеческого организма.
MCHC показывает степень окраски красных телец в плазме крови пациента. В данном случае важно не то, какая часть белка принимает участие в транспортировке, а с какой насыщенностью происходит заполнение каждой клетки.
Обратим внимание, что результаты анализов продемонстрируют не общее количество гемоглобина, которое приходится на одну клетку крови, а плотность заполнения клетки гемоглобином. (MCH показывает количество гемоглобина в клетке). Для выявления дополнительных факторов, например, числа кровяных телец в крови, понадобится делать дополнительные анализы.
Направление на анализ
Оценка эритроцитарного индекса является обязательной процедурой в комплексе с другими исследованиями. Направление на анализ пациент получает при наличии следующих жалоб:
- неважное самочувствие;
- бледность кожных покровов;
- частые головокружения;
- обмороки;
- общий упадок сил;
- снижение работоспособности;
- другие признаки анемии;
- для оценки эффективности лечения анемии;
- плановое профилактическое обследование.
Норма MCHC
Показатели MCHC могут изменяться на всех этапах развития человеческого организма, например, у детей они запредельно высокие, но нормализуются в возрасте 18 лет. У взрослых людей фиксируется показатель гораздо ниже, чем у младенцев (от 28,0 до 37,0 г/л).
Для взрослого человека показатель нормы колеблется в пределах 32,0-36,0 г/л. В преклонном возрасте показатель снижается до отметки 31,0-36,0 г/л.
Рассчитывается MCHC как отношение общего гемоглобина к гематокриту (объем, который занимают эритроциты в кровеносном русле).
Референсные значения mchc
Важно! Нормы различаются в зависимости от реактивов и оборудования, используемого в каждой конкретной лаборатории. Поэтому при интерпретации результатов необходимо пользоваться стандартами, принятыми именно в той лаборатории, где сдавался анализ.
|
Возраст, пол |
Средняя концентрация |
|
|
Дети |
||
|
1 день — 14 дней |
28,0 — 35,0 |
|
|
14 дней — 4,3 недели |
28,0 — 36,0 |
|
|
4,3 недели — 8,6 недель |
28,0 — 35,0 |
|
|
8,6 недель — 4 месяца |
29,0 — 37,0 |
|
|
4 месяца — 12 месяцев |
32,0 — 37,0 |
|
|
12 месяцев — 3 года |
32,0 — 38,0 |
|
|
3 года — 12 лет |
32,0 — 37,0 |
|
|
12 лет — 15 лет |
Женщины |
32,0 — 36,0 |
|
Мужчины |
32,0 — 37,0 |
|
|
15 лет- 18 лет |
Женщины |
32,0 — 36,0 |
|
Мужчины |
32,0 — 36,0 |
|
|
18 лет — 45 лет |
Женщины |
32,0 — 36,0 |
|
Мужчины |
32,0 — 37,0 |
|
|
45 лет — 65 лет |
Женщины |
31,0 — 36,0 |
|
Мужчины |
32,0 — 36,0 |
|
|
65 лет — 120 лет |
Женщины |
32,0 — 36,0 |
|
Мужчины |
31,0 — 36,0 |
Обратите внимание, что в ходе расшифровки анализа лаборантом может быть допущена ошибка. Если показатели заставят лечащего врача засомневаться в их точности, то пациент может быть отправлен на повторное лабораторное исследование. MCHC используют как индикатор ошибок анализатора, потому что это один из самых стабильных гематологических показателей.
Важно! Интерпретация результатов всегда проводится комплексно. Поставить точный диагноз на основании только одного анализа невозможно.
MCHC повышен
Если анализ выявил повышенное содержание MCHC в крови, то можно объяснить это следующими причинами1:
- нарушение водно-электролитного баланса в организме;
- анемия на фоне дефицита витамина В12;
- недостаточное количество фолиевой кислоты в организме;
- врожденные отклонения. (наследственная микросфероцитарная анемия)
- аутоиммунная гемолитическая анемия;
- гиперлипидемия.
MCHC понижен
Причины, провоцирующие понижение значений MCHC:
- наследственные патологии крови (например, нарушение выработки структурных единиц гемоглобина — талассемия);
- недостаточная концентрация железа (нормальные реферсные значения в крови варьируются в пределах 5 мг);
- некоторые виды макроцитарных анемий;
- печеночная недостаточность, неправильное питание, алкоголизм, наследственная предрасположенность.
- нехватка витамина В6.
Все вышеперечисленные факторы оказывают значительное влияние на состояние кроветворной системы. При наличии отклонений в ту или иную сторону важно получить консультацию лечащего специалиста. Любое заболевание лучше предупредить, чем лечить.
Недавние исследования показали взаимосвязь между низким показателем MCHC и развитием депрессии у женщин1.
Подготовка к сдаче анализа
К процедуре сдачи крови на индекс MCHC специальных подготовительных мер принимать не нужно. Обычно этот показатель входит в общий анализ крови. Следует лишь выполнить некоторые врачебные рекомендации:
- сдавать кровь нужно строго натощак, т. е. спустя 8-12 часов после последнего приема пищи. Именно по этой причине плановые анализы крови принимаются в первой половине дня;
- накануне процедуры (вечером, во время ужина) желательно исключить из рациона тяжелую жирную и жареную пищу. Также не рекомендуется переедать;
- за 2 дня до сдачи крови запрещается употребление алкоголя;
- за 1 час до забора крови нельзя курить или использовать никотинозамещающие препараты (таблетки, пластырь, жевательная резинка, спрей). Присутствие никотина в крови может повлиять на результаты теста;
- не рекомендуется также сдавать кровь после физиолечения или рентген-диагностики;
- за несколько дней до процедуры нужно постараться не нервничать, исключить стрессы и тяжелые физические нагрузки;
- предварительно проконсультироваться с лечащим врачом по поводу приема/отмены лекарственных средств, предназначенных для постоянного/длительного применения. Возможно, что их действие может негативно отразиться на результатах анализа.
Соблюдение всех рекомендаций врача по подготовке к процедуре обеспечивает получение достоверной диагностической информации, а также позволяет избежать повторного обследования. Если же уточнение данных первичного исследования все-таки потребуется, то кровь на анализ желательно сдавать в то же самое время, что и в первый раз (связано это с индивидуальными временными колебаниями в организме человека).
Источники:
- 1. Mean Corpuscular Hemoglobin (MCH) and Mean Corpuscular Hemoglobin Concentration (MCHC). — Medscape, Feb, 2014.