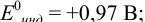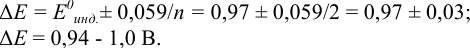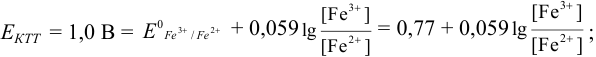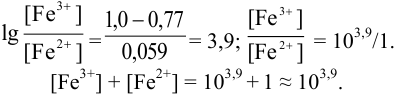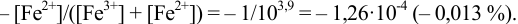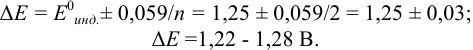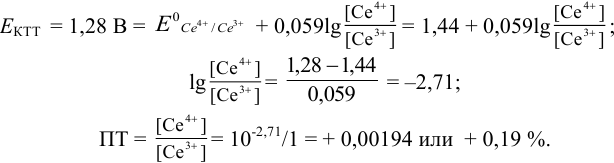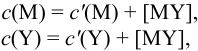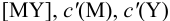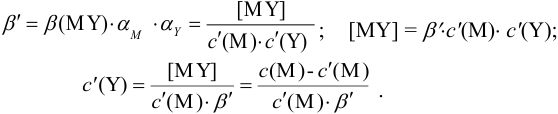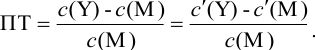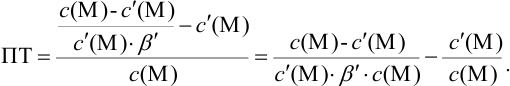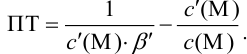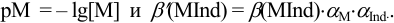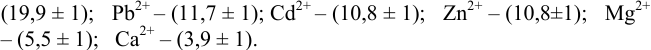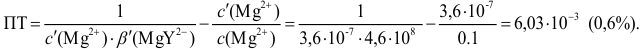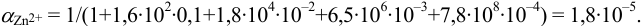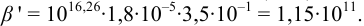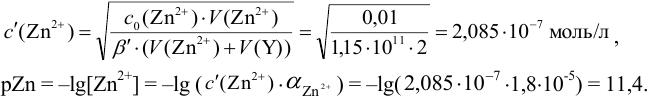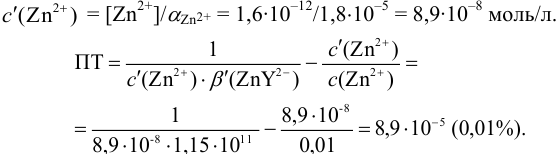Выбор индикатора. Индикаторная погрешность.
Индикатор
– это вещество, которое проявляет
видимое изменение в точке эквивалентности
или вблизи её. Его используют для
обнаружения точки эквивалентности в
титриметрическом анализе.
Индикаторы
кислотно-основного титрования должны
отвечать, по крайней мере, следующим
основным требованиям.
1)
Окраска индикатора должна быть интенсивной
и различаться в кислой и щелочной среде.
2)
Изменение окраски должно быть быстрым,
чётким и обратимым.
3)
Окраска индикатора должна меняться в
узком интервале изменения рН раствора.
4)
Индикатор должен быть чувствительным
и менять свою окраску в присутствии
минимального избытка кислоты или щёлочи.
5)
Индикатор должен быть стабильным, не
разлагаться в водном растворе и на
воздухе.
6)
Индикатор должен обладать высоким
светопоглощением так, чтобы окраска
даже его небольшого количества была
заметна для глаза. Большая концентрация
индикатора может привести к расходу на
него титранта.
Кислотно-основные
индикаторы изменяют свою окраску в
области интервала перехода независимо
от того, достигнута или не достигнута
точка эквивалентности. Правильно
выбранный индикатор изменяет окраску
в области скачка титрования. У неправильно
выбранного индикатора изменение окраски
может происходить задолго до наступления
точки эквивалентности (в недотитрованных
растворах) или после неё (в перетитрованных).
Выбирают
индикатор с помощью кривой титрования.
Для этого на график кривой титрования
наносят интервал перехода индикатора.
У правильно выбранного индикатора
интервал перехода полностью или частично
перекрывается скачком титрования. Если
такого перекрывания нет, индикатор для
данного титрования не подходит. Величину
рН, при которой заканчивается титрование
с данным индикатором, называют показателем
титрования и обозначают символом рТ.
Показатель титрования находится обычно
в середине интервала перехода индикатора.
Правило выбора индикатора можно также
сформулировать, пользуясь понятием рТ.
Индикатор пригоден для данного титрования,
если его рТ лежит в пределах скачка
титрования.
Реакции
диссоциации или ассоциации индикаторов
сопровождаются внутренними структурными
перегруппировками, приводящими к
изменениям окраски. При каждом изменении
рН раствора изменяется окраска индикатора,
но человеческий глаз способен зафиксировать
изменение окраски, если окраска одной
формы становится в 10 раз меньше другой
формы.
К
систематическим ошибкам кислотно-основного
титрования относятся индикаторные
ошибки. Они обусловлены несовпадением
значений рН титруемого раствора в ТЭ и
рТ индикатора в КТТ. Практически
невозможно подобрать такой индикатор
кислотно-основного титрования, значение
рТ которого точно совпадало бы со
значением рН в ТЭ. Поэтому индикатор
меняет свою окраску в КТТ либо до ТЭ,
либо после неё. Если изменение окраски
индикатора происходит до ТЭ, то раствор
недотитрован, в КТТ остаётся некоторое
количество неоттитрованного определяемого
вещества. Если же окраска индикатора
изменяется после ТЭ, то раствор
перетитрован, в КТТ имеется некоторое
избыточное количество титранта. В связи
с этим измеренный объём израсходованного
титранта может быть либо меньше, либо
больше его стехиометрического объёма
в ТЭ. Величина индикаторной ошибки
кислотно-основного титрования, очевидно,
тем заметнее, чем больше разность между
значениями рТ индикатора и рН титруемого
раствора в ТЭ. Обычно стремятся свести
индикаторные ошибки к минимуму так,
чтобы они, во всяком случае, не превышали
бы 0,2%. Это достигается в основном путём
выбора соответствующего индикатора.
Иногда
индикаторную ошибку титрования
рекомендуют называть просто ошибкой
титрования и формулируют её следующим
образом: это разница в количествах
титранта или соответствующая разница
в количествах титруемого вещества:
величина, найденная в конечной точке,
минус величина, отвечающая точке
эквивалентности. Такое определение
ошибки титрования универсально, т.е.
справедливо для всех титриметрических
методов, а не только для кислотно-основного
титрования. Индикаторные ошибки
кислотно-основного титрования подразделяют
на водородную (протонную), гидроксидную,
кислотную и основную. Гидроксидная
ошибка возникает при наличии избытка
гидроксид-ионов в КТТ вследствие либо
недотитровывания раствора сильного
основания кислотой (отрицательная
ошибка), либо перетитровывания раствора
кислоты раствором сильного основания
(положительная ошибка).
Кислотная
ошибка вызвана присутствием некоторого
количества недотитрованной слабой
кислоты в КТТ.
рН=рКинд-lg[HInd]/[Ind],
отсюда рН=рКинд1.
Это выражение показывает интервал
перехода окраски индикатора.
Выбор индикатора
Пояснения. Правило выбора индикатора:
— интервал перехода окраски индикатора должен находиться в пределах скачка титрования или частично перекрываться с ним;
— рТ индикатора должен быть как можно ближе к точке эквивалентности и находиться в пределах скачка титрования.
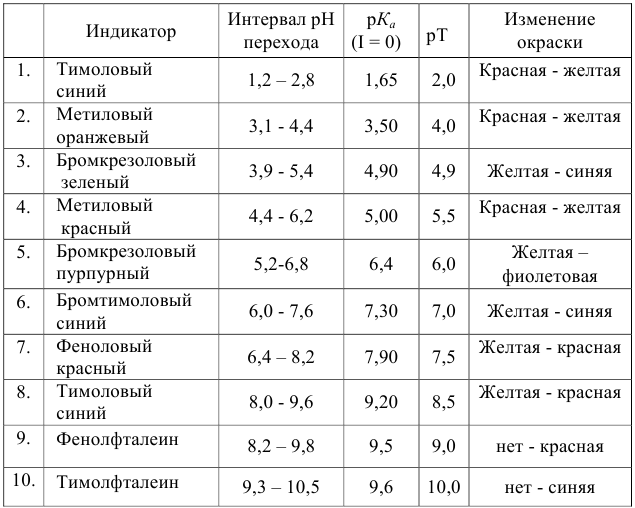
Учитывая правило выбора индикатора выбираем 2 индикатора из справочной литературы (Лурье Ю. Ю. Справочник по аналитической химии. М.: Химия, 1989. 190 с. ).
Таблица 2
Некоторые кислотно-основные индикаторы
| Название |
Интервал перехода окраски, ∆ рН |
Показатель титрования, рТ |
| Метиловый оранжевый | 3, 1– 4, 4 | 4, 0 |
| Метиловый красный | 4, 4 – 6, 2 | 5, 5 |
| Метиловый желтый | 2, 4 – 4, 0 | 3, 0 |
| Фенолфталеин | 8, 2 – 9, 8 | 9, 0 |
| Тимолфталеин | 9, 3 – 10, 5 | 9, 6 |
| Феноловый красный | 6, 4 – 8, 2 | 7, 5 |
| Тимоловый синий | 8, 0 – 9, 6 | 9, 2 |
| Бромтимоловый синий | 6, 0 – 7, 6 | 7, 0 |
| Бромкрезоловый зеленый | 3, 9 – 5, 4 | 4, 5 |
| Бромкрезоловый пурпурный | 5, 2 – 6, 8 | 6, 0 |
Выбираем 2 индикатора: фенолфталеин (рТ=9, 0) и тимоловый синий (рТ=9, 2)
Расчет индикаторных погрешностей
При недотитровывании (рТ < рНТЭ) формула для расчета индикаторной погрешности ( 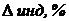
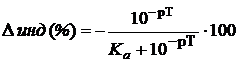
где Ka – константа кислотности
При перетитровывании (рТ > рНТЭ) формула для расчета индикаторной погрешности ( 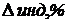
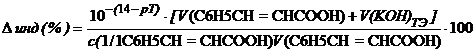
где V(KOH)ТЭ – объем титранта, прибавленный от начала титрования до точки эквивалентности.
Рассчитываем индикаторные погрешности для выбранных индикаторов:
— фенолфталеин (рТ=9, 0> рНТЭ):
— тимоловый синий (рТ=9, 2 > рНТЭ):
Выбор индикатора или оценку его пригодности можно сделать также на основании индикаторных ошибок титрования. При титровании слабой кислоты может возникнуть гидроксидная и кислотная индикаторные ошибки. Гидроксидная ошибка рассчитывается по формуле (10.2). Если при титровании 0,1 М уксусной кислоты в качестве индикатора взять фенолфталеин с рГ 9,0, [c.199]
Кроме метода кривых титрования, для выбора индикатора применяют способ вычисления индикаторной ошибки титрования. [c.328]
Применим выведенные формулы к решению вопроса о выборе индикатора, для чего рассмотрим несколько примеров, i Пример 1. Чему равна индикаторная ошибка титрования 0,1 н. раствора НС1 0,1 н. раствором NaOH с метиловым оранжевым [c.289]
Выше указывалось, что признаком достижения точки эквивалентности служит приобретение раствором определенного значения pH. Поэтому в качестве индикаторов метода нейтрализации служат вещества, окраска которых меняется в зависимости от изменения величины pH. К ним относятся лакмус, метиловый оранжевый, фенолфталеин и многие другие вещества. Окраска каждого из них изменяется внутри определенного узкого интервала значений pH, причем этот интервал зависит только от свойств данного индикатора и совершенно не зависит от природы реагирующих между собой кислоты и основания. Благодаря этому перемена окраски индикатора происходит, как правило, не строго в точке эквивалентности, а с известным отклонением от нее. Такое отклонение влечет за собой некоторую ошибку, называемую индикаторной ошибкой титрования. Величина этой ошибки может колебаться в весьма широких пределах в зависимости от того, какой взят индикатор и какие основание и кислота реагируют между собой. При правильном выборе индикатора ошибка не выходит за обычные пределы аналитических погрешностей и [c.254]
Реакция нейтрализации не сопровождается какими-либо внешними изменениями, например переменой окраски раствора. Поэтому для фиксирования точки эквивалентности приходится прибегать к помощи индикаторов. Таких индикаторов известно много, причем оказывается далеко не безразличным, какой из них выбрать. Надо сказать, что индикаторы обычно изменяют свою окраску не строго в точке эквивалентности, а с некоторыми отклонениями от нее. В соответствии с этим, если индикатор выбран правильно, проистекающая отсюда погрешность (называемая индикаторной ошибкой титрования) мала и не скажется на результатах титрования. Но при неправильном выборе индикатора она может достигнуть значительной величины и совершенно исказить результаты анализа. Кроме того, в таких случаях и самая перемена окраски индикатора происходит не скачком, от одной капли титрующего раствора, а постепенно, так что неизвестно когда следует закончить титрование. [c.329]
Показатель индикатора должен совпадать со значением pH, наблюдаемым в точке эквивалентности, но это совпадение не всегда наблюд 1ется, что может вызвать так называемую индикаторную ошибку, величина которой может колебаться в весьма широких пределах. Поэтому в методах нейтрализации весьма существенным является правильный подбор индикатора, при применении которого величина индикаторной ошибки будет сведена к минимуму. Правильный выбор того или иного индикатора может быть произведен на основе рассмотрения кривых нейтрализации, показывающих изменение концентрации ионов при титровании по методу нейтрализации. [c.56]
Поскольку реакция нейтрализации не сопровождается каким-нибудь внешним эффектом, например изменением окраски раствора, точку эквивалентности определяют с помощью индикаторов. Но обычно индикаторы изменяют окраску не строго в точке эквивалентности, а с некоторым отклонением от нее. Иначе говоря, конечная точка титрования не всегда совпадает с точкой эквивалентности, она только более или менее соответствует точке эквивалентности. Поэтому даже при правильном выборе индикатора допускается погрешность, называемая индикаторной ошибкой титрования. Неправильный выбор инди- [c.246]
Реакция нейтрализации не сопровождается внешним эффектом, поэтому определять эквивалентную точку приходится с помощью индикаторов. Но они меняют окраску не строго в эквивалентной точке, а с некоторым отклонением. В связи с этим даже при правильном выборе индикатора допускается погрешность, называемая индикаторной ошибкой титрования. Неправильный же выбор индикатора искажает результаты анализа. Наиболее часто применяют из индикаторов метиловый оранжевый, метиловый красный, лакмус и фенолфталеин. Индикаторы — это слабые органические кислоты (или основания). Недиссоциированные молекулы их и образуемые ими анионы имеют различную окраску (табл. 26). [c.448]
Поскольку реакция нейтрализации не сопровождается каким-нибудь внешним эффектом, например, изменением окраски раствора, определять точку эквивалентности приходится с помощью индикаторов. Но индикаторы обычно изменяют свою окраску не строго в точке эквивалентности, а с некоторым отклонением от нее. Поэтому даже при правильном выборе индикатора допускается погрешность, называемая индикаторной ошибкой титрования. Неправильный же выбор индикатора может совершенно исказить результаты анализа. Рассмотрим теорию индикаторов и правила выбора их при различных случаях титрования. [c.328]
Поэтому даже при правильном выборе индикатора допускается погрешность, называемая индикаторной ошибкой титрования. Неправильный выбор индикатора может совершенно исказить результаты анализа. Рассмотрим теорию индикаторов и правила их выбора при различных случаях титрования. [c.323]
Наряду с построением кривых титрования существует также другой способ выбора индикатора (стр. 271), заключающийся в вычислении индикаторной ошибки титрования. Напомним, что индикаторная ошибка титрования представляет собой ту погрешность, которая обусловлена несовпадением показателя титрования примененного индикатора с величиной pH в точке эквивалентности. Вследствие этого несовпадения раствор обычно либо несколько пере-титровывают, либо, наоборот, недотитровывают. В результате по окончании титрования раствор содержит некоторый избыток свободной кислоты или свободной щелочи. [c.294]
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 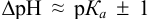
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 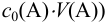
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
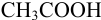
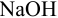
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
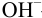
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 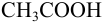



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 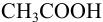
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 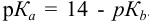
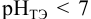
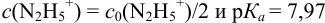
Сравнивая рТ индикаторов и 
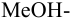
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 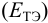

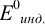
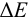
Таблица 8.14
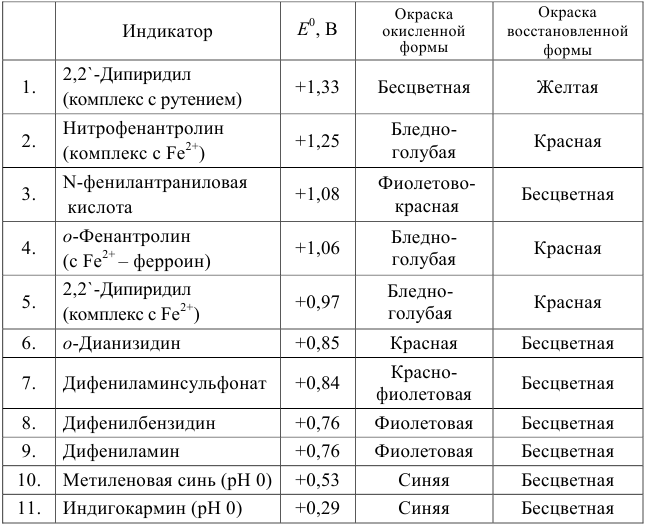
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 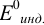
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 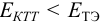
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 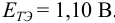
Выберем для рассмотрения порядка расчета два индикатора:
а) с 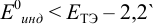
б) с 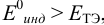
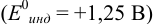
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
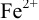



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

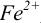
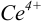
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 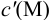
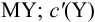
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 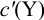
Вблизи ТЭ 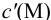
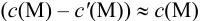
следовательно:
Выражение (8.21) тождественно выражению: 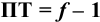
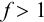
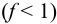
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
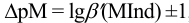
Интервал перехода окраски 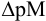
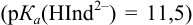
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 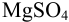

Решение:
В данных условиях 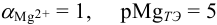
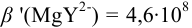
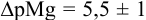
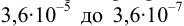

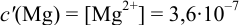
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 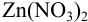

Решение:
1. Рассчитаем условную константу 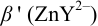
Общие константы устойчивости для аммиачных комплексов 
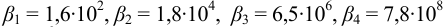

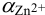
По табл. 7 и табл. 4 приложения находим 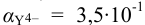
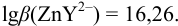

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 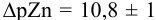
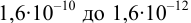

2. Конечная точка титрования наступает при [
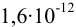

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

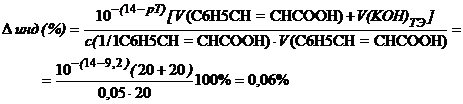


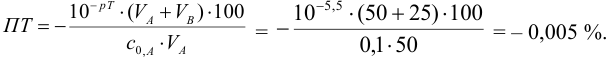
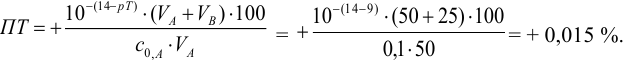
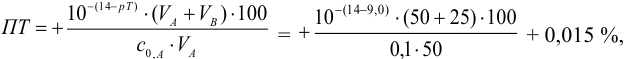
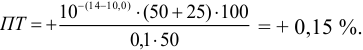
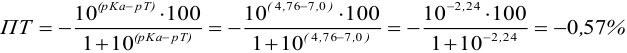
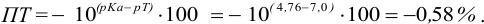
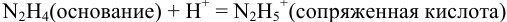
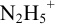
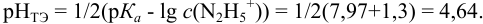
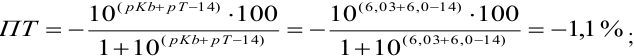
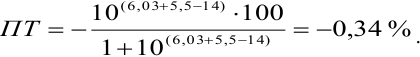

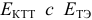 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.