Оснащение занятия.
Оборудование:
скарификаторы, штатив Панченкова,
капилляр Панченкова, пробирки, вата,
спирт.
Реактивы:
5 % раствор лимоннокислого натрия или
10
% трилон Б (ЭДТА)
Алгоритм определения соэ.
-
Ознакомьтесь
с капилляром Панченкова и штативом. -
Промойте
капилляр Панченкова 5 % цитратом натрия,
а затем наберите ¼ капилляра цитрата
натрия и поместите в центрифужную
пробирку. -
Обработайте
палец пациента. -
Проколите
палец пациента скарификатором до упора. -
Наберите
кровь в капилляр Панченкова до метки
«К» без пузырьков воздуха. Суженный
конец капилляра оботрите ваткой от
остатков крови. -
Опустите
капилляр с кровью в пробирку с цитратом
и тщательно перемешайте. -
Наберите
в капилляр смесь крови с цитратом до
метки «К», зажмите указательным
пальцем верхнее отверстие капилляра. -
Поставьте
вертикально капилляр в штатив Панченкова,
суженным отверстием надавив на одну
из резинок штатива и опустив указательный
палец с верхнего отверстия. Укажите
время постановки реакции. Ровно через
1 час снимайте показания.
Ошибки при выполнении анализа соэ.
Ошибки при постановке
СОЭ могут быть связаны с различными
факторами:
-
При
комнатной температуре СОЭ определяется
не позже, чем через 2 часа после взятия
крови. В случае хранения крови при +40С,
СОЭ определяется не позднее, чем через
6 часов, но перед выполнением кровь
прогревают до комнатной температуры. -
Исследование
СОЭ должно проводиться при 18-250С.
При более высоких температурах значение
СОЭ увеличивается, при низких –
замедляется. -
Перед
проведением анализа кровь хорошо
перемешивают, что обеспечит лучшую
воспроизводимость результатов. -
При
отсутствии резкой границы между
эритроцитным столбиком и плазмой
(регенеративных анемиях), над компактной
массой эритроцитов образуется светлая
«вуаль» в несколько миллиметров
из разведенных эритроцитов (главным
образом из ретикулоцитов). В таком
случае определяется граница компактного
слоя, а эритроцитарная вуаль причисляется
к столбику плазмы. -
Стеклянные
капиллярные пипетки могут быть заменены
на пластмассовые (полипропил,
поликарбонат), однако они требуют
проверки и оценки степени корреляции
полученных результатов со стеклянными
капиллярами. -
Нарушение
соотношения кровь/цитрат (неточное
дозирование цитрата или крови), стояние
пробы под наклоном, на свету, в тепле,
более 4х часов с цитратом, во влажном
капилляре.
II. Блок контролирующих материалов.
А:
Инструкция к самостоятельной работе
на занятии.
-
При
подготовке рабочего места к работе
предусмотреть все необходимое и не
загромождать стол лишними реактивами
и оборудованием. -
Предварительно
работать с имитацией крови. -
Обратить
внимание на возможные ошибки при
определении СОЭ. -
Произвести
определение СОЭ. -
Записать
в тетрадь алгоритм методики и полученный
результат: -
Оценить
полученные результаты. -
При
уборке рабочего места, обработке
капилляров и перчаток соблюдать правила
техники безопасности при работе с
заведомо инфицированными материалами
и электроприборами.
Б:
Тема считается усвоенной, если студент
может:
а)
Ответить на вопросы (вопросы для
самоконтроля):
-
Почему
необходимо кровь смешивать с цитратом
натрия? -
Как
называется та прозрачная жидкость,
которая образуется при стоянии капилляра
Панченкова в штативе в течение часа? -
Чему
равно одно деление в капилляре Панченкова? -
Какие
ошибки могут быть допущены при взятии
крови на СОЭ? -
Почему
очень важно соблюдать время при
постановке СОЭ? -
Как
надо обработать капилляр и резиночки
штатива Панченкова после окончания
исследования? -
Как
дезинфицируют капилляры после забора
крови? -
Как
правильно обработать и простерилизовать
скарификаторы после работы?
б)
Выполнить практическую работу.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Ю.В. Первушин, В.В. Вельков*, Л.С. Путренок.**
ГОУ ВПО Ставропольская государственная медицинская академия Росздрава, кафедра клинической лабораторной диагностики ФПО,
*ЗАО «ДИАКОН», Пущино, Московской области,
** Ставропольский краевой клинический диагностический центр.
Почему, врачи, даже современных лечебных учреждений, не могут расстаться с традицией определения СОЭ, несмотря на многочисленные научные данные, которые ставят под сомнение точность и диагностическое значение этого теста?
Скорость оседания эритроцитов (СОЭ, ранее реакция оседания эритроцитов – (РОЭ) — неспецифический лабораторный показатель крови, изменение СОЭ может служить косвенным признаком текущего воспалительного или иного патологического процесса. Более ста лет этот тест, несмотря на то, что является неспецифичным, применяется для количественной характеристики степени тяжести воспалительных процессов, вызванных инфекциями, различными воспалениями, развитием новообразований. Однако, хотя воспаление и является наиболее частой причиной ускорения оседания эритроцитов, увеличение СОЭ также может обуславливаться и другими, в том числе и не всегда патологическими, состояниями. Таким образом, результаты определения СОЭ можно считать достоверными только тогда, когда никакие другие параметры кроме предполагаемых, не влияют на изучаемый показатель. На самом деле слишком многие факторы оказывают влияние на результаты этого теста и поэтому его клиническое значение должно быть пересмотрено.
Основное влияние на скорость оседания эритроцитов, взвешенных в плазме, оказывает степень их агрегации. Процесс этот достаточно сложен. Он зависит от многих факторов и ведущая роль в нем принадлежит трем главным – влияющим на агрегацию эритроцитов, это: 1) поверхностная энергия клеток, 2) заряд клеток и 3) диэлектрическая постоянная.
Последний показатель является характеристикой плазмы, связанной с концентрацией асимметричных молекул. Увеличение содержания таких молекул (белков) приводит к повышению прочности связей между эритроцитами, что, в свою очередь, приводит к агглютинации и слипанию (образованию столбиков) эритроцитов и, тем самым, к более высокой скорости их оседания. Однако и эти основные факторы в свою очередь зависят от многих физико-химических сдвигов, происходящих в организме (Таблица 1).
Таблица 1
Влияние некоторых физико-химических факторов на величину СОЭ (по Г.Е. Ройтбергу и А.В. Струтынскому, 1999)
|
Основные физико-химические факторы |
Наиболее частые |
Изменение СОЭ |
|
Фибриноген |
Увеличение |
Увеличение |
|
α-глобулины |
Увеличение |
Увеличение |
|
γ-глобулины |
Увеличение |
Увеличение |
|
Парапротеины |
Увеличение |
Увеличение |
|
Альбумин |
Увеличение |
Увеличение |
|
Желчные пигменты |
Увеличение |
Уменьшение |
|
Желчные кислоты |
Увеличение |
Уменьшение |
|
Изменения рН крови |
Уменьшение (ацидоз) Увеличение (алкалоз) |
Уменьшение |
|
Вязкость крови |
Увеличение |
Уменьшение |
|
Число эритроцитов |
Увеличение (эритроцитоз) |
Уменьшение |
Кроме этих факторов изменять показатель СОЭ могут лабораторно-методические, биологические и ятрогенные воздействия (Таблица 2).
Таблица 2
Факторы, вызывающие увеличение СОЭ (Л.И. Дворецкий, 1998)
|
Лабораторно-методические |
Биологические |
Ятрогенные |
|
Неточное количество цитрата |
Макроцитоз |
Декстраны |
|
Стояние пробы с цитратом более |
Анемия |
Фенотиазин |
|
Стояние пробы на свету |
Антиэритроцитарные антитела |
а-Метилдопа |
|
Стояние пробы в тепле |
Гиперпротеинемия |
Витамин А |
|
Влажный капилляр |
Диспротеинемия |
Контрацептивы |
|
Стояние пробы под наклоном |
Гиперфибриногенемия |
g-глобулин |
|
Гиперлипидемия |
Дезерил |
|
|
Алкалоз |
||
|
Беременность |
||
|
Пожилой возраст |
Что приводит к ложным результатам при измерении СОЭ?
Ложное повышение СОЭ – суммируя наиболее распространенные факторы и часто встречающиеся клинические ситуации, влияющие на СОЭ, можно заключить, что клиницист чаще всего встречается с ложным повышением СОЭ, когда имеют место:
- анемия с нормальной морфологией эритроцитов
- увеличение в плазме концентрации всех белков, кроме фибриногена, М-протеина, макроглобулинов и агглютининов эритроцитов
- почечная недостаточность
- применение гепарина при взятии крови
- гиперхолестеринемия
- крайняя степень ожирения
- беременность (кстати, определение СОЭ изначально использовали для установления беременности)
- женский пол
- пожилой возраст
- технические погрешности при тестировании (отклонение пробирки от вертикального положения увеличивает СОЭ, при этом угол в 3° от вертикальной линии может приводить к увеличению СОЭ до 30 единиц).
Ложное снижение СОЭ может возникать, когда имеют место:
- повышение количества эритроцитов
- значительное повышение уровня лейкоцитов
- ДВС-синдром (из-за гипофибриногенемии)
- дисфибриногенемия
- афибриногенемия
- значительное увеличение уровня желчных солей в плазме крови
- застойная сердечная недостаточность
- вальпроевая кислота
- низкомолекулярный декстран
- кахексия,
- кормление грудью.
Ложное снижение СОЭ может возникать при морфологических изменениях эритроцитов: эритроциты аномальной, необычной формы препятствуют образованию столбиков и приводят к снижению СОЭ. Именно таким образом, влияют на агрегацию эритроцитов, снижая СОЭ: 1) сфероцитоз, 2) анизоцитоз , 3) пойкилоцитоз.
Интересно, как объективно оценить, что происходит при железодефицитной анемии, когда снижение количества эритроцитов ускоряет СОЭ, а анизо- и пойкилоцитоз его замедляют и как правильно рассчитать относительное значение этих факторов?
Наиболее частые технические погрешности при определении СОЭ
СОЭ снижается при понижении температуры в лаборатории, для определения СОЭ нельзя использовать кровь, полученную более чем за 2 ч до проведения теста: при хранении эритроциты принимают сферическую форму и СОЭ снижается. Полагается также, что тремя наиболее частыми факторами, занижающими СОЭ у пациентов являются: 1) сгущение крови, 2) ацидоз, 3) гипербилирубинемия.
Исходя из перечисленного следует особо подчеркнуть, что при любых заболеваниях, для которых в принципе характерно увеличение СОЭ, этот показатель на определенных стадиях развития патологического процесса, в действительности может оказаться не повышенным и привести к ошибочным выводам, если одновременно имеет место по крайней мере один из ниже перечисленных факторов: 1) сгущение крови, 2) состояние ацидоза или гипербилирубинемия (желтуха), 3) сердечная декомпенсация, 4) состояние кетоацидоза при сахарном диабете и 4) многие другие сдвиги в организме больного. Таким образом, очевидно, что врачи, требующие определения СОЭ, больше опираются на традиции медицины, чем на действительную достоверность этого метод.
Но врачу крайне необходима оценка тяжести воспалительной реакции. Наилучший метод для такой оценки – измерение концентрации С-реактивного белка – основного из белков острой фазы (БОФ) воспаления. Уровни БОФ при воспалительном процессе меняются в разной степени и в зависимости от стадии воспаления (Рис 1). Оценивая эту группу показателей, исходя из динамики уровней БОФ, из степени повышения этих уровней, из их специфичности, и, наконец, из надежности их лабораторного определения, можно четко назвать самого «достойного кандидата на замещение должности» СОЭ – СРБ. Как и все БОФ, СРБ синтезируется в печени под влиянием интерлейкинов, онкостатина М, при модулирующих воздействиях других интерлейкинов и фактора некроза опухолей. СРБ относят к «главным» БОФ воспаления у человека, так как возрастает очень быстро (в первые 6-8 часов) и очень значительно (в 20-100 раз, иногда в 1 000 раз). Но действительно ли измерение уровней СРБ лучше, чем определение СОЭ? В Таблице 3 сопоставлены результаты измерений СОЭ и СРБ, из которых следует, что СРБ является наиболее специфичным и наиболее чувствительным качественным и количественным лабораторным индикатором воспаления и некроза. Концентрация СРБ быстро изменяется в ответ на усиление тяжести воспаления или на его уменьшение. Именно поэтому измерение уровней СРБ широко применяется для мониторинга и контроля эффективности терапии бактериальных и вирусных инфекций, хронических воспалительных заболеваний, онкологических заболеваний, осложнений в хирургии и гинекологии и др.
Рис. 1.Изменения концентрации БОФ при умеренном воспалении (Шевченко О.П., 2005)
Уровни СРБ при различных воспалительных процессах
До 10-30 мг/л – СРБ повышается при вирусных инфекциях, метастазировании опухолей, вялотекущих хронических и некоторых системных ревматических заболеваниях.
До 40-100 мг/л (а иногда и до 200 мг/л) СРБ возрастает при: 1) бактериальных инфекциях, 2) обострении некоторых хронических воспалительных заболеваний и 3) повреждении тканей (хирургические операции, острый инфаркт миокарда). При эффективной терапии бактериальных инфекций уровень СРБ снижается уже на следующий день, если нет – необходимо более эффективное антибактериальное лечение.
До 300 мг/л и более – СРБ возрастает при: 1) тяжелых генерализованных инфекциях, 2) ожогах, 3) сепсисе, которые повышают СРБ почти запредельно.
Таблица 3
От чего зависят изменения СОЭ и уровня СРБ (T. Husain, et al. 2001)
|
Результат измерения зависит от |
СОЭ |
СРБ |
|
Пола |
Да |
Нет |
|
Возраста |
Да |
Нет |
|
Беременности |
Да |
Нет |
|
Температуры |
Да |
Нет |
|
Лекарств (стероиды, салицилаты) |
Да |
Нет |
|
Курения |
Да |
Нет |
|
Уровня белков плазмы |
Да |
Нет |
|
Эритроцитов – кол-ва (Ht) |
Да |
Нет |
|
Лабораторные характеристики показателей |
||
|
Скорость повышения в ответ на заболевание |
Умеренная |
Высокая |
|
Значения нормы |
Широкие |
Узкие |
|
Специфичность |
Умеренная |
Высокая |
|
Чувствительность |
Умеренная |
Высокая |
|
Воспроизводимость |
Низкая/умеренная |
Высокая |
|
Выявление ошибок при выполнении анализа |
Сложное |
Легкое |
|
Продолжительность |
> 60 мин |
< 20 мин |
|
Относительная цена |
х 1 |
х 2-3 |
При подозрении на сепсис новорожденных, уровень СРБ более 12 мг/л — указание на немедленное начало противомикробной терапии (у части новорожденных бактериальная инфекция может и не повышать СРБ). Нейтропения: у взрослого пациента уровень СРБ более 10 мг/л может быть единственным объективным указанием на бактериальную инфекцию. Послеоперационные осложнения: если в течение 4-5 дней после операции СРБ продолжает оставаться высоким (или увеличивается), это указание на развитие осложнений (пневмонии, тромбофлебита, раневого абсцесса). После операции уровень СРБ будет тем выше, чем тяжелее прошедшая операция, чем более она травматична. Сопутствующие бактериальные инфекции: при любых заболеваниях присоединение бактериальной инфекции повышает СРБ более 100 мг/л. Некроз тканей вызывает ОФ, похожий на таковой при бактериальной инфекции. Такой ОФ возможен при: 1) инфаркте миокарда, 2)опухолевых некрозах – тканей почек, легких, толстого кишечника.
Мониторинг СРБ при контроле эффективности лечения различных заболеваний
Системные ревматические заболевания резко увеличивают уровень СРБ: снижение СРБ при ревматоидном артрите указывает на эффективность терапии. При системном васкулите мониторинг СРБ позволяет минимизировать дозы стероидов. При воспалительных заболеваниях желудочно-кишечного тракта: 1) сильное повышение СРБ вызывает болезнь Крона, 2) незначительное увеличение СРБ наблюдается при неспецифическом язвенном колите и 3) при функциональных расстройствах желудочно–кишечного тракта СРБ обычно не повышен. При вторичном амилоидозе повышение СРБ коррелирует с развитием почечных осложнений. При отторжении сердечного трансплантата высокий СРБ связан с инфекционными осложнениями, но не свидетельствует об отторжении как о таковом. При отторжении почечного трансплантата сильная ОФ – один из ранних индикаторов отторжения.
Повышение уровней СРБ при онкологических заболеваниях
Если при высоком уровне СРБ нет явных признаков воспаления или некроза больного следует обследовать на наличие онкозаболеваний!
При злокачественных опухолях возможны различные изменения уровня СРБ, что зависит от: 1) присоединения инфекции, 2) некроза тканей, 3) нарушения функций органов из-за непроходимости респираторных путей или ЖКТ, 4) влияние иммуносупрессии и химиотерапии. Сильная ОФ и повышение СРБ наблюдается при некрозе солидных опухолей. Лимфомы редко сопровождаются тканевым некрозом и изменением спектра белков плазмы. При миеломе очень сильная острая фаза – плохой прогностический признак.
Высокочувствительное измерение СРБ и оценки сердечно-сосудистых рисков
Новое технологическое решение – высокочувствительное иммунотурбидиметрическое определение СРБ или hs-CРБ (hs – high sensitivity) с латексным усилением позволило повысить чувствительность анализа в 10 раз и довести нижнюю границу определения до 0,03-0,05 мг/л. Базовый уровень СРБ – это его уровень в плазме практически здоровых людей: 1) без острого воспалительного процесса, 2) вне обострения хронического заболевания, 3) без перенесенных операций, 4) без травм, 5) при отсутствии некроза тканей и 6) не имеющих онкологии. При измерении hs-СРБ именно изменения его базовых концентраций позволили оценить вялотекущие воспалительные процессы, в частности в эндотелии сосудов, с которыми связывают развитие атеросклероза и его осложнений. Важность определения hs-СРБ при атеросклерозе стала ясна после многочисленных проспективных исследований свидетельствующих, что СРБ при атеросклерозе – это не просто маркер воспаления, но активный участник развития этого заболевания на всех этапах патогенеза.
Итак, о чем свидетельствует изменение базовых концентраций СРБ? В результате многочисленных исследований установлено, что измерения базовых уровней СРБ имеют прогностическое значение, которое позволяет оценить степень риска развития: 1) острого инфаркта миокарда, 2) мозгового инсульта, 3) внезапной сердечной смерти у лиц, не страдающих сердечно- сосудистыми заболеваниями (таблица 4).
Таблица 4
Риск развития сосудистых осложнений в зависимости от уровня hs-СРБ
(О.П.Шевченко, 2005)
|
Уровень hs-СРБ, мг/л |
Риск развития сосудистых осложнений |
|
< 1 |
минимальный |
|
1,1 – 1,9 |
низкий |
|
2,0 – 2,9 |
умеренный |
|
> 3 |
высокий |
- Следует обязательно учитывать, что для стратификации риска сосудистых осложнений значимыми являются уровни СРБ ниже 10 мг/л.
- Если уровень СРБ выше10 мг/л, то очевидно, это связано с острым воспалением, хроническим заболеванием и др.
- Базовый уровень СРБ, измеряется не ранее, чем через 2 недели после исчезновения симптомов любого острого заболевания или обострения хронического заболевания.
При определении риска атерогенеза измерение hs-СРБ проводят в дублях с желательным интервалом в 2 недели. Наибольшее прогностическое значение для оценки риска развития сердечно-сосудистых заболеваний имеет совместное определение hs-СРБ и показателей обмена липидов.
При остром коронарном синдроме – дестабилизацию атеромы и образование тромба связывают с процессами воспаления. При нестабильной стенокардии повышенный уровень СРБ встречается значительно чаще (у 70% пациентов), чем при стенокардии напряжения (у 20% больных). Кроме этого у больных с нестабильной стенокардией, у которых развился острый инфаркт миокарда, СРБ был повышен (>3 мг/л) практически у всех (98%) пациентов. При стратификации риска ранней (до 14 дней) летальности у больных с нестабильной стенокардией и острым инфарктом миокарда наиболее информативно сочетанное определение hsСРБ и тропонина Т. Повышение этих обоих маркеров риска (hsСРБ > 1,55 мг/л, тропонин Т > 0,1 мг/л) указывает на высокий риск летального исхода. Уровни hsСРБ <1,55 мг/л и тропонина Т < 0,1 мг/л – указывают на минимальный риск. При отказе от курения, регулярной физической нагрузке, умеренном потреблении алкоголя, лечении ожирения снижается базовый уровень hsСРБ и, одновременно, коронарный риск. Прием аспирина для профилактики сосудистых осложнений эффективен только у лиц с исходно повышенным базовым уровнем hsСРБ.
hsСРБ и оценки рисков кардиохирургии
У больных, перенесших коронарное шунтирование, повышенный hsСРБ связан с риском ранних отсроченных осложнений. При ангиопластике со стентированием коронарных артерий у больных с ИБС высокий hsСРБ связан с более высоким риском последующего рестеноза. О связи hsСРБ с риском осложнений после инвазивного лечения ИБС свидетельствует следующее: только у 12% пациентов с рестенозом коронарных артерий, развившимся после ангиопластики со стентированием, hsСРБ был < 5 мг/л (в сочетании с нормальным уровнем церулоплазмина, >2 г/л). У всех больных с hsСРБ > 9 мг/л (в сочетании со сниженным уровнем церулоплазмина <0,2 г/л), развился рестеноз коронарных артерий.
hsСРБ и оценки рисков патологий беременности
Измерение hsСРБ дает возможность оценить у беременных женщины риск спонтанных абортов, которые могут быть связаны с вялотекущими воспалительными процессами. При доношенной беременности уровень СРБ обычно составляет 2,4 мг/л. Женщины с повышенным уровнями СРБ в течение 5-19 недели беременности (3,2 мг/л), имеют высокий риск преждевременных родов. А при — при СРБ — 8 мг/л и выше риск преждевременных родов возрастает в 2,5 раза, независимо от других факторов риска.
СОЭ и/или СРБ?
К сожалению, в настоящее время, скорее всего, невозможно полностью отказаться от определения СОЭ и повсеместно перейти на измерение СРБ. Определение СОЭ нельзя заменить в участковых больницах и врачебных амбулаториях. Но в более крупных и современных лечебных учреждениях измерение СОЭ должно постепенно уступать свои позиции определению СРБ. Настоятельно необходимо осуществлять постепенный плановый переход к количественному определению СРБ и использовать его показатель: во-первых, для оценки тяжести воспалительных процессов (диапазон измеряемых концентраций от 10 мг/л и выше) и, во-вторых, для оценки рисков, связанных с вялотекущими воспалительными процессами (диапазон измеряемых концентраций – менее 10 мг/л).
СРБ в воспалительном диапазоне следует измерять для
- определения тяжести воспалительных процессов, вызванных бактериальными и вирусными инфекциями
- мониторинга изменения тяжести таких процессов с целью коррекции их терапии
- мониторинга состояния больного после хирургического вмешательства,
- мониторинга процесса отторжения пересаженной почки
- мониторинга состояния больного после перенесенного инфаркта или ишемического инсульта.
Высокочувствительное измерение СРБ следует применять для оценки рисков:
- возникновения и прогрессирования атеросклероза
- острых коронарных событий
- рисков ишемических инсультов
- оценки рисков патологий беременности.
ЛИТЕРАТУРА
1. Амелюшкина В.А. СОЭ – методы определения и клиническое значение.// В кн. Лабораторная диагностика / ред. В.В.Долгов, О.П. Шевченко. – М.: Изд. «Реафарм». – 2005.– С. 107-109.
2. Шевченко О.П. Характеристика и клиническое значение белков острой фазы воспаления.// В кн. Лабораторная диагностика / ред. В.В.Долгов, О.П. Шевченко. – М.: Изд.«Реафарм». – 2005. – С.137-143
3. Дворецкий Л.И., Особенности лабораторной диагностики в гериатрии.// Клиническая лабораторная диагностика, 1998, № 1, С. 25-32.
4. Карпов Ю.А., Сорокин Е.В. Первичная профилактика сердечно-сосудистых заболеваний: новые ориентиры? РМЖ, Том 10 № 19, 2002
5. Ройтберг Г. Е., Струтынский А. В. Лабораторная и инструментальная диагностика заболеваний внутренних органов. 1999. Изд. «Бином». – 622 с.
6. Сумароков А.Б., Наумов В.Г., Масепко В.П., С-реактивный белок и сердечно-сосудистая патология. 2006, Триада.
7. Albert C, Rifai N, et al; Prospective Study of C-Reactive Protein, Homocysteine, and Plasma Lipid Levels as Predictors of Sudden Cardiac Death; Circulation 2002;105(22):2595-2599
8. Jurado R.L. Why Shouldn’t We Determine the Erythrocyte Sedimentation Rate?// Clinical Infectious Diseases, 2001; 33: 54854-9
9. Ridker P, Rifai N, et al; Comparison of C-Reactive Protein and Low-Density Lipoprotein Cholesterol Levels in the Prediction of First Cardiovascular Events N Engl J Med 2002, 14;347(20):1557-1565
10. Pitiphat W, et al. Plasma C-reactive protein in early pregnancy and preterm delivery. Am J Epidemiol. 2005;162(11):1108-1113.
Лабораторные исследования — более ранний и намного более чувствительный показатель состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию. Важные решения по тактике лечения врач зачастую принимает даже при небольших изменениях лабораторных показателей. Поэтому лабораторные исследования для диагностики и лечения заболеваний так важны. Однако результаты анализов далеко не всегда бывают правильными! Это связано с большим количеством факторов, способных оказать влияние на конечные результаты лабораторного тестирования.
Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации.
Биологическая вариация обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека, и межиндивидуальной вариацией, связанной с различиями между людьми.
К факторам, обуславливающим биологическую вариацию, относят:
-
Физиологические закономерности (влияние расы, пола, возраста, телосложения, характера физической активности и питания);
-
Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воздуха, воды и почвы в месте обитания, социально-бытовая среда);
-
Воздействие производственных и бытовых (алкоголь, никотин, наркотики) токсичных веществ, ятрогенных влияний (диагностические и лечебные процедуры, прием лекарственных средств);
-
Условия, предваряющие или сопровождающие взятие пробы (приём пищи и воды, физическая нагрузка, положение тела при взятии пробы, стрессорные и прочие факторы);
-
Время забора пробы, связанное с влиянием циркадных (суточных) ритмов и времени года;
-
Аналитическая вариация зависит от технологии анализа и используемого оборудования. Также к факторам, обуславливающим аналитическую вариацию, относят:
-
Методику взятия пробы (способ и погрешности процедуры, используемые средства, оборудование и консерванты);
-
Условия окружающей среды (температура, вибрации, тряска, интенсивность освещения) и продолжительность транспортировки биоматериала для исследования в лабораторию.
Недостоверные результаты могут быть вызваны ошибками, допущенными на разных этапах лабораторного исследования, затрудняя постановку диагноза и проведение адекватного лечения. Наиболее часто получение ошибочных результатов связано с внелабораторным (т.н. преаналитическим) этапом. Он включает в себя все стадии от назначения анализов врачом до поступления пробы в лабораторию. Именно с этим этапом связано 2/3 всех ошибочных результатов, которые могут обесценить проведенные исследования. Поэтому правильная организация преаналитического этапа – важнейший элемент обеспечения качества лабораторной диагностики.
Факторы, влияющие на правильность лабораторных исследований на преаналитическом этапе
Прием пищи
Режим питания, состав пищи, перерывы в её приёме оказывают существенное влияние на многие лабораторные показатели. После приема пищи содержание отдельных веществ в крови может повышаться или подвергаться изменениям в результате последующих гормональных эффектов. Наиболее значительно прием пищи повышает содержание в крови триглицеридов и глюкозы. Увеличивается также содержание лейкоцитов (т.н. постпрандиальный лейкоцитоз). Определение многих веществ может затрудняться мутностью, вызванной появлением в крови после приема пищи мельчайших жировых частиц (хиломикронов). Их концентрация достигает максимума через 2-2,5 часа после приема пищи, а, затем, постепенно снижается до незначительной в течение 8-10 часов. В это время целый ряд лабораторных исследований крови может быть невозможен. Голодание, тоже, может искажать результаты исследований. У здоровых людей после двух дней голодания увеличивается концентрация билирубина в крови, после еды его содержание в крови, наоборот, снижается. 3-х дневное голодание в 2-3 раза снижает концентрацию глюкозы в крови, увеличивает концентрацию триглицеридов. После 2-4-недельного голодания в крови снижается концентрация общего белка, холестерина, триглицеридов, мочевины и липопротеинов, повышается выведение почками креатинина и мочевой кислоты. На фоне длительного голодания организм переходит в режим экономии энергии, для чего снижает концентрацию в крови гормонов щитовидной железы – тироксина и трийодтиронина. Одновременно, голодание ведет к увеличению содержания в крови кортизола и дегидроэпиандростерона.
Некоторые продукты и режим питания могут влиять на результаты биохимического исследования крови и мочи. Употребление жирной пищи может повысить в крови концентрацию калия, триглицеридов и активность щелочной фосфатазы. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрацию в крови мочевины, аммиака и солей кальция в моче. Пища с высоким содержанием ненасыщенных жирных кислот может вызвать снижение в крови концентрации холестерина. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 2-3 дня до исследования мочи на содержание 5-оксииндолуксусной кислоты даже у здорового человека её концентрация может стать повышенной. Диета с низким содержанием соли может приводить к повышению уровня альдостерона в 3-5 раз. Напитки, богатые кофеином, увеличивают концентрацию в крови свободных жирных кислот, стимулируют выброс надпочечниками катехоламинов и повышают активность ренина.
Прием алкоголя
Алкоголь снижает в крови концентрацию глюкозы, повышает концентрацию молочной кислоты, мочевой кислоты и триглицеридов. Прямое токсическое воздействие алкоголя на печень повышает активность в крови печеночных ферментов. Повышенное содержание в крови углевод-дефицитного трансферрина, холестерина, мочевой кислоты, активности гамма-глутамилтрансферазы (ГГТ) и увеличение среднего объема эритроцитов свидетельствует о хроническом алкоголизме.
Физическая нагрузка
Может оказывать как временное, так и продолжительное влияние. Преходящие изменения вначале проявляются снижением, а затем увеличением концентрации свободных жирных кислот в крови, двухкратным повышением концентрации аммиака и трехкратным — молочной кислоты. 1-2 часовые активные занятий в спортзале или 1-2 часовая игра в футбол приводит к временным изменениям активности креатинфосфокиназы (КФК), которые наблюдаются при обширных трансмуральных инфарктах. В меньшей степени повышается активность аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ). Эта ферментативная активность остается повышенной в течение суток. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, таких как тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном постельном режиме, иммобилизации, малоподвижном образе жизни и ограничении физической активности повышается протромботический потенциал крови, возрастает риск спонтанного тромбообразования. Также, при длительной иммобилизации увеличивается выделение с мочой норадреналина, кальция, хлора, фосфатов, аммиака, в крови возрастает активность щелочной фосфатазы.
Курение
Никотин и другие содержащиеся в табачной продукции вещества (их более 2000) изменяют секрецию некоторых биологически активных веществ. Курение приводит к увеличению концентрации гемоглобина, количества и объёма эритроцитов, снижает количество лейкоцитов. У курильщиков повышается концентрация карбоксигемоглобина, катехоламинов и кортизола. Изменение концентрации этих гормонов приводит к снижению количества эозинофилов; содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Потребление большого количества сигарет сопровождается также повышением активности гамма-глутамилтрансферазы (ГГТ).
Эмоциональный стресс
Страх, испуг в момент взятия крови, боязнь операции, волнение перед визитом к врачу может влиять на результаты лабораторных исследований. Стрессорные воздействия сопровождаются временным лейкоцитозом; в крови снижается концентрация железа; увеличивается уровень катехоламинов, альдостерона, кортизола, инсулина, пролактина, ангиотензина, ренина, соматотропного гормона, тиреотропного гормона (ТТГ), повышается концентрация альбумина, глюкозы, холестерина, фибриногена. Сильное беспокойство, сопровождаемое глубоким и учащенным дыханием, вызывает дисбаланс кислотно-щелочного равновесия со снижением концентрации в крови молочной и жирных кислот.
Пол пациента
Практически для всех лабораторных показателей установлены достоверные половые различия. В большей степени это относится к содержанию в крови гормонов (прогестерона, эстрадиола, тестостерона, 17-ОН прогестерона, лютеинизирующего гормона, фолликулостимулирующего гормона, пролактина), транспортных белков и биологически активных соединений. В меньшей степени это относится к другим соединениям и форменным элементам крови, но и там различия могут быть существенны.
Возраст пациента
Содержание в крови большинства диагностически значимых веществ зависит от возраста и может значительно изменяться от рождения до старости. Наиболее ярко возрастные изменения проявляются в содержании гемоглобина, билирубина, активности щелочной фосфатазы, показателей липидного обмена, половых гормонов, адренокортикотропного гормона (АКТГ), альдостерона, ренина, гормон роста, паратгормона, дегидроэпиандростерона. С возрастом может меняться содержание маркеров онкологической настороженности, например простатаспецифического антигена (ПСА).
Расовая принадлежность
Для некоторых лабораторных показателей установлены различия нормальных значений между людьми отдельных рас. В сложных клинических ситуациях эти различия нужно учитывать при оценке результатов лабораторных исследований.
Индивидуальные уровни нормальных значений
Установленные нормальные (референтные) значения лабораторных показателей, дифференцированные в зависимости от пола, возраста и технологии анализа, характеризуют группу людей в целом. Однако, внутри любой возрастно-половой группы между отдельными здоровыми людьми наблюдаются также индивидуальные различия. Для некоторых лабораторных показателей эти различия между людьми одного пола и возраста могут быть многократными. С развитием лабораторных технологий, повышением точности исследований, накоплением медицинских знаний таким различиям придается все большее значение. Причина в том, что результаты исследований, присущие одному здоровому человеку, могут говорить о патологическом процессе в организме другого человека, особенно при рассмотрении их в динамике.
Беременность
Беременность является нормальным физиологическим процессом, который сопровождается перестройкой работы многих органов, значительными изменениями выработки половых и тиреоидных гормонов, транспортных белков, адренокортикотропного гормона (АКТГ), ренина, а также целого ряда биохимических и гематологических показателей. Для правильной интерпретации результатов нужно знать срок беременности, когда была взята исследуемая проба крови.
Менструальный цикл
Содержание женских половых гормонов изменяется в широком диапазоне в зависимости от фазы менструального цикла. Оценка результата таких исследований возможна только с привязкой к фазам цикла, для каждой из которых характерны свои диапазоны нормальных значений. Перед исследованием следует уточнить у врача оптимальные дни для взятия крови на анализ уровня фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, прогестерона, эстрадиола, 17-ОН-прогестерона, андростендиона, ингибина и антимюллерова гормона (АМГ). Изменения гормонального фона могут также отражаться на результатах биохимических и гематологических лабораторных исследований. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
Биологические ритмы
Все процессы в организме человека подвержены циклическим ритмам, таким, как циркадные и сезонные. Их влияние отражается на результатах лабораторных исследований. Циркадные (суточные) ритмы наиболее выражены для кортизола, адренокортикотропного гормона (АКТГ), альдостерона, пролактина, ренина, тиреотропного гормона (ТТГ), паратгормона и тестостерона. Отклонения их концентрации от среднесуточных значений могут достигать 400%, что обязательно должно приниматься во внимание. Например, циркадный ритм кортизола может быть причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня. Определяя индивидуальный циркадный ритм секреции гормона, когда в течение суток берется несколько проб анализируемого материала, в сопроводительных документах необходимо указывать точное время взятия каждой из них.
На циркадные ритмы, общие для всех людей, могут накладываться индивидуальные ритмы сна, еды и физической активности. В некоторых случаях следует учитывать сезонные влияния. Например, содержание гормона щитовидной железы трийодтиронина летом на 20% ниже, чем зимой. Содержание тестостерона, наоборот, несколько возрастает в теплое время года.
Прием лекарственных препаратов
Влияние лекарственных препаратов на результаты лабораторных тестов может быть двояким. Нужно различать действие препаратов:
а) Прием которых ожидаемо приводит к изменению результатов лабораторных исследований и действие которых контролируется по этим результатам. При проведении такого мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов.
б) Лабораторный контроль за действием которых не предусмотрен, но которые способны повлиять на правильность результатов лабораторных исследований. Эти препараты и их метаболиты могут привести к получению неправильных результатов лабораторных исследований, оказывая незапланированное влияние на физиологические процессы или негативно воздействовать на технологии лабораторного анализа. Например, уровень тиреотропного гормона (ТТГ) снижается при лечении допамином, концентрация тиреоидных гормонов тироксина и трийодтиронина изменяется при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых антиантацидных препаратов может повышать уровень пролактина у мужчин. Присутствие в биологическом материале контрацептивов, салицилатов, андрогенов может специфически (перекрестные реакции) или не специфически (интерференция) влиять на результаты лабораторных исследований при определении стероидных и тиреоидных гормонов, а также связывающих белков крови. Это лишь краткая иллюстрация множества возможных воздействий. Проведение медикаментозной терапии, могущей искажать результаты анализа, следует обязательно учитывать при назначении лабораторных исследований.
По этим причинам лекарства, мешающие лабораторному анализу, если они назначены не по жизненным показаниям; принимают после взятия биоматериала. Это относится и к любым внутривенным инфузиям. Загрязнение лабораторных проб инфузионными растворами — обычная и часто встречающаяся причина получения неправильных результатов лабораторных исследований. Для исключения этого пробы следует брать из другой руки, из вены, в которую не проводится вливание. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту и когда была взята проба крови.
Диагностические и лечебные мероприятия
На результаты лабораторных исследований могут повлиять оперативные вмешательства, эндоскопия, диализ, внутривенные инфузии, пункции, инъекции, биопсии, пальпация, общий массаж, тепловые процедуры, эргометрия, функциональные тесты, введение рентгеноконтрастных веществ, лучевая и химиотерапия. Например, уровень простатаспецифического антигена (ПСА) может быть повышен в течение нескольких дней после массажа простаты, пальцевого исследования прямой кишки или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к увеличению уровня пролактина. Чтобы предотвратить такое влияние, пробы необходимо забирать до выполнения диагностических процедур, способных исказить результаты теста.
Прочие факторы
Среди прочих факторов, влияющих на результаты лабораторных исследований, имеют значение географическое положение местности, высота над уровнем моря и температура окружающей среды.
Положение тела при заборе крови
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в межклеточное (т.н. интерстициальное), составляющее 1/6 общего объема тела. Клетки крови, вещества, имеющие большую молекулярную массу и связанные с ними не могут проникнуть в ткани и остаются в сосудистом русле. Поэтому их концентрация в крови повышается, в среднем на 5-15%. С этим связана стандартизация положения пациента при взятии крови.
Способ и место забора крови
Участок тела пациента, используемый для взятия крови и техника забора также могут оказать существенное влияние на результаты лабораторных исследований. Лучшее место для забора крови на анализы — локтевая вена. Венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования, предназначены для работы с венозной кровью. В странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые калибровочные и контрольные материалы также предназначены для работы гематологических анализаторов именно с венозной кровью. Помимо этого, при заборе крови из пальца есть методические особенности, которые стандартизировать очень трудно: попадание в образец значительных количеств тканевой (межклеточной) жидкости, нарушение периферического кровотока, необходимость в разведении образца и др., что приводит к ошибкам, низкой точности и воспроизводимости результатов.
Использование капиллярной крови для исследований свертывающей системы (системы гемостаза) не приемлемо в принципе. Это связано с неизбежным попаданием в образец значительных количеств тканевой (межклеточной) жидкости. Тканевая жидкость содержит тканевый тромбопластин, активирующий свертывающую систему, что приведет к получению совершенно неправильных результатов.
Важны также способ и продолжительность наложения жгута на руку при заборе крови. Наложение жгута на период более 2 мин при заборе крови из вены может привести к увеличению концентрации в пробе белков, факторов коагуляции и клеточных элементов.
Капиллярную кровь из пальца для лабораторных исследований допустимо использовать лишь в следующих случаях:
-
При ожогах, занимающих большую площадь поверхности тела пациента.
-
При наличии у пациента очень мелких вен или их плохой доступности.
-
При выраженном ожирении пациента с затрудненным доступом к венам.
-
При установленной склонности к венозному тромбозу.
-
У новорождённых.
Пункцию артерий для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
Хранение и транспортировка биологических материалов
Чувствительность компонентов биологических материалов, имеющих диагностическое значение и изучаемых в лабораториях, очень различна. Некоторые из этих компонентов способны выдерживать хранение и транспортировку при соблюдении определенных условий, другие – нет. По экономическим соображениям принято считать, что с использованием современных систем забора, методов консервации, соблюдении температурных режимов, хранение и транспортировка биологических материалов в течение ограниченного времени допустимы.
В ряде случаев это так. Тем не менее, известно, что многие важнейшие лабораторные показатели допускают очень ограниченную задержку между забором биологического материала и началом исследования. Ситуация еще больше осложняется тем, что одни компоненты лучше сохраняются при охлаждении, тогда как другие, наоборот, в таких условиях претерпевают ускоренную деградацию. Как очевидно, это значительно затрудняет хранение и транспортировку биологических материалов, учитывая, что компоненты с такими разными свойствами зачастую содержатся в одной пробирке. Нужно также учитывать различие между декларируемыми и реальными условиями сбора, хранения и доставки биологических материалов. При этом, стабильность многих компонентов крови и мочи в условиях лабораторной практики остается неизвестной.
Согласно ГОСТ Р 53079.4-2008 «Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа», время доставки образцов в лабораторию не должно превышать 30-60 минут (для мочи – 90 минут), время от забора крови до ее центрифугирования (обязательный этап биохимических и коагулологических исследований) не должно превышать 1 часа. Также, согласно этому документу и другим авторитетным рекомендациям:
-
Не рекомендуется транспортировка образцов цельной крови, используемой, в частности, для проведения ее клинического анализа.
-
Определение скорости оседания эритроцитов (СОЭ) требует начала исследования не позднее 2-х часов с момента забора крови.
-
Моча, собранная для общего анализа крови, может храниться не более 2-х часов, причем применение консервантов нежелательно.
-
Для достоверного дифференциального подсчета лейкоцитарной формулы мазок крови должен быть приготовлен не позднее 3-х часов после ее забора.
Установлено, что в пробах крови, полученных от пациентов с выявленной патологией, могут усиливаться изменения, обычно наблюдаемые под влиянием времени и температуры. Это еще больше сокращает время допустимого хранения и транспортировки биологических материалов, поскольку стабильность компонентов может отличаться у разных пациентов.
Известно, что наименьшей стабильностью обладают показатели, характеризующие состояние свертывающей системы крови. Стандартным условием является проведение общих скрининговых исследований свертывающей системы в течение максимум 4-х часов с момента забора крови. Для т.н. интегральных исследований свертывающей системы крови (исследование тромбодинамики, тромбоэластография) временная задержка, связанная с транспортировкой образцов, недопустима в принципе – получение неправильных, дезориентирующих врача результатов происходит уже после 30-45-минутного промедления. Исследование тромбоцитарного звена свертывающей системы крови еще более уникально – это единственное из более чем 2500 лабораторных исследований, ведущееся на живых клетках. Последнее абсолютно исключает как транспортировку, так и любую задержку начала работы. Все сказанное тем более важно, что судить о состоянии свертывающей системы крови по концентрации или активности отдельных ее компонентов нельзя – значение имеет работа всей системы в целом.
Периодичность лабораторных исследований
Повторные исследования широко используются для оценки эффективности проводимого лечения и прогнозировании исхода заболевания, лекарственном мониторинге, постановке симуляционных тестов. Чтобы избежать получения ошибочных результатов, интервалы между исследованиями должны выбираться с учетом продолжительности «жизни» определяемого вещества в организме, динамики его накопления и выведения при нормальных и патологических процессах, фармакокинетических свойств лекарственных препаратов.
Согласно данным ВОЗ, удельный вес лабораторных анализов составляет 75–80 % от общего числа диагностических исследований, выполняемых в медорганизациях.
Служба значительно эволюционировала: если раньше лаборатория была придатком в поиске факторов риска, постановке диагноза, назначении лечения, то сегодня она является объединяющим механизмом на всех этапах взаимодействия врача и пациента. Централизация лабораторных исследований — мировая тенденция реформирования клинической лабдиагностики. Особое значение имеет преаналитический этап клинических лабораторных исследований.
Лабораторная диагностика
Важная составляющая
Основной целью централизации лабораторных исследований является повышение эффективности лечебно-диагностического процесса за счет расширения объема лабораторной, диагностически значимой информации, которая поступает лечащим врачам из централизованной лаборатории.
Согласно постановлению коллегии Минздрава от 25.07.2018 № 14.4 «О совершенствовании работы службы лабораторной диагностики», централизация лабораторий, направленная на увеличение доступности лабораторных исследований, определена основным стратегическим моментом развития службы клинической лабораторной диагностики страны.
Важнейшей составляющей централизации является процесс взаимодействия с внешним заказчиком (медучреждением) на преаналитическом этапе оказания лабораторных услуг. Преаналитический этап включает прием пациента врачом, назначение лабораторных исследований, заполнение бланка направления, получение пациентом инструкций об особенностях подготовки к сдаче анализов или сбору биологического материала, взятие проб, доставку материала в лабораторию.
При централизации для лаборатории существенно увеличивается число пунктов сбора проб биологического материала, значительно расширяется спектр заказываемых тестов, изменяется структура проб биологического материала, ритм и временной период их поступления в лабораторию.
Взаимодействие централизованной лаборатории с заказчиком на преаналитическом этапе предполагает обучение врачей, медсестер, курьеров, обеспечение их инструкциями по подготовке пациентов к лабораторным исследованиям, правилам взятия, сбора и подготовки проб к транспортировке, организацию логистики доставки. Порядок организации взятия проб биологического материала и доставки его в централизованную лабораторию является одним из важнейших моментов обеспечения правильного взаимодействия лаборатории и учреждения здравоохранения.
Централизация лабораторных исследований предусматривает особые требования к организации преаналитического этапа, строгое выполнение которых позволит обеспечить получение качественных результатов. Любые неточности на этапе назначения лабораторных исследований будут существенным образом снижать эффективность лечебно-диагностического процесса.
Большинство ошибок в процессе лабораторного анализа — от назначения теста до интерпретации результатов — происходит до того, как образец попал в лабораторию, т. е. вне прямого контроля лаборатории. По данным различных исследований, на преаналитический этап приходится от 46 % до 68 % всех лабораторных ошибок.
Наиболее частые ошибки преаналитического этапа:
- отсутствие образца или перечня назначенных исследований;
- ошибки идентификации образца (этикетка,сопроводительный документ);
- гемолиз in vitro (в пробирке);
- сгустки в образце крови/плазмы;
- неправильная пробирка/контейнер;
- недостаточное количество образца (объем пробы);
- неправильное соотношение кровь/антикоагулянт;
- недостаточное перемешивание образца после взятия;
- неадекватные условия хранения и транспортировки;
- неправильный режим центрифугирования (время/скорость).
Рекомендации
При определении приемлемости выявленных ошибок рекомендуется использовать целевые уровни индикаторов качества преаналитического этапа, установленные Международной федерацией клинической химии и лабораторной медицины (IFCC). Ошибки преаналитического этапа могут существенно исказить состав или свойства биологического материала и таким образом существенно снизить диагностическую ценность результата лабораторного исследования. Частота таких ошибок зависит от уровня технологической дисциплины в направляющей организации здравоохранения, качества администрирования этого этапа.
Основные причины большого количества ошибок:
- отсутствие стандартов качества выполнения процедур преаналитического этапа;
- неиспользование для взятия и сбора биоматериала одноразовых безопасных приспособлений по причине существующего ложного представления об их высокой стоимости;
- недостаточные знания и качество обучения среднего медперсонала правилам и технике выполнения процедур преаналитического этапа.
Прогресс лабораторных технологий, оснащение медицинской лаборатории современными автоматическими анализаторами позволили получать существенно более точные результаты анализов. Новые автоматические анализаторы весьма чувствительны к качеству исследуемого биоматериала, что предъявляет более высокие требования к условиям взятия, хранения и срокам доставки проб.
Согласно приказу Минздрава от 18.04.2019 № 466 «О совершенствовании деятельности службы лабораторной диагностики Республики Беларусь», обеспечение качества преаналитического этапа лабораторных исследований является зоной ответственности клинических специалистов. В стандарте СТБ ISO 15189-2015 «Медицинские лаборатории. Требования к качеству и компетенции» требуется установление индикаторов качества с целью мониторинга и оценки работы по всем критическим аспектам преаналитического этапа. Их внедрение в лабораторную практику и систематический сбор данных позволят обеспечить надежность результатов лабораторного тестирования.
Внутренний стандарт
Клинико-диагностическая лаборатория (КДЛ) РНПЦ РМиЭЧ является многопрофильной, с 2016 года выполняет централизованные исследования для взрослых и детей Новобелицкого и Советского районов Гомеля. Заказчиками являются 10 поликлиник. Исследования включают широкий спектр биохимических (специфических белков и метаболитов), иммунохимических (гормоны, онкомаркеры, витамины и др.), коагулологических (коагулограмма, агрегатограмма, факторы свертывания и антикоагулянты, D-димеры и др.) лабораторных тестов.
Разработан внутренний стандарт, который был включен в текст совместного приказа РНПЦ РМиЭЧ и ГУЗО Гомельского облисполкома (№ 117 и № 167 от 05.02.2019) «О централизации лабораторных исследований». Определена схема проведения централизованных лабораторных исследований.
Для обеспечения доступности для врачей-клиницистов информации о полном спектре выполняемых тестов сотрудниками лаборатории разработаны бланки направлений.
Для обеспечения контроля качества выполнения централизованных исследований лаборатория постоянно анализирует результаты применения основных индикаторов качества преаналитического этапа:
- ошибки идентификации и транскрипции тестов;
- несоответствие направления установленной форме;
- неверный тип, недостаточный объем образца;
- повреждение образца/направления в ходе транспортировки;
- образец, направление для образца не получены;
- сгусток в образце.
По результатам анализа, проведенного КДЛ РНПЦ РМиЭЧ, несоответствия в целом выявляются для 1,3 % доставленных образцов сыворотки/плазмы. Среди индикаторов с наибольшей частотой встречаются ошибки транскрипции тестов, составляющие 1 %:
- отсутствие отметок о необходимых тестах;
- нечеткий запрос на исследование;
- незаполненные/не полностью заполненные паспортные данные пациента (не обозначен пол, возраст, не указан диагноз, отсутствует печать врача).
Реже определяются ошибки идентификации пробы — нарушение маркировки, в т. ч. расхождения между нумерацией направления и пробы. В 0,34 % случаев пробы не доставлялись в лабораторию, в 0,3 % — для проб отсутствовали направления на исследования. Несмотря на то что выбраковка по причине гемолиза определена на этапе взятия крови и первичной пробоподготовки, в лабораторию в 0,31 % случаев доставляются гемолизированные образцы. В 0,5–1 % случаев в пробах сыворотки встречаются нити фибрина, сгустки, осадок эритроцитов. Регистрируются случаи доставки количества сыворотки, недостаточного для выполнения назначенных тестов. Такие несоответствия являлись результатом неполного соблюдения поликлиниками правил пробоподготовки: выдержки необходимого времени сворачивания крови, соблюдения режима центрифугирования крови и пипетирования сыворотки.
Для образцов сыворотки с выявленными ошибками транскрипции тестов лаборатория выясняет необходимую информацию по телефону, после чего образцы, как правило, принимаются в работу. Указанные действия позволили минимизировать потери образцов по причине нарушений правил преаналитики. Выбраковка с оформлением акта отказа в приеме биологического материала с объяснением причин проводится для гемолизированных образцов либо для случаев, когда доставляется только проба сыворотки без направления и наоборот. Пробы сыворотки со сгустками, эритроцитами подвергаются повторному центрифугированию, после чего выполняются исследования.

19 июля 2013
НОВЫЕ ЛАБОРАТОРНЫЕ ТЕХНОЛОГИИ ДЛЯ ОПРЕДЕЛЕНИЯ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВ
Определение скорости оседания эритроцитов (СОЭ) является со ставной частью общего анализа крови. Впервые для практической медицины использование СОЭ было предложено шведским врачом R. Fahraeus в 1921 году [6]. Сущность анализа состоит в том, что если взять пробу крови в пробирку с антикоагулянтом (чтобы кровь не свернулась) и оставить ее в покое, то эритроциты начинают медленно падать (оседать) на дно пробирки, оставляя над собой слой жидкой плазмы. На этом феномене основано определение СОЭ. Однако широко в клинической практике определение СОЭ стало использоваться лишь после того, как Альф Вестергрен (A. Westergren, шведский врач, родился в 1891 г.), предложил удобный способ измерения скорости оседания эритроцитов в цельной крови в вертикально установленной стеклянной трубке [12].
В лаборатории стеклянную капиллярную трубку стандартной длины заполняют кровью с антикоагулянтом и оставляют ее в вертикальном положении на определенное время (обычно на 1 ч). В течение этого времени эритроциты оседают, оставляя над собой столбик прозрачной плазмы. Через 1 ч измеряют расстояние между верхней границей плазмы и осевшими эритроцитами. Это расстояние, пройденное оседающими эритроцитами за 1 ч, и является скоростью оседания эритроцитов. Ее величину выражают в миллиметрах в час.
В самом процессе оседания эритроцитов выделяют 3 фазы:
1. агрегация – первичное формирование столбиков эритроцитов;
2. седиментация – быстрое появление эритро-плазматической границы – продолжение формирования столбиков эритроцитов и их оседание;
3. уплотнение – завершение агрегации эритроцитов и оседания столбиков эритроцитов на дне пробирки.
Графически процесс СОЭ описывается S-образной кривой, которая представлена на рис. 1.
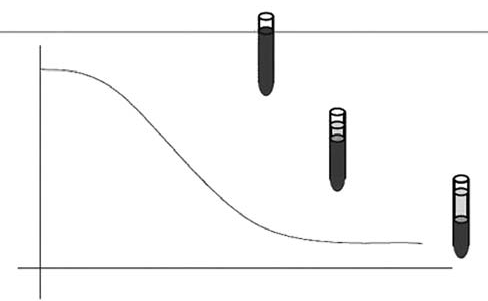
Рисунок 1. Процесс СОЭ.
МЕТОДЫ ОПРЕДЕЛЕНИЯ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВ
В практике клинико-диагностических лабораторий (КДЛ) применяются следующие методы определения СОЭ:
1. метод Панченкова;
2. метод Вестергрена и его модификации;
3. метод измерения кинетики агрегации эритроцитов.
У нас в стране широкое распространение получил метод Панченкова [1]. В этом методе используется стандартный стеклянный капилляр длиной 172 мм, наружным диаметром 5 мм и диаметром отверстия – 1,0 мм. Он имеет четкую коричневую градуировку от 0 до 10 см, шаг шкалы – 1,0 мм, верхнее деление шкалы отмечено «0» и буквой «К» (кровь), напротив деления 50 имеется буква «Р» (реактив).
Методика определения СОЭ методом Панченкова включает следующие этапы:
1. подготовить 5% раствор натрия цитрата и внести на часовое стекло;
2. промыть капилляр 5% раствором натрия цитрата;
3. произвести забор капиллярной крови в промытый капилляр;
4. перенести кровь из капилляра на часовое стекло;
5. повторить шаги 3 и 4;
6. перемешать кровь с натрия цитратом на часовом стекле и вновь заполнить капилляр;
7. установить капил ляр в штатив Панченкова и включить таймер для каждого капилляра отдельно;
8. через 1 ч определить СОЭ по высоте столба прозрачной плазмы.
Метод Панченкова имеет ряд принципиальных недостатков обусловленных плохой стандартизацией производимых промышленностью капилляров, необходимостью использовать для анализа только капиллярную кровь, а также невозможностью адекватно отмыть капилляр при многократном применении. В последние годы метод Панченкова стал применяться для определения СОЭ венозной крови, не смотря на то, что никаких научно-практических исследований по референтным величинам для этого метода, по изучению влияния различных факторов при исследовании венозной крови проведено не было. Поэтому метод Панченкова в настоящее время является источником ошибочных результатов и проблем в работе КДЛ и деятельности врачей-клиницистов, не используется в других странах (кроме стран бывшего СССР) и должен быть исключен из практики лабораторий.
Наиболее широкое распространение в развитых странах мира для определения СОЭ получил метод Вестергрена, который с 1977 года рекомендован Международным Советом по Стандартизации в Гематологии для применения в клинической практике [9]. В классическом методе Вестергрена используют стандартные капилляры из стекла или пластика длиной 300 мм ± 1,5 мм (рабочей является длина капилляра 200 мм), диаметром – 2,55 мм ± 0,15 мм, что повышает чувствительность метода. Время измерения – 1 ч. Для анализа может быть использована как венозная, так и капиллярная кровь. Методика определения СОЭ методом Вестергрена включает следующие этапы:
1. венозная кровь берется в вакуумные пробирки с К-ЭДТА (капиллярная кровь берется в пробирки с К-ЭДТА);
2. пробу венозной (капиллярной) крови смешать с 5% раствором натрия цитрата в соотношении 4:1;
3. произвести забор крови в капилляр Вестергрена;
4. через 1 ч измерить СОЭ по высоте столба прозрачной плазмы.
Метод Вестергрена в настоящее 41 время полностью автоматизирован, что существенно повышает производительность КДЛ и качество результатов. Вместе с тем, необходимо понимать, что классический метод Вестергрена имеет целый ряд модификаций, сущность которых состоит в уменьшении длины капилляра (например, используются моноветты или вакуумные пробирки с раствором натрия цитрата рабочая длина которых составляет 120 мм, а не 200 мм, как в классическом методе Вестергрена), изменении угла установки капилляра (например, ряд фирм использует установку вакуумных пробирок под углом 18°), укорочении времени для наблюдения за оседанием эритроцитов (до 30–18 мин) или сочетании этих изменений. Насколько такие модификации можно называть методом Вестергрена в научной литературе не решен.
На результаты определения СОЭ методом Панченкова и классическим методом Вестергрена могут оказывать существенное влияние ряд факторов преаналитического и аналитического этапов (не связанных с заболеванием пациента) производства лабораторных анализов:
• температура в помещении где проводится анализ (повышение температуры в помещении на 1 °С увеличивает СОЭ на 3%);
• время хранения пробы (не более 4 ч при комнатной температуре);
• используемый антикоагулянт (рекомендован цитрат натрия);
• правильная вертикальность установки капилляра;
• длина капилляра;
• внутренний диаметр капилляра;
• степень разведения крови антикоагулянтом (рекомендуемое разведение 4:1);
• величина гематокрита.
Низкие значения гематокрита (?35%) могут вносить искажения в результаты определения СОЭ. Для получения правильного результата необходим пересчет по формуле Фабри (T.L. Fabry) [5]:
(СОЭ по Вестергрену · 15)/ (55 – гематокрит).
Кроме того, для получения адекватных результатов СОЭ этих методов важно правильно учитывать временные затраты, которые возникают при их практическом выполнении в лаборатории. Так, общее количество времени, затрачиваемое на постановку одной пробы СОЭ, составляет 25–30 с. Если в КДЛ лаборант одновременно ставит 10 проб СОЭ, то временные затраты от первой пробы до последней составят 250–300 с (4 мин 10 с – 5 мин).
Если не учитывать эти временные затраты, то можно получить неправильные результаты исследования, так как СОЭ между 60 и 66 мин (время «остановки» СОЭ) может измениться на 10 мм. Большим недостатком метода Вестергрена является отсутствие возможности осуществлять внутрилабораторный контроль качества.
Данные многих публикаций свидетельствуют о том, что такой контроль в отношении метода Вестергрена является объективной необходимостью. Результаты исследования параллельно тестируемых проб, проведенные Национальной академией клинической биохимии и стандартизации США показали достаточно высокую аналитическую вариацию для определения СОЭ методом Вестергрена – 18,99% [9].
Учитывая все эти недостатки метода Вестергрена, компанией Alifax в 90-е годы был разработан и предложен для использования в клинической практике для определения СОЭ – метод измерения кинетики агрегации эритроцитов. Метод по своей технологии коренным образом отличается от метода Вестергрена, так как определяет агрегационную способность эритроцитов с помощью измерения оптической плотности [10]. Теоретическим основанием данного метода определения СОЭ для его использования в клинической практике служит агрегационная модель оседания эритроцитов, объясняющая этот процесс образованием агрегатов эритроцитов при адсорбции на них макромолекул, способствующих их адгезии, и оседанием агрегатов в соответствии с законом Стокса.
Согласно данному закону, частица, плотность которой превышает плотность среды, оседает под действием силы тяжести с постоянной скоростью. Cкорость оседания пропорциональна квадрату радиуса частицы, разнице ее плотности и плотности среды, и обратно пропорциональна вязкости среды [3]. Сущность новой технологии определения СОЭ, разработанной компанией Alifax, представлена на рис. 2.
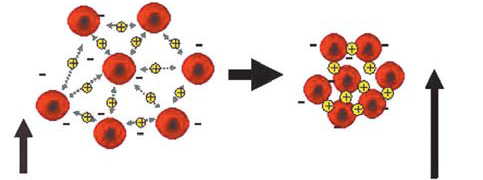
Рисунок 2. Измерение кинетики агрегации эритроцитов.
Каждая проба крови измеряется 1000 раз за 20 секунд. Оптическая плотность автоматически переводится в мм/ч. Измерение агрегации эритроцитов осуществляется автоматически в микрокапилляре анализатора СОЭ, который моделирует кровеносный сосуд. При заборе крови у пациента для определения СОЭ в качестве антикоагулянта используется ЭДТА, что позволяет для анализа использовать пробу крови, взятую для исследования на гематологическом анализаторе (определения основных показателей общеклинического анализа крови).
Корреляция данной технологии с классическим методом Вестергрена составляет 94–99% [4, 8, 11]. Кроме того, при определении СОЭ с использованием ЭДТА стабильность крови увеличивается до 48 ч при температуре хранения 4 °С.
Объектом исследования для анализаторов компании Alifax может быть венозная и капиллярная кровь. Анализаторы компании Alifax поддерживают постоянную физиологическую температуру (37°C) в отсеке для загрузки проб с помощью термостата. Благодаря этому, обеспечивается стабильность результатов исследований вне зависимости от внешней температуры. Низкий уровень гематокрита (?35%) не оказывает влияние на результаты анализа. Нет необходимости использовать формулу Фабри для пересчета полученных значений с поправкой на гематокрит. Более того, анализаторы дополнительно отмечают результаты с низким гематокритом звездочкой (*) [8].
Анализаторы компании Alifax измеряют кинетику агрегации эритроцитов, благодаря этому, данная методика способна устранить влияние факторов преаналитического и аналитического этапов, присущие классическому методу Вестергрена, основанном на оседании [11].
Для калибровки анализаторов компании Alifax и проведения регулярного контроля качества используются специальные латексные частицы. Наборы латексных контролей трех уровней выпускаются готовыми к использованию – низкий (3–6 мм/ч), средний (23–33 мм/ч) и высокий (60–80 мм/ч) [4].
На основании исследования контрольных материалов строится карта Леви-Дженнингса, а результаты регулярного внутрилабораторного контроля качества оценивают согласно правилам Westgard.
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ СКОРОСТЬ ОСЕДАНИЯ ЭРИТРОЦИТОВ
Скорость, с которой оседают эритроциты, представляет собой феномен, который зависит от целого ряда факторов. Понимание роли этих факторов имеет прямое отношение к той диагностической информации, которую представляет определение СОЭ.
В первую очередь, эритроциты опускаются на дно капилляра, так как имеют большую плотность, чем плазма, в которой они взвешены (удельная плотность эритроцитов 1096 кг/м3, удельная плотность плазмы 1027 кг/м3) [3]. Во вторых, эритроциты несут на своей поверхности отрицательный заряд, который определяют белки, связанные с их мебраной. В результате у здоровых людей эритроциты падают вниз каждый сам по себе, так как отрицательный заряд способствует их взаимному отталкиванию. Если по какой-либо причине эритроциты перестают отталкиваться друг от друга, то происходит их агрегация с формированием «монетных столбиков». Образование монетных столбиков и агрегация эритроцитов, увеличивая массу оседающих частиц, ускоряет оседание. Именно этот феномен встречается при многих патологических процессах, сопровождающихся ускорением СОЭ.
Основным фактором, влияющим на образование монетных столбиков из эритроцитов, является белковый состав плазмы крови. Все белковые молекулы снижают отрицательный заряд эритроцитов, способствующий поддержанию их во взвешенном состоянии, но наибольшее влияние оказывают асимметричные молекулы – фибриноген, иммуноглобулины, а также гаптоглобин. Повышение концентрации в плазме крови этих белков, способствует повышению агрегации эритроцитов. Очевидно, что и заболевания, связанные с увеличением уровня фибриногена, иммуноглобулинов и гаптоглобина, будут сопровождаться ускорением СОЭ. На отрицательный заряд эритроцитов влияют и другие факторы: рН плазмы (ацидоз снижает СОЭ, алкалоз повышает), ионный заряд плазмы, липиды, вязкость крови, наличие антиэритроцитарных антител.
Число, форма и размер эритроцитов также влияют на величину СОЭ. Эритропения ускоряет оседание, однако при выраженной серповидности, сфероцитозе, анизоцитозе скорость оседания может быть низкой (форма клеток препятствует образованию монетных столбиков). Повышение количества эритроцитов в крови (эритремия) снижает СОЭ. Референтные величины СОЭ приведены в табл. 1 [2].
Таблица 1. Референтные величины СОЭ по Вестергрену Возраст СОЭ, мм/ч.
| Возраст | СОЭ, мм/ч |
| Новорожденные | 0–2 |
| Младенцы (до 6 мес.) | 12–17 |
| Дети до 17 лет | 2–10 |
| Женщины (моложе 60 лет) | 2–20 |
| Женщины (старше 60 лет) | 2–30 |
| Мужчины (моложе 60 лет) | 2–15 |
| Мужчины (старше 60 лет) | 2–20 |
Величины СОЭ постепенно повышаются с возрастом: примерно на 0,8 мм/ч каждые пять лет. У беременных женщин СОЭ обычно повышена, начиная с 4-го месяца беременности, к ее концу достигает пика – 40–50 мм/ч, и возвращается к норме после родов. Необходимо констатировать, что попытки адаптировать референтные величины СОЭ для метода Вестергрена и метода Панченкова нельзя считать научно-обоснованными.
Величина СОЭ не является специфическим показателем для какоголибо определенного заболевания. Однако нередко при патологии ее изменения имеют диагностическое и прогностическое значение и могут служить показателем эффективности проводимой терапии.
ПРИЧИНЫ ПОВЫШЕНИЯ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВ
Наряду с повышением температуры тела и величины пульса ускорение СОЭ встречается при многих заболеваниях. Изменение состава белков плазмы и их концентрации, которые являются основной причиной повышения СОЭ, – признак любого заболевания, связанного со значительным повреждением тканей, воспалением, инфекцией или злокачественной опухолью. Не смотря на то, что в ряде случаев СОЭ при этих состояниях может оставаться в пределах нормы, в целом, чем выше СОЭ, тем больше вероятность наличия у больного повреждения тканей, воспалительного, инфекционного или онкологического заболевания. Наряду с лейкоцитозом и соответствующими изменениями лейкоцитарной формулы, повышение СОЭ служит достоверным признаком наличия в организме инфекционных и воспалительных процессов. В остром периоде при прогрессировании инфекционного процесса происходит увеличение СОЭ, в период выздоровления СОЭ замедляется, но несколько медленнее в сравнении со скоростью уменьшения лейкоцитарной реакции.
Воспалительные заболевания.
Любой воспалительный процесс в организме сопровождается повышенным синтезом белков плазмы (белки «острой фазы»), включая фибриноген, что способствует формированию монетных столбиков из эритроцитов и ускорению СОЭ. Поэтому определение СОЭ широко использую в клинической практике для подтверждения воспаления при диагностике таких хронических заболеваний, как ревматоидный артрит, болезнь Крона, язвенный колит. Измерение СОЭ позволяет определить стадию заболевания (обострение или ремиссия), оценить его активность и эффективность лечения. Повышение СОЭ указывает на активный воспалительный процесс у больного и, следовательно, отсутствие реакции на проводимую терапию. Наоборот, снижение СОЭ свидетельствует о стихании воспаления в ответ на лечение. Нормальная СОЭ в большинстве случаев исключает наличие воспалительного процесса.
Инфекционные заболевания.
При всех инфекционных заболеваниях иммунная система реагирует повышением продукции антител (иммуноглобулинов). Повышенная концентрация иммуноглобулинов в крови – одна из причин, увеличивающих склонность эритроцитов к агрегации и образованию монетных столбиков. Поэтому все инфекционные заболевания могут сопровождаться ускорением СОЭ. При этом бактериальные инфекции чаще, чем вирусные проявляются повышением СОЭ. Особенно высокое СОЭ наблюдается при хронических инфекциях (подострый бактериальный эндокардит). Повторные исследования СОЭ позволяют оценить динамику течения инфекци-
онного процесса и эффективность лечения.
Онкологические заболевания.
Большинство больных с различными формами злокачественных опухолей имеют повышенную СОЭ. Однако повышение отмечается не у всех пациентов, поэтому измерение СОЭ не используют для диагностики онкологических заболеваний. Но в отсутствие воспалительного или инфекционного заболевания значительное повышение СОЭ (выше 75 мм/ч) должно вызвать настороженность в отношении наличия злокачественной
опухоли.
Особенно выраженное ускорение СОЭ (60–80 мм/ч) характерно для парапротеинемических гемобластозов (миеломная болезнь, болезнь Вальденстрема). Миеломная болезнь – злокачественное заболевание костного мозга с неконтролируемой пролиферацией плазматических клеток, вызывающей разрушение костей и боли в костях. Атипичные плазматические клетки синтезируют огромное количество патологических иммуноглобулинов (парапротеинов), в ущерб нормальных антител. Парапротеины усиливают образование монетных столбиков эритроцитов и повышают СОЭ.
Ускорение СОЭ наблюдается почти у всех больных при злокачественном заболевании лимфатических узлов – болезни Ходжкина. Повреждение тканей. Ряд заболеваний, при которых происходит повреждение тканей, сопровождаются ускорением СОЭ. Например, инфаркт миокарда вызывает повреждение миокарда. Последующий воспалительный ответ на это повреждение включает синтез белков «острой фазы» (в том числе фибриногена), что усиливает агрегацию эритроцитов и увеличивает СОЭ. Аналогичная ситуация возникает при остром деструктивном панкреатите.
Уровень повышения СОЭ и частота изменения этого показателя у пациентов с различными заболеваниями представлены на рис. 3 [7]
Чувствительность и специфичность СОЭ для выявления патологии при различных порогах принятия решения представлены на рис. 4 [7].
ПРИЧИНЫ СНИЖЕНИЯ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВ
Снижение СОЭ встречается в клинической практике значительно реже и не имеет большого клинического значения. Наиболее часто снижение СОЭ выявляют при эритремии и реактивных эритроцитозах (вследствие увеличения количества эритроцитов), выраженной недостаточности кровообращения, серповидно-клеточной анемии (форма клеток препятствует образованию монетных столбиков), механической желтухе (предположительно связано с накоплением в крови желчных кислот).
В заключение необходимо заметить, что, несмотря на широкое применение в клинической практике, определение СОЭ имеет ограниченное диагностическое значение. Вместе с тем, большинство авторитетных экспертов в области клинической медицины, однозначно указываю на то, что диагностические возможности этого метода используются далеко не полностью, и основная проблема для практики отечественных КДЛ лежит в плоскости методических особенностей постановки теста.
СПИСОК ЛИТЕРАТУРЫ
1. Панченков Т.П. Определение оседания эритроцитов при помощи микрокапилляра // Врач. дело. – 1924. – № 16–17. – С. 695–697.
2. Тиц Н. (ред.). Энциклопедия клинических лабораторных тестов: Пер. с англ. – М.: Лабинформ, 1997. – 942 с.
3. Чижевский А.Л., Биофизические механизмы реакции оседания эритроцитов. – Новосибирск: Наука, 1980. – 173 с.
4. de Jonge N., Sewkaransing I., Slinger J., Rijsdijk J.J.M. Erythrocyte Sedimentation Rate by Test-1 Analyzer // Clinical Chemistry. – 2000. – Vol. 46. – June. – P. 881–882.
5. Fabry T.L. Mechanism of erythrocyte aggregation and sedimentation // Blood. – 1987. – Vol. 70. – № 5. – P. 1572–1576.
6. Fahrаeus R. The suspension stability of blood // Physiol. Rev. – 1929. – Vol. 9. – P. 241–274.
7. Fincher R.M., Page M.I. Clinical signifi — cance of extreme elevation of erythrocyte sedimentation rate // Arch. Intern Med. – 1986. – Vol. 146. – P. 1581–1583.
8. Lee B.H., Choi J., Gee M.S., Lee K.K., Park H. Basic Evaluation and Reference Range Assessment of TEST1 for the Automated Erythrocyte Sedimentatioon Rate // Journal of Clinical Pathology and Quality Control. – 2002. – Vol. 24. – № 1. – P. 621–626.
9. NCCLS «Reference and Selected Procedure or ESR Test; Approved standard – 4th Edition». – Vol. 20. – № 27. – P. 10.
10. Plebani M., De Toni S., Sanzari M.C., Bernardi D., Stockreiter E. The TEST 1 Automated System – a new method for measuring the erythrocyte sedimentation rate // Am. J. Clin. Pathol. – 1998. – Vol.
110. – P. 334–340.
11. Reis J., Diamantino J., Cunha N., Valido F. Erythrocyte sedimentation rate in blood a comparison of the Test 1 ESR system with the ICSH reference method // Clinical Chemistry and Laboratory Medicine. – 2007. – Vol. 45 Special Supplement. – P. S118. – MO77.
12. Westergren A. Studies on the suspension stability of the blood in pulmonary tuberculosis // Acta Med. Scand. – 1921. – Vol. 54. – P. 247–281.
Задать вопрос о технологии
Актуальность
Часто у лечащего врача возникают претензии к лабораторным анализам, т. е. происходит не совпадение клинической картины с лабораторными показателями. Нарушение преаналитики является одной из самых частых причин этой проблемы. Данная статья поможет разобраться с этой нелепой, но весьма серьезной задачей.
Что такое преаналитика? Преаналитика – это все процедуры, выполняемые до начала проведения лабораторных исследований, которые непосредственно влияют на результат лабораторного анализа.
Оптимально проведенная преаналитическая подготовка является основным условием точной и полной лабораторной диагностики.
Зачем нужно врачам знать преаналитику? При нарушении преаналитического этапа врачи собственноручно готовят предпосылки для заведомо ложных результатов лабораторного анализа.
Статистика
Затраты времени на этапах лабораторного исследования:
Преаналитическии этап вне лаборатории – 20,20%
Преаналитическии этап в лаборатории – 37,10%
Аналитическии этап – 25,10%
Постаналитическии этап – 13,60%
Отправка результатов – 4%
Анализ ошибок показывает, что около 40% ошибок совершается на преаналитическом этапе при выполнении исследований в плановом порядке и около 60% ошибок происходит на преаналитическом этапе при неотложных анализах. (M.Plebani, P.Carraro, 1997).
Из чего состоит преналитическии этап вне лаборатории?
— Назначение анализов
— Подготовка пациента (психологическая и физическая)
— Заполнение направления.
— Взятие биоматериала.
— Хранение и доставка биоматериала.
На каждом из выше указанных составных может быть допущена ошибка.
Общие правила при подготовке к исследованию крови:
1. Кровь сдается в утренние часы натощак (или в дневные и вечерние часы, спустя 4-5 часов после последнего приема пищи). За 1-2 дня до исследования исключить из рациона продукты с высоким содержанием жиров.
2. Показатели крови могут существенно меняться в течение дня, поэтому рекомендуется все анализы сдавать в утренние часы.
3. Накануне исследования (в течение 24 часов) исключить алкоголь, интенсивные физические нагрузки, прием лекарственных препаратов (по согласованию с врачом).
4. За 1-2 часа до сдачи крови воздержаться от курения, не употреблять сок, чай, кофе, можно пить негазированную воду. Исключить физическое напряжение (бег, быстрый подъем по лестнице), эмоциональное возбуждение. За 15 минут до сдачи крови рекомендуется отдохнуть, успокоиться.
5. Не следует сдавать кровь для лабораторного исследования сразу после физиотерапевтических процедур, инструментального обследования, рентгенологического и ультразвукового исследований, массажа и других медицинских процедур.
6. При контроле лабораторных показателей в динамике рекомендуется проводить повторные исследования в одинаковых условиях – в одной лаборатории, сдавать кровь в одинаковое время суток и пр.
7. Кровь для исследований нужно сдавать до начала приема лекарственных препаратов или не ранее, чем через 10 — 14 дней после их отмены. Для оценки контроля эффективности лечения любыми препаратами нужно проводить исследование спустя 7 – 14 дней после последнего приема препарата. Если Вы принимаете лекарства, обязательно предупредите об этом лечащего врача.
Общие правила применимы ко всем анализам, но для некоторых исследований требуется специальная подготовка и дополнительные ограничения.
Влияние некоторых факторов на результат анализов.
Психический стресс
Степень влияния психического стресса (страх перед взятием крови, предоперационный стресс и т.д.) на лабораторные результаты часто недооценивается. Между тем, под его влиянием может наблюдаться увеличение секреции гормонов (альдостерона, ангиотензина, катехоламинов, кортизола, пролактина, ренина, соматотропина, ТСГ, вазопрессина) и повышение концентрации альбумина, фибриногена, глюкозы, инсулина, лактата и холестерина.
Наложение жгута
Что происходит, когда жгут накладывается на весь период времени при взятии пробы? При использовании давления ниже уровня систолического, внутри капилляров поддерживается эффективное фильтрационное давление. Как следствие, жидкость и низкомолекулярные соединения перемещаются из внутрисосудистого пространства в интерстициальное. Макромолекулы, вещества, связанные с белками и клетки крови не проникают через стенку капилляров, таким образом, их концентрация заметно возрастает, тогда как концентрации низкомолекулярных веществ не изменяются.
Длительность наложения жгута и изменения уровней исследуемых параметров
Сравнение: через 1 мин. через 3 мин.
Параметры Отклонение в %
Билирубин +8
Холестерин +5
Креатинин -9
Креатинкиназа -4
Железо +7
Глюкоза -9
γ-Глютамилтрансфераза -10
Калий +5
Положение тела
Изменение положения тела – из горизонтального в вертикальное – приводит к увеличению уровня ряда показателей.
Параметры Увеличение в %
Гематокрит 13
Эритроциты 15
Холестерин высокой плотности 10
Альдостерон 15
Ренин 60
Взятие пробы из катетера
Если пробы берут из венозных или артериальных инфузионных катетеров, канюлю следует промыть изотоническим солевым раствором в объеме, соизмеримом с объемом катетера. Прежде чем взять пробу, выбросить первые 5 мл крови, полученной из катетера. Взятиепроб для исследований свертывающей системы из катетеров, обработанных гепарином, неприемлемо. Для гепарин-зависимых методов (тромбиновое время, АЧТВ) рекомендуется
предварительно отбросить объем крови, вдвое превышающий объем катетера; первая порция взятой затем крови может быть использована для выполнения исследований, не относящихся к системе гемостаза; последующая порция цитратной крови может использоваться только для определения нечувствительных к присутствию гепарина аналитов: протромбинового времени, рептилазного времени, фибриногена по Clauss, АТ III, мономеров фибрина. Важно, чтобы перед взятием крови в пробирку с раствором цитрата натрия не было длительной паузы, в течение которой кровь в катетере может «застаиваться».
Высота над уровнем моря
Содержание некоторых компонентов крови подвержено значительным изменениям в зависимости от высоты над уровнем моря. С увеличением высоты значительное повышение наблюдается в отношении, например реактивного белка (до 65% на высоте 3600 м), гематокрита и гемоглобина (до 8% на высоте 1400 м) и мочевой кислоты. Адаптация к высоте занимает недели, а возвращение к значениям на уровне моря происходит в течение нескольких дней. Значительное снижение величин с ростом высоты над уровнем моря обнаружено в отношении мочевого креатинина, клиренса креатинина, эстриола (до 50% на высоте 4200 м), осмоляльности сыворотки, ренина плазмы и трансферрина сыворотки.
1 Мошкин А., Долгов В. Обеспечение качества в клинической лабораторной диагностике.. — М.: 2004. – С. 26-43.
2 Преаналитический этап. Пробоподготовка. West Medica
3 Преаналитика: практические советы и методы. SARSTEDT AG & Co.
Түйін: преаналитикалық кезенде көптеген факторлар зертханалық зертудің нәтижесіне әсер ететің зертхана дәрігерлері жақсы түсінеді. Ал клиникалық дәрігердің көбісі бұл жағдайдың маңызың ескермейді. Осы салалардың әсерінен зертханалық зертудің нәтижесін дәрігерлер дұрыс талдамауына және дұрыс ем шара жасамауына алып келеді.
Resume: physicians of Clinical Laboratory Diagnostics had recognized that, in the preanalytical phase, many factors can affect to the results of laboratory tests. Most of physicians don’t know of their influence. Ignorance of this factors may lead to misinterpretation of the result and take on a patient the wrong action.
Лабораторная практика традиционно делится на три этапа: преаналитический, аналитический и постаналитический.
Преаналитическая фаза включает в себя правильный отбор образцов, предоставление информации о пациенте, сбор и маркировку образцов, обработку образцов, сортировку, титрование и центрифугирование. Любой из этих шагов может быть пропущен, что приведет к неточным результатам, которые приписываются преаналитической фазе.
Преаналитические ошибки при исследовани общего анализа крови чаще всего вызваны неверным пониманием запроса на анализ, неправильной маркировкой, контаминацией места отбора, гемолизом, сгустками, недостаточным количеством образцов, проблемами хранения и несоответствующей пропорцией крови к антикоагулянту или неправильным выбором антикоагулянта.
Общая частота неточностей в лабораторных работах, согласно G. Lippi et.al. (2010), варьируется от 0,1% до 3,0%. Считается, что преаналитические ошибки составляют от 46% до 68,2% ошибочных диагнозов, в то время как аналитические ошибки, которые были в центре внимания более ранних исследований, составляют лишь около 10% всех ошибочных диагнозов (Hammerling J., 2013). Кроме того, преаналитические ошибки составляют от 18,5% до 47% всех лабораторных ошибок.
Наиболее распространенными преаналитическими ошибками являются отсутствие медицинской информации, неподходящие контейнеры и потерянные образцы.
Несмотря на то, что существуют международные стандарты отбора проб крови и стандартизации процесса тестирования, соблюдение руководящих принципов здесь крайне низкое, особенно тогда, когда лабораторный персонал не привлекается, а медсестры или врачи выполняют забор крови, частота преаналитических ошибок становится очень высокой.
Кроме того, критерии отбраковки образцов различаются в разных лабораториях. Не хватает профессиональных данных по отчетности, анализу первопричин и стратегиям предотвращения лабораторных ошибок (Lima-Oliveira G, et.al., 2012).
Наиболее распространенной преаналитической ошибкой являются изменения условий хранения из-за задержки при транспортировке, на которые приходится 19,45%, за которыми следуют пробы, забракованные из-за неверных медицинских записей- 19,16%. Общее количество забракованных разбавленных проб составляет 16,35%, а количество забракованных проб из-за неправильных пробирок составляет 16,01%). Отклоняется гемолизированных образцов — 15,13%. Немеченые образцы отклоняются в количестве 10,01%, а образцы со сгустками составляют 3,88% от общего числа забракованных образцов (Toor N., et. al., 2023)
Низкая удовлетворенность пациентов напрямую связана с лабораторными ошибками и высокими затратами как для пациентов, так и для системы лабораторных услуг.
Негативное влияние лабораторных ошибок на лечение пациентов не ограничивается тем фактом, что они увеличивают время обработки, требуют дополнительных заборов крови и приводят к неточным диагнозам и неподходящим лекарствам; они также наносят ущерб репутации лаборатории и подрывают доверие пациентов к диагностическим услугам. Было подсчитано, что лабораторная ошибка оказывает негативное влияние на результаты лечения пациентов до 24,4% (Lippi G., et.al., 2006).
Этот процесс приводит к увеличению финансовой нагрузки на систему здравоохранения. Согласно исследованию S. Green (2013), расходы на преаналитические ошибки составляют от 0,23% до 1,2% всего операционного бюджета больниц.
Сбор крови
Количество и концентрация дикалийэтилендиаминтетрауксусной кислоты (EDTA) в пробирке для сбора крови требуют, чтобы кровь собиралась до определенной отметки на пробирке. Если собрано слишком мало крови, разбавление образца может привести и к изменению параметров. Относительный избыток EDTA в таких случаях также влияет на морфологию клеток крови.
Транспортировка крови
Транспортировка образца должна исключать высокую температуру. Фрагментация эритроцитов при этом является признаком избыточного тепла. Ложно высокое количество лейкоцитов (WBC) при высокой температуре встречается чаще, чем ложно низкое. Известно, что в определенных ситуациях гематологические анализаторы обеспечивают ложное PLT, когда истинное количество тромбоцитов является адекватным.
Физиологические и физические факторы, влияющие на показатели общего анализа крови
Несколько физиологических и физических факторов могут повлиять на результаты CBC и затруднить установление референтных значений. Физиологические факторы включают возраст, этническую принадлежность, пол, сезон, время суток, питание, болезни, стресс, травмы др.
К важным физическим факторам относятся место забора крови, наличие и тип антикоагулянта, а также обработка и подготовка образцов (Dyer D.Cervasio S.,2008). Любая интерпретация результатов должна учитывать эти факторы.
Преаналитические ошибки результатов общего анализа крови
Потеря образца
Отсутствие полноценного запроса на анализ
Неправильная маркировка (19,16% преаналитических ошибок)
Сбор крови
Контаминация места, в котором производится забор крови
Недостаточное количество образца крови
Неправильный выбор антикоагулянта, относительный избыток или дефицит EDTA (16,45% преаналитических ошибок)
Неправильные пробирки (16,01%)
Гемолиз in vitro (15,13% преаналитических ошибок)
Наличие сгустков крови (3,88% преаналитических ошибок)
Транспортировка
Задержка транспортировки (19, 45% преаналитических ошибок)
Неподходящие контейнеры
Высокая температура окружающей среды при транспортировке
<RBC (фрагментация эритроцитов)
WBC >
Неправильное хранение
Высокая температура окружающей среды при хранении
<RBC (фрагментация эритроцитов)
WBC >
Первоначальное замораживание с последующим охлаждением
Нарушение срока хранения образца крови при определенной температуре
Хранение крови
Отложенный анализ проб по организационным, техническим причинам или проверке сомнительных результатов, которые необходимо уточнить — не редкость в клинической практике. Кроме того, реорганизация лабораторных служб по всему миру влечет за собой объединение небольших лабораторий в более крупные, что особенно важно в эпоху новых инициатив в области общественного здравоохранения. Большое количество образцов отправляется из периферийных центров в централизованную лабораторию на большие расстояния, тем самым происходит задержка на 12-24 часа или даже более. Более того, в выходные дни этот интервал может превышать 36 часов. Это важно уситывать в связи с тем, что CBC является наиболее часто проводимым лабораторным тестом, дающим основную и ценную информацию не только для облегчения диагностики и направления дальнейшего тестирования, но и для мониторинга состояния пациента, включая оценку эффективности терапии.
В большинстве случаев мы не можем сразу провести анализ, поэтому информацией о том, как долго мы можем хранить образцы для получения надежных результатов, должны владеть как сотрудники лаборатории, так и врачи.
В литературе большинства производителей автоматических анализаторов часто упоминается, что образцы крови, хранящиеся либо при комнатной температуре, либо при 4 ± 2°C (в холодильнике) до 24 часов, как правило, дают надежные результаты для общего анализа крови и автоматизированного дифференциального подсчета лейкоцитов. Однако, хранение при комнатной температуре может вызвать изменения этилендиаминтетраацетата (EDTA) и количественное влияние хранения на кровь, поскольку известно, что клеточные элементы обладают ограниченной стабильностью в EDTA. В то же время, было отмечено, что хранение в холодильнике крови с антикоагулянтом EDTA улучшает стабильность общего анализа крови (Gulati G., et.al., 2002).
В соответствии с рекомендациями Международного комитета по гематологической стандартизации, максимальные интервалы хранения для общего и лейкоцитарного подсчета с автоматическим дифференциальным подсчетом стабильны при 4°C в течение как минимум 24 ч или даже до 72 ч, при этом существенные различия зависят от типа автоматизированного анализатора клеток крови.
Для CBC образцы можно надежно хранить в течение 24 часов. Для более длительного хранения лучшим выбором будет охлаждение (при 4 °C). Интересно, что в некоторые моменты времени (1, 2 и 4 часа) PLT немного ниже. Хранение при 4 °C показало гораздо большую стабильность. За исключением 8 часов, до 3 дней статистических изменений не было. Преимущества холодильной камеры (4 ° C) очевидны для длительного хранения. Стоит отметить, что хранение образцов более 12 часов для метаболической панели может привести к ненадежным результатам. Разные авторы сообщают, что некоторые анализы крови стабильны до 72 часов после сбора, если хранить их при 4 ° C в холодильнике.
Повреждение эритроцитов при хранении тесно связано с их внутренним энергетическим метаболизмом. Поскольку в эритроцитах нет митохондрий, полностью зависящих от гликолиза для получения энергии, молочная кислота, образующаяся в процессе гликолиза, будет снижать внутреннее значение рН клеток, тем самым снижая уровень метаболизма клеток и уменьшая производство АТP, что приводит к снижению уровня фосфорилирования фосфопротеинов и утрате деформируемости клеточной мембраны. Снижение уровня АТP в свою очередь уменьшает синтез 2,3-дифосфоглицериновой кислоты, а уменьшение значения рН и концентрации 2-магне3-дифосфоглицериновой кислоты сдвигает кривую кислородной диссоциации гемоглобина влево. АТP также является агонистом NO-синтазы. NO и гемоглобин в эритроцитах объединяются с образованием SNOHb и Hb(Fe~II) NO, которые участвуют в транспорте и метаболизме NO. Уменьшение АТP также влияет на ионный насос на клеточной мембране, что приводит к увеличению уровня К + в депонированной крови (Li L., et.al., 2022).
Некоторые параметры, связанные с эритроцитами, такие как RBC, HB и MCHC менее стабильны при хранении при 4 °C, на что может повлиять первоначальное замораживание с последующим охлаждением (Lombardi G., et al., 2011). RDW значительно увеличивается после 24-часового хранения при комнатной температуре. Возможной причиной этого изменения может быть повышенный MCV (de Baca M., et.al., 2006).
По данным D. Gunawardena et.al. (2017) среди параметров CBC лейкоциты (WBC), эритроциты (RBC), HB, MCH, нейтрофилы и лимфоциты стабильны при всех температурах (4 ± 2°С, 23 ± 2°С и 31 ± 2°С.) до 48 часов. Моноциты, эозинофилы, MCH, HCT и SV-RDW показали статистически значимые изменения при 23 ± 2°C и 31 ± 2°C. Значительное снижение количества тромбоцитов (PLT) и увеличение MPV и количества базофилов наблюдались при всех исследуемых температурах вплоть до 48 часов.
Увеличение MPV наблюдается при всех температурах, причем этот показатель не считается очень стабильным для образцов крови, хранящихся в течение длительного времени. Его значения изменяются в первый период времени (1 час) и не имеют различий для температуры хранения (Wu D-W., et.al., 2017). Четыре дня при 4 °C изменяют морфологию, движение и агрегацию тромбоцитов (Mahmoodi M., et al., 2006). MPV может иметь отношение к изменениям формы тромбоцитов, связанным со временем и формой, от дисковидной до сферической и набухания. Возможно, что тробмоциты, которые показывают повышение MPV, не будут подсчитаны машиной как тромбоциты, а будут помечены отдельно, что приведет к снижению PLT. Это говорит о том, что лучше всего оценивать PLT в течение 6 часов после забора крови.
Во всех случаях результаты CBC обычно более стабильны, чем различные биохимические, например, метаболические панели и предоставляют надежные результаты даже через 24 часов хранения.
Эритроциты, хранящиеся с добавлением прогестерона, имеют более высокие уровни АТP, меньший спонтанный лизис, более высокую осмотическую резистентность и более высокое поглощение метиленового синего в течение времени хранения, чем клетки, хранение которых происходит без добавления прогестерона. Этот гормон, по-видимому, находится в устойчивом равновесии между плазмой и эритроцитами в течении 42 дней хранения, и его количество в плазме почти вдвое больше, чем в клетках. После повторных промываний солевым раствором около 10% прогестерона остается прикрепленным к эритроцитам. Специфическая связь прогестерона с популяциями эритроцитов различной плотности показывает, что высокая удельная активность достигается в популяциях клеток низкой плотности (молодые клетки) в течение всего времени хранения (DeVenuto F., S M Wilson S.,1976).
.
Трансфузиология
Во время хранения компонентов крови ex vivo биореактивные вещества, накопленные в среде хранения и вызвавшие изменения в эритроцитах, предоставили постоянные доказательства непрерывных изменений, приводящих к дисфункции эритроцитов и способны оказывать неблагоприятное воздействие на переливаемого хозяина (Gacko M., et.al., 2004). Удаление лейкоцитов и тромбоцитов как источника свободных радикалов в компонентах эритроцитов влияет на защиту оксидоредуктивного баланса в компонентах эритроцитов во время хранения.
Лейкоредуцирование или лейко-истощение относится к снижению количества лейкоцитов менее чем 5 × 10 6 остаточных донорских лейкоцитов в конечном продукте крови при сохранении 85% жизнеспособного исходного RBC. Наличие лейкоцитов в компонентах крови является причиной нескольких осложнений.
Лейкоредуцирование предотвращает фебрильные реакции, накопление цитокинов / хемокинов, избегая фебрильной негемолитической реакции трансфузии (FNHTR), уменьшая передачу цитомегаловируса и невосприимчивость к переливанию тромбоцитов (в концентратах тромбоцитов).
Несмотря на использование аддитивных растворов, изменения морфологии и метаболизма эритроцитов ожидаются при хранении пакетов с кровью с лейко-редукцией и без нее. Хранение эритроцитов вызывает некоторые сложные структурные и биохимические изменения, которые называются поражением хранения эритроцитов (RCSL)
Биохимические изменения включают снижение активности фермента глюкозо-6-фосфатдегидрогеназы (G6PD) в качестве антиоксидантного фермента, увеличение везикуляции эритроцитов, потеря мембран эритроцитов, лизис мембран эритроцитов, снижение уровня 2,3-дифосфоглицерата (2,3- DPG), аденозинтрифосфат (АТФ) и снижение уровня глутатионредуктазы (GSH). Эти процессы сопровождаются снижением рН, увеличением активности фермента ЛДГ и концентрацией лактата.
Эти изменения приводят к снижению функции и выживаемости эритроцитов после переливания. G6PD является важным ферментом в метаболизме эритроцитов и ключевым ферментом окислительного пентозофосфатного пути (PPP). В PPP никотинамид-аденин-динуклеотид-фосфат (NADP) превращается в его восстановленную форму, NADPH, которая необходима для GSH-опосредованной защиты от окислительного стресса поддерживая целостность эритроцитов.
Также наблюдаются некоторые биохимические изменения концентратов эритроцитов при анаэробном гликолизе. В частности, наблюдается увеличение уровней калия (K +) и лактата и одновременное снижение уровней pH, глюкозы и натрия (Na +). Время хранения не влияет на уровни кальция (Ca ++) в концентратах RBC.
Активность ферментов лактатдегидрогеназы и К + в эритроцитах значительно выше (в 20-160 раз), чем в плазме, и можно ожидать, что гемолиз приведет к увеличению этих аналитов.
Cтатистически значимое увеличение активности лактат дегидрогеназы было показано в течение периода хранения в нефильтрованных эритроцитах. Активность фермента LDH в нефильтрованном эритроците по сравнению с LR-RBC увеличилась с 14-го дня хранения и была статистически признана значимой. Такие показатели, как MCV, MCH и MCHC, меньше всего влияли на хранение. Другие авторы обнаружили, что MCV увеличился, а MCHC значительно снизился в течение периода хранения, которые оценивались каждую неделю. (Grezelbash B., et.al., 2018).
J. Latham et al. (1982) наблюдали увеличение концентрации не только лактата, лактатдегидрогеназы, но и гемоглобина во время хранения. Консистенция свободного Hb и скорость гемолиза также были выше в нефильтрованном RBC по сравнению с LR-RBC во время хранения. Эти наблюдения указывают на возможное вовлечение лейкоцитов в большее повреждение эритроцитарной мембраны и благоприятное влияние лейкоредуцирования на качество сохраняемых единиц эритроцитов. Эти различия могут быть связаны с биологически активными веществами, такими как цитокины и гистамин, которые высвобождаются из лейкоцитов во время хранения, что оказывает непосредственное воздействие на мембрану эритроцитов и приводит к некоторым структурным и биохимическим изменениям.
Согласно предложению Castro O., et.al. (2003), общая концентрация гемоглобина, лактатдегидрогеназа и концентрация лактата являются маркерами гемолиза.
Sonker А. et.al. (2014) также сообщили, что лейко-фильтрованный RBC показывает меньшее повышение K +, LDH и гемолиза к концу периода хранения по сравнению с их нефильтрованными единицами. Присутствие лейкоцитов может быть причиной усиленного окислительного стресса. Эти авторы отметили, что активность ферментов LDH, гемолиз и повреждение клеточных мембран (калий, LDH, свободный гемоглобин) усиливаются в компонентах крови с высоким содержанием лимфоцитов.
Дельта – проверки
Преаналитические ошибки, которые могут повлиять на результаты CBC, включают смешивание образцов, неправильное получение образца и нарушение целостности образца между моментом, когда образец был получен и когда он был доставлен в лаборатории.
Дельта-проверки — процесс маркировки различий в конкретных аналитах между последовательными анализами, являются одним из способов выявления таких проблем. Такие проверки эффективны при обнаружении некоторых вариантов преаналитических ошибок.
Среди обычно оцениваемых показателей CBC средний объем клеток, или MCV, и средняя концентрация клеточного гемоглобина, или MCHC, пригодны для дельта -проверок лучше всего. И тот, и другой показатель чрезвычайно стабильны в течении короткого срока — 24 часа. Например, суточный биологический коэффициент вариации MCV у здоровых людей составляет всего 0,5%. Даже в ситуациях быстрого изменения других параметров эритроцитов, таких как острое кровоизлияние, MCV и MCHC не будут значительно изменяться в течение суток, поскольку ответ ретикулоцитов на острую кровопотерю не начинается в течение первых двух-трех дней. За исключением переливания эритроцитов и редко острого внутрисосудистого гемолиза, нет неотложных ситуаций в состоянии пациента, которые бы значительно изменили эти показатели в краткосрочной перспективе. В случае острого гемолиза с гемоглобинемией, MCHC может быть изменен, в отличие от MCV, который будет оставаться стабильным.
Из других проблем, связанных с анализом образца, гемолиз образца также поддается обнаружению с помощью дельта-проверок на основе MCHC. В этом сценарии RBC уменьшается, без изменений в HB и MCV, что приводит к увеличению MCHC.
Загрязнение образцов внутривенной жидкостью и изменения количества клеток из-за свертывания образцов теоретически могут быть обнаружены дельта-проверками HB и HCT, а также изменениями значений RBC, WBC и PLT. Однако нецелесообразно использовать дельта-проверки любого из этих показателей для обнаружения такого образца, поскольку быстрые изменения любого из них являются обычными у госпитализированных пациентов, причем, частота ложноположительных результатов будет здесь неприемлемо высокой. Тем не менее, внутривенное загрязнение приводит к пропорциональному снижению всех этих показателей.
Следует также отметить, что выполнение дельта-проверок на MCHC имеет дополнительное преимущество для обнаружения неисправности анализатора, поскольку MCHC рассчитывается на основе трех параметров эритроцитов RBC, HB и MCV, которые измеряются непосредственно на большинстве гематологических анализаторов. Следовательно, проблемы в любом из этих измерений будут влиять на MCHC. Выбор пределов достоверности для дельта-проверок зависит от ряда факторов, в том числе от желаемого баланса чувствительности и специфичности и оцениваемой популяции пациентов. Статистический подход к дельта-проверкам может быть достигнут путем получения пар точек данных пациентов из репрезентативной популяции. Пределы, охватывающие желаемую долю населения (например, 95% или 99%), могут быть легко выбраны (Savage R., 2006).
Температура хранения
Гемоглобин, количество эритроцитов, количество лейкоцитов, средний корпускулярный гемоглобин остаются стабильными в течение по меньшей мере 24 часов при температуре 33 ° C. Гематокрит, средний корпускулярный объем и количество тромбоцитов стабильны в течение менее четырех часов при 33 ° C. Все вышеперечисленные параметры стабильны при 22 ° С и 4 ° С. Дифференциальная оценка HCT, MCV, PLT показала нестабильность в течение четырех часов при температуре 33 ° C.
Некоторые параметры, связанные с эритроцитами, такие как RBC, HB и MCHC, менее стабильны при хранении при 4 ° C, поскольку на них может повлиять первоначальное замораживание с последующим охлаждением Изменение HCT и MCHC, несомненно, является следствием изменения MCV, поскольку эти параметры частично получены из последнего показателя.
Гемолиз in vitro
Термин «гемолиз» происходит от латинского слова hemo (кровь) и лизиса (взломать) и означает разрушение клеток крови. Лаборанты обычно ограничивают значение понятия «гемолиз» эритроцитами (процесс, называемый эритролизом), которые составляют наибольший процент эритроцитов крови и игнорируют состояние других клеток крови. В связи с этим подходом методы оценки гемолиза зависят «исключительно» от измеренного количества свободного гемоглобина (fHB), выделившегося из разрушенных эритроцитов. Напротив, небольшое количество авторов описывают «гемолиз» как разрушение всех типов клеток крови, а именно панцитолиз и заявляют, что лейкоциты и тромбоциты также могут поддвергаться гемолизу. Стоит отметить, что лейкоциты могут способствовать повышению уровня калия в состоянии лизиса.
Гемолиз может происходить in vivo, при патологических состояниях или in vitro в связи с преаналитическими ошибками.
Гемолиз in vitro в преаналитической фазе является основной проблемой, с которой сталкиваются клинические лаборатории. Определяемый как разрыв мембраны эритроцита с экстравазацией гемоглобина и других внутриклеточных компонентов в окружающую плазму, гемолиз можно обнаружить визуально во время лабораторной оценки из-за изменения окраски плазмы от розового до красного после центрифугирования образца.
Гемолиз in vitro обычно возникает в результате неадекватного забора крови, включая такие факторы, как использование игл малого диаметра, попадание остатков спирта с кожи в образец, трудности с поиском венозного доступа, маленькие и хрупкие вены, которые легко травмируются, и попытки неудовлетворительной пункции. Кроме того, неправильное обращение с образцами, такое как недостаточное заполнение пробирки для сбора, приводящее к избытку антикоагулянта, сильное встряхивание образца, воздействие чрезмерно высоких или низких температур и центрифугирование на очень высокой скорости в течение длительного периода времени, также являются факторами, которые могут нарушить структурная целостность клеток крови (Lippi G., et.al., 2008).
Факторы, способствующие гемолизу in vitro вследствие неадекватного забора крови
Использование игл малого размера
Попадание остатков спирта с кожи в образец
Трудности с поиском венозного доступа
Маленькие и хрупкие вены, которые легко травмируются
Неоднократные попытки плохой пункции
Было показано, что с течением времени количество эритроцитов значительно снижается из-за гемолиза. Повышенная проницаемость клеток будет определяться увеличением MCV — индекса, отражающего набухание эритроцитов. Изменение HCT и MCHC явно является следствием изменения MCV, поскольку эти параметры частично получены из MCV (Buoro S., et al., 2016).
В работе G. de Longe et.al. (2018) образцы с высокой степенью гемолиза превышали спецификации качества для желаемой систематической ошибки, демонстрируя снижение эритроцитов (4,7%), гематокрита (6,6%), MCV (0,6%) и увеличение параметров: RDW (1,3%), MCH (1,5%), MCHC (2,5%) и количество тромбоцитов (36,7%). В то время как образцы с легкой степенью гемолиза имели умеренное увеличение MCH (0,6%), MCHC (0,7%) и количества тромбоцитов (1,4%). Авторами было замечено, что RCB имел погрешность -6,4% (от -22,8% до 10,0%), а HCT — погрешность -8,3% (от -25,7% до 9,2%), превышающую допустимые нормы ±1,7% для проб с высокой степенью гемолиза. Так, эти показатели могут быть занижены до 22,8% для эритроцитов и до 25,7% для HCT или завышены до 10,0% и 9,2% соответственно.
Стоит отметить, что принцип измерения MCV сильно различается в зависимости от используемого гематологического анализатора. с помощью метода импеданса образцы с высокой степенью гемолиза могут демонстрировать умеренное изменение MCV (увеличение на 0,6%) с последующим увеличением RDW на 1,3%, что представляет собой широкий разброс примерно в 12%, оценивая пределы согласия и их доверительные интервалы.
Гемолиз образца крови, взятого для CBC
Высокая степень гемолиза
Снижение RBC (4,7%), HCT (6,6%), MCV (0,6%)
Увеличение RDW (1,3%), MCH (1,5%), MCHC (2,5%)
Отсутствии изменений HB
Увеличение PLT (36,7%)
Низкая степень гемолиза
Увеличение MCH (0,6%), MCHC (0,7%), PLT (1,4%)
Сравнение образцов с разной степенью гемолиза показало снижение количества эритроцитов и гематокрита и увеличение средней концентрации корпускулярного гемоглобина и количества тромбоцитов в образцах с высокой степенью гемолиза. Согласно принятой клинической точке зрения, образцы с высокой степенью гемолиза превышают желаемую погрешность, демонстрируя снижение RBC, HCT и MCV, а также увеличение RDW, MCH, MCHC, PLT. Однако образцы с легкой степенью гемолиза показали лишь незначительное увеличение среднего корпускулярного гемоглобина, средней концентрации корпускулярного гемоглобина и количества тромбоцитов. (de Jonge G., et.al.,2018).
Выяснение интерференционных механизмов гемолиза необходимо для более точного решения проблемы гемолиза in vitro. Гемолизированные образцы влияют на результаты испытаний по нескольким механизмам, таким как: композиционные помехи (из-за разницы между внутриклеточной и внеклеточной концентрацией аналитов), помехи сигнала в инструментальных измерениях и химической помехи в аналитических реакциях. Эти интерференционные механизмы могут сосуществовать в различных сочетаниях. Отказ от результатов анализа гемолизированных образцов может привести к задержке в диагностике, что угрожает безопасности пациента, а запрос дополнительного образца увеличивает рабочую нагрузку лаборанта и стоимость исследования.
Вполне возможно, что клеточный дебрис и строма, образующиеся в результате распада эритроцитов, могут вызывать существенные аналитические помехи в подсчете тромбоцитов


