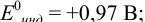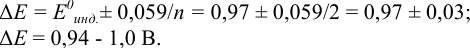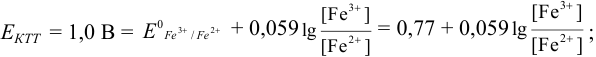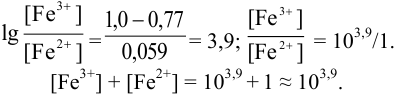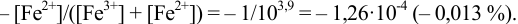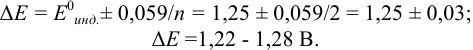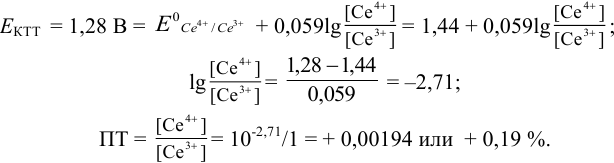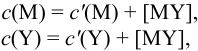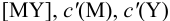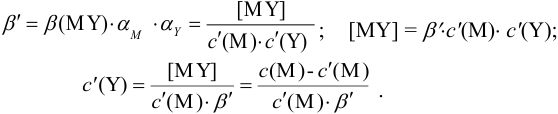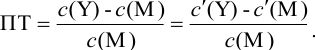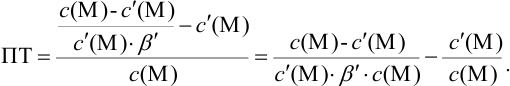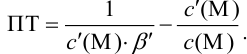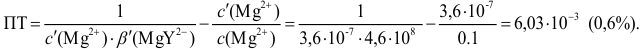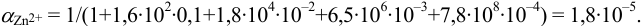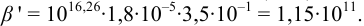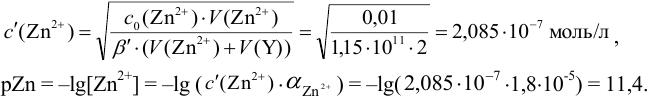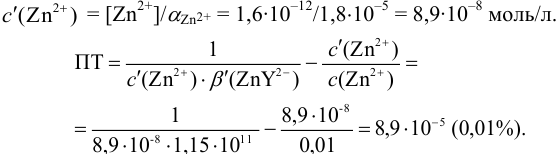Расчет индикаторных погрешностей кислотно-основного титрования
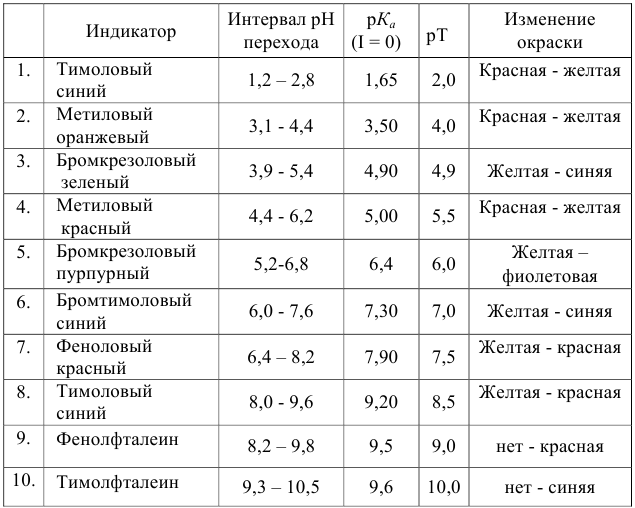
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 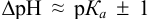
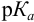
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 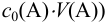
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования
Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а) 
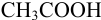
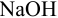
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования 

Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и 

Рассчитаем величину ПТ с двумя индикаторами: с рТ < 

С индикатором метиловым красным (рТ 5,5 < 
С индикатором фенолфталеином (рТ 9,0 > 
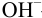
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 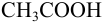



Например, при выборе фенолфталеина (рТ = 9,0):
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз:
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 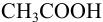
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
или при проведении расчета по приближенной формуле:
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин 

Решение:
Реакция титрования:
приводит к образованию слабой сопряженной кислоты 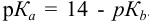
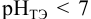
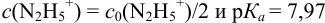
Сравнивая рТ индикаторов и 
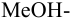
и с метиловым красным (рТ 5,5):
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 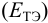

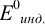
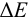
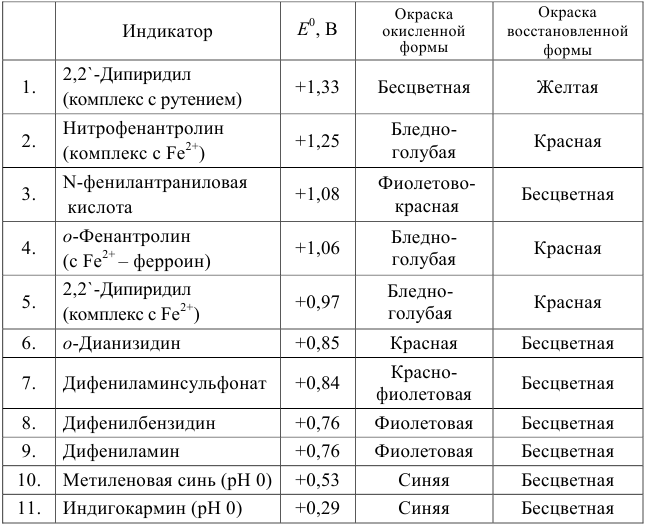
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
Полуреакция восстановления и интервал перехода индикатора:
Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 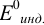
- сравнить
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 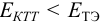
Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли 

Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 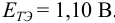
Выберем для рассмотрения порядка расчета два индикатора:
а) с 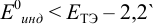
б) с 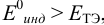
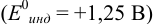
В случае а) интервал перехода индикатора:
Изменение окраски заканчивается при 
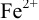



Тогда: ПТ =
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с 
Изменение окраски заканчивается при 

Тогда количество 

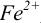
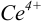
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 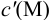
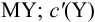
Условные константы устойчивости (см. выражение 8.16) связывают
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
Подставляем в это уравнение выражение для 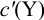
Вблизи ТЭ 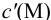
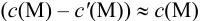
следовательно:
Выражение (8.21) тождественно выражению: 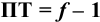
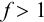
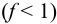
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
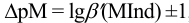
Интервал перехода окраски 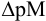
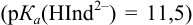
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 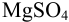

Решение:
В данных условиях 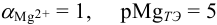
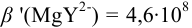
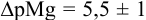
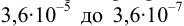

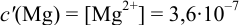
Погрешность титрования 
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 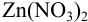

Решение:
1. Рассчитаем условную константу 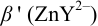
Общие константы устойчивости для аммиачных комплексов 
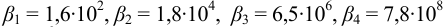

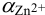
По табл. 7 и табл. 4 приложения находим 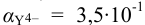
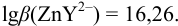

В точке эквивалентности:
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 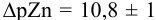
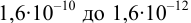

2. Конечная точка титрования наступает при [
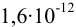

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Уравнение (VI.67) строго справедливо для кислых, нейтральных и слабощелочных растворов. При больших pH наблюдаются отклонения от этого уравнения, величины которых зависят от сорта стекла, природы катионов раствора и pH среды. Эти отклонения называются щелочной ошибкой стеклянного электрода. В сильнокислых средах наклон зависимости Е — pH также отклоняется от предсказываемого [c.135]
Зависимость потенциала стеклянного электрода от pH выражается кривой с минимумом (рис. 8). Положение максимума зависит от сорта стекла и определяется величиной Таким образом, в щелочных растворах (pH > 12) измерения pH со стеклянным электродом приводят к так называемой «щелочной ошибке». Аналогично при pH < О наличие минимума создает «кислотную ошибку», которая, по-видимому, связана с анионной функцией стеклянного электрода в сильнокислой среде. [c.52]
Работа № 4. Определение щелочной ошибки стеклянного электрода ЭСЛ-43-07 [c.199]
Щелочная ошибка титрования. Здесь аналогично приведенному выше мол(но написать [c.288]
Индикаторы и индикаторные ошибки при титровании слабого основания. Из рассмотренных на рис. 10.4 трех индикаторов наиболее подходящим для титрования аммиака, как видно, будет метиловый оранжевый, имеющий рГ 4,0, а наименее подходящим — фенолфталеин, обесцвечивание которого произойдет задолго до точки эквивалентности. В недотитрованных растворах слабого основания, когда рГ больше, чем pH в точке эквивалентности, необходимо контролировать щелочную ошибку титрования, а в перетитрованных растворах — водородную, или Н+-ошибку. [c.207]
По уравнению (10.16) рассчитывается щелочная ошибка титрования. [c.208]
Обычная погрешность титриметрического метода составляет 0,1%. Если принять, что щелочная ошибка равна или меньше [c.209]
Стеклянный электрод функционирует как натриевый электрод, и его потенциал не зависит от pH. Уравнение для щелочной ошибки стеклянного электрода АЕ можно получить, если вычесть уравнение (VI.72) из уравнения (VI.71) [c.137]
Отсюда видно, что щелочная ошибка растет с увеличением аыа+ и pH раствора. [c.137]
Исследования показали, что адсорбция ионов натрия и других щелочных металлов наблюдается при pH = 5—6, т. е. в растворах, в которых щелочные ошибки электрода еще не обнаруживаются. [c.428]
Отсюда следует, что в кислых и щелочных растворах потенциал стеклянного электрода является функцией активности ионов водорода. Каждой области pH отвечает свое значение стандартного потенциала (фст и фст) стеклянного электрода, а наклоны прямых Ф°ст — pH в кислой и щелочной областях одинаковы по величине и обратны по знаку. Зависимость потенциала стеклянного электрода от pH выражается кривой с максимумом и минимумом (рис. 8, а). Положение максимума зависит от сорта стекла и определяется величиной константы обмена. Этим объясняется так называемая щелочная ошибка , т. е. отклонение истинной величины pH в растворах, имеющих рН>12. Наличие минимума на кривой зависимости Е — pf в сильно кислой среде, когда рН<СО, создает так называемую кислую ошибку . Природа кислой ошибки до сих пор детально не выявлена. Н. А. Измайлов и А. М. Александрова высказали предположение, что кислая ошибка объясняется существованием у стеклянных электродов в сильнокислых средах анионной функции. [c.20]
Аналогично можно рассчитать щелочную ошибку. [c.349]
В щелочных средах при pH > 9 значения потенциалов ниже рассчитанных по уравнению Нернста. При дальнейшем увеличении pH ошибка возрастает. Так, при pH 12 для обычных стеклянных электродов она составляет -0,7 ед. pH в присутствии 1 моль/л ионов натрия и -0,3 ед. pH в присутствии 0,1 моль/л последних. Величину щелочной ошибки можно существенно снизить, если использовать стекла другого состава. Чем меньше радиус катиона щелочного металла в стекле, тем меньше конкурирующих катионов (помимо ионов водорода), способных его замещать, и тем выше должна быть их концентрация в растворе, чтобы они могли внедриться в стекло. В настоящее время разработаны литиевые стекла, щелочная ошибка которых в десятки раз меньше, чем у обычных электродов. Электроды из таких стекол можно использовать даже в растворах КОН или НаОН с концентрацией 0,1 моль/л. [c.187]
При использовании фенолфталеина по окончании титрования (рТ 9) в растворе еще имеется неоттитрованное слабое основание, которое вызовет щелочную ошибку титрования [c.86]
Щелочная ошибка титрования — ошибка, вызываемая присутствием в титруемом растворе по окончании титрования нейтральных молекул недотитрованного слабого основания. См. таюке Кислотная ошибка. Индикаторная ошибка. [c.355]
Высокое Непостоянство асимметрического потенциала высокое сопротивление щелочная ошибка Некоторые коллоидные растворы фториды отложения на поверхности электрода [c.229]
Натриевая ошибка стеклянных электродов оказывается связанной с силами взаимодействия атомов кислорода в сетке стекла и щелочными или щелочноземельными ионами в промежутках сетки. Координационное число иона лития, вероятно около четырех, и этот факт может объяснить хорошо известные преимущества лития в уменьшении щелочной ошибки стекол с водородной функцией. Литию требуется для стабильности только четыре кислорода, кроме того, прочно связанные в решетке ионы лития имеют малую тенденцию к обмену на другие, большие по размеру катионы из раствора . [c.263]
Как показывает рис. X. 5, электроды, предназначенные для высоких температур, могут иметь слишком большое сопротивление, не позволяющее применять их при низких температурах. При высоких температурах необходимо иметь в виду, главным образом, устойчивость и щелочную ошибку, при низких же температурах — высокое сопротивление. Некоторые из рН-метров, в которых применяется контур с вибропреобразователем или динамический конденсатор, действуют почти без потребления тока (см. главу XI). Тем не менее, у электродов с очень высоким сопротивлением водородная функция неустойчива и устанавливается медленно. Поэтому такими электродами нельзя пользоваться даже в этих высокочувствительных инструментах. [c.270]
Стабильность, электропроводность и щелочная ошибка стеклянных электродов предположительно связываются с ионными свойствами модифицирующих элементов (например, щелочных и щелочноземельных катионов), находящихся в пустотах решетки стекла. Кроме того, эти свойства связаны с электростатическими [c.273]
Хотя по сравнению с окислами небольших по размеру атомов (кальция, магния, бериллия), окислы бария и стронция более эффективно влияют на уменьшение щелочной ошибки, добавление их в стекло заметно увеличивает электрическое сопротивление . [c.274]
Водородная функция большинства стеклянных электродов нарущается как в кислой, так и в щелочной области. Ошибка электродов (АЕ) из стекла 015 положительна в концентрированных растворах гидроокисей и в щелочных растворах, содержащих большие концентрации щелочных и щелочноземельных катионов. При низких pH ошибка отрицательна. Как в той, так и в другой области ошибка зависит от времени. Положительная величина АЕ означает, что реакция стеклянного электрода на изменение pH дает величины э. д. с. ниже, чем при идеальной водородной функции. Щелочная ошибка электродов из стекла 015 быстро увеличивается, когда температура возрастает выше 30° С, но при 10° С лишь немного меньше, чем при 25° С. [c.279]
Если небольшое количество ионов перешло с поверхности в сильнощелочной раствор, оставив на поверхности стекла отрицательный заряд, то сравнительно немного ионов водорода будет совершать противоположный переход, и ионам щелочного металла придется пересекать границу от раствора (в котором они присутствуют в большой концентрации) к заряженной поверхности стекла. Поэтому электроды обладают смешанной водородной и щелочной функцией. Исходя из этих идей, Дол вывел следующее выражение для щелочной ошибки стеклянного электрода АЕ [c.281]
Хотя разность QNa — Рн имеет физическое значение, она не может быть рассчитана теоретически. Эта величина заметно меняется в зависимости от состояния поверхности стекла и состава раствора. Однако применимость уравнения Дола подтверждается двумя путями. Если записать уравнение (X. 15) в логарифмической форме и преобразовать его, оказывается, что 1п [ехр/ А )—1] должен быть линейной функцией —1п сн, как это и имеет место в действительности. Наклон линии равен 13000— 5 ООО кал/моль для (QNa — Qн) при 25° С. Второй путь проверки уравнения состоит в том, что постоянство разности (С ка — Сн), рассчитанной из наблюдаемых величин АЕ, сохраняется при различных температурах. При высоких значениях pH величина (Ска — Сн) при 50° С незначительно отличается от таковой при 25° С, хотя щелочная ошибка меняется значительно [13]. [c.281]
Применяя радиоактивные индикаторы и электроды, активированные горячими нейтронами в реакторе, Швабе и Даме [94] исследовали на стеклах различных составов кинетику ионного обмена между фазами раствора и стекла в щелочной области. Полученные ими результаты еще раз подтверждают общую концепцию о ионообменном механизме действия стеклянного электрода, которая объясняет не только его водородную функцию, но и щелочную ошибку. Они пришли к заключению, что активность ионов водорода постоянна и равна единице в набухшем слое, где электрод обладает [c.282]
Швабе и Даме вывели следующее уравнение для АрН — щелочной ошибки электрода, выраженной в единицах pH [c.283]
Щелочная ошибка некоторых промышленных стеклянных электродов при 25 и 50° С приведена в табл. X. 5—X. 7. Приводимые поправки следует суммировать с показаниями прибора. Для электродов из стекла 015 щелочная ошибка при температуре ниже комнатной имеет примерно ту же величину, что и при 25° С. Поэтому поправки, данные для 25° С, могут быть применимы в диапазоне температур О—25° С. [c.293]
Состояние электродной поверхности вызывает некоторые изменения в величине щелочной ошибки. Когда ошибка имеет заметную величину, потенциал изменяется во времени. Поэтому приводимые в таблицах поправки следует рассматривать только как прибли- [c.293]
Показания стеклянного электрода не точны в присутствии белков и других органических соединений с большими молекулами, которые адсорбируются на его поверхности. Стеклянный электрод нельзя использовать в сильнощелочной среде, или в кислых растворах, содержащих Р , так как в этих условиях его поверхность разъедается. Для растворов с pH > 10 обычно требуется внесение эмпирических поправок в измеренные значения pH. Так, при pH > 10 в присутствии N3+ с концентрацией 1 г-ион/л отсчитанные значения на ОД—0,2 единицы pH ниже, а при pH = 12 — примерно на единицу pH ниже. Причем эта ошибка ( щелочная ошибка ) зависит не только от значения pH, но и от вида и концентрации присутствующих ионов щелочных металлов.- Она осо- бенно велика для На и меньше для других ионов щелочной группы, особенно для Ь -. В последнее время разработаны новые типы стекла для стеклянных электродов, в состав которых входят литий, цезий, лантан и др., которые обладают очень маленькой щелочной ошибкой и могут использоваться даже при pH = 14 с незначительными поправками для измеренных значений pH. [c.341]
II слабощелочных растворов. При больших pH наблюдаются отклонения от этого уравнения, значения которых зависят от сорта стекла, природы катионов раствора и pH среды. Эти отклонения называются щелочной ошибкой стеклянного электрода. В сильнокислых средах наклон зависимости Лет — pH также не совпадает с предс1йзываемым уравнением ( 1.67). Однако эта кислотная ошибка не зависит от природы анионов и катионов. Потенциал стеклянного электрода не искажается в присутствии каких-либо окислительно-восстановительных систем, в растворах солей тяжелых и благородных металлов, так называемых электродных ядов (сернистых, мышьяковистых и других соединений), органических веществ. Стеклянный электрод можно применять в окрашенных и мутных растворах, в средах, не обладающих буферностью, вблизи точки нейтрализации, причем скорость установления стдостаточно велика. Стеклянные микроэлектроды позволяют определить pH в небольших объемах жидкости и очень удобны для измерения pH в биологических объектах. [c.155]
Сравнивают зависимость Е = f фН) для буферных растворов и растворов NaOH и определяют щелочную ошибку АЕ = — Е аон- [c.201]
Стекла, применяемые для изготовления электродов, должны иметь следующие свойства невысокое сопротивление, малый потенциал асимметрии, небольшую щелочную ошибку. Они не должны также заметно растворяться, иначе pH прголектродного слоя будет отличаться от pH в глубине раствора. Чаще других для изготовления стеклянных электродов использзтот легкоплавкое натриевое стекло, состоящее из 72% Si02, 6% СаО и 22% МагО, или литиевое стекло (72% 02, 6% СаО и 22% ЫгО). При введении в со-188 [c.188]
Щелочная ошибка титрования. Предположив, что для титрования дано слабое основание КЮН, щелочную ошибку титрп-ияния вычисляют аналогично кислотной ошибке [c.114]
Уравнения Дола и Никольского хорошо применимы для описания поведения стеклянного электрода как в области водородной функции, в которой электрод работает без ошибки, так и в той области, где заметно проявляется натриевая функция, т. е. когда Капа много больше, чем н [уравнение (X. 18). В так называемой переходной области, где на поведение электрода влияют ионы и водорода, и натрия, это уравнение мало пригодно. Пытаясь устранить этот дефект, Б. П. Никольский изменил свое первоначальное предположение о том, что все коэффициенты активности в стеклянной фазе равны единице. Приняв, что коэффициент активности иона натрия в стекле равен единице, в то время как для иона водорода он может изменяться, Б. П. Никольский вывел уравнение с двумя эмпирическими параметрами [93]. В противоположность этой точке зрения Лендьел с сотрудниками [101] предположили, что изменение в составе набухшего слоя стекла изменяет коэффициент активности одного только иона натрия, в то время как для водорода он остается постоянным. Они смогли учесть наблюдаемую в переходной области щелочную ошибку с помощью уравнения с тремя соответствующими константами. [c.282]
Кроме ионообменной константы К (для равновесия, определяемого уравнением (X. 17)) это уравнение содержит константу п, которая обозначает отношение активностей ионов водорода и натрия в фазе стекла. Константа п может быть получена из одного только измерения АрН в переходной области. Уравнение (X. 19) прекрасно отражает щелочную ошибку для четырех стекол, включая стекло 015 и титановое стекло Швабе, вплоть до таких высоких значений как АрН 4. Для стекла 015 lg/(=—11,6, а л = 2,6. Теория Олаха [102] также объясняет отклонения от водородной функции в шелочных средах на основе ионообменной теории (см. также [97]). В уравнении Олаха эти отклонения выражены через константу диссоциации кремневой кислоты и силиката натрия в набухшем слое стекла . [c.283]
В концентрированных водных растворах солей и сильных кислот при значениях pH, меньших единицы, и в полностью неводных растворах водородная функция стеклянного электрода имеет ошибку, противоположную по знаку той, которая проявляется в щелочных растворах [12]. В результате этой так называемой отрицательной ошибки величина измеренного в указанном диапазоне pH несколько выше истинной. В отличие от щелочной ошибки, в кислых растворах ошибка мало меняется с температурой. Размеры отрицательной ошибки в растворах сильных кислот, полученные Гольдма-ном и Хаббердом [41], приведены в табл. Х.2. Ошибки даны в милливольтах (АЕ) и в единицах pH (АрН). Поскольку ошибки в кислых растворах зависят от времени, эти значения носят приближенный характер. Увеличение кислой ошибки сопровождается некоторым уменьшением толщины набухшего слоя в поверхности стеклянной мембраны [38] . [c.283]
Одни добавки к стеклу уменьшают щелочную ошибку, другие вызывают ее проявление при низких значениях pH. Гардинер и Сандерс [84] установили, что потенциал электрода из стекла 015 не зависит от pH и представляет собой линейную функцию логарифма концентрации ионов водорода при 50°С в растворах с pH выше, 11 и с высокой концентрацией солей натрия. Было установлено, что определенные стекла, в состав которых входят, по крайней мере, 3% окиси магния или бериллия, имеют настолько хорошую натриевую функцию, что их можно применять для определения концентрации ионов натрия в шелочных растворах [19, 55] Стекла, содержащие окись алюминия или бора, также проявляют функцию металлических ионов [115] . Согласно данным Флатера [120], [c.285]
Относительно щелочной ошибки в неводных средах имеется весьма скудная информация. Однако Харлоу [147] наблюдал нарушения в кривых титрования, снятых со стеклянным электродом в пиридине. Объясняется это тем, что титрант был запачкан следами калия. Ошибка зависит от состава стекла. Щелочная ошибка в уксусной кислоте изучена Вегманом, Эскарфайлом и Симоном [140] . [c.287]
Основы аналитической химии Часть 2 (1965) — [
c.111
,
c.114
]
Основы аналитической химии Книга 2 (1961) — [
c.137
,
c.141
]
Аналитическая химия Часть 1 (1989) — [
c.208
]
Основы аналитической химии Издание 3 (1971) — [
c.154
,
c.156
]
Основы аналитической химии Кн 2 (1965) — [
c.111
,
c.114
]
В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
=
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
(4.2)
где
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
– объем аликвоты титруемого раствора,
мл;
–
концентрация и
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
=
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Щелочная ошибка
Cтраница 1
Щелочная ошибка некоторых промышленных стеклянных электродов при 25 и 50 С приведена в табл. X. Приводимые поправки следует суммировать с показаниями прибора. Для электродов из стекла 015 щелочная ошибка при температуре ниже комнатной имеет примерно ту же величину, что и при 25 С. Поэтому поправки, данные для 25 С, могут быть применимы в диапазоне температур 0 — 25 С.
[1]
Щелочная ошибка титрования вычисляется так же, как и кислотная.
[2]
Небольшие щелочные ошибки электродов, изготовленных из литиевых стекол, вероятно, объясняются замедлением процесса обмена между ионами щелочных металлов раствора и ионами водорода в стекле.
[4]
Относительно щелочной ошибки в неводных средах имеется весьма скудная информация.
[5]
Наличие щелочной ошибки можно удовлетворительно объяснить, предположив существование обменного равновесия между ионами водорода на поверхности стекла и катионами из раствора.
[7]
Аналогично можно рассчитать щелочную ошибку.
[8]
Отсюда видно, что щелочная ошибка растет с увеличением аца и рН раствора.
[9]
Отсюда видно, что щелочная ошибка растет с увеличением aNa и рН раствора.
[10]
По уравнению (10.16) рассчитывается щелочная ошибка титрования.
[11]
Это обусловливает так называемую кислотную или щелочную ошибку индикатора, которая может себя сильно проявить в отношении растворов малой концентрации и с малым буферным действием.
[12]
Состояние электродной поверхности вызывает некоторые изменения в величине щелочной ошибки. Когда ошибка имеет заметную величину, потенциал изменяется во времени.
[13]
Это обусловливает так называемую кис — лотную или щелочную ошибку индикатора, которая может быть существенной в отношении растворов малой концентрации и с малым буферным действием.
[14]
При высоких температурах необходимо иметь в виду, главным образом, устойчивость и щелочную ошибку, при низких же температурах — высокое сопротивление. Тем не менее, у электродов с очень высоким сопротивлением водородная функция неустойчива и устанавливается медленно.
[15]
Страницы:
1
2
3
4



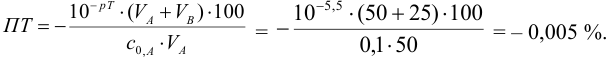
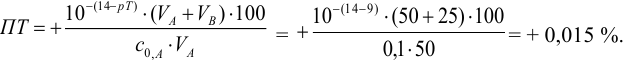
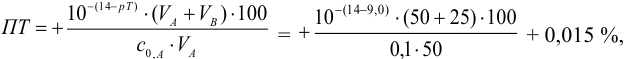
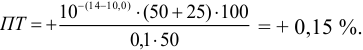
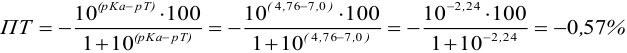
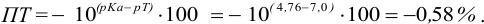
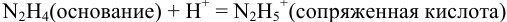
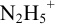
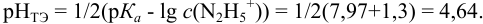
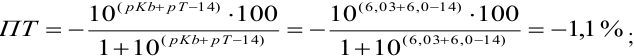
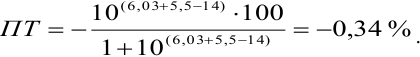

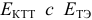 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.