Review
. 2019 Aug 27;19(7):e7687.
doi: 10.5867/medwave.2019.07.7687.
[Article in
Spanish,
English]
Affiliations
-
PMID:
31584929
-
DOI:
10.5867/medwave.2019.07.7687
Review
General concepts in biostatistics and clinical epidemiology: Random error and systematic error
[Article in
Spanish,
English]
Felipe Barraza et al.
Medwave.
2019.
Abstract
in
English,
Spanish
Biomedical research, particularly when it involves human beings, is always subjected to sources of error that must be recognized. Systematic error or bias is associated with problems in the methodological design or during the execu-tion phase of a research project. It affects its validity and is qualitatively ap-praised. On the other hand, random error is related to variations due to chance. It may be quantitatively expressed, but never removed. This review is the first of a methodological series on general concepts in biostatistics and clin-ical epidemiology developed by the Chair of Scientific Research Methodology at the School of Medicine, University of Valparaíso, Chile. In this article, we address the theoretical concepts of error, its evaluation, and control. Finally, we discuss some current controversies in its conceptualization that are relevant to undergraduate and graduate students of health sciences.
La investigación biomédica, particularmente la que involucra a seres humanos, está siempre sometida a fuentes de error que deben ser reconocidas. El error sistemático o sesgo, se asocia con debilidades en el diseño metodológico o de la fase de ejecución del estudio. Éste afecta su validez y se valora cualitativamente. Por su parte, el error aleatorio se relaciona con las variaciones producidas por el azar, el cual puede expresarse cuantitativamente, pero nunca eliminarse. Esta revisión es la primera entrega de una serie metodológica sobre conceptos generales en bioestadística y epidemiología clínica desarrollada por la Cátedra de Metodología de la Investigación Científica de la Universidad de Valparaíso, Chile. En este artículo se abordan los conceptos teóricos asociados al error, su evaluación y control. Finalmente, se discuten algunas controversias actuales en cuanto a su conceptualización, de relevancia para estudiantes de pre y posgrado de ciencias de la salud.
Keywords:
biostatistics; confidence interval; epidemiology; probability; bias.
Similar articles
-
General concepts in biostatistics and clinical epidemiology: Observational studies with cross-sectional and ecological designs.
Cataldo R, Arancibia M, Stojanova J, Papuzinski C.
Cataldo R, et al.
Medwave. 2019 Sep 25;19(8):e7698. doi: 10.5867/medwave.2019.08.7698.
Medwave. 2019.PMID: 31596838
Review.
English, Spanish. -
General concepts in biostatistics and clinical epidemiology: observational studies with case-control design.
Martínez D, Papuzinski C, Stojanova J, Arancibia M.
Martínez D, et al.
Medwave. 2019 Nov 7;19(10):e7716. doi: 10.5867/medwave.2019.10.7716.
Medwave. 2019.PMID: 31821315
Review.
English, Spanish. -
General concepts in biostatistics and clinical epidemiology: observational studies with cohort design.
Lazcano G, Papuzinski C, Madrid E, Arancibia M.
Lazcano G, et al.
Medwave. 2019 Dec 16;19(11):e7748. doi: 10.5867/medwave.2019.11.7748.
Medwave. 2019.PMID: 31999676
English, Spanish.
-
General concepts in biostatistics and clinical epidemiology: Experimental studies with randomized clinical trial design.
Estrada S, Arancibia M, Stojanova J, Papuzinski C.
Estrada S, et al.
Medwave. 2020 Apr 8;20(3):e7869. doi: 10.5867/medwave.2020.02.7869.
Medwave. 2020.PMID: 32469850
Review.
English, Spanish. -
Gender, women and scientific research.
Vargas C, Lutz M, Papuzinski C, Arancibia M.
Vargas C, et al.
Medwave. 2020 Mar 31;20(2):e7857. doi: 10.5867/medwave.2020.02.7857.
Medwave. 2020.PMID: 32243428
Review.
English, Spanish.
Cited by
-
Centre for Statistical and Methodological Excellence (CESAME): A Consortium Initiative for Improving Methodology in Randomised Clinical Trials.
Jørgensen CK, Olsen MH, Nielsen N, Lange T, Mbuagbaw L, Thabane L, Billot L, Binder N, Garattini S, Banzi R, Demotes J, Biagioli E, Rulli E, Bertolini G, Nattino G, Mathiesen O, Torri V, Gluud C, Jakobsen JC.
Jørgensen CK, et al.
Health Serv Insights. 2023 Apr 11;16:11786329231166519. doi: 10.1177/11786329231166519. eCollection 2023.
Health Serv Insights. 2023.PMID: 37077323
Free PMC article.
Publication types
MeSH terms
Билет
2
1.
Биостатистика
— научная отрасль, связанная с разработкой
и использованием статистических методов
в научных исследованиях в медицине,
здравоохранении и эпидемиологии.
Биостатистика,
используя статистическую информацию
и статистические методы, изучает вопросы
здравоохранения и социальные проблемы,
разрабатывает специальные рекомендации.
Биостатистика,
как и статистика в целом, подразделяется
на два раздела:
• Описательную
биостатистику
• Аналитическую
биостатистику
Целью описательной
биостатистики является сбор и
систематизация данных (в том числе
получение обобщенных показателей) о
предмете исследования.Аналитическая
биостатистика ставит перед собой
задачу получения статистических выводов
на основе собранной и систематизированной
информации об объекте исследования
2.
Статистическая
совокупность
– совокупность объектов или явлений
одного вида, объединенных по определенному
признаку.
Генеральная
совокупность
– состоит из всех единиц наблюдения,
кот. Могут быть к ней отнесены в соотв.
С целью использования.
Выборочная
сов.-
часть генеральной сов., полученная путем
отбора, по свойствам кот. Судят или
должны будут судить о генер. Сов-сти.
Репрезентати́вность —
соответствие
характеристик выборки характеристикам популяции или генеральной
совокупности в
целом. Репрезентативность определяет,
насколько возможно обобщать результаты
исследования с привлечением определённой
выборки на всю генеральную совокупность,
из которой она была собрана.
Также,
репрезентативность можно определить
как свойство выборочной совокупности
представлять параметры генеральной
совокупности, значимые с точки зрения
задач исследования.
N=30 000
Родилось
2100
Аборты
1050


1d2b3e4c5e
Билет
3
1.Кокрановское
сотрудничество — было основано в 1979 г.
А. Кокрейном . он обосновал необходимость
использовать в медицине только те
данные, которые были получены в ходе
правильно организованных и проверенных
научных исследованиях. Целью данной
международной организации явилось
поиск и обобщение достоверной информации
о результатах медицинских вмешательств.
Основные
задачи : создание, обновление и
распределение системных обзоров,
результатов медицинских вмешательств,
которые должны облегчить заинтересованным
лицам принятие решения в различных
областях медицины.
Системный
обзор — научное исследование с заранее
спланированными методами, когда объектом
изучения являются не сами пациенты, а
результаты ряда исследований.
Ответ
№ 2.
Относительные
величины
используются для характеристики
закономерностей распределения признаков
в статистической совокупности, а также
для сравнения нескольких совокупностей.
Различают
такие относительные величины:
1)
интенсивные
2)
экстенсивные
3)
соотношения;
4)
наглядности;
5)
относительной интенсивности.
Интенсивные
коэффициенты
характеризуют частоту, уровень,
распространение явления в среде, в
котором оно происходит, с которым
непосредственно связано и как бы
порождается этим окружением
Показатели
интенсивности:
-
Общие
— характеризуют явление в целом
относительно всей среды (общие уровни
смертности, рождаемости, заболеваемости,
инвалидности и т.п.); -
Специальные
— по отдельным группам (возраст, пол,
стаж работы и т.п.).
Показатели
интенсивности показывают, как часто
данное явление случается в той среде,
в которой оно может происходить.
Показатели
экстенсивности показывают, насколько
одно явление больше другого.
Показатели
экстенсивности
отображают удельный вес, структуру,
распределение, состав явления. Их
определяют в том случае, когда необходимо
проанализировать распределение
абсолютного числа явления на его
составные части. Они показывают, какую
часть, удельный вес, процент каждая
часть составляет во всем явлении.
Экстенсивный
показатель можно определить при наличии
общих размеров совокупности и ее
составляющих частей.
Экстенсивный
показатель =
Экстенсивный
показатель определяется в процентах.
Показатели
соотношения
характеризуют численное соотношение
двух не связанных непосредственно между
собой самостоятельных, разнородных
явлений, совокупности или величин
(обеспеченность населения койками,
врачами, число лабораторных исследований
на 100 поликлинических посещений и т.п.).
Пример
расчета коэффициента соотношения:
Обеспеченность
населения врачебными койками =
Показатели
соотношения можно сравнивать между
собой в динамике и в пространстве.
Показатель
наглядности
иногда называют показателем сравнения,
поскольку он отображает изменения,
которые происходят с тем или другим
явлением во времени, показывает их
расхождение на отдельных территориях
или в разных группах населения. Он
показывает, во сколько раз или на
сколько
процентов изменилось явление в динамике,
отличается ли по регионам, не обнаруживая
при этом размер последнего.
Коэффициент
относительной интенсивности
используется как вспомогательный прием
в тех случаях, когда не удаётся получить
прямые интенсивные коэффициенты.
Коэффициент относительной интенсивности
— это числовое соотношение двух структур.
Он используется при изучении структурных
особенностей разных статистических
совокупностей, которые имеют отношение
к одной среде, то есть являются численным
соотношением двух структур. Использовать
их надо в случаях, когда нет возможности
определить прямые
интенсивные коэффициенты
|
Длина |
Ранг |
Масса |
Ранг |
Разница |
Х2 |
|
87 |
1 |
13 |
1 |
0 |
0 |
|
95 |
7,5 |
14 |
3 |
4,5 |
20,25 |
|
115 |
12 |
20 |
10 |
2 |
4 |
|
89 |
3 |
22 |
12 |
9 |
81 |
|
90 |
4,5 |
14 |
3 |
1,5 |
2,25 |
|
90 |
4,5 |
15 |
5,5 |
1 |
1 |
|
101 |
9 |
17 |
8 |
1 |
1 |
|
95 |
7,5 |
15 |
5,5 |
2 |
4 |
|
110 |
10,5 |
18 |
9 |
1,5 |
2,25 |
|
110 |
10,5 |
21 |
11 |
0,5 |
0,25 |
|
88 |
2 |
14 |
3 |
1 |
1 |
|
93 |
6 |
16 |
7 |
1 |
1 |
|
N=12 |
∑=118 |
р=1-6*118/12*143=
1-708/1716= 0,6 Заключение: 0,6 – связь средней
силы, прямая
Билет
4
Клиническая
эпидемиология
– наука, изучающая закономерности
распространения заболеваний, осуществляет
прогнозирование их у каждого конкретного
пациента на основании изучения
клинического течения болезни в аналогичных
случаях. Для этого она использует
соответствующие научные методы изучения
групп больных, обеспечивая точность
прогнозов.
Клиническая
эпидемиология осуществляет методологическое
обеспечение клинических исследований,
их объективную оценку, является
методологической основой доказательной
медицины.
В
практическом плане клиническая
эпидемиология обеспечивает
доказательную медицину необходимыми
методами биостатистики, объективными
критериями достоверности и способами
обобщения результатов клинических
исследований.
Доказательная
медицина
Клиническая
эпидемиология:
Биостатистика:
определяет,
ЧТО изучать и определяет
КАК изучать и
формулирует
гипотезы на основе планировать
исследование
Цели
эпидемиологии:
-
ликвидация
или сокращение проблем, связанных со
здоровьем и их последствий; -
предотвращение
проблем, связанных со здоровьем, их
возникновение и повторение.
Задачи
эпидемиологии
-
изучение
распространения и естественного течения
определенных заболеваний по группам
населения; -
определение
факторов внешней среды, которые
способствуют либо препятствуют
возникновению заболеваний; -
определение
приобретенных проблем в здравоохранении; -
разработка
профилактических мероприятий.
По
характеру вмешательств исследования
делятся на эмпирические, или обсервационные
и экспериментальные
Эмпирические
исследования — это исследование без
преднамеренного вмешательства 8
естественное течение и развитие
заболевания. Исследователь наблюдает
и фиксирует необходимую информацию в
соответствии с программой исследования.
Эмпирические исследования, в свою
очередь, могут быть описательными и
аналитическими.
Описательная
эпидемиология занимается изучением
частоты и распространенности заболеваний
(их следствий), на определенной территории
(страна, область, район, город, село), в
определенное время (месяц, год,
5 лет
и т.д.), в разных группах населения
(дифференцированно по полу, возрасту,
национальностью, социально-экономическому
по состоянию, образованию, профессии,
и т.п.);
-
течения
заболеваний; -
эффективности
диагностических критериев; -
распространенности
потенциально опасных факторов
Аналитические
методы могут быть когортными, исследованиями
типа «случай-контроль» и экологическими.
В
эксперименте исследователь целенаправленно
и сознательно контролирует основные
параметры, которые являются предметом
изучения (например, факторы риска, новые
методы лечения, профилактики), а также
распределяет объекты исследования
(больных и здоровых лиц) за определенными
группами. Экспериментальные исследования
разделяются на полевые (профилактические)
и клинические, неконтролируемые и
контролируемые, рандомизированные и
нерандомизованные.
По
продолжительности наблюдения за
состоянием здоровья исследуемого
контингента эпидемиологические
исследования могут быть одномоментные
и продолжительными Термин «когорта»
означает группу лиц, объединенных
определенной общим признаком, за которыми
наблюдают в течение определенного
периода времени, чтобы проследить, что
с ними произойдет в дальнейшем.При
проведении исследования в когорту
включаются лица, не имеющие изучаемого
заболевания, но оно может проявиться в
дальнейшем (например, в исследовании
факторов риска развития рака эндометрия
все включенные в когорту женщины не
должны иметь заболеваний матки). Группа
лиц, которая включена в когорту, может
быть разделена на две (экспонированы,
т.е. те, которые подпадают под влияние
фактора риска, и неэкспонированы) или
несколько категорий (например, нет
влияния, незначительное влияние,
значительное влияние). Затем эту когорту
наблюдают в течение определенного
времени, чтобы установить, у кого из ее
участников возникает исследуемый
результат. В период наблюдения за
когортой регулярно измеряются все
факторы, которые, как считается, могут
повлиять на появление или развитие
заболевания, и регистрируются все новые
случаи заболеваний.
2.Относительные
величины
используются для характеристики
закономерностей распределения признаков
в статистической совокупности, а также
для сравнения нескольких совокупностей.
Различают
такие относительные величины:
1)
интенсивные
2)
экстенсивные
3)
соотношения;
4)
наглядности;
5)
относительной интенсивности.
Интенсивные
коэффициенты
характеризуют частоту, уровень,
распространение явления в среде, в
котором оно происходит, с которым
непосредственно связано и как бы
порождается этим окружением.Показатели
интенсивности:
-
Общие
— характеризуют явление в целом
относительно всей среды (общие уровни
смертности, рождаемости, заболеваемости,
инвалидности и т.п.); -
Специальные
— по отдельным группам (возраст, пол,
стаж работы и т.п.).
Формула
расчета общего
интенсивного показателя:
Общий
уровень(коэффициент)заболеваемости
=
Формула
расчета специального
интенсивного показателя
Показатели
интенсивности показывают, как часто
данное явление случается в той среде,
в которой оно может происходить.
Показатели
экстенсивности показывают, насколько
одно явление больше другого.
Показатели
экстенсивности
отображают удельный вес, структуру,
распределение, состав явления. Их
определяют в том случае, когда необходимо
проанализировать распределение
абсолютного числа явления на его
составные части. Они показывают, какую
часть, удельный вес, процент каждая
часть составляет во всем явлении.
Экстенсивный
показатель можно определить при наличии
общих размеров совокупности и ее
составляющих частей.
Экстенсивный
показатель определяется в процентах.
Показатели
соотношения
характеризуют численное соотношение
двух не связанных непосредственно между
собой самостоятельных, разнородных
явлений, совокупности или величин
(обеспеченность населения койками,
врачами, число лабораторных исследований
на 100 поликлинических посещений и т.п.).
Пример
расчета коэффициента соотношения:
Обеспеченность
населения врачебными койками =
Показатели
соотношения можно сравнивать между
собой в динамике и в пространстве.
Показатель
наглядности
иногда называют показателем сравнения,
поскольку он отображает изменения,
которые происходят с тем или другим
явлением во времени, показывает их
расхождение на отдельных территориях
или в разных группах населения. Он
показывает, во сколько раз или на
сколько
процентов изменилось явление в динамике,
отличается ли по регионам, не обнаруживая
при этом размер последнего.
Коэффициент
относительной интенсивности
используется как вспомогательный прием
в тех случаях, когда не удаётся получить
прямые интенсивные коэффициенты.
Коэффициент относительной интенсивности
— это числовое соотношение двух структур.
Он используется при изучении структурных
особенностей разных статистических
совокупностей, которые имеют отношение
к одной среде, то есть являются численным
соотношением двух структур. Использовать
их надо в случаях, когда нет возможности
определить прямые интенсивные
коэффициенты.
|
X |
Y |
Ранг |
Ранг |
Разница |
Квадрат |
|
50 |
21 |
6 |
1 |
5 |
25 |
|
42 |
38 |
5 |
2 |
3 |
9 |
|
38 |
43 |
4 |
3 |
1 |
1 |
|
24 |
52 |
2,5 |
4 |
-1,5 |
2,25 |
|
24 |
50 |
2,5 |
5 |
-2,5 |
6,25 |
|
10 |
60 |
1 |
6 |
-5 |
25 |
|
68,5 |
р=1-
6*68,5/6*35= 1-1,96= -0,96 Заключение: -0,96 – непрямая
сильная корреляционная взаимосвязь
BCADD
Билет
5
I.
Эпидемиология-
изучение распространенности и
детерминированных состояний или событий,
связан, со здоровьем,в специально
определенных популяцияхдля управления
и контроля за проблемами здоровья.
Различают эпидемиологию инфекц. и
неинфекц. заболеваний.
Отличается:
-
Латентный
период неинф. заболеваний значительно
более продолжительнее, чем инфекциооных,
и конкретный срок его непредсказуем. -
Хронические
заболевания развиваются постепенно и
его признаки у обследуемых лиц варьируют
в большем диапазоне. -
Для
неинф. заболеваний характерна
мультифакториальная природа, этиология
и патогенезы, причем доминируемый
фактор часто отсутствует. -
невозможно
четко определить восприимчивую часть
и установить абсолют. -
Прогнозы
заболеваемости, эффективности
профилактических мероприятий носят
вероятностный характер и оправдывается
по отношению к популяции в целом.
II.
Табличная сводка статистического
материала часто нуждается в наглядном
изображении в виде графиков. График, в
отличие от таблицы, более наглядно
показывает общую картину распределения
или тенденцию развития явления. При его
использовании прослеживаются более
выразительные взаимосвязи между
показателями.
Каждый
график, чтобы отвечать основным условиям
использования, должен иметь такие
элементы: графический образ; поле;
пространственные
и масштабные ориентиры;
масштабную
шкалу;
експликацию.
Графики
используются с целью облегчения
восприятия материала, его статистического
анализа, сравнения полученных данных.
Они помогают лучше понять численные
соотношения признаков, закономерности
и взаимосвязь отдельных явлений, сделать
выводы наглядными. Графические изображения
способствуют также популяризации и
распространению статистических данных.
Только
правильно построенный график поможет
проиллюстрировать обнаруженную
закономерность или тенденцию.
Графический
образ — это
геометрические знаки, линии, фигуры, с
помощью которых изображаются статистические
данные. Он должен отвечать цели и быть
как можно более выразительным.
Поле
графика —
это место размещения графических
образов.
Пространственные
ориентиры
— это системы координатных сеток. Часто
используют систему прямоугольных
координат, кроме того, есть криволинейные
шкалы. Они целесообразны в секторных
диаграммах.
Масштабом
графика
называется определенная мера перевода
количественной величины в графическую.
Масштабные
ориентиры
определяются системой масштабных шкал,
которые бывают равномерными и
неравномерными. При равномерных
масштабных шкалах отрезки пропорциональны
числам. Если, например, число удваивается,
то отрезок между числами тоже должен
быть в два раза большим.
N=
100 000
родилось
820
умерло
1270


Депопуляция
Ксм >Кр
ADBCA
Билет
6
I.
Клиническая эпидемиология- новое
направление в науке, которое с помощью
проверенных методов эпидемиологических
исследований, биостатистики и анализа
решений позволяют получить научно
обоснованную характеристику полезности
и экономической целесообразности
терапевтической и диагностической
методик.
Цель:
Разработка
и применение методов клинического
наблюдения, которые дают возможность
делать обоснованные заключения, избегая
влияния систематических и случайных
ошибок.
Принципы:
Все
клинические испытания изучаются на
людях, а не на животных или элементах
человеческого организма (культура
тканей, клеточные мембраны, хим. медиаторы,
генетические последовательности н.к.).
Основными
критериями оценки эф-ти вмешательств
явл. клинически значимые исходы
(смертность, заболеваемость, инвалидность).
Предметом
рассмотрения являются те наблюдения,
которые можно представить количественно.
Клинический опыт и интуиция- необходимость
составляющ.врачебного искусства.
Эти
вероятности для конкретного для
конкретного больного лучше всего
анализировать на основе предыдущего
опыта, накопленного в группах аналогичных
больных.
Любые
наблюдения, в том числе клинические
исследования сопровождается ошибками
(систематическими и случайными).
II.
Средние величины дают обобщенную
количественную характеристику
определенного признака в статистической
совокупности при определенных условиях
места и времени.
В
практике здравоохранения средние
величины используются достаточно
широко:
-
для
характеристики организации работы
учреждений охраны здоровья (средняя
занятость койки, средний срок пребывания
в стационаре и др.); -
для
характеристики показателей физического
развития (длина, масса тела, окружность
головы новорожденных, но др.); -
для
анализа клинико-физиологических
показателей (частота пульса, дыхания,
уровень артериального давления и др.); -
для
оценивания данных медико-социальных
и санитарно-гигиенических исследований
(среднее число лабораторных исследований,
средние нормы питательного рациона,
средний уровень радиационного
загрязнения, но др.).
По
форме расчета можно выделить:
а) среднюю
арифметическую величину;
б) среднюю
гармоничную величину;
в) среднюю
геометрическую величину;
г) среднюю
квадратичную, кубическую, и другие
величины.
-
За
охватьшанием совокупности выделяются:
а) групповая
средняя величина;
б) общая
средняя величина.
Рассмотрим
подробнее отдельные виды средних
величин.
Средняя
арифметическая простая определяется
как сумма вариант вариационного ряда,
разделенная на их число. При этом
вариационный
ряд — это
совокупность числовых значений признаков
(вариант), которые могут быть не
систематизированы за своим абсолютным
значением (неранговый ряд), систематизированные
в порядке роста или уменьшения — (ранговый
ряд).
Отдельные
элементы (значение) совокупности
однородных за качественным составом
предметов, явлений, параметров являются
вариантами, а всю их совокупность можно
представить в виде вариационного ряда,
который является основой для определения
средних величин. Вариационный ряд — это
ряд вариант и соответствующих им частот.
Вариационный
ряд может быть простым, где каждая
варианта представлена отдельно, потому
частота каждой из них равняется единице.
Например, распределение больных по
частоте пульса:
68,
69, 75, 70,65, 68, 70, 75, 74, 72, 72, 68. Данный ряд также
неранговый,
потому что варианты не систематизированы.
Систематизировав варианты в порядке
увеличения или уменьшения их числового
значения, данный ряд можно превратить
в ранговый:
65,
68, 68, 68,69, 70, 70, 72,72, 74, 75, 75.
Приведенный
сгруппированный ряд является неинтервальным
, потому что группирование проведено
за абсолютным значением каждой варианты.
Вариационные
ряды, где значение вариант представлен
в виде интервалов, называются интервальными.
В виде интервального ряда часто
представляют признаки со значительным
количеством вариант. При этом значение
каждой варианты поданы в виде интервала
(см. ниже).
Сгруппированный
интервальный вариационный ряд можно
получить путем объединения вариант в
группы. При этом необходимо помнить,
что:
а)размер вариационных
групп должен зависеть от природы явления;
б) имеет
смысл определять одинаковые интервалы;
в) границы
вариационных групп не должны повторяться.
Все
вариационные ряды за качественной
характеристикой распределяются на
дискретные, в которых варианты могут
быть представлены только целыми числами
или полученные в результате подсчетов
(распределение за частотою
пульсу,
числом кроватных дней, посещений) и
инкретные (непрерывные), где варианты
могут быть представлены как целыми, так
и дробными, числами, или является
результатом измерений (приведена
таблица). Клинические параметры являются
по большей части примером инкретных
вариант.
Для
решения вопроса о числе групп необходимо
подать статистическую совокупность в
виде рангового ряда, то есть разместить
ее единицы в определенном порядке. При
численности совокупности менее 100 единиц
не целесообразно планировать больше
10 групп.
Этапы
составления интервального вариационного
ряда:
-
определение
амплитуды ряда; -
определение
числа групп; -
определение
величины интервала.
Средняя
гармоничная определяется
в тех случаях, когда известны данные
числителя при отсутствии данных о
знаменателе. Например, необходимо
определить среднее время, тратящее на
прием одного больного, когда известно,
что 5 врачей вели прием в
течение 8
часов. Каждый из них тратил в среднем
на прием одного больного, соответственно
20; 16; 20; 15; 24 минуты. Средняя арифметическая
(М=17,75) в
данном
случае не даст точную оценку результату,
поскольку каждый из врачей принял
различное ‘ количество пациентов.
Среднюю
гармоничную целесообразно использовать
также при оценивании выживания больных,
средней длительности жизни, некоторых
экономических показателей.
Средняя
геометрическая определяется
для тех параметров, изменения значений
которых проходят в геометрической
прогрессии (изменение численности
населения в период между переписями,
результаты титрования вакцин, прирост
массы тела новорожденных в течение
отдельных месяцев жизни, но др.).
К
средним величинам, которые имеют
относительный характер относятся
медиана и мода.
BDEAB
Билет
7
1.
Рандомизированные исследования
отличаются от других видов исследований
формированием основной и контрольной
групп методом рандомизации — случайным
способом отбора исследуемых в группы,
что позволяет исключить все возможны
расховдения между сравниваемыми
группами, потенциально способные
повлиять на результат исследования.
Для рандомизации обычно используются
специальные компьютерные программы,
построенные на алгоритме генерации
случайных чисел.
Наряду
с рандомизацией при формировании
основной и контрольной групп применяют
метод стратификации. Стратификация
обеспечивает пропорциональное
распределение исследуемых по группам
с учетом факторов, которые существенно
влияют на результаты исследования.
‘іогда
как рандомизация призвана нивелировать
влияние на результаты эксперимента
всех возможных факторов, оставляя лишь
возможность случайных расхождений
между группами исследования, стратификация
позволяет полностью устранить влияние
ограниченного числа факторов. Стратификацию
применяют также для повышения
репрезентативности выборки, «подгоняя»
ее состав в соответствии с популяцией
в целом.
2.
Средние величины дают обобщенную
количественную характеристику
определенного признака в статистической
совокупности при определенных условиях
места и времени.
В
практике здравоохранения средние
величины используются достаточно
широко:
-
для
характеристики организации работы
учреждений охраны
здоровья (средняя занятость койки,
средний срок пребывания в стационаре
и др.); -
для
характеристики показателей физического
развития (длина, масса тела, окружность
головы новорожденных, но др.);
-
для
анализа клинико-физиологических
показателей (частота пульса, дыхания,
уровень артериального давления и др.); -
для
оценивания данных медико-социальных
и санитарно-гигиенических исследований
(среднее число лабораторных исследований,
средние нормы питательного рациона,
средний уровень радиационного
загрязнения, но др.).
Свойством
средней величины является ее обобщённая
характеристика. Средняя величина
рассчитывается путем сопоставления
абсолютных или относительных величин.
При этом качественно
однородная совокупность
и достаточное число наблюдений является
основными требованиями для расчета
средних величин
Средняя
величина имеет двойственный характер:
с одной стороны она характеризует
совокупность в целом, а из второго —-
она является основой для оценки отдельных
единиц совокупности, их разнообразия
и изменчивости
N=200
n=31
p=31/200=15,5%
DCABC
Билет
8
.1.Когорта
-означает
группу лиц ,объеден определенной общим
признаком, за
которым наблюдают
в
течение
определенного периода времени ,чтобы
проследить, что
с
ними произойдет
в дальнейшем.При
проведении
исследования в когорту включают лица,не
имеющих,изучаемого заболевания,но оно
можнт проявиться в дальнейшем(Например:в
исследовании факторов риска
развития
рака эндометрия все включающиеся в
когорту не должны иметь заболевания
матки)
2..
По форме расчета можно выделить:
а) среднюю
арифметическую величину;
б) среднюю
гармоничную величину;
в) среднюю
геометрическую величину;
г) среднюю
квадратичную, кубическую, и другие
величины.
2.
За схватыванием совокупности выделяются:
а) фупповая
средняя величина;
б) общая
средняя величина.
Средняя
арифметическая является
самым распространенным видом средних
величин. Она отображается как X. Однако,
часто средняя арифметическая отражается
буквой М (лат.
Медіа). За
характером данных она может быть простою
или взвешенной.
Средняя
арифметическая простая определяется
как сумма вариант вариационного ряда,
разделенная на их число. При этом
вариационный
ряд
— это совокупность числовых значений
признаков (вариант), которые могут быть
не систематизированы за своим абсолютным
N=30 500
n=250
p=250/30
500*10 000= 81,97 продецимилле
BDAAA
Билет
9
Эпидемиология
—
это изучение распространенности и
детерминант состояний или событий,
связанных со здоровьем, в специально
определенных популяциях для управления
и контроля за проблемами здоровья.
Изучение включает обследование,
наблюдение, тестирование гипотез,
аналитические исследования и эксперименты.
Распространение имеет на внимании
анализ во времени, по месту, по группам
людей, которые были выделены по
индивидуальным признакам и испытали
влияние, которое изучается. Детерминанты
это
физические, биологические, социальные,
культурные и поведенческие факторы,
которые влияют на здоровье. Связанные
со здоровьем состояния и события включают
заболевание, случаи смерти, факторы
поведения (например, курение), реакции
на превентивные меры, организацию и
использование услуг здравоохранения.
Специально определенная популяция
группа по точно определенным признакам
и числу людей. Управление и контроль
является конечной целью эпидемиологического
подхода в здравоохранении укрепить,
защитить и восстановить здоровье.
Цели
эпидемиологии:
-
ликвидация
или сокращение проблем, связанных со
здоровьем и их последствий; -
предотвращение
проблем, связанных со здоровьем, их
возникновение и повторение.
Эпидемиологические
методы исследования . Типы эпидемиологических
исследований по характеру вмешательств,
задачами, которые решаются и организацией
исследований
Эмпирические
Описательные^»”—^ «^Аналитические
^
Описание
Описание Когортные Экологические
Случайный контроль
случаев
серии случаев
В
зависимости от цели эпидемиологические
исследования разделяются на поисковые,
которые выдвигают гипотезу и на те, что
проверяют гипотезу.
По
характеру вмешательств исследования
делятся на эмпирические, или обсервационные
и экспериментальные
Эмпирические
исследования — это исследование без
преднамеренного вмешательства в
естественное течение и развитие
заболевания. Исследователь наблюдает
и фиксирует необходимую информацию в
соответствии с программой исследования.
Эмпирические исследования, в свою
очередь, могут быть описательными и
аналитическими. Аналитические методы
могут быть когортными, исследованиями
типа «случай-контроль» и экологическими.
В
эксперименте исследователь целенаправленно
и сознательно контролирует основные
параметры, которые являются предметом
изучения (например, факторы риска, новые
методы лечения, профилактики), а также
распределяет объекты исследования
(больных и здоровых лиц) за определенными
группами. Экспериментальные исследования
разделяются на полевые (профилактические)
и клинические, неконтролируемые и
контролируемые, рандомизированные и
нерандомизованные.
По
продолжительности наблюдения за
состоянием здоровья исследуемого
контингента эпидемиологические
исследования могут быть сиюминутными
(поперечные, трансверзальные,
кросссекционные) и продолжительными
(продольные, лонгитудинальные — рис. 5).
2.
Средние величины. Критерии разнообразия
признака в совокупности.
Средняя
величина — это обобщающая характеристика
размера изучаемого признака. Она
позволяет одним числом количественно
охарактеризовать качественно однородную
совокупность. Применение средних величин
®
для оценки состояния здоровья — например,
параметров физического развития (средний
рост, средняя масса тела, среднее значение
жизненной емкости легких и др.),
соматических показателей (средний
уровень сахара в крови, средняя величина
пульса, средняя СОЭ
и
др.);
-
для
оценки организации работы
лечебно-профилактических и
санитарно-противоэпидемических
учреждений, а также деятельности
отдельных врачей и других медицинских
работников (средняя длительность
пребывания больного на койке, среднее
число посещений на 1 ч приема в поликлинике
и др.); -
для
оценки состояния окружающей среды.
Средняя
величина бывает:
-
Простая
-
Взвешенная
-
По
способу момента
Критерии
разнообразия признак в совокупности.
Разнообразие
признак — колеблемость признака в
изучаемой совокупности. К таким критериям
относятся:
-
Лимит
-
Амплитуда
-
среднее квадратическое
отклонение -
Коэффициент
вариации
Лимит
— определяется крайними значениями
вариант в вариационном ряду. Амплитуда
— разность крайних вариант.
N=12 344
n=400
p=400/12344*100=3,24%
ABDAD
Билет
10
-
Классификация
эпидемиологических исследований.
Эпидемиологические
испытания принято иногда классифицировать
в зависимости от изучаемой популяции
и характера вмешательства. Если изучаемая
популяция состоит из пациентов, т. е.
лиц, уже имеющих определенное заболевание,
а основной целью является оценка
эффективности новых лекарственных
препаратов (методов лечения), такое
исследование называетсяклиническим
испытанием.
Если
субъектами исследования являются лица,
свободные от данного заболевания, а
вмешательство направлено на его
профилактику, такие исследования
называют полевыми испытаниями.
Данная
классификация не является общепринятой,
поскольку принципиальных различий
между этими двумя видамиисследований
с методической точки зрения нет.
Как
уже отмечалось, эпидемиологические
испытания должны быть контролируемыми,
т. е. организованы таким образом, чтобы
минимизировать влияние ошибок, а также
учитывать возможный мешающий фактор.
Этого можно добиться, применяя уже
упоминавшиеся приемы формирования
групп сравнения (подбор, рестрикция и
т. д.), причем наиболее эффективным из
них является, безусловно, рандомизация.
Эпидемиологические
испытания
организуются, как правило, как когортные
исследования с рандомизированной
выборкой. Наиболее распространенный
термин для обозначения такого исследования
— рандомизированное контролируемое
испытание(РКП).
-
Критерии разнообразия признака в совокупности. Среднее квадратичное отклонение, методики нахождения, его оценка.
Критерии
разнообразия признак в совокупности.
Разнообразие
признак — колеблемость признака в
изучаемой совокупности.
К
таким критериям относятся:
-
Лимит
-
Амплитуда
-
среднее квадратическое
отклонение -
Коэффициент
вариации
Лимит
— определяется крайними значениями
вариант в вариационном ряду.
Амплитуда
— разность крайних вариант.
Среднее
квадратическое отклонение — это квадратный
корень из среднего арифметического все
квадратов разностей между данными
величинами и их средним арифметическим.
Обозначается сигмой.
Коэффициент
вариации
используют для сравнения рассеивания
двух и более признаков, имеющих различные
единицы измерения. Коэффициент вариации
представляет собой относительную меру
рассеивания, выраженную в процентах.
Он вычисляется по формуле:
где
У
—
искомый показатель, с — среднее квадратичное
отклонение, X — средняя величина.
Пример:
Определяется воспроизводимость двух
методов измерения СОЭ. Первый метод
(модифицированный
метод Вестергрина) дал величину С = 1,0
мм при X = 10 мм, а второй (метод
Линсенмайера)
— <^=15 минут и X =180 минут.
Непосредственное
сравнение средних квадратичных отклонений
не дает ответа, так как речь идет о двух
величинах, выраженных в разных единицах
измерения. Следовательно, необходимо
прибегнуть к коэффициенту вариации:
Ѵ1=(1/10)*100=]0%;
Ѵ2=(
15/180)* 100=8,33%.
Воспроизводимость
первого проверяемого метода ниже по
сравнению со вторым (10% > 8,33%).
Nнаселения=50
000
Nосмотренных=10
000
Nзаболевших=4500
p=10 000/50
000* 100%= 20%
ACDBB
Билет
11
1
.Характеристика отдельных видов эпид
исследований: ОПИСАТЕЛЬНЫЙ-описвает
частоту и распостраненнность заболеваний,
наблюдаетза роцессом, не вмешиваясь в
него. Можно установить связь между
частотой встречаемости и его
распосраненностью.
-описание
отдельных случав- подробное описание
даннях, полученных путем наблюдения
одного/нескольких случ.заболеваний(не
более 10).
-описание
серии случав-иследование включающее
обачно описательную
статистику групппы с определенным
заболеванием.Информативно
удобен.Недостатокютсутствие группы
сравнения изучаемыхз случае в разные
моменты времени, на разных стадіях
течения.
АНАЛИТИЧЕСКИЙ-исп-ся
с целью установить причиннные святи
м-ду заболеваниями и различными факторами
риска: профеессинальными,соц.- бытовыми,
окруж.среды,генетическ.А таккже для
оценки эффективности профилактю и
лечебн. мероприятий.
Цель:
проверка гипотезы об этиологических
связях( воздействия-заболевания)
ОДНОМОМЕНТНЫЕ-позволяют исслед-ть
распостраненность.наблюдекние как за
воздействием фактора, так и за его
эфффектом, тополько относительно
к одному моменту времени.Сравнение
частоты болезни у лиц основной и
контрольной групп.Выявление различий
в уровнях воздействия факторов риска
в группах больных и здорових.Преимущество:
доступность и простота.Недостаток:
только на данный момент.
ДЛИТЕЛЬНЫЙ-постоянное
наблюдение за пределенным контингентом.Бывают:
-кроткосрочные;
-долгосрочные;
-ретроспективные(изуч.
характеристики, которые возникли до
начала заболевания);
—
проспективные(вероятность его развития
в будущем). Преимущество:значительн.экономия
времени на его проведение.Одновременное
изучение влияния нескольких факторов
риска.Особенно эффективен при изучении
онкологи.
2.ДОСТОВЕРНОСТЬ-степень
соответствия отоброжаемой действительности
т.е. с какой вероятностью безошибочного
прогноза результаты выборочной
совокупности можна перенести
на генерал.совокуп-ть.Мерой достоверности
является ошибка, она зависит от числа
наблюдений, чем більше
наблюдений, тем менше
ошибка.Коэф 1, 3-99,7% 2-95.5% 1 -68%- не
соответствует медик нормам.
N=50 000
пролечено
11 000
амбулаторно
400 000
ргосп=11 000/50
000*100%=22%
на
1 человека 400 000/50 000= 8 посещений
CCCCA
Выводы:
|
Процент |
Количество |
|
|
1998 |
22% |
8 |
|
2000 |
26% |
7,2 |
Билет
12
1
.ЭМПИРИЧЕСКИЕ ИССЛЕД-наблюдение без
преднамеренного вмешательства в терени
болезни.Включ
в себя
описательный и аналитический методы.
Эмпирические исследования — это
исследование без преднамеренного
вмешательства
в естественное течение и развитие
заболевания. Исследователь наблюдает
и фиксирует необходимую информацию в
соответствии с программой исследования.
Эмпирические исследования, в свою
очередь, могут быть описательными и
аналитическими. Аналитические методы
могут быть когортными, исследованиями
типа «случай-контроль» и экологическими.
В
эксперименте исследователь целенаправленно
и сознательно контролирует основные
параметры, которые являются предметом
изучения (например, факторы риска, новые
методы лечения, профилактики), а также
распределяет объекты исследования
(больных и здоровых лиц) за определенными
группами. Экспериментальные исследования
разделяются на полевые (профилактические)
и клинические, неконтролируемые и
контролируемые, рандомизированные и
нерандомизованные.
2.ОЦЕНКА
ДОСТОВЕРНОСТИ РЕЗУЛЬТАТОВ СТАТ.ИССЛЕДОВ
означаетопределить вкакой мере сделанные
для него выводы можна
перенести
на генерал.совокупность. Для оценки
достоверности результатов любых
выборочных исследований определяют
среднюю
ошибку относительной (тр)
или
средней
величины (тМ).
Параметрическим
критерием оценки существенности разницы
является коэффициент достоверности
(критерий Госсета (Стьюдента)).
N=30 000
Родилось
2100
Аборты
1050


AACCE
Выводы:
|
1999 |
1998 |
|
|
Крождаемости |
72% |
70‰ |
|
Кабортов |
30% |
35‰ |
Билет
13
Описательный
метод —
вид научного
метода,
представляющий собой систему процедур
сбора, первичного анализа и изложения
данных и их характеристик. Описательный
метод — вид социологического исследования
(анализа), предполагающий получение
эмпирических данных, дающих целостное
представление о предмете, его структурных
элементах и обычно не содержащий
установления причинно-следственных
связей, принципиально нового осмысления
системы.
Описательные исследования
необходимы для изучения относительно
схожих сообществ людей (казачество;
депутаты и т. д.) или весьма разношёрстных
объектов (предприятия-банкроты и т. д.)
Здесь пересекаются разные по
социально-экономическим, профессиональным,
национальным, территориальным и иным
характеристикам группы объектов
изучения.
Является необходимым в
структуре объекта выделить однородные
категории, дать им характеристику и т.
д.
Описательный метод особенно свойствен
художественной, документальной
литературе.
Контент-анализ —Анализ
содержания
2.
Оценка достоверности результатов
статистического исследования.
Доверительные границы. Методика
определения доверительных границ.
Доверительные
границы|граница|
ЭТО ИНТЕРВАЛЫ ВАРИАБЕЛЬНОСТИ ПРИЗНАКОВ.
определяют
формулами:
Pген=Pвыб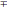
*mp
, где:
-
и Pген
— значение средних и относительных
величин, рассчитанных для генеральной
совокупности; -
и Pвыб
– значение средних и относительных
величин, рассчитанных для выборочной
совокупности; -
mx
и mp
– средние ошибки соответствующих
показателей; -
t
– критерий достоверности или доверительный
коэффициент.
Он
может быть задан с разными степенями
точности и в зависимости|
от вероятности безошибочного прогноза
составлять t = 2 и t = 3.
Средняя ошибка
позволяет определить доверительные
пределы, в которых с определенной
вероятностью находится истинное значение
показателя. Интервал, размещенный между
ними, называется доверительный
интервал (t˟m).
гОРОД
н.: Хср=23,8
дня
m=
±4,6 дняV
ACEEA
σ
=5,2
2
ГРУППА:
|
длительность, |
больные |
fX |
D |
d2 |
d2f |
|
14 |
4 |
56 |
11 |
121 |
484 |
|
17 |
8 |
136 |
8 |
64 |
512 |
|
21 |
7 |
147 |
4 |
16 |
112 |
|
25 |
18 |
450 |
0 |
0 |
0 |
|
28 |
20 |
560 |
3 |
9 |
180 |
|
30 |
8 |
240 |
5 |
25 |
200 |
|
33 |
5 |
165 |
8 |
64 |
320 |
|
70 |
1754 |
1808 |
М=
м=
25 дней
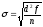

(средняя вариабельность)
Выводы:
|
Город |
2 |
|
|
М |
23,8 |
25 |
|
Cv |
21,85 |
20% |
Билет
14
1.
Аналитические методы исследования.
Основные понятия. Цели. Преимущества и
недостатки. это преобразования и работа
с математическими равенствами и формулами
как с последовательностью символов.
Они отличаются от численных расчётов,
которые оперируют приближёнными
численными значениями, стоящими за
математическими выражениями. Системы
символьных вычислений (их так же называют
системами
компьютерной алгебры)
могут быть использованы для символьного
интегрирования и дифференцирования,
подстановки одних выражений в другие,
упрощения формул и т. д. ОБЛЕГЧИТЬ
И УСКОРИТЬ РАБОТУ ВРАЧА- ЦЕЛЬПреймущество-
быстрота, легкость,недостатки- сбои
программ, системные ошибки при неправельной
загрузки, невозможность индивидуального
подхода.недостаток специалистов кот в
состоянии работать с такой техникой
аналитические методы, которые позволяют
учитывать потенциальную связь между
воздействием и продолжительностью
заболевания Этот метод требует, чтобы
мы получили даты постановки диагноза
для всех случаев, или информацию о
распределении продолжительности
заболевания на различных уровнях
воздействия. Даже при отсутствии связи
между воздействием и продолжительностью
заболевания, тем не менее, возникают
проблемы, которые заключаются в том,
что нынешнее воздействие может быть
связано с теми воздействиями, которые
были в то время, когда оно могло быть
этиологически значимым для нынешнего
заболевания. Подобное время отделено
от настоящего двумя историческими
периодами:
-
временем
индукции между соответствующим
воздействием и возникновением заболевания
(которое остается гипотетическим до
тех пор, пока не будут получены адекватные
данные по времени индукции); -
временем
от возникновения заболевания до момента
проведения исследования (которое мы
можем измерить, желательно из медицинских
записей). -
Оценка
достоверности разности результатов
статистического исследования.
Оценить
достоверность результатов-
означает определить, с какой вероятностью
можно перенести сделанные для него
выводы (результаты изучения признаков)
с выборочной совокупности на всю
генеральную совокупность (т.е., по части
явления судить о явлении в целом, о его
закономерностях). Общие
погрешности
(ошибки) могут иметь как
систематический|систематичный|
характер|
(методические, недостатки|недостаток|
измерительной аппаратуры), так и случайный
(ошибки|ошибка|
исследователя). Погрешности
выборочного наблюдения
связаны|повязал|
с отбором его единиц. Это погрешности
типичности, репрезентативности.Нулевая
и альтернативная гипотезыПроверка
гипотезы
имеет огромное значение в медицинских
исследованиях, потому что позволяет
исследователю делать обобщения о
генеральной совокупности на основе
вероятностей из результатов выборочного
исследования.Цель
исследователя – доказать, что данные
наблюдения, полученные при исследовании
статистически значимы. Проверка гипотезы
подтверждает (или опровергает) утверждение,
что данные наблюдения не возникли
случайно, а отражают подлинную связь
между зависимыми и независимыми
событиями.Нулевая
гипотеза (Но)
утверждает, что нет
разницы
между попавшими и не попавшими под
воздействие факторов (риска) субъектами
в отношении риска развития события
(заболевания и т.п.). Наблюдаемая разница
является случайной.Альтернативная
гипотеза (НА)
утверждает, что есть
разница
между попавшими и не попавшими под
воздействие факторов (риска) субъектов
в отношении риска развития события

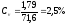
низкий уровень вариабельности)
DBAAE
Билет
15
Одномоментные
исследования.
Исследование,
которое включает в качестве объектов
всех людей в популяции в некий момент,
или репрезентативную выборку всех
подобных людей, включая тех, кто имеет
заболевание, и имеет своей целью описать
популяцию в данный момент, обычно
обозначается как одномоментное (или
кросс-секционное) исследование.
Одномоментное исследование, которое
выполняется для того, чтобы определить
распространенность, называется
исследованием распространенности.
Обычно информация о воздействии
анализируется вместе с информацией о
заболевании, таким образом, чтобы
субпопуляции с различным воздействием
могли бы быть сравнены в соответствии
с распространенностью у них заболеваний.
Одномоментные исследования часто
опираются на воздействия, которые не
меняются, такие как группа крови и
другие, мало меняющиеся характеристики
человека. Для таких воздействий настоящая
информация является полезной. Одномоментные
исследования могут включать формирование
выборки в соответствии со статусом
заболевания.
Нулевая
и альтернативная гипотезы
Проверка
гипотезы
имеет огромное значение в медицинских
исследованиях, потому что позволяет
исследователю делать обобщения о
генеральной совокупности на основе
вероятностей из результатов выборочного
исследования.
Цель
исследователя – доказать, что данные
наблюдения, полученные при исследовании
статистически значимы. Проверка гипотезы
подтверждает (или опровергает) утверждение,
что данные наблюдения не возникли
случайно, а отражают подлинную связь
между зависимыми и независимыми
событиями.
Нулевая
гипотеза (Но)
утверждает, что нет
разницы
между попавшими и не попавшими под
воздействие факторов (риска) субъектами
в отношении риска развития события
(заболевания и т.п.). Наблюдаемая разница
является случайной.
Альтернативная
гипотеза (НА)
утверждает, что есть
разница
между попавшими и не попавшими под
воздействие факторов (риска) субъектов
в отношении риска развития события
(заболевания и т.п.). Наблюдаемая разница
не является случайной.
Если
данные исследования статистически
значимы и нулевая гипотеза не получила
подтверждения, она может быть отвергнута
и принимается альтернативная.
|
Обращения |
Дети |
fX |
D |
d2 |
d2f |
|
2 |
5 |
10 |
2 |
4 |
20 |
|
3 |
10 |
30 |
1 |
1 |
10 |
|
4 |
15 |
60 |
0 |
0 |
0 |
|
5 |
10 |
50 |
1 |
1 |
10 |
|
6 |
4 |
24 |
2 |
4 |
16 |
|
7 |
1 |
7 |
3 |
9 |
9 |
|
45 |
181 |
65 |
Город
В: Хср=3,6
m=
±1,3
σ
=1,2

= 33,3%
Город
А:
М=
м=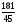
4

(высокая вариабельность) ACCAA
Выводы:
|
Город |
Город |
|
|
Среднее |
4 |
3,6 |
|
М |
1.2 |
1.3 |
|
σ |
30% |
33,3% |
Билет
16
Длительное
или
постоянное наблюдение за определенным
контингентом называют продольным
исследованием. Оно позволяет устанавливать
связь между действием факторов риска
и возникновением заболеваний, даже в
тех случаях, когда эти события разделены
значительным промежутком времени.
Различают короткие исследования
продолжительностью до трех лет и полные
долгосрочные исследования от рождения
до зрелости.
Распределение
продольных исследований на ретроспективные
и
проспективныеотносится
к времени возникновения исследуемых
явлений. В ретроспективных исследованиях
изучаются характеристики, когда
заболевание было еще до начала
исследования, в проспективных — изучается
вероятность его возникновения в будущем.
Обычно аналитические исследования
начинаются с ретроспективного
исследования. Ретроспективное исследование
чаще
проводится как исследования
«случай-контроль». При проведении такого
вида исследования формируются две
группы. Сначала осуществляется отбор
фуппы пациентов с исследуемым заболеванием
(первая группа) и подобной по другим
признакам группы лиц без этого заболевания
(вторая группа). Затем ретроспективно
(по архивным данным или воспоминаниям,
суждениям; данным
Корреляция,
видыкоэффициентовкорреляции.
-
.
Коэффициент
корреляции—
это число, которое находится между -1 и
+1, определяет силу линейной связи двух
случайных переменных. Положительное
значение коэффициента корреляции
означает, что с увеличением одной из
переменных другая также растет, из
уменьшенные одной из них уменьшается
и другая. Негативное значение значит,
что с ростом одной переменной другая
уменьшается, с уменьшением одной из
них другая растет. Коэффициент корреляции
равняется нулю — значит, что между
переменными отсутствует взаимосвязь.
Определение
характера связи между определенными
параметрами проводят путем расчета
коэффициента
корреляции
|
Направленность |
||
|
Прямая связь |
Обратная – |
|
|
Сила |
||
|
Слабая r=0.01-0.29 |
Средняя r=0.30-0.69 |
Сильная r=0.70-0.99 |
Коэффициент
парной корреляции отображает характер
связи 2 признаков.
Он
дает характеристику обобщенной
«неочищенной» связи между параметрами.
Он может быть рассчитан при сопоставлении
двух рядов в виде
-
рангового
коэффициента корреляции (ρ)
и -
линейного
коэффициента корреляции (r).
Корреляционная
зависимость различается по направлению,
силе и форме связи.
По
направлению корреляционная связь может
быть положительной («прямой») и
отрицательной («обратной»). Степень,
сила или теснота корреляционной связи
определяется по величине коэффициента
корреляции. Сила связи не зависит от ее
направленности и определяется по
абсолютному значению коэффициента
корреляции.Максимальное возможное
абсолютное значение коэффициента
корреляции r = 1,00; минимальное r = 0,00.
Среднее
число дней на койку: 340 000:20
000 = 17 дней ADACD
Билет
17
Экспериментальное
исследование — это сравнительное
исследование при преднамеренном
вмешательстве в одну из исследуемых
групп (рандомизированный клинический
эксперимент). Контролируемое испытание,
это экспериментальное исследование
(воздействие оказывает исследователь).
Эксперимент в медицине получил
распространение сравнительно недавно.
Значение контролируемых исследований
трудно переоценить. Клагодаря рандомизации
группы различаются только исследуемым
признаком, тем самым преодолевается
основной недостаток обсервационных
исследований. Экспериментальное
исследовании никто до ею завершения не
знает.к чему оію приведет. Это уменьшает
риск невольной подтасовки. Может быть,
по этой причине контролируемые испытания
нередко приводят к заключению о
неэффективности того или иного метода
лечения, когда обсервационное исследование,
напротив, доказываем его эффективность.
2.Коэффициентранговойкорреляции,
методика, нахождения, его оценка.Коэффициент
ранговой корреляции (Спирмена)
— непараметрический метод, который
используется с целью статистического
изучения связи между явлениями.Особенность
коэффициента Спирмена – простота
вычисления при
недостаточнойточностипозволяетегоиспользовать
для ориентировочногоанализа с
проведениембыстрыхрасчетов, при
определенииданных в получисленном
описательном виде/
Этапы
расчета:
1)
Определить ранги значения каждой
величины рядов X
и Y.
Ранжирование
обоих рядов должно быть однонаправленным.
2)
Определить отклонение значений одного
ряда от другого (dxy).
Их сумма с учетом
знаков должна равняться 0.
3)
Возвести полученные результаты в
квадрат, и определить их сумму
(
4)
Подставляем полученные результаты в
формулу:
ρ
=1-
где
—
сумма квадратов разностей рангов, а
— число парных наблюдений.
Для
оценки достоверности коэффициент
корреляции должен превышать свою
погрешность не меньше, чем в 2,5 – 3 раза
при достаточном числе наблюдений.
При
большом числе наблюдений (n˃100) средняя
ошибка рангового коэффициента корреляции
вычисляется по формуле:
mρ
√n
Оценка
достоверности коэффициента корелляции
проводится по тем же принципам, что
используются для других показателей с
определением числа наблюдений (числа
степеней свободы вариационных рядов
n’=n-2. Полученные результаты сравнивают
с табличными значениями для соответствующих
ступеней вероятности ошибки первого
типа.
В
прошлом году госпитализировано 82%. В
этом году на 7% больше. CBCDD
Билет
18
Ноправдива
= статистически не значима
Ноложна
= статистически значима
Допускание
Но
= статистически не значимо
Отвергание
Но
= статистически значимо
Ошибки
I типа (α – альфа)
Если
Но
правдива в действительности и, полученные
в ходе исследования данные статистически
не значимы, правильное решение – принять
нулевую гипотезу. С другой стороны: если
Но
правдива,
а полученные данные статистически
значимы, решение отвергнуть Но
будет не верным и будет сделана ошибка.
Ее называют ошибкой I типа (альфа). Т.о.,
ошибка
I типа отвергает Но,
когда последняя верна.
Ошибки
II типа (β – бета)
Если
в действительности Но
ложна и полученные данные статистически
значимы, правильным будет отвергнуть
Но.
С другой стороны, если Но
ложна и полученные данные статистически
не значимы , решение принять Но
будет
неправильным и будет сделана ошибка.
Это ошибка II
типа (бета). Т.о., ошибка
II типа принимает Но,
когда последняя ложна.
Для
оценки достоверности результатов
выборочных исследований определяют:
Подборка по базе: Практическая работа 1.docx, Контрольная работа теория государства и права .docx, Практическая работа.docx, Контрольная работа_Введение в экономическую теорию.docx, Домашняя контрольная работа по Естествознанию.docx, контрольная работа английский язык 14.03.docx, 913664 Курсовая работа2.docx, Практическая работа1.doc, Практическая работа.docx, курсовая работа Зилола.docx

Университет имени Марата Оспанова»
Самостоятельная работа студента
Специальность: общая медицина
Дисциплина: Биостатистика
Кафедра: естественно-научных дисциплин
Тема: Методы отбора единиц наблюдения для выборочной совокупности. Возможные типы систематических ошибок оценки в исследованиях. Измерение разнообразия признака. Коэффициент вариаций.
Форма выполнения: реферат
Подготовил:Кайракбаев М.М.
Группа: 223 А
Проверила: Емжарова Г.У.
Актобе 2017 год
План
Введение
Методы отбора единиц наблюдения для выборочной совокупности
Возможные типа систематических ошибок оценки в исследованиях
Коэффицент вариации
Измерение разнообразия признака
Заключение
Список использованной литературы
Введение
Как уже отмечалось ранее статистическое исследование может осуществляться по данным не сплошного наблюдения, основная цель которого состоит в получении характеристик изучаемой совокупности по обследованной её части. Одним из наиболее распространённых в статистике методов, применяющим не сплошное наблюдение, является выборочный метод.
Под выборочным понимается метод статистического исследования, при котором обобщающие показатели изучаемой совокупности устанавливаются по некоторой её части на основе положений случайного отбора. При выборочном методе обследованию подвергается сравнительно небольшая часть всей изучаемой совокупности (обычно до 5-10%, реже до 15-25%). При этом подлежащая изучению статистическая совокупность, из которой производится отбор части единиц, называется генеральной совокупностью. Отобранная из генеральной совокупности некоторая часть единиц, подвергающаяся обследованию, называется выборочной совокупностью, или просто выборкой. Задача выборочного наблюдения состоит в том, чтобы получить правильное представление о показателях всей генеральной совокупности на основе изучения выборочной совокупности.
Значение выборочного метода состоит в том, что при минимальной численности обследуемых единиц проведение исследования осуществляется в более короткие сроки и с минимальными затратами труда и средств. Это повышает оперативность статистической информации, уменьшает ошибки регистрации.
В проведении ряда исследования выборочный метод является единственно возможным, например, при контроле качества продукции (товара, услуги), если проверка сопровождается уничтожением или разложением на составные части обследуемых образцов.
1. Методы отбора единиц наблюдения для выборочной совокупности
Выборочный метод применяется в тех случаях, когда проведение сплошного наблюдения невозможно или экономически нецелесообразно. В частности, проверка качества отдельных видов продукции может быть связана с ее уничтожением (оценка крепости нити на разрыв, дегустация продуктов питания и т.п.); другие совокупности настолько велики, что было бы физически невозможно собрать данные в отношении каждого из их членов (например, при изучении пассажиропотоков или цен на рынках, исследованиях бюджетов семей). Выборочное наблюдение используют также для проверки результатов сплошного наблюдения.
Часть единиц, отобранных для наблюдения, принято называть выборочной совокупностью, а всю совокупность единиц, из которых производится отбор, — генеральной. Качество результатов выборочного наблюдения зависит от того, насколько состав выборки представляет генеральную совокупность, иначе говоря, от того, насколько выборка репрезентативна (представительна). Чтобы обеспечить репрезентативность выборки, необходимо соблюдать принцип случайности отбора единиц, который предполагает, что на включение или исключение объекта из выборки не может повлиять какой-либо иной фактор, кроме случая.
Существуют различные способы формирования выборочной совокупности. Это и индивидуальный отбор, включающий такие разновидности, как собственно случайный, механический, стратифицированный, и серийный, или гнездовой, отбор.
Собственно случайный отбор (или случайная выборка) осуществляется с помощью жеребьевки либо по таблице случайных чисел. В первом случае всем элементам генеральной совокупности присваивается порядковый номер и на каждый элемент заводится жребий — пронумерованные шары или карточки-фишки, которые перемешиваются и помещаются в ящик, из которого затем отбираются наудачу. Во втором случае производится выбор случайных чисел (из специальных таблиц), которые образуют порядковые номера для отбора. Числа в таблицах обычно печатаются в виде блоков цифр (чтобы сделать таблицы более удобными для чтения по сравнению с не разбитой на блоки массой цифр), причем эти объединения в блоки не имеют статистического значения. Например, это могут быть числа
5489, 5583, 3156, 0835, 1988, 3912.
Применение комбинаций этих цифр зависит от размера совокупности: если в совокупности 1000 единиц, то порядковый номер каждой единицы должен состоять из трех цифр от 000 до 999. В таком случае приведенные выше случайные числа дали бы первые 8 номеров единиц выборочной совокупности:
548, 955, 833, 156, 083, 519, 883, 912.
Дополнительные номера могут быть получены из последующих блоков тем же способом.
Несколько сложнее выглядит процедура назначения номеров, отбираемых в выборочную совокупность при произвольном объеме генеральной. Теперь из случайных чисел таблиц формируется последовательность случайных величин, равномерно распределенных в интервале от 0 до 1. Могут использоваться и так называемые псевдослучайные числа, т.е. полученные по определенному алгоритму вручную или с помощью ПЭВМ. В нашем примере такими числами можно было бы считать
0,5489; 0,5583; 0,3156; 0,0835; 0, 1988; 0,3912 и т.д.
отбор выборочный метод исследование
Предположим, что генеральная совокупность состоит из 7328 единиц. Тогда в выборочную должны войти единицы с номерами:
7328 0,5489 = 4022,3 » 4022;
7328 0,5583 =4091,2 «4091;
7328 0,3156 = 2312,7 = 2313;
7328 0,0835= 611,9= 612;
7328 0, 1988 = 1456,8 » 1457;
7328 0,3912 = 2866,7 » 2867.
Процесс формирования случайных. чисел и определения номера отбираемой единицы продолжается до тех пор, пока не будет получен заданный объем выборочной совокупности.
Особенности обследуемых объектов определяют два метода отбора единиц-в выборочную совокупность — повторный (отбор по схеме возвращенного шара) и бесповторный (отбор по схеме невозвращенного шара). При повторном отборе каждая попавшая в выборку единица или серия возвращается в генеральную совокупность и имеет шанс вторично попасть в выборку. При этом вероятность попадания в выборочную совокупность всех единиц генеральной совокупности остается одинаковой. Бесповторный отбор означает, что каждая отобранная единица (или серия) не возвращается в генеральную совокупность и не может подвергнуться вторичной регистрации, а потому для остальных единиц вероятность попасть в выборку увеличивается.
Бесповторный отбор дает более точные результаты по сравнению с повторным, так как при одном и том же объеме выборки наблюдение охватывает больше единиц генеральной совокупности. Поэтому он находит более широкое применение в статистической практике. И только в тех случаях, когда бесповторный отбор провести нельзя, используется повторная выборка (при обследовании потребительского спроса, пассажирооборота и т.п.).
2. Возможные типы систематических ошибок оценки в исследованиях
Эпидемиологические исследования измеряют характеристики популяции. Параметром интереса может быть частота заболевания, распространенность воздействия, или, чаще всего, существующие взаимосвязи между воздействием и заболеванием. Поскольку исследования выполняются на людях, и они могут иметь сопутствующие практические и этические ограничения, практически все они подвержены систематическим ошибкам.
Ошибки отбора.
Ошибки отбора возникают, когда изучаемый пациент не является репрезентативным по отношению к целевой популяции, относительно которой мы пытаемся придти к заключению. Предположим, что исследователь желает оценить распространенность высокого потребления алкоголя (более 21 стандартной единицы в неделю) у взрослых жителей данного города. Он может попробовать сделать это создав случайную выборку из всех взрослых, которые находятся на учете у местного врача общей практики, а затем разослать им по почте опросник, которые будет содержать вопросы относительно привычек употребления ими спиртных напитков. При использовании этого дизайна исследования одним из источников ошибки может быть исключение из выборки тех жителей города, которые не зарегистрировались, или не находятся на учете у врача. Эти, исключенные из анализа лица, могут иметь иные характеристики употребления алкоголя, чем те, кто включены в исследование. Кроме того, не все люди, отобранные для исследования, обязательно заполнят и возвратят анкетные, а те исследуемые, которые отказались отвечать на вопросы, могут иметь иные характеристики потребления алкоголя, чем те, кто ответил на опросник.
Обе эти проблемы — потенциальные источники ошибок отбора. Возможность ошибок отбора всегда должна рассматриваться при определении выборки для изучения.
Более того, в ситуации когда отклик недостаточный, необходимо оценить возможные размеры смещения, вызванного этой ошибкой. Всегда необходимо обращать внимание на проблемы неполного отклика.
Информационные ошибки.
Второй большой класс систематических ошибок является результатом ошибок в измерении воздействия или самого заболевания.
В исследовании, которое пыталось оценить относительный риск врожденных пороков развития, связанных с тем, что мать подвергалась воздействию органических растворителей типа белого спирта, матери детей с пороками развития опрашивались относительно их контакта с подобными веществами в течение беременности, и их ответы сравнивались с ответами, полученными от контрольной группы матерей, родивших нормальных детей.
Когда мы используем подобный дизайн исследования, существует опасность того, что матери, родившие детей с пороками, были более мотивированы выяснить, почему их дети родились с аномалией и поэтому они с большей вероятностью могут вспомнить о своем контакте с органическими растворителями, чем матери из группы контроля.
Если это так, то возникает систематическая информационная ошибка, которая будет приводить к преувеличению оценки риска.
Надо заметить, что систематические ошибки или смещения обычно не могут быть полностью удалены из эпидемиологических исследований. Поэтому целью исследования должно быть сведение их к минимуму, идентификация тех систематических ошибок, которых нельзя избежать, оценка их потенциального воздействия, и принятие их во внимание при интерпретации результатов.
Ошибка измерений.
Как указано выше, ошибки в измерении воздействия или заболевании могут стать важным источником систематической ошибки или смещения в эпидемиологических исследованиях. Поэтому при проведении исследований важно оценить качество измерений, которые в них используются. Идеальная техника опроса является достоверной (то есть она точно измеряет то, что необходимо измерить). Иногда существует надежный стандарт, по сравнению с которым можно измерять достоверность метода, который мы используем. Например, достоверность сфигмоманометра может быть оценена при сравнении данных, полученные с его помощью, с внутриартериальным давлением, а достоверность маммографической диагностики рака молочной железы может быть проверена (если женщина соглашается) биопсией. Более часто, однако, не имеется никакого достоверного стандарта для сравнения. Достоверность анкетного опросника для диагностики стенокардии напряжения не известна полностью: точка зрения варьирует среди экспертов, и даже коронарные ангиограммы могут быть нормальны в истинных случаях стенокардии, а могут быть патологически измененными у людей с отсутствием симптомов стенокардии. Патолог может описывать изменения при аутопсии, но эти изменения мало что могут сказать относительно функционального состояния пациента или наличия у него патологических симптомов. Измерение заболевания у живого человека очень часто нельзя провести с полной достоверностью.
3. Измерение разнообразия признака
Приближенный метод оценки колеблемости вариационного ряда — определение лимита и амплитуды, однако не учитывают значений вариант внутри ряда. Основной общепринятой мерой колеблемости количественного признака в пределах вариационного ряда является Среднее квадратическое отклонение (σ — сигма). Чем больше среднее квадратическое отклонение, тем степень колеблемости данного ряда выше.
Методика расчета среднего квадратического отклонения включает следующие этапы:
1. Находят среднюю арифметическую величину (Μ).
2. Определяют отклонения отдельных вариант от средней арифметической (d=V-M). В медицинской статистике отклонения от средней обозначаются как d (deviate). Сумма всех отклонений равняется нулю.
3. Возводят каждое отклонение в квадрат d2.
4. Перемножают квадраты отклонений на соответствующие частоты d2*p.
5. Находят сумму произведений å (d2*p)
6. Вычисляют среднее квадратическое отклонение по формуле:
при n больше 30, или при n меньше либо равно 30, где n — число всех вариант.
Значение среднего квадратичного отклонения:
1. Среднее квадратическое отклонение характеризует разброс вариант относительно средней величины (т.е. колеблемость вариационного ряда). Чем больше сигма, тем степень разнообразия данного ряда выше.
2. Среднее квадратичное отклонение используется для сравнительной оценки степени соответствия средней арифметической величины тому вариационному ряду, для которого она вычислена.
3. Среднее квадратическое отлонение позволяет установить значения нормы для клинико-биологических показателей. В медицине интервал М±1s обычно принимается за пределы нормы для изучаемого явления. Отклонение оцениваемой величины от средней арифметической больше, чем на 1s указывает на отклонение изучаемого параметра от нормы.
4. В медицине правило трех сигм применяется в педиатрии для индивидуальной оценки уровня физического развития детей (метод сигмальных отклонений), для разработки стандартов детской одежды
5. Среднее квадратическое отклонение необходимо для характеристики степени разнообразия изучаемого признака и вычисления ошибки средней арифметической величины.
Величина среднего квадратического отклонения обычно используется для сравнения колеблемости однотипных рядов. Если сравниваются два ряда с разными признаками (рост и масса тела, средняя длительность лечения в стационаре и больничная летальность и т.д.), то непосредственное сопоставление размеров сигм невозможно, Т.к. среднеквадратическое отклонение — именованная величина, выраженная в абсолютных числах. В этих случаях применяют Коэффициент вариации (Cv)
4. Коэффициент вариации
Вариация — различие значений какого-либо признака у разных единиц совокупности за один и тот же промежуток времени. Причиной возникновения вариации являются различные условия существования разных единиц совокупности. Вариация — необходимое условие существования и развития массовых явлений. Определение вариации необходимо при организации выборочного наблюдения, статистическом моделировании и планировании экспертных опросов. По степени вариации можно судить об однородности совокупности, устойчивости значений признака, типичности средней, о взаимосвязи между какими-либо признаками.
Заключение
Выборочный метод получил широкое распространение в государственной и ведомственной статистике (например, бюджетные исследования семей рабочих, служащих, крестьян, обследования жилищных условий, заработной платы и др.). В торговле с помощью выборочного метода изучаются качество поступивших товаров, эффективность новых форм торговли, спрос населения на определённые виды товаров, степень его удовлетворения и др. Аналогичные исследования проводятся по отношению к сфере обслуживания.
В статистической практике нередко осуществляется выборочная разработка экономической информации, полученной методом сплошного наблюдения.
Список использованной литературы:
1.Медико-биологическая статистика — Гланц С. — Практическое руководство. Год выпуска: 1998
2.Медицинская статистика: конспект лекций. Автор: Жидкова Ольга Ивановна
3.http://www.kebc. papk. su/index. files/statistik/lectio4. htm
Слайд 1ЗАПОРОЖСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Лекции по курсу социальной
медицины и организации здравоохранения
Тема:
Понятие и роль биостатистики
как основной составляющей системы доказательной медицины. Эпидемиологические исследования в здравоохранении.
Доцент Таранов Владимир Владимирович

Слайд 2План лекции:
Введение.
Эпидемиология как наука. Область применения.
Задачи.
Методы эпидемиологических исследований
3.1. Характеристика отдельных видов эмпирических
исследований
Описательные методы исследования
Аналитические методы исследования
3.2. Характеристика экспериментальных исследований
Методика проведения эпидемиологических исследований.
4.1.Планирование эпидемиологических исследований
4.2. Достоверность эпидемиологических исследований

Слайд 3Эпидемиология (традиционное представление)
— это система научных знаний,
обосновывающая предупреждение заноса инфекций, возникновение инфекционных заболеваний
среди населения, а в случае их появления – ликвидацию эпидемических очагов, снижение общего уровня инфекционной заболеваемости.

Слайд 4Эпидемиология (современное представление)
— это наука, изучающая распространенность
состояний или событий, связанных со здоровьем, детерминант
этих состояний и событий, в специально определенных популяциях для управления и контроля за проблемами здоровья.
В настоящее время эпидемиология считается базовой наукой о здоровье населения.

Слайд 5Наиболее важные аспекты эпидемиологии:
наука, которая основана
на теории вероятности, статистике и методах глубокого
научно-исследовательского анализа;
метод причинной аргументации, позволяющий на практике доказать или опровергнуть выдвинутые гипотезы относительно причин возникновения, профилактики и лечения заболеваний (исходов);
инструмент практической деятельности, который позволяет на научной основе сохранять, укреплять, поддерживать здоровье населения.

Слайд 6Особенности эпидемиологии неинфекционных болезней
как правило, латентный
период неинфекционных заболеваний значительно более продолжителен, чем
инфекционных, и конкретный срок его непредсказуем;
хроническое заболевание развивается постепенно и его признаки у обследуемых лиц варьируют в большом диапазоне, что повышает вероятность ошибочной диагностики);
для неинфекционных заболеваний характерна мультифакторная природа этиологии и патогенеза, причем явно доминирующий фактор часто отсутствует;
в отличие от инфекционной эпидемиологии, невозможно выделить невосприимчивую часть популяции и установить, имеет ли место абсолютная устойчивость конкретного лица к определенному хроническому неинфекционному заболеванию;
прогнозы заболеваемости и эффективности профилактических мероприятий носят вероятностный характер и оправдываются по отношению к популяции в целом.

Слайд 7Задачи, которые стоят перед эпидемиологией неинфекционных заболеваний:
Изучение
распространенности и естественного течения определенных заболеваний по
группам населения, выявление масштабов проблем, связанных с этими заболеваниями.
Определение факторов внешней и внутренней среды, которые способствуют либо препятствуют возникновению и распространению этих заболеваний.
Определение приоритетных проблем в области охраны здоровья населения.
Разработка мероприятий по устранению или максимально возможному ослаблению действия неблагоприятных факторов. Изучение эффективности профилактических и лечебных мероприятий.

Слайд 8Методы эпидемиологических исследований
— методы изучения закономерностей распространения
неинфекционных болезней среди населения, основанные на применении
статистических показателей.

Слайд 9Методы эпидемиологических исследований (классификация)
В зависимости от цели
эпидемиологические исследования подразделяются на поисковые (выдвигающие гипотезу)
и проверяющие гипотезу.
По характеру вмешательств — на эмпирические (или обсервационные) и экспериментальные.
С точки зрения продолжительности наблюдения за состоянием здоровья изучаемого контингента эпидемиологические исследования могут быть одномоментными (поперечные, трансверзальные, кросс-секционные) и длительными (продольные, лонгитудинальные). Продольные эпидемиологические исследования делятся на проспективные и ретроспективные.

Слайд 10Эмпирические исследования
— это исследования без преднамеренного вмешательства
в естественное течение и развитие заболевания.
Эмпирические
исследования подразделяются на описательные и аналитические.
К описательным исследованиям относятся методы описание случаев и описание серии случаев.
Аналитические методы могут быть когортными, исследованиями типа «случай-контроль» и экологическими.

Слайд 11Экспериментальные исследования
— исследования, в которых осуществляется целенаправленный
и сознательный контроль основных параметров, являющихся предметом
изучения, а также распределение объектов исследования (больных и здоровых лиц) по определенным группам. Экспериментальные исследования подразделяются на полевые (профилактические) и клинические, неконтролируемые и контролируемые, рандомизированные и нерандомизированные.

Слайд 12Характеристика отдельных видов эмпирических исследований. Описательные методы
исследования
Описательная эпидемиология занимается изучением:
частоты и распространения
заболеваний (исходов) на определенной территории (страна, область, район, город, село), в определённое время (месяц, год, 5 лет и т.д.), в разных группах населения (дифференцированно по полу, возрасту, национальности, социально-экономическому положению, образованию, профессии и т.д.);
течения заболеваний;
эффективности диагностических критериев
распространённости потенциально опасных факторов.

Слайд 13Характеристика отдельных видов эмпирических исследований. Описательные методы
исследования
Описание отдельных случаев – наиболее старый способ
медицинского исследования: подробно излагаются данные, полученные путём наблюдения одного или нескольких случаев заболеваний (не более 10 больных).
Этот метод позволяет привлечь внимание медиков к новым или малоизвестным болезням, проявлениям или сочетаниям болезней; используется для описания необычных проявлений болезней и представляет собой единственный способ сообщения о редком клиническом событии, риске, прогнозе и лечении.

Слайд 14Характеристика отдельных видов эмпирических исследований. Описательные методы
исследования
Описание серии случаев — исследование, включающее обычно
описательную статистику группы болезней (численность группы с определенным заболеванием — 10 пациентов и более). Серия случаев — самый распространенный способ описания клинической картины заболевания.

Слайд 15Характеристика отдельных видов эмпирических исследований. Аналитические методы
исследования
Аналитические эпидемиологические исследования применяют с целью установить
причинные связи между заболеваниями и различными факторами риска (профессиональными, социально-бытовыми, окружающей среды, генетическими и др.), а также для оценки эффективности профилактических и лечебных вмешательств.

Слайд 16Характеристика отдельных видов эмпирических исследований. Аналитические методы
исследования
Аналитические эпидемиологические исследования проводятся с применением комплекса
оригинальных методических подходов (когортные исследования, исследования «случай-контроль»).
Разновидностью аналитических исследований являются экологические исследования (их еще называют территориальными).

Слайд 17Характеристика отдельных видов эмпирических исследований. Аналитические методы
исследования
Когортные исследования.
Термин «когорта» означает группу лиц, объединенных
каким-либо общим признаком и наблюдаемых в течение определенного периода времени, чтобы проследить, что с ними произойдет в дальнейшем.
При проведении исследования в когорту включаются лица, у которых изучаемое заболевание отсутствует, но может проявиться в дальнейшем.
Группа лиц, включенная в когорту, может быть разделена на две (экспонированные, то есть подвергающиеся воздействию фактора риска, и неэкспонированные) или несколько категорий (например, нет воздействия, незначительное воздействие, значительное воздействие). Затем эту когорту наблюдают в течение определенного времени, чтобы установить, у кого из ее участников возникает изучаемый исход.

Слайд 18Характеристика отдельных видов эмпирических исследований. Аналитические методы
исследования
Когортные исследования.
Условия наблюдения за когортой:
1. Когорта должна
наблюдаться в течение срока, превышающего продолжительность естественного течения изучаемого заболевания. Это необходимо для того, чтобы дать возможность фактору риска проявиться.
2. Всех лиц, включенных в когорту, следует контролировать в течение всего периода наблюдения.

Слайд 19Характеристика отдельных видов эмпирических исследований. Аналитические методы
исследования
Когортные исследования.
Недостатки когортных исследований:
Если исход редкий
(что обычно и бывает на самом деле), то в группу приходится включать большое число людей.
В большей степени, чем эксперименты, подвержены систематическим ошибкам.
Требует значительных усилий и средств, то есть когортные исследования стоят дорого.

Слайд 20Характеристика отдельных видов эмпирических исследований. Аналитические методы
исследования
Исследования «случай-контроль»
При проведении исследования данного вида
формируются две группы. Сначала отбирается группа пациентов с изучаемым заболеванием (первая группа) и сходная по остальным признакам группа лиц без этого заболевания (вторая группа). Затем ретроспективно (по архивным данным или воспоминаниям, суждениям; данным, полученным в ходе интервью или анкетирования участников исследования) оценивается частота воздействия возможного фактора риска в обеих группах. Обнаружение в группе больных большей доли лиц, подверженных (экспонированных) влиянию изучаемого фактора, чем в контрольной группе, подтверждает, что между развитием болезни и действием этого фактора существует какая-то связь.
Отличительная особенность методики исследования «случай-контроль» состоит в том, что к моменту начала исследования все изучаемые исходы уже состоялись. В когортном исследовании в начале наблюдения, когда оцениваются факторы риска, участники еще не имеют изучаемого заболевания.
Исследование «случай-контроль» — это метод, альтернативный когортным исследованиям при оценке факторов риска.

Слайд 21Характеристика отдельных видов эмпирических исследований. Аналитические методы
исследования
Экологические исследования. единицей анализа в исследованиях выступает
популяция или ее подгруппа, привязанная в таком случае к географической местности. Цель этих исследований — изучение распространенности и причин того или иного заболевания в разных географических регионах в связи с особенностями каждого региона.

Слайд 22Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Одномоментные исследования
Одномоментное исследование еще называют исследованием распространенности.
Особенность — наблюдение как за воздействием (причиной), так и за эффектом относится к одному моменту времени. Позволяют изучить распространенность какого-либо заболевания (или факторов риска) к моменту обследования и, при необходимости, выявить статистическую связь между распространенностью тех или иных заболеваний и потенциально опасными факторами. Как правило, проводится одно обследование участников научного исследования. Общепринятой формой одномоментных эпидемиологических исследований является скрининг.
Сначала проводится скрининг всей группы, затем более тщательное обследование лиц с подозрениями на отклонение от нормы.

Слайд 23Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Одномоментные исследования
Варианты проведения исследований:
а) сравнение частоты
болезни или ее симптомов у лиц основной и контрольной групп;
б) выявление различий в уровнях воздействия факторов риска в группах больных и здоровых.

Слайд 24Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Одномоментные исследования, преимущества:
относительно небольшие затраты;
доступность и простота;
занимают
немного времени;

Слайд 25Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Одномоментные исследования, недостатки:
1. Оценка частоты, с которой
встречается заболевание (распространенность), основана на определении числа больных, выявленных только в момент обследования.
2. Исследования должны охватывать большие контингенты населения.
3. Наиболее убедительным подтверждением достоверности метода служит соответствие результатов его применения в данный момент результатам, полученным через определенный промежуток времени. В чистом одномоментном исследовании подобного сопоставления сделать нельзя.

Слайд 26Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Одномоментные исследования, недостатки (продолжение):
4. Существенное диагностическое значение
при проведении эпидемиологических исследований имеет сопоставление характеристик больных и здоровых лиц. По ряду причин характеристики, выявляемые при одномоментном исследовании уже заболевших, могут не совпадать с теми характеристиками, которые наблюдаются на начальной стадии формирования патологического процесса, лежащего в основе заболевания.
5. В ходе одномоментных исследований невозможно изучить характеристики лиц, умерших в течение короткого промежутка времени после начала заболевания, и данные могут отличаться от характеристик выживших лиц.
6. Невозможность учесть динамику (фактор времени).

Слайд 27Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Продольное исследование.
Позволяет установить связь между воздействием
факторов риска и возникновением заболеваний в тех случаях, когда между этими событиями значительный промежуток времени.
Различают краткосрочные лонгитудинальные исследования продолжительностью до 3 лет и долгосрочные — от рождения человека до его зрелости и даже смерти.
Деление продольных исследований на ретроспективные и проспективные относится ко времени возникновения изучаемых явлений. В ретроспективных исследованиях изучаются характеристики заболевания, которое возникло до начала исследования, а в проспективных — вероятность его возникновения в будущем.

Слайд 28Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Продольное ретроспективное исследование.
При ретроспективном исследовании путь
исследования обратный — от следствия (болезнь, смерть) к возможной причине (факторам риска).
Ретроспективное исследование характеризуется как схема, в которой наличие связи между воздействием фактора и заболеванием оценивается путем сравнения распространенности изучаемого фактора риска среди больных рассматриваемой формой заболевания и среди здоровых лиц контрольной группы.
Ретроспективное исследование опирается на информацию о факторах риска и последствиях их воздействия, собранную в течение какого-то периода в прошлом.
Ретроспективное исследование чаще проводится в виде исследования «случай-контроль».

Слайд 29Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Продольное ретроспективное исследование, преимущества:
значительная экономия времени на
его проведение;
возможность одновременно изучать влияние на заболеваемость нескольких факторов риска, причем появляется возможность анализировать влияние тех или иных сочетаний факторов и оценивать результат их взаимодействия;
воздействие факторов на обследуемых лиц можно прослеживать сколь угодно далеко в прошлом. Ретроспективные исследования особенно эффективны при изучении рака и других заболеваний с длительным латентным периодом;
возможность проведения исследования в относительно короткие сроки, при необходимости — его легкого повторения;
чувствительный метод изучения редких заболеваний.

Слайд 30Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Продольное ретроспективное исследование, недостатки:
более низкая достоверность полученных
с ее помощью результатов вследствие:
а) сравнительно невысокой точности оценки воздействия факторов риска в прошлом, которая в значительной степени основывается на субъективных данных (полностью или частично — на материалах интервьюирования наблюдаемых. Если группа формируется из лиц, умерших от того или иного заболевания, то интервью берется у ближайших родственников);
б) отсутствия единых условий и критериев оценки состояния здоровья наблюдаемых.

Слайд 31Характеристика отдельных видов эмпирических исследований по продолжительности
наблюдения
Продольное проспективное исследование.
При проспективном подходе путь исследования
пролегает от фактора риска (предполагаемой причины) к последствиям для здоровья (возникновение заболевания, смертельные исходы и т.д.).
Продольные проспективные исследования проводятся в основном как когортные.

Слайд 32Характеристика экспериментальных исследований
Экспериментальные исследования проводятся при непосредственном
контроле исследователя за изучаемыми явлениями (например, за
факторами риска, новыми методами лечения, диагностики или профилактики) в условиях, максимально приближенных к условиям лабораторного эксперимента.
Экспериментом является полный набор наблюдений, проводимый в специально сформированных условиях, которыми исследователь может манипулировать.

Слайд 33Характеристика экспериментальных исследований
Экспериментальные эпидемиологические исследования наиболее актуальны:
а)
при подтверждении причинного характера рассматриваемых связей «воздействие—заболевание»;
б)
при оценке эффективности программ профилактики и лечения.

Слайд 34Характеристика экспериментальных исследований:
Значение экспериментальных исследований определяется двумя
моментами:
снижение заболеваемости при целенаправленном воздействии на фактор
риска является подтверждением научной гипотезы, в соответствии с которой фактор риска действительно служит причиной заболевания;
изменение уровня заболеваемости при воздействии на фактор риска указывает на эффективность данного мероприятия.

Слайд 35Характеристика экспериментальных исследований:
Экспериментальные эпидемиологические исследования подразделяются на
клинические и профилактические (полевые). Объект наблюдения в
клинических исследованиях больные, а в профилактических — здоровые лица с факторами риска.

Слайд 36Характеристика экспериментальных исследований:
Для оценки новых методов лечения
и профилактики могут быть применены два основных
вида исследования: неконтролируемое и контролируемое.
Неконтролируемое клиническое испытание — вид исследования, который применяется, когда ценность метода очевидна даже без формальной проверки, не нужна тщательная, строгая методика проведения испытания: эффективность метода можно доказать путем оценки результатов лишь в одной группе больных без сопоставления с контрольной. Может применяться только в исключительных случаях.
Контролируемое клиническое испытание — это специальный вид когортных исследований, условия проведения которого (подбор групп вмешательств, характер вмешательства, организация наблюдения и оценка исходов) обеспечивают устранение систематических ошибок. По степени контролируемости и управляемости клинические испытания превосходят обычные когортные исследования. При классической схеме контролируемого клинического исследования в эксперименте используют две соответствующим образом подобранные группы (выборки), из которых только одна подвергается воздействию экспериментального фактора (новый метод лечения, профилактики).

Слайд 37Характеристика экспериментальных исследований:
Клинические исследования обычно выполняются на
выборках. Выборка — это часть популяции, полученная
путем отбора.
Идеальный эксперимент требует, чтобы все факторы, влияющие на участников эксперимента, были одинаковы, за исключением фактора, который изучается.
Единственный способ уравнять все посторонние факторы — это распределение пациентов по группам случайным образом, так, чтобы каждый пациент получил равные шансы попасть в группу воздействия или в группу без него.
Процедуру, обеспечивающую случайное распределение больных в экспериментальную и контрольную группы, называют рандомизацией.

Слайд 38Характеристика экспериментальных исследований:
Рандомизированные исследования.
Основная цель рандомизированного
исследования — исключить какую-либо предвзятость или предубеждение
в оценке сравниваемых методов.
Достичь это возможно при:
— случайном, непреднамеренном распределении больных по группам: если количество обследуемых большое, то можно принять, что дополнительные факторы, распределяясь в обеих наблюдаемых группах случайным образом, будут взаимно ликвидироваться);
— отслеживании результатов применения изучаемых методов у всех больных, включенных в исследование;
— «слепой» оценке результатов, когда исследователь не знает, в какую группу был включен больной; двойном «слепом» методе, когда больной также не знает, в какую группу — экспериментальную или контрольную — он будет включен;
— четком определении конечного этапа или результата исследования, что позволяет исключить возможность двоякой трактовки полученных данных.

Слайд 39МЕТОДИКА ПРОВЕДЕНИЯ ЭПИДЕМИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ

Слайд 40Планирование эпидемиологических исследований
Этапы планирования :
определение цели исследования;
выбор
объекта исследования;
выбор схемы (метода) исследования;
составление программы наблюдения;
выбор
методов сбора информации;
определение критериев отнесения наблюдаемых к «экспонированным» и «больным»;
определение методов формирования групп наблюдения;
выбор методов обработки данных

Слайд 41Этапы планирования. Этап 1.
Этап 1. Определение
цели исследования.
Под исследовательскими целями понимается детальное
определение сферы и объёма информации, которую предполагают получить в ходе планируемого эпидемиологического исследования.
При описательном исследовании целью может быть сбор данных о распространенности болезней органов дыхания среди населения определенной территории в течение года.
Цели аналитических и экспериментальных исследований должны предусматривать гипотезы, которые будут проверяться.

Слайд 42Этапы планирования. Этап 2.
Этап 2. Выбор
объекта исследования. В качестве объекта исследования обычно
рассматриваются группы населения, в которых достаточно распространено изучаемое воздействие.
При выборе объекта необходимо учитывать такие факторы, как численность наблюдаемых; интенсивность воздействия, которому они подвергаются; возможность обобщения результатов исследования.

Слайд 43Этапы планирования. Этап 3.
Этап 3. Выбор
схемы (метода) исследования обусловлен сроками проведения и
имеющимися для этого ресурсами; распространенностью воздействия фактора и рассматриваемого заболевания; возможностью получения информации о воздействии и случаях возникновения заболевания; характером заболевания (в частности, наличием латентного периода).
Например, проспективное исследование имеет высокую достоверность, поэтому применяется для подтверждения прошедших предварительную проверку гипотез и уточнения характера неблагоприятного воздействия фактора на состояние здоровья. Ретроспективные исследования отличаются сравнительно небольшой трудоемкостью, поэтому их широко используют в тех случаях, когда гипотеза еще не получила надежного обоснования.

Слайд 44Этапы планирования. Этап 4.
Этап 4. Составление
программы наблюдения.
На этом этапе определяют перечень
признаков (переменных, параметров), подлежащих регистрации в отношении каждого наблюдаемого лица. Выбор признаков зависит от целей исследования и возможного влияния различных демографических и социально-экономических факторов на возникновение рассматриваемого заболевания. Перечень регистрируемых признаков может включать — социально-демографическую характеристику объекта наблюдения (пол, возраст, семейное положение и др.);
Характер сведений о состоянии здоровья изучаемой популяции обусловлен в первую очередь видом изучаемого заболевания и типом эпидемиологического исследования.
Для характеристики переменных, которые будут предметом изучения, необходимо установить их измерительные шкалы. Выделяют простые и композиционные (сложные) шкалы измерения признаков.

Слайд 45Простые измерительные шкалы
номинальная;
порядковая;
интервальная (разделительная);
относительная.

Слайд 46Номинальная шкала
Номинальная шкала состоит из двух или
большего числа классов, которые качественно отличаются друг
от друга. Например:
— пол
1. мужской
2. женский
— наличие тошноты
1. да
2. нет
— локализация головных болей
1. затылок
2. лобная область
3. другие области
Применение номинальной шкалы ограничивает область допустимых математических операций, поскольку позволяет использовать статистические методики, с помощью которых проводят только подсчёт (количество случаев, модальная величина).

Слайд 47Порядковая шкала
Порядковая шкала в сравнении с номинальной
имеет то преимущество, что отдельные классы шкалы
ранжированы, т.е. упорядочены по степени интенсивности данной характеристики.
Например:
— частота появления симптомов болезни
1. часто
2. время от времени
3. редко
4. никогда
— нетрудоспособность
1. полная
2. частичная
3. без ограничений трудоспособности
Однако измерение с помощью порядковой шкалы не даёт никакой информации о величине различий между отдельными пунктами шкалы, т.е. недопустимо сравнивать расстояния между различными градациями.
Наряду со статистическими методиками, допустимыми при номинальной шкале, к порядковым шкалам можно применять математические методы для неравных интервалов шкалы (медиана, процентили, ранговая корреляция).

Слайд 48Интервальная (разделительная) шкала
По интервальной (разделительной) шкале между
точками равные промежутки (интервалы). Примеры подобной шкалы:
измерение температуры, влажности и т.п. Однако, нулевая точка на интервальной шкале является вопросом принятой условности (договорённости).
Например, нельзя сказать, что двухдневный новорождённый «в два раза старше» новорождённого, который прожил один день, поскольку принятый в шкале «нуль» не обязательно означает отсутствие данной характеристики.
Произвольность принятой нулевой точки делает недопустимыми при применении этой шкалы операции умножения и деления, поскольку отношение между ступенями шкалы неравные.

Слайд 49Относительная шкала
Свойства относительной шкалы отличаются тем, что
она имеет абсолютную нулевую точку, которая обозначает
отсутствие данной характеристики. В результате этого отношение между числами шкалы точно отражает различия в интенсивности изучаемой характеристики в объекте. Примеры такого рода шкал:
измерение массы тела в килограммах; роста – в сантиметрах;
измерение содержания гемоглобина в 100 мл крови;
показатель смертности.
К относительной шкале можно применять основные математические операции и методы вариационной (параметрической) статистики.
Данные измеренные в относительной шкале можно, могут быть сгруппированы в категории с равными интервалами.

Слайд 50Композиционные (сложные) шкалы
Композиционные (сложные) шкалы базируются на
данных о двух или большем числе переменных.
Примеры таких шкал: потребность в калориях, рассчитанная на основе различных видов пищи; определение стадии болезни на основе многих клинических симптомов.
Композиционную шкалу можно также конструировать на основе сравнения количественных переменных (например, показатель ожирения, рассчитанный путем сопоставления массы тела и роста).

Слайд 51Выбранная измерительная шкала должна отвечать следующим условиям:
1)
соответствовать целям исследования. Например, шкала профессий будет
разной в зависимости от того, служит ли вид профессии критерием социального положения или критерием экспозиции к вредным факторам производственной среды;
2) быть практичной, т.е. удобной на этапе сбора информации;
3) быть достаточно «сильной», т.е. как можно более информативной и чёткой;
4) отдельные позиции шкалы должны быть точно определены. Например, если случаи болезни молено классифицировать по отдельным стадиям заболевания, то эти стадии необходимо учитывать;
5) шкала должна охватывать достаточное число категорий, чтобы не случалось потерь необходимой информации;
6) шкала должна быть исчерпывающей, охватывающей все возможные варианты классификации;
7) шкала должна быть однозначной (разъединяющей), то есть данная информация может быть включена только в один из выделенных классов. Например, возрастные группы до 40 лег, 40-49 лет, 50—59 лет и т.д.

Слайд 52Этапы планирования. Этап 5.
Этап 5. Выбор
методов сбора информации. На этом этапе определяют
способы получения данных в соответствии с составленной на предыдущем этапе программой наблюдения: устанавливают все источники информации и условия проведения исследования.
На этом же этапе разрабатываются все регистрационные бланки наблюдений.

Слайд 53Этапы планирования. Этап 6.
Этап 6. Определение
критериев отнесения наблюдаемых к «экспонированным» и «больным».
На данном этапе конкретизируют проверяемую гипотезу применительно к условиям исследования, четко сформулировав, что подразумевается под понятиями «экспонированные» и «больные». Понятие «экспонированные» должно характеризоваться совокупностью условий: тип контакта объекта наблюдения с изучаемым фактором риска, его продолжительность и интенсивность, свойства изучаемого фактора.
Определение критериев отнесения наблюдаемых лиц к «больным» зависит и от метода сбора информации. При использовании официальных материалов регистрации случаев заболеваний и случаев смерти следует только четко определить перечень изучаемых нозологических форм в соответствии с Международной классификацией болезней. Если источником информации служат истории болезни, то условия отнесения наблюдаемых к «больным» могут быть сформулированы более подробно.

Слайд 54Этапы планирования. Этап 7.
Этап 7. Определение
методов формирования групп наблюдения. На данном этапе
уточняется вид статистического наблюдения (сплошное или выборочное). Если проводят выборочное исследование, то определяют необходимую численность выборки и способы отбора наблюдаемых. Способы отбора должны обеспечивать прежде всего представительность наблюдаемых по отношению к популяции. Кроме этого, в аналитической эпидемиологии применяют методы направленного отбора, предназначенные для устранения влияния вмешивающихся факторов на результаты

Слайд 55Этапы планирования. Этап 8.
Этап 8. Выбор
методов обработки данных. Этот этап включает определение
методов измерения и оценки основных показателей состояния здоровья наблюдаемых контингентов и эффект изучаемого воздействия.

Слайд 56Достоверность эпидемиологических исследований

Слайд 57Ошибки
На правильность и достоверность результатов научных
исследований в биологии, медицине, физике, химии и
других наук, могут влиять ошибки, под которыми понимают разницу между действительным значением изучаемого признака и полученным результатом исследования этой характеристики. Чем больше полученный в исследовании результат отражает действительное значение исследуемой характеристики, тем он точнее.
В статистике могут возникнуть ошибки двух видов: репрезентативности и регистрации.

Слайд 58Ошибки репрезентативности
Ошибки репрезентативности характерны только для выборочного наблюдения
и возникают в результате того, что выборочная
совокупность не полностью воспроизводит генеральную. Они определяются как расхождение между значениями показателей, полученных по выборке, и значениями показателей этих же величин, которые были бы получены при проведенном сплошном наблюдении с одинаковой степенью точности.

Слайд 59Ошибки регистрации
— Случайные;
Систематические;
Непреднамеренные.

Слайд 60Случайные ошибки
Случайные ошибки — это отклонение результата
(отдельного наблюдения) в выборке от истинного значения
в популяции, обусловленное исключительно случайностью. Например, при измерении артериального давления могут возникнуть случайные ошибки, связанные с:
а) неправильно подобранной шириной манжетки;
б) неаккуратным ее закреплением;
в) с загрязнением и невертикальным положением тонометра;
г) способностью исследователя улавливать тоны сжимаемой артерии и т.д.
Случайная ошибка может иметь место на любом этапе исследования, ее никогда нельзя исключить полностью и следует обязательно учитывать при оценке результатов исследования. Случайные ошибки выявляются путем повторения измерения (наблюдения). Использование статистических данных помогает минимизировать случайную ошибку путем выбора оптимальных методов исследования и анализа данных. Если случайные ошибки невелики, то они в очень незначительной степени искажают (смещают) результаты исследования.

Слайд 61Систематические ошибки
О систематической ошибке говорят, когда результаты
т следования устойчиво воспроизводятся при повторении, но
дают неправильное представление об изучаемом явлении. Систематической ошибкой или смещением называется устойчивое отклонение результатов исследования от истинных показателей, связанное с несовершенством методики исследования на любой его стадии. Систематическая ошибка тенденциозно искажает характеристики (параметры) изучаемого признака в выборке и сторону уменьшения или увеличения.
Отличие систематической ошибки от случайной заключается и в том, что причины систематической коренятся в самой методике исследования, тогда как случайной — в вероятностном разбросе данных. Если случайная ошибка понижает способность исследования выявить имеющийся эффект, то систематическая может привести к однонаправленному искажению результата и принципиально неверному выводу.

Слайд 62Достоверность эпидемиологического исследования
Достоверность результатов, получаемых в ходе
эпидемиологического исследования, определяется главным образом отсутствием в
них систематической ошибки.
Принято различать две стороны этого понятия: внутренняя достоверность означает правильность результатов корректно проведенного исследования; внешняя — характеристика, отражающая, в какой мере результат измерения соответствует истинной величине из генеральной совокупности и может быть перенесен на другие аналогичные ситуации.

Слайд 63Основные категории систематических ошибок
Систематическая ошибка, обусловленная отбором;
Систематическая
ошибка, обусловленная вмешивающимися факторами;
Систематическая ошибка, обусловленная измерением.

Слайд 64Систематические ошибки отбора
обусловлены тем, что в изучаемую
группу не включены лица, относящиеся, но не
вошедшие в нее по разным причинам. В результате этого сравниваемые группы исследуемых различаются не только по главным изучаемым признакам, но и по другим факторам, влияющим на результат исследования.

Слайд 65Систематическая ошибка, обусловленная вмешивающимися факторами
Вмешивающийся фактор —
неучтённый, связанный с известным исследуемым фактором и
некоторым образом влияющий на результат (исход). Исследуемый и вмешивающиеся факторы достаточно тесно связаны, они как бы «ходят парой», и, если вмешивающиеся факторы не контролируются исследователями, полученный результат будет искажён.
Систематические ошибки при воздействии вмешивающихся факторов и систематические ошибки, возникающие при отборе, не исключают друг друга, но относятся к разным этапам исследования. Систематическая ошибка при отборе возникает при формировании групп наблюдения на этапе планирования исследования. Ошибки из-за вмешивающихся факторов должны учитываться при анализе данных по окончании исследования.

Слайд 66Систематическая ошибка, обусловленная измерением
возникает, когда в сравниваемых
группах пациентом применяются неодинаковые методы измерения: например,
различия в методах диагностики и классификации изучаемых состояний. Эти ошибки можно уменьшить, используя следующие приемы: критерии диагностики изучаемых исходов должны быть унифицированы, стандартны в исследуемых группах; исследователи должны с одинаковой тщательностью и точностью выявлять исходы во всех группах и не должны знать, к какой группе при надлежит каждый пациент.

Руководство по применению принципов биостатистики в клинических исследованиях лекарственных препаратов
Коллегия Евразийской экономической комиссии в соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая 2014 года, пунктом 3 статьи 3 и статьей 6 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года, а также в целях гармонизации предъявляемых к проведению клинических исследований лекарственных препаратов требований, установленных законодательством государств – членов Евразийского экономического союза, РЕКОМЕНДУЕТ
государствам – членам Евразийского экономического союза по истечении 6 месяцев с даты опубликования настоящей Рекомендации на официальном сайте Евразийского экономического союза при проведении клинических исследований лекарственных препаратов применять Руководство согласно приложению.
Врио Председатель Коллегии
Евразийской экономической комиссии
В.Назаренко
Приложение
к Рекомендации Коллегии
Евразийской экономической комиссии
от 3 ноября 2020 г. N 19
РУКОВОДСТВО
ПО ПРИМЕНЕНИЮ ПРИНЦИПОВ БИОСТАТИСТИКИ В КЛИНИЧЕСКИХ
ИССЛЕДОВАНИЯХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
I. Общие положения
1. Настоящее Руководство содержит указания для спонсоров в отношении планирования, проведения, анализа и оценки клинических исследований лекарственного препарата в процессе его клинической разработки, а также содержит указания по работе экспертов, ответственных за подготовку резюме по заявлению и оценку доказательства эффективности и безопасности лекарственного препарата, преимущественно по результатам клинических исследований на поздних фазах разработки лекарственного препарата.
2. В настоящем Руководстве описаны основные принципы применения биостатистики в клинических исследованиях лекарственных препаратов. Настоящее Руководство не содержит положений об использовании конкретных статистических процедур и методов. Практические шаги, обеспечивающие надлежащую реализацию указанных принципов, являются обязанностью спонсора. Настоящее Руководство содержит общие положения об интеграции данных из разных клинических исследований. Некоторые принципы и процедуры, касающиеся управления данными и мониторинга при проведении клинических исследований, содержатся в других актах органов Евразийского экономического союза.
3. Представленные принципы применимы для различных направлений клинических исследований лекарственных препаратов. В соответствии с Правилами надлежащей клинической практики Евразийского экономического союза, утвержденными Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 79, ответственность за статистическую работу, связанную с клиническими исследованиями лекарственных препаратов, возлагается на квалифицированного и опытного статистика. Роль и ответственность статистика клинического исследования в связке с другими специалистами по клиническому исследованию состоит в обеспечении правильного применения принципов биостатистики в клинических исследованиях, обосновывающих разработку лекарственного препарата.
4. В протоколе, написанном до начала проведения клинического исследования, необходимо четко изложить основные характеристики его дизайна, а также принципиальные особенности предлагаемого статистического анализа каждого клинического исследования. Полнота выполнения процедур, предусмотренных протоколом, и корректность планирования априори первичного анализа будет отражаться на корректности конечных результатов и выводов исследования. Протокол и последующие поправки подлежат одобрению персоналом, ответственным за данную деятельность, включая статистика клинического исследования. Статистик клинического исследования должен убедиться, что протокол и поправки охватывают все значимые статистические аспекты (с использованием соответствующей технической терминологии).
5. Принципы, изложенные в настоящем Руководстве, применимы в первую очередь к проведению клинических исследований на поздних этапах разработки лекарственных препаратов, многие из которых являются исследованиями, подтверждающими эффективность лекарственных препаратов. Кроме эффективности первичной переменной подтверждающих клинических исследований лекарственных препаратов может быть переменная безопасности (например, нежелательное явление, лабораторная переменная или электрокардиографический параметр), фармакодинамическая или фармакокинетическая переменная (как в случае проведения подтверждающего исследования биоэквивалентности). Более того, некоторые подтверждающие результаты могут быть получены за счет объединения данных разных исследований, поэтому некоторые принципы, предусмотренные настоящим Руководством, применимы к этой ситуации. Несмотря на то, что ранние фазы разработки лекарственного препарата состоят преимущественно из клинических исследований, имеющих поисковый характер (пункты 16 и 17 настоящего Руководства), статистические принципы, изложенные в настоящем Руководстве, применимы и для них. Принципы, изложенные в настоящем Руководстве, следует, по возможности, применять ко всем фазам клинической разработки.
6. Подходы, описанные в настоящем Руководстве, позволяют минимизировать систематические ошибки и максимизировать точность (прецизионность) статистических оценок. Следует максимально полно выявить потенциальные источники систематических ошибок для того, чтобы попытаться их ограничить. Наличие систематических ошибок может серьезно сказываться на способности получения достоверных выводов по результатам клинических исследований.
7. Некоторые источники систематических ошибок обусловлены дизайном исследования (например, такое распределение субъектов по группам исследования, при котором пациенты с низким риском систематически попадают в одну из групп). Другие источники систематических ошибок возникают во время проведения и анализа клинического исследования лекарственных препаратов. Например, нарушение протокола и исключение субъекта из анализа, основанное на знании конкретного исхода для этого субъекта, являются возможными источниками систематических ошибок, способными повлиять на правильную оценку эффекта вмешательства. Поскольку систематические ошибки могут возникать по неявным или неизвестным причинам, а их влияние не поддается прямому измерению, необходимо оценивать устойчивость полученных результатов и основных выводов исследования. Устойчивость полученных результатов и итоговых выводов подразумевает, что выполнение анализа на основании альтернативных предположений или аналитических подходов не оказывает существенного влияния на эффект вмешательства и первичные выводы исследования. Интерпретация статистических мер неопределенности эффекта вмешательства и сравнений вмешательств должна предусматривать учет потенциального вклада систематических ошибок в p-значение, доверительный интервал и выводы.
8. Поскольку преобладающие подходы к планированию и анализу клинических исследований лекарственных препаратов основывались на частотных статистических методах, при обсуждении проверки гипотез и (или) доверительных интервалов указания настоящего Руководства касаются использования преимущественно частотных методов статистического анализа. При этом допускается использование иных подходов к статистическому анализу и проверке гипотез, не основанных на частотных методах (байесовский подход и др., если основания для их использования четко определены, а получаемые результаты и выводы достаточно устойчивы.
II. Определения
9. Для целей настоящего Руководства используются понятия, которые означают следующее:
«байесовский подход» — подход к анализу данных, позволяющий получить апостериорное распределение вероятности некоторого параметра (например, эффекта вмешательства) на основании наблюдаемых данных и априорного распределения вероятности такого параметра и использующий полученное апостериорное распределение в качестве основы для статистического вывода;
«безопасность и переносимость» — безопасность лекарственного препарата, характеризующая медицинский риск для субъекта, обычно оцениваемый в клиническом исследовании с помощью лабораторных тестов (включая клиническую биохимию и гематологию), определения витальных признаков, клинических нежелательных явлений (заболеваний, симптомов и жалоб) и других специальных тестов на безопасность (например, электрокардиограмма, офтальмологическое обследование), а также переносимость лекарственного препарата характеризующая степень, с которой явные нежелательные реакции могут переноситься субъектом исследования;
«взаимодействие (качественное и количественное)» — случай, при котором контраст вмешательств (например, разница между исследуемым лекарственным препаратом и контрольным вмешательством) зависит от другого фактора (например, клинического центра, который участвует в исследованиях лекарственного препарата). Количественное взаимодействие обозначает случай, при котором величина контраста различается для разных уровней фактора, тогда как в случае качественного взаимодействия направление контраста различается по меньшей мере для одного уровня фактора;
«включенный термин» — термин низшего уровня в иерархическом словаре, с помощью которого кодируется описание, сделанное исследователем;
«выбывший субъект» — субъект клинического исследования, который по какой-то причине не смог продолжить исследование до последнего визита, предусмотренного для него протоколом исследования;
«генерализуемость», «генерализация (обобщаемость)» — степень, с которой данные клинического исследования можно надежно экстраполировать с субъектов исследования на более широкую популяцию пациентов с использованием более широкого диапазона клинических условий применения лекарственного препарата;
«двойное маскирование» — метод сохранения ослепления при распределении комплектов лекарственных препаратов для осуществления вмешательства при проведении клинического исследования в случае, если нельзя выполнить 2 идентичных вмешательства. Комплекты лекарственных препаратов готовят для вмешательства A (активный лекарственный препарат и неотличимое от него плацебо) и для вмешательства B (активный лекарственный препарат и неотличимое от него плацебо). Затем субъекты клинического исследования получают 2 вида вмешательств: либо активный лекарственный препарат A и плацебо B, либо плацебо A и активный лекарственный препарат B;
«исследование не меньшей эффективности (безопасности)» — исследование, основной целью которого является подтверждение того, что ответ на исследуемое вмешательство не является клинически менее выраженным относительно ответа на вмешательство сравнения (активного лекарственного препарата или плацебо);
«исследование превосходства» — исследование, основной целью которого является подтверждение того, что ответ на исследуемое вмешательство превосходит таковой на вмешательство сравнения (активный лекарственный препарат или плацебо-контроль);
«исследование эквивалентности» — исследование, основной целью которого является подтверждение того, что ответ на 2 или более вмешательства различается на величину, не являющуюся клинически значимой. Как правило устанавливается, если истинная разница между вмешательствами находится между нижней и верхней границами эквивалентности клинически приемлемых различий;
«метаанализ» — формализованная оценка количественных доказательств из 2 и более исследований, направленных на решение одного и того же вопроса. Наиболее часто предусматривает статистическое объединение сводных статистик различных исследований, но в некоторых случаях понятие также используется для обозначения объединения первичных данных;
«надежность повторной оценки одним экспертом» — получение эквивалентных результатов при проведении клинических исследований лекарственных препаратов с привлечением одного и того же эксперта (оценщика) в разных случаях;
«надежность повторной оценки разными экспертами» — получение эквивалентных результатов при проведении клинических исследований лекарственных препаратов с привлечением разных экспертов (оценщиков) в разных случаях;
«ослепленная проверка» — проверка и оценка данных за период между завершением клинического исследования лекарственных препаратов (последнее наблюдение последнего субъекта) и снятием ослепления в целях окончательной доработки плана анализа;
«переменная глобальной оценки» — единая переменная, обычно представляющая собой шкалу упорядоченных категориальных оценок (рейтингов), которая содержит объективные показатели и субъективное общее впечатление исследователя о состоянии или изменении состояния субъекта исследования;
«план статистического анализа» — документ, содержащий детализированное и описанное специализированным языком (с использованием технических терминов) изложение основных элементов анализа, указанного в протоколе, и включающий в себя детализированные процедуры проведения статистического анализа первичных и вторичных переменных, а также других данных;
«подтверждающее клиническое исследование» — клиническое исследование, при котором выполняется проверка заранее сформулированной гипотезы и которое контролируется в достаточной степени;
«полная анализируемая совокупность» — совокупность субъектов клинического исследования, которая максимально соответствует теоретической концепции (принцип «по намерению лечить») и формируется из совокупности всех рандомизированных субъектов клинического исследования за счет минимального и обоснованного исключения субъектов из исследования;
«предпочтительный термин» — термин в иерархическом словаре, объединяющий несколько включенных терминов и используемый для репортирования частоты возникновения какого-либо явления в рамках клинических исследований (например, обнаруженный исследователем у пациента симптом в виде боли в левой руке может быть закодирован с использованием термина «боль в суставе», который репортируется указывается в отчете в виде предпочтительного термина «артралгия»);
«принцип «по намерению лечить» — принцип, устанавливающий, что эффект вмешательства лучше всего оценивается с помощью анализа в зависимости от исходного намерения лечить субъект (то есть анализа запланированного режима вмешательства), а не от фактического режима вмешательства. В отношении субъектов исследования, распределенных в группу вмешательства, необходимо проводить наблюдение, оценку и анализ в составе исходной группы этого вмешательства (независимо от их фактического соответствия исходно запланированному курсу вмешательства);
«принцип «совокупность по протоколу», «валидные случаи», «выборка эффективности», «выборка поддающихся оценке субъектов» — принцип, устанавливающий, что эффект вмешательства лучше всего оценивается с помощью анализа фактического режима вмешательства (то есть анализа совокупности данных, полученных от подмножества субъектов, которые соответствовали требованиям протокола в достаточной степени для того, чтобы обеспечить способность полученных данных с высокой вероятностью отражать эффект вмешательства в соответствии с научной моделью исследования). Соответствие требованиям протокола включает в себя достижение субъектом клинического исследования необходимой степени вмешательства, доступность результатов измерений у данного субъекта и отсутствие серьезных нарушений данным субъектом требований протокола;
«промежуточный анализ» — анализ, направленный на сравнение групп вмешательств с точки зрения эффективности или безопасности в любой момент до завершения клинического исследования лекарственных препаратов;
«систематическая ошибка (статистическая и операционная)» — тенденция вызывать отклонения оценки эффекта вмешательства от его истинного значения систематически присущая любым факторам, связанным с дизайном, проведением, анализом и оценкой результатов клинических исследований лекарственных препаратов. Систематические ошибки, связанные с отклонениями при проведении клинического исследования, являются операционными, прочие систематические ошибки — статистическими;
«содержательная валидность» — степень пригодности оценок переменной (например, рейтинговой шкалы) для измерения изучаемого показателя;
«статистик клинического исследования» — статистик, имеющий образование, подготовку и опыт, достаточные для реализации принципов, изложенных в настоящем Руководстве, и ответственный за статистические аспекты исследования»;
«суррогатная переменная» — переменная, которая позволяет измерить эффект вмешательства непрямым способом в случаях, когда прямое измерение клинического эффекта вмешательства невозможно или практически невыполнимо;
«устойчивость» — степень чувствительности итоговых выводов к различным ограничениям в данных, статистическим допущениям и подходам к анализу данных;
«характеристическое отсутствие» — значение переменной, которое однозначным образом определяет либо отсутствие некоторого состояния (например, подтверждает отсутствие заболевания), либо подтвержденное отсутствие сведений о показателе (например, запланированный вариант ответа «не знаю» или «нет информации» наряду с ответами «есть» и «нет»). В отличие от пропущенного значения, которое может быть восполнено разными способами, характеристическое отсутствие однозначным образом определяет значение показателя;
«частотные (статистические) методы» — статистические методы, в которых используются критерии значимости и доверительные интервалы, которые можно интерпретировать с точки зрения частоты определенных исходов, наступающих в гипотетических повторных реализациях одной и той же экспериментальной ситуации;
«эффект вмешательства» — эффект, объясняемый действием вмешательства в клиническом исследовании лекарственного препарата. В большинстве клинических исследований искомый эффект вмешательства представляет собой сравнение (или контраст) 2 и более вмешательств;
«явление, возникшее при вмешательстве» — явление, возникшее у субъекта во время вмешательства (при его отсутствии до вмешательства) или усугубившееся по сравнению с состоянием субъекта до вмешательства.
Иные понятия, используемые в настоящем Руководстве, применяются в значениях, определенных Правилами надлежащей клинической практики Евразийского экономического союза.
III. Статистические принципы при составлении программы
клинической разработки лекарственного препарата
1. Контекст исследования
План разработки
10. Процесс клинической разработки нового лекарственного препарата осуществляется с целью выяснить, существуют ли диапазон доз и режим дозирования, при которых можно показать одновременную безопасность и эффективность лекарственного препарата в такой степени, что соотношение «польза — риск» будет приемлемым, а также определить субъектов исследования, которым лекарственный препарат может принести пользу, и показания к его применению.
11. Достижение указанных в пункте 10 настоящего Руководства целей обычно требует упорядоченной программы клинических исследований (программы клинической разработки), каждое из которых имеет свои цели, в соответствии с Руководством по общим вопросам клинических исследований (приложение к Рекомендации Коллегии Евразийской экономической комиссии от 17 июля 2018 г. N 11). Программу клинической разработки следует изложить в разделе 2.5 модуля 2 регистрационного досье лекарственного препарата (с указанием соответствующих временных точек принятия решений, позволяющих с достаточной гибкостью проводить модификации клинической разработки по мере накопления информации).
12. В регистрационном досье лекарственного препарата необходимо четко описать основные этапы программы и вклад в достижение поставленных целей, вносимый каждым исследованием. Интерпретация и оценка доказательств, полученных в рамках программы исследований, предусматривают синтез доказательств из отдельных исследований (в соответствии с подразделом 2 раздела VIII настоящего Руководства). Для облегчения синтеза доказательств необходимо использование стандартных характеристик исследований (например, словарей медицинских терминов, формулировок и сроков оценки основных измерений, процедур обработки отклонений от протокола и т.д.). Если медицинские вопросы освещаются в нескольких исследованиях, могут быть информативны такие методы синтеза информации, как статистическое резюме, обзор или метаанализ. По возможности эти вопросы необходимо представить в плане анализа, чтобы указать все соответствующие исследования и заранее определить все необходимые общие элементы дизайнов исследований. В указанном плане необходимо осветить другие существенные статистические проблемы (при наличии), способные повлиять на ряд исследований, включенных в общий план.
Подтверждающее клиническое исследование
13. Подтверждающие клинические исследования необходимы для получения надежного доказательства эффективности или безопасности исследуемого лекарственного препарата. В таких исследованиях ключевая интересующая гипотеза напрямую следует из основной цели исследования, она заранее сформулирована и является гипотезой, которая впоследствии проверяется по завершении исследования. В подтверждающем исследовании одинаково важно оценить с должной точностью (прецизионностью) величину эффектов, связанных с интересующим вмешательством, и сопоставить эти эффекты с их клинической значимостью.
14. Подтверждающие клинические исследования направлены на получение однозначного доказательства для подтверждения соответствующих гипотез (утверждений), поэтому степень соблюдения протокола и стандартных операционных процедур особенно важна. Все неизбежные изменения необходимо объяснять и описывать с одновременной оценкой их влияния. В протоколе клинического исследования необходимо представить обоснование дизайна каждого такого исследования и таких важных статистических аспектов, как основные параметры планируемого анализа. Каждое исследование должно касаться строго ограниченного круга вопросов.
15. Надежное доказательство для подтверждения соответствующих гипотез подразумевает, что результаты подтверждающих клинических исследований будут свидетельствовать о наличии у исследуемого лекарственного препарата клинической пользы. В связи с этим подтверждающие клинические исследования должны быть достаточными для четкого и однозначного ответа на каждый клинический вопрос, соответствующий гипотезам об эффективности или безопасности исследуемого лекарственного препарата. Кроме того, следует предоставить объяснение и основание для обобщения (генерализации) результатов в отношении целевой популяции пациентов; это может также оказать влияние на необходимые количество и вид клинических центров (например, специализированные или общей практики) и (или) исследований. Результаты подтверждающего клинического исследования (исследований) должны быть устойчивыми. В некоторых случаях достаточно существенными могут оказаться доказательства, основанные на результатах одного подтверждающего клинического исследования.
Поисковое клиническое исследование
16. Научное обоснование и дизайн подтверждающих клинических исследований следует основывать на предыдущей клинической работе, проведенной в рамках серий поисковых исследований. Как и все клинические исследования, поисковые исследования должны иметь четкие и конкретные цели. Вместе с тем в противоположность подтверждающим клиническим исследованиям их цели не всегда могут сводиться к простой проверке заранее сформулированных гипотез. Кроме того, поисковые клинические исследования зачастую нуждаются в более гибком подходе к планированию, для того чтобы можно было вносить изменения в план исследования по мере накопления результатов. Их анализ может заключаться в разведочной оценке данных. Могут проводиться и проверки гипотез, но выбор гипотезы при этом может непосредственно зависеть от полученных данных. Подобные исследования не могут служить основой для формального подтверждения эффективности, хотя они могут вносить вклад в общую совокупность соответствующих доказательств.
17. Любое клиническое исследование может включать в себя как подтверждающие, так и поисковые элементы. Например, в большинстве подтверждающих клинических исследований данные также подвергаются поисковому анализу, который служит основанием для объяснения или является дополнительным аргументом в поддержку их основных результатов, а также для выработки новых гипотез для последующих изысканий. В протоколе клинического исследования необходимо четко разграничить аспекты исследования, которые будут использованы для подтверждающего доказательства, и аспекты, которые будут основой для поискового анализа.
2. Предмет клинических исследований
лекарственных препаратов
Популяция
18. В более ранние фазы разработки лекарственного препарата на выбор субъектов клинического исследования может оказывать сильное влияние желание максимизировать вероятность выявления специфичных искомых клинических эффектов, вследствие чего субъекты могут набираться из очень узкой подгруппы всей популяции пациентов, которой в итоге может быть показано назначение лекарственного препарата. Вместе с тем при проведении подтверждающих клинических исследований субъекты исследований должны наиболее полно соответствовать требованиям, предъявляемым к целевой популяции для вмешательства. В таких исследованиях обычно целесообразно максимально снизить жесткость критериев включения и невключения в целевую популяцию, сохраняя при этом достаточную однородность популяции, необходимую для точной (прецизионной) оценки эффекта вмешательства. По результатам одного клинического исследования нельзя сделать вывод о всей группе пациентов, для которых будет предназначен исследуемый лекарственный препарат (в силу возможных влияний их местоположения, времени проведения клинического исследования, медицинских практик конкретных исследователей и клиник и т.д.). Вместе с тем влияние подобных факторов в процессе клинического исследования лекарственного препарата следует по возможности минимизировать и проанализировать при интерпретации результатов клинического исследования.
Первичные и вторичные переменные
19. Первичной переменной («целевой» переменной, первичной конечной точкой) должна быть переменная, способная представить наиболее клинически значимое и надежное доказательство, напрямую связанное с первичной целью исследования. Как правило, используется одна первичная переменная. Обычно в качестве первичной переменной выбирают переменную эффективности, поскольку первичная цель большинства подтверждающих клинических исследований лекарственных препаратов состоит в получении научного доказательства их эффективности. В некоторых случаях первичной переменной могут быть безопасность и (или) переносимость, которые всегда являются важным аспектом исследования. Параметры, касающиеся качества жизни и фармакоэкономики, также могут быть первичными переменными.
20. Выбор первичной переменной должен соответствовать нормам и стандартам в соответствующей области медицины. Рекомендуется использовать надежную и валидированную переменную, данные о которой получены в предыдущих исследованиях или опубликованы в научной литературе. Следует представить достаточные доказательства того, что первичная переменная является валидной и надежной мерой клинически значимого эффекта и пользы вмешательства для популяции пациентов, описываемой с помощью критериев включения и невключения субъектов в исследование. Первичную переменную следует использовать для определения размера выборки (в соответствии с подразделом 5 раздела IV настоящего Руководства), если не обоснован иной подход.
21. Во многих случаях подход к оценке исходов вмешательства может быть неочевидным и должен быть тщательно регламентирован (например, недопустимо без соблюдения дополнительных условий выбирать смертность в качестве первичной переменной; смертность можно оценивать путем сравнения доли живых в фиксированных временных точках или сопоставления общего распределения времени выживания в течение установленного периода). Другим распространенным примером является повторяющееся событие, мерой эффекта вмешательства может быть простая дихотомическая переменная (любое возникновение события в течение установленного промежутка времени), время до первого возникновения события, частота возникновения (число событий за единицу времени) и т.д.
22. Если в качестве первичной переменной выбрана оценка функционального статуса субъекта исследования, то проведение ее оценки в динамике в процессе изучения эффекта вмешательства при хронических заболеваниях вызывает затруднения. Существует много подходов к осуществлению этой оценки (например, сравнение оценок, выполненных в начале и в конце наблюдения, сравнение для регрессионных прямых углов наклона, рассчитанных с помощью всех оценок в течение всего периода наблюдения, сравнение доли субъектов со значениями показателей, превышающими определенный порог или опускающимися ниже определенного порога, или сравнение с использованием методов, применяемых для повторных измерений данных). Во избежание проблем множественности при тестировании гипотез, возникающих в связи с проведением апостериорных сравнений, в протоколе клинического исследования лекарственных препаратов очень важно дать точное определение первичной переменной, которое будет использоваться для статистического анализа. Кроме того, в протоколе клинического исследования следует описать и обосновать клиническую значимость выбранной первичной переменной и валидность связанных процедур измерения.
23. В протоколе клинического исследования необходимо указать первичную переменную (с обоснованием ее выбора). Переформулировка первичной переменной после снятия ослепления почти всегда будет недопустима, поскольку привносимые вследствие этого систематические ошибки трудно поддаются оценке. Если клинический эффект вмешательства, определенный основной целью, будет измеряться с использованием нескольких методов, в протоколе клинического исследования один из методов измерений необходимо указать в качестве первичной переменной на основании клинической значимости, важности, объективности и (или) других применимых характеристик — во всех случаях осуществимости такого выбора.
24. Вторичными переменными являются либо вспомогательные измерения, связанные с первичной целью клинического исследования, либо измерения эффектов, связанные с вторичными целями. Их также следует предварительно сформулировать в протоколе клинического исследования и объяснить их относительную важность и вклад в интерпретацию результатов исследования. Число вторичных переменных может быть ограничено и соответствовать ограниченному числу вопросов, на которые будет отвечать исследование.
Составные переменные клинического исследования
25. Если из множества параметров, связанных с основной целью клинического исследования, невозможно выбрать одну первичную переменную, другой допустимой стратегией является интеграция или комбинирование нескольких параметров в одну «составную» переменную с помощью заранее выработанного алгоритма. В некоторых случаях первичная переменная действительно представляет собой комбинацию нескольких клинических параметров (например, рейтинговые шкалы при артрите, психических расстройствах и др.). При применении такого подхода решается проблема множественности без необходимости корректировки ошибки I рода.
26. Метод комбинирования нескольких измерений необходимо описать в протоколе клинического исследования, а интерпретацию получаемой шкалы представить с точки зрения величины клинически значимой пользы вмешательства. Если составная переменная используется в качестве первичной, компоненты такой переменной иногда допускается анализировать отдельно (в случае, если это клинически оправдано и валидировано). Если в качестве первичной переменной используется рейтинговая шкала, особенно важно рассмотреть такие факторы, как содержательная валидность, надежность повторных оценок одним или разными экспертами, а также оперативность (скорость реакции) и чувствительность (величину изменения) в отношении изменения тяжести заболевания.
Переменные глобальной оценки в клиническом исследовании
27. В некоторых случаях для измерения совокупной безопасности, совокупной эффективности и (или) совокупной пользы вмешательства разрабатываются переменные глобальной оценки. Такая переменная объединяет в себе объективные переменные и общее впечатление исследователя о состоянии или изменении состояния субъекта исследования и обычно представляет собой шкалу упорядоченных категориальных рейтинговых оценок. В таких областях медицины, как неврология и психиатрия, глобальные оценки совокупной эффективности хорошо проработаны.
28. Переменные глобальной оценки обычно имеют в своем составе субъективный компонент. При использовании переменной глобальной оценки в качестве первичной или вторичной переменной в протокол исследования необходимо включить более подробные сведения о шкале в отношении:
а) значимости шкалы для оценки первичной цели исследования;
б) основания для признания валидности и надежности шкалы;
в) способы работы с данными, полученными в отношении отдельного субъекта, с целью его отнесения к конкретной категории по такой шкале;
г) способы отнесения субъектов с отсутствующими данными к определенной категории (варианту ответа) шкалы измерения или иного способа их оценки.
29. Если при осуществлении глобальной оценки исследователем рассматриваются объективные переменные, то такие переменные необходимо рассматривать в качестве дополнительных первичных или по меньшей мере важных вторичных переменных.
30. Глобальная оценка объединяет показатели как пользы, так и риска, возникающих при вмешательстве, и отражает процесс принятия решений лечащим врачом, который должен сопоставить пользу и риск при принятии решений о назначении препарата. Недостаток переменных глобальной оценки полезности заключается в том, что их использование в некоторых случаях может приводить к признанию 2 препаратов эквивалентными, несмотря на сильно различающиеся профили полезных и нежелательных реакций. Например, признание полезности исследуемого вмешательства как эквивалентной или превосходящей полезность альтернативного вмешательства может маскировать тот факт, что изучаемое вмешательство обладает небольшой эффективностью (или не обладает эффективностью) при меньшем числе нежелательный реакций. В связи с этим переменную глобальной оценки не рекомендуется использовать в качестве первичной переменной. Если глобальная полезность указана в качестве первичной, необходимо отдельно предусмотреть специфичные исходы эффективности и безопасности в качестве дополнительных первичных переменных.
Множественные первичные переменные
клинического исследования
31. В определенных ситуациях желательно использовать несколько первичных переменных, каждая из которых (или подмножество которых) могла бы быть достаточной для описания спектра эффектов при применении методов терапии. Необходимо детально описать запланированный способ интерпретации доказательства такого рода. Должно быть пояснено, достигается ли цель исследования при доказанном влиянии хотя бы на одну из переменных, на определенное их число или же на все переменные. Необходимо четко указать первичную гипотезу или гипотезы и изучаемые оценки (например, среднее, доля, распределение) в отношении выбранных первичных переменных и описанного подхода к статистическому выводу (формулировке статистического заключения). Вследствие потенциальной проблемы множественности необходимо объяснить влияние проводимых сравнений на ошибку I рода (в соответствии с подразделом 6 раздела VI настоящего Руководства), в протоколе клинического исследования необходимо указать способ контроля ошибки I рода. При оценке влияния множественных сравнений на ошибку I рода можно проанализировать степень взаимной корреляции между предлагаемыми первичными переменными. Если цель клинического исследования состоит в подтверждении влияния на все выбранные первичные переменные, то введение поправки для ошибки I рода не требуется, однако необходимо подробно проанализировать влияние множественности сравнений на ошибку II рода и размер выборки.
Суррогатные переменные
32. При отсутствии практической возможности прямой оценки клинической пользы вмешательства для субъекта исследования посредством наблюдения за фактической клинической эффективностью допускается предусмотреть косвенные критерии — суррогатные переменные. Для ряда показаний используются общепринятые суррогатные переменные, которые, как считается, являются надежными прогностическими показателями клинической пользы. При использовании суррогатной переменной возникают два опасения. Во-первых, такая переменная может не являться истинным прогностическим фактором для интересующего клинического исхода. Например, она может измерять активность вмешательства, связанную с одним специфичным фармакологическим механизмом, но не давать полной информации о спектре действий и ключевых эффектах вмешательства (как положительных, так и отрицательных). Существует множество примеров, когда вмешательства, показывавшие выраженное благотворное влияние на предлагаемую переменную, в итоге оказывались пагубными для клинического исхода у субъектов исследования, и, наоборот, есть примеры вмешательств, приносящих клиническую пользу без поддающегося измерению влияния на предлагаемые суррогатные переменные. Во-вторых, суррогатные переменные могут не соотноситься с величиной клинической пользы, которую можно было бы напрямую сопоставить с нежелательными реакциями. Предложены статистические критерии валидации суррогатных переменных, но опыт их использования относительно ограничен. На практике надежность суррогатной переменной зависит от следующих факторов:
биологическая убедительность взаимосвязи между клинической эффективностью и суррогатной переменной;
подтверждение в эпидемиологических исследованиях прогностической ценности переменной выбранной в качестве суррогатной переменной для оценки клинического исхода;
доказательство на основе ранее проведенных клинических исследований того, что влияние вмешательства на суррогатную переменную соотносится с влиянием вмешательства на клинический исход.
Зависимость между клинической эффективностью и суррогатными переменными для одного лекарственного препарата необязательно будет применима при лечении одного и того же заболевания к лекарственному препарату с другим механизмом действия.
Категориальные переменные клинического исследования
33. При необходимости в клиническом исследовании для непрерывных или порядковых переменных допускается применение подхода с дихотомической категоризацией исследуемой переменной или введение иного вида категоризации. Наиболее распространенной дихотомической категоризацией является использование критериев «успех — неуспех» или «ответ на лечение — отсутствие ответа на лечение». При использовании дихотомических критериев требуются:
точная формулировка (например, указания минимального процента улучшения (по сравнению с исходным значением) в случае их использования для оценки непрерывной переменной);
указание величины, соответствующей некоторому пороговому уровню, превышение которого позволяет выставить соответствующую категорию (например, «хороший»), в случае применения порядковой рейтинговой шкалы. Примером применения порогового уровня является использование значения диастолического давления, равного 90 мм рт. ст., относительно которого происходит дихотомическая категоризация степени снижения давления («ответ на лечение — отсутствие ответа на лечение»).
Категоризация переменных применяется в случае, если это позволяет оценить клиническую пользу вмешательства. Критерии категоризации необходимо заранее сформулировать и описать в протоколе клинического исследования, так как знание результатов исследования может послужить источником систематической ошибки при выборе критериев категоризации. Категоризация переменных обычно подразумевает некоторую потерю информации, и следствием этого является снижение статистической мощности при анализе данных, что необходимо учитывать при расчете размера выборки.
3. Методы планирования в целях минимизации
систематических ошибок
34. Наиболее важными методами планирования в целях минимизации систематических ошибок при проведении клинических исследований являются ослепление и рандомизация, которые должны быть стандартными элементами большинства контролируемых клинических исследований, сведения о которых включаются в регистрационное досье лекарственного препарата. В большинстве таких исследований используется метод двойного ослепления, при котором комплекты для осуществления вмешательства заранее упаковываются и доставляются в центр (центры), маркированные только номером субъекта и номером периода терапии так, чтобы ни одному из участников исследования не было известно о вмешательстве, назначенном конкретному субъекту исследования (даже в виде кодовой буквы). Указанный подход описывается в пунктах 38 — 43 настоящего Руководства.
35. Систематические ошибки можно также снизить на этапе планирования клинического исследования за счет включения в протокол клинического исследования процедур, направленных на минимизацию ожидаемых отклонений при проведении исследования, которые могли бы отрицательно повлиять на анализ (включая различные виды нарушений протокола, наличие исключенных субъектов и отсутствующих значений). Протокол клинического исследования должен предусматривать как способы снижения частоты подобных проблем, так и методы обработки последствий таких проблем на этапе анализа данных.
Метод ослепления (маскировки)
36. Метод ослепления (маскировки) направлен на ограничение возникновения осознанных или неосознанных систематических ошибок при проведении и интерпретации результатов клинического исследования, связанных с влиянием исходного знания вида изучаемого вмешательства в каждой группе субъектов исследования на:
а) привлечение субъектов в клиническое исследование;
б) распределение субъектов исследования по группам;
в) последующее оказание субъектам исследования медицинской помощи;
г) отношение субъектов к изучаемым вмешательствам;
д) оценку конечных точек;
е) обработку данных, полученных от исключенных из исследования субъектов;
ж) исключение данных из анализа;
з) прочие аспекты клинического исследования и статистическую оценку.
37. Основополагающей целью метода ослепления (маскировки) является предотвращение идентификации вмешательств до тех пор, пока не будет исключена возможность возникновения систематических ошибок.
38. Двойное слепое исследование представляет собой исследование, в котором ни субъект исследования, ни кто-либо из исследователей или персонала спонсора, участвующих в осуществлении вмешательства или клинической оценке субъектов (включая любое лицо, определяющее соответствие субъектов критериям отбора, оценивающее конечные точки или проверяющее соответствие протоколу клинического исследования), не обладают сведениями о получаемом субъектом вмешательстве. Такая степень ослепления поддерживается на протяжении всего исследования, и только после достижения приемлемого уровня качества очистки данных ослепление соответствующего персонала снимается. Если требуется снятие ослепления кода вмешательства для кого-либо из персонала спонсора, не участвующего в осуществлении вмешательства или клинической оценке субъектов (например, для биоаналитиков, аудиторов, лиц, участвующих в репортировании сведений о серьезных нежелательных явлениях), спонсор обязан использовать соответствующие стандартные операционные процедуры для защиты от ненадлежащего распространения информации о кодах вмешательств. В простом слепом исследовании исследователь и (или) его персонал (но не субъект) осведомлены о вмешательстве, или наоборот. В открытом исследовании вариант вмешательства известен всем. Оптимальным подходом является двойное слепое исследование, при котором применяемые в исследовании вмешательства неотличимы друг от друга (по внешнему виду, вкусу и др.) как до, так и во время применения, и ослепление поддерживается во время всего исследования.
39. Достижению максимального уровня двойного ослепления могут препятствовать следующие факторы:
природа вмешательств может полностью различаться (например, хирургия и фармакотерапия);
2 лекарственных препарата могут иметь разные рецептуры, и хотя их и можно сделать неотличимыми за счет использования капсулы, изменение рецептуры может также изменить фармакокинетические и (или) фармакодинамические свойства и тем самым потребовать подтверждения их биоэквивалентности;
суточный режим назначения 2 вмешательств может различаться.
Один из способов достижения двойного ослепления в указанных случаях состоит в использовании метода «двойного плацебо». Этот метод иногда вынуждает прибегать к настолько нестандартным режимам применения лекарственного препарата или метода лечения, что может отрицательно сказаться на мотивации и соответствии субъектов протоколу клинического исследования. Его использованию могут также препятствовать проблемы этического характера (например, использование имитации хирургического вмешательства для обеспечения необходимой степени ослепления (маскировки) видов вмешательств). Все вышеперечисленные случаи не являются основанием для отказа от использования метода двойного ослепления по формальному признаку.
40. Двойной слепой характер некоторых клинических исследований может быть частично нарушен явными эффектами, индуцируемыми вмешательством. В подобных случаях надежность ослепления можно повысить за счет ослепления исследователей и вовлеченного в исследование персонала спонсора в отношении результатов некоторых тестов (например, определенных лабораторных показателей). В исследованиях, в которых уникальные или специфичные эффекты вмешательства могут приводить к снятию ослепления отдельных субъектов, необходимо предусмотреть подходы к минимизации систематических ошибок, аналогичные применяемым в открытых исследованиях.
41. Если двойное ослепление невыполнимо, следует рассмотреть возможность использования простого ослепления. В некоторых случаях с практической или этической точки зрения возможно проведение только открытого исследования. При проведении простых слепых и открытых исследований обеспечивается большая гибкость, однако важно, чтобы знание исследователем предстоящего вмешательства не повлияло на решение о включении субъекта в исследование. Такое решение должно предшествовать знанию о рандомизированном вмешательстве. В случае проведения таких исследований для организации назначения рандомизируемого вмешательства целесообразно предусмотреть централизованный метод рандомизации, (например, телефонная рандомизация). Кроме того, клиническая оценка осуществляется медицинским персоналом, который не вовлечен в лечение субъектов и который остается ослепленным по отношению к вмешательству.
42. В простых слепых и открытых исследованиях необходимо прилагать все усилия к минимизации известных источников систематических ошибок, а первичные переменные должны быть максимально объективными. В протоколе клинического исследования должны быть описаны причины выбора вида ослепления наряду с мерами, принимаемыми для минимизации систематических ошибок другими способами. Например, спонсор должен использовать соответствующие стандартные операционные процедуры, обеспечивающие достаточное ограничение доступа к коду вмешательства во время очистки базы данных перед передачей ее для анализа.
43. Снятие ослепления (с отдельного субъекта исследования) допускается, только в случае, если знание назначенного вмешательства сочтено лечащим врачом обязательным для оказания помощи субъекту. Сведения о каждом намеренном или непреднамеренном снятии ослепления необходимо указать в отчете и объяснить по завершении исследования (независимо от причин возникновения). Необходимо документировать процедуру и сроки раскрытия кода назначенных вмешательств.
Рандомизация
44. Рандомизация вводит умышленный элемент случайности при назначении вмешательств субъектам в клиническом исследовании. Во время последующего анализа данных исследования она создает прочную статистическую основу для количественной оценки доказательств, относящихся к эффектам вмешательства, а также способствует получению групп вмешательств со схожими распределениями прогностических факторов (как известных, так и неизвестных). Вместе с ослеплением рандомизация помогает избежать возможных систематических ошибок при выборе субъектов и распределении их по группам, которые возникают вследствие предсказуемости назначаемых вмешательств.
45. В схеме рандомизации клинического исследования документально закрепляется случайное распределение вмешательств субъектам исследования. В наиболее простом случае это последовательный перечень вмешательств (или их последовательность в перекрестном исследовании) или соответствующих кодов по номеру субъекта исследования. Логистика некоторых исследований (например, имеющих фазу скрининга) может усложнить рандомизацию, однако конкретизированное и заранее спланированное назначение вмешательства или последовательности вмешательств субъекту должно быть четко описано. Разные дизайны исследований требуют разных процедур генерации схем рандомизации. Схема рандомизации должна быть воспроизводима в случае необходимости.
46. Несмотря на то, что простая или неограниченная рандомизация является допустимым подходом, некоторых преимуществ можно, как правило, добиться за счет блоковой рандомизации (рандомизации субъектов в блоки). Она помогает повысить сопоставимость групп вмешательств, особенно если характеристики субъектов могут со временем изменяться (например, в результате изменений тактики привлечения), а также обеспечивает надежную гарантию того, что группы вмешательств будут приблизительно равного размера. В перекрестных исследованиях она позволяет добиться получения сбалансированных дизайнов, характеризующихся повышенной эффективностью и более простой интерпретацией результатов. Необходимо тщательно подбирать длину блоков, чтобы они были достаточно короткими для ограничения потенциальной несбалансированности, но достаточно длинными, чтобы избежать предсказуемости в конце последовательности в блоке.
47. Исследователи и другой вовлеченный в клиническое исследование персонал, как правило, должны быть ослеплены в отношении длины блока. Той же цели можно достичь, используя две или более длины блоков, случайно выбираемых для каждого блока (теоретически в двойном слепом исследовании предсказуемость обычно не играет роли, однако фармакологические эффекты лекарственных препаратов могут дать возможность делать предположения, основанные на изучении закономерности).
48. В многоцентровых исследованиях необходимо организовать централизованную процедуру рандомизации. Рекомендуется использовать отдельную случайную схему рандомизации для каждого центра, то есть проводить стратификацию по центрам или распределять несколько полных блоков в каждый центр. В более общем смысле стратификация по важным прогностическим факторам, измеряемым в исходном состоянии, то есть до начала вмешательства (например, тяжесть заболевания, возраст, пол и др.), может оказаться ценным способом улучшения сбалансированности распределения в пределах страт. Она имеет большую потенциальную пользу в небольших исследованиях.
49. Использование более двух или трех факторов стратификации редко требуется, поскольку в такой ситуации сложно достичь баланса и это логистически проблематично. Использование процедуры динамического распределения, предусмотренной пунктом 52 настоящего Руководства может помочь сбалансировать одновременно по нескольким факторам стратификации при условии, что остальные процедуры исследования удастся адаптировать с учетом подобного подхода. Факторы, для которых была стратифицирована рандомизация, следует учитывать в ходе последующего анализа.
50. Очередной рандомизируемый в исследование субъект должен всегда получать вмешательство, соответствующее очередному свободному номеру в соответствующей схеме рандомизации (и в соответствующей страте, если рандомизация стратифицированная). Присваивать очередному субъекту исследования соответствующий номер и связанное с ним вмешательство необходимо только после подтверждения вступления такого субъекта в рандомизированную часть исследования.
51. В протоколе исследования не должно содержаться настолько подробного описания рандомизации, чтобы оно позволило бы предсказывать группу распределения (например, указания длины блоков). Спонсор или независимая третья сторона обязаны хранить саму схему рандомизации в закрытом доступе, обеспечивающем сохранение ослепления на протяжении всего исследования. Доступ к схеме рандомизации во время исследования должен учитывать возможность того, что в экстренном случае может потребоваться снятие ослепления с любого субъекта. В протоколе клинического исследования необходимо описать используемую процедуру, необходимую документацию, а также последующее лечение и оценку субъекта.
52. Динамическое распределение является альтернативной по отношению к рандомизации процедурой, при которой на назначение вмешательства субъекту влияет текущий баланс распределенных вмешательств, а также (в случае стратифицированного исследования) — страта, к которой принадлежит субъект, и баланс внутри нее. Необходимо избегать процедур динамического распределения, основанных на заранее определенных (детерминированных) алгоритмах, и для каждого назначенного вмешательства внедрить соответствующий элемент рандомизации. Для сохранения двойного ослепления исследования необходимо приложить максимум усилий. Например, знать код вмешательства могут только работники центрального офиса исследования, из которого осуществляется контроль за динамическим распределением, как правило, с помощью телефонного контакта. Это, в свою очередь, позволяет выполнить дополнительные проверки соответствия критериям отбора и упорядочивает вход в исследование и иные факторы важные для определенных разновидностей многоцентровых исследований. Тогда можно следовать обычной системе предварительной упаковки и маркировки запасов лекарственных препаратов для двойных слепых исследований, однако порядок их применения перестает быть последовательным. Желательно использовать соответствующие компьютерные алгоритмы, чтобы работники центрального офиса исследования оставались ослепленными в отношении кода вмешательства. При планировании динамического распределения необходимо тщательно оценить сложность логистики и потенциальное влияние динамического распределения на анализ.
IV. Дизайн клинического исследования
1. Выбор дизайна
Дизайн в параллельных группах
53. Наиболее распространенным дизайном подтверждающих клинических исследований является дизайн в параллельных группах, в котором субъекты исследования рандомизируются в две или более группы, при этом каждой группе назначаются разные вмешательства, которые включают в себя исследуемый препарат в одной или более дозах, а также одно или более контрольных вмешательств, таких как плацебо и (или) активный компаратор.
54. Предположения, лежащие в основе указанного дизайна, менее сложные, чем в случае большинства других дизайнов. Вместе с тем, как и при других видах дизайнов, возможны дополнительные особенности исследования, осложняющие анализ и интерпретацию (например, ковариаты, повторные измерения в динамике, взаимодействие между факторами дизайна, нарушения протокола, наличие выбывших и исключенных из исследования субъектов.
Перекрестный дизайн
55. При перекрестном дизайне каждый субъект рандомизируется в последовательность из двух или более вмешательств, в результате чего он является своим собственным контролем для сравнения вмешательств. Преимущества этого подхода в том, что он уменьшает число субъектов и обычно число оценок, необходимых для достижения определенной мощности, иногда в значительной степени. В простейшем перекрестном дизайне 2 x 2 каждый субъект получает два вмешательства в рандомизированном порядке в ходе 2 последовательных периодов вмешательства, часто разделенных отмывочным периодом. Наиболее распространенное его расширение предусматривает сравнение n (n > 2) вмешательств в n периодах, при этом каждый субъект получает все n вмешательства. Существуют многочисленные вариации дизайнов, в том числе при которых каждый субъект получает подмножество n (n > 2) вмешательств, или такие, при которых вмешательства повторяются в отношении одного субъекта.
56. Для перекрестных дизайнов характерен ряд проблем, которые могут привести к несостоятельности их результатов. Основным затруднением является перенос, то есть остаточное влияние вмешательств в последующих периодах вмешательств. В аддитивной модели влияние различающегося между группами переноса приводит к систематическим ошибкам в прямых сравнениях вмешательств. В перекрестном дизайне 2 x 2 эффект переноса невозможно статистически отличить от эффекта взаимодействия между вмешательством и периодом, а проверка на значимость любого из этих эффектов не обладает достаточной мощностью, поскольку соответствующий контраст является межиндивидуальным. Эта проблема менее выражена в случае использования дизайнов более высоких порядков, но ее нельзя полностью игнорировать. В связи с этим при использовании перекрестного дизайна важно избегать переноса. Проще всего этого достичь при помощи тщательного выбора дизайна на основе знаний как о заболевании, так и о новом лекарственном препарате. Исследуемое заболевание должно иметь хроническое и стабильное течение. Искомые эффекты лекарственного препарата должны полностью проявиться в течение периода вмешательства. Отмывочные периоды должны быть достаточно продолжительными для полной обратимости эффектов лекарственного препарата. Факт того, что указанные условия, скорее всего, будут выполнены, необходимо установить до исследования, опираясь на предыдущие сведения и данные.
57. Существуют ряд дополнительных проблем, требующих внимания при использовании перекрестных дизайнов. Наиболее значимой из них является усложнение анализа и интерпретации результатов клинического исследования вследствие потери субъектов. Кроме того, потенциальный перенос затрудняет отнесение нежелательных явлений, возникающих в последующих периодах вмешательства, к соответствующему вмешательству. Этот и другие вопросы описаны в Руководстве по подбору дозы лекарственных препаратов (приложение к Рекомендации Коллегии Евразийской экономической комиссии от 12 марта 2019 г. N 8). Перекрестный дизайн необходимо, как правило, ограничивать ситуациями, в которых ожидается незначительная потеря субъектов.
58. Распространенным и в целом удовлетворительным использованием перекрестного дизайна 2 x 2 является подтверждение биоэквивалентности двух производственных рецептур одного и того же лекарственного препарата. В данном случае у здоровых добровольцев влияние переноса на соответствующую фармакокинетическую переменную наименее вероятно, если время отмывки между двумя периодами достаточно продолжительно. Тем не менее важно выполнить проверку этого предположения во время анализа на основе полученных данных (например, за счет подтверждения того, что лекарственный препарат не обнаруживается в начале каждого периода).
Факторный дизайн
59. В факторном дизайне 2 и более вмешательства оцениваются одновременно за счет использования варьирующих комбинаций вмешательств. Простейшим примером является факторный дизайн 2 x 2, при котором субъектам в случайном порядке назначается одна из 4 возможных комбинаций 2 вмешательств A и B:
назначение только вмешательства A;
назначение только вмешательства B;
назначение вмешательств и A, и B;
не назначение ни A, ни B вмешательств.
60. Во многих случаях факторный дизайн используется с целью изучения взаимодействия между вмешательствами A и B. Статистический тест на взаимодействие может быть недостаточно мощным для обнаружения взаимодействия, если размер выборки был рассчитан на основе теста на главные эффекты. Это важно учитывать, если подобный дизайн используется для изучения объединенных эффектов A и B, в частности, если вмешательства могут применяться вместе.
61. Другим значимым применением для факторного дизайна является установление характеристик зависимости «доза — ответ» при одновременном применении вмешательств C и D, особенно если эффективность каждого вида монотерапии была установлена при некоторой дозе в предыдущих клинических исследованиях. Выбирается число (m) доз C, обычно включая нулевую дозу (плацебо), и сходное число (n) доз D. Тогда полный дизайн состоит из m x n групп вмешательств, каждая из которых получает разную комбинацию доз C и D. Результирующую оценку поверхности отклика можно затем использовать для установления оптимальной комбинации доз C и D для клинического применения, как описано в Руководстве по подбору дозы лекарственных препаратов.
62. В некоторых случаях к перекрестному дизайну 2 x 2 прибегают для эффективного использования субъектов клинических исследований за счет оценки эффективности 2 вмешательств с тем же числом субъектов, которое потребовалось бы для оценки эффективности одного из них. Такая стратегия подтвердила свою эффективность масштабных исследований смертности. Эффективность и валидность этого подхода зависят от отсутствия взаимодействия между вмешательствами A и B, так что влияние A и B на первичные переменные эффективности соответствует аддитивной модели, и поэтому эффект A фактически одинаков, независимо от того, является ли он дополнительным по отношению к эффекту B, или изучается отдельно. Как и в случае перекрестного дизайна исследования, доказательство, что данное условие будет выполнено, необходимо получить до исследования, опираясь на имеющиеся сведения и данные.
2. Многоцентровые исследования
63. Многоцентровые исследования проводят по двум основным причинам. Во-первых, многоцентровое исследование — это приемлемый способ эффективной оценки нового лекарственного препарата. При некоторых обстоятельствах такое исследование может быть единственным практичным видом исследования с набором необходимого количества субъектов, достаточным для достижения цели исследования в разумный срок. Многоцентровые исследования допускается проводить на любом этапе клинической разработки. Может быть несколько центров с большим количеством субъектов исследования в каждом или (в случае редкого заболевания) большое количество центров с небольшим количеством субъектов исследования в каждом. Во-вторых, исследование может быть спланировано как многоцентровое (с множеством исследователей), главным образом, для более надежной основы последующей генерализации полученных результатов. Это обусловлено возможностью привлечения субъектов из более широкой популяции и назначения лекарственного препарата в более широком диапазоне клинических условий. Таким образом, экспериментально моделируется ситуация, которая больше похожа на будущие условия применения лекарственного препарата. В этом случае участие большого количества исследователей также способствует формированию более широкого спектра клинических суждений относительно ценности лекарственного препарата. Такого рода исследование обычно является подтверждающим и проводится в более поздних фазах разработки лекарственного препарата и предусматривает участие большого количества исследователей и исследовательских центров. В целях дальнейшего облегчения генерализуемости исследование иногда может проводиться в разных странах.
64. Для корректной интерпретации и экстраполяции результатов многоцентрового исследования способ выполнения исследования по протоколу должен быть понятным и подобным во всех центрах, принимающих участие в исследованиях. Более того, обычные расчеты размера выборки субъектов исследования и мощности исследования зависят от предположения, что различия между сравниваемыми вмешательствами в центрах представляют собой несмещенные оценки одной и той же величины. Необходимо разрабатывать общий протокол и проводить исследование, с учетом этого допущения. Процедуры необходимо максимально полно стандартизировать. Вариацию критериев оценки и режимов изучаемого воздействия можно уменьшить с помощью проведения встреч исследователей, подготовки персонала до начала исследования и тщательного мониторинга во время исследования. Качественный дизайн должен предусматривать одинаковое распределение субъектов по вмешательствам внутри каждого центра, а хорошая организация исследования должна способствовать достижению этой цели. Исследования, в которых ограничиваются избыточные колебания числа субъектов на центр, и исследования, в которых исключается вариант небольшого числа маленьких центров, имеют преимущества, если впоследствии выявляется необходимость учета гетерогенности эффекта вмешательства между центрами, поскольку в них меньше разница между различными взвешенными оценками эффекта вмешательства (это не относится к исследованиям, все центры которых являются очень маленькими или в которых центр в анализе не фигурирует). Неспособность принять указанные меры предосторожности (в сочетании с сомнениями относительно однородности результатов) может в сложных ситуациях снизить ценность многоцентрового исследования до такой степени, что его нельзя будет рассматривать в качестве источника убедительного доказательства выдвинутых спонсором гипотез.
65. В простейшем многоцентровом исследовании каждый исследователь отвечает за субъектов, привлекаемых к участию в исследовании в одной больнице, так, что «центр» уникально идентифицируется исследователем или больницей. Однако обычно в клинических исследованиях складывается более сложная ситуация. Один исследователь может привлекать субъектов из нескольких больниц и один исследователь может представлять команду клиницистов (со-исследователей), каждый из которых привлекает субъектов исследования в одной или нескольких взаимосвязанных больницах. При сомнениях относительно определения центра в статистической модели в статистическом разделе протокола клинического исследования (в соответствии с подразделом 1 раздела VI настоящего Руководства) необходимо четко формулировать понятие «центр» (например, определить клинический центр по исследователю, расположению или региону) в контексте конкретного исследования.
66. В большинстве случаев центры можно удовлетворительно определить по исследователю этих центров. При наличии сомнений цель должна состоять в таком определении центров, позволяющем достичь однородности по важным факторам, влияющим на измерение первичных переменных и на эффект вмешательств. Любые правила объединения центров во время анализа необходимо заранее обосновать и изложить по возможности в протоколе клинического исследования, однако в любом случае решения относительно указанного подхода необходимо всегда принимать ослепленно по отношению к вмешательству (например, во время ослепленной проверки).
67. Статистическую модель, которая будет использоваться для оценивания и тестирования эффектов вмешательств, необходимо описать в протоколе клинического исследования. Основной эффект вмешательства можно изучить сначала с использованием модели, допускающей различия между центрами, не предусматривающей фактора «взаимодействие вмешательство — центр». Если эффект вмешательства в центрах проявляется однородно, то рутинное включение факторов взаимодействия в модель снижает эффективность теста в отношении главных эффектов. При наличии истинной гетерогенности эффектов вмешательств интерпретация главного эффекта вмешательства противоречива.
68. В некоторых клинических исследованиях (например, в некоторых крупных клинических исследованиях с изучением смертности и участием небольшого числа субъектов исследования в каждом из клинических центров) могут отсутствовать причины ожидания какого-либо влияния центра на первичные и вторичные переменные, поскольку клинические центры, скорее всего, не оказывают клинически значимого влияния на общий вывод по исследованию. В других клинических исследованиях с самого начала может быть известно, что ограниченное число субъектов на центр приведет к ограничению ценности включения эффектов центра в статистическую модель. В подобных случаях включать фактор «центр» в модель анализа нецелесообразно, а стратифицировать рандомизацию по центру в этой ситуации не нужно.
69. Если в клиническом исследовании со значительным числом субъектов на клинический центр обнаружены положительные эффекты вмешательств, необходимо, как правило, изучить гетерогенность эффектов вмешательств между клиническими центрами, поскольку она может повлиять на генерализуемость выводов. Выраженную гетерогенность можно выявить с помощью графического представления результатов отдельных центров или с помощью аналитических статистических методов, таких как расчет критерия значимости для фактора «взаимодействие вмешательство — центр». При использовании такого статистического критерия значимости важно понимать, что он имеет низкую мощность в исследовании, направленном на обнаружение главных эффектов вмешательства.
70. Если обнаружена гетерогенность эффектов вмешательств, ее необходимо интерпретировать с осторожностью и активно искать объяснение этому факту с позиций других особенностей организации клинического исследования или характеристик субъектов. Такое объяснение обычно подразумевает тщательный дальнейший анализ и интерпретацию. В целях обоснования устойчивости оценок эффекта вмешательства при наличии гетерогенности этого эффекта вмешательства (на что может указывать выраженное количественное взаимодействие между эффектом вмешательства и клиническим центром) могут использоваться альтернативные оценки эффекта вмешательства с присвоением оценкам от разных клинических центров весовых коэффициентов. Иные подходы в данном случае возможны только при наличии соответствующего обоснования их применения в отчете о клиническом исследовании. Следует установить причину любой гетерогенности эффекта вмешательства, характеризующейся выраженными качественными взаимодействиями между эффектом вмешательства и клиническим центром. Если причина гетерогенности эффекта вмешательства не установлена, то могут потребоваться дополнительные клинические исследования, прежде чем эффект вмешательства можно будет предсказать с достаточной степенью надежности.
71. Дизайн многоцентровых исследований, описанный в пунктах 65 — 70 настоящего Руководства, соответствует статистической модели с фиксированными эффектами. Однако для изучения гетерогенности эффекта вмешательства допускается использование смешанных моделей. Такие модели рассматривают факторы «центр» и «взаимодействие вмешательство — центр» в качестве случайных и наиболее востребованы в клинических исследованиях с участием большого числа центров.
3. Вид сравнений
Исследования превосходства
72. С научной точки зрения эффективность вмешательства наиболее убедительно устанавливается с помощью:
подтверждения превосходства над плацебо в плацебо-контролируемом исследовании;
подтверждения превосходства над активным контрольным вмешательством в исследовании с активным контролем;
установления зависимости «доза — ответ».
73. В случае серьезных заболеваний, при терапевтическом вмешательстве, эффективность которого доказана с помощью исследования превосходства, плацебо-контролируемое исследование может быть признано неэтичным. В этом случае с целью контроля необходимо предусмотреть научно обоснованное активное вмешательство. Пригодность плацебо-контроля или активного контроля в клиническом исследовании определяется в каждом конкретном случае.
Исследования эквивалентности и не меньшей эффективности
(безопасности) лекарственного препарата
74. В некоторых случаях исследуемый лекарственный препарат сравнивают с референтным лекарственным препаратом (вмешательством) без цели подтверждения превосходства эффекта исследуемого лекарственного препарата. Такие исследования делятся на две основные категории в зависимости от цели: исследования эквивалентности и исследования не меньшей эффективности (безопасности).
75. Исследование биоэквивалентности попадает в первую категорию. В некоторых случаях исследования клинической эквивалентности проводятся с другими целями (например, подтверждения эквивалентности воспроизведенного лекарственного препарата референтному лекарственному препарату, который уже зарегистрирован, если эти лекарственные препараты не абсорбируются и не попадают в кровоток).
76. Многие исследования с активным контролем направлены на подтверждение того, что эффективность исследуемого препарата не меньше эффективности активного контроля, и поэтому попадают во вторую категорию. Другим вариантом является исследование, в котором несколько доз исследуемого лекарственного препарата сравнивают с рекомендуемой дозой или несколькими дозами лекарственного препарата, применяемого для стандартной терапии. Цель такого дизайна состоит одновременно в демонстрации зависимости «доза — ответ» исследуемого препарата и в сравнении исследуемого препарата с активным контролем.
77. Исследования эквивалентности и не меньшей эффективности (безопасности) с активным контролем могут также предусматривать дополнительное использование плацебо, преследуя таким образом несколько целей в одном исследовании (например, они могут устанавливать превосходство исследуемого вмешательства над плацебо и тем самым валидировать дизайн исследования и одновременно оценивать степень сходства эффективности и безопасности с активным контролем). Хорошо известны затруднения, связанные с использованием исследований эквивалентности и не меньшей эффективности (безопасности) с активным контролем, не предусматривающих плацебо или нескольких доз нового лекарственного препарата. Они обусловлены неизбежным отсутствием какой-либо меры внутренней валидности (в противоположность исследованиям превосходства), что делает необходимой внешнюю валидацию.
78. Исследования эквивалентности и не меньшей эффективности (безопасности) являются неконсервативными по своей природе, поэтому многие недочеты при планировании и проведении исследований будут иметь тенденцию смещать результаты в пользу заключения об эквивалентности. По этой причине элементам дизайна таких исследований необходимо уделять особое внимание, а их проведение требует особой тщательности. Например, особенно важно минимизировать частоту нарушений критериев включения (невключения) субъектов в исследование, отсутствия приверженности, исключения субъектов из исследования, потери последующего наблюдения, отсутствующих данных и других отклонений от протокола, а также минимизировать их влияние на последующий анализ.
79. Необходимо внимательно подбирать активные компараторы. Примером подходящего активного компаратора может быть широко применяемая терапия, эффективность которой при соответствующем показании была четко установлена и охарактеризована количественно в хорошо спланированном и документированном исследовании (исследованиях) превосходства и от которой можно с надежностью ожидать проявления схожей эффективности в намеченном активно контролируемом исследовании. С этой целью новое исследование должно иметь те же основные элементы дизайна (первичные переменные, дозу активного компаратора, критерии отбора и т.д.), что и ранее проведенные исследования превосходства, в которых активный компаратор убедительно показал клинически значимую эффективность, принимая во внимание достижения в медицинской и статистической практике, применимые для нового исследования.
80. Крайне важно, чтобы протокол клинического исследования, направленного на подтверждение эквивалентности или не меньшей эффективности (безопасности), содержал четкое указание, что это его явная цель. Границу эквивалентности необходимо указать в протоколе исследования в виде наибольшей разницы в оценках эффективности (безопасности), которую можно считать клинически приемлемой, при этом она должна быть меньше разницы оценок эффективности (безопасности), продемонстрированной в исследованиях превосходства активного компаратора. При проведении активно контролируемого исследования эквивалентности необходимо указать как верхнюю, так и нижнюю границы, тогда как в случае активно контролируемого исследования не меньшей эффективности (безопасности) — только нижнюю. Необходимо клинически обосновать выбор границ эквивалентности.
81. Статистический анализ, как правило, основывается на использовании доверительных интервалов. В случае исследований эквивалентности необходимо использовать двусторонние доверительные интервалы. Вывод об эквивалентности делается, если доверительный интервал полностью укладывается в границы эквивалентности. С технической точки зрения это эквивалентно одновременному использованию 2 односторонних тестов для проверки (сложной) нулевой гипотезы о том, что разница между вмешательствами выходит за границы эквивалентности против (сложной) альтернативной гипотезы о том, что разница между вмешательствами находится в пределах границ. Поскольку две нулевые гипотезы являются взаимоисключающими, ошибка I рода контролируется должным образом. В случае исследований не меньшей эффективности необходимо использовать односторонний доверительный интервал. Подход, основанный на построении доверительных интервалов, имеет аналог с односторонней проверкой гипотезы для тестирования нулевой гипотезы о том, что разница между вмешательствами (исследуемый препарат минус контроль) равна нижней границе эквивалентности против альтернативы, состоящей в том, что разница между вмешательствами больше, чем нижняя граница эквивалентности. Выбор ошибки I рода следует рассматривать независимо от использования одно- или двусторонней процедуры. Расчеты размера выборки должны основываться на указанных методах.
82. Вывод об эквивалентности или не меньшей эффективности (безопасности), основанный на получении незначимого результата тестирования нулевой гипотезы об отсутствии разницы между исследуемым лекарственным препаратом и активным компаратором, неприемлем.
83. Есть также ряд особенностей при выборе анализируемых совокупностей. Субъекты, исключенные или выбывшие из группы вмешательства или группы компаратора, с большей вероятностью не достигают ответа, тем самым результаты использования полной анализируемой совокупности могут вносить систематическую ошибку в данные о пользе подтверждения эквивалентности исследуемого лекарственного препарата.
Исследования для подтверждения зависимости
«доза — ответ»
84. Изучение соотношения между ответной реакцией организма на новый исследуемый лекарственный препарат и его дозой можно проводить на всех фазах разработки лекарственного препарата и с помощью любых подходов в соответствии с Руководством по подбору дозы лекарственных препаратов. Исследования зависимости «доза — ответ» могут преследовать множество целей, в том числе следующие:
подтверждение эффективности лекарственного препарата;
изучение формы и расположения кривой зависимости «доза — ответ»;
оценивание оптимальной начальной дозы;
выявление оптимальных стратегий для коррекции дозы под индивидуальные нужды;
определение максимальной дозы, превышение которой не будет приносить дополнительной пользы.
85. Цели исследования необходимо рассматривать, используя данные, полученные для множества исследуемых доз, включая плацебо (нулевая доза), если оно применимо. Использование процедур оценки зависимости «доза — ответ», включая построение доверительных интервалов и использование графических методов, столь же важно, как и использование статистических критериев. Используемые методы проверки гипотез необходимо адаптировать с учетом естественного порядка назначения доз или конкретных характеристик, касающихся формы кривой зависимости «доза — ответ» (например, монотонности). Подробное описание планируемых статистических процедур необходимо представить в протоколе исследования.
4. Групповые последовательные дизайны
86. Групповые последовательные дизайны используют для облегчения проведения промежуточного анализа. Несмотря на то, что приемлемые виды дизайнов, позволяющие проведение промежуточного анализа, не ограничиваются групповыми последовательными дизайнами, их используют чаще всего, поскольку практичнее оценивать сгруппированные исходы субъектов через определенные интервалы во время исследования, нежели на непрерывной основе по мере поступления данных от каждого субъекта. Необходимо полностью определить статистические методы до получения сведений об исходах вмешательств и назначении вмешательств субъектам (то есть до снятия ослепления). Проверку или проведение промежуточного анализа данных, поступающих в рамках группового последовательного дизайна, может осуществлять независимый комитет по мониторингу данных (в соответствии с подразделом 6 раздела V настоящего Руководства). Несмотря на то, что такой дизайн чаще и успешнее всего используется в крупных долгосрочных исследованиях смертности или значимых конечных точек, не связанных со смертностью, он все шире используется и в других целях. Существует понимание того, что безопасность необходимо отслеживать во всех исследованиях, и поэтому следует всегда предусматривать необходимость формализованных процедур, определяющих раннюю остановку клинических исследований из соображений безопасности.
5. Размер выборки
87. Количество субъектов в клиническом исследовании обычно определяют, исходя из основной цели исследования, оно должно быть достаточно большим для получения надежного ответа на поставленные вопросы. Если размер выборки определяется на другой основе, то необходимо указать и обосновать эту основу. Например, клиническое исследование, размер выборки для которого рассчитывается на основе требований безопасности либо важных вторичных целей, может требовать большего количества субъектов, нежели исследование, размер выборки для которого определяется на основе первичного вопроса эффективности, как это указано в Руководстве по общим вопросам клинических исследований (приложение к Рекомендации Коллегии Евразийской экономической комиссии от 17 июля 2018 г. N 11).
88. При использовании обычного метода определения размера выборки необходимо охарактеризовать следующие параметры: первичную переменную, статистический критерий, нулевую гипотезу, альтернативную («рабочую») гипотезу для выбранной дозы (доз) (включая рассмотрение разницы между вмешательствами, подлежащей выявлению или отклонению для выбранной дозы и популяции субъектов), вероятность ошибочного отклонения нулевой гипотезы (ошибку I рода) и вероятность ошибочного неотклонения нулевой гипотезы (ошибку II рода), а также подход к работе с исключенными из клинического исследования субъектами и нарушениями протокола. В некоторых случаях частота возникновения событий представляет основной интерес для оценки мощности исследования, при этом необходимо выдвинуть предположения, чтобы провести экстраполяцию от необходимого числа событий на итоговый размер выборки для клинического исследования.
89. Способ расчета размера выборки необходимо указать в протоколе клинического исследования вместе с оценками всех количественных характеристик, использованных в расчетах (дисперсии, средних значений, частоты ответов, частоты явлений, искомой разницы). Необходимо также представить основу для указанных оценок. Важно изучить чувствительность оценки размера выборки к разнообразным отклонениям от указанных предположений, что это можно осуществить, предоставив диапазон размеров выборок, с учетом возможных отклонений от предположений. В подтверждающих клинических исследованиях предположения должны, как правило, основываться на опубликованных научных данных или результатах предыдущих исследований. Искомая разница между вмешательствами может основываться на предположении о минимальном эффекте, имеющем клиническую значимость при ведении пациентов, или на предположении об ожидаемом эффекте нового вмешательства, если предполагается, что он больше, чем эффект стандартного вмешательства. Традиционно вероятность ошибки I рода принимается равной 5% или менее либо ее значение устанавливается с учетом каких-либо поправок, вносимых из соображений множественности сравнений. На конкретный выбор могут влиять априорное правдоподобие тестируемой гипотезы и планируемые результаты. Вероятность ошибки II рода традиционно принимается равной 10 или 20%. Спонсору исследования следует удерживать это значение на наименьшем достижимом уровне, особенно в случае исследований, которые затруднительно или невозможно провести повторно. В некоторых случаях приемлемы или даже предпочтительны значения, альтернативные общепринятым уровням ошибок I и II рода.
90. Расчеты размера выборки должны позволить получить число субъектов, требуемое для первичного анализа. Если это «полная анализируемая совокупность», то оценки величины эффекта могут потребовать уменьшения по сравнению с совокупностью «по протоколу». Это необходимо, чтобы можно было учесть размывание эффекта вмешательства, возникающее в связи с включением данных субъектов исследования, в отношении которых досрочно прекращено вмешательство или у которых была низкая приверженность. Предположения о вариабельности могут также требовать пересмотра.
91. Размер выборки для исследования эквивалентности или не меньшей эффективности (безопасности) должен, как правило, основываться на необходимости получения доверительного интервала для различий между вмешательствами, свидетельствующей, что вмешательства различаются не более чем на клинически приемлемую величину. Если мощность исследования эквивалентности оценивается из предположения, что истинная разница равна нулю, то размер выборки, необходимый для достижения такой мощности, будет недооценен, если истинная разница не равна нулю. Если мощность исследования не меньшей эффективности оценивается для истинной разницы, равной нулю, то размер выборки, необходимый для достижения такой мощности, будет недооценен, если эффект исследуемого препарата будет меньше, чем эффект активного контроля. Выбор «клинически приемлемой» разницы требует обоснования с позиций его значения для будущих пациентов и такая разница может быть меньше, чем «клинически значимая» разница, определенная в рамках исследований превосходства.
92. Точный размер выборки при групповом последовательном дизайне невозможно зафиксировать заранее, поскольку он зависит от случайности в сочетании с выбранными правилами остановки проведения исследования и истинной разницы между вмешательствами. Дизайн правил остановки проведения исследования должен учитывать последующее распределение размера выборки, обычно выражаемое в виде ожидаемого и максимального размеров выборки.
93. Если частота событий ниже ожидаемой или вариабельность выше ожидаемой, существуют методы переоценки размера выборки без снятия ослепления или выполнения сравнения вмешательств.
6. Сбор и обработка данных
94. Сбор и передача данных от исследователя спонсору может происходить с использованием различных носителей (таких как бумажные индивидуальные регистрационные карты, удаленные системы мониторинга центров, медицинские компьютерные системы и электронная передача данных). Независимо от используемой технологии сбора данных, их форма и содержание должны полностью соответствовать протоколу и подлежат установлению до начала проведения клинического исследования. Основное внимание следует обращать на данные, необходимые для проведения запланированного анализа, включая контекстные сведения (например, сроки оценки относительно дозирования), требуемые для подтверждения соответствия протоколу или выявления важных отклонений от протокола. Отсутствующие значения должны быть отличимыми от нулевого значения и характеристического отсутствия.
95. Процесс сбора данных вплоть до закрытия базы данных необходимо проводить в соответствии с разделом 5 Правил надлежащей клинической практики Евразийского экономического союза. В частности, должны быть предусмотрены своевременные и надежные процессы записи данных, исправления ошибок и заполнение пропусков, чтобы обеспечить получение качественной базы данных и достижение целей исследования с помощью запланированного анализа.
V. Вопросы проведения клинического исследования
1. Мониторинг и промежуточный анализ
клинического исследования
96. Качественное проведение клинического исследования в соответствии с протоколом клинического исследования оказывает ключевое влияние на надежность результатов. Тщательный мониторинг обеспечивает минимизацию возникновения и раннее выявление затруднений, а также предотвращает их повторное возникновение.
97. Есть два разных вида мониторинга, в целом характеризующих подтверждающие клинические исследования, спонсируемые фармацевтической отраслью. Первый вид мониторинга касается надзора за качеством клинического исследования, тогда как второй затрагивает снятие ослепления в целях осуществления сравнений вмешательств (промежуточного анализа). Оба вида мониторинга, помимо разных обязанностей персонала, предусматривают доступ к разным видам данных и сведений об исследовании, поэтому к ним применяются разные принципы контроля потенциальных статистических и операционных систематических ошибок.
98. В целях контроля качества клинического исследования проверки, проводимые в рамках мониторинга, могут включать в себя оценку соблюдения протокола, приемлемости накопленных данных, успешности целевых показателей набора, уместности предположений дизайна, успешности удерживания субъектов в исследованиях и т.д. Такой мониторинг не требует доступа к сведениям о сравнительных эффектах вмешательств, снятия ослепления данных и поэтому не влияет на ошибку I рода. Мониторинг исследования с такой целью является ответственностью спонсора и может проводиться спонсором или независимой группой, выбираемой спонсором. Период для мониторинга данного вида обычно начинается с отбора исследовательских центров и завершается сбором и очисткой данных последнего субъекта исследования.
99. Другой вид мониторинга клинического исследования (промежуточный анализ) предусматривает накопление сравнительных результатов вмешательств. Промежуточный анализ требует неослепленного (то есть со снятием кода) доступа к назначению вмешательств по группам (фактическому назначению вмешательства или идентификации назначения вмешательства группе) и сравнительным обобщенным сведениям о группах вмешательств. При этом протокол исследования (или соответствующие поправки перед первым анализом) должен содержать статистические планы промежуточного анализа для предотвращения определенных видов систематических ошибок.
2. Изменения критериев включения и невключения
субъектов в исследования
100. Критерии включения и невключения должны оставаться неизменными (в соответствии с критериями, установленными протоколом исследования) на протяжении всего периода привлечения субъектов. В некоторых случаях изменения целесообразны (например, в долгосрочных исследованиях, когда получение новых научных знаний из источников, непосредственно не связанных с исследованием, или по результатам промежуточных анализов указывает на необходимость изменения критериев отбора). Изменения также могут быть обусловлены выявлением регулярных нарушений критериев включения (невключения) субъектов в исследование или низкой скоростью привлечения субъектов к участию в исследованиях ввиду излишней строгости таких критериев. Изменения необходимо вносить без снятия ослепления и всегда описывать в поправке к протоколу исследования, которая должна освещать все статистические последствия, такие как корректировка размера выборки из-за другой частоты событий, или модификации запланированного анализа, такие как стратификация анализа в соответствии с модифицированными критериями включения (невключения) субъектов в исследование.
3. Скорость набора субъектов исследования
101. В исследованиях с большой продолжительностью набора субъектов необходимо вести мониторинг скорости их набора и, если она опускается ощутимо ниже запланированного уровня, выявить причины снижения и принять меры для их устранения, чтобы сохранить мощность исследования и уменьшить опасения относительно избирательного включения субъектов в исследование и других аспектов качества исследования. В многоцентровых исследованиях такой подход применяется к отдельным центрам в рамках всего клинического исследования.
4. Коррекция размера выборки
102. В долгосрочных исследованиях обычно появляется возможность проверить предположения, лежащие в основе первоначального дизайна и расчетов размера выборки. Это может быть особенно важно, если детали исследования были определены на основании предварительных и (или) неопределенных сведений. В результате промежуточной проверки, выполняемой с использованием ослепленных данных, может обнаружиться, что совокупные дисперсии ответов, частота событий или показатель выживаемости не соответствуют ожидаемым. Допускается, используя соответствующим образом модифицированные предположения, пересчитать размер выборки, который необходимо обосновать и указать в поправке к протоколу и отчете о клиническом исследовании. Необходимо разъяснить меры, принятые для сохранения ослепления, и последствия (в случае их возникновения) для величины ошибки I рода и ширины доверительных интервалов. Потенциальную необходимость пересмотра размера выборки необходимо предусмотреть в протоколе исследования во всех применимых ситуациях.
5. Промежуточный анализ и ранняя остановка
клинического исследования
103. Промежуточный анализ — это анализ, направленный на сравнение групп вмешательств с точки зрения эффективности (безопасности) в любое время до официального завершения исследования. Поскольку число, методы и последствия таких сравнений влияют на интерпретацию исследования, промежуточный анализ (промежуточные анализы) необходимо заранее тщательно спланировать и описать в протоколе исследования. Особые обстоятельства могут потребовать проведения промежуточного анализа, не предусмотренного в начале исследования. В подобных случаях поправку к протоколу, описывающую промежуточный анализ, необходимо внести до получения неослепленного доступа к данным о сравнении вмешательств. Если промежуточный анализ планируется для того, чтобы принять решение, прекращать исследование или нет, следует применять групповой последовательный дизайн, в котором в качестве правил используются схемы статистического мониторинга.
104. Цель проведения подобного промежуточного анализа состоит в ранней остановке исследования в случае, если превосходство исследуемого вмешательства однозначно установлено либо если подтверждение значимой разницы между вмешательствами стало маловероятным, или если проявились неприемлемые нежелательные реакции. В целом критерии (границы) для раннего прекращения исследования по причине, связанной с эффективностью, требуют больше доказательств (то есть являются более консервативными), чем критерии (границы) для мониторинга безопасности. Если дизайн исследования и цель мониторинга предусматривают несколько конечных точек, то этот аспект множественных сравнений также следует учитывать при планировании статистической обработки и анализе результатов.
105. Протокол клинического исследования должен описывать график проведения промежуточных анализов или по меньшей мере обоснования, которые будут определять его составление (например, применение гибких подходов использования функции расходования величины альфа). Более подробные сведения допускается представить в поправке к протоколу клинического исследования перед началом первого промежуточного анализа. Правила остановки исследования и их характеристики необходимо четко описать в протоколе клинического исследования или поправках к нему. Необходимо также оценить возможное влияние ранней остановки исследования на анализ других важных переменных. Все это должно быть описано или одобрено независимым комитетом по мониторингу данных (если он сформирован в рамках клинического исследования).
106. Отклонения от запланированной процедуры всегда несут риск того, что результаты клинического исследования окажутся не валидными. Если возникает необходимость изменения процедуры клинического исследования, все последующие изменения статистических процедур необходимо при первой возможности описать в поправке к протоколу клинического исследования, особенно в части информации о влиянии на анализ и выводы, к которым могут привести подобные изменения. Выбранные процедуры должны всегда обеспечивать контроль совокупной вероятности ошибки I рода.
107. Осуществление промежуточного анализа должно быть полностью конфиденциальным процессом, поскольку потенциально затрагиваются неослепленные данные и результаты клинического исследования. Все работники, задействованные в проведении клинического исследования, должны оставаться ослепленными в отношении результатов подобных анализов, поскольку появляется возможность изменения их отношения к клиническому исследованию, что приведет к изменению характеристик привлекаемых субъектов исследования или систематических ошибок при сравнении вмешательств. Этот принцип можно применять ко всему исследовательскому персоналу и персоналу, нанятому спонсором, за исключением лиц, непосредственно вовлеченных в выполнение промежуточного анализа. Исследователей необходимо информировать лишь о решении продолжить или прекратить клиническое исследование либо о внесении изменений в процедуры исследования.
108. Большинство клинических исследований, направленных на обоснование эффективности (безопасности) исследуемого лекарственного препарата, должны продолжаться до завершения набора всего запланированного размера выборки. Клинические исследования подлежат ранней остановке только по этическим причинам или если их запланированная мощность более не считается приемлемой. Вместе с тем планы разработки лекарственного препарата предусматривают необходимость доступа спонсора к сравнительным данным о вмешательствах по различным причинам (например, в связи с планированием других исследований). Только часть клинических исследований будет предусматривать изучение серьезных угрожающих жизни исходов или смертности, для чего из этических соображений может потребоваться последовательный мониторинг накапливающихся сравнительных данных о вмешательствах. В любой из указанных ситуаций протокол исследования или поправки к нему до неослепленного доступа к сравнительным данным о вмешательствах должны содержать планы промежуточного статистического анализа, чтобы описать способ обращения с потенциально привносимыми статистическими и операционными систематическими ошибками.
109. Во многих клинических исследованиях лекарственных препаратов, особенно оказывающих большое влияние на здоровье населения, ответственность за мониторинг сравнений исходов эффективности (безопасности) необходимо возложить на внешнюю независимую группу (независимый комитет по мониторингу данных, совет по мониторингу данных и безопасности или комитет по мониторингу данных), обязанности которых необходимо четко описать в протоколе клинического исследования.
110. Если спонсор берет на себя функцию ведения мониторинга сравнений эффективности (безопасности) и следовательно имеет доступ к неослепленным сравнительным сведениям, необходимо особо тщательно подойти к защите целостности исследования, а также к управлению сведениями и ограничению их распространения. Спонсор обязан обеспечить организацию деятельности независимого комитета по мониторингу данных в соответствии с документированными стандартными операционными процедурами, а также ведение протоколов заседаний, содержащих информацию о принятых решениях, включая записи промежуточных результатов.
111. Следует избегать проведения ненадлежащим образом спланированного промежуточного анализа (в том числе с последующей ранней остановкой исследования) по причине возможной дискредитации результатов клинического исследования и снижения надежности сделанных выводов.
112. Если проведен незапланированный промежуточный анализ, в отчете о клиническом исследовании следует объяснить необходимость его проведения, степень снятия ослепления, дать оценку потенциальной величины привнесенных систематических ошибок и влияния незапланированного анализа на интерпретацию результатов всего исследования.
6. Роль независимого комитета по мониторингу данных
при оценке хода клинического исследования
113. В целях периодической оценки хода клинического исследования, данных о безопасности и критичных переменных эффективности, а также составления рекомендаций, касающихся продолжения, модификации или прекращения исследования, спонсор вправе учредить независимый комитет по мониторингу данных.
114. Независимый комитет по мониторингу данных в своей деятельности должен руководствоваться оформленными в виде документа стандартными операционными процедурами и вести протоколы своих заседаний, с указанием в том числе промежуточных результатов. Записи должны быть доступны для ознакомления лицам, осуществляющим мониторинг, аудит и инспекцию клинических исследований, по завершении клинического исследования. Независимость указанного комитета направлена на контроль распространения важных сравнительных сведений и защиту целостности клинического исследования от нежелательного влияния, обусловленного доступом к информации исследования. Независимый комитет по мониторингу данных функционирует обособленно от этического совета организации и независимого этического комитета. В состав независимого комитета по мониторингу данных должны входить специалисты в области клинических исследований, обладающие знаниями в соответствующих дисциплинах, включая статистику.
115. Если в состав независимого комитета по мониторингу данных входят представители спонсора, их права и функции необходимо четко указать в стандартных операционных процедурах комитета (например, наличие права голоса по ключевым вопросам). Поскольку такие представители спонсора получат доступ к неослепленным сведениям, стандартные операционные процедуры должны также пояснять как выполняется контроль распространения промежуточных результатов исследования в организации спонсора.
VI. Анализ данных
1. Предварительное установление требований к анализу данных
116. При планировании клинического исследования принципиальные особенности последующего статистического анализа данных необходимо описать в статистическом разделе протокола клинического исследования. Указанный раздел должен содержать все принципиальные особенности предлагаемого подтверждающего анализа первичной переменной (переменных) и способ работы с возникающими при анализе проблемами. При поисковых клинических исследованиях в данном разделе могут содержаться более общие принципы и указания.
117. План статистического анализа может быть представлен в виде отдельного документа, составляемого после завершения подготовки протокола клинического исследования. В плане статистического анализа можно осуществить более техническую и детализированную проработку основных характеристик, указанных в протоколе клинического исследования. План статистического анализа может содержать детализированные процедуры выполнения статистического анализа первичных и вторичных переменных и других данных. План статистического анализа необходимо пересматривать и обновлять по результатам ослепленной проверки данных (при необходимости) и окончательно оформить до снятия ослепления. Необходимо хранить документы о времени окончательного оформления плана статистического анализа, а также времени последующего снятия ослепления.
118. Если ослепленная проверка предполагает изменение принципиальных характеристик, указанных в протоколе клинического исследования, ее необходимо документировать в поправке к протоколу клинического исследования. В противном случае будет достаточно обновить план статистического анализа в соответствии с рекомендациями ослепленной проверки. Подтверждающими признаются лишь результаты анализов, предусмотренных протоколом клинического исследования (включая поправки).
119. В статистическом разделе отчета о клиническом исследовании необходимо четко описать статистическую методологию, в том числе в какой момент в ходе клинического исследования принимались методологические решения.
2. Анализируемые совокупности
120. Совокупность субъектов исследования, данные которых будут включены в основные анализы, необходимо определить в статистическом разделе протокола клинического исследования. Следует предусмотреть документирование сведений о всех субъектах, в отношении которых были инициированы процедуры клинического исследования (например, вступительный период). Содержание документируемых сведений о субъекте зависит от детальных особенностей конкретного исследования, но во всех возможных случаях необходимо по меньшей мере собирать демографические и исходные данные о состоянии заболевания.
121. Если все субъекты, рандомизированные для клинического исследования, соответствовали всем критериям включения (невключения) в клиническое исследование, безупречно соблюдали все процедуры исследования без потерь для последующего наблюдения и обеспечили полные записи данных клинического исследования, то совокупность субъектов, включаемых в анализ, будет очевидна. Дизайн и проведение клинического исследования должны быть нацелены на максимальное соответствие такому идеалу, однако на практике возможность его полного достижения сомнительна. Следовательно, в статистическом разделе протокола клинического исследования необходимо заранее отразить ожидаемые проблемы с точки зрения того, как они будут влиять на подлежащие анализу субъекты и данные. Протокол клинического исследования должен также устанавливать процедуры, направленные на минимизацию всех ожидаемых недочетов при проведении клинического исследования, способных помешать удовлетворительному анализу, включая различные виды нарушений протокола клинического исследования, наличие исключенных из клинического исследования субъектов и отсутствующих значений. Протокол клинического исследования должен предусматривать способы снижения частоты подобных проблем и методы решения проблем, возникающих при анализе данных. Возможные изменения в способе обработки нарушений протокола при анализе данных, следует определить во время ослепленной проверки. Желательно выяснить время возникновения каждого важного нарушения протокола клинического исследования, его причины и влияние на результат клинического исследования. В отчете о клиническом исследовании необходимо документировать частоту и вид нарушений протокола клинического исследования, отсутствующие значения и другие проблемы, а также описать их потенциальное влияние на результаты клинического исследования.
122. Решения, касающиеся анализируемой совокупности, должны опираться на следующие принципы:
а) минимизация систематических ошибок;
б) недопущение инфляции ошибки I рода.
Полная анализируемая совокупность
123. Принцип «по намерению лечить» подразумевает включение в первичный анализ всех рандомизированных пациентов. Следование указанному принципу требует полного последующего наблюдения за всеми рандомизированными субъектами на предмет исследуемых исходов. На практике такой идеал труднодостижим вследствие ряда причин. В настоящем Руководстве понятие «полная анализируемая совокупность» используется для описания анализируемой совокупности, которая максимально полно и близко соответствует принципу «по намерению лечить» с включением всех рандомизированных субъектов.
124. Поддержание первоначальной рандомизации в анализе важно для предотвращения систематических ошибок и получения надежного основания для проведения статистических тестов. Во многих клинических исследованиях использование полной анализируемой совокупности является консервативной стратегией. Во многих ситуациях с ее помощью можно также дать оценку эффектам вмешательства, которая будет с большей вероятностью отражать таковые, наблюдаемые в последующей практике.
125. Существует ограниченное число обстоятельств, которые могут приводить к исключению рандомизированных субъектов из полной анализируемой совокупности, включая несоответствие основным критериям включения (невключения) (нарушение соответствия критериям отбора), случаи, когда субъект не принял ни одной дозы исследуемого лекарственного препарата, а также отсутствие каких-либо данных после рандомизации. Подобные исключения всегда подлежат обоснованию. Субъектов, не соответствующих критериям включения (невключения), можно исключить из анализа без возможности привнесения систематических ошибок только при следующих обстоятельствах:
а) критерий отбора измерен до рандомизации;
б) выявление соответствующих нарушений отбора полностью объективно;
в) все субъекты одинаково тщательно оцениваются на предмет нарушений соответствия отбору (иногда это труднодостижимо в открытом исследовании и даже в двойном слепом исследовании, если снятие ослепления данных происходит до такой проверки, что подчеркивает важность ослепленной проверки);
г) все выявленные нарушения критериев включения (невключения) исключены.
126. В некоторых случаях обоснованно исключить из совокупности всех рандомизированных субъектов тех субъектов, которые не принимали исследуемый лекарственный препарат. Принцип «по намерению лечить» будет сохранен, несмотря на исключение таких субъектов, при условии, что знание назначаемого вмешательства не могло повлиять на решение о начале вмешательства. В других ситуациях может быть необходимо исключение из совокупности всех рандомизированных субъектов любого субъекта, у которого отсутствуют какие-либо данные после момента рандомизации. Ни один анализ не считается полным, пока не рассмотрены потенциальные систематические ошибки, возникающие в связи с указанными конкретными и любыми другими исключениями.
127. Если используется полная анализируемая совокупность субъектов, нарушения протокола, возникающие после рандомизации, могут оказывать влияние на данные и выводы, особенно если их возникновение связано с назначенным вмешательством. В большинстве случаев включение данных таких субъектов в анализ допустимо и соответствует принципу «по намерению лечить». Особые проблемы возникают в отношении субъектов, исключенных из вмешательства после получения одной или более доз, которые не представляют данные после точки исключения, и субъектов, выбывших из-под последующего наблюдения по другим причинам, поскольку невключение указанных субъектов в полную анализируемую совокупность может серьезно подорвать подход к запланированному статистическому анализу данных. В этом контексте ценными являются измерения первичной переменной (переменных), выполненные в момент выхода субъекта из-под наблюдения независимо от причины или впоследствии собранные в соответствии с намеченным графиком оценки протокола клинического исследования, последующий сбор данных особенно важен в клинических исследованиях, первичной переменной (переменными) которой является смертность или развитие тяжелой формы заболевания. Намерение осуществлять сбор данных таким способом необходимо описать в протоколе клинического исследования. Для восполнения отсутствующих данных можно также использовать методы импутации (восполнения данных), спектр которых широко представлен от использования метода продвижения вперед последнего имеющегося наблюдения (LOCF) до сложных математических моделей.
128. Другие стратегии, направленные на обеспечение доступности измерений первичных переменных для каждого субъекта полной анализируемой совокупности, могут требовать некоторых предположений об исходах субъектов или более простого выбора исхода (например, успех — неуспех). Использование каждой из указанных стратегий необходимо описать и обосновать в статистическом разделе протокола клинического исследования, и понятно объяснить предположения, лежащие в основе всех используемых математических моделей. Необходимо также подтвердить устойчивость соответствующих результатов анализа, особенно если рассматриваемая стратегия могла сама по себе привести к систематическим ошибкам в оценке эффекта вмешательства.
129. Ввиду непредсказуемости некоторых проблем иногда предпочтительно отложить подробное описание путей их решения до ослепленной проверки данных в конце исследования. Если такие проблемы ожидаются, данный подход необходимо заранее отразить в протоколе клинического исследования.
Принцип «совокупность по протоколу» («валидные случаи»,
«выборка эффективности», «выборка поддающихся
оценке субъектов»)
130. Принцип «совокупность по протоколу», иногда описываемый как валидные случаи, выборка эффективности или выборка поддающихся оценке субъектов, очерчивает подмножество субъектов полной анализируемой совокупности, являющихся более приверженными протоколу клинического исследования, и отвечает следующим характеристикам:
а) заранее определен минимальный объем назначенного вмешательства;
б) доступны измерения первичной переменной (переменных);
в) отсутствуют какие-либо грубые нарушения протокола клинического исследования, в том числе нарушения критериев включения (невключения).
131. Причины исключения субъектов из-за несоответствия принципу «совокупность по протоколу» необходимо определить до снятия ослепления, полностью охарактеризовать и документировать соответственно конкретному клиническому исследованию.
132. Использование принципа «совокупность по протоколу» может максимально увеличить возможность подтверждения новым вмешательством дополнительной эффективности в анализе и наиболее точно отразить научную модель, лежащую в основе протокола клинического исследования. Вместе с тем в зависимости от клинического исследования, соответствующие проверка гипотезы и оценка эффекта вмешательства могут быть консервативными или нет; систематическая ошибка, которая может оказаться серьезной, возникает по причине того, что следование протоколу клинического исследования может быть связано с вмешательством и исходом.
133. Необходимо в полной мере выявить и обобщить все проблемы, ведущие к исключению субъектов при формировании совокупности в соответствии с принципом «совокупность по протоколу», равно как и другие нарушения протокола клинического исследования. К данной группе нарушений протокола клинического исследования относятся ошибки в назначении вмешательств, применение запрещенного протоколом клинического исследования лекарственного препарата, низкая приверженность субъектов, их потеря для последующего наблюдения и отсутствующие данные. Надлежащей практикой является оценка закономерности возникновения таких проблем в группах вмешательств путем анализа частоты и времени до их возникновения.
Анализ одновременно полной анализируемой совокупности
и принципа «совокупность по протоколу»
134. В целом целесообразно подтвердить отсутствие чувствительности основных результатов исследования к альтернативным вариантам выбора анализируемой совокупности субъектов. В подтверждающих клинических исследованиях обычно необходимо планировать проведение анализа полной анализируемой совокупности, и соблюдение принципа «совокупность по протоколу», чтобы все выявленные различия между ними можно было подвергнуть открытому обсуждению и интерпретации. В некоторых случаях желательно более глубоко изучить зависимость чувствительности выводов к выбору анализируемой совокупности субъектов. Если при анализе полная анализируемая совокупность и принцип «совокупность по протоколу» приводят к принципиально одинаковым выводам, доверие к результатам исследования возрастает, однако необходимость исключения значительной доли субъектов из анализа принципа «совокупность по протоколу», будет вызывать сомнение в совокупной валидности результатов исследования.
135. Полная анализируемая совокупность и принцип «совокупность по протоколу» играют разные роли в исследованиях превосходства (нацеленных на подтверждение превосходства исследуемого препарата), исследованиях эквивалентности или исследованиях не меньшей эффективности (безопасности) (нацеленных на подтверждение сопоставимости исследуемого лекарственного препарата). В исследованиях превосходства полная анализируемая совокупность используется в первичном анализе (за редким исключением), поскольку это позволяет избежать избыточно оптимистичных оценок эффективности, возникающих в случае анализа принципа «совокупность по протоколу», так как неприверженные субъекты, включаемые в полную анализируемую совокупность, как правило, уменьшают оцениваемый эффект вмешательства. В исследованиях эквивалентности и исследованиях не меньшей эффективности (безопасности) использование полной анализируемой совокупности, как правило, нельзя отнести к консервативныму подходу, и ее роль необходимо тщательно изучить.
3. Отсутствующие данные (значения) и выбросы
136. Отсутствующие данные (значения) являются потенциальным источником систематических ошибок в клиническом исследовании. Следовательно, необходимо обеспечить максимальное соблюдение всех требований протокола клинического исследования в отношении сбора и работы с данными. При проведении любого клинического исследования всегда имеются какие-либо отсутствующие данные. Тем не менее исследование можно рассматривать как валидное, если используются адекватные методы работы с отсутствующими данными (значениями) и они заранее определены в протоколе клинического исследования. Определение методов допустимо оптимизировать за счет обновления данного аспекта в плане статистического анализа во время ослепленной проверки. В настоящее время не существует универсальных методов работы с отсутствующими данными. Необходимо изучить чувствительность результатов статистического анализа к методам работы с отсутствующими данными, особенно если количество отсутствующих данных значительно.
137. Аналогичный подход необходимо использовать при оценке влияния выбросов, статистическое определение которых в некоторой степени произвольно. Однозначное отнесение некоторого значения к выбросам наиболее убедительно, если оно обосновано как с медицинских, так и со статистических позиций (тогда медицинский контекст часто будет определять соответствующее действие). Никакая процедура работы с выбросами, установленная протоколом клинического исследования или планом статистического анализа, не должна априори благоприятствовать какой-либо группе вмешательств. Следует еще раз подчеркнуть, что данный аспект анализа может быть обновлен во время ослепленной проверки, что благоприятно скажется на качестве статистического анализа. Если в протоколе клинического исследования процедура работы с выбросами не предусмотрена, необходимо провести один анализ всех полученных значений и по меньшей мере один анализ после исключения или снижения влияния выбросов и обсудить разницу между их результатами.
4. Преобразование данных
138. Решение о преобразовании ключевых переменных перед анализом лучше всего принимать на этапе разработки дизайна клинического исследования на основании схожих данных из предыдущих клинических исследований. Трансформации (например, извлечение квадратного корня, логарифмирование) необходимо установить в протоколе клинического исследования и обосновать, особенно для первичной переменной (переменных). Общие принципы, определяющие использование преобразований, направленных на обеспечение выполнения предположений, лежащих в основе статистических методов, должны быть приведены в типовых разделах; в некоторых клинических областях выработаны стандартные подходы к определенным переменным. Решение о необходимости и способе преобразования переменной должно зависеть от выбора конкретной шкалы, облегчающей клиническую интерпретацию.
139. Аналогичные подходы применимы к другим производным переменным, таким как изменение показателя от исходного значения, относительное изменение показателя от исходного значения, площадь под кривой повторных измерений, отношение двух разных переменных. Необходимо тщательно продумать последующую клиническую интерпретацию результатов и обосновать в протоколе клинического исследования использование производных переменных.
5. Оценивание, доверительные интервалы и проверка гипотез
140. Статистический раздел протокола клинического исследования должен содержать проверяемые гипотезы и (или) эффекты вмешательств, подлежащие оценке для удовлетворения первичных целей клинического исследования. Статистические методы, используемые для выполнения указанных задач, необходимо описать для первичной переменной и желательно для вторичной переменной (переменных) и объяснить лежащую в их основе статистическую модель. Все возможные случаи оценки эффекта вмешательства необходимо сопроводить доверительными интервалами с указанием способов их вычисления. Необходимо предусмотреть любые намерения использовать исходные данные для улучшения точности (прецизионности) или корректировать оценки на потенциальные исходные различия (например, с помощью ковариационного анализа).
141. Следует указать, какие тесты на статистическую значимость будут использоваться: одно- или двусторонние. Использование односторонних тестов необходимо заранее обосновать. Если проверка гипотез считается нецелесообразной, необходимо представить альтернативные методы получения статистических выводов. Практика использования одно- и двусторонних тестов для получения выводов дает противоречивые результаты. Подход к установлению ошибки I рода для односторонних тестов, равной половине стандартной ошибки I рода для двусторонних тестов, является предпочтительным в регуляторных условиях. Это повышает согласованность с двусторонними доверительными интервалами, которые, как правило, целесообразно использовать для оценивания возможной разницы между двумя вмешательствами.
142. Конкретная выбранная статистическая модель должна отражать актуальные медицинские и статистические сведения об анализируемых переменных, а также статистический дизайн исследования. Необходимо всесторонне охарактеризовать все эффекты, включаемые в анализ (например, в моделях дисперсионного анализа), и объяснить способ (при наличии), с помощью которого указанная совокупность эффектов может быть модифицирована в ответ на предварительные результаты. Те же соображения применимы к совокупности ковариат, включаемых в ковариационный анализ. При выборе статистических методов необходимо уделить должное внимание статистическому распределению как первичных, так и вторичных переменных. Делая такой выбор (например, между параметрическими и непараметрическими методами), важно помнить о необходимости представления статистической оценки величины эффекта вмешательства вместе с доверительными интервалами (в дополнение к тестам значимости).
143. Необходимо четко разграничить первичный анализ первичной переменной (переменных) от вспомогательных анализов первичных и вторичных переменных. В статистическом разделе протокола клинического исследования или плане статистического анализа необходимо включить информацию о способе обобщения и регистрации данных, не относящихся к первичным и вторичным переменным. Такая информация должна включать в себя описание всех подходов, принятых в целях достижения согласованности анализа между разными исследованиями (например, в отношении данных о безопасности лекарственного препарата).
144. Подходы к моделированию, учитывающие сведения об известных фармакологических параметрах, степень приверженности отдельных субъектов протоколу клинического исследования и другие биологические данные, могут позволить получить ценное понимание фактической или потенциальной эффективности, особенно с точки зрения оценивания эффекта вмешательства. Необходимо всегда четко указывать предположения, лежащие в основе таких моделей, и подробно описывать ограничения в отношении любых выводов.
6. Корректировка уровня значимости и доверительного уровня
145. В случае множественности обычный частотный подход к анализу данных клинического исследования может требовать корректировки ошибки I рода. Множественность может возникать, например, вследствие нескольких первичных переменных, нескольких сравнений вмешательств, проведения повторной оценки в динамике и (или) промежуточных анализов. Иногда, если возможно, предпочтительны методы недопущения или уменьшения множественности, такие как установление ключевой первичной переменной (для нескольких переменных), выбор критического контраста вмешательств (для нескольких сравнений), использование такого обобщающего параметра, как площадь под кривой (для повторных измерений). В подтверждающих анализах любые аспекты множественности, сохраняющиеся после реализации подобных методов, необходимо указать в протоколе клинического исследования. План анализа должен всегда предусматривать поправки на множественность и описание особенности процедуры внесения поправок или объяснение, почему таковая не требуется.
7. Подгруппы субъектов, взаимодействия и ковариаты
146. Первичная переменная (переменные) нередко систематически связана с другими влияниями, а не только с вмешательством. Например, возможна взаимосвязь с такими ковариатами, как возраст и пол, или возможны различия между определенными подгруппами субъектов, например, субъекты, получившие вмешательство в разных центрах многоцентрового исследования. В некоторых случаях поправка на влияние ковариат или эффекты подгрупп субъектов является неотъемлемой частью запланированного анализа и тем самым требует описания в протоколе клинического исследования. При планировании клинического исследования необходимо заранее выявить те ковариаты и факторы, которые, как ожидается, могут оказать важное влияние на первичную переменную (переменные), и предложить способы их учета при анализе, чтобы повысить точность (прецизионность) и компенсировать отсутствие баланса между группами вмешательств. Если один или более факторов используются для стратификации дизайна, целесообразно учесть такие факторы в анализе. В случае сомнений относительно потенциального значения поправки часто рекомендуется рассматривать анализ без поправок как заслуживающий основное внимание, а анализ с поправками — как вспомогательный. Необходимо уделить особое внимание эффектам центра и роли исходных измерений первичной переменной (переменных). Не рекомендуется вводить в основные анализы поправки на ковариаты, измеряемые после рандомизации, поскольку они могут быть подвержены влиянию вмешательств.
147. Эффект вмешательства может сам по себе варьировать в зависимости от подгруппы или ковариаты: например, эффект вмешательства может снижаться с возрастом или быть более выражен в определенной диагностической категории субъектов. В некоторых случаях такие взаимодействия ожидаемы или представляют особенный априорный интерес (например, пожилые) и поэтому анализ подгрупп или статистическая модель, учитывающая взаимодействия, является частью запланированного подтверждающего анализа. В большинстве случаев анализы подгрупп или взаимодействий являются поисковыми и требуют явного упоминания, с их помощью необходимо оценивать однородность всех совокупных обнаруженных эффектов вмешательств. В целом к подобным анализам следует приступать с добавления факторов взаимодействия в рассматриваемую статистическую модель с последующим проведением дополнительных поисковых анализов в соответствующих подгруппах субъектов или стратах, сформированных по ковариатам. В случае если такие анализы проводятся как поисковые, требуется их осторожная интерпретация. Вывод об эффективности (или ее отсутствии) или безопасности вмешательства, основанный исключительно на поисковых анализах в подгруппах, едва ли будет приемлем.
8. Целостность данных и валидность компьютерного
программного обеспечения
148. Надежность численных результатов анализа зависит от качества и валидности методов и программного обеспечения (самостоятельно и несамостоятельно написанного), используемых как для управления данными (ввода, хранения, верификации, коррекции и извлечения данных), так и для статистической обработки. В связи с этим деятельность по управлению данными должна основываться на продуманных и действенных стандартных операционных процедурах. Компьютерное программное обеспечение, используемое в целях управления данными и статистического анализа, должно быть надежным, необходимо располагать документацией на соответствующие процедуры тестирования программного обеспечения.
VII. Оценка безопасности и переносимости
лекарственных препаратов
1. Содержание оценки безопасности и переносимости
лекарственных препаратов
149. Оценка безопасности и переносимости лекарственных препаратов является важным элементом всех клинических исследований. На ранних фазах клинических исследований такая оценка носит преимущественно поисковый характер и чувствительна только к явным проявлениям токсичности, тогда как на поздних фазах клинических исследований установление профиля безопасности и переносимости лекарственного препарата производится на больших выборках субъектов. Контролируемые клинические исследования поздних фаз являются важным средством объективного поиска новых потенциальных нежелательных реакций, несмотря на недостаточную мощность подобных клинических исследований для оценки безопасности и переносимости лекарственных препаратов.
150. С целью выдвижения конкретных гипотез относительно превосходства или эквивалентности с точки зрения безопасности и переносимости исследуемого лекарственного препарата по сравнению с другим лекарственным препаратом или другой дозой исследуемого лекарственного препарата можно спланировать отдельные клинические исследования. Подобные конкретные гипотезы необходимо подкреплять соответствующими доказательствами из подтверждающих клинических исследований, аналогично тому, как это делается для соответствующих гипотез относительно эффективности лекарственного препарата.
2. Выбор переменных и сбор данных
151. В любом клиническом исследовании методы и параметры, выбранные для оценки безопасности и переносимости лекарственного препарата, зависят от множества факторов, включая знания о нежелательных реакциях близкородственных лекарственных препаратов, сведения из доклинических и предыдущих клинических исследований, а также возможные последствия фармакодинамических, фармакокинетических свойств конкретного лекарственного препарата, пути введения, тип исследуемых субъектов и продолжительность клинического исследования.
152. Основной объем данных о безопасности и переносимости лекарственного препарата обычно составляют лабораторные тесты в части клинической биохимии и клинических анализов крови, жизненно важные показатели и клинические нежелательные явления (заболевания, симптомы и жалобы). Особенно важно регистрировать серьезные нежелательные явления и отмену вмешательства вследствие нежелательных явлений.
153. Более того, в целях облегчения объединения данных из разных исследований рекомендуется использовать согласованную методологию для сбора и оценки данных на протяжении всей программы клинической разработки. Использование общего словаря нежелательных явлений особенно важно. Структурно такой словарь позволяет обобщать данные о нежелательных явлениях на трех разных уровнях: системно-органный класс, предпочтительный термин или включенный термин. Предпочтительный термин — уровень, на котором обычно обобщаются нежелательные явления; предпочтительные термины, принадлежащие одному и тому же системно-органному классу, можно затем объединить при описательном представлении данных.
3. Совокупность оцениваемых субъектов
и представление данных
154. Для итоговой оценки безопасности и переносимости лекарственного препарата совокупность обобщаемых субъектов обычно включает в себя тех субъектов, которые приняли по меньшей мере одну дозу исследуемого лекарственного препарата. Собрать переменные безопасности и переносимости лекарственного препарата у таких субъектов необходимо максимально полно, включая информацию о виде нежелательного явления, его тяжести, начале и продолжительности явления. В особых субпопуляциях (женщины, пожилые, тяжелобольные или получающие распространенную сопутствующую терапию) могут потребоваться дополнительные оценки безопасности и переносимости, что может потребовать освещения более специфичных вопросов.
155. Во время оценки безопасности и переносимости лекарственного препарата все переменные безопасности и переносимости потребуют внимания, поэтому в протоколе клинического исследования необходимо обозначить широкий подход. Необходимо репортировать все нежелательные явления, независимо от того, считаются ли они связанными с вмешательством или нет. При оценке безопасности и переносимости лекарственного препарата необходимо учитывать все имеющиеся данные в исследуемой популяции. Необходимо тщательно определить единицы измерений и нормальные рабочие диапазоны лабораторных переменных; если в одном и том же исследовании используют разные единицы или разные нормальные диапазоны (например, в случае участия нескольких лабораторий), то измерения необходимо должным образом стандартизировать, чтобы провести унифицированную оценку. Использование шкалы градации токсичности необходимо заранее предусмотреть и обосновать.
156. Частоту возникновения определенного нежелательного явления обычно выражают в виде отношения числа субъектов с возникшими нежелательными явлениями к числу субъектов, подвергаемых риску. Вместе с тем не всегда очевидно, как оценивать частоту. Например, в зависимости от ситуации знаменателем может служить число субъектов, подвергшихся экспозиции, или степень экспозиции (в человеко-годах). Независимо от того, является ли целью вычисления оценка риска или сравнение групп вмешательств, в протоколе клинического исследования необходимо сформулировать определение. Это особенно важно, если запланировано долгосрочное вмешательство и ожидается значительная доля исключенных из исследования субъектов или случаев смерти. В подобных ситуациях необходимо предусмотреть методы анализа выживаемости и рассчитать кумулятивную частоту нежелательных явлений во избежание риска недооценки.
157. Если имеет место значительный фоновый шум из симптомов и жалоб (например, в психиатрических исследованиях), при оценивании риска разных нежелательных явлений необходимо предусмотреть методы его учета. Одним из таких методов является использование принципа «возникшее при вмешательстве», при котором нежелательные явления регистрируются только в случае их возникновения или усугубления по сравнению с периодом до вмешательства.
158. Допустимы также другие методы снижения фонового шума, такие как игнорирование нежелательных явлений легкой степени или соблюдение условия, чтобы нежелательное явление сохранялось на протяжении повторных визитов, с целью включения в числитель формулы расчета частоты. Подобные методы необходимо описать и обосновать в протоколе клинического исследования.
4. Статистическая оценка безопасности и переносимости
лекарственного препарата
159. Изучение безопасности и переносимости лекарственного препарата — комплексная проблема. Для любого лекарственного препарата можно обычно предвидеть и специально отследить ряд специфичных нежелательных реакций, однако спектр возможных нежелательных реакций очень широк, и о возникновение новых и непредвиденных реакций. Более того, нежелательное явление, возникшее после нарушения протокола клинического исследования (например, применение неразрешенного протоколом клинического исследования лекарственного препарата), может привнести систематическую ошибку. Такой фон является причиной статистических затруднений, связанных с аналитической оценкой безопасности и переносимости лекарственных препаратов, и служит доказательством того, что однозначные сведения из подтверждающих клинических исследований являются, скорее, не правилом, а исключением.
160. В большинстве клинических исследований последствия для безопасности и переносимости лучше всего поддаются анализу с применением к данным методов описательной статистики, дополняемых расчетом доверительных интервалов, если это способствует правильной интерпретации. Также важно использовать графические методы представления данных, на которых закономерности распределения нежелательных явлений приводятся как для групп вмешательств, так и субъектов исследования.
161. В некоторых случаях вычисление p-значений приводится либо для оценки некоторой интересующей разницы, либо в качестве маркера, применяемого к большому числу переменных безопасности и переносимости лекарственных препаратов, с целью обозначения различий, заслуживающих дополнительного внимания. Это особенно полезно в отношении лабораторных данных, которые в противном случае было бы трудно должным образом обобщить. Лабораторные данные рекомендуется подвергать количественному (например, оценивать средние значения вмешательств) и качественному анализу (например, путем подсчета значений, выше или ниже определенного порога).
162. Если выполняются проверки гипотез, целесообразно предусмотреть статистические поправки на множественность для количественной оценки ошибки I рода, однако большие опасения вызывает ошибка II рода. В отсутствие поправки на множественность следует осторожно интерпретировать мнимые статистически значимые результаты.
163. В большинстве исследований необходимо установить, что клинически неприемлемая с точки зрения безопасности и переносимости разница у исследуемого лекарственного препарата с препаратом сравнения или плацебо отсутствует. Подобно оценке эффективности в исследованиях эквивалентности и исследования не меньшей эффективности (безопасности) в этой ситуации предпочтительно использовать доверительные интервалы для тестирования гипотезы. Таким способом четко выявляется низкая степень точности (прецизионности) данных, часто возникающая вследствие низкой частоты возникновения нежелательных событий.
5. Выводы
164. Данные о безопасности и переносимости лекарственного препарата обычно обобщаются из разных исследований непрерывно в ходе разработки исследуемого препарата и, в частности, в момент подачи заявления о регистрации. Полезность такой информации зависит от отдельных адекватных и строго контролируемых исследований с высококачественными данными.
165. Совокупная польза лекарственного препарата всегда является вопросом баланса между риском и пользой и может также рассматриваться в рамках одного клинического исследования, даже несмотря на то, что оценка соотношения «польза — риск» обычно проводится по итогам всей программы клинических исследований.
VIII. Представление результатов в отчете
1. Оценка и представление результатов в отчете
166. В процессе планирования клинического исследования в протоколе клинического исследования должны были быть указаны описанные в разделе VI настоящего Руководства ключевые элементы анализа. По завершении проведения клинического исследования и после компоновки и представления данных для предварительного инспектирования целесообразно выполнить ослепленную проверку запланированного анализа, описанную в разделе VI настоящего Руководства. Такая предварительная проверка, ослепленная в отношении вмешательства, должна охватывать решения, затрагивающие, к примеру, исключение субъектов или данных из анализируемых совокупностей; допустимы также проверка возможных преобразований и выявление выбросов; в модель могут быть добавлены важные ковариаты, обнаруженные в недавних клинических исследованиях; могут быть пересмотрены решения об использовании параметрических или непараметрических методов. Решения, принимаемые в это время, необходимо отразить в отчете и отделить их от решений, принятых статистиком после получения доступа к кодам вмешательств, поскольку ослепленные решения, как правило, обладают меньшим потенциалом привнесения систематических ошибок. Статистики или другой персонал, вовлеченный в неослепленный промежуточный анализ, не должны участвовать в ослепленной проверке или модификациях плана статистического анализа. Если ослепление нарушается вследствие возникновения в данных очевидных эффектов, вызванных вмешательствами, потребуется с особой осторожностью подойти к ослепленной проверке.
167. Многие из более детальных аспектов представления и табулирования необходимо окончательно сформировать во время или незадолго до ослепленной проверки, чтобы к моменту фактического анализа были готовы полные планы в отношении всех его аспектов, включая отбор субъектов, отбор и модификацию данных, обобщение и табулирование данных, оценивание и проверку гипотез. После завершения валидации данных необходимо перейти к анализу в соответствии с заранее определенными планами; чем больше выдерживаются подобные планы, тем выше надежность результатов. Особое внимание необходимо уделить любым различиям между запланированным анализом, описанным в протоколе, поправках к протоколу или плане статистического анализа, обновленном по результатам ослепленной проверки, и фактическим анализом. Необходимо представить подробное объяснение всех отклонений от запланированного анализа.
168. В отчете о клиническом исследовании необходимо учесть всех субъектов, вступивших в клиническое исследование, независимо от того, были они включены в анализ или нет. Необходимо оформить как документ все основания исключения субъекта из анализа. Для каждого субъекта исследования, включенного в полную анализируемую совокупность, но не в анализ по принципу «совокупность по протоколу», также необходимо оформить в виде письменного документа причины исключения субъекта из анализа по принципу «совокупность по протоколу». Аналогично для всех субъектов исследования, включенных в анализируемую совокупность, необходимо учесть значения всех важных переменных во всех значимых временных точках.
169. Необходимо тщательно оценить влияние всех случаев выбывания субъектов клинического исследования и данных, исключения субъектов из группы вмешательства и крупных нарушений протокола клинического исследования на основные анализы первичной переменной (переменных). Необходимо идентифицировать субъектов, выбывших из-под последующего наблюдения, исключенных из вмешательства или существенно нарушивших протокол клинического исследования, и представить их описательный анализ, включая причины их выбывания или исключения из клинического исследования и связь этих причин непосредственно с самим вмешательством и изучаемым исходом.
170. Описательная статистика составляет неотъемлемую часть отчетов. Соответствующие таблицы и (или) графические представления должны понятно иллюстрировать важные свойства первичных и вторичных переменных, а также ключевые прогностические и демографические переменные. Результаты основных анализов, относящихся к целям клинического исследования, необходимо подвергнуть особенно тщательному описательному представлению. При репортировании о результатах тестов на значимость необходимо указывать точные p-значения (например, p = 0,034), а не ограничиваться исключительно ссылкой на критические значения.
171. Основной целью анализа клинического исследования является получение ответов на вопросы, сформулированные в его основных целях. При этом в случае неослепленного анализа могут возникнуть новые вопросы, требующие статистической оценки. Следствием этого может стать проведение дополнительного (возможно, сложного) статистического анализа. Такую дополнительную работу необходимо описать в отдельном разделе отчета о клиническом исследовании отдельно от работ, запланированных протоколом клинического исследования.
172. Существует вероятность возникновения непредвиденных дисбалансов между группами вмешательств с точки зрения исходных показателей, не предусмотренных в качестве ковариат в запланированном анализе, но обладающих некоторой прогностической важностью. Оптимальное решение данной ситуации достигается путем подтверждения того, что дополнительный анализ с учетом указанных дисбалансов приводит к тем же выводам, что и запланированный анализ. Если это не достигается, необходимо рассмотреть влияние непредвиденных дисбалансов на указанные выводы.
173. В целом незапланированные анализы данных следует использовать ограниченно. Такие анализы часто проводятся, если предполагается, что эффект вмешательства может варьировать в зависимости от некоторого другого фактора или факторов. Тогда следует попытаться выявить подгруппы субъектов, для которых эффект вмешательства особенно полезен. Потенциальные опасности избыточной интерпретации незапланированных анализов в подгруппах хорошо известны (подраздел 7 раздела VI настоящего Руководства), поэтому их следует избегать. Подобные проблемы с интерпретацией могут возникать и в случае, когда в подгруппе субъектов вмешательство оказывается неэффективным или развиваются нежелательные реакции, поэтому необходимо надлежащим образом оценить такую вероятность и в последующем обеспечить соответствующее представление полученных данных.
174. В анализ, интерпретацию и представление результатов клинического исследования необходимо включать статистическое заключение. С этой целью статистик исследования должен входить в число лиц, отвечающих за подготовку отчета о клиническом исследовании, и одобряющих его.
2. Обобщение клинической базы данных
175. В случае заявления о регистрации лекарственного препарата необходимо представить совокупное резюме и синтез всех доказательств относительно безопасности и эффективности лекарственного препарата из всех репортируемых клинических исследований. Резюме можно сопроводить статистическим объединением результатов (при необходимости).
176. В рамках такого резюме возникает ряд специфических статистических задач: описание демографических и клинических особенностей целевой популяции, получавшей лечение во время программы клинических исследований; освещение ключевых аспектов эффективности с помощью рассмотрения результатов соответствующих (обычно контролируемых) клинических исследований и освещения степени, в которой их результаты взаимно подкрепляют или ослабляют друг друга; обобщение сведений о безопасности, доступных из объединенной базы данных всех клинических исследований, результаты которых вносят вклад в заявление о регистрации, и выявление потенциальных проблем для безопасности. Во время планирования программы клинических исследований необходимо уделить особое внимание единообразию формулировок определений и сбора данных измерений, что будет облегчать последующую интерпретацию серий клинических исследований, особенно если измерения могут подвергнуться объединению между исследованиями. Необходимо выбрать и использовать единый словарь для регистрации сведений о лекарственном препарате, медицинском анамнезе и нежелательных явлениях. Почти всегда требуется единое определение первичных и вторичных переменных, оно незаменимо для метаанализа. Способ измерения ключевых переменных эффективности, сроки оценки относительно рандомизации и включения в исследование, работа с нарушениями и отклонениями от протокола и, возможно, определение прогностических факторов — все это должно быть согласованным между отдельными клиническими исследованиями, если только нет обоснованных причин этого не делать.
177. Необходимо подробно описать все статистические процедуры, использованные для объединения данных разных клинических исследований. Необходимо уделить внимание:
возможности привнесения систематических ошибок, связанных с отбором клинических исследований;
однородности результатов разных клинических исследований;
надлежащим моделированием различных источников вариации.
Необходимо оценить чувствительность выводов к статистическим предположениям и вариантам отбора данных.
Данные об эффективности
178. Отдельные клинические исследования всегда должны быть достаточно масштабными, чтобы достичь своих целей. Дополнительные ценные сведения можно также получить, объединив ряд клинических исследований, в которых рассматриваются, идентичные ключевые вопросы эффективности лекарственного препарата. Чтобы осуществить сравнение данных об эффективности, основные результаты такого набора исследований необходимо представить в идентичной форме, обычно в виде таблиц или графиков, отразив в первую очередь оценку и доверительные границы. Использование метааналитических методов для объединения указанных оценок часто является полезным дополнением, поскольку оно позволяет получить более точную совокупную оценку величины эффектов вмешательств и обеспечивает полное и всестороннее резюме результатов исследований. В исключительных случаях метаанализ может быть наиболее подходящим (или даже единственно возможным) способом получения достаточного совокупного доказательства эффективности лекарственного препарата с помощью проверки общей гипотезы. При использовании с этой целью метаанализ должен иметь свой собственный проспективно созданный протокол.
Данные о безопасности лекарственного препарата
179. При обобщении данных о безопасности лекарственного препарата важно тщательно изучить базу данных о безопасности на предмет наличия любых признаков потенциальной токсичности и отслеживать в дальнейшем любые ее признаки с помощью соответствующей подтверждающей модели наблюдений. Объединение данных о безопасности по всему объему применения (экспозиции) лекарственного препарата у человека является важным источником сведений, поскольку больший размер выборки данных о безопасности лекарственного препарата позволяет повысить шанс обнаружения более редких нежелательных явлений и, оценки их приблизительной частоты. Вместе с тем из-за отсутствия группы компаратора данные о частоте из такой базы данных сложно поддаются оценке, поэтому данные сравнительных исследований имеют особую ценность для преодоления этого затруднения. Результаты исследований, в которых используется один и тот же компаратор (плацебо или определенный активный компаратор), необходимо объединить и представить отдельно по каждому компаратору, обеспечивающему достаточные данные.
180. Необходимо сообщать обо всех признаках потенциальной токсичности, обнаруживаемых при изучении данных о безопасности лекарственного препарата. При оценке правдоподобия таких потенциальных нежелательных реакций необходимо учитывать проблему множественности, возникающую в связи с многочисленными сравнениями. При оценке данных о безопасности лекарственного препарата необходимо также надлежащим образом использовать методы анализа выживаемости с целью получения потенциальной связи частоты нежелательных явлений с продолжительностью экспозиции и (или) последующего наблюдения. Чтобы обеспечить надлежащую оценку соотношения «польза — риск», необходимо соответствующим образом количественно оценить риски, связанные с выявленными нежелательными реакциями.